培养容器以及培养容器的制造方法与流程
本发明涉及一种细胞的培养技术,特别涉及用于使淋巴细胞活化的培养容器及其制造方法。
背景技术:
近年来,在医药品的生产、基因治疗、再生医疗、免疫疗法等领域中,要求在人工环境下高效地大量培养细胞或组织、微生物等。
在这样的状况下,向由透气性膜形成的培养容器中封入细胞和培养液,在封闭系统中自动地大量培养细胞。
特别是在培养淋巴细胞的情况下,在用于增加细胞数的培养之前,首先需要使用抗cd3抗体进行用于使淋巴细胞活化的培养。为此,向加入了抗cd3抗体的培养容器中加入淋巴细胞和培养液,进行其活化。
但是,在向培养容器中仅加入了少量的溶液状的抗cd3抗体的情况下,对淋巴细胞的刺激就会不充分,无法充分地进行活化。另一方面,在向培养容器中大量地加入了溶液状的抗cd3抗体的情况下,会因细胞的防御机理而使存在于细胞膜中的cd3抗原脱落,淋巴细胞的活化受到阻碍。
以抗cd3抗体作为主成分的免疫抑制剂是着眼于这样的淋巴细胞的性质而创造的物质,当将其对在内脏器官·组织移植后产生排斥反应的患者施用时,大量的抗cd3抗体与抗原结合而集聚,该集聚物被引入细胞内后向细胞外排出。或者,集聚物由酶切断,从细胞表面除去抗原。其结果是,刺激不会被传递到细胞内,淋巴细胞的活化受到抑制。
如此所述,很难使用游离在溶液中的抗体恰当地控制淋巴细胞的活化,以往,一般广泛进行的是,将抗cd3抗体固相化在培养容器的底内面,使用这样的培养容器适度地刺激淋巴细胞,由此将淋巴细胞活化。
另外,在制造淋巴细胞的活化用培养袋(以下有时简称为活化培养袋)时,在向培养袋内封入含有抗cd3抗体的抗体溶液而使抗cd3抗体固相化在培养袋内面后,清洗培养袋内而除去游离抗体,其后封入淋巴细胞和培养液而进行活化培养。通过像这样清洗培养袋内而除去游离抗体,就可以更加有效地进行淋巴细胞的活化。
现有技术文献
特許文献1:日本特开2007-175028号公报
技术实现要素:
发明所要解决的问题
因而,本发明人等为了调查在活化培养袋中残存有抗体溶液时的游离抗体对活化的不良影响,使用各种浓度的抗体溶液,进行了淋巴细胞的活化。
其结果是发现,令人惊奇的是,虽然在抗体浓度是活化培养袋的制造中所用的程度的较高浓度的情况下,淋巴细胞的活化受到抑制,然而在某个一定范围的低浓度的情况下,淋巴细胞的活化反而得到促进。
即,通过将抗cd3抗体固相化在活化培养袋中,并且封入低浓度的游离抗体,可以促进由活化培养袋造成的淋巴细胞的活化,其结果是,判明可以进一步提高淋巴细胞的增殖效率。
此处,专利文献1的实施例1中记载,为了制造淋巴细胞的活化培养袋,向培养袋内封入含有抗cd3抗体的抗体溶液而使抗cd3抗体固相化在培养袋内面后,在保持封入抗体溶液不变的状态下进行活化。另外,在专利文献1的实施例2中记载,在使抗cd3抗体固相化在培养袋内面后,清洗培养袋内而除去游离抗体,其后封入淋巴细胞和培养液而进行活化。此后,其结果是显示,在保持封入抗体溶液不变的状态下进行活化的实施例1与清洗培养袋内而除去游离抗体的实施例2相比,淋巴细胞的增殖效率低。
即可以认为,实施例1中由于在培养袋内残留有大量的游离抗体,因此淋巴细胞的活化受到抑制,与实施例2相比淋巴细胞的增殖效率变低。
另一方面,专利文献1中,对于为了进一步提高淋巴细胞的活化效率而向使抗cd3抗体固相化了的活化培养袋中封入一定范围的低浓度的游离抗体的做法,既没有记载也没有启示。
本发明是鉴于上述事情而完成的,其目的在于,提供能够以高于以往的效率使淋巴细胞活化的培养容器及其制造方法。
用于解决问题的方法
为了达成上述目的,本发明的培养容器采用了如下的构成,即,是用于使淋巴细胞活化的由软包装材料制成的袋状的培养容器,在相面对的容器内面的一面以10~300ng/cm2的密度(以下有时将每单位面积的抗体固相化量简称为密度)固相化有抗cd3抗体,并且以每1cm2由所述一面构成的培养面中0.25~400ng且0.1~800μl的量封入了溶液状的抗cd3抗体。
另外,本发明的培养容器的制造方法采用了如下的方法,即,是用于使淋巴细胞活化的由软包装材料制成的袋状的培养容器的制造方法,在相面对的容器内面的一面以10~300ng/cm2的密度固相化抗cd3抗体,以每1cm2由所述一面构成的培养面中0.25~400ng且0.1~800μl的量封入溶液状的抗cd3抗体。
发明效果
根据本发明,可以提供能够以高于以往的效率使淋巴细胞活化的培养容器及其制造方法。
附图说明
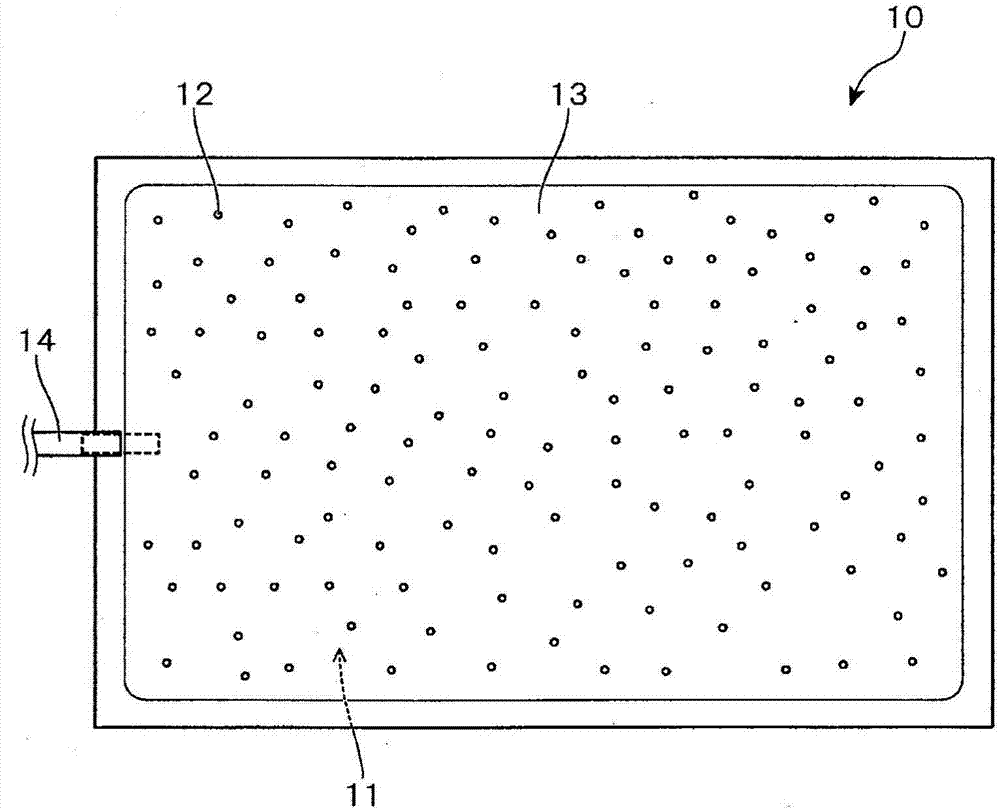
图1是显示出本发明的实施方式的培养容器的概略的正面示意图。
图2是显示出本发明的实施方式的培养容器的概略的俯视示意图。
图3是显示出向本发明的实施方式的培养容器中封入淋巴细胞和培养液而进行活化培养的样子的正面示意图。
图4是显示出本发明的实施方式的培养容器的应用例的概略的正面示意图。
图5是显示出表示借助本发明的实施方式的培养容器的各种游离抗体浓度(10ng/ml~500ng/ml)的细胞增殖倍率的实验1(仅为活化培养工序)的结果的图。
图6是显示出表示借助本发明的实施方式的培养容器的各种游离抗体浓度(5ng/ml,10ng/ml)的细胞增殖倍率的实验2(活化培养工序+扩增培养工序)的结果的图。
具体实施方式
以下,对本发明的培养容器、以及培养容器的制造方法的实施方式,使用图1~4进行详细说明。图1是显示出本实施方式的培养容器的概略的正面示意图,图2是同一培养容器的俯视示意图,图3是显示出向该培养容器中封入淋巴细胞和培养液而进行活化培养的样子的正面示意图。另外,图4是显示出该培养容器的应用例的概略的正面示意图。
[培养容器]
如图1、2所示,本发明的实施方式的培养容器10具有在上下方向相面对的容器壁。此外,容器内面的一方成为将抗体12固相化了的固相化面11(图1、2的容器内的底面),该固相化面11被作为培养面使用。另外,在培养容器10内,封入了抗体12游离的抗体溶液13。
而且,在培养容器10中,具备可以连接管道14的端口,利用该端口进行向培养容器10内的淋巴细胞和培养液的封入、以及培养后的淋巴细胞和培养液的回收。虽然图1、2的例子中在培养容器10上连接有一条管道14,然而也可以连接2条以上。
培养容器10被使用具有细胞培养所必需的透气性的膜制成袋状(bag型)。作为这样的培养容器10的材料,可以合适地使用聚乙烯、聚丙烯等聚烯烃系树脂。
作为固相化在固相化面11的抗体12,使用抗cd3抗体。利用抗cd3抗体将淋巴细胞活化,可以使之增殖。
固相化面11中的抗体12的固相化的密度优选设为10~300ng/cm2,更优选设为10~40ng/cm2。
如果将抗体12的固相化的密度设为10ng/cm2以上,则可以高效地使淋巴细胞活化。另外,由于固相化面11中的抗cd3抗体的最密填充密度为300ng/cm2,因此通过将抗体12固相化至该密度范围,可以使淋巴细胞恰当地活化。此外,如果将抗体12的固相化的密度设为10~40ng/cm2,则可以特别大地提高淋巴细胞的增殖效率。
在培养容器10中,优选在作为培养面使用的固相化面11中,以每1cm2中0.25~400ng且0.1~800μl的量封入溶液状的抗体12。这是因为,通过向培养容器10中以这样的量封入溶液状的抗体12,可以进一步提高淋巴细胞的活化,其结果是,可以进一步提高增殖效率。
从这样的观点考虑,更优选以每1cm2培养面中0.5~300ng且0.1~600μl的量封入溶液状的抗体12,进一步优选以1~200ng且0.1~400μl的量封入,更进一步优选以1~200ng且0.1~200μl的量封入。
另外,优选将培养容器10中的游离的抗cd3抗体的浓度(以下有时简称为游离抗体浓度)设为5~100ng/ml。这是因为,通过使游离抗体浓度在这样的范围中,可以进一步提高淋巴细胞的活化,其结果是,可以进一步提高增殖效率。
此处,对于使用了由软包装材料制成的培养容器的细胞培养,为了获得优异的培养效率,一般多将培养液的液厚设为0.2~2cm而进行。在游离抗体浓度为5ng/ml的情况下,如果将液厚设为0.2cm,则每1cm2中的抗体量为1ng。另外,在游离抗体浓度为100ng/ml的情况下,如果将液厚设为2cm,则每1cm2中的抗体量为200ng。因而,如果将游离抗体浓度设为5~100ng/ml、将培养液的液厚设为0.2~2cm,则会向培养容器10中以每1cm2培养面中1~200ng的量封入溶液状的抗体12。
另外,有时基于调整细胞密度等理由而从0.05~4cm的范围中选择培养液的液厚。如果将该情况下的游离抗体浓度设为5~100ng/ml并进行培养,则在游离抗体浓度为5ng/ml的情况下,将液厚设为0.05cm时,则每1cm2中的抗体量为0.25ng。另外,在游离抗体浓度为100ng/ml的情况下,将液厚设为4cm时,则每1cm2中的抗体量为400ng。因而,向培养容器10中以每1cm2培养面中0.25~400ng的量封入溶液状的抗体12。
此外,由于很难向培养容器中以每1cm2培养面积中少于0.1μl的量封入溶液状的抗cd3抗体,因此优选以0.1μl以上的量封入。另外,从由软包装材料制成的培养容器的处置等观点考虑,通常所用的培养容器的容量多为每1cm2培养面积中4000μl以下,对于相对于培养液量而言的抗体溶液量的比例,为了获得优异的培养效率,优选设为2成以下,更优选设为1成以下,进一步优选设为0.5成以下。由此,优选向培养容器中以每1cm2培养面积中800μl以下的量封入溶液状的抗cd3抗体,更优选以400μl以下的量封入,进一步优选以200μl以下的量封入。
通过向这样的培养容器10中经由管道14注入淋巴细胞和培养液、进行淋巴细胞的活化,与使用仅进行抗体12的固相化的培养容器的情况相比,可以使淋巴细胞恰当地接触抗cd3抗体,可以进一步提高淋巴细胞的活化效率。
图3是示意性地显示出这样的活化培养的样子的图,抗体12被固相化在培养容器10的底内面,并且抗体12在培养液30中以低浓度游离。这样,淋巴细胞20就会由经过固相化的抗体12和游离着的抗体12活化。
另外,也优选将本发明的实施方式的培养容器作为如下的培养容器10a来构成,即,如图4所示,在与固相化面11相面对的容器内面(以下有时称作对置面)以小于固相化面11中的密度的密度固相化抗cd3抗体。
即,在对置面是没有固相化有抗体12的非固相化面的情况下,例如如果在保管时或运输时溶液中的游离抗体吸附于非固相化面,则培养容器中的游离抗体的浓度降低,因此其浓度控制变得困难。
因而,本实施方式的培养容器10a中,通过将抗cd3抗体固相化在对置面,而可以抑制培养容器中的游离抗体的浓度降低。固相化在对置面的抗cd3抗体的浓度没有特别限定,然而优选使之为固相化面11的0.01~0.9倍左右的密度。
[培养容器的制造方法]
本实施方式的培养容器10例如可以如下所示地制造。
首先,使用塑料挤出成型装置将低密度聚乙烯挤出成型,形成膜。此后,使用脉冲热封机,由该膜制造培养袋型的培养容器10。另外,将管道14经由端口与培养容器10连接。
然后,将培养容器10载放于装载台,封入给定的量的气体,并且继续封入溶解有抗体12的缓冲液。此后,通过对培养容器10进行摇动等,而在培养容器10内的底面上使缓冲液的液滴移动,使缓冲液中所含的抗体12附着于培养容器10内的底面上。
此时,作为固相化在固相化面11的抗体12使用抗cd3抗体,如前所述,优选将固相化面11中的抗体12的固相化的密度设为10~300ng/cm2,更优选设为10~40ng/cm2。
另外,通过将抗cd3抗体也固相化在与固相化面11相面对的容器内面,就可以制造图4所示的培养容器10a。
此时,优选以固相化面11的0.01~0.9倍左右的密度将抗cd3抗体固相化。
继而,向如此所述地固相化有抗体12的培养容器10(或培养容器10a)内,以每1cm2培养面(固相化面11)中0.25~400ng且0.1~800μl的量封入溶液状的抗cd3抗体。另外,如前所述,更优选以每1cm2培养面中0.5~300ng且0.1~600μl的量封入溶液状的抗cd3抗体,进一步优选以1~200ng且0.1~400μl的量封入,更进一步优选以1~200ng且0.1~200μl的量封入。
如上说明所示,根据本实施方式,可以获得具备固相化有抗体12的固相化面11、并且以上述最佳的量封入了溶液状的抗cd3抗体的培养容器。这样,利用这样的培养容器,可以以高于以往的效率将淋巴细胞活化,可以进一步提高淋巴细胞的增殖效率。
[实施例]
制造封入了各种浓度的抗体溶液的培养容器而进行淋巴细胞的活化,确认了借助各个培养容器得到的淋巴细胞的增殖效率。具体而言,如下所示地进行。
<实验1>
[培养容器的制作]
使用laboplastomill(东洋精机制作所制)将低密度聚乙烯挤出成型而成形为厚100μm的膜,用脉冲热封机制作出11cm×20.5cm(约225cm2)的培养袋。
[抗体的固相化]
向该培养袋中封入空气约250ml,封入溶解有20μg的抗cd3抗体(takarabio株式会社制)的磷酸缓冲液(抗体溶液,lifetechnologyjapan株式会社制)2ml。此后,摇动培养袋,使液滴以10m/分钟的速度在培养袋内面上移动2.5分钟。然后,排出抗体溶液后,封入磷酸缓冲液2ml,以10m/分钟的速度使之在培养袋内面上移动2.5分钟,将其排出,由此进行清洗,从培养袋内面除去游离抗体。利用bca法测定出被固相化了的抗体量,其结果为37ng/cm2的固相化量。
[活化培养试验用培养袋的制作]
将固相化有抗体的培养袋用脉冲热封机调整为5cm×5cm,制作出用于在活化培养试验中使用的培养袋。然后,以使培养时的游离抗体的浓度分别为10ng/ml、50ng/ml、100ng/ml、200ng/ml、500ng/ml的方式,将溶解有抗cd3抗体的磷酸缓冲液(分别为1μg/ml、5μg/ml、10μg/ml、20μg/ml、50μg/ml)50μl封入活化试验用培养袋中。另外,作为对照实验,准备了没有封入溶解有抗cd3抗体的磷酸缓冲液的培养袋。
[淋巴细胞的活化工序]
将作为淋巴细胞的一种的人末梢血单核细胞(cellapplications,inc.制)8.2×105个悬浮于加入了2%胎牛血清(lifetechnologiesjapan株式会社制)的alys505n-7(株式会社细胞科学研究所)培养基中,准备了细胞悬浮液。此后,分别向活化培养试验用培养袋中封入细胞悬浮液5ml。
通过将这些培养袋在37℃静置培养116小时,而进行了淋巴细胞的活化(活化培养工序)。此后,活化培养结束时计数培养袋中的细胞数,算出增殖倍率。将其结果表示于图5中。
如图5所示,对于淋巴细胞的增殖倍率,对照实验(仅固相化)为4.30倍,游离抗体浓度10ng/ml时为5.24倍,游离抗体浓度50ng/ml时为5.20倍,游离抗体浓度100ng/ml时为4.88倍,游离抗体浓度200ng/ml时为3.77倍,游离抗体浓度500ng/ml时为3.18倍。
即,可知在游离抗体浓度为10ng/ml~100ng/ml的情况下,与仅利用经过固相化的抗体进行活化的情况相比,增殖效率提高。
与之不同,可知在游离抗体浓度为200ng/ml以上的情况下,与仅利用经过固相化的抗体进行活化的情况相比,增殖效率降低。
如此所述,可以认为,在游离抗体浓度为上述一定范围的低浓度的情况下,可以进一步提高淋巴细胞的增殖效率。另一方面,在游离抗体浓度更大的情况下,淋巴细胞的活化受到阻碍,增殖效率降低。
<实验2>
进行了用于确认培养容器中的游离抗体浓度小于10ng/ml时的淋巴细胞的增殖效率的实验。对于培养容器的制作、以及抗体的固相化,与实验1相同地进行。
[活化培养试验用培养袋的制作]
将固相化有抗体的培养袋用脉冲热封机调整为5cm×5cm,制作出用于在活化培养试验中使用的培养袋。然后,以使培养时的游离抗体的浓度分别为5ng/ml、10ng/ml的方式,将溶解有抗cd3抗体的磷酸缓冲液(分别为0.5μg/ml、1μg/ml)50μl封入活化试验用培养袋。另外,作为对照实验,准备了没有封入溶解有抗cd3抗体的磷酸缓冲液的培养袋。
[淋巴细胞的活化工序]
将作为淋巴细胞的一种的人末梢血单核细胞(cellapplications,inc.制)8.6×105个悬浮于加入了2%胎牛血清(lifetechnologiesjapan株式会社制)的alys505n-7(株式会社细胞科学研究所)培养基中,准备了细胞悬浮液。此后,分别向活化培养试验用培养袋中封入细胞悬浮液5ml。
此后,通过将这些培养袋在37℃静置培养122小时,而进行了淋巴细胞的活化。
然后,将活化了的淋巴细胞转移到没有固相化抗体的盘(corning制)中,恰当地进行稀释操作,培养192小时(扩增培养工序)。此后,在扩增培养结束时计数培养袋中的细胞数,算出增殖倍率。将其结果表示于图6中。
如图6所示,对于淋巴细胞的增殖倍率,对照实验(仅固相化)为73倍,游离抗体浓度5ng/ml时为125倍,游离抗体浓度10ng/ml时为103倍。
即,可知在游离抗体浓度为5ng/ml及10ng/ml的情况下,与仅利用经过固相化的抗体进行活化的情况相比,增殖效率均大幅度提高。
如上所述,根据实验1及实验2的结果可以确认,在培养容器中的游离抗体浓度为5~100ng/ml的情况下,与仅利用经过固相化的抗体进行活化的情况相比,增殖效率提高。
本发明并不限定于以上的实施方式或实施例,当然可以在本发明的范围内中实施各种变更。
例如,可以使培养容器的大小、淋巴细胞的种类、以及培养基与实施例不同等,适当地进行变更。
产业上的可利用性
本发明可以适用于大量培养淋巴细胞的情况。
将该说明书中记载的文献及成为本申请的巴黎优先权的基础的日本申请说明书的内容全都引用到本文中。
符号的说明
10、10a培养容器,
11固相化面,
12抗体,
13抗体溶液,
14管道,
20淋巴细胞,
30培养液。
- 还没有人留言评论。精彩留言会获得点赞!