一种基于Eps8羧基末端效应区的双重抗肿瘤多肽的制作方法
本发明涉及有机化学领域,具体涉及来自哺乳动物的多肽,该多肽具有抗肿瘤活性,适用于制备抗肿瘤药物。
背景技术:
多肽药物在临床应用上具有非常重要的开发价值。部分多肽药物具有促进机体免疫功能的作用,称为多肽疫苗。诱导强且特异性抗肿瘤免疫应答的新型肿瘤抗原的鉴定保证了针对各种类型肿瘤的多肽疫苗的开发和临床应用(Reche P,et al.J Immunol Res 2015;2015:349049;Jazirehi AR,et al.Cancer Res 2011;71(4):1406-1417;Andersen RS,et al.Cancer Immunol Immunother 2011;60(2):227-234;Gritzapis AD,et al.Cancer Res 2010;70(7):2686-2696;Klepin HD,et al.Oncologist 2009;14(3):222-232.)。迄今为止,已有许多实用肿瘤相关抗原衍生多肽的临床试验,均在不同程度上诱导出抗肿瘤免疫应答(Walter S,et al.Nat Med2012;18(8):1254-1261;Bae J,et al.Clin Cancer Res 2012;18:4850-60;Slingluff CJ,et al.Clin Cancer Res 2007;13:6386-95;Slingluff CJ,et al.Clin Cancer Res 2009;15:7036-44;Slingluff CJ,et al.J Clin Oncol 2011;29:2924-32.)
由于治疗驱动的免疫选择会导致肿瘤抗原的删除、突变或下调,进而导致肿瘤细胞免疫逃逸,因此,对肿瘤细胞发生发展必不可少的肿瘤相关抗原是免疫疗法的理想靶标,可将肿瘤免疫逃逸的风险降至最低。
Eps8,即表皮生长因子受体通路底物8(Epidermal growth factor receptor Pathway Substrate 8,Eps8),是表皮生长因子受体(EGFR,Epidermal Growth Factor Receptor)重要的激酶活性底物之一。已经证实,Eps8在许多肿瘤细胞中表达上调,包括宫颈癌(Chen YJ,et al.Mol Cancer Ther 2008;7:1376-85.)、结直肠癌(Maa MC,et al.J Biol Chem2007;282:19399-409.)、垂体瘤(Xu M,et al.Endocrinology 2009;150:2064-71.)、口腔鳞癌(Chu PY,et al.Asia Pac J Clin Oncol 2012;8:e77-81.)、胰腺导管癌(Welsch T,et al.Cancer Lett 2007;255:205-18.)、乳腺癌(Yao J,et al.Cancer Res 2006;66:4065-78.)、甲状腺癌(Griffith OL,et al.J Clin Oncol 2006;24:5043-51.)、食管癌(Bashir M,et al.Cell Commun Signal 2010;8:13.)及恶性胶质瘤(Ding X,et al.Oncol Rep 2013;29:697-703.)等实体肿瘤,及多发性骨髓瘤(李玉华等.山东医药2011;51:9-11.)、白血病(Li YH,et al.Clin Lab 2013;59(11-12):1261-1269;Li YH,et al.Leuk Res 2015;39(6):575-581;Kang H,et al.Blood 2012;119:1872-81.)等血液系统肿瘤。进一步分析发现,Eps8表达上调促进肿瘤细胞增殖与转移,抑制肿瘤细胞凋亡,降低药物敏感性,与肿瘤患者预后差密切相关(Welsch T,et al.Cancer Lett 2007;255:205-18;Chen YJ,et al.Mol Cancer Ther 2008;7:1376-85;Ding X,et al.Oncol Rep 2013;29:697-703;Li YH,et al.Future Oncol 2013;9(10):1587-1594.)。以上研究说明Eps8是肿瘤发生发展的关键分子和预后因子。
另有部分多肽药物发挥抑制肿瘤增殖、转移等生物学活性的作用,称为多肽抑制剂。这类多肽药物以阻断促瘤相关信号通路为目的。近十年已有多个抗肿瘤多肽药物被批准上市,如应用于前列腺癌的促性腺激素释放激素(GnRH)拮抗剂abarelix(Abarelix:abarelix-depot-F,abarelix-depot-M,abarelix-L,PPI 149,R 3827.Drugs R D 2003;4(3):161-166.)和degarelix(Frampton JE,et al.Drugs 2009;69(14):1967-1976.),及应用于多发性骨髓瘤的蛋白酶体抑制剂carfilzomib(McCormack PL.Drugs 2012;72(15):2023-2032.)。
公开号为CN 103694333A的专利申请公开了一种EPS8抗肿瘤CTL表位肽,并验证了其促进CTL细胞杀伤肿瘤细胞的效果。但是,本发明人的后续研究发现,上述CTL表位肽的肿瘤细胞增殖抑制效果不理想,抑制率均低于50%。
因此,开发双重抗肿瘤效应的多肽,即,该多肽既可促进CTL细胞杀伤肿瘤细胞,又可直接抑制肿瘤细胞增殖、克隆形成,对抗肿瘤药物的设计具有重大意义。
技术实现要素:
本发明所要解决的技术问题的提供一种基于Eps8羧基末端效应区的双重抗肿瘤多肽,该多肽既可引发相应分子特异性的CTL,又可阻断Eps8羧基末端效应区信号通路,抑制肿瘤细胞的增殖。
本发明解决上述问题的技术方案为:
一种基于Eps8羧基末端效应区的双重抗肿瘤多肽,该多肽的氨基酸序列为
Leu-Phe-Ser-Leu-Asn-Lys-Asp-Glu-Leu(SEQ ID No:1)。
上述双重抗肿瘤多肽可按SEQ ID NO:1所示序列采用固相合成法合成得到。
上述双重抗肿瘤多肽位于Eps8羧基末端效应区,既具有免疫原性,又可阻断Eps8羧基末端效应区相关信号通路,抑制肿瘤细胞的增殖,因此可用于制备免疫抑制和杀伤肿瘤细胞的双重抗肿瘤的药物。
本发明所述的双重抗肿瘤多肽能够诱导特异性T细胞免疫应答,表现为刺激特异性T细胞分泌高水平IFN-γ并对Eps8阳性肿瘤细胞产生特异性杀伤效应。本发明所述的双重抗肿瘤多肽还可阻断Eps8羧基末端效应区的信号通路,直接抑制肿瘤细胞增殖,因此可与常规化疗药物联用。
附图说明
图1为本发明所述双重抗肿瘤多肽的质谱图。
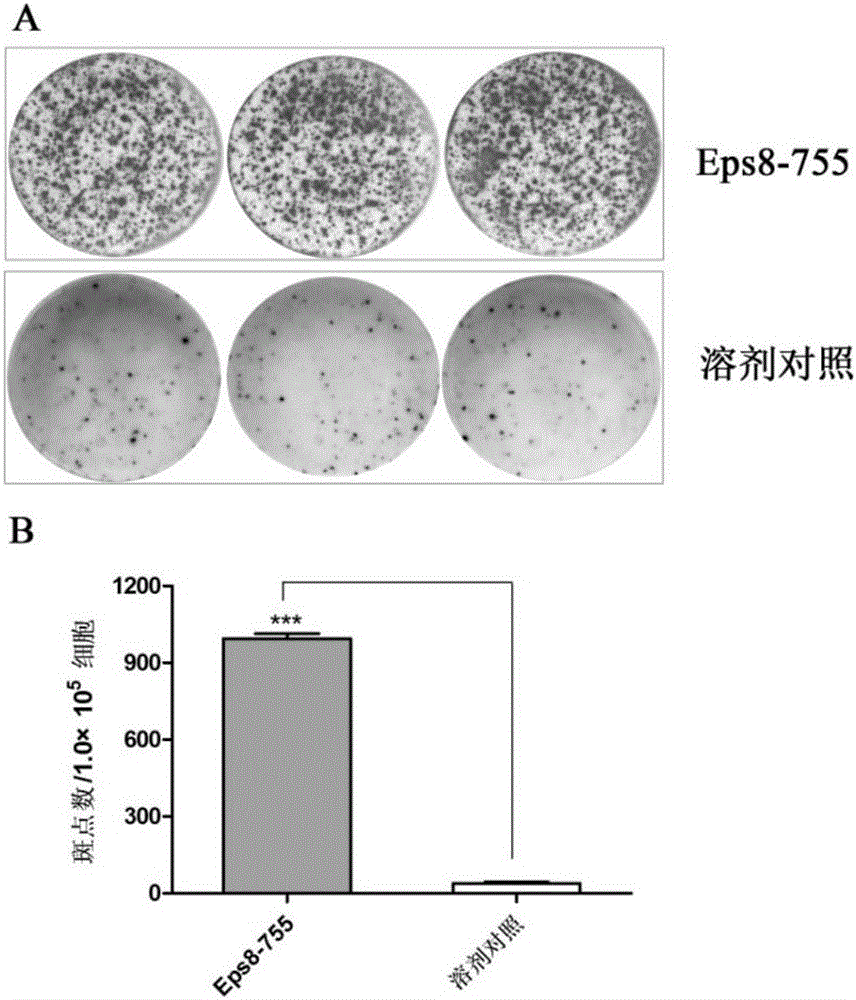
图2为本发明所述双重抗肿瘤多肽诱导的特异性CTL分泌IFN-γ能力的检测结果图,其中,图A为诱导CTL分泌IFN-γ显微照片;图B诱导CTL分泌IFN-γ斑点数的条形图。
图3为本发明所述双重抗肿瘤多肽诱导的特异性CTL对Eps8阳性、HLA-A*2402阳性结肠癌细胞SW620体外杀伤能力的曲线图,图中的横坐标表示效应细胞(CTL)与靶细胞(SW620)的比值(效靶比),纵坐标表示杀伤率(%)。
图4为本发明所述双重抗肿瘤多肽诱导的特异性CTL对Eps8阳性、HLA-A*2402阳性结肠癌细胞Colo320体外杀伤能力的曲线图,图中的横坐标表示效应细胞(CTL)与靶细胞(Colo320)的比值(效靶比),纵坐标表示杀伤率(%)。
图5为本发明所述双重抗肿瘤多肽诱导的特异性CTL对Eps8阳性、HLA-A*2402阳性非小细胞肺癌细胞A549体外杀伤能力的曲线图,图中的横坐标表示效应细胞(CTL)与靶细胞(A549)的比值(效靶比),纵坐标表示杀伤率(%)。
图6为本发明所述双重抗肿瘤多肽诱导的特异性CTL对Eps8阳性、HLA-A*2402阳性肝癌细胞HepG2体外杀伤能力的曲线图,图中的横坐标表示效应细胞(CTL)与靶细胞(HepG2)的比值(效靶比),纵坐标表示杀伤率(%)。
图7为本发明所述双重抗肿瘤多肽作用48h对Eps8阳性、HLA-A*2402阳性肿瘤细胞增殖抑制率的曲线图,图中的横坐标表示多肽浓度,纵坐标表示增殖抑制率(%)。
图8为本发明所述双重抗肿瘤多肽对Eps8阳性、HLA-A*2402阳性肿瘤细胞克隆形成的抑制率的条形图,图中的横坐标表示多肽浓度,纵坐标表示克隆形成抑制率(%)。“*”表示与相应的溶剂对照组(0μM)相比,P<0.05;“***”表示与相应的溶剂对照组(0μM)相比,P<0.001。
图9为公开号为CN 103694333A的专利申请所述CTL表位肽对Eps8阳性、HLA-A*0201阳性的SW480细胞增殖抑制率的曲线图。
具体实施方式
实施例1(Eps8羧基末端效应区多肽的筛选)
本发明所述的Eps8羧基末端效应区来源的抗肿瘤多肽,是根据抗原的一级结构,采用免疫信息学手段,运用在线生物学软件SYFPEITHI(http://www.syfpeithi.de/bin/MHCServer.dll/EpitopePrediction.htm)(该算法记载于Rammensee H,et al.Immunogenetics 1999;50(3-4):213-219.)和BIMAS(http://www-bimas.cit.nih.gov/molbio/hla_bind/)(该算法记载于Parker KC,et al.J Immunol 1994;152(1):163-175.)对Eps8分子SH3结构域的HLA-A*2402限制性进行预测分析,筛选出氨基酸序列为SEQ ID No:1所示的多肽,并记为Eps8-755。SEQ ID No:1所示的多肽由杭州中肽生化有限公司根据本发明人所提供的序列,采用Fmoc固相肽合成法合成。采用反相高压液相色谱仪对其合成的目标产物进行纯化和纯度分析,结果显示其纯度>95%,再采用质谱法进行鉴定和分子量测定,得到如图1所示的质谱图。
下述实施例2-7分别对本例所得到的多肽Eps8-755(SEQ ID No:1)的双重抗肿瘤效果进行验证。
实施例2[体外致敏抗原呈递细胞(APC)的诱导]
使用外周血单个核细胞衍生的树突状细胞(DC)作为APC,参考别处所述(Nakahara S,et al.Cancer Res 2003Jul 155,63(14):4112-8)在体外诱导DC。具体而言,利用Ficoll-Plaque密度梯度法分离健康志愿者(HLA-A*2402阳性)外周血中分离单个核细胞(PBMCs),通过贴壁法分离原始DC,在含有10%FBS的PRMI-1640、1000U/ml粒细胞-巨噬细胞集落刺激因子(GM-CSF)和1000U/ml白介素4(IL-4)的培养液中培养。在培养第7天,在含3μg/mlβ2-微球蛋白的培养基中,利用每一种合成肽(20μg/ml)冲激经细胞因子诱导的DC 3小时。所生成的细胞在细胞表面表达DC相关分子,如CD80、CD83、CD86和HLA-Ⅱ分子(数据未显示)。
实施例3(体外CTL的诱导)
上述经多肽冲激的DC用丝裂霉素C(MMC)灭活(30μg/ml,30min),以1:20比例与自体CD8+T细胞(由CD8阳性分离试剂盒通过正选择获得)混合,于含IL-7 10ng/ml的培养基中培养。第3天,在培养基中加入IL-2至终浓度为20U/ml。在第7天和第14天,用经肽冲激的、灭活的自体DC进一步刺激T细胞。第21天收集细胞检测CTL功能(Olson BM,et al.Cancer Immunol Immunother 2011;60(6):781-792;Andersen RS,et al.Cancer Immunol Immunother 2011;60(2):227-234.)。
实施例4(CTL分泌IFN-γ功能)
利用IFN-γ-ELISPOT检测上述CTL活性。具体而言,按试剂盒操作说明,于96孔硝酸纤维素膜培养板预孵育捕获抗体过夜,次日计数并调整上述效应细胞至1×106/ml,接种于培养板,每孔100μl,孵育24h,洗板,分别孵育一抗、二抗,显色,最后用ELISPOT读板器对斑点进行计数。分组包括:正对照组:效应细胞+10μl PHA,终浓度1~4μg/ml;实验组:效应细胞;背景负对照组:100μl的Lympho-Spot无血清培养基。
结果:如图2所示,与溶剂对照组相比,Eps8-755诱导的T细胞分泌IFN-γ数显著增加,P<0.001。
实施例5(CTL杀伤肿瘤细胞功能)
利用乳酸脱氢酶(LDH)释放法检测CTL杀伤肿瘤细胞的能力。具体而言,按照CytoNon-Radioactive Cytotoxicity Assay试剂盒操作说明,以上述CTL为效应细胞,以各肿瘤细胞(SW620、Colo320、A549和HepG2)为靶细胞,检测特异性T细胞对肿瘤细胞的杀伤能力。设置实验组、效应细胞自发释放组、靶细胞自发释放组、靶细胞最大释放组、背景对照组和体积校正组。将效应细胞和靶细胞共孵育,反应4h后加入底物显色30min,终止反应后,酶标仪测定波长490nm的吸光度(A)值,计算CTL对肿瘤细胞的杀伤率。杀伤率(%)=[(实验组的相对A值-靶细胞自发释放组的相对A值-效应细胞自发释放组的相对A值)/(靶细胞最大释放组的相对A值-靶细胞自发释放组的相对A值)]×100%。其中,实验组、靶细胞自发释放组及效应细胞自发释放组分别减去培养基对照组A值获得其相应的相对A值;靶细胞最大释放组减去体积控制组获得其相应的相对A值。
结果:如图3-图6所示,与溶剂对照组相比较,来源于Eps8羧基末端效应区的多肽Eps8-755诱导的特异性T细胞显著杀伤Eps8阳性、HLA-A*2402阳性的肿瘤细胞SW620、Colo320(结肠癌)、A549(非小细胞肺癌)及HepG2(肝癌)。
实施例6[抑制肿瘤细胞增殖(CCK-8法)]
取对数生长期细胞用PBS洗涤,计数后重悬于含体积分数10%胎牛血清RPMI 640培养基中至密度为5×104/ml,以100μl/孔接种于96孔板,置于孵箱过夜,待细胞贴壁后换成无血清培养基进行4h饥饿处理,弃培养液,用PBS洗两遍,然后加入配制好的相应浓度(25、50、75、100、125、150、175μM)的多肽溶液,分别培养48h后每孔加入10μl CCK-8溶液,培养箱中继续培养3h。置于酶标仪中,读取450nm波长处吸光度值。实验重复三次,均设3个复孔,取平均值为最终结果。
结果:如图7所示,源自Eps8羧基末端效应区的多肽Eps8-755显著抑制HLA-A*2402和Eps8阳性的结肠癌细胞SW620、Colo320、HT-29及A549的增殖。Eps8-755对SW620的半数抑制浓度(IC50)为46.47μM(95%CI:39.47-54.72),对Colo320细胞的IC50为113.0μM(95%CI:106.7-119.7),对HT-29细胞的IC50为123.2μM(95%CI:114.0-133.2),对A549细胞的IC50为152.0μM(95%CI:137.7-167.8)。
实施例7[抑制肿瘤细胞克隆形成(平板克隆实验)]
取对数生长期各肿瘤细胞,含10%FBS的完全培养液重悬,加入候选多肽至终浓度为100μM、200μM,以500个细胞/孔接种于6孔板,置37℃、5%CO2孵箱中培养7-14天,形成肉眼可见克隆后(含50个细胞以上),用PBS缓冲液漂洗细胞一次,吸尽残余液体。加入4%多聚甲醛室温固定20min,弃固定液,PBS缓冲液漂洗细胞一次,加入0.5%结晶紫染液,室温染色10-20min,弃染色液,蒸馏水冲洗后晾干,计算细胞克隆形成率=(克隆数/接种细胞数)×100%。
结果:如图8所示,源自Eps8羧基末端效应区的多肽Eps8-755抑制肿瘤细胞SW620、Colo320、A549及HepG2克隆形成。
实施例8(对比实验)
本例采用CCK-8法对公开号为CN 103694333A的专利申请所述的四个CTL表位肽EPS8-101、EPS8-276、EPS8-360和EPS8-455抑制肿瘤细胞增殖的能力进行验证,具体步骤如下:取对数生长期SW480细胞用PBS洗涤,计数后重悬于含体积分数10%胎牛血清RPMI 640培养基中至密度为5×104/ml,以100μl/孔接种于96孔板,置于孵箱过夜,待细胞贴壁后换成无血清培养基进行4h饥饿处理,弃培养液,用PBS洗两遍,然后加入配制好的相应浓度的多肽溶液,分别培养48h后每孔加入10μl CCK-8溶液,培养箱中继续培养3h。置于酶标仪中,读取450nm波长处吸光度值。实验重复三次,均设3个复孔,取平均值为最终结果。
结果:如图9所示,四个CTL表位肽EPS8-101、EPS8-276、EPS8-360和EPS8-455在0-100μM浓度区间对SW480细胞增殖没有抑制作用,仅在高浓度150-200μM区间表现出抑制作用,但其抑制率仍低于50%。将图9与图7比较可见,四个CTL表位肽EPS8-101、EPS8-276、EPS8-360和EPS8-455抑制SW480细胞增殖的能力明显弱于本发明所述多肽Eps8-755(SEQ ID No:1)。
总之,本发明鉴定了源自Eps8-SH3结合域的新型多肽,这些多肽一方面可以诱导CTL杀伤肿瘤细胞,另一方面可以显著抑制肿瘤增殖、克隆形成和转移,具有双重抗肿瘤效应,适用于肿瘤免疫疗法和肿瘤靶向疗法。
上述实施例2-8说明,本发明所述多肽本发明所述多肽Eps8-755(SEQ ID No:1)与公开号为CN 103694333A的专利申请所述的四个CTL表位肽EPS8-101、EPS8-276、EPS8-360和EPS8-455的功能和作用具有下述不同:1、本发明所述多肽为HLA-A*2402限制性多肽,适用于HLA-A*2402阳性人群;公开号为CN 103694333A的专利申请所述的四个CTL表位肽为HLA-A*0201限制性多肽,适用于HLA-A*0201阳性人群;2、本发明所述多肽除了激活抗肿瘤免疫反应外,还具有直接抑制肿瘤细胞增殖、克隆形成等生物学活性的作用,而公开号为CN 103694333A的专利申请所述的四个CTL表位肽仅能激活抗肿瘤免疫反应。
- 还没有人留言评论。精彩留言会获得点赞!