用于鉴定哺乳动物肉类的引物及方法与流程
本发明涉及食品检测技术领域,具体涉及用于鉴定哺乳动物肉类的引物及方法。
背景技术:
近年来,伴随着社会的快速发展,人们的生活水平也随之有了大幅提高,对包括肉类在内的农副产品的需求量大幅增加。于此同时,食品工业发展的脚步也进一步加快。在巨大利益的驱使下,不法企业使用价格相对低的肉冒充价格高的品种进行销售牟取暴利,这种以假乱真、以次充好的做法严重的损害到了消费者的合法利益。因此,对肉类冒充,以次充好的准确鉴定就显得尤为重要。
目前,哺乳动物肉类鉴定的方法主要包括:感官鉴定法、光谱鉴定法、色谱鉴定法、蛋白质鉴定法、免疫学方法以及核酸鉴定法。1992年,孙美艺等人从动物的肾上腺提取热稳定性抗原,制备抗血清,采用琼脂免疫扩散与对流免疫电泳方法鉴定猪肉、羊肉、牛肉、马肉、驴肉、骡肉(孙美艺,白竟玉.食用肉种类的鉴定[J].中国食品卫生杂志.1992,01)。何玮玲等人于2012年基于动物线粒体细胞色素b基因的差异性位点,设计了两组各5条长度不同的引物,利用多重PCR技术鉴定了猪肉、牛肉、羊肉和鸡肉等4种肉类成分(何玮玲,张驰,杨静等.食品中4种肉类成分多重PCR的快速鉴别方法[J].中国农业科学.2012,09)。2013年,李通等人建立了牛、羊、猪、鸡、鸭5种常见动物肉类成分的PCR鉴别方法,即分别使用牛、羊、猪、鸡、鸭的特异性引物对牛、羊、猪、鸡、鸭肉的总DNA进行扩增,获得的DNA片段通过限制性内切酶分别验证PCR扩增的特异性(李通,尹艳,王海等.聚合酶链式反应快速鉴别5种常见肉类别[J].食品科学.2013,08)。尚柯等人于2013年根据Genebank中猪、牛、羊的线粒体细胞色素b(Cyt-b)基因序列,设计了猪、牛、羊的通用上游引物和特异性下游引物,并确立了多重PCR对肉类动物源性的检测方法。2014年,向华等人公开了一种检测肉制品中动物源性的引物系统,通过该引物系统并结合质谱法能鉴别出肉制品中猪、牛、羊、鸡、鸭、兔的源性成分(尚柯,段庆梓,张玉等.多重PCR法用于畜肉源性鉴定的研究[J].食品工业科技.2013,08)。同时,利用近红外光谱技术通过测定肉类中油脂、蛋白质等化学成分来确定肉品品质和品种鉴别也是近年来食品检测领域用于鉴定肉类的常用手段。
DNA条形码的概念在2003年由加拿大科学家Paul Hebert首次提出,这一概念的理论依据是根据不同物种间具有多变性而种内却十分保守的序列,来对物种进行准确的鉴定的方法。近年来,伴随着生物学及相关技术的发展,DNA条形码技术已经在物种鉴定方面得到了广泛的应用。由于其操作简便,并且较之于其它的鉴定方法还有着不受形态和个体差异影响以及能够准确鉴定到种水平的优势。本发明的方法是以DNA条形码技术为基础,首次通过PCR特异扩增与测序相结合的方式来对哺乳动物种类进行鉴定的。
细胞色素C氧化酶I基因(COI基因),在能够保证足够变异的同时又很容易被通用引物扩增,其DNA序列本身很少存在插入和缺失;它在基因序列上变化慢,拥有系统发育信号多,所以更适合解析亲缘关系密切的分类类群;它还拥有蛋白编码基因所共有的特征,即密码子第3位碱基不受自然选择压力的影响,可以自由变异,非常适合用于物种分类检测。
技术实现要素:
本发明的一个目的是提供用于鉴定哺乳动物肉类的成套引物。
本发明提供的用于鉴定哺乳动物肉类的成套引物,由上游引物1、上游引物2、上游引物3、上游引物4、下游引物1、下游引物2、下游引物3和下游引物4组成;
所述上游引物1、所述上游引物2、所述上游引物3和所述上游引物4的核苷酸序列分别为序列表中的序列1、序列2、序列3和序列4;
所述下游引物1、所述下游引物2、所述下游引物3和所述下游引物4的核苷酸序列分别为序列表中的序列5、序列6、序列7和序列8。
上述引物中,所述上游引物1、所述上游引物2、所述上游引物3、所述上游引物4、所述下游引物1、所述下游引物2、所述下游引物3和所述下游引物4的摩尔比为1∶1∶1∶1∶1∶1∶1∶1。
本发明另一个目的是提供用于鉴定哺乳动物肉类的PCR试剂。
本发明提供的PCR试剂,包括上述引物。
上述PCR试剂由PCR扩增体系、所述上游引物1、所述上游引物2、所述上游引物3、所述上游引物4、所述下游引物1、所述下游引物2、所述下游引物3、所述下游引物4和水组成;
所述上游引物1、所述上游引物2、所述上游引物3、所述上游引物4、所述下游引物1、所述下游引物2、所述下游引物3和所述下游引物4在所述PCR试剂中的浓度均为0.5μM。
本发明第三个目的是提供用于鉴定哺乳动物肉类的试剂盒。
本发明提供的试剂盒,包括上述的引物或上述的PCR试剂。
上述引物、上述试剂或上述试剂盒在制备鉴定或辅助鉴定待测肉类是哪种哺乳动物肉类的产品中的应用也是本发明保护的范围。
本发明第四个目的是提供一种鉴定或辅助鉴定待测肉类为哪种哺乳动物肉类的方法。
本发明提供的方法,包括如下步骤:
1)用上述引物对所述待测肉类进行PCR扩增,得到PCR扩增产物;
2)测序PCR扩增产物,得到待测肉类PCR扩增产物序列;
3)将所述待测肉类PCR扩增产物序列在NCBI数据库中进行BLAST比对,若所述待测肉类PCR扩增产物序列与NCBI数据库某种哺乳动物肉类的序列同源性大于等于95%,则所述待测肉类为或候选为该种哺乳动物肉类;若所述待测肉类PCR扩增产物序列与NCBI数据库某种哺乳动物肉类的序列同源性小于95%,则所述待测肉类不为或候选不为该种哺乳动物肉类。
上述方法中,所述PCR扩增的退火温度为50℃。
上述方法中,所述PCR扩增的模板为所述待测肉类的基因组DNA。
上述中,所述哺乳动物肉类为猪肉、牛肉、羊肉或兔肉。
本发明提供的引物、试剂盒及方法可以在短时间内准确鉴定多种哺乳动物肉类的动物来源,这些方法具有操作简便、不受形态和个体差异影响而能够准确鉴定到种水平以及鉴定准确率高等特点。通过本发明所提供的方法,可以对目前市面上常见的多种哺乳动物肉类进行动物种类鉴定,具有高效、限制少、应用范围广、准确的特点。不仅为食品检测领域提供了新的思路和方向,还为高效鉴定日常肉类提供了一种简单、便捷、准确的途径,同时为肉类市场的监督管理提供了一种新的方法和手段。
附图说明
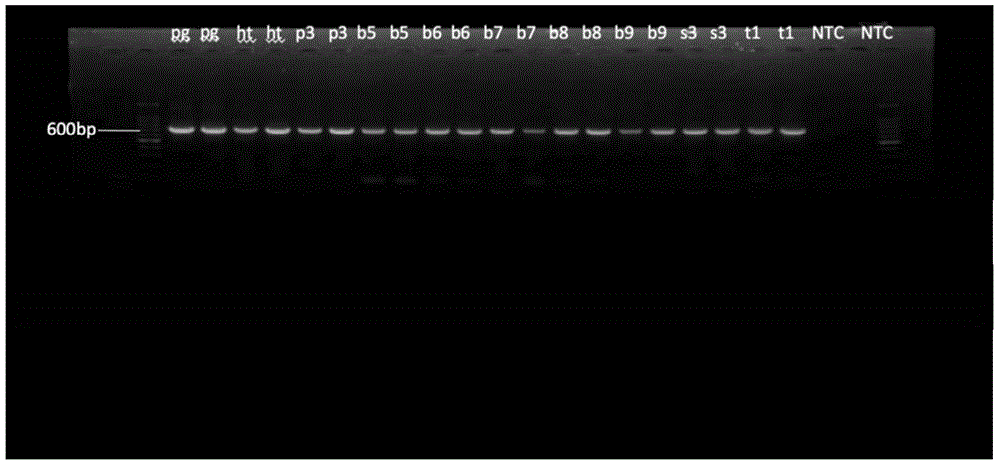
图1为10种哺乳动物肉类COI基因PCR扩增结果的电泳检测图谱。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的样品均为收集市售哺乳动物肉类。
实施例1、哺乳动物肉类鉴定专用引物及方法
一、哺乳动物肉类鉴定专用引物
1、鉴定专用引物
根据COI基因设计哺乳类动物COI基因通用引物,同时结合测序以及序列比对技术,可以在核酸水平上实现对哺乳类动物的分类鉴定。
哺乳类动物COI基因通用引物由上游引物组和下游引物组组成,
上游引物组由上游引物1、上游引物2、上游引物3和上游引物4组成:
上游引物1:TGTAAAACGACGGCCAGTATTCAACCAATCATAAAGATATTGG(序列1);
上游引物2:TGTAAAACGACGGCCAGTTCTCAACCAACCACAAAGACATTGG(序列2);
上游引物3:TGTAAAACGACGGCCAGTTCTCAACCAACCACAARGAYATYGG(序列3);
上游引物4:TGTAAAACGACGGCCAGTTCTCAACCAACCAIAAIGAIATIGG(序列4);
下游引物组由下游引物1、下游引物2、下游引物3和下游引物4组成:
下游引物1:CAGGAAACAGCTATGACTAAACTTCTGGATGTCCAAAAAATCA(序列5);
下游引物2:CAGGAAACAGCTATGACTAGACTTCTGGGTGGCCRAARAAYCA(序列6);
下游引物3:CAGGAAACAGCTATGACTAGACTTCTGGGTGGCCAAAGAATCA(序列7);
下游引物4:CAGGAAACAGCTATGACTAGACTTCTGGGTGICCIAAIAAICA(序列8)。
人工合成上述各条引物。
二、鉴定用试剂盒
鉴定用试剂盒包括PCR反应体系,PCR反应体系总体积为30μl,由15μl2×Premix Taq(Takara,PR02MA)、1.5ul的上游引物1(其在反应体系中的终浓度为0.5μM)、1.5ul的上游引物2(其在反应体系中的终浓度为0.5μM)、1.5ul的上游引物3(其在反应体系中的终浓度为0.5μM)、1.5ul的上游引物4(其在反应体系中的终浓度为0.5μM)、1.5ul的下游引物1(其在反应体系中的终浓度为0.5μM)、1.5ul的下游引物2(其在反应体系中的终浓度为0.5μM、1.5ul的下游引物3(其在反应体系中的终浓度为0.5μM)、1.5ul的下游引物4(其在反应体系中的终浓度为0.5μM),DNA模板1μl,补双蒸水2μl至30μl体系。
三、哺乳动物肉类鉴定方法的确定
1、基因组DNA提取
收集市售哺乳动物肉类样品按照以下步骤进行DNA提取:
a)切割组织样品,少于25mg(脾组织少于10mg)尽量剪成小碎块置于2ml离心管中,加入180μl Buffer ATL。
b)加入20μl proteinase K,振荡处理20s,56℃水浴至组织完全裂解。短时离心,以去除离心管盖内沿液体。
c)加入200μl Buffer AL,振荡15S,70℃水浴10min。短时离心,以去除离心管盖内沿液体。
d)加入200μl乙醇(96%-100%),振荡15s,短时离心,以去除离心管盖内沿液体。
e)小心将以上所得混合液(包括沉淀物)小心加入到QIAamp Mini spin column中(without wetting the rim)将离心柱放入2ml收集管中。盖紧离心管盖,以6000×g(8000rpm)离心lmin。将离心管取出,放入一支洁净的2ml收集管中(试剂盒提供)。丢弃收集管及其中液体。
f)小心加入500μl Buffer AW1到QIAamp Mini spin column中(without wetting the rim)。盖紧离心管盖,以6000×g(8000rpm)离心lmin。将离心管取出,放入一支洁净的2ml收集管中(试剂盒提供)。丢弃收集管及其中液体。
g)小心加入500μl Buffer AW2到QIAamp Mini spin column中(without wetting the rim)。盖紧离心管盖,以20000×g(14000rpm)离心3min。将离心管取出,放入一支洁净的2ml收集管中(试剂盒提供)。丢弃收集管及其中液体。
h)将QIAamp Mini spin column置入一支新的2ml收集管中(自备),丢弃收集管及其中液体。全速离心1min。
i)将QIAamp Mini spin column置入一支洁净1.5ml收集管中(自备),丢弃收集管及其中液体。小心在QIAamp Mini spin column中加入200μl Buffer AE或蒸馏水。室温下静置1min,6000×g(8000rpm)离心1min。
重复离心操作。将收集管盖好,测DNA浓度后保存于-20℃冰箱中,备用。
2、COI基因PCR扩增
使用上述一的试剂盒,对上述1获得的基因组DNA进行PCR扩增。反应条件如下:
得到扩增产物。
3、扩增产物的测序和比对
上述2获得的扩增产物经1.5%琼脂糖进行凝胶电泳检测,得到约650bp的扩增产物。
将650bp的扩增产物通过ABI3730测序平台进行焦磷酸测序。测序结果在NCBI数据库中进行BLAST比对。
实施例2、哺乳动物肉类核酸鉴定
实验材料:收集市售哺乳动物肉类样品:猪肉、牛肉、羊肉和兔肉。
1、基因组DNA提取
按照实施例1的二的1方法分别提取猪肉、牛肉、羊肉和兔肉的基因组DNA。
2、COI基因PCR扩增
分别以猪肉、牛肉、羊肉和兔肉的基因组DNA作为模板,用实施例1的二的方法进行PCR扩增,得到不同样本的PCR扩增产物。
3、扩增产物的测序和比对
上述2获得的不同样本的PCR扩增产物经1.5%琼脂糖进行凝胶电泳检测,结果如图1所示,图1各泳道代表如表1所示,ntc为negative control,可以看出,所有哺乳类动物肉都能扩增出650bp的条带。
将不同样本对应的650bp的扩增产物进行测序,结果如下:
泳道1条带测序结果如序列9所示;
泳道3条带测序结果如序列10所示;
条带测序结果如下:
泳道5条带测序结果如序列11所示;
测序结果如下:
泳道7条带测序结果如序列12所示;
测序结果如下:
泳道9条带测序结果如序列13所示;
测序结果如下:
泳道11条带测序结果如序列14所示;
测序结果如下:
泳道13条带测序结果如序列15所示;
测序结果如下:
泳道15条带测序结果如序列16所示;
测序结果如下:
泳道17条带测序结果如序列17所示;
测序结果如下:
泳道19条带测序结果如序列18所示;
测序结果如下:Blast比对结果如表1所示,
表1为图1中20条泳道中经过测序的肉样品对应标注的动物品种,该动物对应的已知COI基因信息以及Blast比对结果
上述结果表明,对于目前市面上常见的10种哺乳动物肉类样品,采用本发明的引物或试剂盒,通过本发明所述的鉴定方法,可以准确地对所述10种哺乳动物鉴定到种的水平,说明无假冒现象,均准确鉴定到种的水平上,鉴定准确率达100%。
因此,本发明的引物、试剂盒或方法可以确定待测肉类为哪种哺乳动物肉类的方法如下:用上述试剂盒对待测肉样品进行PCR扩增,得到PCR扩增产物,测序PCR扩增产物,得到待测肉类PCR扩增产物序列,将所述待测肉类PCR扩增产物序列在NCBI数据库中进行BLAST比对,若所述待测肉类PCR扩增产物序列与NCBI数据库某种哺乳动物肉类的序列同源性大于等于95%,则所述待测肉类为或候选为该种哺乳动物肉类;若所述待测肉类PCR扩增产物序列与NCBI数据库某种哺乳动物肉类的序列同源性小于95%,则所述待测肉类不为或候选不为该种哺乳动物肉类。
- 还没有人留言评论。精彩留言会获得点赞!