一种高纯度尿促卵泡素的制备方法与流程
本发明涉及生物技术领域,具体涉及一种尿促卵泡素的提取制备方法。
背景技术:
尿促卵泡素(urine Follicle Stimulating Hormone,u-FSH)是主要成分为卵泡刺激素 (Follicle Stimulating Hormone,FSH)的组合物,高纯度尿促卵泡素中FSH含量可以达到95%以上,几乎不含黄体生成素(Luteotropic Hormone,LH)。FSH是一种糖蛋白激素,分子量约为30KD。FSH能促进颗粒细胞增生,刺激类固醇生成,调节配子细胞的发育和成熟,是下丘脑-垂体-性腺轴中的主要激素之一。FSH对人类具有调控月经周期、排卵和调节雄性睾丸功能的作用,临床上常用它治疗女性不孕症和男性促性腺激素分泌不足、精小管缺陷等。
在人的脑垂体和绝经期与绝经后的妇女尿中两者的含量较高,因此也是提取FSH 的主要来源。用于生产u-FSH的原料人绝经期促性腺激素(Human Menopausal Gonadotropin,HMG)主要包含卵泡刺激素与黄体生成素(Luteotropic Hormone,LH)。FSH与LH效价的比值约为1:1。制备高纯度尿促卵泡素需要除去HMG 中的LH 和其他尿蛋白质,保留高纯度单一活性组分的FSH。
目前,国外高纯度的u-FSH 生产技术主要由Serono 公司掌握, 其工艺流程为先用乙醇抽提HMG 粗品,再经硅酸铝吸附,然后经阴离子交换层析,再使用抗FSH 单克隆抗体层析柱捕获FSH,最后通过反相层析获得高纯度u-FSH。国内高纯度的u-FSH主要由丽珠和天伟两家公司生产,其生产工艺中均使用了抗LH抗体吸附除去LH的工艺步骤。利用抗原抗体特异性反应来除去LH,具有纯化效率高等优点。但目前大多数抗体为鼠源或兔源,本身属于蛋白质,在层析过程中,偶联于基质上的抗体脱落会造成异源蛋白的污染,影响产品品质。同时,抗体免疫亲和层析柱价格昂贵,使用寿命短,维护及工业放大生产困难,这些不足都严重阻碍了其应用推广。因此,本领域迫切需要开发出一种能够制备出低含量LH及高纯度FSH产品的操作简便、生产成本低的生产工艺。发明人发现LH的疏水性强于FSH,可通过疏水层析技术将其分离,因此可以采用疏水层析代替抗体免疫亲和层析,以解决上述问题。
技术实现要素:
针对以上工艺的不足,本发明的目的是提供一种尿促卵泡素的制备方法,与已有工艺相比,该制备方法操作简便、生产成本低,获得的尿促卵泡素纯度更高,无外源蛋白的污染。 FSH比活性大于10000IU/mg 蛋白质,LH:FSH效价低于1:100。
本发明提供的尿促卵泡素的制备方法包括以下步骤:
(1) 人绝经期促性腺激素粗制品经阴离子交换层析纯化,得到尿促卵泡素中间体I;
(2) 尿促卵泡素中间体I经阳离子交换层析纯化,得到尿促卵泡素中间体II;
(3) 尿促卵泡素中间体II经染料亲和层析纯化,得到尿促卵泡素中间体III;
(4) 尿促卵泡素中间体Ⅲ经疏水层析纯化,得到高纯度尿促卵泡素的溶液;
根据以上所述的制备方法,其特征在于,所述制备方法还包括将步骤(4)所得尿促卵泡素进行超滤换盐,换盐所用溶液为0.01M PB缓冲溶液,优选地,其pH为5.5-7.0。
优选地,上述制备方法还包括将步骤(4)所得尿促卵泡素溶液与冻干保护剂混合后冻干,冻干保护剂为乳糖,优选地,其添加量为3%-6%(g/ml)。
优选地,上述制备方法所述阴离子交换层析填料配基为三乙基氨基乙基、二乙基氨基乙基、氨基乙基或三乙醇基氨基,基质为纤维素、葡聚糖、琼脂糖、苯乙烯;所述阳离子交换层析填料配基为羧甲基、磺酸基、磷酸基、亚磷酸基、酚基,基质为纤维素、葡聚糖、琼脂糖、聚苯乙烯;所述染料亲和层析填料配基为Cibacron Blue、Red、Green、Orange,基质为琼脂糖、葡聚糖或壳聚糖;所述疏水层析填料为以丁基、辛基、苯基或新戊基为配基的乙烯醇和甲基丙烯酸酯共聚物、琼脂糖、纤维素、聚苯乙烯、聚丙烯酸甲酯或壳聚糖。
具体来说,所述步骤(1)包括以下步骤:
用水溶解HMG粗制品,调节溶液的pH值至5.5-8.0;将HMG粗制品溶液上样至已平衡好的阴离子交换层析柱;以pH 值为5.5-8.0 的0.02M PB溶液洗涤,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;以pH 值为5.5-8.0 的含0.05-0.2M NaCl的0.02M PB溶液洗脱,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,所得洗脱液即为尿促卵泡素中间体I;
具体来说,所述步骤(2)包括以下步骤:
将卵泡刺激素中间体I的溶液上样至已平衡好的阳离子交换层析柱;以pH 值为4.0-5.5 的0.1M HAc-NaAc溶液洗涤,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用pH 值为4.0-5.5的含0.1-0. 5M NaCl的0.1M HAc-NaAc溶液洗脱,并检测洗脱液在280nm 处的吸光值,直至吸光值不再下降,所得洗脱液即为尿促卵泡素中间体II;
具体来说,所述步骤(3)包括以下步骤:
将卵泡刺激素中间体II的溶液上样至已平衡好的Cibacron Blue染料亲和层析柱;以pH 值为6.0-9.0 的0.1M NaAc溶液洗涤,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再以pH 值为8.0-10.0 的含0.8-2.5M KCl 的0.02M PB溶液洗脱,并检测洗脱液在280nm 处的吸光值,直至吸光值不再下降,所得洗脱液即为尿促卵泡素中间体III;
具体来说,所述步骤(4)包括以下步骤:
将卵泡刺激素中间体III的溶液上样至已平衡好的疏水层析柱;用pH值为7.0-9.0 的含有1.0-1.5M 硫酸铵的0.02M PB溶液洗涤,并检测洗涤液在280nm 处的吸光值,直至吸光值不再下降;再以pH 值为7.0-9.0 的含有0.2-0.4M 硫酸铵的0.02M PB溶液洗脱,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,所得洗脱液即为高纯度尿促卵泡素的溶液;
本发明以HMG为起始原料,依次采用阴离子交换层析、阳离子交换层析、染料亲和层析以及疏水层析工艺,提取纯化制得高纯度FSH。其中,利用蛋白质两性电离的性质,通过改变溶液pH,使蛋白质带上不同电荷,经过阴离子交换层析与阳离子交换层析,FSH纯化倍数可达50倍以上。利用FSH能与染料亲和吸附的性质,进一步去除杂质蛋白,使FSH纯化倍数达到150倍以上。最后利用LH与FSH疏水性差异,去除LH,获得高纯的几乎不含LH的尿促卵泡素。
附图说明
图1为本发明的工艺流程图。
图2为实施例1制备的高纯度尿促卵泡素成品的HPLC图谱。
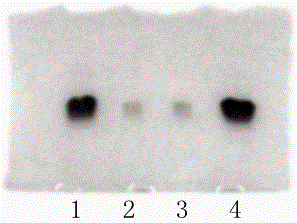
图3为实施列1和实施例2制备的FSH的电泳图谱。其中,1:实施例1制备成品;2:实施例1制备成品5%自身对照;3:实施例2制备成品5%自身对照;4:实施例2制备成品;
图4为实施例2制备的高纯度尿促卵泡素成品的HPLC图谱。
具体实施方式
本发明涉及的生物效价、比活性及纯度的测定及计算方法。
生物效价测定:
FSH、LH生物效价测定按照《中华人民共和国药典》2015年版四部通则1216及1217检测。
比活性测定:
精密称取本品约10mg,精密加入水1ml使溶解;另精密称取牛血清白蛋白对照品,加水溶解制成每1ml中分别含1.0mg、0.8mg、0.6mg、0.4mg、0.2mg、0mg的溶液,照紫外-可见分光光度法(《中华人民共和国药典》2015年版四部通则0401),分别在280nm的波长处测定吸光度,以牛血清白蛋白溶液的浓度为横坐标,在280nm的吸光度为纵坐标绘制标准曲线,吸光度和浓度关系应呈线性。从标准曲线上求得供试品溶液的蛋白浓度,按下式计算比活:
HPLC纯度测定:
取本品适量,加水制成每1ml中约含500IU FSH的溶液作为供试品溶液。照《中华人民共和国药典》2015年版四部通则0512高效液相色谱法试验。采用凝胶色谱柱 Superdex 75;以磷酸盐缓冲液(取85%H3PO46.74ml,加水800ml,再加Na2SO4 14.2g,用50%NaOH调pH 至6.7,用水定容为1000ml);柱温30℃;流速0.5ml/min;检测波长214nm;进样量100μl。
电泳有关物质测定:
照(《中华人民共和国药典》2015年版四部通则0541第五法SDS-聚丙烯酰胺凝胶电泳法)检查。供试品溶液浓度为30000IU FSH/ml,将其稀释20倍作为对照溶液,上样量为10μl。
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
实施例1
如图1所示,将HMG粗制品(本公司生产,批号Z0203150901)作为起始原料,其FSH生物效价为30IU/mg,LH生物效价为28IU/mg,FSH比活性为43IU/mg蛋白质。
1. Capto DEAE 阴离子交换层析
用200ml水溶解8.0g HMG粗制品,调节溶液的pH值至7.5,将此溶液上样至柱体积为250ml的Capto DEAE层析柱(购自GE公司),层析柱预先用平衡液(0.02M PB,pH7.5)平衡好;上样结束后用平衡液洗涤未吸附的蛋白,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用洗脱液(0.02M PB+0.15MNaCl)洗脱FSH,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,共收集洗脱流出液1.0L,用截留分子量为6KD的超滤膜浓缩至约100ml,加入预冷至-20℃的95%乙醇至乙醇浓度为85%,搅拌均匀后静置过夜沉淀蛋白,次日离心收集沉淀,加入无水乙醇脱水3次后真空干燥,得到尿促卵泡素中间体I 0.73g。
2. CM-Sepharose 阳离子交换层析
尿促卵泡素中间体I 0.7g 用30ml平衡液(0.1M HAc-NaAc,pH4.5)溶解后上样至柱体积为20ml的 CM-Sepharose 层析柱(购自GE公司),层析柱预先用平衡液平衡好;上样结束后用平衡液洗涤未吸附的蛋白,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用洗脱液(0.1M HAc-NaAc+0.5M NaCl,pH4.5)洗脱FSH,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,共收集洗脱流出液100ml,即为尿促卵泡素中间体II。
3. Capto Blue (high sub)染料亲和层析
将尿促卵泡素中间体II 98ml调节pH及电导率与平衡液(0.1M NaAc,pH7.0)一致,上样至已平衡好的柱体积为15ml的Capto Blue (high sub) 层析柱(购自GE公司);上样结束后用平衡液洗涤未吸附的蛋白,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用洗脱液(0.02M PB+2.0M KCl,pH 9.0)洗脱FSH,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,共收集洗脱流出液70ml,即为尿促卵泡素中间体III。
4. Phenyl-650M疏水层析
往尿促卵泡素中间体III 68ml中添加固体硫酸铵,搅拌溶解,调节pH及电导率与平衡液(0.02M PB+1.4M (NH4)2SO4,pH7.0)一致,上样至已平衡好的柱体积为10ml的Phenyl Phenyl-650M层析柱(购自TOSOH公司);上样结束后用平衡液洗涤未吸附的蛋白,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用洗脱液(0.02M PB+0.3M (NH4)2SO4,pH7.0)洗脱FSH,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,共收集洗脱流出液40ml,即为高纯度尿促卵泡素溶液。
将高纯度尿促卵泡素溶液用截留分子量为6KD的超滤膜超滤浓缩后,用0.01M PB缓冲溶液(pH 6.0)换盐3次,按照4%(w/v)的比例添加乳糖配制成冻干原液,冷冻干燥后得到0.91g高纯度尿促卵泡素成品,成品相关参数见表1,FSH的HPLC及电泳纯度图谱分别如图2及图3所示。
表1 实施例1制备的高纯度尿促卵泡素成品参数
实施例2
将低纯度HMG(本公司生产,批号Z0203150901)作为起始原料,其FSH生物效价为30IU/mg,LH生物效价为28IU/mg,FSH比活性为43IU/mg蛋白质。
1. Capto DEAE 阴离子交换层析
用500ml水溶解20g HMG,调节溶液1的pH值至7.5,将此溶液上样至柱体积为630ml的Capto DEAE层析柱(购自GE公司),层析柱预先用平衡液(0.02M PB,pH7.5)平衡好;上样结束后用平衡液洗涤未吸附的蛋白,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用洗脱液(0.02M PB+0.15M NaCl)洗脱FSH,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,共收集洗脱流出液2.5L,用截留分子量为6KD的超滤膜浓缩至约100ml,加入预冷至-20℃的95%乙醇至乙醇浓度为85%,搅拌均匀后静置过夜沉淀蛋白,次日离心收集沉淀,加入无水乙醇脱水3次后真空干燥,得到尿促卵泡素中间体I 1.85g。
2. CM-Sepharose 阳离子交换层析
尿促卵泡素中间体I 1.8g 用80ml平衡液(0.1M HAc-NaAc,pH4.5)溶解后上样至柱体积为50ml的 CM-Sepharose 层析柱(购自GE公司),层析柱预先用平衡液平衡好;上样结束后用平衡液洗涤未吸附的蛋白,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用洗脱液(0.1M HAc-NaAc+0.5M NaCl,pH4.5)洗脱FSH,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,共收集洗脱流出液250ml,即为尿促卵泡素中间体II;用截留分子量为6KD的超滤膜浓缩至约100ml,加入预冷至-20℃的95%乙醇至乙醇浓度为85%,搅拌均匀后静置过夜沉淀蛋白,次日离心收集沉淀,加入无水乙醇脱水3次后真空干燥,得到尿促卵泡素中间体II干燥品 0.24g。
3. Capto Blue (high sub) 染料亲和层析
尿促卵泡素中间体II干燥品 0.21g用平衡液(0.1M NaAc,pH7.0)溶解,上样至已平衡好的柱体积为40ml的Capto Blue (high sub) 层析柱(购自GE公司);上样结束后用平衡液洗涤未吸附的蛋白,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用洗脱液(0.02M PB+2.0M KCl,pH 9.0)洗脱FSH,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,共收集洗脱流出液174ml,即为尿促卵泡素中间体III;加入预冷至-20℃的95%乙醇至乙醇浓度为85%,搅拌均匀后静置过夜沉淀蛋白,次日离心收集沉淀,加入无水乙醇脱水3次后真空干燥,得到尿促卵泡素中间体II干燥品 0.13g。
4. Phenyl-650M疏水层析
尿促卵泡素中间体II干燥品 0.11g用平衡液(0.02M PB+1.4M (NH4)2SO4,pH7.0)溶解,上样至已平衡好的柱体积为25ml的Phenyl-650M层析柱(购自TOSOH公司);上样结束后用平衡液洗未吸附的蛋白,并检测洗涤液在280nm处的吸光值,直至吸光值不再下降;再用洗脱液(0.02M PB+0.3M (NH4)2SO4,pH7.0)洗脱FSH,并检测洗脱液在280nm处的吸光值,直至吸光值不再下降,共收集洗脱流出液94ml,即为高纯度尿促卵泡素。
将高纯度尿促卵泡素用截留分子量为6KD的超滤膜超滤浓缩后,用0.01M PB缓冲溶液(pH 6.0)置换原缓冲溶液3次,按照4%(w/v)的比例添加乳糖配制成冻干原液,冷冻干燥后得到2.31g 高纯度尿促卵泡素成品,成品相关参数见表2,FSH的电泳及HPLC纯度图谱分别如图3及图4所示。
表2 实施例2制备的高纯度尿促卵泡素成品参数
。
- 还没有人留言评论。精彩留言会获得点赞!