一种利用鱼卵保存液提高CRISPR‑Cas9基因编辑和传代效率的鱼类育种方法与流程
本发明属于鱼类分子育种领域,具体涉及一种利用鱼卵保存液提高CRISPR-Cas9基因编辑和传代效率的鱼类育种方法。
背景技术:
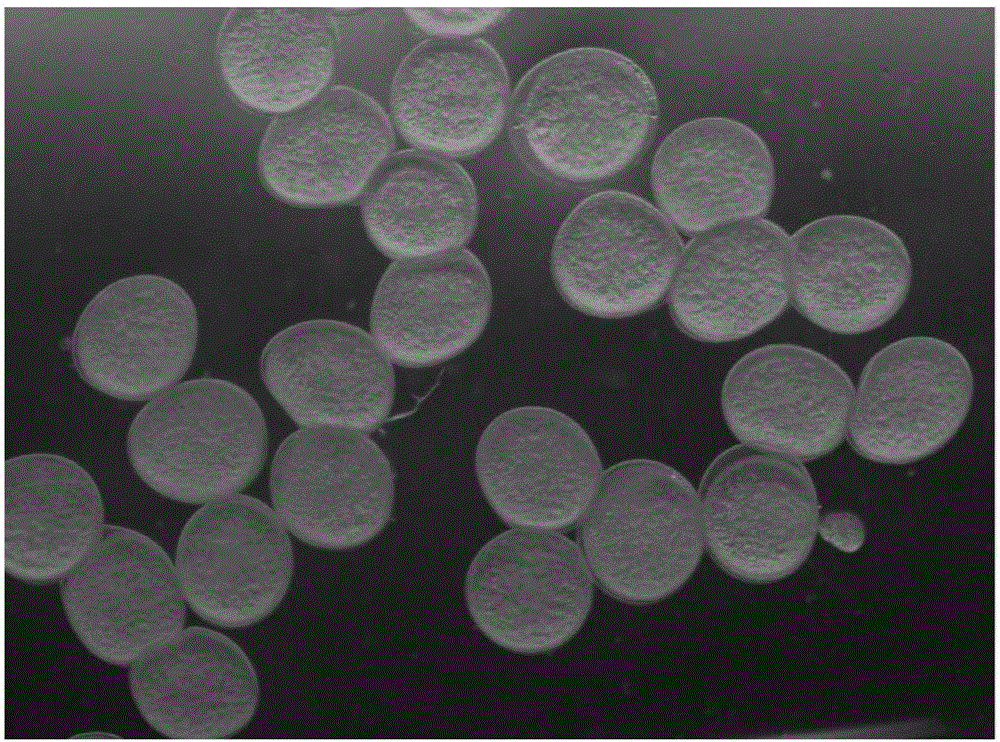
:基因编辑对研究鱼类基因功能及对其进行鱼类育种与品种改良有着重要的意义。但是,传统的CRISPR-Cas9基因编辑方法打靶效率较低,给基因编辑鱼类的筛选带来繁重的工作,严重阻碍了基因编辑鱼类育种的发展。近年来,许多学者致力于提高基因编辑效率和传代效率方法的研究,有通过在显微注射时共注射可在性腺特异表达的荧光蛋白,实现对生殖细胞进行荧光标记(DongZ,DongX,JiaW,etal.,Theinternationaljournalofbiochemistry&cellbiology.2014;55:329-34.)。虽然一定程度上由荧光标记提高筛选效率,但是并不能从本质上提高基因编辑效率。另外,根据同源重组效率间接影响基因编辑效率,通过抑制同源重组促进NHEJ修复的方法来提高基因编辑效率(MaruyamaT,DouganSK,TruttmannMC,etal.,Naturebiotechnology.2015,33(5):538-42.)。此外,还有通过直接注射Cas9蛋白来提高靶基因的编辑效率(FujiiH,KotaniH,TaimatsuK,etal.,PloSone.2015,10(5):e0128319.)。但是上述现有技术中的方法,都不能很好地提高CRISPR-Cas9基因编辑技术的打靶效率和基因编辑传代效率。技术实现要素:为了克服现有技术中所存在的问题,本发明的目的在于提供一种利用鱼卵保存液提高CRISPR-Cas9基因编辑和传代效率的鱼类育种方法。为了实现上述目的以及其他相关目的,本发明采用如下技术方案:本发明的第一方面,提供一种利用鱼卵保存液提高CRISPR-Cas9基因编辑和传代效率的鱼类育种方法,包括步骤:(1)收集鱼卵:挑选正常发育成熟的雌鱼,进行人工取卵,收集鱼卵并将其置于鱼卵保存液中保存;(2)显微注射:将步骤(1)中保存在鱼卵保存液中的鱼卵取出,注射Cas9cappedRNA和gRNA,将经显微注射后的鱼卵置于鱼卵保存液中保存;(3)人工授精:取出步骤(2)中经显微注射后的鱼卵,加入适量雄鱼精子,进行人工授精,获得受精卵;(4)育种:将步骤(3)中所得受精卵进行培养,获得基因编辑处理的P0代鱼;将所述基因编辑处理的P0代鱼与野生型鱼杂交,获得基因编辑处理的F1代传代鱼。优选地,所述鱼为斑马鱼。优选地,所述鱼卵保存液中含有Leibovitz'sL-15和牛血清蛋白。优选地,每1000ml所述鱼卵保存液中,Leibovitz'sL-15的体积为800~950ml。更优选为900ml。优选地,每1000ml所述鱼卵保存液中,牛血清蛋白的质量是0.4~0.8g。更优选是0.5g。优选地,步骤(1)中,进行人工取卵时,选择正常性成熟且腹部膨大的雌鱼。优选地,步骤(2)中,保存时,放置于恒温生化培养箱中避光保存。优选地,步骤(3)中,取健康雄鱼解剖获得精巢,加入适量缓冲液进行研磨,取适量精巢研磨液,获得雄鱼精子。优选地,步骤(4)中,所述基因编辑选自:mc4r基因编辑、mrap2b基因编辑、mc3r基因编辑或mpv17基因编辑。本发明的第二方面,提供了前述方法在研究鱼类基因功能中的用途。与现有技术相比,本发明具有如下有益效果:本发明将鱼卵保存液技术、显微注射技术和CRISPR-Cas9基因编辑技术三者巧妙的结合起来,大大提高了CRISPR-Cas9基因编辑技术的打靶效率和基因编辑传代效率,明显地节约了利用基因编辑方法进行鱼类育种的筛选时间,对促进基因编辑鱼类育种的快速发展有着重要意义。附图说明图1:鱼卵注射皿示意图。图2:保存在鱼卵保存液中的经显微注射后的卵子。图3:mc4r、mrap2b、mc3r和mpv17基因编辑T7E1检测。图4:注射mcherrymRNA到斑马鱼卵子中,2小时后可见红色荧光蛋白表达(a,白光b,荧光),证明未受精的卵子具有翻译蛋白的能力。图5:基因编辑效率检测(A)和传代效率检测(B);nP0和sP0分别表示正常注射和鱼卵保存注射P0代;nf1和sf1分别表示正常注射和鱼卵保存注射F1代。图6:pXT7-Cas9示意图。图7:pUC57-gRNA示意图。具体实施方式在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本
技术领域:
技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本
技术领域:
的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本
技术领域:
常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULARCLONING:ALABORATORYMANUAL,Secondedition,ColdSpringHarborLaboratoryPress,1989andThirdedition,2001;Ausubel等,CURRENTPROTOCOLSINMOLECULARBIOLOGY,JohnWiley&Sons,NewYork,1987andperiodicupdates;theseriesMETHODSINENZYMOLOGY,AcademicPress,SanDiego;Wolffe,CHROMATINSTRUCTUREANDFUNCTION,Thirdedition,AcademicPress,SanDiego,1998;METHODSINENZYMOLOGY,Vol.304,Chromatin(P.M.WassarmanandA.P.Wolffe,eds.),AcademicPress,SanDiego,1999;和METHODSINMOLECULARBIOLOGY,Vol.119,ChromatinProtocols(P.B.Becker,ed.)HumanaPress,Totowa,1999等。实施例1一、鱼卵保存液的配制配制鱼卵保存液:取商业化Leibovitz'sL-15培养液,加入灭菌去离子水和牛血清蛋白,用10mMNaOH将pH调到9.0,获得鱼卵保存液。所述鱼卵保存液中,Leibovitz'sL-15培养液的体积百分比为90%,牛血清蛋白的终浓度为0.5mg/mL。二、人工取卵挑选体格健壮正常发育成熟的3月龄雌雄斑马鱼,在斑马鱼养殖水循环系统中进行分缸养殖,光周期为14:10(光照14h,黑暗10h),早晚喂养丰年虫,根据生长情况适量补喂水蚯蚓。试验前夜挑选腹部明显膨大斑马鱼雌鱼与体质健壮的雄鱼用隔板分开于产卵盒内,第二天早上取雌鱼于MS-222水中麻醉,用吸水纸擦干雌鱼体表水分(特别是生殖孔附近的水),置于培养皿中,轻压斑马鱼腹部,可见金黄色有光泽的卵子从生殖孔流出,随后将雌鱼放回清水复苏,待收集一定数量的卵子后,向卵子中加入适量步骤一所配置的鱼卵保存液,于28.5℃避光保存。三、显微注射1、鱼卵注射皿的制备:取载玻片一块,将其边缘预先烧制光滑,并在烧制过程中用秃头镊子在其边缘压制出凹槽,以便注射时固定卵子,并将制作好的载玻片固定到9cm的培养皿(塑料和玻璃均可)中(如图1所示)。2、准备注射针:将外径为1.02mm内径0.58mm的玻璃毛细针管,用拉针仪拉成针形,在体式显微镜最高放大倍数下用手术刀将针头切断少许,尽量将针头切成斜面。3、注射液的制备:5μl注射体系中将pXT7-Cas9(结构示意图如图6所示,序列如SEQIDNO.1所示)和pUC57-gRNA(结构示意图如图7所示,序列如SEQIDNO.2所示)转录出的Cas9cappedRNA和gRNA分别稀释至300ng/μl和20~50ng/μl,加入0.5μl酚红。用微量上样针吸取2μl注射液加入注射针中。将保存在鱼卵保存液中的卵子,放入注射皿,沿“置卵槽”排列成行,吸取多余保存液体,保留部分鱼卵保存液,以保证卵子在注射过程中保持湿润。4、显微注射:调整注射仪注射压,使Cas9cappedRNA和gRNA总注射量保持在50pg左右,在与水平成45度方向下针,扎入后轻踏注射板,保持数秒后平稳退针。本实施例中,选取的目的基因分别为:mc4r、mrap2b、mc3r和mpv17。针对各个目的基因,所用Cas9cappedRNA和gRNA的具体信息分别下表1所示:mc4rgRNAtargetspacerGGGGGTGTTTGTGGTGTGCTSEQIDNO.3mc4r-T7E-FGACCGCTACATCACAATCTSEQIDNO.4mc4r-T7E-RTTGGCTTCTGAAGGCATATSEQIDNO.5mpv17gRNAtargetspacerGGGTCTTTGGAGATCTTATCSEQIDNO.6mpv17-T7E-FCCGTTTGTCATAATGTGGSEQIDNO.7mpv17-T7E-RCTGCTTAGGGAGGTTTCTSEQIDNO.8mrap2bgRNAtargetspacerGCTGGAAGTGGGCGGGTCTCSEQIDNO.9mrap2b-T7E-FAATAGAGAGGGAAGAGGGCGASEQIDNO.10mrap2b-T7E-RAGAAAGTCGTCATGGCCGAGSEQIDNO.11mc3rgRNAtargetspacerGACCGTACGCAGAGCTCTGGSEQIDNO.12mc3r-T7E-FTTCTCACCCTGGGCATCGSEQIDNO.13mc3r-T7E-RGAGTCGCCATAAGCACTASEQIDNO.14如上表1给出了每个基因具体的打靶位点序列,以及T7E检测引物序列。四、鱼卵保存液中保存收集经步骤三中经显微注射后的卵子,小心转移到含有鱼卵保存液的培养皿中,放入28.5℃的恒温生化培养箱中避光保存30~40min。保存在鱼卵保存液中的显微注射后卵子如图2所示,显微注射后的卵子能够在鱼卵保存液中稳定保存,保持受精能力。五、人工授精取斑马鱼雄鱼MS-222麻醉后解剖取精巢,根据精巢大小加入适量Cortland鱼用生理盐水(Cortland配方:NaCl7.25g/L;KCl0.38g/L;CaCl20.162g/L;NaHCO31.0g/L;NaH2PO40.41g/L;MgSO40.23g/L;葡萄糖1.0g/L)研磨,根据精液浓度加入适量Cortland鱼用生理盐水稀释,放至冰盒低温保存;将于28.5℃恒温生化培养箱中避光保存的卵子取出,除去保存液后加入适量精子,添加少量清水短暂摇晃,室温放置2~4min,然后加入适量孵化水,置于28.5℃的恒温生化培养箱中继续培养,直至受精卵孵化成仔鱼。五、基因打靶效率和编辑基因传代效率检测利用T7核酸内切酶Ⅰ(T7E1)识别并切割不完全配对DNA原理,收集P0代受精卵和与野生型斑马鱼杂交后F1代受精卵,提取基因组DNA,根据基因打靶序列设计引物,在20μLPCR反应体系中,扩增目的基因片段,将所得目的基因片段与野生型鱼获得的对应片段等体积混合,取8.5μL与1μLT7核酸内切酶Ⅰ缓冲液混合均匀进行高温变性退火(变性退火程序:95℃5min,95℃-75℃0.1℃/s,75℃-16℃0.1℃/s,16℃2min),加入0.5μLT7E1酶37℃孵育20min,2%琼脂糖凝胶电泳,观察酶切后条带是否与预测大小一致。图3为T7E1检测结果,凝胶图结果表示试验所用gRNA具有引导Cas9剪切基因组的能力,主要证明实验所用gRNA的有效性。图4结果证明卵子具有翻译的能力,证明Cas9cappedRNA在卵子中可以翻译成Cas9蛋白。对比传统的方法,提前注射给Cas9cappedRNA,利用卵子提取翻译出Cas9蛋白,从而给Cas9蛋白更加充足的时间对基因组进行剪切编辑。图5A表示,通过对比卵子保存方法和传统注射方法检测P0代的打靶效率,可以发现卵子保存方法大大提高了Cas9的基因编辑效率,利用卵子保存方法p0代检测到的有基因突变鱼的个体数量显著多于传统方法,四个基因的打靶效率均有显著提高。图5B表示,卵子保存方法,大大提高了性腺传代效率,通过检测F1代鱼是否能遗传亲本的基因突变,发现卵子保存方法基因突变的传代效率也大大提高。此外,本发明还采用了其他两种鱼卵保存液,其中一种鱼卵保存液中,Leibovitz'sL-15培养液的体积百分比分别为80%,牛血清蛋白的终浓度为0.8mg/mL。另外一种鱼卵保存液中,Leibovitz'sL-15培养液的体积百分比分别为95%,牛血清蛋白的终浓度为0.4mg/mL。采用上述相同的方法,取得了基本相同的实验效果,在此不再一一详述。由此可见,本发明利用鱼卵保存液和CRISPR-Cas9基因编辑技术,结合显微注射,提高了CRISPR-Cas9基因编辑效率和编辑基因性腺传代效率,从而大大节约编辑基因筛选时间,快速获得基因编辑鱼类。因此,与传统CRISPR-Cas9基因编辑相比,本发明大大提高了CRISPR-Cas9基因编辑效率,增加了编辑基因传代效率,缩短了获得基因编辑鱼类纯系的筛选时间,对促进基因编辑鱼类分子育种的应用具有巨大的推动作用。以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本
技术领域:
的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1