杉木植物磺肽素CLPSK2基因及其应用的制作方法
本发明属于基因技术领域,具体涉及杉木植物磺肽素(PSK)CLPSK2基因及其应用。
背景技术:
杉木是我国南方特有常绿针叶树种之一,其生长快,干形通直圆满,耐腐蚀,木材优良,具有重要的生态价值及经济价值。杉木在我国已经有3000多年的栽培历史,栽培面积达853.86Mha,占我国森立储蓄面积的25~30%,商品木材提供占我国人工林的25%左右。20世纪50年代以来,我国开始有计划的进行杉木遗传改良,并通过一系列的育种手段,选育出大批杉木优良种源、家系及优良无性系。目前,育种策略由传统育种发展到分子生物学紧密相连,并且基于基因组信息的选择育种新阶段。
目前,靠杉木种子园提供种子的育种方式,易受自然环境影响,容易出现大小年现象从而导致优良种子产量不稳定,另外,有性繁殖子代性状不稳定,这在一定程度上影响杉木实生林地发展。为满足市场需求及解决育种方面的难题,一种快速有效的杉木优良无性繁殖技术,即胞胚胎发生技术应运而生。体细胞胚胎发生技术具有繁殖数量多,速度快,再生率高等优点,是实现优良种苗模式化生产的重要手段。已有研究表明PSK-α能促进体细胞胚的形成,并已经建立了杉木体胚发生体系,但总得体胚发生同步化程度不高,稳定性差。因此深入了解PSK基因功能及其调控机理具有重要意义。
技术实现要素:
发明目的:针对现有技术中存在的不足,本发明的目的是提供一种杉木植物磺肽素CLPSK2基因,满足使用需求。本发明的另一名地是提供一种上述杉木植物磺肽素CLPSK2基因的应用。
技术方案:为了实现上述发明目的,本发明采用的技术方案为:
杉木植物磺肽素CLPSK2基因,其DNA序列如SEQ ID NO.1所示。
所述的杉木植物磺肽素CLPSK2基因的表达蛋白,其氨基酸序列如SEQ ID NO.2所示。
含有所述的杉木植物磺肽素CLPSK2基因的表达载体或宿主细胞。
所述的杉木植物磺肽素CLPSK2基因在促进植物生根中的应用。
所述的杉木植物磺肽素CLPSK2基因在促进植物促进愈伤组织增殖中的应用。
有益效果:与现有技术相比,本发明的杉木植物磺肽素CLPSK2基因,通过试验证实,在功能上既能促进根的生长,又能促进愈伤组织增殖,在植物育种已经生长中将具有广泛的应用。
附图说明
图1是转基因卡那霉素抗性植株结果图;
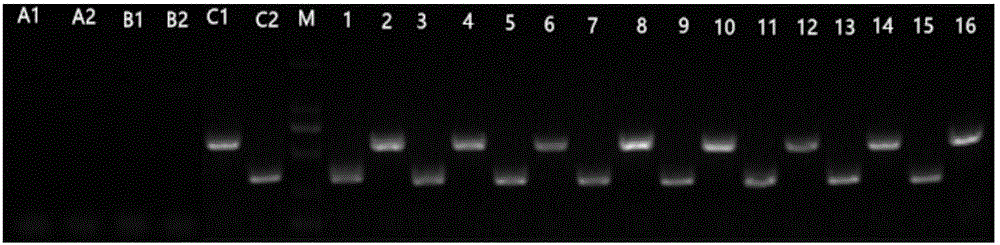
图2是转基因植株PCR结果电泳图;图中:M-DL2000;A1,B1,C1, 2,4,6,8,10,12,14,16 -使用引物35S-F和ClPSK2-R;A2,B2,C2, 1,3,5,7,9,11,13,15-使用引物CLPSK2-F和CLPSK2-R;A1,A2-模板为ddH2O;B1,B2-模板为野生型拟南芥DNA;C1,C2-模板为重组质粒;1~16-模板为拟南芥初步筛选阳性植株的DNA;
图3是ClPSK2基因对拟南芥愈伤增值的影响结果图;图中:WT-野生型,P2-转ClPSK2株系;
图4是转ClPSK2 T2代植株与野生型拟南芥植株诱导形成愈伤的鲜重结果图;图中:1-野生型拟南芥;2~4转CLPSK2基因T2代的不同株系;
图5是过量表达ClPSK基因对拟南芥根长的影响结果图;图中:1~3-野生型Col,6~7-ClPSK2转基因株系;
图6是转ClPSK T2代植株与野生型拟南芥植株根长的比较结果图;图中:1-野生型Col;2~4-转CLPSK2基因T3代的不同株系;
图7是过量表达ClPCK对拟南芥器官发生的影响结果图;图中:A,B,C,D-为液体悬浮培养前拟南芥愈伤状态,E,F,G,H-为悬浮培养7d时拟南芥愈伤状态,I,J,K,L-为悬浮培养14d拟南芥愈伤组织状态;A,E,I-对照,B,F,J-用0.1mg/L PSK处理,D,H,L-转ClPSK2基因;
图8是倒置显微镜下拟南芥愈伤组织形成不定根的型态结果图;图中:悬浮培养14d时,拟南芥不定根的型态,A-用0.1mg/L PSK-α处理, C-转ClPSK2基因;
图9是细胞周期相关基因半定量结果图;图中:A-未转基因愈伤组织悬浮材料,B-0.1mg/L PSK-α处理的未转基因愈伤组织悬浮材料,D-转ClPSK2愈伤组织悬浮材料;
图10是细胞周期相关基因相对表达量结果图;
图11是根形态建成相关基因半定量结果图;图中:A~E依次对应的组织为:根、茎、叶、胚性愈伤组织、成熟子叶胚;
图12是根形态建成基因相对表达量结果图。
具体实施方式
下面结合具体实施例对本发明做进一步的说明。
实施例1
杉木植物磺肽素基因CLPSK2的克隆,具体步骤如下:
1)采用CTAB法提取杉木愈伤RNA,获得纯度较高的RNA,OD260/OD280值在1.8-2.0,OD260/OD230值为2.0。
2)使用POCHE公司反转试剂盒,模板为上述提取RNA,按照说明书步骤合成cDNA第一链,所得cDNA放于-20℃保存。
3)PCR扩增目的片段:以cDNA为模板,使用TOYOBO公司的高保真酶KOD-Fx进行PCR扩增,25μL PCR扩增体系为:12.5μL 2×PCR Buffer,5μL dNTP(2 mM),0.75μL Forward Primer,0.75μL Reverse Primer,1.0μL cDNA,0.5μL KOD-Fx polymerase,4.5μL ddH2O。具体引物序列如下表所示:
ClPSK2-F:5'-ATGAAAAAAATTTCATTTCAACAGGGAAG-3';
ClPSK2-R:5'-TGGGTTCTTGTGGTGTTGTGTATAAATG-3'。
PCR反应条件:94℃2min;98℃10s,50℃30s,36 cycles;68℃1min;4℃forever。
PCR反应结束后,进行1.5%凝胶电泳检测,条带大小与预期相符。
4)将获得的与预期大小相符的目的片段,使用AXYGEN公司的DNA凝胶回收试剂盒经行回收,回收纯化后的产物,取2μL 1.5%琼脂糖进行凝胶电泳检测回收效果。
5)回收目的片段加尾,高保真酶KOD-Fx PCR扩增产物为平末端,必须添加polyA尾后才能进行TA克隆,20µL反应体系为:2µL 10×PCR Buffer,0.4µL 10mMdNTP,1.6µL 25mM MgCl2,10µL DNA,0.2µL rTaq polymerase,5.8µL ddH2O。PCR反应体系为:72℃,30min。
6)链接反应:连接的克隆载体为PMD19-T Vector(Takara公司提供),10µL链接体系:5µL Solution I,1µL PMD19-T Vector,4µL PCR产物,将链接体系0.2mL EP管中,之后置于16℃水浴锅中,链接反应4-5h。
7)将连接产物转化至JM109大肠杆菌感受态细胞中,挑取阳性克隆进行PCR验证后,将确定有预期条带的单克隆菌株送至上海英俊公司进行测序。
所得的基因序列如SEQ ID NO.1所示,命名为植物磺肽素基因CLPSK2。其氨基酸序列如SEQ ID NO.2所示。
实施例2
植物磺肽素基因CLPSK2的超表达载体构建及转化,步骤如下:
1)添加酶切位点:由于实施例1中克隆的目的基因两边没有酶切位点,需要添加酶切位点才能与PBI121载体连接。以带有目的片段的克隆载体PMD19-T阳性重组质粒为模板,通过重新构建引物,在目的片段两侧添加Xba I和Bam HI两个酶切位点。
2)质粒提取:采用SDS碱裂解法提取质粒。
3)20µL PCR反应体系:1.0µL 10×PCR Buffer,0.4µL 10mMdNTP,1.2µL 25mM MgCl2,1.0µL Forward Primer,1.0µL Reverse Primer,1.0µL质粒,0.1µL rTaq polymerase,13.3µL ddH2O。所用引物:
CLPSK2Xba I-F:5'-TCTAGAATGAAAAAAATTTCATTTCAACAGGG-3';
CLPSK2 Bam HI-R:5'-GGATCCTGGGTTCTTGTGGTGTTGT-3';
反应条件:94℃5 min;95℃30s,57℃30s,32cycles;72℃1min30s;72℃7min;4℃forever。
取5µL PCR产物进行1.5%琼脂糖凝胶电泳检测,用AXYGENA凝胶回收试剂盒进行纯化目的片段。
4)构建超表达载体:将分离出来的带有酶切位点的目的片段,用Takara公司提供的限制性内切酶(Xba I和Bam HI)酶切,将酶切反应后回收的目的片段及PBI121空载片段,用New England Biolabs 公司提供的T4链接酶经行链接,载体片段:目的片段=3:1-5:1。链接温度为16℃,链接4-6h。构建出超表达载体。
5)重组质粒的筛选:将目的片段与PBI121链接产物转入大肠杆菌JM109的超感细胞中。将得到的阳性单菌落接种于含有抗生素(含有50mg/ml卡那霉素)的LB培养基中,置于恒温摇床上,37℃,250rpm培养12-16h。以菌液为模板,使用通用引物35S上游引物和目的条带下游引物及目的条带上下游性引物,通过菌液PCR,筛选阳性克隆。35S-F序列为:5'-TGAAGATAGTGGAAAAGGAAGGTG-3'。将阳性克隆菌液送至上海英俊公司测序,分析测序结果,看是否有基因突变现象。
6)重组质粒转化农杆菌:测序结果正确的大肠杆菌进行质粒提取,将提取的重组质粒转入农杆菌感受细胞中,用抗生素(卡那霉素和庆大霉素)筛选阳性菌株,将条带正确的阳性克隆菌液与50%无菌甘油,以2:1体积比混合后,放于-80℃保存。
7)农杆菌介导转化拟南芥:将含有超表达载体的农杆菌GV3101,用花絮浸染的方式转入野生型拟南芥Col中。主要步骤包括:选择长势良好的拟南芥,转化前去除荚果及已开花授粉的花朵;将拟南芥花絮浸泡在制备好的农杆菌菌液中,浸泡30-40s;将浸泡过的拟南芥平方在托盘中,避光放置24h;将拟南芥取出,放于23℃16h光照、8h黑暗的光周期培养箱中培养。
8)转基因植株的筛选:将收集的拟南芥转基因T1代种子进行灭菌处理后,播种至含有抗生素的1/2MS固体培养基(含有50mg/ml卡那霉素和100mg/ml头孢霉素)上,纯化24h后,置于23℃光照培养。挑选抗卡那霉素的拟南芥阳性植株,移栽至营养土中,培养条件为置于23℃16h光照、8h黑暗的光周期培养箱中。
在含有卡纳的筛选培养基上,筛选阳性植株,转基因阳性植株有卡纳霉素抗性,将会在含有卡纳霉素的培养基上存活,如图1所示。
9)拟南芥转基因植株的鉴定:CTAB法提取拟南芥叶片DNA,以提取拟南芥叶片DNA为模板,用通用引物35S上游引物和目的条带下游引物及目的条带上下游性引物,进行PCR反应。
从初步筛选的的抗性植株中选取8棵进行PCR检测,以抗性植株DNA为模板,用通用引物35S上游引物和目的条带下游引物及目的条带上下游性引物,进行PCR反应,PCR结果如图2所示。由图2可知,经琼脂糖凝胶电泳分离后,抗性植株均出现特异性条带,且与目的片段大小一致,说明转基因植株中存在CLPSK2基因。
实施例3
CLPSK2基因的应用,主要过程如下:
1、转基因植株组织培养
1)培养基配方:基本培养基:MS+20g/l蔗糖,琼脂6.8g/l,pH5.8。愈伤诱导培养基:MS+2.0g/l 2,4D+0.2g/l 6-BA+0.5g/l 水解酪蛋白+30g/l 蔗糖,琼脂6.8g/l,pH5.8。再生体细胞胚诱导培养基:MS+30g/l蔗糖,pH5.8。
2)愈伤组织诱导:将野生型Col种子及转基因拟南芥T2株系P1-1、P1-5、P1-21、P2-2、P2-4、P2-12的种子灭菌,分别点在基本培养基及加卡纳霉素的A培养基上,置于23℃光照培养。当拟南芥长出四片真叶时,进行外植体取材及愈伤诱导培养。
将野生型Col及转基因阳性植株(经PCR验证,含有目的片段),用解剖刀划伤叶片及根茎部后接种到愈伤诱导培养基中,野生型为对照,对照及每个转基因株系各处理30棵。置于23℃培养箱中暗培养,获取愈伤组织。
3)诱导器官发生:将野生型Col及转基因阳性植株诱导的的胚性愈伤组织分别转入再生体细胞胚诱导培养基中,野生型为对照,23℃,85rpm,黑暗液体悬浮培养,三组重复,显微观察细胞状态。
将拟南芥接种于愈伤诱导培养基上,培养30d后,发现转基因株系愈伤增值速度明显比对照快,如图3所示。对愈伤组织的鲜重及干重进行数据统计,如图4所示,发现转基因株系形成愈伤组织的鲜重及干重数值明显高于对照组,且差异性显著。
4)转基因植株根长观察
将野生型Col种子及转基因拟南芥T3纯和种子,灭菌后点在A培养基,将培养皿竖直放置,置于23℃光照培养。观察拟南芥根部形态变化。
对培养15d的转基因阳性植株T3代植株进行根长测量,发现转基因株系根明显长于比对照,如图5所示。对野生型及转基因株系根长进行数据统计,结果如图6所示,转基因株系根长明显长于对照组,且差异性显著。
将拟南芥诱导愈伤接种于基本MS液体培养基中培养,野生型拟南芥形成的愈伤组织经过液体悬浮培养愈伤表面无明显变化,0.1mg/L PSK-α处理野生型拟南芥形成的愈伤组织经过悬浮培养,7d时表面有凸起产生(图7F),14d时愈伤组织表面有不定根产生(图7J);转基因愈伤组织经过悬浮培养,7d时转基因愈伤组织表面有凸起产生(图7G,H),14d发现转基因愈伤表面有不定根产生(图7K,L)。用倒置显微镜观察,愈伤表面形成的凸起有明显的根的特征(图7-8)。
5)基因表达分析
取野生型及转基因株T2系形成的愈伤提取RNA,并反转形成cDNA,通过半定量和qRT-PCR的方法检测细胞周期相关基因表达水平。取液体培养7d的愈伤组织提取RNA,并反转形成cDNA,通过半定量和qRT-PCR的方法检测与根型态建成相关基因表达水平。引物序列如下:
AtActin-F:5'-GGCTCCTCTTAACCCAAAGGC-3'
AtActin-R:5'-CACACCATCACCAGA ATCCAGC-3';
AtCYCD4-F:5'-GATGAGGGCATGArTGTTGACG-3';
AtCYCD4-R:5'-CCAAACTGGTGTACTTCACAAGC-3';
AtCYCB1-F:5'-CTCAAAATCCCACGCTTCTTGTGG-3';
AtCYCB1-R:5'-CACGTCTACTACCTTTGGTTTCCC-3';
AtCDKB1-F:5'-GGTGGTGACATGTGGTCTGTTGG-3';
AtCDKB1-R:5'-CGCAGTGTGGAAACACCCGG-3';
AtRBR-F:5'-CTCATAAGTCGCCTGCTGCTAAG-3';
AtRBR-R:5'-TTGCTGTGCTCACTGGTGTTG-3';
SCR-F:5'-TGGTCGAGGAGGArGAGGAATAG-3';
SCR-R:5'-CGCTTGTGTAGCTGCATTTCC-3';
SHR-F:5'-ACACTGTACCATCGACCAAACACC-3';
SHR-R:5'-ACGAAAACCAATCCAACCAC-3';
PLT1-F:5'-CCTAGACTGGCCTTCCCTTC-3';
PLT1-R:5'-GTTACCTACAGTCGTCACTTGTGC-3';
PLT2-F:5'-ACTCTTGTCTCGTCATGTTTTTCA-3';
PLT2-R:5'-TAGCGGTTGGAGGACCATCG-3';
WOX5-F:5'-AAGCTTGCGAAGAAGATTGTCAAGAGG-3';
WOX5-R:5'-GATATCCGTGGTGGTCTCTCGAATATA-3'。
半定量PCR:以 cDNA 为模板,配制PCR反应混合液,20µL半定量体系:2µL 10×PCR Buffer,0.4µL 10mM dNTPs,1.2µL MgSO4 (25mM),0.5µL Forward Primer,0.5µL Reverse Primer,2µL cDNA,0.1µL rTaq,12.3µL ddH2O。试验中各个模板的量相同,PCR 体系以及程序都完全相同,试验重复3次。
PCR条件:94℃2min;94℃15s,54℃30s,28-30cycles;72℃1min;72℃10min;4℃forever。
实时荧光定量PCR:实时定量PCR采用Roche 公司的 LightCycler®480 SYBR Green I Master 试剂盒,在LightCycler®480 II (Roche)上完成,每个样品反应三次重复,数据提取分析采用LightCycler®480 software (Roche)。实时定量反应体系为:10µL SYBR Green PCR Master Mix,0.5µL Forward Primer,0.5µL Reverse Primer,3µL cDNA(10ng/µL),ddH2O up to 20µL。
反应程序:95℃5min;95℃10s,60℃15s,40cycles;72℃15s。
取悬浮培养7d的愈伤组织悬浮材料,进行细胞周期相关基因CYCB1;1、CYCD4;1、CDKB1;1、RBR表达量的对比分析,结果如图10、11所示。CYCB1;1、CYCD4;1、CDKB1;1、RBR在转ClPSK2愈伤组织及经0.1mg/L PSK-α处理的愈伤组织中均上调表达,转ClPSK2愈伤组织表达量略高于0.1mg/L PSK-α处理的愈伤组织,说明过量表达ClPSK2促进了细胞分裂。
取悬浮培养7d的愈伤组织悬浮材料,进行根发育相关基因PLT1、PLT2、SHR、SCR、WOX5表达量的对比分析,结果如图11、12所示。PLT1、PLT2、SHR、SCR、WOX5在转ClPSK2愈伤组织及经PSK-α处理的愈伤组织中均上调表达,转ClPSK2愈伤组织表达量略高于PSK-α处理的愈伤组织。说明过量表达ClPSK2促进细胞分化及根的形态建成。
在拟南芥中异源表达CLPSK2基因能明显促进拟南芥根的伸长,与拟南芥过量表达AtPSK4表型一致,说明CLPSK2基因在功能上能促进根的生长。
过量表达CLPSK2能使拟南芥形成的愈伤组织生长速度远远超过对照组,说明CLPSK2能促进愈伤组织增值。
SEQUENCE LISTING
<110> 南京林业大学
<120> 杉木植物磺肽素CLPSK2基因及其应用
<130> 100
<160> 27
<170> PatentIn version 3.3
<210> 1
<211> 294
<212> DNA
<213> Cunninghamia lanceolata
<400> 1
atgaaaaaaa tttcatttca acagggaagg ctgtggattt ttagcatatg cagtatcttt 60
cttgtggtta cagtcatggc tgcacgccca catccaagag gtgtcctgaa tgcttctgtg 120
ttgttcacaa aagatcaaat ggagataaag cacacttttg ctagcaaggt ggaaaaagaa 180
gagtcaaagg tagggaatga atgtggcaat gatatgaatg aagaagaatg cttagatcgg 240
agaacattag ctgctcagac agattacatt tatacacaac accacaagaa ccca 294
<210> 2
<211> 98
<212> PRT
<213> Cunninghamia lanceolata
<400> 2
Met Lys Lys Ile Ser Phe Gln Gln Gly Arg Leu Trp Ile Phe Ser Ile
1 5 10 15
Cys Ser Ile Phe Leu Val Val Thr Val Met Ala Ala Arg Pro His Pro
20 25 30
Arg Gly Val Leu Asn Ala Ser Val Leu Phe Thr Lys Asp Gln Met Glu
35 40 45
Ile Lys His Thr Phe Ala Ser Lys Val Glu Lys Glu Glu Ser Lys Val
50 55 60
Gly Asn Glu Cys Gly Asn Asp Met Asn Glu Glu Glu Cys Leu Asp Arg
65 70 75 80
Arg Thr Leu Ala Ala Gln Thr Asp Tyr Ile Tyr Thr Gln His His Lys
85 90 95
Asn Pro
<210> 3
<211> 24
<212> DNA
<213> Artificial
<220>
<223> 35S-F序列
<400> 3
tgaagatagt ggaaaaggaa ggtg 24
<210> 4
<211> 21
<212> DNA
<213> Artificial
<220>
<223> AtActin-F序列
<400> 4
ggctcctctt aacccaaagg c 21
<210> 5
<211> 22
<212> DNA
<213> Artificial
<220>
<223> AtActin-R序列
<400> 5
cacaccatca ccagaatcca gc 22
<210> 6
<211> 22
<212> DNA
<213> Artificial
<220>
<223> AtCYCD4-F
<400> 6
gatgagggca tgartgttga cg 22
<210> 7
<211> 23
<212> DNA
<213> Artificial
<220>
<223> AtCYCD4-R序列
<400> 7
ccaaactggt gtacttcaca agc 23
<210> 8
<211> 24
<212> DNA
<213> Artificial
<220>
<223> AtCYCB1-F序列
<400> 8
ctcaaaatcc cacgcttctt gtgg 24
<210> 9
<211> 24
<212> DNA
<213> Artificial
<220>
<223> AtCYCB1-R序列
<400> 9
cacgtctact acctttggtt tccc 24
<210> 10
<211> 23
<212> DNA
<213> Artificial
<220>
<223> AtCDKB1-F序列
<400> 10
ggtggtgaca tgtggtctgt tgg 23
<210> 11
<211> 20
<212> DNA
<213> Artificial
<220>
<223> AtCDKB1-R序列
<400> 11
cgcagtgtgg aaacacccgg 20
<210> 12
<211> 23
<212> DNA
<213> Artificial
<220>
<223> AtRBR-F序列
<400> 12
ctcataagtc gcctgctgct aag 23
<210> 13
<211> 21
<212> DNA
<213> Artificial
<220>
<223> AtRBR-R
<400> 13
ttgctgtgct cactggtgtt g 21
<210> 14
<211> 23
<212> DNA
<213> Artificial
<220>
<223> SCR-F
<400> 14
tggtcgagga ggargaggaa tag 23
<210> 15
<211> 21
<212> DNA
<213> Artificial
<220>
<223> SCR-R序列
<400> 15
cgcttgtgta gctgcatttc c 21
<210> 16
<211> 24
<212> DNA
<213> Artificial
<220>
<223> SHR-F序列
<400> 16
acactgtacc atcgaccaaa cacc 24
<210> 17
<211> 20
<212> DNA
<213> Artificial
<220>
<223> SHR-R
<400> 17
acgaaaacca atccaaccac 20
<210> 18
<211> 20
<212> DNA
<213> Artificial
<220>
<223> PLT1-F序列
<400> 18
cctagactgg ccttcccttc 20
<210> 19
<211> 24
<212> DNA
<213> Artificial
<220>
<223> PLT1-R序列
<400> 19
gttacctaca gtcgtcactt gtgc 24
<210> 20
<211> 24
<212> DNA
<213> Artificial
<220>
<223> PLT2-F序列
<400> 20
actcttgtct cgtcatgttt ttca 24
<210> 21
<211> 20
<212> DNA
<213> Artificial
<220>
<223> PLT2-R序列
<400> 21
tagcggttgg aggaccatcg 20
<210> 22
<211> 27
<212> DNA
<213> Artificial
<220>
<223> WOX5-F序列
<400> 22
aagcttgcga agaagattgt caagagg 27
<210> 23
<211> 27
<212> DNA
<213> Artificial
<220>
<223> WOX5-R序列
<400> 23
gatatccgtg gtggtctctc gaatata 27
<210> 24
<211> 29
<212> DNA
<213> Artificial
<220>
<223> ClPSK2-F引物
<400> 24
atgaaaaaaa tttcatttca acagggaag 29
<210> 25
<211> 28
<212> DNA
<213> Artificial
<220>
<223> ClPSK2-R序列
<400> 25
tgggttcttg tggtgttgtg tataaatg 28
<210> 26
<211> 32
<212> DNA
<213> Artificial
<220>
<223> CLPSK2Xba I-F序列
<400> 26
tctagaatga aaaaaatttc atttcaacag gg 32
<210> 27
<211> 25
<212> DNA
<213> Artificial
<220>
<223> CLPSK2 Bam HI-R序列
<400> 27
ggatcctggg ttcttgtggt gttgt 25
- 还没有人留言评论。精彩留言会获得点赞!
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺