杀虫基因PPTX-15及其编码的杀虫肽与应用的制作方法
技术领域本发明涉及基因工程和生物防治领域,特别是一种杀虫基因及其编码杀虫肽与应用。
背景技术:
目前广泛用于害虫防治的杀虫基因主要是苏云金芽孢杆菌产生bt毒素的基因,bt毒素对鳞翅目、双翅目、鞘翅目等农业害虫表现出极高的杀虫特异性。因此bt毒素基因被转基因到棉花、玉米、烟草等广泛种植的重要作物中。携带抗虫基因的转基因作物在农业害虫防治方面起着重要的作用。然而,单一抗虫基因的长期使用使害虫对bt毒素的抗性不断增加。多种昆虫群体在自然环境下对bt蛋白制剂和bt转基因作物产生了抗性,如棉铃虫、小菜蛾及二化螟等(易晓莉等,昆虫对bt毒素抗性研究进展[j],江苏农业科学,2014年第7期)。因此,开发另外一种高效环保的新型抗虫基因或蛋白质能够增加对抗虫基因的选择和降低抗性的发展。
蜘蛛毒素因其化学多样性和广谱性而被作为潜在的杀虫剂受到广泛关注(g.f.king,etal.,spider-venompeptides:structure,pharmacology,andpotentialforcontrolofinsectpests,annu.rev.entomol.2013,58:475-96.)。蜘蛛毒素能够作用于昆虫细胞膜的多种通道和受体,如离子通道、神经配体门控通道和g蛋白关联受体等。因此对多种昆虫都具有抗虫作用。但目前对蜘蛛毒素的研究多集中在黑寡妇蜘蛛中集中重要毒素的作用机制,对其杀虫作用的直接测试比较少。
综上,现有对蜘蛛毒素的研究还不能满足抗虫基因的选择需求。因此需要一种具有杀虫效果的蜘蛛毒素,该毒素能够通过分子基因工程的方法大量表达或通过转基因技术在作物中表达,从而达到抗虫的效果。
技术实现要素:
本发明的目的是针对现有技术的上述不足,提供一种源于拟环纹豹蛛的杀虫基因pptx-15,其核苷酸序列如seqidno.1所示。
本发明的另一目的是提供一种源于拟环纹豹蛛杀虫基因pptx-15编码的杀虫肽,其氨基酸序列如seqidno.2所示,其成熟肽序列如seqidno.3。
本发明的另一目的是本发明所述源于拟环纹豹蛛的杀虫基因及其编码的杀虫肽在农作物害虫防治方面的应用。
本发明的目的可通过如下技术方案实现:
一种源于拟环纹豹蛛的杀虫基因pptx-15,其核苷酸序列如seqidno.1所示。
一种含有本发明所述人源杀虫基因的原核载体。
如本发明所述源自拟环纹豹蛛杀虫基因编码的杀虫肽在农作物害虫防治方面的应用。
一种含有如本发明所述源自拟环纹豹蛛杀虫基因编码的杀虫肽的杀虫剂。
本发明参考已经发现的黑寡妇蜘蛛等的毒素基因,利用生物信息学分析方法,对拟环纹豹蛛转录组数据库(已经公开)中的基因进行筛选,获得拟环纹豹蛛毒素的候选基因,然后利用多聚酶链式反应(pcr)及sanger法测序,获得该基因的完整序列。将该基因构建到原核表达载体pet-32a(+)中,经原核系统表达,即可获得该基因编码的杀虫肽。制备周期短,氨基酸序列小,适合体外大规模生产,同时,该杀虫肽作为全新的杀虫基因资源,具有不同于bt毒素的杀虫机制,对拓展具有生物活性的新型杀虫基因资源,降低现有bt毒素广泛使用存在的各类安全风险,减少杀虫剂的使用具有重要的科学及现实意义。
附图说明:
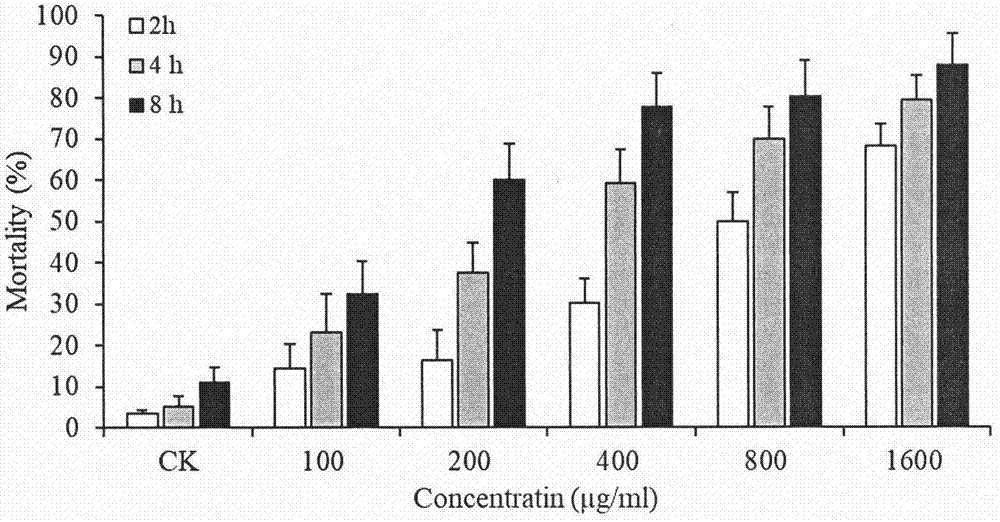
图1为注射ck和重组毒素pptx-15后,褐飞虱在不同时间点的死亡率。
图2为注射ck和重组毒素pptx-15后,灰飞虱在不同时间点的死亡率。
图3为注射ck和重组毒素pptx-15后,白背飞虱在不同时间点的死亡率。
具体实施方式:
实施例中所设计的试剂和培养基配方:
(1)lb液体培养基:
在900ml双蒸水中加入10g胰化蛋白胨,5g酵母提取物和5gnacl,搅拌混匀,用双蒸水定容至1l,置于高压灭菌锅中,121℃,灭菌20min,冷却后置于4℃保存。
(2)lb固体培养基:
在900ml双蒸水中加入10g胰化蛋白胨,5g酵母提取物,5gnacl和15g琼脂,搅拌混匀,用双蒸水定容至1l,置于高压灭菌锅中,121℃,灭菌20min,冷却后至50℃加入终浓度为100mg/l的羧苄青霉素,倒板,冷却后置于4℃保存。
(3)转膜缓冲液:
甘氨酸2.9g,trisbase5.8g,sds0.37g,甲醇200ml,加入双蒸水定容至1l。
(4)pbst:
pbs中加入0.05%体积的吐温-20。
(5)封闭液:
pbst中加入1%的脱脂奶粉。
(6)tris-hcl:
将1m的tris-hcl稀释至20mm。
(7)结合缓冲液:
20mm磷酸钠,0.5m氯化钠,10mm咪唑,双蒸水定容至1l,ph7.4。
(8)洗脱缓冲液:
20mm磷酸钠,0.5m氯化钠,500mm咪唑,双蒸水定容至1l,ph7.4。
实施例1
毒素的制备
蜘蛛毒素基因的设计和构建
对拟环纹豹蛛转录组数据库(已经公开)中的基因进行筛选,获得拟环纹豹蛛毒素的候选基因pptx-15,将其成熟肽序列按照大肠杆菌密码子偏好性进行密码子优化,设计出用于在大肠杆菌中表达的pptx-15基因序列。设计完成的基因由invitrogen公司合成,并在南京金斯瑞公司完成测序,将合成的基因克隆到大肠杆菌表达载体pet-32a(+)中,构建出含有目的基因的pet-32a(+)-pptx-15重组质粒,该毒素基因引入banhi和ecori酶切位点。
重组质粒pet-32a(+)-pptx-15的诱导表达
在lb平板中挑取不同的阳性菌斑,分别加入到含有100mg/l羧苄青霉素的lb液体培养基中,恒温摇床中250r/min,37℃,12h。将培养后的菌液按照1∶100的比例,接种到含有100mg/l羧苄青霉素的lb液体培养基中,200r/min,37℃,培养4h,此时菌液的od值为0.5-0.7;在pet-32a(+)-pptx-15重组子中加入终浓度为0.4mmol/l的iptg,200r/min,37℃,诱导表达培养5h;取表达后的菌液4ml,4℃,12000rpm离心5min,弃上清,在菌体沉淀中加入1.5ml20mm的tris-hcl,ph=7.4,重悬后进行超声破菌,强度12%,10min,运行5s,暂停5s;破菌后4℃,18000rpm,离心10min,取上清,弃沉淀。
westernblot检测
取50μl的破碎液,加17μl的loadingbuffer和2μl的β-巯基乙醇,100℃煮沸5min,加20μl的混合液到sds-聚丙烯酰胺凝胶,并加入10μl的蛋白标样,50v,50min,然后100v直至上样缓冲液至凝胶底部;电泳结束后,将凝胶取出后进入转膜缓冲液中,并将pvdf膜浸泡于甲醇1min后转入转膜缓冲液,之后进行转膜,100ma,50min;转膜结束后,将膜取出,pbst洗3次,每次5min,封闭液封闭2h,37℃,80r/min;封闭后将膜取出,pbst洗3次,每次10min,转入加入一抗的封闭液(1∶1000),孵育2h,37℃,80r/min;一抗孵育结束后,将膜取出,pbst洗3次,每次10min,转入加入二抗的封闭液(1∶2000),孵育1.5h,37℃,80r/min;二抗孵育结束后,pbst洗3次,每次10min,加入发光液,避光3min,滤纸吸干表面液体后,化学发光检测。
重组质粒pet-32a(+)-pptx-15的大量诱导表达
将培养后的菌液按照1∶100的比例,接种到100ml含有100mg/l羧苄青霉素的lb液体培养基中,培养基的体积不能超过容器体积的20%,200r/min,37℃,培养4h,此时菌液的od值为0.5-0.7;在pet-32a(+)-pptx-15重组子中加入终浓度为0.4mmol/l的iptg,200r/min,37℃,诱导表达培养5h;取表达后的菌液,4℃,12000rpm离心15min,弃上清,在菌体沉淀中加入20%培养基体积的20mm的tris-hcl,ph=7.4,重悬后进行超声破菌,强度12%,30min,运行5s,暂停5s;破菌后4℃,18000rpm,离心30min,取上清,弃沉淀。
重组毒素pptx-15的纯化
将大量诱导表达破菌后的粗蛋白液用0.22μm的滤膜过滤,采用aktaavant全自动蛋白质分离纯化系统和histraptmhp镍柱(5ml)进行纯化。先用5个柱体积的结合缓冲液平衡镍柱,流速5ml/min,上样流速1ml/min,上样后用6个柱体积的结合缓冲液清洗柱子,流速1ml/min,最后用3个柱体积的洗脱缓冲液洗脱目的蛋白,流速5ml/min。纯化后的蛋白产量约为0.85mg/l。
拟环纹豹蛛的杀虫基因pptx-15的核苷酸序列为seqidno.1,如下:
拟环纹豹蛛的杀虫基因pptx-15的氨基酸序列为seqidno.2,如下:
拟环纹豹蛛的杀虫基因pptx-15的成熟肽序列为seqidno.3,如下:
实施例2
生测的过程和方法
采用显微注射法测定了重组毒素pptx-15对3种稻飞虱的杀虫活性,试虫选取5龄若虫,每个处理3个重复,每个重复选取30头试虫,注射前,先把试虫用co2麻醉,每头试虫注射重组毒素20nl,注射部位为第一和第二胸板节间膜,注射结束后,将试虫放置在装有水稻苗的一次性口杯中,水稻苗用2%的琼脂固定,整个实验过程要轻柔,减少对试虫的伤害。实验共分为对照组和实验组,对照组注射pbs,实验组注射重组毒素pptx-15。图1、2和3分别为注射重组毒素pptx-15后,3种稻飞虱在不同时间点的死亡情况,可以看出重组的毒素pptx-15对3种稻飞虱都有较好的杀虫活性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺