骨关节炎治疗的制作方法
本申请要求2008年12月22日提交的美国临时申请号61/139,679和2009年3月30日提交的美国临时申请号61/164,486的权益,这两个申请均通过引用全文并入本文。
发明领域
本发明一般涉及用于治疗和/或预防骨关节炎(OA)的方法。根据本发明,GM-CSF拮抗剂可有效治疗骨关节炎。GM-CSF拮抗剂包括但不限于对GM-CSF或GM-CSF受体特异性的抗体。本发明还提供可用于在某些疾病模型中测试拮抗剂的转基因动物,诸如GM-CSF敲除小鼠。
发明背景
骨关节炎(OA)也称为退行性关节炎,是在老年人和肥胖者中最普遍的疾病。OA是关节的疾病,但不同于类风湿性关节炎(RA),这种疾病不是系统性的,通常只影响一个或数个关节。这种疾病导致关节软骨的总的破坏,下方骨头的硬化,和骨赘形成,造成运动能力丧失和疼痛。最终的结果往往是需要全关节置换。
OA在美国影响约~2100万人,构成所有初级保健就诊的25%,并占所有NSAID(非甾体抗炎药)处方的50%。目前没有可用的减慢或停止疾病进展的疗法;现在的药物仅仅治疗症状。该疾病的发病率和严重程度随着年龄增加。在65岁时,80%的美国人表现出OA的影像学证据,而只有60%将是有症状的。65岁时所有关节疾病的65%是OA。在2006年,美国有735,000次OA相关的住院。
现在的OA药物治疗OA的症状而不是疾病本身。治疗OA的常用药物包括非甾体抗炎药物(NSAID),诸如双醋瑞因、扶他林、莫比可与奥斯克(通用名称:双氯芬酸钠、米索前列醇、美洛昔康)。NSAID主要是通过在中枢神经系统(CNS)中抑制前列腺素合成而起作用的口服化合物。其它常用药物包括非麻醉镇痛剂,诸如ultram(曲马多)、COX-2抑制剂,诸如西乐葆和arcoxia(塞来考昔、艾托考昔)、麻醉镇痛剂,诸如duragesic(右丙氧芬芬太尼)、透明质酸,诸如suparts、海尔根、orthovisc和欣维可(Hylan G-F20)、和皮质甾类,诸如泼尼松龙和甲基泼尼松龙(methyl predinisolone)。OA的现有治疗倾向于排除经由组织改造而手术诸如软骨细胞移植的需要;然而,这些治疗仅适用于晚期OA的治疗。考虑的治疗OA的其它方法包括增生疗法(prolotherapy),其中将刺激物诸如葡萄糖注射到患病关节中,从而造成急性炎症反应,但也强化和有希望地愈合组织、韧带、肌腱和软骨。因此,对于治疗OA存在高度未满足的医疗需求。
已知一些细胞因子牵涉在骨关节炎中(Blom等,Current Drug Targets(2008)8:283)。认为几种细胞因子诸如‘破坏性’细胞因子IL-1和合成代谢的生长因子转化生长因子β(TGFβ)是可能的药物靶。
粒细胞巨噬细胞集落刺激因子(GM-CSF)是一种功能为白细胞生长因子的细胞因子。GM-CSF刺激干细胞产生粒细胞(嗜中性粒细胞、嗜曙红粒细胞和嗜碱性粒细胞)和单核细胞。单核细胞离开循环,迁移进入组织,从而成熟为巨噬细胞。因此,其是天然免疫/炎性级联的一部分,小数目巨噬细胞活化可以藉以快速导致其数目增加,这是对于斗争感染决定性的过程。GM-CSF的活性形式在胞外以同二聚体存在。尤其是,GM-CSF已经鉴定为自身免疫疾病如类风湿性关节炎(RA)中的炎性介质,导致促炎性细胞因子、趋化因子和蛋白酶的产生增加,并因此最终导致关节破坏。
WO 06/0234412公开了骨关节炎的多种生物标志,其通过蛋白微阵列鉴定。鉴定的生物标志之一是GM-CSF,报告其在OA组织中四倍上调。然而,没有提供GM-CSF也可以是治疗介入的点的指示或暗示,仅仅是在OA组织中四倍上调,如以WO 06/0234412中公开的技术鉴定的,WO 06/0234412也未暗示上述。在相关静脉中,Devalaraja等(US20020141994A1)在适于以集落刺激因子的拮抗剂治疗的可能适合的适应症的长列表中粗略提到OA。适应症的列表包括动脉硬化、败血症、哮喘、自身免疫病、骨质疏松症和类风湿性关节炎。除了其它集落刺激因子诸如M-CSF和G-CSF以外,GM-CSF是Devalaraja等提及的集落刺激因子之一。事实上,Devalaraja等没有包括为什么拮抗GM-CSF将适于治疗患有OA的受治疗者的数据或其它洞察。
发明概述
本发明首次证明,GM-CSF是用于治疗OA的有效靶。这一发现是新的,现有技术没有教导、暗示或提供治疗OA的这样一个介入点的任何理由。因此,本发明提供例如用于治疗受治疗者骨关节炎的方法,所述方法包括向所述受治疗者施用有效量的GM-CSF拮抗剂的步骤。
在另一方面,本发明涵盖用于预防受治疗者骨关节炎的方法,所述方法包括向所述受治疗者施用有效量的GM-CSF拮抗剂的步骤。
在另一方面,本发明涉及包含能够拮抗GM-CSF活化、增殖、诱导患有骨关节炎或怀疑患有骨关节炎的受治疗者中的细胞生长和/或存活的能力的GM-CSF拮抗剂的组合物,所述组合物还包含一种或多种药学上可接受的载体和/或稀释剂。
在另一方面,本发明涉及包含用于治疗骨关节炎的GM-CSF拮抗剂的组合物,所述组合物还包含一种或多种药学上可接受的载体和/或稀释剂。
在本发明的具体方面,GM-CSF拮抗剂是对GM-CSF特异性的抗体。
在本发明的替代方面,GM-CSF拮抗剂是对GM-CSF受体特异性的抗体。
在其它方面,本发明涉及GM-CSF拮抗剂在制备用于治疗骨关节炎的药物中的用途。
在其它方面,本发明提供用于治疗骨关节炎的GM-CSF拮抗剂。
在整个说明书中,除非上下文另外要求,否则词语“包含(comprise)”、“具有(have)”和“包括(include)”和其相应的变化形式诸如“包含(comprises)”、“包含(comprising)”、“具有(has)”、“具有(having)”、“包括(includes)”和“包括(including)”将理解为表示含有所指的元素或整数、或元素或整数的组,但不排除任何其它元素或整数、或元素或整数的组。
附图简述
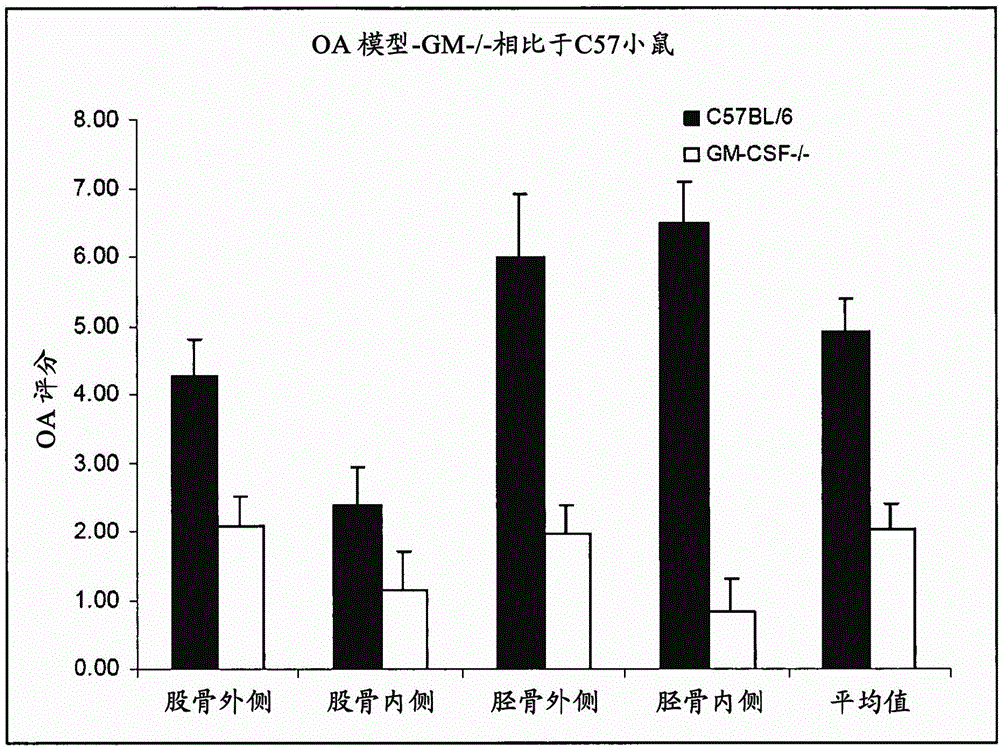
图1显示通过组织学评分评价的不同区域的关节损伤的定量数据。实验设置和评分系统描述在实施例2。“Lat.”代表外侧,“Med.”代表内侧。统计分析以Mann-Whitney进行。数据对于股骨外侧(p=0.02)、胫骨外侧(p=0.003)、胫骨内侧(p=0.001)、和所有区域(平均值;p=0.002)是统计学显著的。
图2显示健康对照膝盖的示例组织学切片。放大倍数是100×。没有观察到软骨损伤、骨赘形成、滑膜炎或变形。S=滑膜内层,C=软骨层。
图3显示胶原酶诱导OA模型中C57BL/6小鼠左膝
的示例组织学切片。各切片的放大倍数在图中标出。上面一行图片显示软骨损伤、骨赘形成和滑膜炎是明显的。O=骨赘。S=滑膜内层。下面一行图片显示还存在关节变形。
图4显示胶原酶诱导OA模型中GM-CSF-/-小鼠左膝的示例组织学切片。各切片的放大倍数在图中标出。如所见的,异常和/或损伤与C57BL/6小鼠(参见图3)相比严重度低得多,与健康对照小鼠(参见图2)相当。O=骨赘。S=滑膜内层。
图5显示在OA小鼠模型中用GM-CSF抗体治疗性治疗的膝关节组织学评分。Lat.=外侧。Med.=内侧。结果表示为平均值±SEM。如可见的,用抗-GM-CSF抗体治疗的小鼠显示较少的疾病。
图6显示以双足平衡测痛仪(incapacitance meter)评价后肢重量分配的实验结果。如图所示,从OA诱导后第27天开始,数据是显著的(未配对t-检验)。
发明详述
本发明证明,GM-CSF是用于治疗OA的有效靶。在这方面,本发明一方面提供利用GM-CSF拮抗剂带来在OA方面的预防或治疗益处的方法。
本发明提供治疗方法,包括向需要这样的治疗的受治疗者施用治疗有效量的GM-CSF拮抗剂。本文所用的“治疗有效量”或“有效量”是指引发期望的生物响应所必要的GM-CSF拮抗剂的量。根据本发明,治疗有效量是治疗和/或预防骨关节炎所必要的GM-CSF拮抗剂的量。
本文所用的“GM-CSF拮抗剂”包括最广泛含义的GM-CSF拮抗剂;包括抑制GM-CSF活性或功能、或通过任何其它方式对GM-CSF施加治疗作用的任何分子。术语GM-CSF拮抗剂包括但不限于,特异性结合GM-CSF的抗体、对GM-CSF特异性的抑制性核酸、或对GM-CSF特异性的小有机分子。还包含在术语GM-CSF拮抗剂含义中的有特异性结合GM-CSF受体的抗体、对GM-CSF受体特异性的抑制性核酸、或对GM-CSF受体特异性的小有机分子。
抑制性核酸包括但不限于,反义DNA、三链体形成寡核苷酸、外部指导序列、siRNA和microRNA。有用的抑制性核酸包括与对照相比,减少编码GM-CSF的RNA表达至少20、30、40、50、60、70、80、90或95%的抑制性核酸。抑制性核酸和引入它们的方法是本领域公知的。siRNA设计软件是可获得的。
对GM-CSF或GM-CSF受体特异性的小有机分子(SMOL)可经由天然产物筛选或筛选化学品库来鉴定。通常SMOL的分子量低于500道尔顿,更通常从160到480道尔顿。SMOL的其它典型特征是以下一种或多种:
-分配系数log P在从-0.4到+5.6的范围
-摩尔折射率从40到130
-原子数目从20到70
综述参见Ghose等,J Combin Chem:1:55-68,1999和Lipinski等,Adv Drug Del Rev 23:3-25,1997。
优选地,用于本发明的GM-CSF拮抗剂是对GM-CSF特异性或对GM-CSF受体特异性的抗体。这样的抗体可以是任何类型,诸如鼠、大鼠、嵌合、人源化或人类抗体。因此,“人类”抗体或功能性人类抗体片段定义为不是嵌合(如,不是“人源化”)且不是来自(整个或部分地)非人类物种的。人类抗体或功能性抗体片段可衍生自人类或可以是合成的人类抗体。“合成的人类抗体”在本文定义为具有整个或部分地,计算机模拟地衍生自基于对已知人类抗体序列分析的合成序列的序列的抗体。人类抗体序列或其片段的计算机模拟设计可例如,通过分析人类抗体或抗体片段序列数据库并利用从其获得的数据设计多肽序列来实现。人类抗体或功能性抗体片段的另一实例是由从人类来源抗体序列文库(即,这种文库是基于从人类天然来源获取的抗体)分离的核酸编码的抗体或功能性抗体片段。
“人源化抗体”或功能性人源化抗体片段在本文定义为:(i)衍生自非人类来源(如,带有异源免疫系统的转基因小鼠),该抗体是基于人类种系序列;或(ii)嵌合的,其中可变结构域衍生自非人类来源,恒定结构域衍生自人类来源;或(iii)CDR-嫁接的,其中可变结构域的CDR来自非人类来源,而可变结构域的一个或多个构架为人类来源,恒定结构域(如果存在)为人类来源。
术语“嵌合抗体”或功能性嵌合抗体片段在本文定义为具有衍生自或对应于见于一种物种的序列的恒定抗体区和衍生自另一物种的可变抗体区的抗体分子。优选地,恒定抗体区衍生自或对应于见于人类如,见于人类种系或体细胞的序列,可变抗体区(如,VH、VL、CDR或FR区)衍生自见于非人类动物如,小鼠、大鼠、兔或仓鼠的序列。
本文所用的,如果抗体能够区分抗原与一种或多种参考抗原,则认为这样的抗体“特异性结合”、“特异性结合”、“对...特异性”或“特异性识别”这样的抗原(在本文是GM-CSF,或可选地GM-CSF受体),因为结合特异性不是绝对的,而是相对特征。参考抗原可以是用作参考点的一种或多种紧密相关的抗原,如,IL3、IL5、IL-4、IL13或M-CSF。以其最通用形式(且当未提及具体参考时),“特异性结合”是指抗体区分目标抗原与无关抗原的能力,如例如根据以下方法之一确定的。这种方法包括但不限于,蛋白质印迹、ELISA-检验、RIA-检验、ECL-检验、IRMA-检验和肽扫描。例如,可进行标准ELISA测定。评分可通过标准显色进行(如,第二抗体以辣根过氧化物,四甲基联苯胺以过氧化氢进行显色)。某些孔中的反应通过光密度,例如在450nm的光密度评分。典型的背景(=阴性反应)可以是0.1OD;典型的阳性反应可以是1OD。这表示阳性/阴性的差异可以大于10倍。通常,结合特异性的确定不是通过利用单个参考抗原,而是利用一组约三种到五种无关抗原进行,诸如奶粉、BSA、铁传递蛋白或类似无关抗原。另外,“特异性结合”可能涉及抗体区分其靶抗原不同部分的能力,如,区分GM-CSF或GM-CSF受体的不同结构域或区域、或区分GM-CSF或GM-CSF受体的一个或多个关键氨基酸残基或氨基酸残基段。
而且,因此,本文所用的“免疫球蛋白”(Ig)定义为属于类IgG、IgM、IgE、IgA或IgD(或其任何亚类)的蛋白,包括所有常规已知的抗体和其功能性片段。因此,抗体/免疫球蛋白的“功能性片段”定义为抗体/免疫球蛋白保留抗原结合区的片段(如,IgG可变区)。抗体的“抗原结合区”通常见于抗体的一个或多个高变区,即,CDR-1、-2、和/或-3区;然而,可变“构架”区也可在抗原结合中起重要作用,诸如通过提供CDR的骨架。优选地,“抗原结合区”至少包含可变轻(VL)链的氨基酸残基4至103和可变重(VH)链的5至109,更优选地包含VL的氨基酸残基3至107和VH的4至111,尤其优选地是完整VL链和VH链(VL的氨基酸位置1至109和VH的1至113;按照WO 97/08320编号)。用于本发明的优选免疫球蛋白类是IgG。本发明的“功能性片段”包括F(ab')2片段、Fab片段、scFv或包含单免疫球蛋白可变结构域或单结构域抗体多肽的构建体的结构域,如,单重链可变结构域或单轻链可变结构域。可改造F(ab')2或Fab以使在CH1结构域和CL结构域之间发生的分子间二硫化物相互作用最小或完全去除。
本发明的抗体可衍生自基于计算机模拟设计并由合成产生的核酸编码的氨基酸序列的重组抗体文库。抗体序列的计算机模拟设计例如,通过分析人类序列数据库并利用从其获得的数据设计多肽序列来实现。用于设计和获得计算机模拟产生的序列的方法描述于,例如,Knappik等,J.Mol.Biol.296:57,2000;Krebs等,J.Immunol.Methods.254:67,2001;Rothe等,J.Mol.Biol.376:1182,2008和授予Knappik等,2000同上的美国专利号6,300,064,其通过引用全文并入本文。
对GM-CSF特异性的任何抗体可用在本发明。示例抗体公开于US 11/914,599,其通过引用全文并入本文。其它示例抗体包括包含描述为SEQ ID NO:1的重链可变区的氨基酸序列或描述为SEQ ID NO:2的轻链可变区的氨基酸序列的抗体。又其它示例抗体包括衍生自包含描述为SEQ ID NO:1的重链可变区或描述为SEQ ID NO:2的轻链可变区的氨基酸序列的抗体的抗体。又其它示例抗体包括与包含描述为SEQ ID NO:1的重链可变区或描述为SEQ ID NO:2的轻链可变区的氨基酸序列的抗体具有相同特异性和/或结合相同表位的抗体。又其它示例抗体包括包含与描述为SEQ ID NO:1的序列至少70%、至少80%、至少90%或至少95%同源的重链可变区的抗体。又其它示例抗体包括包含与描述为SEQ ID NO:2的序列至少70%、至少80%、至少90%或至少95%同源的轻链可变区的抗体。
SEQ ID NO:1:
SEQ ID NO:2:
可用在本发明的替代示例抗体是包含描述为SEQ ID NO:3的重链可变区的氨基酸序列或描述为SEQ ID NO:4的轻链可变区的氨基酸序列的抗体。其它示例抗体包括衍生自包含描述为SEQ ID NO:3的重链可变区或描述为SEQ ID NO:4的轻链可变区的氨基酸序列的抗体的抗体。又其它示例抗体包括与包含描述为SEQ ID NO:3的重链可变区或描述为SEQ ID NO:4的轻链可变区的氨基酸序列的抗体具有相同特异性和/或结合相同表位的抗体。又其它示例抗体包括包含与描述为SEQ ID NO:3的序列至少70%、至少80%、至少90%或至少95%同源的重链可变区的抗体。又其它示例抗体包括包含与描述为SEQ ID NO:4的序列至少70%、至少80%、至少90%或至少95%同源的轻链可变区的抗体。
SEQ ID NO.3:重MOR
QVQLVESGGGLVQPGGSLRLSCAASGFTFSSYWMNWVRQAPGKGLEWVSGIENKYAGGATYYAASVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARGFGTDFWGQGTLVTVSS
SEQ ID NO.4:轻MOR
DIELTQPPSVSVAPGQTARISCSGDSIGKKYAYWYQQKPGQAPVLVIYKKRPSGIPERFSGSNSCNTATLTISGTQAEDEADYYCSAWGDKGMVFGGGTKLTVLGQ
可用在本发明的替代示例抗体是包含选自以下的H-CDR3序列的抗体:
优选地,包含选自SEQ ID NO.5-16任一种的H-CDR3序列的抗体另外包含以下H-CDR1序列:
Asp Tyr Leu Leu His
1 5
(SEQ ID NO:17),
和/或以下H-CDR2序列:
Trp Leu Asn Pro Tyr Ser Gly ASp Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
(SEQ ID NO:18),
和/或以下L-CDR1序列:
Arg Ala Ser Gln Asn Ile Arg Asn Ile Leu Asn
1 5 10
(SEQ ID NO:19),
和/或以下L-CDR2序列:
Ala Ala Ser Asn Leu Gln Ser
1 5
(SEQ ID NO:20),
和/或以下L-CDR3序列:
Gln Gln Ser Tyr Ser Met Pro Arg Thr
1 5
(SEQ ID NO:21)
可用于本发明的替代示例抗体是包含以下的抗体:以下L-CDR1序列:
Arg Ala Ser His Arg Val Ser Ser Asn Tyr Leu Ala
1 5 10
(SEQ ID NO:22),
和/或以下L-CDR2序列:
Gly Ala Ser Asn Arg Ala Thr
1 5 (SEQ ID NO:23),
和/或以下L-CDR3序列:
Gln Gln Tyr Ala Ser Ser Pro Val Thr
1 5 (SEQ ID NO:24),
和/或以下H-CDR1序列:
Gly Tyr Ile Phe Pro Thr Phe Ala Leu His
1 5 10
(SEQ ID NO:25),
和/或以下H-CDR2序列:
Ser Ile Asn Thr Ala Ser Gly Lys Thr Lys Phe Ser Thr Lys phe Gln
1 5 10 15
(SEQ ID NO:26),
和/或以下H-CDR3序列:
Asp Arg Phe Gln Asn Ile Met Ala Thr Ile Leu ASp Val
1 5 10
(SEQ ID NO:27)
优选地所述抗体包含SEQ ID NO.22-27的所有CRD。
GM-CSF受体是促红细胞生成素受体超家族的成员。它是异二聚的,由α亚基和β亚基构成。α亚基是对GM-CSF高度特异性的,而β亚基是与其它细胞因子受体包括IL3和IL5共有的。这反映在β受体亚基的组织分布较广泛。α亚基,GM-CSFRα主要在骨髓细胞和非造血细胞上表达,诸如嗜中性粒细胞、巨噬细胞、嗜曙红粒细胞、树突细胞、内皮细胞和呼吸道上皮细胞。全长GM-CSFRα是400个氨基酸的I型膜糖蛋白,属于I型细胞因子受体家族,由22个氨基酸的信号肽(位置1-22)、298个氨基酸的胞外结构域(位置23-320)、位置321-345的跨膜结构域和短的55个氨基酸的胞内结构域组成。信号肽被裂解以提供GM-CSFRα的成熟形式,为378个氨基酸的蛋白。人类和鼠GM-CSFRα的cDNA克隆是可获得的,并且在蛋白水平,受体亚基具有36%的同一性。GM-CSF能够以相对低的亲和力与仅α亚基结合(Kd 1-5nM),但根本不结合仅β亚基。然而,α亚基和β亚基二者的存在导致高亲和力配体-受体复合体(Kd>>100pM)。GM-CSF信号传导如下发生:通过初始与GM-CSFRα链结合,然后与较大亚基即共有的β链交联产生高亲和力相互作用,这将JAK-STAT途径磷酸化。
对GM-CSF受体特异性的任何抗体可用在本发明。示例抗体包括包含描述为SEQ ID No:28-46任一种的H-CDR3序列的氨基酸序列的抗体。其它示例抗体包括衍生自包含描述为SEQ ID No:28-46任一种的H-CDR3序列的氨基酸序列的抗体的抗体。又其它示例抗体包括与包含描述为SEQ ID No:28-46任一种的H-CDR3序列的氨基酸序列的抗体具有相同特异性和/或结合相同表位的抗体。又其它示例抗体包括包含与描述为SEQ ID No:28-46任一种的H-CDR3序列至少70%、至少80%、至少90%或至少95%同源的H-CDR3序列的抗体。
在某些方面,本发明提供用于治疗受治疗者骨关节炎的方法,所述方法包括向所述受治疗者施用GM-CSF拮抗剂的步骤。在这一上下文中使用的“受治疗者”是指任何哺乳动物,包括啮齿动物诸如小鼠或大鼠、和灵长类诸如食蟹猴(Macaca fascicularis)、猕猴(Macaca mulatta)或人类(Homo sapiens)。优选地受治疗者是灵长类,最优选地是人类。
在某一方面,本发明提供包含能够拮抗GM-CSF活化、增殖、诱导患有骨关节炎或怀疑患有骨关节炎的受治疗者中的细胞生长和/或存活的能力的GM-CSF拮抗剂的组合物,所述组合物还包含一种或多种药学上可接受的载体和/或稀释剂。本发明的抗-GM-CSF抗体可拮抗GM-CSF在骨关节炎中的任何作用。
在另一方面,本发明提供用于预防受治疗者骨关节炎的方法,所述方法包括向所述受治疗者施用GM-CSF拮抗剂。在这一上下文中使用的“预防”是指目的是阻止疾病发作或延迟疾病发作的方法。
在某些方面,本发明提供包含可用于治疗骨关节炎的GM-CSF拮抗剂的组合物,所述组合物还包含一种或多种药学上可接受的载体和/或稀释剂。
在其它方面,本发明提供GM-CSF拮抗剂在制备用于治疗骨关节炎的药物中的用途。
在其它方面,本发明提供用于治疗骨关节炎的GM-CSF拮抗剂。
本发明的组合物优选地是包含用于治疗骨关节炎的GM-CSF拮抗剂和药学上可接受的载体、稀释剂或赋形剂的药物组合物。这样的载体、稀释剂和赋形剂是本领域公知的,本领域技术人员将发现最适于用本发明的GM-CSF拮抗剂治疗受治疗者的制剂和施用途径。
在另一方面,本发明提供具有GM-CSF-/-基因型的遗传改造的哺乳动物。在具体方面,所述哺乳动物是小鼠。术语“敲除的”小鼠(或哺乳动物)、某一基因“被破坏的”小鼠(或哺乳动物)、和具有“-/-基因型”的小鼠(或哺乳动物)在本发明中可互换使用并且是本领域公认的。各自的动物在染色体的两个等位基因上具有各自的基因缺陷,所述基因在本文是GM-CSF。
实施例1:
GM-CSF-/-小鼠的产生
GM-CSF-/-小鼠的产生描述在Stanley等(1994).Proc.Natl.Acad.Sci.USA 91:5592。简单地说,嵌合小鼠通过向C57BL/6(H-2b)宿主胚泡微注射带有被破坏的GM-CSF基因的129/OLA-衍生ES细胞(H-2b)而产生。将突变GM-CSF等位基因的种系传递者(transmitter)与C57BL/6小鼠杂交11代,将获得的GM-CSF+/-小鼠种间杂交获得用于实验的GM-CSF-/-、GM-CSF+/-和GM-CSF+/+小鼠。GM-CSF基因型状态通过PCR分析尾DNA来确定。对动物随意喂养标准啮齿动物食物和水,与同样性别的同窝出生者圈养在内垫锯屑的笼中。将8至15周龄的两种性别的小鼠交付实验。
实施例2:
验证GM-CSF作为骨关节炎的靶
在骨关节炎实验模型中,比较GM-CSF-/-小鼠与C57BL/6小鼠(参见如,Mills等,J Immunol 164:6166-6173,2000)。
方法:小鼠(每组n=10)在第-2天和第0天接受左膝关节内注射胶原酶(Blom等,Arthritis Rheum 56:147-157,2007)。在第42天杀死小鼠,收集膝关节,固定,脱钙,包埋在石蜡中,用切片机切成7μm。然后对载玻片用番红O/固绿、苏木精和曙红染色以证明关节病理学。研究的病理学包括:软骨损伤、滑膜炎、骨赘形成和关节变形。
用于软骨病理学的评分系统如下:
等级
0 正常
1 不规则、但完整
1.5 不规则、带有粗糙表面
2 浅表纤毛化(Superficial fibrillation)
2.5 浅表纤毛化、软骨层中细胞减少
3 垂直裂
3.5 分支(Branching)和/或水平裂、潮标破裂(tidemark ruptures)
4 软骨损失,未延伸到潮标
4.5 软骨损失,延伸到潮标
5 软骨损失超出潮标,但未延伸到骨
5.5 软骨损失延伸到骨
6 骨损失/重建/变形
阶段
1 <10%面积受损
2 10-25%面积受损
3 25-50%面积受损
4 50-75%面积受损
等级乘以阶段得到评分。
这一评分系统是基于在临床和实验OA中评价OA组织病理学的公认方法。参见Pritzker等,Osteoarthritis Cartilage 14:13-29,2006。等级定义为OA发展到软骨中的深度。阶段定义为牵涉软骨的水平范围,即,有多少软骨受影响。等级乘以阶段得到评分以提供总的评分,从而代表对OA严重程度和范围的综合评价。对每只小鼠的最多六个切片评分。
结果:检查这些关节显示,GM-CSF-/-小鼠比对照小鼠显示较少的膝关节病理学,指示GM-CSF在正常骨关节炎病理学和进展中的作用。在C57BL/6小鼠观察到的病理学包括软骨层严重损伤、骨赘形成、关节变形和滑膜炎。GM-CSF-/-小鼠显示没有骨赘形成或关节变形,较少的软骨损伤和滑膜炎。
关于不同区域关节损伤的定量数据显示在图1。代表性组织学显示在图2(健康对照膝盖)、图3(C57BL/6左膝)和图4(GM-CSF-/-左膝)。与C57BL/6小鼠相比,GM-CSF基因缺陷型小鼠发展较少的胶原酶诱导OA病理学。
总之,在骨关节炎实验模型中,与C57BL/6小鼠相比,GM-CSF-/-小鼠显示明显减少的膝关节病理学,验证了GM-CSF为骨关节炎治疗介入的药物靶。
实施例3:
GM-CSF拮抗剂在OA治疗中的治疗效力
这一实验中,我们使用对GM-CSF特异性的单克隆抗体证实GM-CSF拮抗剂可有效治疗骨关节炎。
胶原诱导的OA小鼠模型:
在第0天和第2天对C57BL/6小鼠右膝关节内给予1个单位的VII型胶原酶以诱导关节不稳定(参见Blom等,(2004)Osteoarthritis Cartilage.12;627-35)。
抗-GM-CSF抗体治疗:
将20只小鼠随机分为2组(10只小鼠/组)。
组1(n=10):抗-GM-CSF抗体(22E9)
组2(n=10):IgG2a同种型对照抗体。
以250μg/小鼠/治疗的抗-GM-CSF抗体(22E9)或IgG2a同种型对照抗体腹膜内治疗小鼠,每周三次,持续6周。治疗在诱导OA之前4天开始(预防性),即,在第-4天、第-2天、第0天(第一次胶原酶注射当天)治疗小鼠,然后每周3次,直到6周时实验结束)。在第2周、第4周和第6周,对小鼠放血。检查血清的抗体含量和对22E9的免疫原性。纯化对照抗体和抗-GM-CSF抗体二者以包含少于10个内毒素单位/ml。
抗体22E9用作示例抗-GM-CSF抗体。22E9是IgG2a同种型,是大鼠抗-小鼠GM-CSF-特异性抗体。22E9购自AbD Serotec(Martinsried,Germany;目录号1023501)。存在替代的供应商,如,eBioscience(SanDiego.CA,USA,目录号14-7331)。
组织学:
最后一次注射后6周,对小鼠膝关节进行组织学研究。收集膝关节,固定,脱钙,包埋在石蜡中,用切片机切成7μm。然后对载玻片用番红O/固绿、苏木精和曙红染色以证明关节病理学。研究的病理学包括:软骨损伤、滑膜炎、骨赘形成和关节变形。
与实施例2相同的评分系统用于软骨病理学。等级乘以阶段得到评分。
以下评分系统用于滑膜炎(滑膜层评分系统):
0 与正常关节比较无变化
1 滑膜内层增厚,炎症细胞有些流入
2 滑膜内层增厚,炎症细胞中级流入
3 滑膜内层明显增厚,观察到炎症细胞最大程度流入
疼痛测量:
用于OA模型的疼痛指示是利用双足平衡测痛仪测量的重量的差异分配。这种仪器测量操作的后肢与对侧未操作后肢之间重量分配的变化。在实验之前允许小鼠适应设备三次。经5秒的阶段测量每个后肢上承受的重量。取每只小鼠每个时间点的三次独立测量值,然后取平均值。实验期间每周进行2次测量。结果表示为胶原酶注射肢/对照肢×100。
结果:
对于组织学中分析的所有区域(除了股骨内侧以外),即股骨外侧、胫骨外侧和胫骨内侧,在用抗-GM-CSF抗体治疗的小鼠中有朝向疾病减少的明显趋势。结果描绘在图5。
对重量分配的评价作为与关节炎相关疼痛的量度,显示与对照mAb-治疗组相比,抗-GM-CSF mAb-治疗组从第27天开始重量从患关节炎的膝盖明显转移。结果描绘在图6。
与用对照抗体治疗的小鼠相比,用GM-CSF拮抗剂治疗的小鼠显示较少的疾病。与用对照抗体治疗的小鼠相比,用GM-CSF拮抗剂治疗的小鼠还显示在疾病后面阶段显著较少的疼痛。与接受GM-CSF-特异性抗体的小鼠相比,用同种型对照抗体治疗的小鼠显示显著增加的骨关节炎体征。这证明GM-CSF拮抗剂有效地治疗OA。
实施例4:
包含SEQ ID NO.1或2的GM-CSF特异性抗体的治疗效力
重复实施例3,藉以使用包含描述为SEQ ID NO:1的重链可变区的氨基酸序列或描述为SEQ ID NO:2的轻链可变区的氨基酸序列的GM-CSF特异性抗体作为GM-CSF拮抗剂。可使用小鼠以外的另一物种,尤其是本实验中使用的抗体对其交叉反应的物种。优选地本实验中使用的动物物种是大鼠。
与接受包含描述为SEQ ID NO:1的重链可变区的氨基酸序列或描述为SEQ ID NO:2的轻链可变区的氨基酸序列的GM-CSF特异性抗体的动物相比,用同种型对照抗体治疗的动物显示显著增加的骨关节炎体征。这证明该抗体在OA治疗中的效力。
实施例5:
包含SEQ ID NO.3或4的GM-CSF特异性抗体的治疗效力
重复实施例3。使用包含描述为SEQ ID NO:3的重链可变区的氨基酸序列或描述为SEQ ID NO:4的轻链可变区的氨基酸序列的GM-CSF特异性抗体作为GM-CSF拮抗剂。可使用小鼠以外的另一物种,尤其是本实验中使用的抗体对其交叉反应的物种。优选地本实验中使用的动物物种是大鼠。
与接受包含描述为SEQ ID NO:3的重链可变区的氨基酸序列或描述为SEQ ID NO:4的轻链可变区的氨基酸序列的GM-CSF特异性抗体的动物相比,用同种型对照抗体治疗的动物如大鼠显示显著增加的骨关节炎体征。这证明该抗体在OA治疗中的效力。
实施例6:
包含SEQ ID NO.5-20的GM-CSF特异性抗体的治疗效力
重复实施例3。使用包含选自SEQ ID NO.5-16任一种的H-CDR3序列的GM-CSF特异性抗体作为GM-CSF拮抗剂。优选地,所述抗体还包含SEQ ID NO:16的H-CDR1序列、和/或SEQ ID NO:17的H-CDR2序列、和/或SEQ ID NO:18的L-CDR1序列、和/或SEQ ID NO:19的L-CDR2序列)、和/或SEQ ID NO:20的L-CDR3序列。可使用小鼠以外的另一物种,尤其是本实验中使用的抗体对其交叉反应的物种。优选地本实验中使用的动物物种是大鼠。
与接受本实施例的GM-CSF特异性抗体的动物相比,用同种型对照抗体治疗的动物如大鼠显示显著增加的骨关节炎体征。这证明该抗体在OA治疗中的效力。
实施例7:
包含SEQ ID NO.21-26的GM-CSF特异性抗体的治疗效力
重复实施例3。使用包含SEQ ID NO:22的L-CDR1序列、和/或SEQ ID NO:23的L-CDR2序列、和/或SEQ ID NO:24的L-CDR3序列、和/或SEQ ID NO:25的H-CDR1序列、和/或SEQ ID NO:26的H-CDR2序列、和/或SEQ ID NO:27的H-CDR3序列的GM-CSF特异性抗体作为GM-CSF拮抗剂。优选地所述抗体包含SEQ ID NO.22-27的所有CRD。可使用小鼠以外的另一物种,尤其是本实验中使用的抗体对其交叉反应的物种。优选地本实验中使用的动物物种是大鼠。
与接受本实施例的GM-CSF特异性抗体的动物相比,用同种型对照抗体治疗的动物如大鼠显示显著增加的骨关节炎体征。这证明该抗体在OA治疗中的效力。
实施例8:
对GM-CSF受体特异性的抗体的治疗效力
重复实施例3,区别是使用对GM-CSF受体特异性的单克隆抗体代替对GM-CSF特异性的单克隆抗体。
使用包含描述为SEQ ID No:27-45任一种的H-CDR3序列的氨基酸序列的GM-CSF受体特异性抗体作为GM-CSF拮抗剂。可使用小鼠以外的另一物种,尤其是本实验中使用的抗体对其交叉反应的物种。优选地本实验中使用的动物物种是大鼠。
与接受本实施例的GM-CSF受体特异性抗体的动物相比,用同种型对照抗体治疗的动物如大鼠显示显著增加的骨关节炎体征。这证明该抗体在OA治疗中的效力。
实施例9:
临床试验
临床试验在患有膝盖骨关节炎的成年患者中进行。随机化、双盲、安慰剂-对照临床试验的目的是确定本发明的GM-CSF拮抗剂与安慰剂对诊断为膝盖骨关节炎(OA)的30名患者总样本中总的疼痛缓解和生活质量的比较差异。另一目的是确定本发明的GM-CSF拮抗剂的安全性和耐受性,这由不良事件、体检和生命体征确定。
方法:
年龄为40岁和以上、临床诊断为膝盖骨关节炎、并证实在试验前的这个月膝盖疼痛至少15天的30名患者(约15名成年男性和15名成年女性)参与本研究。患者接受治疗有效量的GM-CSF拮抗剂或安慰剂(如,每两周一次,持续约六个月)。
研究中使用Western Ontario and McMaster Universities骨关节炎指数(WOMAC;Bellamy等,J Rheumatol 15(12):1833-40,1988)和SF-36v2生活质量工具量表(Quality of Life instrument scales)(Quality Metric Health Outcomes Solutions,Lincoln,RI)。WOMAC是一种疾病特异性、自我实施的健康状态量度。它在患有臀部和/或膝盖骨关节炎的患者探测疼痛区域临床上重要的症状、僵硬和身体功能。此指数由24个问题组成(5-疼痛、2-僵硬和17-身体功能),可在5分钟内完成。WOMAC是用于在多种介入(药理学、营养、手术、物理治疗等等)后检测临床上重要的健康状态变化的有效、可靠和灵敏的工具。WOMAC问卷有效地评价对臀部或膝盖骨关节炎的介入的作用。SF-36v2生活质量工具是多目的、简式健康调查,有36个问题。它产生8-等级的功能性健康概况和健康评分以及基于心理测定的生理健康和心理健康概要量度、和基于偏好的健康效用指数。它是一种通用的量度,不同于针对具体年龄、疾病或治疗组的量度。因此,SF-36v2已经证明对于调查一般人群和特定人群、比较疾病的相对负荷、和区分宽范围的不同治疗产生的健康益处有用。SF-36v2产生关于以下的健康方面和子集的信息:生理健康(包括身体功能、角色生理(role-physical)、身体疼痛和总体健康)和心理健康(包括活力、社会机能、角色心理状况(role-emotional)和心理健康)。
结果:
身体疼痛的变化:与安慰剂相比,用本发明的GM-CSF拮抗剂治疗的患者在SF-36v2身体疼痛上的改进是统计学显著的。评分越高越好,因为这表示患者服用产品后感觉到较少疼痛。接受本发明的GM-CSF拮抗剂的组与安慰剂组相比,身体疼痛评分有统计学显著的改进。
角色生理评分的变化:在由于身体健康引起的角色限制(角色生理)方面,本发明的GM-CSF拮抗剂与安慰剂相比的优越效果在第8周、第12周和第20周是统计学显著的。评分越高越好,因为这表示患者注意到身体的进步和日常生活活动中遇到的限制减少。接受本发明的GM-CSF拮抗剂的组与安慰剂组相比,角色生理评分有统计学显著的改进。
总WOMAC评分的变化:用本发明的GM-CSF拮抗剂治疗的组的总WOMAC评分统计学显著地好于安慰剂组的总WOMAC评分(评分越低越好)。
WOMAC ADL的变化:用本发明的GM-CSF拮抗剂治疗的组比安慰剂组日常生活活动(测量为WOMAC ADL亚-评分)的改进大。用本发明的GM-CSF拮抗剂治疗的组与安慰剂组相比,WOMAC ADL评分有统计学显著的改进(评分越低越好)。
总结:
临床试验显示本发明的GM-CSF拮抗剂改进患有膝盖骨关节炎的患者生活质量的效力。考虑到没有发现严重的副作用,临床试验的结果还显示产品的安全性和耐受性。
本发明的GM-CSF拮抗剂的效力还可通过在本发明的GM-CSF拮抗剂对其交叉反应的其它物种中研究来确立(如,对马进行以评价关节活动);通过对软骨细胞培养物进行测定,利用体外研究以确定本发明的GM-CSF拮抗剂抑制IL-1-诱导的聚集蛋白多糖降解的能力。
本领域技术人员将认识到,除了具体描述的以外,易于对本文描述的本发明变化和修改。将理解的是,本发明包括所有这样的变化和修改。本发明还单独地或集合地包括在本说明书中提到或指出的所有步骤、特征、组合物和化合物,和任何两种或多种所述步骤或特征的任意组合和所有组合。
参考文献
Bellamy等,J Rheumatol 15(12):1833-40,1988
Blom等,Arthritis Rheum 56:147-157,2007
Ghose等,J Combin Chem:7:55-68,1999
Knappik等,J.Mol.Biol.296:57,2000
Krebs等,J.Immunol.Methods.254:67,2001
Lipinski等,Adv Drug Del Rev 23:3-25,1997
Mills等,J Immunol 764:6166-6173,2000
Pritzker等,Osteoarthritis Cartilage 74:13-29,2006
Rothe等,J.Mol.Biol.376:1182,2008
- 还没有人留言评论。精彩留言会获得点赞!