利用根癌土壤杆菌生物合成纳米硒的方法及其应用与流程
本发明涉及微生物学及生物纳米硒制备技术领域,具体地说,涉及一种利用无致病性的根癌土壤杆菌生物合成纳米硒的方法及其应用。
背景技术:
硒(Selenium,Se)元素是许多有机体必需的微量元素之一,是生物体内硫氧还原蛋白酶、脱碘酶、谷胱甘肽过氧化酶等多种含硒酶蛋白的必需组分,并且参与人体多种代谢途径。研究发现,人体缺硒会导致多种疾病,并且增加患癌风险。我国具有丰富硒资源,但硒在自然界分布极不均匀,导致我国三分之二以上地区缺硒。中国营养学会及FAO/WHO/IAEA联合专家委员会确定人体硒摄入量适宜范围为60-250μg/d,安全剂量为400μg/d,中毒剂量为800μg/d。硒过量也会造成人体危害。因此亟待为缺硒人群开发安全高效硒源。自然界中硒形态包括负二价、零价、四价及六价四种形态,研究表明,负二价、四价及六价形态的硒毒性巨大,作为补硒源具有潜在危险;块状零价单质硒不具有生物学活性,而纳米级别的单质硒具有显著生物学活性,并且能显著抑制肿瘤,因此开发纳米硒作为补硒源具有明显优势。
国内外研究人员对微生物参与的硒的各价态间的转化及有机硒的形成有较明确的认识。相对于化学或物理方法制备单质纳米硒过程中的高能耗高污染,通过微生物对无机硒转化,可得到更为简便、经济、绿色环保获取单质纳米硒的方法。近十年来,发现许多细菌可以耐受高浓度的硒盐,并转化硒盐为低毒的红色单质纳米硒。涵盖的种属极其丰富,已有报道约30个属,包括大肠杆菌(Escherichia coli)、荚膜红细菌(Rhodobacter capsulatus)、枯草芽孢杆菌(Bacillus subtilis)、荧光假单胞菌(Pseudomonas fluorescens)等,总体上它们属于变形菌门和厚壁菌门。
技术实现要素:
本发明的目的是提供一种利用根癌土壤杆菌生物合成纳米硒的方法及其应用。
为了实现本发明目的,本发明从土壤中分离得到一株可耐受较高浓度亚硒酸盐、硒酸盐的根癌土壤杆菌(Agrobacterium tumefaciens)S2-323,菌株S2-323现已保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,保藏编号CGMCC No.12580,保藏日期2016年6月1日。
根癌土壤杆菌S2-323为土壤杆菌属,根癌土壤杆菌属于变形菌门、根瘤菌科,革兰氏阴性杆菌,主要分布于根际土壤中,为植物内生菌,多数菌株能在低氧张力的植物组织中生长。
本发明还提供含有所述根癌土壤杆菌S2-323的复合微生物菌剂。
本发明还提供利用所述根癌土壤杆菌S2-323生物合成纳米硒的方法,所述方法是向发酵培养基中添加亚硒酸盐和/或硒酸盐,发酵培养根癌土壤杆菌S2-323,并从发酵产物中分离纯化纳米硒。所述发酵产物包括发酵液经离心所得菌体沉淀,菌悬液以及菌体裂解液。
本发明所述亚硒酸盐、硒酸盐包括亚硒酸/硒酸的钠盐、钾盐等无机盐。优选亚硒酸钠、硒酸钠。
所述发酵培养基中亚硒酸盐的浓度为0.001-100mM,优选1-5mM,更优选5mM。所述发酵培养基中硒酸盐的浓度为0.001-500mM,优选0.001-400mM,更优选0.001-300mM。
本发明提供的利用根癌土壤杆菌S2-323生物合成纳米硒的方法,包括以下步骤:
S1、菌种活化
用NA培养基对菌株进行活化培养,NA培养基配方为:牛肉膏30g/L,蛋白胨5g/L,MnSO4·H2O 5mg/L,琼脂15g/L,pH 7.0-7.2;将菌株S2-323接种于NA培养基斜面上,28℃培养36小时;
S2、种子液的制备
种子培养用GYT液体培养基,GYT液体培养基配方为:蔗糖10-12g/L,酵母膏8-10g/L,KH2PO4 2.0-4.0g/L,NaCl 0.2-0.4g/L,MgSO4·7H2O 0.3-0.5g/L,pH 7.0-7.2;将活化好的菌株S2-323用无菌生理盐水配制成108CFU/mL的菌悬液,以1%的接种量接种于GYT液体培养基中,28℃摇床震荡培养,转速为150rpm,培养时间为24-36h;
S3、发酵罐发酵
发酵培养采用CM发酵培养基,CM发酵培养基配方为:蛋白胨5-8g/L,葡萄糖10-15g/L,玉米粉5-15g/L,亚硒酸盐5mM,pH 7.2;控制培养基体积为发酵罐体积的50-70%,将种子液按照1-3%的接种量接入发酵罐,控制发酵温度为25-30℃,搅拌速度为200-300rpm,通气量为1:0.8-1.2(发酵液体积:每分钟通气量体积),罐压1.2-1.6F/cm2,发酵48-96小时;
S4、从发酵产物中分离纯化纳米硒。
从发酵产物中分离纯化生物纳米硒的方法如下:
方案I:
发酵液下罐,5000-9000rpm离心15-30min收集菌体沉淀,用无菌生理盐水5000-9000rpm离心15-30min清洗2-3遍,并用发酵液1/20体积的水(优选无菌纯净水)重悬沉淀,所得菌悬液经冷冻干燥,即得纳米硒干粉。
方案II:
a、发酵液下罐,将发酵液置于冰上进行超声破碎细胞,设置变幅杆为Φ8-12,占空比30-60%,功率600-700W,频率20KHz,启停间隔5-10s,破碎15-40min,得到菌体裂解液;
b、菌体裂解液于4000-8000rpm离心10-25min,所得沉淀用无菌生理盐水4000-8000rpm离心20-30min清洗2-3遍;将沉淀重悬于发酵液1/20体积的水(优选无菌纯净水)中,得到纳米硒悬液;
c、将纳米硒悬液转移至萃取塔中,按照发酵液0.3-0.6倍体积的量加入环己烷萃取3-5次,收集下层水相,4000-6000rpm离心10-25min,所得沉淀用无菌生理盐水5000-8000rpm离心10-20min清洗2-3遍;冷冻干燥,即得纳米硒干粉;
d、获得高纯度、分散性较好生物纳米硒悬液。
冷冻干燥与生物纳米硒制备:将方案I中制备的生物纳米硒,用液氮冷冻20-30min,放入冷冻干燥机中进行冷冻干燥,冷冻干燥参数为压强30-200Pa,加热板温度为28-37℃,样品厚度为15-30mm;干燥时间在60-80小时,得到生物纳米硒干粉A。
将方案II中制备的生物纳米硒,用液氮冷冻20-30min,放入冷冻干燥机中进行冷冻干燥,冷冻干燥参数为压强20-80Pa,加热板温度为5-15℃,样品厚度为5-10mm;干燥时间在24-48小时,得到纯生物纳米硒干粉B。
本发明还提供由所述根癌土壤杆菌S2-323发酵制备的生物纳米硒。其中,所述生物纳米硒的粒径为100-300nm,主要粒径为200-250nm。
本发明进一步提供由所述根癌土壤杆菌S2-323生物合成的纳米硒在制备食品、保健品、药品、畜禽饲料以及农用肥料中的应用。
本发明还提供由所述生物纳米硒制备的富硒功能食品、富硒保健品和硒药片以及富硒肥料、富硒饲料。其中,生物纳米硒所占含量分别为10-2500μg/kg、10-500mg/kg、50-800mg/kg、50-800μg/kg和1-5g/kg。在本发明的一个具体实施方式中,将生物纳米硒干粉A和B分别悬浮于纯净水中,配制成1-5g/L的富硒肥料A和富硒肥料B。将肥料A和B用于小麦、水稻、玉米等粮食作物种植,用于大豆、花生、谷子、红薯等杂粮的种植,并在金针菇、香菇、木耳等食用菌养殖中施用,用于番茄、茄子、黄瓜等蔬菜的种植,以及用于苹果、猕猴桃等水果和茶叶种植中,获得可再加工的富硒作物、富硒食用菌、富硒水果、富硒茶叶。
在本发明的另一个具体实施方式中,将生物纳米硒干粉A或B按照50-800μg/kg比例与饲料原料混合均匀,配制成富硒饲料A和富硒饲料B。将饲料A和B饲喂蛋鸡、肉鸡、猪、羊、牛等畜禽后,获得可再加工的富硒鸡蛋、富硒鸡肉、富硒猪肉、富硒羊肉、富硒牛肉。
在本发明的又一个具体实施方式中,将生物纳米硒干粉B按照10-2500μg/kg的比例与小米面粉、植物油和纯净水(三者的重量百分比为55%、10%和35%)混合均匀,投入膨化机中挤压膨化,烘干装袋,获得膨化小米富硒功能食品。或者,将小米面粉替换为玉米粉、荞麦粉或豆粉,可获得膨化玉米、荞麦或豆粉富硒功能食品。
在本发明的再一个具体实施方式中,将生物纳米硒干粉B(10-500mg/Kg)与淀粉(972.50-999.99g/Kg)、维生素E(0-22g/Kg)和β胡萝卜素(0-5g/Kg)混合均匀,加入润湿剂,在制粒机中制成微粒,将微粒烘干并填充到胶囊壳中,控制每粒胶囊重0.3-0.6g,按100粒每瓶装瓶,封口包装入库。
将生物纳米硒干粉B(50-800mg/Kg)与淀粉和植物蛋白粉(淀粉和植物蛋白粉的重量比为95:4.9)混合均匀,将粘合剂HPMC加入到上述混合物中,在混合机中搅拌均匀,将原料投入压片机中开车压片,烘干,每粒片重0.4-0.6g,按100粒每瓶装瓶,封口包装入库。
本发明对纳米硒合成菌根癌土壤杆菌S2-323生物合成纳米硒的发酵工艺条件进行优化,对亚硒酸盐、硒酸盐的耐受范围,对不同浓度亚硒酸盐的转化效率,不同时间点的转化效率变化,以及对其生长曲线、致病性、发酵工艺、纳米硒分离纯化技术等进行研究,探索出可进行工厂化生产生物纳米硒的一套技术。为获得可进行再加工的富硒产品,本发明还进行了纯化后生物纳米硒的深加工研究,开发出了富硒肥料、富硒饲料、富硒功能食品、富硒保健品以及硒药片等。
本发明利用根癌土壤杆菌S2-323合成生物纳米硒,对生物纳米硒进行分离纯化,大量制备生物纳米硒,并在肥料、饲料、富硒功能食品加工、保健品及医药产品中应用。采用生物发酵工艺制备纳米硒,具有环境友好,产率高,安全高效等特点,生产获得的生物纳米硒用于富硒肥料、富硒饲料,施肥或饲喂后,作物、瓜果、蔬菜、肉蛋奶富硒效果显著。
附图说明
图1为本发明实施例1中根据菌株S2-323的16S rRNA基因序列构建的系统进化树。
图2为本发明实施例2中菌株S2-323对不同浓度亚硒酸钠的耐受性。
图3为本发明实施例3中菌株S2-323对不同浓度硒酸盐的耐受性。
图4为本发明实施例4中菌株S2-323在不同亚硒酸盐浓度下的纳米硒产量(A)及对应浓度下的转化率(B)。
图5为本发明实施例5中菌株S2-323在不同时间点的纳米硒产量(A)与对应时间点的转化率(B),以及菌株S2-323在空白培养基与含硒培养基中的生长曲线(C)。
图6为本发明实施例6中菌株S2-323根癌致病基因凝胶电泳结果(A)与向日葵接种实验结果(B)。
图7为本发明实施例7培养基中添加5mM亚硒酸盐时,根癌土壤杆菌S2-323透射电子显微镜(TEM)照片(A)和生物纳米硒能谱(EDX)分析图(B);其中,B是对A图中箭头所指颗粒进行分析的结果。
图8为本发明实施例8中根癌土壤杆菌S2-323转化生成的纳米硒颗粒纯化后透射电子显微镜(TEM)照片。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如Sambrook等分子克隆实验手册(Sambrook J&Russell DW,Molecular Cloning:a Laboratory Manual,2001),或按照制造厂商说明书建议的条件。
以下实施例中所述亚硒酸盐是指亚硒酸钠,所述硒酸盐是指硒酸钠。
实施例1根癌土壤杆菌S2-323的分离纯化及鉴定
1、菌株S2-323的分离纯化
从土壤中分离得到一株可耐受较高浓度亚硒酸盐、硒酸盐的菌株S2-323。
2、菌株S2-323的鉴定
(1)PCR扩增16S rRNA基因序列并测序:
将菌株S2-323接种于LB固体培养基培养24h,取0.2mL灭菌PCR管,加入10μL ddH2O,无菌牙签挑取单个菌落到PCR管中搅拌混匀。
(2)构建PCR反应体系:
16S rRNA:以8F(5’-CGGGATCCAGAGTTTGATCCTGGCTCAGAACGAACGCT-3’)及1506R(5’-CGGGATCCTACGGCTACCTTGTTACGACTTCACCCC-3’)为引物,PCR扩增获得16S rRNA基因序列。PCR反应体系为:ddH2O,18.5μL;10×Buffer,2.5μL,dNTP Mix,2μL;引物8F,0.5μL;引物1506R,0.5μL;菌液,0.5μL;rTaq DNA聚合酶,0.5μL。
PCR反应条件为:94℃10min;94℃40s,56℃40s,72℃1min,共30个循环;72℃10min;4℃保存。
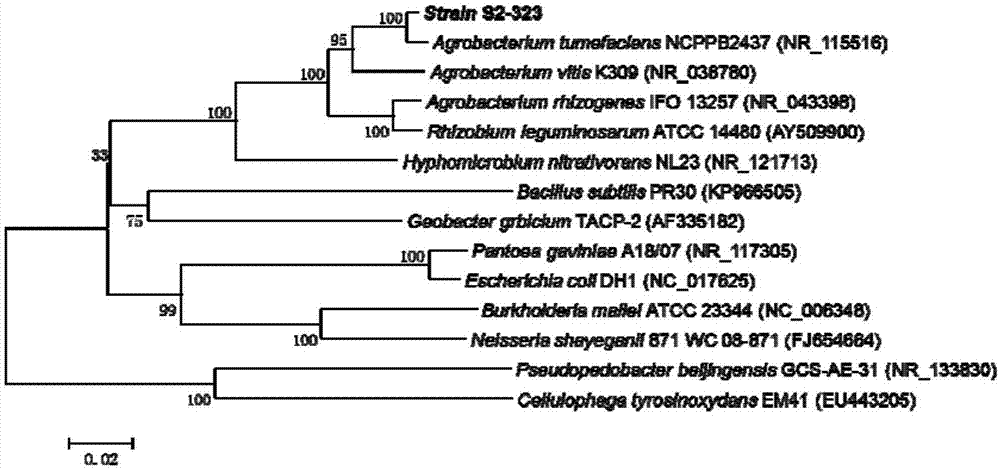
将PCR扩增获得的DNA片段进行纯化,并测序,测序结果用DNAMAN软件拼接。将测得的16S rRNA基因序列(SEQ ID NO:1)登录GenBank,获得的登录号为KY000521,并应用BLAST程序与GenBank数据库(http://www.ncbi.blm.nih.gov/blast.cgi)中已有细菌的16S rRNA基因序列进行相似性比较分析,结果显示S2-323菌株16S rRNA基因序列与Agrobacterium tumefaciens MBW菌株16S rRNA基因序列相似度为100%,S2-323菌株16S rRNA基因进化树见图1。由此确定S2-323菌株为根癌土壤杆菌。
实施例2根癌土壤杆菌S2-323对亚硒酸盐的耐受浓度
制备固体LB不同浓度含硒培养基(每升培养基含NaCl 10g,胰蛋白胨10g,酵母提取物5g,琼脂15g,去离子水1L),121℃高压灭菌20min;配制1M的亚硒酸盐母液,过滤灭菌,加入亚硒酸盐溶液,使培养基中亚硒酸盐含量分别为0mM、50mM、75mM、100mM。
将S2-323菌株挑取单菌落接种于LB液体培养基中摇培8h(150rpm,28℃),取上述菌液,稀释为OD600=0.8的母液备用;将母液分别稀释至10-1、10-2、10-3、10-4、10-5、10-6,分别在含硒平板上滴加2.5μL不同浓度的菌液,每个浓度6个重复,28℃培养48h,观察菌落生长及颜色变化。
结果见图2,S2-323菌株在50mM、75mM亚硒酸盐存在时,根癌土壤杆菌生长良好并且能够产生纳米硒,100mM亚硒酸盐存在时,根癌土壤杆菌S2-323仍能生长。由此可知根癌土壤杆菌S2-323对亚硒酸盐耐受浓度范围为0-100mM。
实施例3根癌土壤杆菌S2-323对硒酸盐的耐受浓度
制备固体LB不同浓度含硒培养基(每升培养基含NaCl 10g,胰蛋白胨10g,酵母提取物5g,琼脂15g,去离子水1L),121℃高压灭菌20min;配制硒酸盐母液,过滤灭菌,加入硒酸盐溶液,使培养基中硒酸盐含量分别0mM、200mM、300mM、400mM、500mM。
将S2-323菌株挑取单菌落接种于LB液体培养基中摇培8h(150rpm,28℃),取上述菌液,稀释为OD600=0.8的母液,再将母液稀释至10-1,分别在不同浓度的含硒平板上滴加2.5μL菌液,每个浓度3个重复,28℃培养48h,观察菌落生长及颜色变化。
结果见图3,S2-323菌株在200mM、300mM硒酸盐存在时,生长良好并合成纳米硒;400mM硒酸盐存在时,S2-323能生长并合成纳米硒;500mM硒酸盐存在时S2-323仍能存活,可知根癌土壤杆菌S2-323对硒酸盐的耐受范围为0-500mM。
实施例4根癌土壤杆菌S2-323对生物纳米硒的合成效率
制备不同浓度含硒液体LB培养基,121℃高压灭菌20min;配制亚硒酸盐母液,过滤灭菌,加入亚硒酸盐溶液,使培养基中亚硒酸盐含量分别为1mM、2.5mM、5mM、7.5mM、10mM,每个浓度梯度3个重复。
将S2-323菌株挑取单菌落接种于LB液体培养基中摇培8h(150rpm,28℃),取上述菌液,稀释至OD600=0.8;将稀释好的菌液按照0.1%接种量接种于LB培养基(含有亚硒酸盐)中,摇培48小时。
用蒸馏水配置1M的Na2S溶液(现配现用);将发酵液9000-13000rprn离心10-20min,去上清,清洗3次,然后加入与菌液体积比为2:1的1M Na2S溶液,混匀后充分反应1h,再9000-13000rpm离心5-10min;然后取上清液在500nm处测定吸光度。每个样品3个重复,每个样品测定3次。
根据纳米硒吸光度标准曲线换算可知S2-323菌株在不同亚硒酸盐浓度下的纳米硒产量(图4A)及转化率(图4B)。S2-323菌株在较低浓度下可将亚硒酸盐全部转化为纳米硒,1mM时转化率为98.02%;2.5mM亚硒酸盐存在时,S2-323菌株纳米硒转化率能达到60.30%,在5mM亚硒酸盐存在时,S2-323菌株纳米硒转化率为31.12%,且此时S2-323合成纳米硒单位体积的产量达到最高,为1.56mM。
实施例5根癌土壤杆菌S2-323合成纳米硒的最佳培养时间
1、制备含硒液体LB培养基,121℃高压灭菌20min;配制亚硒酸盐母液,过滤灭菌,加入亚硒酸盐溶液,使培养基中亚硒酸盐含量5mM。
2、将S2-323菌株挑取单菌落接种于LB液体培养基中摇培8h(150rpm,28℃),取上述菌液,稀释至OD600=0.8;将稀释好的菌液按照0.1%接种量接种于空白与5mM亚硒酸盐LB培养基中,28℃,150rpm摇培,对照与处理各3个重复。分别于摇培0h、4h、8h、12h、24h、30h、36h、48h、60h、72h、84h取样,每个处理三个重复。
3、将培养好的菌液9000-13000rprn离心10-20min,弃上清,清洗3次,然后加入与菌液体积比为2:1的1MNa2S溶液,混匀后充分反应1h,再9000-13000rpm离心5-10min;然后取上清液在500nm处测定吸光度。每个样品3个重复,每个样品测定3次。
4、另将培养好的菌液9000-13000rpm离心3-5min,弃上清,加入与样品体积比为5:8的0.1MNaOH,混匀;将样品沸水浴处理10-20min,9000-14000rpm离心5-10min;取上述样品上清液,加入10倍体积考马斯亮蓝染色3-5min,在595nm处测定样品的吸光度,每个样品三个重复。
5、根据纳米硒吸光度标准曲线换算可知,S2-323菌株在5mM亚硒酸盐浓度下的不同时间点纳米硒产量(图5A)及对应的纳米硒转化效率(图5B)。S2-323菌株在摇培48h后合成纳米硒单位体积的产量达到最高并保持稳定。由此说明根癌土壤杆菌S2-323合成纳米硒的最佳生长时间为48-80h。
6、根据蛋白标准曲线换算可知S2-323菌株正常条件下与亚硒酸盐胁迫条件下菌体蛋白含量随时间的变化趋势(图5C)。空白处理与5mM亚硒酸盐条件下,S2-323菌株均在24小时达到对数生长期,48小时达到稳定期;由此说明根癌土壤杆菌S2-323合成纳米硒的最佳生长时间为48-80h。
实施例6根癌土壤杆菌S2-323致病性检验
1、分子实验检验
PCR扩增致病性基因VirC:将根癌土壤杆菌(Agrobacterium tumefaciens)C58(致病性阳性对照)及S2-323菌株接种于LB固体培养基培养24h,取0.2mL灭菌PCR管,加入10μLddH2O,无菌牙签挑取单个菌落到PCR管中搅拌混匀。
构建PCR反应体系:以VCF3(5’-GGCGGGCGYGCYGAAAGRAARACYT-3’)及VCR3(5’-AAGAACGYGGNATGTTGCATCTYAC-3’)为引物。PCR反应体系为:ddH2O,18.5μL;10×Buffer,2.5μL,dNTP Mix,2μL;引物VCF3,0.5μL;引物VCR3,0.5μL;菌液,0.5μL;rTaqDNA聚合酶,0.5μL;PCR反应条件为:95℃,14.5min;95℃30s,62℃90s,72℃90s,共30个循环;72℃10min;4℃保存。
电泳检测:将S2-323以及阳性对照C58获得的PCR扩增基因片段进行1%琼脂糖凝胶电泳检测,电泳图结果见图6A,C58菌株PCR扩增获得414bp致病基因片段,而S2-323菌株PCR扩增产物未出现相应条带,由此说明S2-323菌株不携带根癌致病性基因VirC。
2、利用根癌病鉴别S2-323对向日葵的致病性
将S2-323菌株活化36h,然后接种0.1%于液体LB培养基中,28℃摇培48h。用酒精消毒向日葵幼苗的茎部并用接种针刺伤表皮,取无菌脱脂棉蘸取1ml的摇培48h后的S2-323菌液,包裹于向日葵幼苗茎部。以致病性的Agrobacterium tumefaciens C58菌株为阳性对照,以无菌水为阴性对照。接种后向日葵幼苗置于20-28℃,70%RH温室内培养3周。每个处理接种10株向日葵。
向日葵接菌实验结果见图6B,C58菌株接种后的向日葵植株均出现冠瘿瘤症状,而接种S2-323菌株与无菌水的向日葵植株均未出现冠瘿瘤症状。向日葵致病性实验也表明S2-323菌株无致病性。
实施例7根癌土壤杆菌S2-323合成生物纳米硒特征分析
活化根癌土壤杆菌S2-323,转接0.1%的菌液(OD600=0.8)于灭菌后的含LB液体培养基的锥形瓶中,加入1M亚硒酸盐母液,终浓度为5mM,置于摇床内,28℃150rpm培养48h。
将摇培48h后的红色菌液取出,在常温下4000-8000rpm离心10-20min,去上清,用生理盐水重悬浮沉淀,离心冲洗3遍,取菌与纳米硒的红色混合液,滴加在碳支持膜铜网上,用滤纸吸去多余水分,晾干,在透射电镜下(TEM,JEM-1230,Japan)观察,并利用能谱分析仪(EDX)对该纳米颗粒进行分析。
结果如图7A和7B所示,透射电镜下,S2-323细胞内可见球形纳米硒颗粒,粒径约200-300nm。通过EDX能谱分析箭头所指的纳米颗粒可知,出现在1.37、11.22和12.49keV处的特定吸收峰为硒的特征峰,说明S2-323菌株将亚硒酸盐还原后合成的纳米颗粒是纳米硒。
实施例8根癌土壤杆菌S2-323合成生物纳米硒发酵工艺
1、菌种活化
用NA培养基对菌株进行活化培养,NA培养基配方为:牛肉膏30g/L,蛋白胨5g/L,MnSO4·H2O 5mg/L,琼脂15g/L,pH7.0-7.2;将菌株S2-323接种于NA培养基斜面上,28℃培养36小时;
2、种子液的制备
种子培养用GYT液体培养基,GYT液体培养基配方为:蔗糖10-12g/L,酵母膏8-10g/L,KH2PO4 2.0-4.0g/L,NaCl0.2-0.4g/L,MgSO4·7H2O 0.3-0.5g/L,pH 7.0-7.2;将活化好的菌株S2-323用无菌生理盐水配制成108CFU/mL的菌悬液,以1%的接种量接种于GYT液体培养基中,28℃摇床震荡培养,转速为150rpm,培养时间为24-36h;
3、发酵罐发酵
发酵培养采用CM发酵培养基,CM发酵培养基配方为:蛋白胨5-8g/L,葡萄糖10-15g/L,玉米粉5-15g/L,亚硒酸盐5mM,pH 7.2;控制培养基体积为发酵罐体积的50-70%,将种子液按照1-3%的接种量接入发酵罐,控制发酵温度为25-30℃,搅拌速度为200-300rpm,通气量为1:0.8-1.2(发酵液体积:每分钟通气量体积),罐压1.2-1.6F/cm2,发酵48-96小时。发酵液下罐,测得发酵液中纳米硒含量为1.6mM。
4、生物纳米硒的分离纯化
(1)纳米硒的收集、清洗与浓缩
发酵液下罐,5000-9000rpm离心15-30min收集菌体沉淀,用无菌生理盐水5000-9000rpm离心15-30min清洗2-3遍,并用发酵液1/20体积的无菌纯净水重悬沉淀,将纳米硒浓缩至发酵液浓度的20倍,达到32mM。
(2)生物纳米硒的分离纯化
a、发酵液下罐,将发酵液置于冰上进行超声破碎细胞,设置变幅杆为Φ8-12,占空比30-60%,功率600-700W,频率20KHz,启停间隔5-10s,破碎15-40min,得到菌体裂解液;
b、菌体裂解液于4000-8000rpm离心10-25min,所得沉淀用无菌生理盐水4000-8000rpm离心20-30min清洗2-3遍;将沉淀重悬于发酵液1/20体积的无菌纯净水中,得到纳米硒悬液;
c、将纳米硒悬液转移至萃取塔中,按照发酵液0.3-0.6倍体积的量加入环己烷萃取3-5次,收集下层水相,4000-6000rpm离心10-25min,所得沉淀用无菌生理盐水5000-8000rpm离心10-20min清洗2-3遍;冷冻干燥,即得纳米硒干粉;
d、获得高纯度、分散性较好生物纳米硒悬液,透射电子显微镜观察结果见图8。
(3)冷冻干燥与生物纳米硒制备
将步骤(1)中制备的生物纳米硒,用液氮冷冻20-30min,放入冷冻干燥机中进行冷冻干燥,冷冻干燥参数为压强30-200Pa,加热板温度为28-37℃,样品厚度为15-30mm;干燥时间在60-80小时,得到生物纳米硒干粉A。
将步骤(2)中制备的生物纳米硒,用液氮冷冻20-30min,放入冷冻干燥机中进行冷冻干燥,冷冻干燥参数为压强20-80Pa,加热板温度为5-15℃,样品厚度为5-10mm;干燥时间在24-48小时,得到纯生物纳米硒干粉B。
实施例9生物纳米硒在富硒肥料、饲料、功能食品、保健品和药品中的应用
1、将生物纳米硒干粉A和B分别悬浮于纯净水中,配制成1g/L的富硒肥料A和富硒肥料B。将肥料A和B用于小麦、水稻、玉米等粮食作物种植,用于大豆、花生、谷子、红薯等杂粮的种植,并在金针菇、香菇、木耳等食用菌养殖中施用,用于番茄、茄子、黄瓜等蔬菜的种植,以及用于苹果、猕猴桃等水果和茶叶种植中,获得可再加工的富硒作物、富硒食用菌、富硒水果、富硒茶叶。富硒粮食和杂粮硒含量为100-300μg/kg,富硒蔬菜和水果硒含量为20-100μg/kg,富硒食用菌硒含量为150-5000μg/kg。
2、将生物纳米硒干粉A或B按照50-800μg/kg比例与饲料原料混合均匀,配制成富硒饲料A和富硒饲料B。将饲料A和B饲喂蛋鸡、肉鸡、猪、羊、牛等畜禽后,获得可再加工的富硒鸡蛋、富硒鸡肉、富硒猪肉、富硒羊肉、富硒牛肉。富硒鸡蛋硒含量为200-1000μg/kg,富硒畜禽肉硒含量为200-800μg/kg。
3、将生物纳米硒干粉B按照10-2500μg/kg的比例与小米面粉、植物油和纯净水(三者的重量百分比为55%、10%和35%)混合均匀,投入膨化机中挤压膨化,烘干装袋,获得膨化小米富硒功能食品。或者,将小米面粉替换为玉米粉、荞麦粉或豆粉,可获得膨化玉米、荞麦或豆粉富硒功能食品。
4、将生物纳米硒干粉B(10-500mg/Kg)与淀粉(972.50-999.99g/Kg)、维生素E(0-22g/Kg)和β胡萝卜素(0-5g/Kg)混合均匀,加入润湿剂,在制粒机中制成微粒,将微粒烘干并填充到胶囊壳中,控制每粒胶囊重0.3-0.6g,按100粒每瓶装瓶,封口包装入库。
5、将生物纳米硒干粉B(50-800mg/Kg)与淀粉和植物蛋白粉(淀粉和植物蛋白粉的重量比为95:4.9)混合均匀,将粘合剂HPMC加入到上述混合物中,在混合机中搅拌均匀,将原料投入压片机中开车压片,烘干,每粒片重0.4-0.6g,按100粒每瓶装瓶,封口包装入库。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110> 中国农业大学
<120> 利用根癌土壤杆菌生物合成纳米硒的方法及其应用
<130> KHP161117071.3
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 1496
<212> DNA
<213> 根癌土壤杆菌
<400> 1
tactccttgg gcgattgaag ctgcccttcg ggatccagag tgtgatcctg gctcagaacg 60
aacgctggcg gcaggcttaa cacatgcaag tcgaacgccc cgcaagggga gtggcagacg 120
ggtgagtaac gcgtgggaat ctaccgtgcc ctgcggaata gctccgggaa actggaatta 180
ataccgcata cgccctacgg gggaaagatt tatcggggta tgatgagccc gcgttggatt 240
agctagttgg tggggtaaag gcctaccaag gcgacgatcc atagctggtc tgagaggatg 300
atcagccaca ttgggactga gacacggccc aaactcctac gggaggcagc agtggggaat 360
attggacaat gggcgcaagc ctgatccagc catgccgcgt gagtgatgaa ggccttaggg 420
ttgtaaagct ctttcaccgg agaagataat gacggtatcc ggagaagaag ccccggctaa 480
cttcgtgcca gcagccgcgg taatacgaag ggggctagcg ttgttcggaa ttactgggcg 540
taaagcgcac gtaggcggat atttaagtca ggggtgaaat cccagagctc aactctggaa 600
ctgcctttga tactgggtat cttgagtatg gaagaggtaa gtggaattcc gagtgtagag 660
gtgaaattcg tagatattcg gaggaacacc agtggcgaag gcggcttact ggtccattac 720
tgacgctgag gtgcgaaagc gtggggagca aacaggatta gataccctgg tagtccacgc 780
cgtaaacgat gaatgttagc cgtcgggcag tatactgttc ggtggcgcag ctaacgcatt 840
aaacattccg cctggggagt acggtcgcaa gattaaaact caaaggaatt gacgggggcc 900
cgcacaagcg gtggagcatg tggtttaatt cgaagcaacg cgcagaacct taccagctct 960
tgacattcgg ggttcgggca gtggagacat tgtccttcag ttaggctggc cccagaacag 1020
gtgctgcatg gctgtcgtca gctcgtgtcg tgagatgttg ggttaagtcc cgcaacgagc 1080
gcaaccctcg cccttagctg ccagcattta gttgggcact ctaaggggac tgccggtgat 1140
aagccgagag gaaggtgggg atgacgtcaa gtcctcatgg cccttacggg ctgggctaca 1200
cacgtgctac aatggtggtg acagtgggca gcgagacagc gatgtcgagc taatctccaa 1260
aagccatctc agttcggatt gcactctgca actcgagtgc atgaagttgg aatcgctagt 1320
aatcgcagat cagcatgctg cggtgaatac gttcccgggc cttgtacaca ccgcccgtca 1380
caccatggga gttggtttta cccgaaggta gtgcgctaac cgcaaggagg cagctaacca 1440
cggtagggtc agcgactggg gtgaagtcgt aacaaggtag ccgagtccca agcgac 1496
- 还没有人留言评论。精彩留言会获得点赞!