含有细胞片的层叠体、心脏疾病治疗剂及细胞片层叠用薄膜的制作方法
本发明涉及一种由细胞片和高分子薄膜构成的层叠体。本发明也涉及一种包含上述层叠体的心脏疾病治疗剂。本发明还涉及一种细胞片层叠用薄膜。
背景技术
近年来,实施了许多再生医疗及细胞移植治疗。尤其,研究了许多如下治疗,即,将细胞制成细胞片,仅将细胞制成片状来进行移植的治疗。与将每一个细胞以悬浮液的形式进行给药的情况相比,细胞片保持为结构物,由此使体内的存活良好且有效性得到提高。在专利文献1中,为了提供一种使用了不包含妨碍应用于临床的源自制造工序的杂质成分的细胞培养液的制造方法,记载有一种包含在不包含有效量的生长因子的细胞培养液中培养实质上无需增殖而能够形成细胞片的密度的细胞的细胞片的制造方法。
另一方面,对于不是片状的每一个细胞,研究了将成为细胞的支撑体的支架材料和细胞组合来进行移植。作为成为细胞的支撑体的支架材料,已知有基因重组明胶。在专利文献2中记载有一种基因重组明胶,其特别有用于伴有细胞附着的一些用途、例如细胞培养工作及伴有支架依赖性细胞的细胞培养的用途以及各种医疗用途。
以往技术文献
专利文献
专利文献1:日本特开2010-81829号公报
专利文献2:国际公开wo2008/103041号公报
技术实现要素:
发明要解决的技术课题
在仅利用细胞制作片材的情况下,细胞片非常脆,具有难以保持初始形状的问题或处理变得困难的问题。在细胞片的移植中,优选解决上述问题。本发明欲解决的课题在于提供一种含有具有强度且移植时或传输时容易处理的细胞片的层叠体。本发明欲解决的课题在于提供一种使用了上述层叠体的心脏疾病治疗剂及细胞片层叠用薄膜。
用于解决技术课题的手段
为了解决上述问题,本发明人等进行深入研究的结果,发现了通过将500μg/cm2~10mg/cm2的生物相容性高分子薄膜层叠于细胞片上,能够提高细胞片的强度及处理性能,从而完成了本发明。根据本发明,提供以下发明。
[1]一种层叠体,其包含500μg/cm2~10mg/cm2的生物相容性高分子薄膜及配置在上述生物相容性高分子薄膜的至少一个表面上的细胞片。
[2]根据[1]所述的层叠体,其中,生物相容性高分子薄膜满足下述式1。
式1:(溶胀时膜厚/干燥时膜厚)×100≥-27.5×干燥时膜厚+880
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
[3]根据[1]或[2]所述的层叠体,其中,生物相容性高分子薄膜满足下述式2。
式2:(溶胀时膜厚/干燥时膜厚)×100≥-27.5×干燥时膜厚+962.5
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
[4]根据[1]~[3]中任一项所述的层叠体,其中,生物相容性高分子薄膜的由下述式3表示的溶胀率为230%以上。
式3:(溶胀时膜厚/干燥时膜厚)×100
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
[5]根据[1]~[4]中任一项所述的层叠体,其中,生物相容性高分子薄膜的干燥时膜厚为5~200μm。
[6]根据[1]~[5]中任一项所述的层叠体,其中,生物相容性高分子薄膜的润湿时膜厚为50~500μm。
[7]根据[1]~[6]中任一项所述的层叠体,其中,细胞为心肌细胞或骨骼肌成肌细胞。
[8]根据[1]~[7]中任一项所述的层叠体,其中,生物相容性高分子为重组明胶。
[9]根据[8]所述的层叠体,其中,重组明胶由下述式4表示。
式4:a-[(gly-x-y)n]m-b
式中,a表示任意的氨基酸或氨基酸序列,b表示任意的氨基酸或氨基酸序列,n个x分别独立地表示氨基酸中的任一个,n个y分别独立地表示氨基酸中的任一个,n表示3~100的整数,m表示2~10的整数。另外,n个gly-x-y可以彼此相同,也可以不同。
[10]根据[8]或[9]所述的层叠体,其中,重组明胶由下述式5表示。
式5:gly-ala-pro-[(gly-x-y)63]3-gly
式中,63个x分别独立地表示氨基酸中的任一个,63个y分别独立地表示氨基酸中的任一个。另外,63个gly-x-y可以彼此相同,也可以不同。
[11]根据[8]~[10]中任一项所述的层叠体,其中,重组明胶具有(1)序列号1中所记载的氨基酸序列、或(2)与序列号1中所记载的氨基酸序列具有80%以上的序列同源性且具有生物相容性的氨基酸序列。
[12]根据[8]~[11]中任一项所述的层叠体,其中,重组明胶具有序列号1中所记载的氨基酸序列。
[13]一种心脏疾病治疗剂,其包含[1]~[12]中任一项所述的层叠体。
[14]一种细胞片层叠用薄膜,其由500μg/cm2~10mg/cm2的生物相容性高分子薄膜组成。
[15]根据[1]~[12]中任一项所述的层叠体,其用于心脏疾病的治疗。
[16]一种用于制造心脏疾病治疗剂的[1]~[12]中任一项所述的层叠体的用途。
[17]一种心脏疾病的治疗方法,其包含将[1]~[12]中任一项所述的层叠体移植到需要心脏疾病治疗的对象的工序。
发明效果
根据本发明的层叠体,能够提高细胞片的强度及处理性能。根据本发明的心脏疾病治疗剂,能够治疗心脏疾病。本发明的细胞片层叠用薄膜在本发明的层叠体的制造中有用。
附图说明
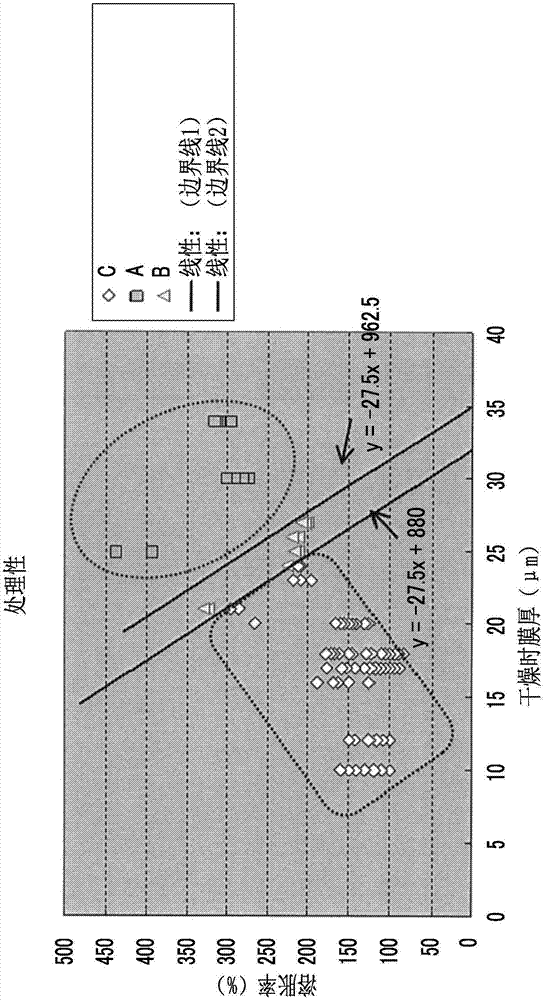
图1表示高分子薄膜的处理性能评价的结果。
图2表示关于高分子薄膜的蛋白渗透试验的试验系统的示意图和试验结果。
图3表示高分子薄膜的蛋白渗透试验的结果。
图4表示将高分子薄膜的蛋白渗透性绘制在溶胀率和干燥时膜厚的曲线图的结果。
图5表示移植到梗塞模型之后的左心室内腔面积变化率(fac)的变化。
图6表示通过肌球蛋白重链(myosinheavychain:mhc)的免疫染色确认骨骼肌成肌细胞而得的结果。
具体实施方式
以下,对本发明的实施方式进行详细说明。
<层叠体>
本发明的层叠体为包含500μg/cm2~10mg/cm2的生物相容性高分子薄膜及配置在上述生物相容性高分子薄膜的至少一个表面上的细胞片的层叠体。在本说明书中,生物相容性高分子薄膜也称为高分子薄膜。
作为本发明的层叠体的具体例,能够举出包含1个生物相容性高分子薄膜和1个细胞片的层叠体(即,仅在生物相容性高分子薄膜的一个表面上具有细胞片的层叠体)、以及在2个细胞片之间具有1个生物相容性高分子薄膜的层叠体(即,在生物相容性高分子薄膜的两个表面上具有细胞片的层叠体),但是并无特别限定。
[生物相容性高分子薄膜]
(生物相容性高分子薄膜的特性)
在本发明中所使用的生物相容性高分子薄膜的密度为500μg/cm2~10mg/cm2。通过将密度设在上述范围内,能够制造具有足够强度的层叠体。生物相容性高分子薄膜的密度优选为500μg/cm2~5.0mg/cm2,更优选为500μg/cm2~2.0mg/cm2。
生物相容性高分子薄膜的密度通过制作时的“涂布质量÷涂布面积”来计算。另外,所谓涂布质量是指,被涂布的生物相容性高分子的质量。
在本发明中所使用的生物相容性高分子薄膜优选满足下述式1。
式1:(溶胀时膜厚/干燥时膜厚)×100≥-27.5×干燥时膜厚+880
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
通过满足式1,生物相容性高分子薄膜的处理性能得到进一步提高,因此优选。另外,在对生物相容性高分子溶液进行干燥来制作薄膜时,在以4℃将其凝胶化的状态下对其进行干燥来制造薄膜的情况下,可获得满足上述式1的生物相容性高分子薄膜,处理性能得到进一步提高。另一方面,若通过在室温(25℃)下对其进行干燥来制作生物相容性高分子薄膜,则可获得不满足上述式1的生物相容性高分子薄膜。
在本发明中所使用的生物相容性高分子薄膜更优选满足下述式2。
式2:(溶胀时膜厚/干燥时膜厚)×100≥-27.5×干燥时膜厚+962.5
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
与满足式1的情况相比,通过满足式2,生物相容性高分子薄膜的处理性能得到进一步提高。
干燥时膜厚是通过测微计(mitutoyocorporation.制softtouchmicroclm等)测量所干燥的生物相容性高分子薄膜的厚度而得的膜厚。溶胀时膜厚是通过测微计测量利用注射用水充分地润湿的生物相容性高分子薄膜的厚度而得的膜厚。
在本发明中所使用的生物相容性高分子薄膜的由下述式3表示的溶胀率优选为230%以上。
式3:(溶胀时膜厚/干燥时膜厚)×100
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
通过将由式3表示的溶胀率设为230%以上,能够提高蛋白质(在实施例中为66kda的蛋白质)的渗透性。即,能够兼顾细胞的浸润防止和蛋白质(营养成分等)的渗透,因此优选。
由式3表示的溶胀率更优选为250%以上,进一步优选为270%以上,尤其优选为300%以上。由式3表示的溶胀率的上限并无特别限定,但是通常为1000%以下。
生物相容性高分子薄膜的干燥时膜厚并无特别限定,但是优选为5~200μm,更优选为10~100μm,进一步优选为20~50μm,尤其优选为20~40μm。
生物相容性高分子薄膜的润湿时膜厚并无特别限定,但是优选为50~500μm。通过设为上述范围,能够防止生物相容性高分子薄膜的翘曲。生物相容性高分子薄膜的润湿时膜厚更优选为50~300μm,进一步优选为100~300μm。
(生物相容性高分子)
所谓生物相容性是指,与生物接触时不会引起如长期且慢性炎症反应等显著的不良反应。关于在本发明中所使用的生物相容性高分子,只要对生物具有相容性,则对是否在生物体内进行分解并无特别限定,但是优选为生物可降解高分子。作为非生物可降解高分子,具体而言,可举出聚四氟乙烯(ptfe)、聚氨酯、聚丙烯、聚酯、氯乙烯、聚碳酸酯、丙烯酸、硅酮及mpc(2-甲基丙烯酰氧基乙基磷酸胆碱)等。作为生物可降解高分子,具体而言,可举出源自天然的肽、重组肽或化学合成肽等多肽(例如,以下所说明的明胶等)、聚乳酸、聚乙醇酸、乳酸/乙醇酸共聚物(plga)、透明质酸、糖胺聚糖、蛋白多糖、软骨素、纤维素、琼脂糖、羧甲基纤维素、几丁质及壳聚糖等。上述中,尤其优选重组肽。针对这些生物相容性高分子,可以对提高细胞粘接性进行研究。具体而言,能够使用“利用相对于基材表面的细胞粘接基质(纤连蛋白、玻连蛋白、层粘连蛋白)、细胞粘接序列(由氨基酸单字母标记表示的rgd序列、ldv序列、redv序列、yigsr序列、pdsgr序列、ryvvlpr序列、lgtipg序列、rniaeiikdi序列、ikvav序列、lre序列、dgea序列、及hav序列)肽的涂布”、“基材表面的氨化、阳离子化”、或“基材表面的等离子体处理、利用电晕放电的亲水性处理”等方法。
关于包含重组肽或化学合成肽的多肽的种类,只要具有生物相容性,则并无特别限定,但是例如优选明胶、胶原蛋白、去端肽胶原、弹性蛋白、纤连蛋白、pronectin、层粘连蛋白、腱生蛋白、纤维蛋白、丝蛋白、巢蛋白、血小板反应蛋白、retronectin,最优选明胶、胶原蛋白、去端肽胶原。作为用于本发明中的明胶,优选天然明胶、重组明胶或化学合成明胶,进一步优选重组明胶。在此所说的天然明胶是指,由源自天然的胶原蛋白制作的明胶。
所谓化学合成肽或化学合成明胶是指,人工合成的肽或明胶。关于明胶等肽的合成,可以是固相合成,也可以是液相合成,但是优选固相合成。对于本领域技术人员来说肽的固相合成是公知的,例如可举出使用fmoc基团(芴基-甲氧基-羰基:fluorenyl-methoxy-carbonyl基团)来作为氨基的保护的fmoc基团合成法、以及使用boc基团(叔丁氧羰基:tert-butyloxycarbonyl基团)来作为氨基的保护的boc基团合成法等。另外,化学合成明胶的优选的方式能够应用在本说明书中在后面叙述的重组明胶中所记载的内容。
在本发明中所使用的生物相容性高分子的亲水性值“1/iob”值优选为0至1.0。更优选为0至0.6,进一步优选为0至0.4。所谓iob是指,基于由藤田穆提出的表示有机化合物的极性/非极性的有机概念图的亲疏水性的指标,关于其详细内容,例如在“pharmaceuticalbulletin,”vol.2,2,pp.163-173(1954)、“化学的领域”vol.11,10,pp.719-725(1957)、“fragrancejournal,”vol.50,pp.79-82(1981)等中进行了说明。简言之,将所有有机化合物的来源设为甲烷(ch4),且其他化合物均视作甲烷的衍生物,对其碳原子数、取代基、转换部、环等分别设定一定的数值,并将该得分加在一起而求出有机性值(ov)、无机性值(iv),将该值绘制在将有机性值作为x轴且将无机性值作为y轴的图上。所谓有机概念图中的iob是指,有机概念图中的无机性值(iv)与有机性值(ov)之比即“无机性值(iv)/有机性值(ov)”。关于有机概念图的详细内容,参考“新版有机概念图-基础和应用-”(甲田善生等著,sankyoshuppanco.,ltd,2008)。在本说明书中,由取iob的倒数而得的“1/iob”值表示亲疏水性。其为表示“1/iob”值越小(接近0),越亲水的标记。
通过将在本发明中所使用的高分子的“1/iob”值设为上述范围,亲水性变高,并且吸水性变高。
在本发明中所使用的生物相容性高分子为多肽的情况下,由总平均亲水性(grandaverageofhydropathicity:gravy)值表示的亲疏水性指标优选为0.3以下且-9.0以上,进一步优选为0.0以下且-7.0以上。总平均亲水性(gravy)值能够通过《gasteigere.,hooglandc.,gattikera.,duvauds.,wilkinsm.r.,appelr.d.,bairocha.;proteinidentificationandanalysistoolsontheexpasyserver;(in)johnm.walker(ed):theproteomicsprotocolshandbook,humanapress(2005).pp.571-607》及《gasteigere.,gattikera.,hooglandc.,ivanyii.,appelr.d.,bairocha.;expasy:theproteomicsserverforin-depthproteinknowledgeandanalysis.;nucleicacidsres.31:3784-3788(2003).》的方法来获得。
通过将在本发明中所使用的高分子的gravy值设为上述范围,亲水性变高,并且吸水性变高。
(重组明胶)
生物相容性高分子优选重组明胶。
所谓重组明胶,为通过基因重组技术制作的具有与明胶类似的氨基酸序列的多肽或者蛋白样物质,优选源自胶原蛋白的局部氨基酸序列的氨基酸序列的基因重组体。
重组明胶优选具有由胶原蛋白的特征性gly-x-y表示的序列(x及y分别独立地表示氨基酸中的任一个)的重复。在此,多个gly-x-y可以彼此相同,也可以不同。
作为重组明胶,例如能够使用ep1014176、美国专利6992172号、国际公开wo2004/85473、国际公开wo2008/103041等中所记载的重组明胶,但是并不限定于这些。作为在本发明中所使用的重组明胶而优选的重组明胶为以下方式的重组明胶。
从天然明胶原有的性能来看,重组明胶的生物相容性优异,并且由于不是源自天然的,因此不用担心牛海绵状脑病(bse)等,从而非感染性优异。并且,与天然明胶相比,重组明胶均匀,且其序列是确定的,因此在强度及分解性方面,也能够通过交联等而模糊较少且精密地设计。
重组明胶的分子量并无特别限定,但是优选为2000以上且100000以下(2kda(千道尔顿)以上且100kda以下),更优选为2500以上且95000以下(2.5kda以上且95kda以下),进一步优选为5000以上且90000以下(5kda以上且90kda以下),最优选为10000以上且90000以下(10kda以上且90kda以下)。
优选重组明胶具有由胶原蛋白的特征性gly-x-y表示的序列的重复。在此,多个gly-x-y可以彼此相同,也可以不同。在gly-x-y中,gly表示甘氨酸,x及y表示任意的氨基酸(优选除甘氨酸以外的任意的氨基酸)。所谓由胶原蛋白的特征性gly-x-y表示的序列是指,明胶·胶原蛋白的氨基酸组成及序列中的、与其他蛋白质相比非常特异的部分结构。在该部分中,甘氨酸占整体的约3分之1,且在氨基酸序列中以每3个中有1个的方式重复。甘氨酸是最简单的氨基酸,且对分子链的配置的限制也较少,对凝胶化时的螺旋结构的再生贡献较大。优选由x及y表示的氨基酸大量包含亚氨基酸(脯氨酸、氧脯氨酸),且占整体的10%~45%。优选为重组明胶的序列的80%以上、进一步优选为95%以上、最优选为99%以上的氨基酸为gly-x-y的重复结构。
关于一般的明胶,极性氨基酸中带电荷的氨基酸与不带电荷的氨基酸以1:1存在。在此,所谓极性氨基酸,具体而言,是指半胱氨酸、天冬氨酸、谷氨酸、组氨酸、赖氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸及精氨酸,其中,所谓极性不带电荷的氨基酸是指半胱氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸及酪氨酸。在本发明中所使用的重组明胶中,所构成的所有氨基酸中,极性氨基酸的比例为10~40%,优选为20~30%。并且,上述极性氨基酸中的不带电荷的氨基酸的比例优选为5%以上且小于20%,更优选为5%以上且小于10%。而且,优选在序列上不包含丝氨酸、苏氨酸、天冬酰胺、酪氨酸及半胱氨酸中的任一个(优选为2个以上)氨基酸。
通常,在多肽中,已知有作为细胞粘接信号发挥作用的最小氨基酸序列(例如,nagaico.,ltd出版发行“病态生理”vol.9、no.7(1990年)527页)。关于在本发明中所使用的重组明胶,可以在一分子中具有2个以上的这些细胞粘接信号。作为具体的序列,从所粘接的细胞的种类较多的方面考虑,优选由氨基酸单字母标记表示的rgd序列、ldv序列、redv序列、yigsr序列、pdsgr序列、ryvvlpr序列、lgtipg序列、rniaeiikdi序列、ikvav序列、lre序列、dgea序列及hav序列的序列。进一步优选rgd序列、yigsr序列、pdsgr序列、lgtipg序列、ikvav序列及hav序列,尤其优选rgd序列。在rgd序列中,优选ergd序列。
作为在本发明中所使用的重组明胶中的rgd序列的配置,优选rgd之间的氨基酸数量在0~100之间(优选在25~60之间)不均匀。
关于该最小氨基酸序列的含量,在蛋白质1分子中优选为3~50个,进一步优选为4~30个,尤其优选为5~20个。最优选为12个。
在本发明中所使用的重组明胶中,优选rgd基序相对于氨基酸总数的比例至少为0.4%。在重组明胶包含350个以上的氨基酸的情况下,优选350个氨基酸的每一段(stretch)至少包含1个rgd基序。rgd基序相对于氨基酸总数的比例更优选至少为0.6%,进一步优选至少为0.8%,更加进一步优选至少为1.0%,尤其优选至少为1.2%,最优选至少为1.5%。关于重组肽内的rgd基序的数量,每250个氨基酸,优选至少为4个、更优选为6个、进一步优选为8个、尤其优选为12个以上且16个以下。0.4%的rgd基序的比例对应于每250个氨基酸至少为1个rgd序列。rgd基序的数量为整数,因此为了满足0.4%的特征,由251个氨基酸组成的明胶必须至少包含2个rgd序列。关于本发明的重组明胶,优选每250个氨基酸至少包含2个rgd序列,更优选每250个氨基酸至少包含3个rgd序列,进一步优选每250个氨基酸至少包含4个rgd序列。作为本发明的重组明胶的另一方式,至少包含4个rgd基序,优选包含6个rgd基序,更优选包含8个rgd基序,进一步优选包含12个以上且16个以下的rgd基序。
重组明胶可以被局部水解。
优选在本发明中所使用的重组明胶由下述式4表示。
式4:a-[(gly-x-y)n]m-b
式中,a表示任意的氨基酸或氨基酸序列,b表示任意的氨基酸或氨基酸序列,n个x分别独立地表示氨基酸中的任一个,n个y分别独立地表示氨基酸的任一个。n优选为3~100的整数,进一步优选为15~70的整数,最优选为50~65的整数。m优选表示2~10的整数,更优选表示3~5的整数。另外,n个gly-x-y可以彼此相同,也可以不同。
更优选在本发明中所使用的重组明胶由下述式5表示。
式5:gly-ala-pro-[(gly-x-y)63]3-gly
式中,63个x分别独立地表示氨基酸中的任一个,63个y分别独立地表示氨基酸中的任一个。另外,63个gly-x-y可以彼此相同,也可以不同。
优选在重复单元上键合多个天然存在的胶原蛋白的序列单元。在此所说的天然存在的胶原蛋白,只要是天然存在的,则可以是任一个,但是优选i型、ii型、iii型、iv型或v型胶原蛋白。更优选i型、ii型或iii型胶原蛋白。根据另一形态,上述胶原蛋白的来源优选人、牛、猪、小鼠或大鼠,更优选人。
在本发明中所使用的重组明胶的等电点优选为5~10,更优选为6~10,进一步优选为7~9.5。关于重组明胶的等电点的测量,如等电点电泳法(参考maxey,c.r.(1976);phitogr.gelatin2,editorcox,p.j.academic,london,engl.)中所记载那样,能够通过对将1质量%明胶溶液通入阳离子及阴离子交换树脂的混晶柱之后的ph进行测定来实施。
优选重组明胶不被去胺基化。
优选重组明胶不具有端肽。
优选重组明胶通过编码氨基酸序列的核酸来制备且实质上为纯多肽。
重组明胶尤其优选具有:
(1)序列号1中所记载的氨基酸序列;或
(2)与序列号1中所记载的氨基酸序列具有80%以上(优选为90%以上,更优选为95%以上,尤其优选为98%以上)的序列同源性,且具有生物相容性的氨基酸序列。
重组明胶最优选具有序列号1中所记载的氨基酸序列。
本发明中的序列同源性是指由下述式计算出的值。
%序列同源性=[(相同残基数)/(对齐长度)]×100
2个氨基酸序列中的序列同源性能够通过本领域技术人员公知的任意的方法来确定,能够使用blast((基本局部比对搜索工具:basiclocalalignmentsearchtool))程序(j.mol.biol.215:403-410,1990)等来确定。
重组明胶可以由在序列号1中所记载的氨基酸序列中缺失、取代或者加成1个或者数个氨基酸而得的氨基酸序列组成,并且具备具有生物相容性的氨基酸序列。
“缺失、取代或者加成1个或者数个氨基酸而得的氨基酸序列”中的“1个或者数个”是指,优选为1~20个,更优选为1~10个,进一步优选为1~5个,尤其优选为1~3个。
重组明胶能够通过本领域技术人员公知的基因重组技术来制造,例如能够按照ep1014176a2号公报、美国专利第6992172号公报、国际公开wo2004/85473号、国际公开wo2008/103041号等中所记载的方法来制造。具体而言,获取编码规定的重组明胶的氨基酸序列的基因,并将其整合到表达载体,制作重组表达载体,将其导入到适当的宿主并制作转化体。通过在适当的培养基中培养所获得的转化体来产生重组明胶,因此能够通过回收由培养物产生的重组明胶来制备在本发明中所使用的重组明胶。
(生物相容性高分子薄膜的制造方法)
生物相容性高分子薄膜的制造方法并无特别限定,生物相容性高分子薄膜能够通过常规方法来制造。例如,能够通过使生物相容性高分子的水溶液流入塑料托盘,并在低温下(例如,4℃的冰箱中等)或室温下进行干燥来制造生物相容性高分子薄膜。优选将生物相容性高分子的水溶液在低温下(例如,4℃的冰箱中等)进行干燥。
生物相容性高分子薄膜中的生物相容性高分子能够进行交联。
作为一般的交联方法,已知有热交联、利用醛类(例如,甲醛、戊二醛等)的交联、利用缩合剂(碳二亚胺、氰胺等)的交联、酶交联、光交联、紫外线交联、疏水性相互作用、氢键、离子性相互作用等,在本发明中也能够使用上述交联方法。作为在本发明中所使用的交联方法,进一步优选热交联、紫外线交联或酶交联,尤其优选热交联。
在利用酶进行交联的情况下,作为酶,只要具有高分子材料之间的交联作用,则并无特别限定,但是能够优选使用转谷氨酰胺酶及漆酶、最优选使用转谷氨酰胺酶来进行交联。作为通过转谷氨酰胺酶进行酶交联的蛋白质的具体例,只要是具有赖氨酸残基及谷氨酰胺残基的蛋白质,则并无特别限制。转谷氨酰胺酶可以源自哺乳类,也可以源自微生物,具体而言可举出ajinomotoco.,inc.制activa系列、作为试剂出售的源自哺乳类的转谷氨酰胺酶、例如orientalyeastco.,ltd.制、upstateusainc.制、biodesigninternational制等的源自豚鼠肝脏的转谷氨酰胺酶、源自山羊的转谷氨酰胺酶、源自兔子的转谷氨酰胺酶等源自人的凝血因子(因子(factor)xiiia,haematologictechnologies,inc.公司)等。
关于进行交联(例如,热交联)时的反应温度,只要能够进行交联,则并无特别限定,但是优选为-100℃~500℃,更优选为0℃~300℃,进一步优选为50℃~300℃,更加进一步优选为100℃~250℃,尤其优选为120℃~200℃。
进行交联(例如,热交联)时的反应时间并无特别限制,但是通常为1小时至72小时,优选为2小时至48小时,更优选为4小时至36小时。
[细胞片]
所谓本发明中的细胞片是指,将细胞作为主要成分的片材。关于细胞片,细胞彼此连结而成为片状,只要是片状,则其结构并无特别限定,可以是单层细胞片、由双层以上的细胞形成的片材、或由经三维培养的细胞形成的片材中的任一种。
细胞彼此可以直接和/或隔着介入物质而彼此连结。作为介入物质,只要是至少能够将细胞彼此机械连结的物质,则并无特别限定,但是例如可举出细胞外基质等。介入物质优选源自细胞的物质、尤其源自构成细胞片的细胞的物质。细胞至少可机械连结,但是还可以功能性连结、例如化学连结、电连结。
在本发明中的细胞片中包含能够形成细胞片的任意的细胞。作为细胞的例子,并无特别限定,可包含心肌细胞、成肌细胞(例如,骨骼肌成肌细胞)、成纤维细胞、滑膜细胞、上皮细胞、及内皮细胞等。在上述中也优选心肌细胞及骨骼肌成肌细胞。作为细胞,能够使用源自能够利用细胞片进行治疗的任意的生物的细胞。生物并无特别限定,例如可举出人、非人类的灵长类(猴子等)、狗、猫、猪、马、山羊、绵羊、小鼠、大鼠及仓鼠等。并且,所使用的细胞可以只有1种,但是还能够使用2种以上的细胞。在形成细胞片的细胞为2种以上的情况下,存在最多的细胞的比率(纯度)在细胞片制造结束时优选为25%以上,更优选为50%以上,进一步优选为60%以上。
细胞片能够通过公知的细胞片的制造方法或遵照该方法的方法来制造。例如,在培养皿中培养细胞,并在细胞成为片状之后,从培养皿回收片材即可。如上所述,细胞片的制造方法并无特别限定,但是作为一例,能通通过日本特开2010-81829号公报中所记载的方法来制造细胞片。具体而言,可以通过在不包含有效量的生长因子的细胞培养液中培养实质上不增殖而能够形成细胞片的密度的细胞来制造细胞片。
所谓“实质上不增殖而能够形成细胞片的密度”是指,在不包含生长因子的培养液中进行培养的情况下,能够形成细胞片的细胞密度。例如,在为骨骼肌成肌细胞的情况下,使用包含生长因子的培养液的现有方法中,为了形成细胞片,将约6,500个/cm2的密度的细胞接种于板上,但是即使在不包含生长因子的培养液中培养上述密度的细胞,也无法形成细胞片。例如,关于骨骼肌成肌细胞,“实质上不增殖而能够形成细胞片的密度”典型地为300,000个/cm2以上。关于细胞密度的上限,只要细胞片的形成不会受损,且细胞不会转变成分化,则并无特别限制,但是关于骨骼肌成肌细胞,例如为1,100,000个/cm2。若为本领域技术人员,则能够通过实验来适当地确定合适的细胞密度。在培养期间,细胞可以增殖,也可以不增殖,但是即使增殖,也不会增殖到细胞的性质发生变化的程度。例如,骨骼肌成肌细胞若融合则开始分化。优选骨骼肌成肌细胞以虽然形成细胞片,但是不会转变成分化的密度进行接种。优选细胞超过测量误差的范围而不增殖。关于细胞是否增殖,例如能够通过比较接种时的细胞数量和细胞片形成后的细胞数量来进行评价。在本方式中,关于细胞片形成后的细胞数量,典型地为接种时的细胞数量的300%以下,优选为200%以下,更优选为150%以下,进一步优选为125%以下,尤其优选为100%以下。
作为一例,关于细胞的培养,在规定的期间内(优选在细胞不会转变为分化的期间内)进行。在该情况下,细胞在培养期间保持为未分化的状态。关于细胞的向分化的转变,能够通过本领域技术人员公知的任意的方法来进行评价。例如,在为骨骼肌成肌细胞的情况下,能够将肌球蛋白重链(mhc)的表达、细胞的多核化设为分化的指标。培养时间优选在48小时以内,更优选在40小时以内,进一步优选在24小时以内。
生长因子是指与没有生长因子的情况相比促进细胞的增殖的任意的物质,例如包含上皮细胞生长因子(egf)、血管内皮生长因子(vegf)或成纤维细胞生长因子(fgf)等。
所谓有效量的生长因子是指,与没有生长因子的情况相比,显著促进细胞的增殖的生长因子的量、或为了便于说明,在本技术领域中为了细胞的增殖而通常添加的量。关于促进细胞增殖的显著性,例如能够通过本技术领域中公知的任意的统计学方法、例如t检验等来适当地进行评价,并且通常的添加量能够从本技术领域的各种公知文献中获知。具体而言,骨骼肌成肌细胞的培养中的egf的有效量例如为0.005μg/ml以上。
因此,所谓“不包含有效量的生长因子”是指,培养液中的生长因子的浓度小于该有效量。例如,骨骼肌成肌细胞的培养中的egf的培养液中的浓度优选为小于0.005μg/ml,更优选为小于0.001μg/ml。在优选的方式中,培养液中的生长因子的浓度小于生物体内的通常的浓度。在该方式中,例如,骨骼肌成肌细胞的培养中的egf的培养液中的浓度优选为小于5.5ng/ml,更优选为小于1.3ng/ml,进一步优选为小于0.5ng/ml。在进一步优选的方式中,本发明中的培养液实质上不包含生长因子。在此,所谓实质上不包含是指,培养液中的生长因子的含量为在将细胞片应用于生物的情况下不会造成不良影响的程度,优选在培养液中不会积极地添加生长因子。因此,在该方式中,培养液不包含其中的其他成分、例如血清等中所包含的浓度以上的浓度的生长因子。
关于细胞培养液(有时简称为“培养液”),只要能够保持细胞的生存,则并无特别限定,但是典型地,能够利用将氨基酸、维生素类、电解质作为主要成分的培养液。例如,培养液是基于细胞培养用基础培养基而成。对于基础培养基,并无限定,例如包含dmem(dulbecco改进的eagle培养基)、mem(eagle最小必需培养基)、f12、ham、rpmi1640、mcdb(mcdb102、104、107、131、153、199等)、l15、skbm(注册商标)、ritc80-7等。这些基础培养基的大部分可市售获得,且其组成也是公知的。基础培养基可以直接使用标准组成(例如,以市售获得的状态),也可以根据细胞种类、细胞条件来适当地变更该组成。因此,基础培养基并不限定于公知的组成的培养基,可以追加、去除、增加或者减少1种或2种以上的成分。
作为在基础培养基中所包含的氨基酸,并无特别限定,例如可举出l-精氨酸、l-胱氨酸、l-谷氨酰胺、甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-蛋氨酸、l-苯丙氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸、l-缬氨酸等。
作为基础培养基中所包含的维生素类,并无特别限定,例如可举出d-泛酸钙、胆碱、叶酸、i-肌醇、烟酰胺、核黄素、硫胺、吡哆醇、生物素、硫辛酸、维生素b12、腺嘌呤、胸苷等。
作为在基础培养基中所包含的电解质,并无特别限定,例如可举出cacl2、kcl、mgso4、nacl、nah2po4、nahco3、fe(no3)3、feso4、cuso4、mnso4、na2sio3、(nh4)6mo7o24、navo3、nicl2、znso4等。
在基础培养基中,除了这些成分以外,还可以包含d-葡萄糖等糖类、丙酮酸钠、酚红等ph指示剂、腐胺等。
在假设应用于人的一例中,细胞培养液实质上不包含类固醇剂成分。在此,“类固醇剂成分”是指,具有类固醇核的化合物中,可能会对生物造成肾上腺皮质功能障碍、库欣综合征等不良影响的化合物。作为上述化合物,并无特别限定,例如可包含皮质醇、泼尼松龙、去炎松(triamcinolone)、地塞米松、倍他米松等。因此,“实质上不包含类固醇剂成分”是指,培养液中的上述化合物的含量为在将细胞片应用于生物的情况下不会造成不良影响的程度,优选在培养液中不会积极地添加这些化合物,即培养液不包含其中的其他成分、例如血清等中所包含的浓度以上的浓度的类固醇剂成分。
在假设应用于人的一例中,细胞培养液实质上不包含异种血清成分。在此,“异种血清成分”是指源自与受体不同种类的生物的血清成分。例如,在受体为人的情况下,源自牛或马的血清、例如胎牛血清(fbs、fcs)、小牛血清(cs)、马血清(hs)等相当于异种血清成分。因此,“实质上不包含异种血清成分”是指,培养液中的这些血清的含量为在将细胞片应用于生物的情况下不会造成不良影响的程度(例如,细胞片中的血清白蛋白含量小于50ng的量)(优选在培养液中不会积极地添加这些物质)。
在假设应用于人的一例中,细胞培养液包含同种血清成分。在此,“同种血清成分”是指源自与受体相同种类的生物的血清成分。例如,在受体为人的情况下,人血清相当于同种血清成分。同种血清成分优选自己血清成分即源自受体的血清成分。同种血清成分的含量只要是能够形成细胞片的量,则并无特别限定,但是优选为5~40v/v(容量/容量)%,更优选为10~20v/v(容量/容量)%。
在一例中,细胞培养液实质上不包含硒成分。在此,“硒成分”包括硒分子及含硒化合物、尤其能够使硒分子在生物体内游离的含硒化合物、例如亚硒酸等。因此,所谓“实质上不包含硒成分”是指,培养液中的这些物质的含量为在将细胞片应用于生物的情况下不会造成不良影响的程度,优选在培养液中不会积极地添加这些物质,即培养液不包含其中的其他成分、例如血清等中所包含的浓度以上的浓度的硒成分。具体而言,例如在为人的情况下,培养液中的硒浓度低于将培养基中所包含的人血清的比例乘以人血清中的正常值(例如,10.6~17.4μg/dl)而得的值(即,若人血清的含量为10%,则例如,硒浓度小于1.0~1.7μg/dl)。
典型地,细胞片可通过将细胞接种于培养液中的工序及培养细胞并形成细胞片的工序来制造。
细胞的培养能够在本技术领域中通常进行的条件下进行。例如,作为典型的培养条件,可举出在37℃、5%co2下的培养。关于培养期间,从充分形成细胞片及防止细胞分化的观点考虑,优选为48小时以内,更优选为40小时以内,进一步优选为24小时以内。培养能够在任意大小及形状的容器中进行。
<层叠体的制造方法>
作为本发明的层叠体的制造方法,只要是能够层叠细胞片和生物相容性高分子薄膜的方法,则并无特别限定。例如,分别制作细胞片和生物相容性高分子薄膜之后,可以在细胞片的表面层叠生物相容性高分子薄膜,或者也可以在生物相容性高分子薄膜的表面层叠细胞片。或者,可以通过如下方式来制备层叠体:通过在预先制作生物相容性高分子薄膜之后,将细胞接种于生物相容性高分子薄膜的表面上并进行培养来形成细胞片。
<心脏疾病治疗剂>
本发明的层叠体能够用于对象的疾病、伤病的治疗。例如,基于骨骼肌成肌细胞的细胞片能够用作心脏疾病治疗剂。作为心脏疾病,例如可举出心肌梗塞、缺血性心肌病、扩张型心肌病、心绞痛等。
作为包含本发明的层叠体的心脏疾病治疗剂的给药方法,例如可举出在受损的心肌组织的损伤部位直接贴付心脏疾病治疗剂的方法等。
包含本发明的层叠体的心脏疾病治疗剂的给药对象并无特别限定,但是优选举出人、非人类灵长类(猴子等)、狗、猫、猪、马、山羊、绵羊、大鼠、小鼠及仓鼠等,更优选人。
<细胞片层叠用薄膜>
如上所述,通过将500μg/cm2~10mg/cm2的生物相容性高分子薄膜层叠于细胞片上,能够制造本发明的层叠体。因此,根据本发明,可提供由500μg/cm2~10mg/cm2的生物相容性高分子薄膜组成的细胞片层叠用薄膜。生物相容性高分子薄膜的详细内容及优选的方式在本说明书中如上所述。
通过以下的实施例,对本发明进行进一步具体的说明,但是本发明并不受实施例的限定。
实施例
(1)重组明胶
准备了以下cbe3来作为重组明胶(国际公开wo2008/103041号公报中所记载)。
cbe3:
分子量:51.6kd
结构:gap[(gxy)63]3g
氨基酸数量:571个
rgd序列:12个
亚氨基酸含量:33%
几乎100%的氨基酸是gxy的重复结构。在cbe3的氨基酸序列中不包含丝氨酸、苏氨酸、天冬酰胺、酪氨酸及半胱氨酸。cbe3具有ergd序列。
等电点:9.34
gravy值:-0.682
1/iob值:0.323
氨基酸序列(序列表的序列号1)(与国际公开wo2008/103041号公报的序列号3相同。其中末尾的x修正为“p”)
gap(gapglqgapglqgmpgergaaglpgpkgergdagpkgadgapgapglqgmpgergaaglpgpkgergdagpkgadgapgkdgvrglagpigppgergaaglpgpkgergdagpkgadgapgkdgvrglagpigppgpagapgapglqgmpgergaaglpgpkgergdagpkgadgapgkdgvrglagpp)3g
(2)重组明胶薄膜的制作
作为高分子薄膜的代表例,使用实施例1的cbe3来制作了重组明胶薄膜。制备1质量%、2质量%、3质量%或4质量%的cbe3水溶液,并使该cbe3水溶液4ml流入设置有硅酮框架(8cm×10cm)的塑料托盘中。在4℃或室温下,对该塑料托盘进行干燥直至水分消失,由此获得了重组明胶薄膜。
将上述重组明胶薄膜从塑料托盘/硅酮框架取出,并在减压下以160℃实施热交联(交联时间为6小时、12小时、24小时),获得了不溶性重组明胶薄膜试样。
通过如上述那样的制作方法,获得了500μg/cm2、1mg/cm2、1.5mg/cm2及2.0mg/cm2的重组明胶薄膜。重组明胶薄膜的密度通过制作时的“涂布质量÷涂布面积”来计算。另外,涂布质量是指被涂布的重组明胶的质量。
(3)高分子薄膜的溶胀率的评价
关于在上述(2)中制作的各重组明胶薄膜,进行了溶胀率的评价来作为物理性能值。评价时,用直径为8mm的活检环钻掏空重组明胶薄膜,从而准备了直径为8mm的圆盘状薄膜。此时,测量干燥时的厚度并设为干燥时膜厚。用注射用水充分润湿该圆盘状薄膜之后,测量润湿时的厚度并设为润湿时膜厚。另外,关于膜厚的测量,使用测微计(mitutoyocorporation.制softtouchmicroclm)来进行。
根据该润湿时膜厚和干燥时膜厚,计算出溶胀率((溶胀时膜厚[μm]/干燥时膜厚[μm])×100)。
(4)高分子薄膜的处理性能的评价
使用如上述(3)那样获得的润湿状态的圆盘状薄膜来实施了处理性能的评价。在用钳子夹住该润湿状态的圆盘状薄膜的一侧并沿水平举起的情况下,将薄膜保持水平的情况设为a,将薄膜的末端(远离钳子的一侧)下垂并弯曲30度以上的情况设为b,将折叠成一半的情况设为c来评价了处理性能。另外,处理性能的评价为c的薄膜也能够通过根据需要设计使用方法来(例如,对薄膜附加框架而使用等)在实际使用上毫无问题地使用。
并且,在细胞片上层叠有高分子薄膜的情况下的处理性能与只有高分子薄膜的情况为相同的结果。
(5)溶胀率、干燥时膜厚及处理性能的评价的总结
将在上述(3)及(4)中评价的所有结果绘制在将溶胀率用作纵轴且将干燥时膜厚用作横轴的曲线图,并进行了总结(图1)。并且,对基于每一个高分子薄膜的处理性能评价(a、b、c)绘制的点进行了分组(图1)。其结果发现,在干燥时膜厚和溶胀率的曲线图中,能够绘制与处理性能相关的边界线。
发现在处理性能a与b的边界存在如下边界线(边界线2):
溶胀率((溶胀时膜厚[μm]/干燥时膜厚[μm])×100)=-27.5×干燥时膜厚[μm]+962.5。
发现在处理性能b与c的边界存在如下边界线(边界线1):
溶胀率((溶胀时膜厚[μm]/干燥时膜厚[μm])×100)=-27.5×干燥时膜厚[μm]+880。
因此发现,关于高分子薄膜的处理性能,
高分子薄膜优选溶胀率((溶胀时膜厚[μm]/干燥时膜厚[μm])×100)≥-27.5×干燥时膜厚[μm]+880,
更优选溶胀率((溶胀时膜厚[μm]/干燥时膜厚[μm])×100)≥-27.5×干燥时膜厚[μm]+962.5。
(6)高分子薄膜的蛋白渗透试验
使用在上述(2)中所制作的高分子薄膜,实施了蛋白成分的渗透试验。作为蛋白成分,选择了代表性白蛋白(分子量为66kda)。示出了若该蛋白成分渗透薄膜,则能够经由薄膜来交换营养成分。
图2中示出了试验系统的示意图和其结果。作为上液,设置了将白蛋白以41mg/ml溶解于pbs(磷酸缓冲生理盐水)而得的白蛋白溶液。在其下设置了各种高分子薄膜,并随时间测量了渗透至下液(pbs)的白蛋白量。白蛋白的测量使用了bio-rad蛋白质分析(bio-rad公司)。
其结果发现,白蛋白分子渗透高分子薄膜,并出现在下液(图2)。并且,发现在对各种薄膜进行测试的过程中存在蛋白渗透性较高的薄膜组(a组)和蛋白渗透性较低的薄膜组(b组)。
(7)高分子薄膜的蛋白渗透试验(sds-page(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳))
关于在上述(6)中进行的蛋白渗透试验,为了分析是否白蛋白未分解,而在相同分子量的状态下从上液向下液渗透高分子薄膜,进行sds-page并确认了渗透的白蛋白的分子量。
其结果发现,如图3所示,不管是蛋白的渗透性较高的薄膜组,还是蛋白的渗透性较低的薄膜组,渗透的白蛋白均保持与上液相同的66kda的分子量。并且,在蛋白渗透性较高的薄膜组和蛋白渗透性较低的薄膜组中,还确认到在渗透的白蛋白量中存在较大的差异。
(8)蛋白渗透性、溶胀率、干燥时膜厚
通过高分子薄膜的物理性能来分析了在上述(6)及(7)中确认的蛋白的渗透性。作成将在上述(3)中实施的溶胀率用作纵轴且将干燥时膜厚用作横轴的曲线图,并在此绘制了被测试的高分子薄膜。然后,将上述(6)及(7)分组为a组和b组(图4)。结果发现,在a组与b组之间绘制溶胀率=230的边界来作为边界线。
因此,从蛋白渗透性的观点考虑,发现通过使用溶胀率≥230%的高分子薄膜来制造蛋白渗透较高的结构。考虑作为通过设为溶胀率≥230%的高分子薄膜来使细胞所需的营养素、液性因子有效且容易渗透的高分子薄膜产生较高的治疗效果。
(9)细胞片以及重组明胶薄膜和细胞片的层叠体的制作
作为高分子薄膜和细胞片的层叠体的代表例,制作了重组明胶薄膜和细胞片的层叠体。使大鼠骨骼肌成肌细胞悬浮于在dmem低葡萄糖(dmemlowglucose)(thermofisherscientific公司制)中添加20容量%的胎牛血清(fbs)(moregate公司制)而得的培养基中,并在48孔多孔温度响应性培养皿(upcell:cellseedinc.)各接种1.3×106cells,在37℃、5%co2条件下培养一夜之后,将培养皿放置于室温下,由此获得了细胞片。
同样地,在直径为6mm的硅酮框架的低表面设置用相同培养基溶胀的重组明胶薄膜,将大鼠骨骼肌成肌细胞以与上述相同的方式各接种1.3×106cells,在37℃、5%co2条件下培养一夜,由此获得了重组明胶薄膜和细胞片的层叠体。
(10)大鼠梗塞模型的制作
对产后8周龄的成年大鼠(lewis系,雄,charlesriverlaboratoriesinternational,inc.制),使用异氟烷(abbvieinc.制)进行吸入麻醉,插入气管导管,并利用小动物用呼吸机使其进行强制呼吸的状态下暴露心脏,对冠状动脉(lad)进行结扎,以闭合了胸部。1周后通过超声心动装置(hd11xe,philipselectronicsjapan,ltd制)以乳头肌水平描绘出左心室短轴图像,由左心室扩张末期截面积(以下,称为lveda)及左心室收缩末期截面积(以下,称为lvesa)测量心脏功能(左心室内腔面积变化率,以下称为fac)(参考下式),对于fac的值低于60%的个体,判断为梗塞模型成立,并提供于移植。
[数式1]
(11)层叠体或细胞片的移植
对制成梗塞模型的个体,与模型制作处理同样地实施了麻酔处理之后,切开肋间并暴露了心脏。将在上述(9)中所制作的高分子薄膜和细胞片的层叠体、或细胞片移植到左心室前壁部之后,在表面涂布了纤维蛋白制剂(chemo-sero-therapeuticresearchinstitute)。在确认纤维蛋白制剂已凝固之后,闭合了胸部(sham组(假手术组)只涂布纤维蛋白制剂)。关于实施数量,移植了高分子薄膜和细胞片的层叠体的组设为6只,移植了细胞片的组设为4只,sham组设为4只。
(12)有效性的评价
关于观察期,设为至移植高分子薄膜和细胞片的层叠体、或细胞片之后12周。在梗塞模型制作处理前、模型判定/移植时、移植3周后、移植4周后、移植8周后及移植12周后,实施超声心动检查,根据fac的变化判断了有效性。并且,对于各组,通过tukey-kramer法进行多重比较,判定了fac变化的显著差异。将结果示于图5中。
在移植了高分子薄膜和细胞片的层叠体的组中,发现保持fac的值直至移植12周后,并保持心脏功能。另一方面,在sham组中,4只中3只在移植12周后因心力衰竭而死亡,且发现在移植12周后存活的个体的fac也大幅下降。
根据这些结果,示出了通过移植高分子薄膜和细胞片的层叠体来保持心脏功能,并具有提高存活率的效果。而且,在移植了高分子薄膜和细胞片的层叠体的组与移植了细胞片的组之间,未观察到fac值的显著差异,因此认为即使在移植了高分子薄膜和细胞片的层叠体的情况下,与移植了细胞片的情况相比,细胞移植的治疗效果也未受到阻碍。
(13)病理分析
用10质量%中性缓冲福尔马林固定移植后第12周的心脏之后,将其切成圆片并进行石蜡包埋,以3~4μm切成了薄片。将切片脱去石蜡之后,用0.3质量%过氧化氢加甲醇进行处理,并使用1%牛血清白蛋白(bsa)进行了粘连。混合单克隆抗骨骼肌球蛋白(monoclonalanti-skeletalmyosin)(fast)克隆(clone)my-32、小鼠腹水液(mouseascitesfluid)(sigma-aldrich公司制),并在冷藏中反应一夜,作为二次抗体,使用envision+duallinksystem-hrp(dako公司制),用二氨基联苯胺(dab)进行可视化,用苏木素进行了对比染色。将结果示于图6中。
其结果确认到,在移植了高分子薄膜和细胞片的层叠体的个体中,肌球蛋白重链阳性骨骼肌成肌细胞以层状残留。这些肌球蛋白重链阳性细胞具有骨骼肌细胞的特征性的肌节(sarcomere)结构,且认为是骨骼肌成肌细胞存活,并成熟为骨骼肌细胞。另一方面,在移植了细胞片的个体中,未确认到这种移植细胞的残留,因此认为通过移植高分子薄膜和细胞片的层叠体来良好地保持移植后的细胞的状态,提高包括血管新生的自心脏的血流供应,由此能够促进移植细胞的存活。
并且,在高分子薄膜和细胞片的层叠体的移植部周边,未观察到淋巴细胞等炎性单核细胞的累积,认为高分子薄膜能够无免疫原性地移植到心脏表面。
序列表
<110>富士胶片株式会社
<120>含有细胞片的层叠体、心脏疾病治疗剂及细胞片层叠用薄膜
<130>16f02151
<160>10
<170>patentinversion3.5
<210>1
<211>571
<212>prt
<213>recombinant
<400>1
glyalaproglyalaproglyleuglnglyalaproglyleuglngly
151015
metproglygluargglyalaalaglyleuproglyprolysglyglu
202530
argglyaspalaglyprolysglyalaaspglyalaproglyalapro
354045
glyleuglnglymetproglygluargglyalaalaglyleuprogly
505560
prolysglygluargglyaspalaglyprolysglyalaaspglyala
65707580
proglylysaspglyvalargglyleualaglyproileglypropro
859095
glygluargglyalaalaglyleuproglyprolysglygluarggly
100105110
aspalaglyprolysglyalaaspglyalaproglylysaspglyval
115120125
argglyleualaglyproileglyproproglyproalaglyalapro
130135140
glyalaproglyleuglnglymetproglygluargglyalaalagly
145150155160
leuproglyprolysglygluargglyaspalaglyprolysglyala
165170175
aspglyalaproglylysaspglyvalargglyleualaglypropro
180185190
glyalaproglyleuglnglyalaproglyleuglnglymetprogly
195200205
gluargglyalaalaglyleuproglyprolysglygluargglyasp
210215220
alaglyprolysglyalaaspglyalaproglyalaproglyleugln
225230235240
glymetproglygluargglyalaalaglyleuproglyprolysgly
245250255
gluargglyaspalaglyprolysglyalaaspglyalaproglylys
260265270
aspglyvalargglyleualaglyproileglyproproglygluarg
275280285
glyalaalaglyleuproglyprolysglygluargglyaspalagly
290295300
prolysglyalaaspglyalaproglylysaspglyvalargglyleu
305310315320
alaglyproileglyproproglyproalaglyalaproglyalapro
325330335
glyleuglnglymetproglygluargglyalaalaglyleuprogly
340345350
prolysglygluargglyaspalaglyprolysglyalaaspglyala
355360365
proglylysaspglyvalargglyleualaglyproproglyalapro
370375380
glyleuglnglyalaproglyleuglnglymetproglygluarggly
385390395400
alaalaglyleuproglyprolysglygluargglyaspalaglypro
405410415
lysglyalaaspglyalaproglyalaproglyleuglnglymetpro
420425430
glygluargglyalaalaglyleuproglyprolysglygluarggly
435440445
aspalaglyprolysglyalaaspglyalaproglylysaspglyval
450455460
argglyleualaglyproileglyproproglygluargglyalaala
465470475480
glyleuproglyprolysglygluargglyaspalaglyprolysgly
485490495
alaaspglyalaproglylysaspglyvalargglyleualaglypro
500505510
ileglyproproglyproalaglyalaproglyalaproglyleugln
515520525
glymetproglygluargglyalaalaglyleuproglyprolysgly
530535540
gluargglyaspalaglyprolysglyalaaspglyalaproglylys
545550555560
aspglyvalargglyleualaglyproprogly
565570
<210>2
<211>4
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>2
arggluaspval
1
<210>3
<211>5
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>3
tyrileglyserarg
15
<210>4
<211>5
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>4
proaspserglyarg
15
<210>5
<211>7
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>5
argtyrvalvalleuproarg
15
<210>6
<211>6
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>6
leuglythrileprogly
15
<210>7
<211>10
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>7
argasnilealagluileilelysaspile
1510
<210>8
<211>5
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>8
ilelysvalalaval
15
<210>9
<211>4
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>9
aspglygluala
1
<210>10
<211>4
<212>prt
<213>artificialsequence
<220>
<223>descriptionofartificialsequence:adhesivesequence
<400>10
gluargglyasp
1
权利要求书(按照条约第19条的修改)
1.(修改后)一种层叠体,其包含500μg/cm2~10mg/cm2的生物相容性高分子薄膜及配置在所述生物相容性高分子薄膜的至少一个表面上的细胞片,其中,
生物相容性高分子薄膜满足下述式1,
式1:(溶胀时膜厚/干燥时膜厚)×100≥-27.5×干燥时膜厚+880
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
2.(删除)
3.(修改后)根据权利要求1所述的层叠体,其中,
生物相容性高分子薄膜满足下述式2,
式2:(溶胀时膜厚/干燥时膜厚)×100≥-27.5×干燥时膜厚+962.5
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
4.(修改后)根据权利要求1或3所述的层叠体,其中,
生物相容性高分子薄膜的由下述式3表示的溶胀率为230%以上,
式3:(溶胀时膜厚/干燥时膜厚)×100
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
5.(修改后)根据权利要求1、3、4中任一项所述的层叠体,其中,
生物相容性高分子薄膜的干燥时膜厚为5~200μm。
6.(修改后)根据权利要求1、3~5中任一项所述的层叠体,其中,
生物相容性高分子薄膜的润湿时膜厚为50~500μm。
7.(修改后)根据权利要求1、3~6中任一项所述的层叠体,其中,
细胞为心肌细胞或骨骼肌成肌细胞。
8.(修改后)根据权利要求1、3~7中任一项所述的层叠体,其中,
生物相容性高分子为重组明胶。
9.根据权利要求8所述的层叠体,其中,
重组明胶由下述式4表示,
式4:a-[(gly-x-y)n]m-b
式中,a表示任意的氨基酸或氨基酸序列,b表示任意的氨基酸或氨基酸序列,n个x分别独立地表示氨基酸中的任一个,n个y分别独立地表示氨基酸中的任一个,n表示3~100的整数,m表示2~10的整数,另外,n个gly-x-y可以彼此相同,也可以不同。
10.根据权利要求8或9所述的层叠体,其中,
重组明胶由下述式5表示,
式5:gly-ala-pro-[(gly-x-y)63]3-gly
式中,63个x分别独立地表示氨基酸中的任一个,63个y分别独立地表示氨基酸中的任一个,另外,63个gly-x-y可以彼此相同,也可以不同。
11.根据权利要求8~10中任一项所述的层叠体,其中,
重组明胶具有(1)序列号1中所记载的氨基酸序列、或(2)与序列号1中所记载的氨基酸序列具有80%以上的序列同源性且具有生物相容性的氨基酸序列。
12.根据权利要求8~11中任一项所述的层叠体,其中,
重组明胶具有序列号1中所记载的氨基酸序列。
13.(修改后)一种心脏疾病治疗剂,其包含权利要求1、3~12中任一项所述的层叠体。
14.(修改后)一种细胞片层叠用薄膜,其由500μg/cm2~10mg/cm2的生物相容性高分子薄膜组成,生物相容性高分子薄膜满足下述式1,
式1:(溶胀时膜厚/干燥时膜厚)×100≥-27.5×干燥时膜厚+880
其中,溶胀时膜厚及干燥时膜厚的单位是μm。
- 还没有人留言评论。精彩留言会获得点赞!