利用由物理刺激引起的环境流入的细胞重编程方法与流程
本发明涉及利用由超声波处理、激光处理或热处理等的物理刺激引起的环境流入的细胞重编程方法。
支持本发明的韩国国家研究开发项目作为韩国保健福祉部及韩国保健产业振兴院主管的高科技医疗技术开发项目,技术课题的固有号码为“hi14c3297”,研究课题的名称为“在缺血性脑损伤模型中利用微rna追踪系统的体内干细胞分布及神经分化监测法的开发”,并得到主管机关的韩国天主教关东大学产学合作基金会的支持。
并且,支持本发明的韩国国家研究开发项目作为由韩国未来创建科学部及韩国研究基金会的主管的中型研究员支持项目,技术课题的固有号码为“2013r1a2a2a01068140”,研究课题的名称为“基于微rna的干细胞分化追踪辐射生物分子成像方法的开发”,并得到主管机关的韩国天主教关东大学产学合作基金会的支持。
背景技术
将体细胞重编程为其他类型的细胞、祖细胞及干细胞等的方法对于临床上的细胞治疗、疾病模型及移植来说属于重要技术。这种技术通过将目前几种多能基因及各种分化特异性表达基因等作为靶向的分子及化学方法来得到尝试。然而,以往的方法在稳定性和效率性方面上存在问题,具有过程复杂的缺点。
细胞暴露于各种环境中,这种环境随着细胞的更换在短时间或长时间内影响细胞的基因表达,而且因由环境变化引起的压力而调节细胞的基因表达程序。在细胞培养环境中,培养基成分包含各种物质和离子,这种环境的细胞内流入可以为能够促进细胞变化的革命性方法。然而,细胞在由磷脂组成的细胞膜的影响下因细胞培养基的各种成分中存在的极性程度及大小的多样性而难以实现细胞传达及流入。据报道,最近,在由超声波引起的微泡和空化(cavitation)效果的影响下能够导致外部环境的细胞内流入,据报道,超声波刺激对细胞发育起到积极效果。而且,还报道了三磷酸腺苷(atp)可以被超声波诱导并且这种三磷酸腺苷与细胞膜的受体进行反应来诱导物质输送。
在这方面,本发明人设计了利用如超声波等的物理刺激来暂时损坏体细胞膜的同时利用由超声波引起的培养基的空化效果来向细胞内传达各种物质的方法,由此开发了利用由物理刺激引起的环境流入的细胞重编程方法,其被称为“physicalstimulation-mediatedpermeationofenvironmentaltransitionguidedcellularreprogramming,enter细胞”,从而完成了本发明。
技术实现要素:
技术问题
本发明的目的在于,提供借助能够促进环境流入的物理刺激来使被分化细胞实现重编程的方法。
解决问题的手段
为了达到上述目的,本发明提供细胞的重编程方法,包括:向分化细胞或未分化细胞与培养基的混合物提供能够促进环境流入(environmentalinflux)的物理刺激的步骤;将接受上述物理刺激的混合物培养规定时间来获得重编程的细胞的步骤。
而且,本发明提供细胞的重编程方法,包括:向分化细胞或未分化细胞与培养基的混合物中提供能够促进环境流入的物理刺激的步骤;将接受上述物理刺激的混合物培养1天至6天的步骤;对从上述培养物中分离的包含外泌体的细胞外囊泡(extracellularvesicles)以及分化细胞或未分化细胞进行混合并培养规定时间来获得重编程的细胞的步骤。
发明的效果
在本发明中,在没有引入分化细胞的反分化的诱导因子及化学物质的情况下,向分化细胞提供能够促进如超声波处理、激光处理或热处理等的环境流入的、物理刺激,来使细胞仅在外部环境的流入下重编程为多能细胞或与分化细胞具有不同的表型的任意分化细胞,而且这种诱导的生产过程简单而有效,因此具有能够提高自体细胞治疗的可能性的效果。
附图说明
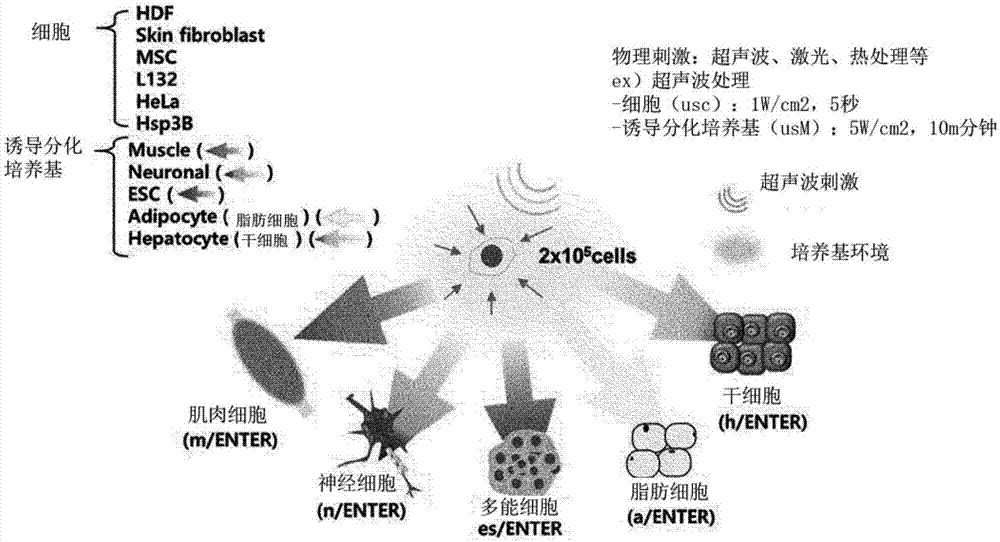
图1为示出对于本发明的各种利用由物理刺激引起的环境流入的细胞重编程(enter,environmentaltransitionguidedcellularreprogramming)细胞的重编程方法的示意图。
图2的(a)~(b)为显示由超声波刺激引起的细胞膜损伤及恢复的结果,图2的(a)为用扫描电子显微镜(sem,scanningelectronmicroscope)拍摄的细胞表面图像,图2的(b)为活/死试剂盒(活/死kit)染色图像。
图3的(a)~(c)为示出对细胞内ca流入分析(a)、三磷酸腺苷反应分析(b)及三磷酸腺苷受体基因表达进行逆转录聚合酶链式反应(rt-pcr)分析的结果(c)的图。
图4的(a)~(c)为示出利用qd605显示由超声波刺激引起的细胞内的外部物质流入可能性的结果的图,图4的(a)为示出在usmc-s(超声波暴露培养基和细胞(ultrasound-exposedmediumandcells))球状细胞和单细胞中的qd605流入分析结果的图,图4的(b)及图4的(c)为显示在各个环境条件下的usmc-s球状细胞(b)和单细胞(c)内的qd605流入分析及转录因子表达结果的图。
图5为示出对经过超声波处理的培养液内的外泌体的rna进行逆转录聚合酶链式反应分析的结果的图。
图6的(a)~(c)为示出由外泌体引起的物质传达的结果的图,图6的(a)为捕获由外泌体引起的qd605向另外细胞移动的过程的图像,图6的(b)为示出外泌体内的蛋白质标记的表达的图,图6的(c)为示出由外泌体引起的聚(poly)(a)27-cy5.5传达实验结果的图。
图7的(a)~(b)为示出根据经过超声波处理的细胞的培养液内外泌体和未经过超声波处理的细胞的共培养的、细胞的变化的图,图7的(a)为细胞形状随培养时间变化的图,图7的(b)为示出与外泌体进行培养6天的细胞内oct4的表达的结果的图。
图8为示出本发明的人真皮成纤维细胞的直接分化方法的图。
图9的(a)~(b)为示出在脂肪细胞诱导分化培养基中经过超声波处理的人真皮成纤维细胞被分化成脂肪细胞的结果的图,图9的(a)为示出被诱导分化后第20天的细胞的变化和脂肪细胞的油红o染色的结果的图,图9的(b)为示出对被诱导分化细胞的脂肪细胞标记基因表达进行逆转录聚合酶链式反应分析的结果的图。
图10的(a)~(c)为示出神经干细胞诱导分化培养基和经过超声波处理的人真皮成纤维细胞分化为神经祖细胞的结果的图,图10的(a)为示出被诱导分化后第3天的细胞的变化的图,图10的(b)为被诱导分化的神经祖细胞标记表达的图,图10的(c)为示出在附着的细胞中队神经祖细胞标记表达进行分析的结果的图。
图11为示出在诱导分化为神经祖细胞的细胞(n/enter细胞)中对pax6及巢蛋白(nestin)的表达进行分析的流式细胞术分析结果的图。
图12为示出作为n/enter细胞中的增殖标记的ki67表达的图。
图13的(a)为示出在n/enter细胞的单类球状中增殖细胞的过程的图,图13b为示出增殖的细胞中的神经祖细胞的属性保持结果的图。
图14的(a)~(b)为示出将n/enter细胞移植到小鼠的脑中后的分化的结果的图,图14的(a)为示出被移植的细胞(hna染色细胞)中的星形胶质细胞标记(gfap)的表达的图,图14的(b)为示出被移植后经过分化细胞中的突触蛋白(synl)的分泌的图。
图15的(a)~(c)为示出神经干细胞诱导分化培养基和由超声波刺激引起的mef分化成神经祖细胞的结果的图,图15的(a)为示出细胞形状变化的图,图15的(b)为示出类球状的神经祖细胞标记的表达的图,图15的(c)为示出利用流式细胞术的神经祖细胞标记的表达分析结果的图。
图16为从mef中诱导分化的神经祖细胞(小鼠n/enter细胞(mousen/entercells))的分化标记表达分析结果的图。
图17为示出肝细胞的直接分化的示意图。
图18的(a)~(b)为示成肝细胞诱导分化培养基和经过超声波处理的人皮肤成纤维细胞(hdf)分化成肝细胞的结果的图,图18的(a)为示出细胞形状变化的图,图18的(b)为示出肝细胞标记的表达的图。
图19的(a)~(c)为示出成肝细胞诱导分化培养基和经过超声波处理的hela细胞在肝细胞(helah/enter)中分化的结果的图,图19的(a)为示出细胞形状变化的图,图19的(b)为示出利用荧光定量聚合酶链式反应(qpcr)的肝细胞标记的表达结果的图,图19的(c)为免疫细胞化学方法的肝细胞标记的表达结果的图。
图20的(a)~(b)为示出成肝细胞诱导分化培养基和经过超声波处理的hep3b细胞分化成肝细胞(hep3bh/entercell)的结果的图,图20的(a)为示出细胞形状变化的图,图20的(b)为示出肝细胞标记的表达的图。
图21的(a)~(b)为示出人类es培养基和经过超声波处理的hdf分化成s/enter细胞的结果的图,图21的(a)为示出细胞形状变化的图,图21的(b)为示出oct4表达随培养时间变化的图。
图22的(a)~(b)为示出es/enter细胞中的多能性标记基因(a)及蛋白质(b)的表达的图。
图23的(a)~(c)为示出es/enter细胞中的多能属性分析结果的图,图23的(a)为示出利用流式细胞术的多能性标记分析结果的图,图23的(b)为示出微阵列分析的多能基因表达模式分析结果的图,图23c为示出利用亚硫酸氢盐测序法的oct4及nanog启动子与否形成甲基化的分析结果的图。
图24的(a)~(b)为示出es/enter细胞中的三胚层标记基因(a)及蛋白质(b)的表达的图。
图25为示出在不同培养时间上的es/enter细胞中的oct4及三胚层标记表达的变化的图。
图26的(a)~(b)为示出经过贴壁培养的es/enter细胞中的三胚层标记蛋白质的表达(a)及利用亚硫酸氢盐测序法的es/enter细胞的三胚层标记dna的甲基化分析(b)结果的图。
图27的(a)~(c)为示出es/enter细胞体外分化成神经细胞(a)、心肌细胞(b)及肝细胞(c)的结果图。
图28的(a)~(c)为示出从hdf中分析神经细胞(a)、心肌细胞(b)及肝细胞(c)标记的表达与否的结果的图。
图29的(a)~(c)为示出对被诱导分化的es/enter细胞的神经细胞(a)、心肌细胞(b)及肝细胞(c)分化标记基因表达进行逆转录聚合酶链式反应分析的结果图。
图30为示出根据es/enter细胞的染色体g-带分析的核型分析结果的图。
图31的(a)~(b)为示出es/enter细胞的肌肉移植及体内分化结果的图,图31a为示出被移植的细胞的分化成骨骼肌的分化结果的图,图31的(b)为示出被移植的细胞的oct4表达及增殖(k167)与否的图。
图32的(a)~(c)为示出es/enter细胞向小鼠脑内的移植及体内分化结果的图,图32的(a)为示出细胞被移植的坐标的图,图32的(b)为示出被移植的细胞的星形胶质细胞分化标记(gfap)和神经元标记物(突触蛋白,synl及vesicularglutamatetranspoter(vglutl))的分泌的图,图32的(c)为示出被移植的细胞的oct4表达和增殖(ki67)与否的图。
图33的(a)~(c)为示出根据人类es培养基和超声波刺激的mef分化成小鼠es/enter(小鼠es/enter)细胞的结果的图,图33的(a)为示出细胞形状及oct4-gfp表达随培养时间变化的图,图33的(b)为示出根据培养时间的球状细胞的形成率的图,图33的(c)为示出oct4表达的变化的图。
图34的(a)~(d)为示出小鼠es/enter细胞中的多能属性分析结果的图,图34的(a)为示出根据免疫细胞化学方法的多能性标记蛋白质的表达的图,图34的(b)为根据逆转录聚合酶链式反应的多能性标记基因的表达的图,图34的(c)为根据流式细胞术的多能性标记基因的表达比率分析结果的图,图34的(d)为示出小鼠es/enter细胞的碱性磷酸酶(ap)染色结果的图。
图35的(a)~(c)为示出在小鼠es/enter细胞中对三胚层特性进行分析的结果的图,图35的(a)为示出根据免疫细胞化学方法的三胚层标记的表达的图,图35的(b)及图35的(c)为示出在不同培养时间内的三胚层标记基因(b)及蛋白质(c)的表达模式的分析结果的图。
图36的(a)~(c)为示出小鼠es/enter细胞体外分化成神经细胞(a)、心肌细胞(b)的结果的图以及根据小鼠es/enter细胞的染色体g-带分析的核型分析结果(c)的图。
图37的(a)~(c)为示出根据人类es培养基和经过超声波刺激的l132细胞分化成l132es/enter细胞的结果的图,图37的(a)为示出细胞形状随培养时间变化的图,图37的(b)及图37的(c)为示出l132es/enter细胞的多能(b)及三胚层(c)属性的图。
图38的(a)~(c)为示出人类es培养基和经过超声波刺激的msc分化成msces/enter细胞的结果的图,图38的(a)为示出细胞形状随培养时间变化的图,图38的(b)及图38的(c)为示出msces/enter细胞的多能(b)及三胚层(c)属性的图。
图39的(a)~(c)为示出人类es培养基和经过超声波刺激的人皮肤成纤维细胞分化成sfes/enter细胞的结果的图,图39的(a)为示出细胞形状随培养时间变化的图,图39的(b)及图39的(c)为示出sfes/enter细胞的多能(b)及三胚层(c)属性的图。
图40的(a)~(c)为示出利用热处理和hes培养基的hdf分化成es/enter细胞的结果的图,图40的(a)为示出被诱导分化的hdf球状细胞的图,图40的(b)及图40的(c)为示出es/enter细胞的多能(b)及三胚层(c)属性的图。
图41的(a)~(c)为示出利用激光刺激和hes培养基的hdf分化成es/enter细胞的结果的图,图41的(a)为示出被诱导分化的hdf球状细胞的图,图41的(b)及图41的(c)为示出es/enter细胞的多能(b)及三胚层(c)属性的图。
图42为示出确认细胞外囊泡(evs)是否传递至正常体细胞的结果的图。
图43为示出确认根据evs的人成纤维细胞的重编程诱导与否的结果的图。
图44为示出在诱导es/enter时回收的经过evs处理的人成纤维细胞在不同培养时间内的细胞形状的变化的图。
图45为示出确认根据evs添加量的经过培养6天的hdf的oct4表达与否的flowcytometry分析结果的图。
图46的(a)~(b)为示出在当诱导es/enter时回收的经过evs处理且进行培养3天的hdf中确认多能性标记蛋白质(a:icc图像)及基因(b:荧光定量聚合酶链式反应分析)表达与否的结果的图。
图47的(a)~(b)为示出在当诱导n/enter时回收的经过evs处理且进行培养3天的hdf中确认神经干细胞标记蛋白质(a:icc图像)及基因(b:荧光定量聚合酶链式反应分析)表达与否的结果的图。
具体实施方式
以下,对本发明的结构进行详细的说明。
本发明的重编程方法,包括:向分化细胞或未分化细胞与培养基的混合物提供能够促进环境流入的物理刺激的步骤;将接受上述物理刺激的混合物培养规定时间来获得重编程的细胞的步骤。
本发明的特征在于,向分化细胞或未分化细胞提供能够促进如超声波处理、激光处理或热处理等的环境流入的物理刺激,并且在能够诱导所需的重编程的细胞的任意培养基中对分化细胞或未分化细胞进行培养,来能够用多能(pluripotency)细胞;或者上述分化或与未分化细胞具有不同的表型的任意的分化细胞,例如,肝细胞、成骨细胞、脂肪细胞、肌肉细胞、神经细胞、星形胶质细胞、角质细胞、毛囊细胞、胰腺β细胞或心肌细胞等来诱导细胞的重编程。
作为一实施例,在作为重编程的细胞的多能细胞的情况下,对分化细胞和干细胞培养基进行混合,并提供物理刺激来培养规定时间,从而分化细胞可重编程为多能细胞。
作为再一实施例,在与分化成重编程的细胞的细胞具有不同的表型的任意的分化细胞的情况下,对分化细胞和所需分化细胞的诱导分化培养基进行混合,并提供物理刺激来培养规定时间,从而分化细胞可重编程为具有不同的表型的任意的分化细胞。
作为另一实施例,对未分化细胞,例如诱导性多能干细胞或胚胎干细胞和所需分化细胞的诱导分化培养基进行混合,并提供物理刺激来培养规定时间,从而可以重编程为相对于以往技术的分化率得到改善的所需分化细胞。
在本发明的细胞的重编程方法中,由分化细胞或未分化细胞上的物理刺激引起的细胞外的环境流入诱导分化细胞或未分化细胞的重编程。这种环境流入意味着,来自接受物理刺激的分化细胞的遗传物质、化学物质、小分子、外泌体或包含外泌体的细胞外囊泡(extracellularvesicles);或者培养基成分等流入邻近的分化细胞或未分化细胞。
根据本发明的细胞的重编程方法,对于分化细胞或未分化细胞的环境流入可以确定稳定表达在多能性标记和三胚层标记的、多能细胞和与上述分化细胞或未分化细胞具有不同的表型的分化细胞上的重编程方向。
另外,重编程方向可以通过培养基的种类来确定。
即,如上所述,在分化细胞或未分化细胞中,对于多能细胞的重编程可以在向分化细胞与干细胞培养基的混合物提供物理刺激的情况下得到诱导,在分化细胞中,对于具有不同的表型的任意的分化细胞的重编程可以在向分化细胞和任意的分化细胞的诱导分化培养基的混合物提供物理刺激的情况下可以得到诱导,在未分化细胞和任意的分化细胞的诱导分化培养基的混合物提供物理刺激的情况下,可以重编程为任意的分化细胞。
相对于分化细胞或未分化细胞上的环境流入,本发明人尤其考虑到由物理刺激引起的细胞膜损伤和细胞分泌物质(外泌体或包含外泌体的细胞外囊泡)。即,由于超声波、激光、或热处理诱导由能量引起的温度上升、由超声波引起的微泡的震动、诱导液体的流动产生即沿着细胞膜的微流形成,由于这种效果导致细胞膜的微小损伤,进而诱导空穴产生,从而增加外部物质的吸收,其目的在于,当细胞膜的损伤或流动性增加时,通过细胞内的ca2+浓度变化即,细胞内的ca2+浓度变化分析,瞬间反应细胞内(cytosol)的ca2+浓度的增加来确认细胞膜的流动性的增加,根据本发明的一具体实施例,在经过超声波处理之后ca2+浓度急速增加,之后逐渐降低,并通过降低到未经过超声波处理的对照组的水平来可确认在诱导细胞膜的损伤之后得到恢复的情况。并且,据了解,通过对于具有多种由超声波引起的三磷酸腺苷产生及增加的细胞性压力的反应及与细胞膜内的三磷酸腺苷受体之间的反应,来诱导内吞作用。即,三磷酸腺苷浓度和细胞损伤及细胞内物质流入之间存在相关性,为了确认这些,在经过超声波处理后对细胞中的三磷酸腺苷浓度进行分析的结果发现与未处理的对照组相比三磷酸腺苷的浓度显著高。此外,与对照组相比,受到三磷酸腺苷的影响的细胞膜内离子p2x受体和代谢p2y受体表达在经过超声波处理的细胞内被激活。这些结果显示出由超声波引起的细胞内的损伤以及细胞外部环境的流入的可能性。
另一方面,据了解,在外泌体或包含外泌体的细胞外囊泡的内部包含遗传信息物质(dna、mrna、微rna、蛋白质),并且通过细胞膜的损伤露出于细胞膜外的、外泌体或包含外泌体的细胞外囊泡经过再次转入周边的其他细胞的过程之后,可传达存在于外泌体或包含外泌体的细胞外囊泡的内部的遗传基因物质。因此,在由超声波处理引起的刺激的影响下,在细胞内保持低表达状态或被控制的表达状态的多个多能性标记、多个三胚层标记或多个分化细胞标记的表达得到诱导或促进的同时,在细胞膜上产生损伤,从而存在于包含上述表达被诱导或促进的多个多能性标记、多个三胚层标记或多个分化细胞标记的、细胞内部的外泌体或包含外泌体的细胞外囊泡排出于外部并传达至周边细胞,而且周边细胞也处于部分细胞膜被损伤的状态,因此增加细胞膜的流动性,从而估计,与正常状态相比,外泌体或包含外泌体的细胞外囊泡向细胞内部转入的效率高,进而被认为通过传达存在于这种外泌体或包含外泌体的细胞外囊泡的内部的、上述表达被诱导或促进的与多能、产生、分化有关的遗传,来制备多能细胞或任意的分化细胞。在本发明的一具体实施例中,在诱导多能细胞的过程中回收培养基,并提取培养基内的外泌体或包含外泌体的细胞外囊泡之后确认在这些内部中是否存在与多能细胞相关的多能性标记或分化标记的结果,确认出已知的多个多能性标记、多个分化标记显示出高表达状态,由此被认为支持本发明人的这种假设。而且显示出在这种超声波处理、激光处理或热处理的情况下也是处于正常状态无畸形的核型。
通过这种假设能够实现如下步骤,即,通过由细胞膜的损伤引起的外泌体或包含外泌体的细胞外囊泡的释放诱导来制备多能细胞或分化细胞。
作为上述分化细胞可以使用:包含来自哺乳动物的真皮成纤维细胞、皮肤成纤维细胞等的体细胞;包含子宫癌细胞(hela)、肝癌细胞(hep3b)等的癌细胞;或者包含肺上皮细胞(l132cell)的器官组织细胞等。
在本说明书中,术语“体细胞”是指构成成体并具有有限的分化能力及自我生产能力的细胞。根据一实例,上述体细胞可以为构成哺乳动物的皮肤、毛发、脂肪的体细胞,优选地,可以为来自哺乳动物的成纤维细胞,但并不局限于此。
在本说明书中,术语“未分化细胞”是指具有分化能力及自我生产能力的细胞。例如,诱导性多能干细胞、胚胎干细胞、祖细胞等。
在本说明书中,术语“多能细胞”是指在经过物理刺激之后获得多能的细胞,在严格意义上,在经过超声波、激光、磁场、等离子体、发光二极管(light-emittingdiode)、电刺激、化学性暴露、热处理或酸处理之后获得多能的细胞。在本说明书中,上述多能整体是指稳定地表达从干细胞中表达的多能性标记的状态。另外,它指的是表达三种类的内胚层、外胚层及中胚层的三胚层标记的状态。上述多能细胞可以用作“embryonicstemcellmeaia-basedenvironmentaltransition-guidedcellularreprogramming(es/enter)细胞”。
在根据本发明的多能细胞中,诱导分化受到外部环境的局限性,在相对于干细胞的属性,具有强的分化属性的祖细胞(progenitorcell)的属性更强的部分上与已知的诱导性多能干细胞具有不同的特征。即,在将如诱导万能干细胞等的胚胎干细胞作为细胞治疗剂来使用的情况下,需要经过一定程度的分化过程的准备步骤,涉及变为癌的危险要素,而且存在在为了引入反诱导分化因子而使用病毒载体时的安全性问题,但本发明的多能细胞在不额外引入用于基因突变的反诱导分化因子或化学物质等的反诱导分化物质的情况下进行诱导,因此无需与其他种类的细胞进行共同培养的培养,从而不存在细胞污染(与其他细胞混合的问题)的问题,在体内实验中不形成类似于癌细胞的畸胎瘤,从而不存在癌症发生的问题,确保安全性。换句话说,本发明的多能细胞具有如下优点,即诱导过程短又简单,因此通过处理自我细胞来大大缩短直到移植的时间。
上述多能细胞的特征在于稳定地表达oct3/4、s0x2、nanog、c-myc、klf4、tdgf1、ssea4、tra-1-60、pax6、巢蛋白、鼠短尾突变体表型(brachyury)、sma、gata4或afp中的一种的多能性标记基因或由中胚层及内胚层构成的三胚层标记基因。
在本说明书中,术语“重编程(reprogramming)”是指从以无分化能力的细胞或具有一定的分化能力的细胞等的不同的形式来存在的分化细胞中最终能够恢复或转换成新型细胞或者具有新型分化潜能的状态的过程。而且还包括从具有分化能力的细胞最终能够转换成新型细胞的过程。根据本发明,当分化细胞受到能够促进环境流入的物理刺激时,可以重编程为多能细胞或与分化细胞具有不同的表型的所需的任意分化细胞。并且,当未分化细胞受到能够促进环境流入的物理刺激时,显示更好的分化率的同时可重编程为任意的分化细胞。
上述分化细胞可以包含,例如,用于表达pax6、sox1、sox2、巢蛋白、map2、tuj1、gfap或o4中的一种的神经细胞(称为“neuronalstemcellmedia-basedenter,n/enter”);用于表达结蛋白(desmin)、pax3、辅肌动蛋白(actinin)、sma、gata4或nkx2-5中的一种的肌肉细胞(称为“muscledifferentiationmedia-basedenter,m/enter”);用于表达afp、hnfla、hnf4a、ck18或alb中的一种的肝细胞(称为“hepatocytedifferentiationmedia-basedenter,h/enter”);或者用于表达pparc2、c/ebpa、ap2或fabp4中的一种的脂肪细胞(称为“adipocytedifferentiationmedia-basedenter,a/enter”),但并不局限于此。
在本说明书中,“培养基”在整体上是指使用于体外细胞培养的培养基,在本发明中意味着干细胞培养基或诱导分化培养基,上述干细胞培养基更具体地意味着胚胎干细胞培养基。而且,“诱导分化培养基”为使用于一般的干细胞的分化细胞上的诱导的培养基,例如,可以使用专能干(multipotent)细胞诱导分化培养基、成肝细胞诱导分化培养基、成骨诱导分化培养基、脂肪细胞诱导分化培养基、肌肉细胞诱导分化培养基、星形胶质细胞诱导分化培养基、神经元细胞诱导分化培养基、血管内皮细胞诱导分化培养基、角质细胞诱导分化培养基、胰腺β细胞诱导分化培养基或心肌细胞诱导分化培养基等,但并不局限于此。
参考图1,对本发明的细胞的重编程方法进行详细说明。
首先,对培养基以及分化细胞或未分化细胞进行混合,并向上述混合物提供物理刺激。
在向包含分化细胞或未分化细胞的混合物中提供物理刺激之前,向培养基提供物理刺激来可提高细胞的重编程效率。
上述物理刺激可以为超声波、激光、等离子体、发光二极管、电刺激、化学性暴露、热处理或酸处理中的一种。
在上述培养基的超声波处理中,可以照射输出强度为lw/cm2至20w/cm2的超声波1分钟至20分钟,具体地,可以照射输出强度为2w/cm2至10w/cm2的超声波5分钟至15分钟,更具体地,可以照射输出强度为3w/cm2至7w/cm2的超声波7分钟至13分钟。
在对于培养基的激光处理中,可以照射300nm至900nm的波长范围的脉冲激光束1分钟至20分钟,更具体地,可以照射上述波长范围的脉冲激光束3分钟至10分钟,更具体地,可以照射上述波长范围的脉冲激光束4分钟至6分钟。在上述波长范围中,可以使用例如400nm、808nm、880nm的波长。
在对于培养基的热处理中,可以在40℃至50℃的温度的条件下进行5分钟至20分钟。
当向分化细胞或未分化细胞提供物理刺激时,能够以规定的强度来使之得到暴露,当超过此范围时,细胞的存活力可能会减少。
因此,在对于培养基以及分化细胞或未分化细胞的混合物的超声波处理中,可以用输出强度为0.5w/cm2至3w/cm2来照射1秒钟至5秒钟,更具体地,可以用输出强度为0.7w/cm2至2w/cm2来照射1秒钟至5秒钟,更具体地,可以用输出强度为0.8w/cm2至1.5w/cm2来照射1秒钟至5秒钟。
在对于培养基以及分化细胞或未分化细胞的混合物的激光处理中,可以照射300nm至900nm的波长范围的脉冲激光束1秒钟至20秒钟,更具体地,可以照射上述波长范围的脉冲激光束3秒钟至10秒钟,更具体地,可以照射上述波长范围的脉冲激光束4秒钟至6秒钟。在上述波长范围中,可以使用例如400nm、808nm、880nm的波长。
在对于培养基以及分化细胞或未分化细胞的混合物的热处理中,可以在40℃至50℃的温度条件下暴露1分钟至10分钟之后,在0℃至4℃的温度条件下暴露5秒钟至10秒钟。
其次,将接受物理刺激的混合物培养规定时间来获得重编程的细胞。
对于接受物理刺激的混合物的培养可以进行在形成借助悬浮培养(suspendedculture)或贴壁培养(monolayerculture)方式稳定地表达多能性标记或分化标记的球状细胞的期间,即,在2天至10天内,但不特别限制于此。
根据本发明的一具体实施例,悬浮培养显示出比贴壁培养更高的球状细胞形成效率。而且,悬浮培养与贴壁培养相比球状细胞的数量大,显示规定的大小分布。
根据本发明的一具体实施例,在经过超声波或激光处理的人皮肤成纤维细胞的悬浮培养的情况下,多能性标记或分化标记的表达约从第3天开始增加或稳定,并且从该时期开始重编程。而且,在经过热处理的人皮肤成纤维细胞的悬浮培养的情况下,多能性标记的表达从约第8天开始增加或稳定,并且从该时期开始重编程。
可通过上述多能性标记,例如,oct3/4、sox2、nanog、c-myc、klf4、tdgf1、ssea4、tra-1-60等的表达来确认球状细胞具有多能的情况。可通过逆转录聚合酶链式反应或免疫细胞化学方法来分析多能性标记的确认,但不特别局限于此。
而且,本发明的多能细胞的特征在于,以高水平来表达三胚层标记,即,外胚层(pax6、巢蛋白)标记、中胚层(鼠短尾突变体表型、sma)标记、内胚层(gata4、afp)标记。
在其他具体实施例中,在诱导分化培养基中向皮肤成纤维细胞提供物理刺激的情况下,在进行培养后的约1天至20天内可形成球状细胞。
在用神经细胞进行重编程的情况下,分化标记可以为pax6、sox1、sox2、巢蛋白、map2、tujl、gfap或o4中的一种以上。
在用肌肉细胞进行重编程的情况下,可以为结蛋白、辅肌动蛋白、pax3、sma、gata4或nkx2-5中的一种以上。
在用肝细胞进行重编程的情况下,可以为afp、hnfla、hnf4a、ck18或alb中的一种以上。
在用脂肪细胞进行重编程的情况下,可以为能够进行油红o染色且pparc2、c/ebpa、ap2或fabp4中的一种。
而且,本发明的多能细胞的特征在于,通过表达作为增殖标记蛋白质的ki-67来产生增殖能力。
而且,当上述重编程的多能细胞与营养细胞进行共培养时,可能增加多能细胞的增殖。
而且,本发明的细胞的重编程方法还可包括在诱导分化培养基中对上述多能细胞进行培养的步骤。根据上述诱导分化培养基的种类,多能细胞可以分化为所需的分化细胞。
作为上述诱导分化培养基可以使用专能干(multipotent)细胞诱导分化培养基、成肝细胞诱导分化培养基、成骨诱导分化培养基、脂肪细胞诱导分化培养基、肌肉细胞诱导分化培养基、星形胶质细胞诱导分化培养基、神经细胞诱导分化培养基、血管内皮细胞诱导分化培养基、角质细胞诱导分化培养基、胰腺β细胞诱导分化培养基或心肌细胞诱导分化培养基等,但不特别局限于此。
而且,本发明涉及细胞的重编程方法,包括:向分化细胞或未分化细胞与培养基的混合物提供能够促进环境流入的物理刺激的步骤;将接受上述物理刺激的混合物培养1天至6天的步骤;将从上述培养物中分离的包含外泌体的细胞外囊泡(extracellularvesicles)和分化细胞或未分化细胞进行混合并培养规定时间来获得重编程的细胞的步骤。
本发明的细胞的重编程方法的特征在于,将从受到物理刺激的分化细胞或未分化细胞中分离的包含外泌体的细胞外囊泡以及分化细胞或未分化细胞培养规定时间,来重编程为任意的分化细胞。
上述包含外泌体的细胞外囊泡向分化细胞或未分化细胞与培养基的混合物提供能够促进环境流入的物理刺激,并将接受上述物理刺激的混合物培养1天至6天之后可利用离心分离技术来回收。
以上描述了对上述分化细胞或未分化细胞的物理刺激,为了避免重复省略其说明。
上述包含外泌体的细胞外囊泡可表达oct3/4、sox2、nanog、c-myc、klf4、tdgf1、ssea4、tra-1-60、pax6、巢蛋白、鼠短尾突变体表型、sma、gata4或afp中的一种的多能性标记或三胚层标记;pax6、巢蛋白、soxl、sox2、map2、tujl、gfap或o4中的一种的神经细胞标记;结蛋白、pax3、辅肌动蛋白、sma、gata4或nkx2-5中的一种的肌肉细胞标记;afp、hnfla、hnf4a、ck18或alb中的一种的肝细胞标记;或者能够进行油红o染色的、pparc2、c/ebpa、ap2或fabp4中的一种的脂肪细胞标记。
例如,在上述包含外泌体的细胞外囊泡包含多能性标记的情况下,若与分化细胞进行培养则上述分化细胞可重编程为多能细胞。而且,在上述包含外泌体的细胞外囊泡包含分化标记的情况下,若与分化细胞进行培养则可重编程为具有不同表型的任意的分化细胞。而且,在上述包含外泌体的细胞外囊泡包含分化标记的情况下,若与未分化细胞进行培养则可重编程为任意的分化细胞。
根据本发明的一具体实施例,在染色有作为在诱导es/enter时回收的外泌体标记的cd63的、细胞外囊泡(evs)中确认了各种多能性标记的表达,并且在经过上述evs处理的正常人类体细胞中进行培养3天后,得到多能性标记的oct4、sox2及nanog的表达并确认了细胞的重编程。
而且,在染色有作为在诱导n/enter时回收的外泌体标记的cd63的、细胞外囊泡(evs)中,确认了如pax6等的神经干细胞的标记的表达,在经过上述evs处理的正常人类体细胞中进行培养3天后,确认了作为神经干细胞标记的soxl、sox2、pax6、巢蛋白的表达。
而且,在染色有作为在诱导m/enter时回收的外泌体标记的cd63的、细胞外囊泡(evs)中,确认了如pax3等的肌肉细胞标记的表达,在染色有作为在诱导h/enter时回收的外泌体标记的cd63的、细胞外囊泡(evs)中,确认了如hnfla等的肝细胞标记的表达。
因此,可以看出受到物理刺激的分化细胞或未分化细胞可分泌包含重编程因子的细胞外囊泡,将这些对分化细胞或未分化细胞进行处理,并借助悬浮培养方式或贴壁培养方式培养1天至20天,来可重编程为任意的多能细胞或分化细胞。
作为可通过本发明的细胞的重编程方法来重编程的细胞可以为上述种类的多能细胞或分化细胞,为了避免重复记载省略其说明。
以下,参考实施例,对本发明进行详细的说明。但以下实施例只是用于说明本发明,本发明的内容并不局限于以下实施例。
实施例1.由物理刺激引起的细胞内环境流入的证明实验
本实施例是对于由物理刺激引起的细胞内环境流入的证明实验,为此,对于细胞,将从英杰(invitrogen)中购入primaryhdf细胞在添加有10%fbs(gibco)和1%的青霉素(penicillin)/链霉素(streptomycin)(gibco)的dmem(dulbecco'smodifiedeaglemedium)中进行培养,对于培养液的超声波处理在5w/cm2条件下进行10分钟,对于细胞处理,在l×106的细胞上在lw/cm2条件下处理5秒钟之后,与经过处理的培养液一起在35mm的培养皿中培养了2×105的细胞。
为了分析扫描电子显微镜图像,将未处理的hdf细胞和用如上所述的方法来被处理之后在37℃的温度下,在5%的co2培养箱中进行培养2小时的细胞,用4%的多聚甲醛在4℃温度下固定12小时之后,用0.1%的鞣酸溶液处理1小时,在1%的四氧化锇溶液中处理2小时之后,用不同浓度的丙酮进行脱水之后,用液体co2来干燥细胞,并使之固定在涂敷于金钯的表面,并用电子显微镜(1555vp-fesem,carlzeiss)观察了细胞。
为了分析活/死图像,对于细胞,在未处理的hdf和在经过超声波处理之后在37℃温度下,在5%的co2培养箱中进行培养2小时的细胞上用活/死活力/细胞毒性测定试剂盒(live/deadviability/cytotoxicityassaykit)(美国俄勒岡尤金分子探针(molecularprobes,eugene,or,usa))来进行了染色。在染色过程中,在活细胞中添加2μm的钙黄绿素(活细胞染色染料(livecellstainingdye))及4μm的乙锭同型二聚体(ethd-l,死细胞染色染料(deadcellstainingdye))的细胞培养液之后,在37℃温度下,在5%的co2培养箱中进行培养30分钟之后,在荧光显微镜(ix3-zdc,olympus)分析了红色荧光(ethd-1染色,死亡或损伤的细胞,excitation/emission,528/617nm)和绿色荧光(calcein染色,活细胞,excitation/emission,494/517nm)。
如图2的(a)部分所示,在超声波的影响下细胞膜受到损伤,从而形成能够进入外部环境空穴,如此损伤在2小时后得到了恢复。
而且,在经过超声波刺激之后,为了确认损伤的细胞及细胞的恢复而利用用于分析细胞死亡的活/死试剂盒来对细胞进行了染色。
如图2的(b)部分所示,在细胞中处理超声波之后,在处理之后进行染色,在经过2小时后进行染色的结果,在处理之后,观察到了绿色荧光和红色荧光共存的细胞,在2小时之后,显示红色荧光的细胞数量显著减少,如图2的(a)部分所示,当细胞膜得到恢复时,红色荧光开始减少。
由此,虽然因受到超声波刺激而产生细胞损伤,但能够得到恢复,像这样认为,通过由刺激引起的细胞膜的损伤来能够实现培养基的环境流入,进而分析了由细胞内的物质流入引起的现象。
另一方面,在图2中,usmc(超声波暴露培养基和细胞)是指在各个细胞及培养基上处理超声波的情况,usmc-s意味着得到悬浮培养的usmc。
实施例2.对于由物理刺激引起的细胞内外部物质流入的证明实验
测量了对细胞内外部物质流入敏感的细胞内钙浓度的变化,并为了确认根据由超声波引起的三磷酸腺苷产生的物质流入可能性而用逆转录聚合酶链式反应分析了已知的通过细胞内三磷酸腺苷测定和三磷酸腺苷反应来使细胞膜内受体开通细胞膜外部物质流入通道的、三磷酸腺苷受体的表达。
利用faluo-4th新钙测定试剂盒(fluo-4nwcalsiumassaykit)(分子探针)进行了钙浓度分析。将未处理的hdf细胞和在直接用超声波(lw/cm2,5秒钟)处理之后暴露于经过超声波处理的培养基(5w/cm2,10分钟)上的细胞(usmc-s)与每个试剂盒内的部件中的分析缓冲液进行混合,并在每个96-孔板的孔上分配3×l04细胞后,在每个孔和fluo-4nw试剂进行混合后,用varioskan闪光荧光微孔板荧光计(varioskanflashfluorescentmicroplatefluorometer)(美国萨诸塞州沃尔瑟姆赛默飞世尔科技(thermofisherscientific,waltham,ma,usa))以10秒钟的间隔测量了在激发波长为494nm/释放波长为516nm范围内的荧光15分钟。
三磷酸腺苷利用腺苷5'-三磷酸(adenosine5'-triphosphate)(三磷酸腺苷)生物发光测定试剂盒(bioluminescentassaykit)来测量了三磷酸腺苷。对于细胞,将未处理的细胞和在用超声波(lw/cm2,5秒钟)直接处理后暴露于经过超声波处理的培养基(5w/cm2,10分钟)上的细胞(usmc-s)与每个试剂盒内的部件中的分析缓冲液进行混合,并在每个96-孔板的孔上分配3×l04细胞后,在每个孔上分配100μl的三磷酸腺苷分析混合物和三磷酸腺苷标准物质,并在常温下培养3分钟后用varioskan闪光荧光微孔板荧光计(赛默飞世尔科技公司)测量了发光强度。
在用于分析三磷酸腺苷受体表达的逆转录聚合酶链式反应中,在经过处理的细胞中利用rneasy加小试剂盒(plusminikit)(德国希尔登凯杰公司(qiagen,hilden,germany))来提取rna,用试剂盒(superscripiikit)(美国加州卡尔斯巴德英杰(invitrogen,carlsbadca,usa))合成cdna。对于聚合酶链式反应,在聚合酶链式反应预混料(韩国大田柏业(bioneer,daejeon,korea))中混合cdna和引物后,利用热循环式聚合酶链式反应仪(thermalcyclerdicepcrmachine)(tp600,takara,otsu,japan)进行如下条件,即在95℃温度下变性5分钟;在95℃温度下进行30秒钟;在梯度(gradient)(50~65℃)条件下进行30秒钟及在72℃温度下在1分钟内循环35次;以及在72℃温度下进行15分钟。
表1
p2受体的聚合酶链式反应引物列表
如图3所示,在受到超声波刺激后细胞内的钙流入增加至60秒钟,在60分钟后细胞内的三磷酸腺苷浓度增加到最大值,细胞膜内的三磷酸腺苷受体的表达也在1小时及4时间后增加。这些因受到超声波刺激而最初向细胞内流入外部物质的情况可通过钙的浓度的增加来得到确认,可知,在超声波的影响下产生三磷酸腺苷,由此三磷酸腺苷受体受到反应来开通细胞膜的通道,从而能够流入外部物质。
实施例3.由利用qd605的物理刺激引起的细胞内的外部物质的流入证明实验
作为外部物质使用qd605,并确认qd605是否被超声波流入到细胞内。qd605为一种荧光纳米材料,已知其对或细胞的渗透性差,由此确认了由利用qd605的超声波引起的细胞内的外部物质的流入。
为此,如实施例1向hdf施加超声波刺激后,处理l00pmol的qd605,并在24小时后,在单细胞和球状细胞确认了qd605的存在。
如图4所示,在未受到超声波刺激的hdf中未观察到荧光。然而,在受到超声波刺激的hdf中观察到荧光。
而且,为了确认对于由外部物质流入导致的细胞变化的可能性,在各个培养基环境(es,neuroprogenitor,hepatocyte,muscle)中处理超声波之后,放入l00pmol的qd605并在24小时后,通过icc来确认了各个分化过程上的转录因子(es:oct4,neuroprogenitor:pax6,hepatocyte:hnfla,muscle:pax3)的表达。
如图4的(b)部分及图4的(c)部分所示,从各个流入外部物质(qd605)的细胞及球状细胞中观察到了转录因子。这说明因外部物质的流入而可能产生细胞的重编程。
在实验过程中,在4个环境流入样本中仅es/enter和n/enter形成了球状细胞。然而,m/enter和h/enter未形成球状细胞。这种情况在于细胞的特性和培养基组成。在es和神经祖细胞的情况下,在悬浮培养过程中形成球状细胞或类球状细胞,但在肌肉细胞和肝细胞的情况下,未形成球状细胞。其原因在于,在诱导分化过程中,使之附着于被涂敷的培养皿中进行培养,尤其,在肌肉细胞的培养基中流入有fbs,但由于fbs起到提高细胞附着力的作用,因此不形成球状细胞。
实施例4.对于受到物理刺激的细胞培养液内的外泌体的分析
由超声波引起的细胞刺激不能向所有细胞施加同样的刺激,因此细胞的重编程可能发生在部分细胞,并考虑了这些改变的细胞和那些不改变细胞之间的细胞交换的可能性。最近,参考了根据外泌体的细胞之间的物质交换的可能性,从经过超声波处理的细胞中排出的培养基内的外泌体可能包含遗传物质,由于从重编程的细胞中分泌的物质中可能包含对重编程起到重要作用的遗传物质,在按照培养时间交换培养基时对在经过超声波处理后进行培养的培养基内的外泌体进行回收,并用amiconultra-0.5是结合(密理博(millipore))提取培养液内的外泌体的rna,用superscripiikit(美国加州卡尔斯巴德英杰)合成cdna。对于聚合酶链式反应,在聚合酶链式反应预混料(韩国大田柏业)中混合cdna和引物后,利用热循环式聚合酶链式反应仪(日本大津宝生tp600(tp600,takara,otsu,japan))进行如下条件,即在95℃温度下变性5分钟;在95℃温度下进行30秒钟;在梯度(gradient)(50~65℃)条件下进行30秒钟及在72℃温度下在1分钟内循环35次;以及在72℃温度下进行15分钟(表2)。
如图5所示,在外泌体的rna中确认了多能rna的表达。
另一方面,在图5中,usmc是指对各个细胞及培养基进行超声波处理的情况,usmc-a是指经过贴壁培养的usmc。
表2
多能性标记基因的聚合酶链式反应引物列表
实施例5.利用外泌体传达物质的证明实验
在上述实施例4中,在经过超声波处理的细胞的培养液内的外泌体中确认了多能性标记的表达,因此确认了通过这种外泌体来传达遗传物质及蛋白质。
在经过超声波处理后添加qd605来拍摄了活细胞的图像的结果,如图6的(a)部分所示,确认出在经过7小时45分钟时流入有qd605的细胞的qd605与细胞质的一部分一起脱落,并移动到其他细胞中的现象。
像这样被脱落的细胞质的一部分预计是外泌体,将经过usmc处理的细胞暴露于各种培养基环境中之后,在4%的多聚甲醛中固定10分钟,并在包含0.1%的聚乙二醇辛基苯基醚(tritonx-100)的磷酸缓冲盐溶液(pbs)中浸泡40分钟。用包含5%(v/v)的山羊血清的磷酸缓冲盐溶液溶液封闭1小时,在4℃温度下用第一抗体对作为外泌体标记的cd63(1:100,圣克鲁斯生物技术(santacruzbiotechnology))和作为通过各个诱导分化培养基来得到诱导的细胞的初始表达标记的胚胎干细胞(oct41:200;nanog1:200;abeam)、神经干细胞(pax6,1:200;abeam)、肌肉细胞(pax3,1:200;abeam)及肝细胞(hnfla,1:200;细胞信号技术(cellsignalingtechnology))等进行了染色过夜。并且,用包含0.03%的聚乙二醇辛基苯基醚的磷酸缓冲盐溶液缓冲液清洗,在常温下对与第二抗体alexa-488或-594结合的抗-兔抗体、抗-小鼠抗体(1:1000,thermo,excitation/emission,495/519nm,excitation/emission,590/617nm)进行染色1.5小时后,用包含0.03%的聚乙二醇辛基苯基醚的磷酸缓冲盐溶液缓冲液清洗,并用包含dapi的安装溶胶(美国加州伯林盖姆维百奥实验室公司(vectorlaboratories,inc.,burlingame,ca),excitation/emission,420/480nm)来进行安装之后用共聚焦激光荧光显微镜(lsm700;carlzeiss)分析了图像。
如图6的(b)部分所示,预测为露出于细胞周边的细胞质的一部分的部分被cd63染色,在诱导es/enter时用作为外泌体标记的cd63进行染色的细胞外囊泡(evs)中,确认出如oct4、nanog等的多能细胞标记的表达,在诱导n/enter时用作为外泌体标记的cd63进行染色的细胞外囊泡(evs)中,确认出如pax6等的神经干细胞的标记的表达,在诱导m/enter时用作为外泌体标记的cd63进行染色的细胞外囊泡(evs)中,确认出如pax3等的肌肉细胞标记的表达,在诱导h/enter时用作为外泌体标记的cd63进行染色的细胞外囊泡(evs)中,确认出如hnfla等的肝细胞标记的表达。
根据上述结果,假设了从细胞质中外泌体被脱落,这些包含遗传物质和蛋白质,并传达至周边细胞来可诱导周边细胞的变化。为了证明这一点,提取外泌体,并将外泌体用cd63进行染色(染色是为区分新注射的外泌体而实施,因为外泌体也可存在于培养中的细胞中)之后,在外泌体中流入在该外泌体内修饰poly(a)27-cy5.5的遗传物质之后,与未处理的hdf一起进行培养,此时认为可通过外泌体传达poly(a)27-cy5.5。
如图6的(c)部分所示,在细胞内中发现了用cd63进行染色的外泌体,并且像cd63一样确认了cy5.5的表达。这意味着由外泌体注射的基因(poly-a)被传达。
实施例7.受到物理刺激的细胞和正常细胞的共培养
由外泌体可传达遗传物质,因此假设从人类es培养基中培养的细胞中分泌的外泌体可以改变周边的细胞或未处理的细胞的属性,为了证明这一点,在将从人类es培养基环境中培养的经过超声波处理的细胞培养2天的培养基中提取外泌体,并在对未被作为人类es培养基和成纤维细胞培养基的dmem处理的细胞进行培养的过程中,混合外泌体提取物来进行培养6天。
其结果,在添加有外泌体的组中,产生了球状细胞(图7的(a)部分),确认了该细胞中的oct4表达的结果,观察到作为多能性标记的oct4的表达(图7的(b)部分)。这意味着根据外泌体的遗传物质的传达可以诱导细胞重编程。
实施例8.成纤维细胞的直接重编程
在上述实施例1至实施例7中,证明了通过培养基环境的变化进行细胞重编程并对周边细胞也可进行重编程的事实,基于此,通过适用各种培养基环境来确认了细胞的重编程。
为此,如图8所示,将人成纤维细胞收集到lml的诱导分化培养基中的l×l06细胞中后,用超声波以lw/cm2的强度来处理5秒钟后,在35mm培养皿或6-孔板中分成2×l05/well后,在用超声波以10w/cm2的强度处理10分钟的2ml的诱导分化培养基中进行培养。
尽管根据诱导分化培养基的种类而不同,但进行培养后约2天至6天之间形成了球状细胞。
而且,利用脂肪细胞诱导分化培养基来处理usmc后进行培养20天的结果,观察到细胞内产生了气泡,通过气泡分析发现,作为用于鉴别脂肪细胞的脂质染色试剂的油红o被染色。这是表示细胞产生脂肪的指标(图9的(a)部分)。
而且,提取细胞的rna之后利用逆转录聚合酶链式反应来确认脂肪细胞标记基因、pparc2、c/ebpa、ap2、fabp4的表达的结果,显示出在诱导分化后表达得到增加(图9的(b)部分)。
而且,为了确认神经干细胞(神经祖细胞)诱导分化培养基和由超声波引起的hdf的神经祖细胞的的分化,在经过诱导分化后第3天产生的球状细胞和附着的细胞中通过免疫细胞化学染色确认了神经祖细胞标记、oct4、sox2、pax6、巢蛋白的表达。
图10的(a)部分为诱导分化细胞的状态,图10的(b)部分为显示球状细胞中的神经祖细胞标记的图,确认出若诱导分化则oct4的表达减少,sox2和pax6而且巢蛋白的表达高。图10的(c)部分为显示从附着的细胞中的表达的结果,显示了如上所述的表达模式。此时,神经祖细胞或神经干细胞的标记为sox2、pax6、巢蛋白,oct4作为多能性标记,在成体干细胞或祖细胞的情况下oct4的表达降低。
表3
诱导分化培养基的组成
在图11中,通过流式细胞术分析了在诱导分化后经过7天的诱导分化细胞中的pax6/巢蛋白的表达模式的结果,在经过处理后的第一天pax6和巢蛋白的表达为50%以上,第3天pax6、巢蛋白的表达最高。
在图12中,诱导分化后的第3天为了从细胞中表达神经祖细胞标记(pax6/巢蛋白)的细胞中确认增殖与否,而确认ki67的表达的结果,在观察白色箭头所示的细胞时,可确认出在表达巢蛋白的细胞中具有ki67的表达。这些结果表明诱导分化细胞具有增殖能力。图12中的箭头表示被巢蛋白染色的细胞正在增殖。
图13显示了确认诱导分化细胞(n/entercells)的自我更新(self-renewal)的实验结果,图13的(a)部分作为视频,确认了从1个球状细胞开始增殖的细胞表达pax6和巢蛋白,可知向之后增殖的细胞原样传达神经祖细胞属性。
其次,在5周龄的小鼠的脑上注射诱导分化细胞(n/entercells),并经过4周后回收脑之后确认对于注射的细胞的周边细胞的分化,并确认了分化细胞的功能。
如图14的(a)部分所示,用humannuclearantigen(hna)染色注射在脑的细胞(n/entercells)并标记之后,对标记的细胞进行染色gfap抗体的结果,注射的细胞中确认了gfap的表达。
并且,为了确认具有gfap表达的细胞是否正常运作,是否分泌突触蛋白(synapsin)而用突触蛋白1抗体(1:500,r&dsystem)进行了染色。其结果,从在表达有hna的细胞中表达有gfap的细胞中观察到突触蛋白1的表达(图14的(b)部分)。
其次,在诱导分化后第3天产生的球状细胞中利用免疫细胞化学染色确认了神经祖细胞标记(oct4、sox2、pax6、巢蛋白)的表达。
为此,将球状细胞和附着的细胞在4%的多聚甲醛中固定10分钟,并在包含0.1%的聚乙二醇辛基苯基醚的磷酸缓冲盐溶液中浸泡40分钟。用包含5%(v/v)的山羊血清的磷酸缓冲盐溶液封闭1小时,在4℃温度下用第一抗体对作为oct4(1:200)、sox2(1:200)、pax6(l;200)、巢蛋白(1:200,细胞信号技术)等进行染色过夜。并且用包含0.03%的聚乙二醇辛基苯基醚的磷酸缓冲盐溶液缓冲液清洗,在常温下对与第二抗体alexa-488或-594结合的抗-兔抗体、抗-小鼠抗体(1:1000,thermo,excitation/emission,495/519nm,excitation/emission,590/617nm)进行染色1.5小时后,用包含0.03%的聚乙二醇辛基苯基醚的磷酸缓冲盐溶液缓冲液清洗,并用包含dapi的安装溶胶(美国加州伯林盖姆维百奥实验室公司,excitation/emission,420/480nm)来进行安装之后用共聚焦激光荧光显微镜(lsm700;carlzeiss)分析了图像。
在图15的(a)部分中确认球状细胞的形成,确认出在球状细胞中作为神经祖细胞标记的pax6及巢蛋白的表达高(图15的(b)部分)。
图15的(c)部分显示了通过流式细胞术对在诱导分化后经过3天的诱导分化细胞中的pax6/巢蛋白的表达模式进行分析的结果,在处理后的第一天pax6和巢蛋白的表达为70%以上,第3天pax6、巢蛋白的表达最高。
图16现实了在诱导分化后经过20天的细胞中用免疫细胞化学染色确认神经祖细胞标记(sox2、pax6、巢蛋白)的表达的结果,上端及中间的图像表示sox2和pax6以及巢蛋白的表达高,下端图像为少突胶质细胞标记的表达的结果,同样表示如上所述的表达模式。
此结果意味着诱导分化细胞具有类似于神经祖细胞分化能力的分化能力。
实施例9.直接肝细胞分化
如图17的示意图所示,将hdf细胞、hela细胞及hep3b细胞收集到lml的诱导分化培养基中的l×l06细胞中后,用超声波以lw/cm2强度处理5秒钟后,在35mm的层粘连蛋白(laminin)涂敷培养皿中分成2×l05/孔后,在用超声波以10w/cm2强度处理10的2ml的成肝细胞诱导分化培养基中进行培养。将利用成肝细胞诱导分化培养基诱导分化细胞命名为h/enter。
在图18中,诱导了成肝细胞诱导分化培养基和经过超声波处理的hdf的肝细胞(h/enter)的分化。并且显示了诱导分化hdf20天后的细胞外形的变化,在hdf诱导分化20天后,通过免疫细胞化学方法确认肝细胞标记(afp、hnf4a、ck18、alb)的结果,从h/enter细胞中确认了肝细胞标记的表达。
其次,诱导了成肝细胞诱导分化培养基和经过超声波处理的hela细胞的肝细胞(helah/enter)的分化。并且显示了诱导分化hela细胞19天后的细胞(helah/enter)外形的变化,诱导分化hela细胞20天后,通过(helah/enter)荧光定量聚合酶链式反应确认了肝细胞标记(alb、hnf4a、cyp3a4f、cyp3a7f、aiat、sox7、gata6)。
如图19的(a)部分所示,确认出与hela细胞相比,在诱导分化的hela细胞中大多数肝细胞标记得到增加。
而且,在诱导分化hela细胞3周后通过免疫细胞化学方法确认肝细胞标记(hnf4a、ck18、alb)的结果,确认出与hela细胞相比,在分化的hela细胞(helah/enter)中肝细胞标记的表达得到增加(图19的(b)部分)。
在诱导分化hela细胞3周后通过免疫细胞化学方法确认肝细胞标记(hnf4a、ck18、alb)的结果,确认出与hela细胞相比,在分化的hela细胞(helah/enter)中肝细胞标记的表达得到增加(图19的(c)部分)。
其次,又到了成肝细胞诱导分化培养基和经过超声波处理的hep3b细胞的肝细胞(hep3bh/entercell)的分化。在诱导分化hep3b细胞19天后,在细胞外形的变化和诱导分化hep3b细胞3周后通过免疫细胞化学确认了肝细胞标记(hnf4a、ck18、alb)的表达与否。
如图20的(b)部分所示,确认出与hep3b细胞相比,从分化的hep3b细胞(hep3bh/enter)中肝细胞标记的表达得到增加。
其次,诱导了人类es培养基和经过超声波处理的hdf的es/enter细胞的分化。图21的(a)部分显示细胞形状随培养时间变化的结果,图21的(b)部分显示根据培养时间的oct4表达的差异的结果,在诱导分化人类es培养基后第1天形成球状细胞,作为多能性标记的oct4的表达随培养时间增加。
回收经过6天培养来形成的球状细胞并通过逆转录聚合酶链式反应和icc确认了多能性标记的表达。其结果,在es/enter细胞中确认了多能性标记基因(a)及蛋白质(b)的表达。
在上述es/enter细胞中分析多能属性的结果,利用流式细胞术确认了es/enter细胞的ssea4和tra-1-60的表达(图23的(a)部分),用微阵列分析(affymetrixchip)对多能基因表达的模式进行分析的结果,与hdf相比显示出类似于es细胞的模式(图23的(b)部分)。并且,确认在通过亚硫酸氢盐测序法来表达的dna基因中开始合成的启动子部分的甲基化是否被松散的结果,确认出重要的多能基因oct4和nanog被开放。从这些结果可以看出,诱导分化为人类es培养基的es/enter具有多能属性(图23c)。
表4
用于甲基化分析的亚硫酸氢盐测序法引物列表
其次,在es/enter细胞中确认了分化标记。图24显示了在es/enter细胞中的三胚层标记基因的表达(a)和蛋白质表达(b),图25显示了在不同培养时间中的es/enter细胞中的oct4和三胚层标记基因表达的变化,图26为利用贴壁培养的es/enter细胞中的三胚层标记蛋白质的表达(a)及亚硫酸氢盐测序法的es/enter细胞的三胚层标记dna甲基化分析(b)的结果。
表5
分化标记基因的聚合酶链式反应引物列表
在es/enter球状细胞中通过逆转录聚合酶链式反应和icc确认了三胚层标记的表达,这些结果为显示es/enter细胞具有多分化的分化属性的指标。
因此,确认作为根据培养时间的多能性标记的oct4的表达模式的结果,确认出6天后多能属性的oct4的表达降低,三胚层标记的表达得到增加。这种结果显示es/enter细胞在多能属性中进行分化。由此确认出来自从附着es/enter球状细胞后培养2天的球状细胞的细胞对三胚层标记进行表达,并对代表性的三胚层标记基因的dna甲基化进行分析的结果,确认出三胚层标记基因处于开放状态。
图27为对于es/enter细胞的神经细胞(a)、心肌细胞(b)及肝细胞(c)的体外分化实验的结果,利用将es/enter细胞诱导分化为各个三胚层中分化细胞的培养基,来诱导分化4周的结果,诱导分化为神经细胞(外胚层)、心肌细胞(中胚层)、肝细胞(内胚层),表达了各个分化标记。
图28为从hdf中确认神经细胞(a)、心肌细胞(b)及肝细胞(c)的分化标记的表达的结果,在hdf中未表达分化标记。
图29为显示诱导分化的es/enter细胞的神经细胞(a),心肌细胞(b)及肝细胞(c)的分化标记基因的表达的逆转录聚合酶链式反应分析结果,诱导分化的es/enter中的分化标记基因的表达得到增加。这些结果为证明es/enter的多分化能力的结果。
图30为显示根据es/enter细胞的染色体g-带分析的核型的结果,在产生es/enter时,对由超声波刺激引起的细胞染色体突变与否进行分析的结果,显示正常。
其次,在将es/enter细胞移植到5周龄的scid小鼠的腿部肌肉后的4周后,利用hna确认了移植的细胞。
如图31所示,确认出es/enter细胞分化成骨骼肌肉。并且,确认出被移植的细胞中的oct4未进行表达及增殖。
其次,将es/enter细胞移植到小鼠的脑并确认了体内分化。为此,在将es/enter细胞移植到5周龄的scid小鼠的脑中后的4周后,利用hna确认了移植的细胞。
其结果,确认出es/enter细胞分化成星形胶质细胞(gfap),并确认出分泌突触蛋白和vesicularglutamatetranspoter。这意味着被移植的细胞通过正常分化来执行功能。并且,确认出被移植的细胞中的oct4未进行表达,而且未进行增殖(图32)。
其次,在mef(小鼠胎儿成纤维细胞)的情况下,用如hdf的方法的hes培养基诱导分化成小鼠es/enter细胞。用于这次实验的mef为og2-mef,用将oct4启动子作为载体成为转基因的小鼠胎儿成纤维细胞进行了实验。在此细胞的情况下,在表达oct4时,这些细胞用于观察表达gfp荧光的细胞中oct4的表达。
如图33所示,在通过超声波处理来被诱导的细胞中,球状细胞的数量和大小以及gfp表达随时间增加。
其次,在上述小鼠es/enter细胞中分析了多能属性。
如图34所示,小鼠es/enter的icc、逆转录聚合酶链式反应、流式细胞术、ap染色显示出与小鼠es相似的趋势。
其次,在上述小鼠es/enter细胞中分析了三胚层特性。
实验结果,在小鼠es/enter细胞中也观察到人类es/enter中显示的三胚层属性,按照不同培养时间,通过逆转录聚合酶链式反应和icc分析上述表达随时间变化。该结果与人类es/enter的结果相同(图35)。
在图36中,利用小鼠es/enter的神经细胞(a)和心肌细胞(显示体外分化,图36c显示了根据小鼠es/enter的染色体g带分析的核型分析结果。核型分析为gtg带染色体分析(gtgbandingchromosomeanalysis)(韩国首尔gendix公司)来进行了实验。
实验结果,通过从小鼠es/enter细胞中确认神经细胞及心肌细胞分化标记来确认分化,并通过对由超声波引起的染色体突变进行核型分析的结果确认出未有突变。
实施例10.利用其它细胞的es/enter的诱导分化实验
通过这些结果,总结出该方法不仅用于hdf而且可用于其他个体的细胞,并适用于各种细胞(l132、msc、患者皮肤成纤维细胞)。
利用l132(肺上皮细胞)、msc(mesenchymalstemcell,间充质干细胞)及skinfibroblast(来自患者的皮肤成纤维细胞)等与es/enter相同的方法诱导分化的结果,形成了细胞球状细胞,并类似于es/enter,显示出多能性标记及三胚层标记的表达。
图37显示通过人类es培养基和经过超声波刺激的l132细胞分化成l132es/enter细胞的结果,图37的(a)部分显示细胞形状随培养时间变化的结果,图37的(b)部分及图37的(c)部分显示l132es/enter细胞的多能(b)及三胚层(c)属性。
图38显示通过人类es培养基和经过超声波刺激将msc分化成msces/enter细胞的结果,图38的(a)部分显示细胞形状随培养时间变化的记过,图38的(b)部分及图38的(c)部分显示msces/enter细胞的多能(b)及三胚层(c)属性。
图39显示通过人类es培养基和经过超声波刺激将人皮肤成纤维细胞分化成sfes/enter细胞的结果,图39的(a)部分显示细胞形状随培养时间变化结果,图39的(b)部分及图39的(c)部分显示sfes/enter细胞的多能(b)及三胚层(c)属性。
实施例11.利用其它物理刺激诱导分化es/enter细胞
在与上述相同的培养基环境的人类es培养液中使用了作为用于诱导分化的物理刺激使用了热处理(heatshock)和激光。
首先,利用热处理(heatshock)和hes培养基诱导了hdf的es/enter细胞的分化。为了热处理,在42℃温度下暴露hdf2分钟后,在冰上淬火约5秒钟。图40的(a)部分显示诱导分化的hdf球状细胞,图40的(b)部分及图40的(c)部分显示es/enter细胞的多能(b)及三胚层(c)属性。
其次,利用激光刺激和hes培养基诱导了hdf的es/enter细胞的分化。对于激光处理条件,使用了用于治疗ocla的激光(ndlux),并用808nm的激光照射5秒钟后进行了培养。图41的(a)部分显示诱导分化的hdf球状细胞,图41的(b)部分及图41的(c)部分显示es/enter细胞的多能(b)及三胚层(c)属性。
如图40及图41所示,两个刺激均形成类似于超声波的效果形成有细胞球状细胞,并确认出多能及三胚层标记的表达。这些结果表明,由培养基环境流入而导致的细胞重编程可适用于各种细胞,除了培养基环境之外,还可以使用用于环境流入的物理刺激以及各种方法,并且像以往的结果一样,通过环境可以改变细胞的属性。
实施例12.利用细胞外囊泡(extracellularvesicles,evs)的细胞的重编程
对于细胞,将从英杰购入的primaryhdf在添加有10%的fbs(gibco)和1%的青霉素/链霉素(penicillin/streptomycin)(gibco)的dmem中进行培养,对于培养基的超声波处理在5w/cm2条件下进行10分钟,对于细胞处理,在l×106的细胞上在lw/cm2条件下处理5秒钟之后,与上述超声波处理的培养基一起在35mm的培养皿中在37℃温度下,在5%的co2条件下培养了2×l05的细胞1天。回收培养液后放入超滤管超滤离心管(amiconultracentrifugalfilter)(密理博(millipore)),并在14000rpm条件下进行离心分离20分钟,并用过滤器过滤培养液内的evs并回收。
其次,培养hdf以在培养皿中填充约70~80%后,回收培养液并用d-磷酸缓冲盐溶液清洗2次后,在各个胚胎干细胞培养基或神经干细胞分化培养基(gibco)中添加从第一天的es/enter和n/enter的培养基中回收的10μl/ml(v/v)的浓缩evs后,与上述清洗的hdf进行混合并培养3天。
实施例13.正常体细胞(hdf)中的evs的传达实验
为了确认利用evs的体细胞的重编程,如上述实施例12所示,浓缩将受到物理刺激的细胞培养1天后获得的evs之后,利用diddye标记evs,并向正常体细胞传达上述evs,从被传达的细胞中确认出各个作为多能性标记的oct4和作为神经干细胞标记的pax6的表达。
为此,将从上述实施例12中获得的evs50/w与d-磷酸缓冲盐溶液450/w进行混合并稀释,在此添加2.5μl的细胞标记溶液(vybrantdidcell-labellingsolution)(分子探针,excitation/emission,644/667nm),并在37℃温度下对外泌体进行染色30分钟。染色后再次用超滤管超滤离心管(密理博)在14000rpm条件下,进行离心分离20分钟来浓缩did染色的evs后,用d-磷酸缓冲盐溶液反复稀释2次后,添加到3ml的hdf培养液(包含5%的fbs的dmem(gibco)培养液)后,在37℃条件下,在5%的co2条件下培养24小时。将培养24小时的hdf用4%的多聚甲醛(paraformaldehyde)固定10分钟,并用0.2%的triton×100in磷酸盐缓冲液透化10分钟。之后,在4℃温度下用3%的牛血清蛋白(bsa)磷酸盐缓冲液封闭1小时后,用作为第一次抗体的兔-抗体oct4(1:250,abeam)和pax6(l:200,abeam)进行染色过夜后,用作为第2次2抗体的抗-兔缀合的alexa-488(1:1000,thermo,excitation/emission,495/519nm)进行染色1小时。对染色有2次抗体的样本,用包含dapi(4',6-二脒基-2-苯基二氢吲哚(4',6-diamidino-2-phenylindoiedihvdrochlonde),维百奥实验室,excitation/emission,420/480nm)的安装溶胶来对共聚焦激光扫描显微镜(共聚焦激光扫描显微镜(confocallaserscanningmicroscope),lsm700;carlzeiss)的图像进行分析并在图42中显示结果。在附图中,绿色显示oct4,红色显示用染料染色(diddye)进行染色的evs。
如图42所示,确认出经过物理刺激后从细胞中分泌的evs根据细胞培养基环境包含各种多能性标记的基因及蛋白质,确认出这种因子可根据evs传达到邻近的细胞。上述结果表明,从在各种培养基环境中受到物理刺激的细胞中分泌的evs可能会诱导正常体细胞的重编程。
实施例14.由evs导致的人成纤维细胞的重编程效果
在上述实施例13中,从在各种培养基环境中受到物理刺激的细胞中分泌的evs可能会诱导正常体细胞的重编程,因此为了鉴证这一点,使用作为人成纤维细胞培养基的dmem培养基和作为人类胚胎干细胞或ips细胞的培养基的hesc培养基来进行了实验。对于对照组,在未添加evs的各个培养基中培养3天,对于处理组,在各个培养基中添加10μl/ml(v/v)的evs并培养3天。
如上述实施例13所述,培养的细胞为兔-抗体-oct4(1:250,abeam)作为第一次抗体,作为第二次抗体使用抗兔缀合的alexa-488(1:1000,excitation/emission,495/519nm)并进行染色,并用包含dapi的安装溶胶安装后,用共聚焦激光显微镜分析图像并显示在图43中。在附图中,hesc为人类esc培养基,dmem为成纤维细胞培养基,evs显示在诱导es/enter时回收的evs。
如图43所示,在对照组中未观察到oct4的表达,但在处理组中观察到oct4的表达和细胞形成球状细胞的现象。上述结果表明,细胞重编程仅由evs诱导,而不是由培养基诱导。
实施例15.经过evs处理的人成纤维细胞在不同培养时间上的形状的变化
将在诱导es/enter时回收的10μl/ml(v/v)的evs在人成纤维细胞中处理之后培养6天,并观察细胞的形状变化。
如图44所示,细胞的形状随培养时间变化,在第3天观察到形成球状细胞。
实施例16.根据在诱导es/enter时回收的evs添加量培养6天的hdf的多能性标记表达确认实验
为了确定用于细胞重编程的evs的最佳浓度,将evs的添加量改变为hdf并培养6天。而且,由于使用在诱导es/enter时回收的evs,因此用流式细胞术(flowcytometry)对表达作为多能性标记的oct4的细胞进行了分析。
为此,将在用在诱导es/enter时回收的evs在成纤维细胞中培养时,用0μl/ml、5μl/ml、12.5μl/ml、25μl/ml、50μl/ml及100μl/ml(v/v)的各个浓度来添加并在37℃温度下,在5%的co2条件下培养6天。如上述实施例13所示,经过培养的细胞为兔-抗体-oct4(l:250,abcam)作为第一次抗体,作为第二次抗体使用抗兔缀合的alexa-488(1:1000,excitation/emission,495/519nm)并进行染色,并利用bdaccuritmc6flowcytometry(bdbiosciences)进行了分析。
如图45所示,当处理12.5μl/ml(v/v)的evs时,在84.6%的细胞中检测到oct4的表达。
实施例17.经过在诱导es/enter时回收的evs处理的培养3天的hdf中的多能性标记表达确认实验
将在诱导es/enter时回收的10μl/ml(v/v)的evs在人成纤维细胞中处理之后培养3天,并确认细胞重编程效果。如上述实施例13所示,为了对经过培养的细胞进行icc分析,作为第一次抗体使用兔-抗体-oct4(l:250,abcam)、sox2(1:250,abcam)及nanog(1:250,abcam),作为第二次抗体使用抗兔缀合的alexa-488(1:1000,thermoexcitation/emission,495/519nm),并用包含dapi的安装溶胶安装后,用共聚焦激光显微镜分析了图像。对于荧光定量聚合酶链式反应分析,在经过培养3天的细胞中用trizol(takara)回收整个rna后,用superscrip2kit(英杰)合成cdna。对于聚合酶链式反应分析,用逆转录聚合酶链式反应仪器(absteponeplus,ab)对作为多能性标记的oct4、sox2及nanog进行了分析。
如图46所示,icc分析结果,在人成纤维细胞核中观察到作为多能性标记的oct4、sox2及nanog的表达,用逆转录聚合酶链式反应对基因表达进行荧光定量聚合酶链式反应分析的结果,oct4、sox2及nanog基因与未处理evs的正常成纤维细胞相比过表达约50倍。
实施例18.经过在诱导n/enter时回收的evs处理的培养3天的hdf中的神经干细胞标记表达确认实验
将在诱导n/enter时回收的10μl/ml(v/v)的evs在人成纤维细胞中处理后培养3天,并确认细胞重编程效果。如上述实施例13所示,为了对经过培养的细胞进行icc分析,作为第一次抗体使用兔-抗体-soxl(l:200,abcam)、sox2(1:250,abcam)、pax6(1:200,abcam)及小鼠-抗-巢蛋白(1:250,thermoscientific),作为第二次抗体使用抗-兔缀合的alexa-488(1:1000,thermoexcitation/emission,495/519nm)及抗-小鼠缀合的alexa-594(1:1000,thermo,alexa488excitation/emission,495/519nm;alexa594excitation/emission,590/617nm),用包含dapi的安装溶胶安装后,用共聚焦激光扫描显微镜分析了图像。对于荧光定量聚合酶链式反应分析,在经过培养3天的细胞中用trizol(takara)回收整个rna后,用superscrip2kit(invitrogen)合成cdna。对于聚合酶链式反应分析,用逆转录聚合酶链式反应仪器(absteponeplus,ab)对作为神经干细胞标记的sox1、sox2、pax6及巢蛋白进行了分析。
如图47所示,通过icc分析,从人成纤维细胞核中观察到作为神经干细胞标记的soxl、sox2及pax6的表达,从细胞质中观察到巢蛋白的表达。用逆转录聚合酶链式反应对基因表达进行荧光定量聚合酶链式反应分析的结果,soxl,sox2,pax6及巢蛋白基因与未经过evs处理的正常成纤维细胞相比过表达约200倍。
表6
荧光定量聚合酶链式反应引物列表
产业上的可利用性
本发明可以使用于细胞治疗剂的领域。
- 还没有人留言评论。精彩留言会获得点赞!