氨甲环酸环烯烃杂质的合成方法及氨甲环酸环烯烃杂质的应用与流程
本发明涉及化学合成
技术领域:
,尤其是涉及一种氨甲环酸环烯烃杂质的合成方法及氨甲环酸环烯烃杂质的应用。
背景技术:
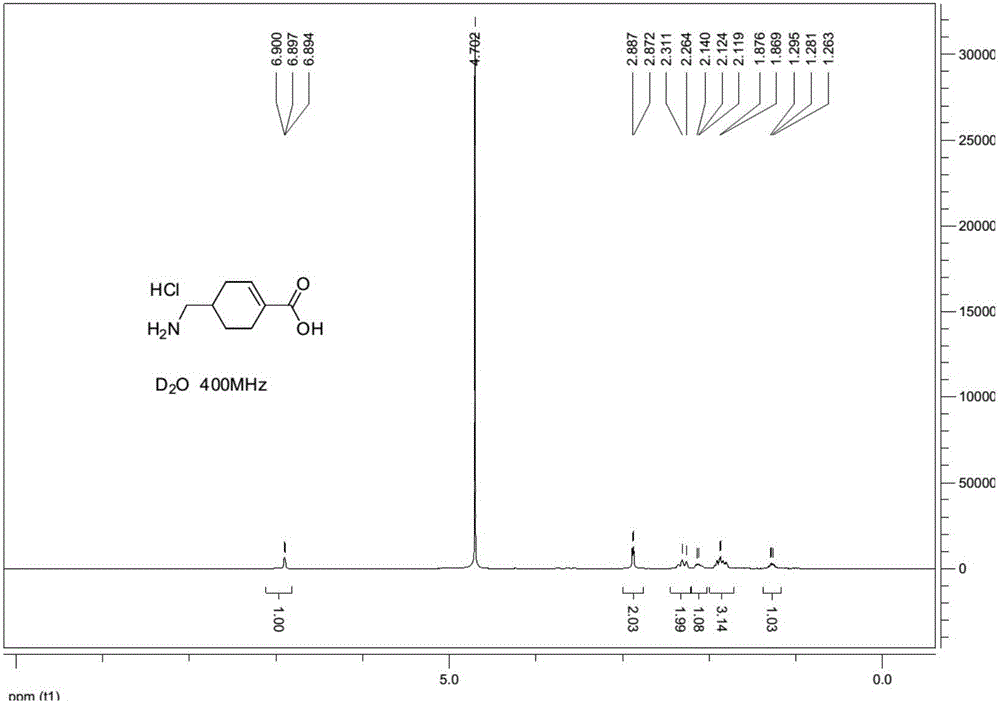
:氨甲环酸,又称传明酸,其英文名称为:TranexamicAcid,其化学名称为:对氨甲基环己烷甲酸或者反式-4-氨甲基-环己烷甲酸。氨甲环酸主要用于主要用于急性或慢性、局限性或全身性纤维蛋白溶解亢进所致的各种出血。氨甲环酸的质量标准在我国药典中有所记载,其中明确指出可能含有环烯烃杂质,英国药典也明确记载了氨甲环酸中环烯烃杂质的结构。现有技术中,已经公开了多种氨甲环酸质量控制的检测方法,以检测包括氨甲环酸环烯烃在内的多种杂质的含量,但是现有技术中,尚未公开氨甲环酸环烯烃杂质的高效合成方法。氨甲环酸环烯烃杂质是氨甲环酸质量控制中非常重要的杂质,对氨甲环酸杂质的相关研究意义重大。因此,提供一种氨甲环酸环烯烃杂质的高效合成方法,能够弥补现有技术中的不足,为氨甲环酸的质量控制提供合格、廉洁、易得的对照品,为安全用药提供重要的指导意义。因此,特提出本发明。技术实现要素:本发明的目的在于提供氨甲环酸环烯烃杂质的合成方法,从而为氨甲环酸的质量控制提供杂质对照品。本发明提供了一种氨甲环酸环烯烃杂质的合成方法,所述合成反应包括以下步骤:(1)式I所示结构的化合物和邻苯二甲酸酐,在第一有机溶剂中发生酰胺化反应,生成式II所示结构的化合物;(2)式II所示结构的化合物和二氯亚砜,在第二有机溶剂中发生酰氯化反应,得到式III所示结构的化合物;(3)式III所示结构的化合物和溴,在第三有机溶剂中发生取代反应,得到式IV所示结构的化合物;(4)式IV所示结构的化合物和有机醇,发生酯化反应,得到式V所示结构的化合物;(5)式V所示结构的化合物,在脱卤化氢试剂作用下,在第五有机溶剂中发生脱卤化氢反应,得到式VI所示结构的化合物;(6)式VI所示结构的化合物和浓盐酸,发生水解反应,得到式VII所示结构的化合物,即氨甲环酸环烯烃杂质,所述氨甲环酸环烯烃杂质为式VII所示结构的化合物;其中,R基团为C1-C5的烷基。进一步的,步骤(2)中,所述酰氯化反应中还加入催化剂N,N-二甲基甲酰胺;步骤(3)中,所述取代反应中还加入催化剂红磷。进一步的,步骤(1)中,所述第一有机溶剂为冰乙酸;步骤(2)中,所述第二有机溶剂为二氯乙烷或者氯仿;步骤(3)中,所述第三有机溶剂为二氯乙烷或者氯仿;步骤(4)中,所述有机醇为甲醇或者乙醇,所述R基团为甲基或者乙基;步骤(5)中,所述第五有机溶剂为四氢呋喃或者1,4-二氧六环,所述脱卤化氢试剂为1,8-二氮杂双环[5.4.0]十一碳-7-烯;步骤(6)中,所述水解反应在第六有机溶剂中进行,所述第六有机溶剂为1,4-二氧六环。进一步的,步骤(1)中,所述酰胺化反应的反应温度为115-120℃;步骤(2)中,所述酰氯化反应的反应温度为80-85℃;步骤(3)中,所述取代反应的反应温度为80-85℃;步骤(4)中,所述酯化反应的反应温度为45-55℃;步骤(5)中,所述脱卤化氢反应的反应温度为65-70℃;步骤(6)中,所述水解反应的反应温度为110-120℃。进一步的,步骤(1)中,所述酰胺化反应的反应温度为118℃;步骤(2)中,所述酰氯化反应的反应温度为83℃;步骤(3)中,所述取代反应的反应温度为83℃;步骤(4)中,所述酯化反应的反应温度为50℃;步骤(5)中,所述脱卤化氢反应的反应温度为67℃;步骤(6)中,所述水解反应的反应温度为115℃。进一步的,步骤(1)中,所述式I所示结构的化合物、所述邻苯二甲酸酐、所述第一有机溶剂的摩尔数比为1:0.8-1.2:20-40;步骤(2)中,所述式II所示结构的化合物、所述二氯亚砜、所述第二有机溶剂、所述N,N-二甲基甲酰胺的摩尔数比为1:2-3:8-15:0.02-0.06;步骤(3)中,所述式III所示结构的化合物、所述溴、所述红磷的摩尔数比为1:2-2.5:0.3-0.8;步骤(4)中,所述式IV所示结构的化合物、所述有机醇的摩尔数比为1:90-100;步骤(5)中,所述式V所示结构的化合物、所述脱卤化氢试剂、所述第五有机溶剂的摩尔数比为1:1.3-2.0:50-70;步骤(6)中,所述式VI所示结构的化合物、所述浓盐酸、所述第六有机溶剂的摩尔数比为1:8-12:38-45。进一步的,步骤(1)中,所述式I所示结构的化合物、所述邻苯二甲酸酐、所述冰乙酸的质量为1:1:27;步骤(2)中,所述式II所示结构的化合物、所述二氯亚砜、所述二氯乙烷、所述N,N-二甲基甲酰胺的质量比为1:2.4:11:0.04;步骤(3)中,所述式III所示结构的化合物、所述溴、所述红磷的质量比为1:2.2:0.5;步骤(4)中,所述式IV所示结构的化合物、所述甲醇的质量比为1:95;步骤(5)中,所述式V所示结构的化合物、所述脱卤化氢试剂、所述四氢呋喃的质量比为1:1.75:56;步骤(6)中,所述式VI所示结构的化合物、所述浓盐酸、所述四氢呋喃的质量比为1:9.7:42.4。进一步的,步骤(1)中,所述酰胺化反应的反应时间为2.5-3.5h;步骤(2)中,所述酰氯化反应的反应时间为1-2h;步骤(3)中,所述取代反应的反应时间为100-150h;步骤(4)中,所述酯化反应的反应时间为0.5-1.5h;步骤(5)中,所述脱卤化氢反应的反应时间为50-70h;步骤(6)中,所述水解反应的反应时间为100-200h。进一步的,步骤(1)中,所述酰胺化反应的反应时间为3h;步骤(2)中,所述酰氯化反应的反应时间为1.5h;步骤(3)中,所述取代反应的反应时间为130h;步骤(4)中,所述酯化反应的反应时间为1h;步骤(5)中,所述脱卤化氢反应的反应时间为60h;步骤(6)中,所述水解反应的反应时间为120h。另外本发明的另一目的在于提供一种按照所述的合成方法合成的氨甲环酸环烯烃杂质在制备氨甲环酸杂质对照品中的应用,以为氨甲环酸的质量控制提供杂质对照品。本发明提供的氨甲环酸环烯烃杂质的合成方法以氨甲环酸和邻苯二甲酸酐为原料,经过酰胺化反应、酰氯化反应、取代反应、酯化反应、脱卤化氢反应、水解反应等步骤,能够得到纯度高、结构正确的氨甲环酸环烯烃杂质。另外,本发明提供了按照所述方法合成的氨甲环酸杂质在制备氨甲环酸杂质对照品中的应用,为氨甲环酸的质量控制提供了合格、廉价、易得的杂质对照品。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明实施例6合成的化合物VII的氢谱图。具体实施方式下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明提供了一种氨甲环酸环烯烃杂质的合成方法,包括以下步骤:(1)式I所示结构的化合物和邻苯二甲酸酐,在第一有机溶剂中发生酰胺化反应,生成式II所示结构的化合物;(2)式II所示结构的化合物和二氯亚砜,在第二有机溶剂中发生酰氯化反应,得到式III所示结构的化合物;(3)式III所示结构的化合物和溴,在第三有机溶剂中发生取代反应,得到式IV所示结构的化合物;(4)式IV所示结构的化合物和有机醇,发生酯化反应,得到式V所示结构的化合物;(5)式V所示结构的化合物,在脱卤化氢试剂作用下,在第五有机溶剂中发生脱卤化氢反应,得到式VI所示结构的化合物;(6)式VI所示结构的化合物和浓盐酸,发生水解反应,得到式VII所示结构的化合物,即氨甲环酸环烯烃杂质。在一个优选的实施方式中,步骤(1)还包括对反应生成的式II所示结构的化合物的纯化,具体为:酰胺化反应结束后,待反应液降至室温,加水,析出固体过滤、烘干,得到的白色固体即为式II所示结构的化合物。其中加入水的体积(mL)为式I所示结构的化合物的质量(g)的10-20倍,优选15倍。在另一个优选的实施方式中,步骤(4)还包括对反应生成的式V所示结构的化合物的纯化,具体为:酯化反应结束后,反应液减压蒸馏除去甲醇,向反应液中加入乙酸乙酯,依次用水、饱和碳酸氢钠溶液、饱和氯化钠溶液洗涤,再用无水硫酸钠干燥、过滤,浓缩干,得到的淡黄色固体即为式V所示结构的化合物。在另一个优选的实施方式中,步骤(5)还包括对反应生成的式VI所示结构的化合物的纯化,具体为:托卤化氢反应结束后,待反应液降至室温,向溶液中加入同体积的石油醚,垫硅胶过滤,再用二氯甲烷和石油醚的混合溶剂冲洗硅胶柱,将所有溶液浓缩干,得到的白色固体即为式VI所示结构的化合物。在另一个优选的实施方式中,步骤(6)还包括对反应生成的式VII所示结构的化合物的纯化,具体为:水解反应结束后,将反应液浓缩除去1,4-二氧六环,加少量水,用乙酸乙酯萃取,水层浓缩干,即得到式VII所示结构的化合物。在另一个优选实施方式中,步骤(4)中的有机醇为甲醇,R基团为甲基,式IV所示结构的化合物和甲醇,发生酯化反应,得到式V-1所示结构的化合物。式V-1所示结构的化合物经过脱卤化氢反应,生成式VI-1所示结构的化合物。在另一个优选实施方式中,步骤(4)中的有机醇为乙醇,R基团为乙基,式IV所示结构的化合物和甲醇,发生酯化反应,得到式V-2所示结构的化合物。式V-2所示结构的化合物经过脱卤化氢反应,生成式VI-2所示结构的化合物。为了有助于更清楚的理解本发明,现结合具体实施例解释如下。如未明确指出,实施例中用到的原料试剂均由市场购得,实施例中出现的一些试剂的中英文对照如表1所示。表1试剂中英文对照中文全称英文缩写N,N-二甲基甲酰胺DMF冰乙酸AcOH二氯亚砜SOCl2二氯乙烷DCE甲醇MeOH1,8-二氮杂双环[5.4.0]十一碳-7-烯DBU四氢呋喃THF1,4-二氧六环DOA乙醇EtOH实施例1化合物II的制备在1000mL烧瓶内,加入40g化合物I,37.7g邻苯二甲酸酐,400mL冰乙酸。118℃回流反应3小时,TLC点板显示原料反应完全,其中TLC展开剂为冰乙酸:甲醇=1:4。待反应液降至室温,向反应液中加入600mL冰水,反应液中有固体析出,将析出的固体过滤、水洗、烘干,得到白色固体即为化合物II,其质量为70g,收率为95.8%。实施例2化合物III的制备在1000mL烧瓶内,加入40g化合物II,400mL二氯乙烷,3滴DMF,搅拌下,缓慢加入40g二氯亚砜。二氯亚砜加完后,83℃回流反应1.5小时,TLC点板显示化合物II反应完全,其中TLC展开剂为石油醚:乙酸乙酯=5:1。其中,溶剂二氯乙烷也可以用氯仿替代。实施例3化合物IV的制备实施例2的反应完成后,反应液降温至60℃以下,小心缓慢加入催化量的红磷,加完,再加入46g溴素,升温至83℃反应约130h。采用HPLC监控反应,待原料基本反应完时,反应结束。实施例4化合物V-1的制备实施例3的反应完成后,反应液降温至50℃,缓慢加入400mL甲醇,50℃反应1h。TLC点板显示原料反应完全,其中TLC展开剂为石油醚:乙酸乙酯=5:1。浓缩除去大部分的甲醇,用乙酸乙酯溶解,水洗,饱和碳酸氢钠溶液洗,饱和食盐水洗,无水硫酸钠干燥,过滤,浓缩干,得到的淡黄色固体即为化合物V-1,其质量为50g,收率为94.45%。实施例5化合物VI-1的制备在1000ml烧瓶内,加入50g化合物V-1,600mL四氢呋喃和35gDBU,67℃回流反应60h。HPLC显示原料反应完。反应液降至室温过滤,然后用二氯甲烷:石油醚=1:1的溶液过快速柱,浓缩干,得到的白色固体即为化合物VI-1,其质量为28g,收率为71.1%。其中,溶剂四氢呋喃也可以用1,4-二氧六环替代。实施例6化合物VII的制备在250ml烧瓶内,加入5g化合物VI-1、60mL1,4-二氧六环和30mL浓盐酸,115℃回流反应120h,中间补加浓盐酸20mL。TLC点板显示化合物VII反应完全,其中TLC展开剂为石油醚:乙酸乙酯=5:1。反应液浓缩出去大部分1,4-二氧六环,加少量水,用乙酸乙酯萃取5次,水层浓缩干,得到固体即为化合物VII粗品,共3.3g。用甲叔基丁基醚:乙醇=3:1打浆,过滤得到类白色样品即为化合物VII,其质量为2.5g,收率为78%。图1为按照该方法合成的化合物VII的氢谱图,表明化合物VII即为氨甲环酸环烯烃杂质。实施例7化合物V-2的制备实施例3的反应完成后,反应液降温至50℃,缓慢加入400mL乙醇,50℃反应1h。TLC点板显示原料反应完全,其中TLC展开剂为石油醚:乙酸乙酯=5:1。浓缩除去大部分的乙醇,用乙酸乙酯溶解,水洗,饱和碳酸氢钠溶液洗,饱和食盐水洗,无水硫酸钠干燥,过滤,浓缩干,得到的淡黄色固体即为化合物V-2,其质量为52g,收率为95%。实施例8化合物VI-2的制备在1000ml烧瓶内,加入52g化合物V-2,600mL四氢呋喃和35gDBU,67℃回流反应60h。HPLC显示原料反应完。反应液降至室温过滤,然后用二氯甲烷:石油醚=1:1的溶液过快速柱,浓缩干,得到的白色固体即为化合物VI-2,其质量为29g,收率为70%。其中,溶剂四氢呋喃也可以用1,4-二氧六环替代。实施例9化合物VII的制备在250ml烧瓶内,加入5.2g化合物VI-2、60mL1,4-二氧六环和30mL浓盐酸,115℃回流反应约120h,中间补加浓盐酸20mL。TLC点板显示化合物VII反应完全,其中TLC展开剂为石油醚:乙酸乙酯=5:1。反应液浓缩出去大部分1,4-二氧六环,加少量水,用乙酸乙酯萃取5次,水层浓缩干,得到固体即为化合物VII粗品,共3.2g。用甲叔基丁基醚:乙醇=3:1打浆,过滤得到类白色样品即为化合物VII,其质量为2.4g,收率为77%。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1