和β淀粉样蛋白特异性结合的化合物的制作方法
本发明涉及医药
技术领域:
,尤其涉及一种能够和β淀粉样蛋白特异性结合的化合物、其制备方法及其制备药物的用途。
背景技术:
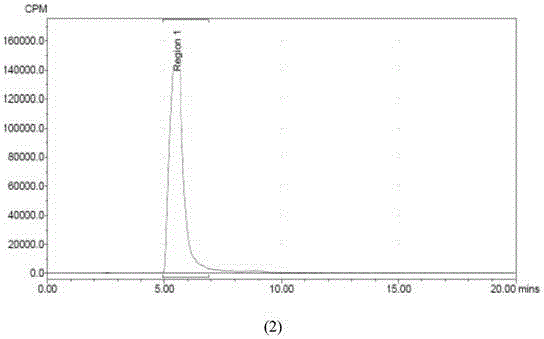
:目前研究表明β淀粉样蛋白的沉积和阿尔兹海默症(AD)的发病机制有密切的关系,因此β淀粉样蛋白的检测以及如何消除或减少β淀粉样蛋白就成了研究的热点,为了进一步研究或消除β淀粉样蛋白,需要有一种能和β淀粉样蛋白特异性结合的化合物。随着中子捕获治疗技术的发展,利用中子捕获治疗技术来消除β淀粉样蛋白能够有较高的靶向性和较好的治疗效果,然而目前尚未发现一种能和中子捕获治疗技术结合起来并能够和β淀粉样蛋白特异性结合的化合物。技术实现要素:为了解决上述技术问题,本发明一方面提供了一种能够和β淀粉样蛋白特异性结合的化合物,所述化合物为2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑,该化合物具有如结构式I所示的结构:其中,R1为-B(OH)2,R2为-NHCH3;并且R1中的硼元素是对热中子捕获截面大的核素10B。对热中子捕获截面大的核素包含但不限于10B、155Gd或157Gd。其中所述的对热中子捕获截面大的核素是指在相同能量的热中子照射下,中子捕获截面大于等于人体基本组成元素(C、H、O、N、P、S)的中子捕获截面的100倍及以上的核素,其中在相同能量的热中子照射下构成人体基本组成元素中的H的中子捕获截面最大,在热中子能量为0.025eV的条件下H的热中子捕获截面为0.2barn,10B的热中子捕获截面为3800barn,155Gd的热中子捕获截面为60700barn,而157Gd的热中子捕获截面为254000barn,均大于在相同能量的热中子照射下的H元素的热中子捕获截面的100倍。这种热中子捕获截面大的核素能够与热中子作用发生核反应,释放出至少一种有杀伤力的射线,该射线射程短,基本上只破坏和所述化合物特异性结合的β淀粉样蛋白的结构,而并不破坏其他正常组织,对正常组织的危害很小。10B核素在中子射线的照射下发生如下反应,放射能量:利用含硼(10B)化合物对热中子具有高捕获截面的特性,借由10B(n,α)7Li中子捕获及核分裂反应产生4He和7Li两个重荷粒子。如反应式I所示,两荷电粒子的平均能量约为2.33MeV,具有高线性转移(LinearEnergyTransfer,LET)、短射程特征,α粒子的线性能量转移与射程分别为150keV/μm、8μm,而7Li重荷粒子则为175keV/μm、5μm,两粒子的总射程约相当于一个细胞大小,因此对于生物体造成的辐射伤害能局限在细胞层级。该化合物具有和β淀粉样蛋白特异性结合的性质,并且具有对热中子捕获截面大的核素10B,因此可以利用该化合物和β淀粉样蛋白形成结合物后,再利用中子捕获治疗装置产生的中子射束对所述结合物进行照射,中子和所述化合物中的10B元素发生核反应,产生的能量能够破坏β淀粉样蛋白的结构。优选的是,所述和β淀粉样蛋白特异性结合的化合物中,所述化合物的R2中的碳元素为11C。11C作为一种放射性核素经常被用来标记化合物以供医学诊断和使用,本发明提供的化合物2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑具有和β淀粉样蛋白特异性结合的性质,用放射性核素11C标记该化合物后,所述化合物能够用于PET/CT中追踪判定β淀粉样沉积于脑部的部位,用来诊断AD。本发明另一方面提供了该能够和β淀粉样蛋白特异性结合的化合物的制备方法,结构式I所示的化合物由结构式II所示的化合物2-(4-硝基苯)-6-溴苯并噻唑制备而成:结构式I所示的能够和β淀粉样蛋白特异性结合的化合物是2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑。优选的是,能够和β淀粉样蛋白特异性结合的化合物的制备方法中,由2-(4-硝基苯)-6-溴苯并噻唑制备2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑的方法包括:2-(4-硝基苯)-6-溴苯并噻唑经还原反应生成2-(4-氨基苯)-6-溴苯并噻唑的步骤;2-(4-氨基苯)-6-溴苯并噻唑加入甲醛反应生成2-(4-甲胺基苯)-6-溴苯并噻唑的步骤;2-(4-甲胺基苯)-6-溴苯并噻唑加入联硼酸频那醇酯反应生成2-(4-甲胺基苯)-6-硼酸频哪醇酯苯并噻唑的步骤,其中所述联硼酸频那醇酯中的硼为10B;2-(4-甲胺基苯)-6-硼酸频哪醇酯被氧化剂氧化为由结构式I所示的化合物2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑的步骤。优选的是,2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑还可以通过以下反应由2-(4-硝基苯)-6-溴苯并噻唑制备而成:由2-(4-硝基苯)-6-溴苯并噻唑和联硼酸频那醇酯反应生成2-(4-硝基苯)-6-硼酸频哪醇酯苯并噻唑的步骤,其中所述的联硼酸频那醇酯中的硼为10B;2-(4-硝基苯)-6-硼酸频哪醇酯苯并噻唑被氧化剂氧化为2-(4-硝基苯)-6-二羟基硼基苯并噻唑的步骤;2-(4-硝基苯)-6-二羟基硼基苯并噻唑被还原剂还原为2-(4-氨基苯)-6-二羟基硼基苯并噻唑的步骤;2-(4-氨基苯)-6-二羟基硼基苯并噻唑、碘甲烷和三氟甲基磺酸银在高温条件下反应生成由结构式I所示的化合物2-(甲胺基苯)-6-二羟基硼基苯并噻唑的步骤。以上两种合成2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑的步骤中,结构式I中的化合物的10B来源于所使用的反应剂联硼酸频那醇酯中的10B,如上所述的,在制备如结构式I所示的化合物时,应根据实际应用需要的含10B化合物的纯度来选择反应剂联硼酸频那醇酯中含10B的联硼酸频那醇酯所需要的含量。另外,碘甲烷中的C可以为12C,也可以为11C。进一步优选的是,所述能够和β淀粉样蛋白特异性结合的化合物的制备方法中,所述碘甲烷中的碳为11C。由放射性标记的碘甲烷合成的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑也具有放射性,并且放射性的11C标记在结构式I所示的化合物的R2的甲胺基上。将结构式I所示的化合物用11C标记后可以利用其放射性结合正电子发射型计算机断层显像(PositronEmissionComputedTomography,简称PET)用以追踪β淀粉样蛋白沉积于脑部的部位,用以对AD诊断。需要说明的是,即便用11C标记了结构式I所示的化合物,所述化合物仍然具有和β淀粉样蛋白特异性结合的性质,并且所述化合物仍然含有对热中子捕获截面大的核素10B,因此用11C标记的结构式I所示的化合物仍然具有和中子捕获治疗装置结合以消除β淀粉样蛋白的性质。优选的是,所述能够和β淀粉样蛋白特异性结合的化合物的制备方法中,所述的氧化剂可以优选为偏高碘酸钠,或氧化性和偏高碘酸钠类似的其他氧化剂。本发明第三方面提供了2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑在制备与β淀粉样蛋白特异性结合的药物中的应用,由2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑制备的药物和β淀粉样蛋白形成结合物,再用中子捕获治疗装置放射的中子射线照射所述结合物,中子和10B元素反应产生的能量破坏β淀粉样蛋白。本发明第四方面提供了用11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑在制备β淀粉样蛋白PET显像剂中的应用。本发明的有益效果一方面是通过提供了一种能够和β淀粉样蛋白特异性结合的新化合物,实现了通过中子捕获治疗装置消除和该化合物特异性结合的β淀粉样蛋白,为消除β淀粉样蛋白提供了一种新的思路和方法;另一方面,通过提供一种用放射性同位素11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑,为β淀粉样蛋白的PET显像剂提供了新选择。附图说明图1是2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑的1HNMR图谱;图2是加速器中子源的中子捕获治疗装置的平面示意图;图3是反应堆中子源的中子捕获治疗装置的平面示意图;图4中的(1)图和(2)图分别是11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑分别在30min和60min时的稳定性图谱;图5中的A图和B图分别是注射用11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑30min后的对照鼠和SAMP8模型鼠的PET影像;图6是牛血清白蛋白和H310BO3的混合溶液分别在距离准直器出口不同位置处经辐射线照射后的SDS-PAGE电泳图谱。具体实施方式下面通过实施例对本发明的技术方案做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它成分或其组合的存在或添加。本发明所述的快中子为能区大于40keV的中子,超热中子能区在0.5eV到40keV之间,热中子能区小于0.5eV。本发明提供的能够和β淀粉样蛋白特异性结合的化合物为2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑,其结构的确认如附图1所示。该化合物可以和中子捕获治疗装置结合起来用以消除β淀粉样蛋白沉积斑块。如图2或图3所示:所述中子捕获治疗装置包括中子源、射束整形体和准直器,其中射束整形体包括反射体、缓速体、热中子吸收体和辐射屏蔽装置,其中中子源包括加速器中子源和反应堆中子源。在利用中子捕获治疗装置消除β淀粉样蛋白沉积斑块的过程中,通常情况下需要在中子捕获治疗装置的射束整形体内将来自于中子源的混合辐射场中的快中子调整到超热中子并降低混合辐射场中其他有害射线的含量,虽然和β淀粉样蛋白特异性结合的化合物上的核素是对热中子捕获截面大的核素,但是考虑到中子射束从中子捕获治疗装置的准直器到能和β淀粉样蛋白特异性结合的化合物的过程中,中子射束的能量会随着二者距离的增加能量会有一定程度的衰减,并且中子射束在到达和β淀粉样蛋白特异性结合的化合物的过程中往往会有其他物质对中子的能量进行不同程度的缓速,因此为了保证到达和β淀粉样蛋白特异性结合的化合物中子的能量和中子强度,通常情况下需要将射束整形体内的快中子缓速为超热中子,提高从准直器出来的中子射束中的超热中子的含量。如附图2所示的中子源为是加速器的中子捕获治疗装置,其中加速器10a将质子加速,通过扩束装置20扩大质子束P的横截面积,使所述质子束P打到靶材T上并产生中子,其反应原理为:质子、氘核等带电粒子经由加速器加速至足以克服靶原子核库仑斥力的能量,与金属靶T发生核反应产生子核和中子,其中常用的金属靶材通常为锂和铍。通过该方法产生的是混合辐射场,在利用该中子捕获治疗装置进行照射时,需要尽可能的降低其他种类的辐射线,而射束整形体30a中的缓速体32a具有调整所述混合辐射场能量的作用,反射体31a将向其他方向扩散的混合辐射场反射回来,以降低中子的损失,射束整形体30a还可以包括热中子吸收体33a,其能够吸收能量较低的热中子,所述射束整形体30a外部设置一层辐射屏蔽装置34a,以避免射线泄露对附近的人造成伤害。射束整形体30a的后部安装有准直器40a,经过射束整形体30a调整后的射束再通过准直器40a进行汇聚。如附图3所示的是中子源为反应堆的中子捕获治疗装置,其中反应堆中子源10b通过管道将产生的中子束N传递至射束整形体30b,反应堆中子源10b和加速器10a中子源一样产生的都是混合辐射场,该混合辐射场中的能量较高的快中子通过射束整形体30b中的缓速体32b缓速为能破坏β淀粉样蛋白结构的中子,向其他方向扩散的射线通过反射体31b反射回缓速体32b中,以提高射线的利用率;射束整形体中的热中子吸收体33b可以吸收混合辐射场中能量较低的热中子以使中子射束N中的超热中子含量更高,所述中子射束N经过准直器40b的汇聚,以提高中子照射是的精准度。下面通过实施例进一步说明本发明的技术方案。本发明所述的化合物上的硼元素为10B并且该化合物上可以含有放射性元素11C。如未做特殊说明,本发明所述的含硼的化合物中的硼元素均为10B。<实施例1>和β淀粉样蛋白特异性结合的化合物的制备方法和β淀粉样蛋白特异性结合的化合物2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑可通过如下反应进行制备:将1g的2-(4-硝基苯)-6-溴苯并噻唑溶于10mL的乙醇中,再加入5.39g的SnCl2.2H2O,该反应体系于100℃的条件下搅拌1h得到2-(4-氨基苯)-6-溴苯并噻唑;1HNMR:400MHzDMSOδ8.29(s,1H),7.80-7.82(d,J=8.8Hz,1H),7.74-7.76(d,J=8.8Hz,2H),7.58-7.60(m,1H),6.65-6.67(d,J=8.4Hz,2H),5.95(s,2H)。向1g的2-(4-氨基苯)-6-溴苯并噻唑中加入16.4mmol甲醛,再向其中加入10mL的四氢呋喃(THF)和20mL的甲醇,再一次性加入0.886g的甲醇钠构成反应液,所述反应液在65℃的条件下搅拌反应12h,然后将反应液降温至25℃,加入620.41mg的硼氢化钠(NaBH4),再将反应温度升至65℃,搅拌反应1h得到2-(4-甲胺基苯)-6-溴苯并噻唑;1HNMR:400MHzCDCl3δ7.97(s,1H),7.89-7.91(d,J=8.8Hz,2H),7.81-7.83(d,J=8.8Hz,1H),7.52-7.54(m,1H),6.64-6.66(d,J=8.8Hz,2H),2.93(s,3H)。将100mg的2-(4-甲胺基苯)-6-溴苯并噻唑、95.46mg的联硼酸频那醇酯和92.23mg的醋酸钾构成反应体系,向反应体系中加入4mL的THF和2mL的二甲基亚砜(DMSO),在20℃充氮的条件下加入26.39mg的二氯二(三苯基磷)合钯(Pd(PPh3)2Cl2),在90℃条件下搅拌反应12h得到2-(4-甲胺基苯)-6-硼酸频哪醇酯苯并噻唑,其中联硼酸频那醇酯中的硼为10B;向300mg的2-(4-甲胺基苯)-6-硼酸频哪醇酯苯并噻唑加入20mLTHF和10mL水,再加入875.93mg偏高碘酸钠(NaIO4)构成反应体系,将该反应体系在25℃条件下搅拌反应12h得到结构式I所示的化合物:2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑。该化合物的1HNMR扫描图谱如图1所示。1HNMR:400MHzMeOHδ8.27(s,1H),7.83-7.85(m,4H),6.66-6.68(d,J=7.6Hz,2H),2.85(s,3H)。其中,2-(4-硝基苯)-6-溴苯并噻唑可通过以下步骤进行制备:向25mL浓度为10M的氢氧化钾溶液里加入5g的2-氨基-6-溴-苯并噻唑,再加入5mL乙二醇构成的混合溶液于125℃搅拌反应2h,得到2-氨基-5-溴苯硫醇;1HNMR:400MHzDMSOδ7.21-7.26(m,1H),6.99(s,1H),6.81-6.72(m,1H),6.39(s,1H),5.72(s,2H)。2g的2-氨基-5-溴苯硫醇中加入1.48g的对硝基苯甲醛,再加入40mL的DMSO构成反应溶液,所述反应溶液于180℃搅拌反应0.5h,得到2-(4-硝基苯)-6-溴苯并噻唑;1HNMR:400MHzDMSOδ8.54(s,1H),8.34-8.41(m,4H),8.07-8.09(d,J=8.8Hz,1H),7.74-7.77(m,1H)。本实施例中合成所述的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑的具体反应过程如反应式II所示(该反应式中的硼元素均为10B):<实施例2>和β淀粉样蛋白特异性结合的化合物的制备方法本实施例中2-(4-硝基苯)-6-溴苯并噻唑的合成方法和<实施例1>所示的合成方法相同。向100mg的2-(4-硝基苯)-6-溴苯并噻唑中加入90.91mg的联硼酸频那醇酯和87.84mg的醋酸钾,再加入4mL的THF和2mL的DMSO,在20℃充氮的条件下加入25mg的二氯二(三苯基磷)合钯,反应体系在95℃条件下搅拌反应15h得到2-(4-硝基苯)-6-硼酸频哪醇酯苯并噻唑,其中联硼酸频那醇酯中的硼为10B;1HNMR:400MHzCDCl3δ8.44(s,1H),8.35-8.37(d,J=8.8Hz,2H),8.28-8.30(d,J=8.8Hz,2H),8.11-8.13(d,J=8Hz,1H),7.96-7.98(d,J=8Hz,1H),1.40(s,12H)。向539.7mg的2-(4-硝基苯)-6-硼酸频哪醇酯苯并噻唑中加入30mL的THF和10mL水,再加入1.51g的偏高碘酸钠,该反应体系在25℃条件下反应23h得到2-(4-硝基苯)-6-二羟基硼基苯并噻唑;1HNMR:400MHzDMSOδ8.56(s,1H),8.36-8.42(m,4H),8.29(m,2H),8.10-8.12(d,J=8.4Hz,1H),8.00(m,1H)。向100mL甲醇中加入200mg催化剂Pd/C,再加入180mg的2-(4-硝基苯)-6-二羟基硼基苯并噻唑构成反应体系,所述反应体系在氢气环境下真空脱气并在25℃条件下反应10min生成2-(4-氨基苯)-6-二羟基硼基苯并噻唑;1HNMR:400MHzMeOHδ8.29(s,1H),7.80-7.84(m,4H),6.74-6.76(d,J=8.8Hz,2H)。利用氮气载带碘甲烷通过加热至200℃的三氟甲基磺酸银管后,再将其通入溶解有2-(4-氨基苯)-6-二羟基硼基苯并噻唑的无水丙酮中构成反应液,将反应液在80℃反应5min后加水猝灭,得到2-(4甲胺基苯)-6-二羟基硼基苯并噻唑。其中碘甲烷中的C可以为具有放射性的11C,由其合成的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑同样具有放射性元素11C,因此该具有放射性的化合物可以和PET结合用于追踪β淀粉样蛋白沉积于脑部的部位及AD的诊断。1HNMR:400MHzMeOHδ8.27(s,1H),7.83-7.85(m,4H),6.66-6.68(d,J=7.6Hz,2H),2.85(s,3H)。本实施例的反应过程如反应式III所示(该反应式中的B均为10B):<实施例3>11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑在制备β淀粉样蛋白PET显像剂中的应用由本领域技术人员熟知的实验方法,由<实施例2>中合成的由11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑经过制备型的HPLC纯化,纯化后其放射性化学纯度为98.15%,其HPLC的保留时间为5.43min,和标准品2-(4-甲胺基苯)-6二羟基硼基苯并噻唑的保留时间一致,可以确定纯化产品为所需的放射性化合物。利用HPLC检测11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑在体外的稳定性,时间选为30min和60min,附图4中的(1)图为稳定性30min放射性图谱,(2)图为稳定性60min放射性图谱,30min和60min的放射性化学纯度均为100%,因此,所述11C标记的放射性化合物的放射性化学纯度符合实验要求。<实施例4>11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑和β淀粉样蛋白特异性结合的实验SAMP8(senescenceacceleratedmouseprone8)小鼠是目前最常见的研究AD(阿尔兹海默症)的动物模型,其脑部存在大量淀粉样蛋白沉积斑块,本实施例采用SAMP8小鼠作为模型鼠,普通实验鼠作为对照鼠,模型鼠和对照鼠均为10月龄,分别向这两种老鼠注射含有11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑,再通过Micro-PET扫描来研究2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑和β淀粉样蛋白是否具有特异性结合的性质。分别选取体重为31.5±0.3g的模型鼠和对照鼠,分别向其注射31.0±0.6μCi的11C标记的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑,并用西门子型号为INVEON的Micro-PET进行扫描,其中扫描能窗为350-650KeV。本领域技术人员熟知地,造成阿尔兹海默症主要的病因为β淀粉样蛋白沉积斑块聚积在脑部的大脑皮层和海马区,本实施例通过Micro-PET扫描并利用PMOD软件对模型鼠和对照鼠脑部进行比对,分析确定了SAMP8模型鼠和对照鼠的大脑皮层和海马区对具有放射性的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑的吸收,以说明该化合物能否对β淀粉样蛋白沉积斑块能特异性结合,具体结果如表1和表2所示:表1,模型鼠和对照鼠大脑皮层对放射性2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑的摄取从表1可以看出:在放射性药物注射后第35分钟时,模型鼠与对照鼠大脑皮层摄取量的比值可达2.7,高于有效硼中子捕获治疗的标靶与非标靶的硼浓度比值(2.5),此结果可说明放射性2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑可有效的与β淀粉样蛋白沉积斑结合,并积聚在病灶处。更可期许使用硼中子捕获治疗阿尔兹海默氏症的病人,病灶处可接受大量的辐射剂量,达到治疗的目的,并降低正常脑组织的辐射伤害。表2,模型鼠和对照鼠的海马区对放射性2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑的摄取从表2可以看出,放射性药物注射后的25及35分钟,模型鼠与对照鼠的海马区比值皆为3.2,高於有效硼中子捕获治疗的标靶与非标靶的硼浓度比值(2.5),此结果亦可佐证放射性2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑可有效的与β淀粉样蛋白沉积斑块结合,并积聚在病灶处。SAMP8模型鼠为加速老化的阿尔兹海默氏症的发病鼠,在大脑皮层和海马区的病灶部位皆聚积了大量的β淀粉样蛋白沉积斑块,通过表1和表2中模型鼠和对照鼠的实验数据可以看出,SAMP8模型鼠的大脑皮层和海马区相较于正常的对照鼠对2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑具有更强的吸收能力,因此说明了2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑和β淀粉样蛋白具有特异性,将来更可利用硼中子捕获治疗来治疗阿尔兹海默氏症,为阿尔兹海默氏症患者提供另一种先进的治疗方式。依据表2的分析结果,在老鼠注射放射性2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑后的25至35分钟,放射性药物于模型鼠大脑的海马区与对照鼠的比值皆为3.2,因此取中间值30min的Micro-PET影像图的进一步比对放射性的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑在脑部积聚的情形。图5是注射放射性的2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑第30min时的PET扫描并经AMIDE软件处理过的影像,其中A图为对照鼠注射放射性药物30min时的影像,A图中(1)图为对照鼠冠状切面扫描影像,(2)图为(1)图沿Y轴向的切面扫描图,(3)图为(1)图沿X轴向的脑部切面扫描图;B图为SAMP8模型鼠注射放射性药物30min时的影像,同样地,B图中(1)图为模型鼠冠状切面扫描影像,(2)图为(1)图沿Y轴向的切面扫描图,(3)图为(1)图沿X轴向的脑部切面扫描图。其中A图中的(3)和B图中的(3)能反映脑部放射性药物吸收情况的,将这两幅影像对比可以看出,B图(3)中的SAMP8模型鼠的脑部相对于A图(3)中的对照鼠的脑部聚积有大量的放射性药物,而已知模型鼠脑部具有大量β淀粉样蛋白沉积斑块,由此可说明2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑对β淀粉样蛋白沉积斑块有特异性,且未来2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑可用于硼中子捕获治疗。<实施例5>模拟2-(4甲胺基苯)-6-二羟基硼基苯并噻唑在制备消除β淀粉样蛋白的药物的中应用的实验本实施例用硼酸(H310BO3)来代替2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑,其中硼酸(H310BO3)中的硼元素为10B,用牛血清白蛋白(BSA)来模拟β淀粉样蛋白,将硼酸和牛血清白蛋白构成的混合溶液置于中子捕获治疗装置产生中子射束环境中,通过SDS-PAGE凝胶电泳分析中子对牛血清白蛋白的作用以及在H310BO3存在的条件下,中子对牛血清白蛋白的作用。一、中子对牛血清白蛋白的作用用超纯水配置浓度为0.01%(w/w)的BSA溶液,配置的溶液在4℃条件下保存及实验操作,取1mLBSA溶液置于中子捕获治疗装置的准直器出口的中心线上,其中所述溶液距离准直器出口距离为2cm,设置中子捕获治疗装置以使准直器出口处的中子强度为2.4×1011个/s,所述BSA溶液在该中子环境中照射2h;另取1mLBSA溶液作为对照液不进行中子照射。将用中子照射2h的BSA溶液和对照液分别用考马斯亮蓝染色并做SDS-PAGE凝胶电泳,用ImageJ软件分别将上述样品液和对照液的电泳图谱中蛋白条带的颜色进行量化,其数值用来表示蛋白质的相对含量,其中定义对照液中的BSA含量为1,在上述中子照射实验条件下,经中子照射2h后的BSA的含量为0.8,其含量大概有20%的减少,由此可见,包含有中子射束的辐射线能够影响蛋白质的含量。二、在H310BO3存在的条件下,中子对牛血清白蛋白的作用用超纯水配置BSA和H310BO3的溶液,其中,在所述溶液中,BSA的浓度为0.01%(w/w),H310BO3的浓度为0.18M;配置的溶液均在4℃保存及实验操作,从所述溶液中分别取8份(编号分别为A、B、C、D、E、F、G、H),每份1mL的溶液用中子捕获治疗装置进行照射,分别将8份溶液置于中子捕获治疗装置准直器出口的中心线上,溶液A距离准直器出口的距离为2cm,溶液B距离准直器的出口为4cm,溶液C距离准直器的出口为6cm,并以此类推。准直器出口处的射束中除了包括中子射线,还包括伽马射线及其他辐射线,在实际对蛋白质起到破坏作用的主要是中子射线,本实施例用射束中的中子强度来描述所述射束的强度,其中,本实施例采用的中子中子强度为2.4×1011个/s,8份溶液在该中子环境中照射2h;另从所述BSA和H310BO3溶液中取1mL作为对照液,该对照液不经中子照射。将对照液和经中子捕获治疗装置放射的辐射线照射过的的8份溶液分别用考马斯亮蓝染色并做SDS-PAGE凝胶电泳,图6所示为对照液和8份溶液的SDS-PAGE电泳图谱。图6中前两个蛋白条带为对照液中的BSA,其余分别为经过所述辐射线照射后的BSA,8份溶液均置于准直器出口中心线上,由于在所述中心线上的溶液中均含有H310BO3,而10B元素对热中子有较大的捕获截面,因此从准直器出口出来的辐射线中的中子经过含有H310BO3的溶液后,其中子剂量大幅度下降,离准直器出口越远的溶液,其BSA接受到的辐射剂量越少。从图6可以看出,8个经中子照射过的溶液相比于对照样,其蛋白条带的颜色均有不同程度的变浅,并且,离准直器出口越近,其溶液内的蛋白条带的颜色越浅,说明蛋白含量减少的越多,而离准直器出口越近,溶液受到的中子辐射剂量越大,进一步说明,中子剂量的大小影响溶液中BSA的含量,中子剂量越强,经所述中子照射后的溶液中BSA的含量越少。用ImageJ软件分别将对照液和8份溶液对应的电泳图谱中的BSA蛋白条带的颜色进行量化,其数值用来表示蛋白的相对含量,其中,定义对照液中的BSA含量为1,在上述中子照射实验条件下,经中子照射2h后的BSA的含量如表3所示。由表3可以看出,经中子照射的溶液中BSA含量均有不同程度的降低,距离准直器出口2cm的溶液经中子强度为2.4×1011个/s的中子照射2h后,其BSA含量仅剩5.3%,说明在H310BO3存在的条件下,中子能大幅度破坏BSA结构,降低BSA的含量;并且在实验误差允许的范围内,8个溶液随着溶液距离准直器出口的距离越远,其BSA含量整体呈减少的趋势,进一步说明中子剂量的大小对影响BSA的含量。表3,在H310BO3存在条件下,中子对牛血清白蛋白的作用溶液编号BSA含量(%)对照液100A5.3B2.6C18.9D14.0E22.9F35.1G49.6H60.7本发明提供的化合物2-(4-甲胺基苯)-6-二羟基硼基苯并噻唑和H310BO3一样携带有热中子捕获截面大的核素10B,并且该化合物能够和β淀粉样蛋白特异性结合,将所述化合物置于含有β淀粉样蛋白的环境中,所述化合物会在β淀粉样蛋白的周围形成较高的浓度,再用中子捕获治疗装置发射的中子射束照射所述化合物聚积的区域,其释放的能量能破坏蛋白质的结构。以上列举具体实施例对本发明进行说明,需要指出的是,以上实施例只用于对发明作进一步说明,不代表本发明的保护范围,其他人根据本发明的提示做出的非本质的修改和调整,仍属于本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1