多黏菌素衍生物及其用途的制作方法
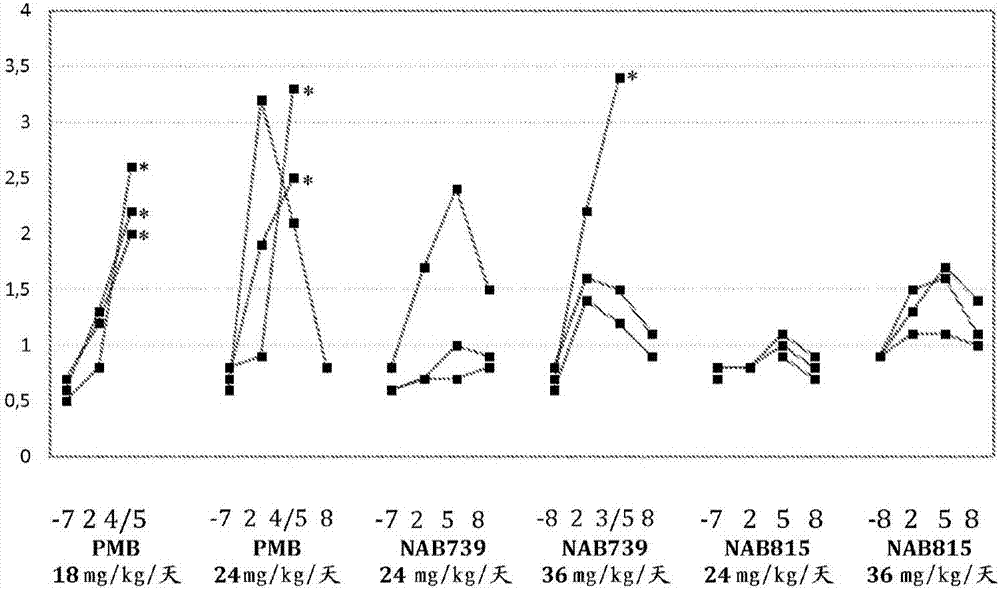
本发明涉及多黏菌素衍生物及其在治疗由革兰氏阴性菌引起的感染中的用途。
背景技术:
:脓毒性感染(septicinfection)每年使超过215,000名美国人丧生。估计每年有750,000名美国人感染重症脓毒症(sepsis),其中29%因此死亡。脓毒症死亡占美国所有死亡病例的9%。在美国,脓毒症造成的死亡人数与心肌感染相同,甚至比交通事故还多。每年有两百万至三百万美国人获得医院感染,其中10%的这些感染发展成为脓毒症。这些患者中超过90,000名死于在医院感染的脓毒症。大肠杆菌(escherichiacoli)和肺炎克雷伯氏菌(klebsiellapneumoniae)(均为革兰氏阴性菌)引起所有社区获得性脓毒性感染的几乎40%以及所有医疗保健相关脓毒性感染的约三分之一。它们引起所有革兰氏阴性脓毒性感染中的约60%至75%。脓毒性感染的其他革兰氏阴性病原体包括波美不动杆菌(acinetobacterbaumannii)和绿脓假单胞菌(pseudomonasaeruginosa)。革兰氏阴性菌造成的脓毒症性感染超过总数的40%,并且这些细菌中许多具有极高的多重抗药性。多黏菌素是由多黏类芽孢杆菌(paenibacilluspolymyxa)菌株及相关生物体产生的一组密切相关的抗生素物质。这些阳离子药物是分子量为约1000的相对简单的肽。多黏菌素(例如多黏菌素b)是十肽抗生素,即它们由十(10)个氨酰基残基组成。它们具有杀菌性并且对革兰氏阴性菌(例如大肠杆菌(e.coli)以及肠杆菌(enterobacteriaceae)、假单胞菌(pseudomonas)、波美不动杆菌(a.baumannii)等的其他物种)尤其有效。但是,多黏菌素具有严重的副作用,包括肾毒性和神经毒性。因此,由于其高全身毒性,这些药物作为治疗剂的用途十分有限。极高多重抗药性的革兰氏阴性菌的流行目前迫使临床医师将多黏菌素恢复为严重感染最后的一线治疗,尽管多黏菌素具有众所周知的肾毒性。多黏菌素的肾毒性可使治疗复杂化或者甚至可能要求其停用。因此,必须权衡肾毒性的风险与对患者存活的有益效果。根据最近研究,多黏菌素b和黏菌素(colistin)(从甲磺酸黏菌素中释放)的肾毒性率为10%至30%,但是在选定材料中,黏菌素的该比率可高达43%至48%,而多黏菌素b的该比率高达55%。因此,个体差异很大(vaara,m.2013,newderivativesofpolymyxins,journalofantimicrobialchemotherapy2013,68:1213-9)。当前数据表明,在危重病患者中,目前的给药方案非最优并且导致血清浓度过低,使得情况更加不幸。因此建议临床医师使用更大的剂量,但这进一步增加了肾毒性。发明简述因此,本发明的目的是提供对革兰氏阴性菌有效并具有降低的肾毒性的多黏菌素衍生物。本发明的目的通过多黏菌素衍生物及其可药用盐以及特征在于独立权利要求中所述的其用途来实现。在从属权利要求中公开了本发明的优选实施方案。附图简述在下文中,将参考附图通过优选实施方案更详细地描述本发明,其中图1示出了在用多黏菌素b(pmb)、nab739或nab815(每组3只动物,iv,tid)处理之前(第-7/-8天)和期间(第2至8天)的s-bun(mg/dl);图2示出了在用多黏菌素b(pmb)、nab739或nab815(每组3只动物,iv,tid)处理之前(第-7/-8天)和期间(第2至8天)的s-crea(mg/dl);图3示出了在用多黏菌素b(pmb)、nab739或nab815(每组3只动物,iv,tid)处理之前(第-7/-8天)和期间(第2至8天)的u-nag(u/l)/u-crea(mg/dl)比×10。图4示出了在用多黏菌素b(pmb)、nab739或nab815(每组3只动物,iv,tid)处理之前(第-7/-8天)和期间(第2至8天)的u-ggt(u/l)/u-crea(mg/dl)比。发明详述近来,已进行了多次尝试来开发耐受性更好的多黏菌素衍生物。我们早先已表明,pct/fi2007/050441(其全部内容和公开内容在此通过引用并入)中所公开的化合物具有显著的抗菌活性并且可用于治疗由革兰氏阴性菌引起的感染。此外,已表明所有均仅携带三(3)个正电荷的这些化合物较携带五(5)个正电荷的化合物肾毒性较小,并且还示出了关于此的初步证据(vaaram.等.novelpolymyxinderivativescarryingonlythreepositivechargesareeffectiveantibacterialagents.antimicrobagentschemother2008,52:3229-36;vaaram.和vaarat.polymyxinderivativesandusesthereof.2010.u.s.patent7,807,637;vaaram.polymyxinsandtheirnovelderivatives.curropinmicrobiol2010;13:574-81;mingeot-leclercqm.-p.novelpolymyxinderivativesarelesscytotoxicthanpolymyxinbtorenalproximaltubularcells.peptides2012;35:248-52;vaaram.和vaarat.thenovelpolymyxinderivativenab739isremarkablylesscytotoxicthanpolymyxinbandcolistintohumankidneyproximaltubularcells.intjantimicrobchemother2013,41:292-3;vaara,m.2013,newderivativesofpolymyxins,journalofantimicrobialchemotherapy2013,68:1213-9)。虽然这些化合物(例如nab739)对革兰氏阴性菌具有良好的抗菌性,但是期望尝试开发以可靠且明确的方式耐受更良好的衍生物。目前,出人意料地意识到,如本文中定义的具体多黏菌素衍生物表现出对革兰氏阴性菌的期望的高抗菌作用而没有不可接受的肾毒性。根据美国专利申请2006004185(还参见qualej.等,activityofpolymyxinbandthenovelpolymyxinanaloguecb-182,804againstcontemporarygram-negativepathogensinnewyorkcity,microbdrugresist2012,13:574-81),在2010年已停止cb-182,804(一种在其他方面与多黏菌素b相同但携带2-氯-苯基氨基-羰基作为与n端连接的脂肪酰基部分的分子)的开发。在狗的肾毒性研究中,dap-3多黏菌素类似物与多黏菌素b没有充分差异(mageet.v.等,discoveryofdap-3polymyxinanaloguesforthetreatmentofmultidrug-resistantgram-negativenosocomialinfections,j.med.chem.2013,56:5079-5093)。两个项目均只包含具有五个正电荷的化合物。这种尝试还包括kern及其合作者的尝试(keirsteadn,earlypredictionofpolymyxin-inducednephrotoxicitywithnextgenerationurinarykidneyinjurybiomarkers,toxicolsci2014,137:278-91)。未公布任何细节或任何另外的进展。专利申请wo/2013/072695描述了各自携带至少四个正电荷的超过30种多黏菌素九肽。它们中的若干种较多黏菌素b和黏菌素对人肾近端小管上皮细胞(humanrenalproximaltubuleepithelialcell,hrptec)细胞系hk-2的细胞毒性小。此外,在7天大鼠研究中,它们中的三种较同等剂量的黏菌素在较小程度上提高尿半胱氨酸蛋白酶抑制剂c、白蛋白和nag水平。专利申请wo/2014/188178继续了wo/2013/072695中描述的工作。如标题“polymyxinderivativesandtheiruseincombinationtherapytogetherwithdifferentantibiotics”表明,主要重点在于通过早先专利申请的多黏菌素衍生物增强其他抗生素(例如利福平)以及若干种新型衍生物的活性。一些新型衍生物(实例衍生物44、46和48)在r3处(根据常用于多黏菌素的方案对氨酰基残基进行编号,即,来自多黏菌素b之n端的第一个残基编号为r1)携带dser。它们中之一(衍生物46)仅携带三个正电荷。它是nab739类似物,在其他方面与nab739相同但携带2-环己基-2-羟基乙酰基(也称为2-环己基-2-羟基乙酰基)作为末端部分,而nab739携带辛酰基。该申请总共描述了大约100种衍生物,除上述衍生物实例46之外,这些衍生物携带4至6个正电荷。除衍生物实例19、30、31和32(其环状七肽部分与多黏菌素e的环状七肽部分相同)以及衍生物实例50(其环状七肽部分与多黏菌素s的环状七肽部分相同)之外,所有衍生物其环状七肽部分与多黏菌素b相同。很多衍生物较多黏菌素b和黏菌素对人肾近端小管上皮细胞(hrptec)细胞系hk-2的细胞毒性较小。此外,在7天大鼠研究中,证明它们中的三种(实例衍生物1、4和10)较同等剂量的黏菌素在较小程度上提高尿半胱氨酸蛋白酶抑制剂c、白蛋白和nag水平。在该申请中,表明在n端基团中存在氨基官能团可降低肾毒性。然而,在具有众所周知的肾毒性的多黏菌素b和黏菌素中,r1确实携带游离氨基。该申请还表明n端中的羟基和/或杂环基可具有类似的降低毒性作用。寻找临床相关的肾毒性模型具有挑战性。mageet.v.等,2013(参见上文)表明多黏菌素衍生物5x(其中r3是二氨基丙酰基(代替二氨基丁酰基)和相对极性的6-氧代-1-苯基-1,6-二氢吡啶-3-羰基作为脂肪酰替代物)较多黏菌素b对人肾近端小管上皮细胞(hrptec)的细胞毒性显著更小。此外,在7天大鼠研究中,5x较多黏菌素b具有较小肾毒性。受这些结果鼓舞,作者进行了7天狗研究。在该研究中,肾毒性结果仅略微支持5x。作者得出结论认为,关于肾病变,在大鼠中5x较多黏菌素b耐受性更好,但是这种优势在狗中不成立,表明在该物种中预测肾毒性的hrptec测定失败。在同一实验室的另一项研究(burtd.等,applicationofemergingbiomarkersofacutekidneyinjuryindevelopmentofkidney-sparingpolypeptide-basedantibiotics.drugchemtoxicol.2014;37:204-12)中,多黏菌素b在狗和猴中引起s-crea和bun应答的快速起效,而在大鼠中则不引起s-crea和bun应答的快速起效。作者得出结论认为,在大鼠中缺乏应答可能归因于物种特异性多黏菌素b应答和肾脏生理学方面的差异。本研究中不包括化合物5x。因为s-crea和bun是临床治疗中非常相关的肾毒性标志物,故可以预期动物模型例如狗或猴较啮齿动物模型更可靠地预测人的肾毒性。因此,体外hrptec测定和体内大鼠研究(如它们在其他方面一样具有吸引力)可能误导性地给出不能在更接近人的动物模型中重复的有希望的结果。nab815及其先前描述的参考化合物nab739落入仅携带三(3)个正电荷的多黏菌素的范畴中。如此处目前所示,在食蟹猴中两者较多黏菌素b明显具有更小的肾毒性。此外,nab815较nab739甚至具有更小的肾毒性。所有的动物均对其耐受。患者对多黏菌素b和黏菌素应答的异质性具有临床意义,因为一些患者似乎比另一些患者更易受肾毒性作用的影响。由同样高剂量(36mg/kg/天)的nab739和nab815诱导的形态学研究结果的组织病理学比较显示,nab815的肾病改变不太严重。因此,nab815较nab739具有明显优势。虽然不希望受理论束缚,但这可能是由于电荷分布的差异。鉴于nab739在七肽环中携带其所有三个正电荷,nab815在七肽环中仅携带两个正电荷。因此,nab815的七肽环不像任何已知的多黏菌素。在相同发明人的先前专利申请(pct/fi2007/050441)和公开(vaaram.等,2008.novelpolymyxinderivativescarryingonlythreepositivechargesareeffectiveantibacterialagents.antimicrobagentschemother52:3229-3236;vaara,m.,t.vaara.2010.structure-activitystudiesonnovelpolymyxinderivativesthatcarryonlythreepositivecharges.peptides31:2318-2321)中,所有在环部分中具有两个正电荷以及在尾部分中具有一个正电荷的分子(nab715、nab716和nab717)是一个主题的变体。尾部中的一个正电荷在r3位置,并且环状部分中的两个正电荷在r5、r8和r9的三个可能位置之间转移。在三种组合(正电荷在r5&r8处、在r5&r9处和在r8&r9处)中,仅一种(r5&r9)表现出活性,然而,该活性显著低于在环状部分中具有所有三个正电荷(在r5&r8&r9处)的最佳化合物(nab739和nab737)的活性。在设计根据本专利申请的化合物(nab815)中,采用了完全不同的方法。在尾部分中,保留两个羟基(由于分别在r2和r3处的thr和dthr),并且正电荷被置于r1处(而不在r3处)。作为出人意料的结果,可保留高抗菌活性,而仅三个正电荷中之一位于尾部分。早先专利申请和随后的公开未公开任何具有其中含有一个正电荷的全长尾部(r1、r2和r3)的化合物。非常明显,也如此处所示的是,在食蟹猴中nab815以非常显著的程度被排泄到尿中,而多黏菌素b的排泄几乎为零。这在治疗源于泌尿道的严重感染中可能是有利的。因此,本发明提供了具有式(i)的化合物及其可药用盐:其中r1为dabr2为thrr3为dthrr4为dabr5为dabr6为dpher7为leur8为abur9为dab;r10为thr;以及r(fa)为辛酰基。本发明的化合物包含环状七肽部分r4-r10和与n端氨酰基残基r4连接的侧链。侧链由r(fa)-三肽(r1-r3)残基组成。r(fa)是与三肽侧链的n端氨基酸残基的α-氨基连接的辛酰基残基(oa)。具体地,r1-r10表示氨基酸序列dab-thr-dthr-cy[dab-dab-dphe-leu-abu-dab-thr-],即,seqidno.1。因此,根据本发明的化合物是oa-dab-thr-dthr-cy[dab-dab-dphe-leu-abu-dab-thr-],即,oa-seqidno.1或其可药用盐。如将由以下讨论的示例性药理学测试结果所示,式(i)化合物表现出高的抗菌活性并且对施用仅表现出较少或没有不期望的肾毒性作用。本文中使用的缩写:dab是指α,γ-二氨基正丁酰基,即2,4-二氨基丁酰基;abu是指2-氨基丁酰基;thr是指l-苏氨酸;dthr是指d-苏氨酸;dphe是指d-苯丙氨酸;leu指l-亮氨酸;以及oa是指辛酰基。表述“可药用的”表示可用于制备通常是安全、无毒且在生物学上和在其他方面均不是不期望的药物组合物,并且包括可用于兽医以及人制药用途两者。术语“可药用盐”是指含酸和碱的盐并且已知是无毒且常用于药物文献中的盐。这样的盐的实例是通过使用可药用无毒酸形成的酸加成盐,所述可药用无毒酸是例如盐酸、硝酸、硫酸、磷酸、草酸、富马酸、马来酸、琥珀酸、乙酸、柠檬酸、抗坏血酸、马来酸、苯甲酸、酒石酸、碳酸等。通常使用的用于形成可药用盐的酸是硫酸。本文中已使用的“包括”或“包含”表示随后描述的组,可以但不必包括其他要素。本发明的化合物可抑制具有临床重要性的革兰氏阴性菌生长,或使其对抗菌剂致敏。所述革兰氏阴性菌可以是属于下列的那些:不动杆菌属(acinetobacter)、产气单孢菌属(aeromonas)、产碱杆菌属(alcaligenes)、博德特菌属(bordetella)、布兰汉氏菌属(branhamella)、弯曲杆菌属(campylobacter)、柠檬酸杆菌属(citrobacter)、肠杆菌属(enterobacter)、埃希氏菌属(escherichia)、弗朗西丝氏菌属(francisella)、梭杆菌属(fusobacterium)、嗜血杆菌属(haemophilus)、螺杆菌属(helicobacter)、克雷伯氏菌属(klebsiella)、军团菌属(legionella)、莫拉氏菌属(moraxella)、巴斯德氏菌属(pasteurella)、邻单胞菌属(plesiomonas)、假单胞菌属(pseudomonas)、沙门氏菌属(salmonella)、沙雷氏菌属(serratia)、志贺氏菌属(shigella)和耶尔森氏菌属(yersinia)的物种。所述细菌可以是,例如:大肠杆菌(escherichiacoli)、肺炎克雷伯氏菌(klebsiellapneumoniae)、产酸克雷伯氏菌(klebsiellaoxytoca)、阴沟肠杆菌(enterobactercloacae)、产气肠杆菌(enterobacteraerogenes)、其他肠杆菌物种、弗氏柠檬酸杆菌(citrobacterfreundii)、绿脓假单胞菌(pseudomonasaeruginosa)、其他假单胞菌物种、波美不动杆菌(acinetobacterbaumanni),以及许多其他非发酵型革兰氏阴性菌物种。所述细菌还包括幽门螺杆菌(helicobacterpylori)以及其他具有临床重要性的革兰氏阴性菌。特别地,所述革兰氏阴性杆菌选自:大肠杆菌、肺炎克雷伯氏菌、产酸克雷伯氏菌、阴沟肠杆菌、弗氏柠檬酸杆菌、绿脓假单胞菌和波美不动杆菌,优选地,所述革兰氏阴性菌选自:大肠杆菌、肺炎克雷伯氏菌、绿脓假单胞菌和波美不动杆菌。可用本发明的化合物治疗的细菌感染包括例如:菌血症(bacteremia)、败血症、皮肤和软组织感染、肺炎、脑膜炎、盆腔腹膜区的感染(pelveoperitonealregion)、异物感染、血液病患者的发烧、与静脉内线或其他导管、管道(canyl)和/或装置相关的感染、胃肠道、眼内或耳内的感染、浅表皮肤感染以及潜在毒性细菌在胃肠道、黏膜和/或皮肤的定殖。本发明的化合物可用于治疗细菌感染和/或细菌感染性疾病,特别是革兰氏阴性菌引起的细菌感染和/或细菌感染性疾病。炎性疾病和病症的实例包括但不限于:严重的医院获得性感染、免疫受损患者的感染、器官移植患者的感染、重症监护室(intensivecareunits,icu)处的感染、烧伤创面的严重感染、严重的社区获得性感染、囊性纤维化患者的感染以及由多重抗性革兰氏阴性菌引起的感染。因此,本发明提供了治疗细菌感染,特别是由革兰氏阴性菌引起的感染的方法,其包括向有此需要的患者施用如本文中限定的化合物或如本文中限定的药物组合物。本发明的化合物可以以约1mg/kg体重至约300mg/kg体重,优选3mg/kg体重至100mg/kg体重的日剂量范围内的有效量施用。本发明的化合物可以以单一日剂量施用,或者每日总剂量可以以每日两次、三次或四次的分剂量施用。“有效量”是指赋予被治疗的对象治疗效果的化合物的量。治疗效果可以是客观的(即,通过一些测试或标志物可测量的)或主观的(即,对象给出效果的指示或感觉到效果)。这样的治疗不一定完全改善疾病的状况。此外,这样的治疗或预防可与用于减轻本领域技术人员已知的病症的其他传统治疗结合使用。本发明的化合物最优选单独使用或在其他活性成分,特别是其他抗菌剂中使用。所述其他活性成分可与本发明的化合物以任何顺序同时或依次施用。所述抗菌剂可选自:克拉霉素、阿奇霉素、红霉素和其他大环内酯类,酮内酯类,氟代酮内酯类(fluoroketolide),克林霉素和其他林可酰胺类,链阳性菌素类,利福平、利福布汀、利福拉齐和其他利福霉素类,夫西地酸、莫匹罗星、唑烷酮类,万古霉素、达巴万星(dalbavancin)、特拉万星(telavancin)、奥利万星(oritavancin)和其他糖肽抗生素,氟喹诺酮类、杆菌肽、四环素和氟代环素类衍生物、β-内酰胺类抗生素、新生霉素、截短侧耳素(pleuromutilin)、叶酸合成抑制剂、去甲酰酶抑制剂和细菌流出泵抑制剂。特别地,所述抗细菌剂可选自:克拉霉素、阿奇霉素、红霉素、泰利霉素、索利霉素(solithromycin)、克林霉素、链阳性菌素组合奎奴普丁-达福普汀、eravacycline、米诺环素、omadacycline、利福平、利福布汀、利福拉齐、夫西地酸、莫匹罗星、唑烷酮类特地唑胺和利奈唑胺、万古霉素、达巴万星、奥利万星、特拉万星、氟喹诺酮类莫西沙星、德拉沙星和avarafloxacin以及叶酸合成抑制剂三甲氧苄氨嘧啶。本发明的化合物可通过多种途径施用,例如,肠胃外、皮下、静脉内、关节内、鞘内、肌内、腹膜内和通过皮内注射及经皮、经直肠、经颊、经口腔粘膜、经鼻、经眼睛途径以及通过吸入和通过植入。包含本发明的化合物作为活性成分的药物组合物还可包含可药用添加剂,例如促进将活性化合物加工成药学上可使用的制剂的可药用载体和/或赋形剂。合适的药物组合物可包含本发明的化合物与一种或更多种其他活性成分(特别是如上讨论的抗菌剂)的组合。化合物可配制成合适的组合物;合适的施用形式包括例如溶液剂、分散剂、混悬剂、散剂、胶囊剂、片剂、丸剂、控制释放胶囊剂、控制释放片剂和控制释放丸剂。一般制备方法本发明的化合物可通过本领域已知的方法制备。以下实施例举例说明了式(i)的化合物的制备。实施例1:nab815的合成nab815(结构式为辛酰基-αdab-thr-dthr-[环-α,ydab-αdab-dphe-leu-abu-αdab-thr],其中r10处的羧基端thr通过其羧基与r4处的2,4-二氨基丁酸残基(dab)的4-氨基连接,相对分子质量为1175.44)可以例如使用先前描述的用于其他多黏菌素衍生物(例如nab739)的方法(美国专利7,807,637)通过常规固相化学法来合成。c端氨基酸是预先连接在固相上市售的,当用酸将其从树脂上切下时,得到c端羧酸。保护策略是使用三个水平的正交保护(orthogonalprotection)——对α氨基功能的暂时性fmoc保护;通过在酸切割阶段被除去的基团对参与环化的dab残基的γ-氨基的保护;以及在环化反应发生过程中覆盖反应性侧链功能的半永久性保护。在所述肽从树脂上切下之后,c端羧酸与r4处的二氨基丁酸残基(dab)的γ-氨基反应形成环状肽。在环化步骤之后,除去半永久性保护基团得到nab肽。因此,氨基酸的α氨基功能被芴甲氧羰基(fmoc)保护,并且在每个循环用二甲基甲酰胺(dmf)中的20%哌啶除去fmoc。用叔丁氧羰基(tboc,在切割步骤被除去的酸不稳定基团)保护参与环化的氨基酸(即,r4处的dab)。用对酸切割步骤稳定的基团(即,苄氧羰基(z))保护具有功能性侧链基团的氨基酸。氨基酸d-苯丙氨酸和亮氨酸天然地不需要侧链保护。氨基端不被保护;这使得在酰基化过程中发生直接反应。在商业自动化合成仪中进行合成步骤,其中使用脲六氟磷酸o-(6-氯苯并三唑-1-基)-n,n,n’,n’-四甲基(hctu)作为活化剂。通过使用4倍摩尔过量的每种氨基酸或脂肪酸、4倍摩尔过量的活化剂hctu(见上文)和8倍摩尔过量的n-甲基吗啉进行酰化反应。反应时间为30分钟。已受保护的氨基酸购自标准供应商。通过用95%三氟乙酸和5%水的溶液在室温下反应2小时从树脂上移去肽,得到部分保护的产物。用乙醚沉淀所得肽。所使用的环化混合物是苯并三唑-1-基-氧代-三吡咯烷基鏻六氟磷酸盐(pybop)、n-羟基苯并三唑(hobt)和n-甲基吗啉(nmm),分别以摩尔量计过量2、2和4倍。将所述肽溶解在二甲基甲酰胺中,添加环化混合物并使其反应2小时。通过加入冷的乙醚沉淀环化的受保护肽。通过用水洗涤所述肽除去任何残余的pybop。通过催化脱氢除去剩余的侧链保护基团(z)。将所述肽在氢气气氛和钯炭(palladiumcharcoal)催化剂存在下溶解于乙酸-甲醇-水(5∶4∶1)中。通过反相色谱使用常规乙腈∶水∶三氟乙酸梯度纯化所述肽。通过冻干使产物干燥。nab815被转化为其硫酸盐。产物为白色冻干物。其在溶液(在水中1mg/ml)中的外观为透明且无色。当通过esi-ms鉴定时,m为1175.4u(平均质量)。药理学测试提供以下实施例以示例性方式说明本发明,这些实施例不应被认为限制本发明的范围。此外,测定中化合物的浓度是示例性的并且不应被认为是限制。本领域技术人员可用本领域已知的方法定义药学上相关浓度。所有动物实验均按照伦理行为标准和合适的机构动物护理和使用策略进行。实施例2:nab815及其比较物的抗菌活性化学品来源:nab815硫酸盐(批号1051607;通过hplc测定的纯度98.8%)和nab739硫酸盐,结构式为辛酰基-thr-dser-[cyclo-α,γdab-αdab-dphe-leu-αdab-αdab(即,oa-seqid2)(批号1049851,通过hplc测定的纯度为97.3%)。多黏菌素b硫酸盐获自sigma-aldrich,st.louis,mo,usa(目录号p0972,批号bcbf8382v;纯度89.3%)。使用如临床和实验室标准学会(clinicalandlaboratorystandardsinstitute)2012年所述的clsi标准方法和müller-hintonii培养基(methodsfordilutionantimicrobialsusceptibilitytestsforbacteriathatgrowaerobically.approvedstandard,第九版.clsi文献m07-a9.临床和实验室标准学会,wayne,pa.),一式三份地完成最小抑制浓度(minimuminhibitoryconcentration,mic)测定。由含有5%绵羊血的胰酶解酪蛋白大豆琼脂上的过夜培养物制备起始接种物(5×105cfu/ml)。将微量滴定板在35℃下孵育20小时,此时目视读取所述板。通过使用多黏菌素衍生物与利福平(革兰氏阴性菌的完整外膜充当渗透屏障的这样的抗菌剂的一种模型化合物)的组合进行协同研究。表1示出了mic值(μg/ml),即多黏菌素b、参考化合物(nab739)和根据本发明的化合物(nab815)单独以及与固定浓度的利福平(0.25μg/ml)*组合的抗菌活性,包括多黏菌素易感和多黏菌素不易感菌株两者。表1*不存在利福平的情况下的mic值是来自一式三份测定的模态mic值和来自一式两份测试板测定(checkerboardassay)的mic的概要。存在利福平(0.25μg/ml)的情况下的mic值来自一式两份测试板测定。靶标菌株名称后的括号中示出了每种靶标菌株的利福平的模态mic(μg/ml)(来自一式三份测定)。nab815对大肠杆菌、肺炎克雷伯氏菌和不动杆菌的多黏菌素易感菌株的mic与nab739和多黏菌素b的mic相同或非常接近。多黏菌素b较nab815和nab739对绿脓假单胞菌以及对三种菌株(其显示出对多黏菌素b的易感性降低)中的两种(肺炎克雷伯氏菌jm109和波美不动杆菌cmi417)显示出更好的活性。所有三种肽的亚抑制浓度显著增强了利福平的活性(表1)。在1μg/ml下,nab815将利福平对肺炎克雷伯氏菌atcc43816的mic从16μg/ml降低至0.25μg/ml(即,降低64倍),并将利福平对大肠杆菌atcc25922和大肠杆菌jmi3328的mic从8μg/ml降低至0.25μg/ml(即,降低32倍)。非常重要的是,显示出对多黏菌素的易感性降低的菌株也易受nab815和利福平的组合活性的影响。用nab739获得了非常相似的结果。针对绿脓假单胞菌,nab815和nab739两者与利福平均缺乏任何显著的协同活性。总之,nab815和nab739的抗菌活性不仅在单独时而且在利福平的存在下彼此相同或非常接近。实施例3:毒性和毒代动力学研究通过使用食蟹猴进行体内毒性和毒代动力学研究。进行动物研究的实验室得到了实验动物护理评估和认可协会(associationforassessmentandaccreditationoflaboratoryanimalcare,aaalac)认可,具有由实验动物福利局(officeoflaboratoryanimalwelfare,olaw)签发的动物福利保证,已向美国农业部(unitedstatesdepartmentofagriculture,usda)登记,并且具有负责遵守关于实验动物人道关怀和使用的适用法律法规的机构动物护理和使用委员会(iacuc)。使原初雌性食蟹猴适应研究室28天,在此期间向每只动物植入永久性留置股骨导管以允许连续的静脉内输注。在开始给药前,允许动物至少2周的手术恢复期。化学品来源如下:nab815硫酸盐(批号1051607;通过hplc测定的纯度98.8%,以及批号1054308;通过hplc测定的纯度98.4%)和nab739硫酸盐(批号1049851,通过hplc测定的纯度97.3)。多黏菌素b硫酸盐来自sigma-aldrich(目录号p0972,批号bcbf8382v)。在使用的每一天,称量合适量的nab739、nab815或多黏菌素b并溶解在合适体积的无菌盐水中以制备每个测试品和阳性对照的储备溶液。在储备溶液制备中使用校正因子以考虑每个测试品中的纯度和硫酸盐含量两者。因此,剂量(例如36mg/kg/天)是指纯肽作为其游离碱形式而不是作为其硫酸盐的剂量。剂量如下:多黏菌素b18mg/kg/天(第1组),多黏菌素b24mg/kg/天(第2组),nab73924mg/kg/天(第3组),nab73936mg/kg/天(第4组),nab81524mg/kg/天(第5组),nab81536mg/kg/天(第6组)。每个研究组包括三只动物。持续7天,通过静脉内(iv)输注每日三次(tid)向动物给药,剂量体积为10ml/kg持续1小时(±10分钟),间隔8±0.5小时。初始剂量施用当天被指定为研究第1天,后续日期连续编号。初始剂量施用前的日期连续编号,将适应环境的最后一天称为第-1天。以设计的间隔评估以下参数:临床观察、体重、临床病理学(血液学、凝血、血清化学、包括尿沉渣和尿化学的尿液分析)、毒代动力学(血浆和尿液)和解剖病理学(肾脏)。在事先未安排的基础上处死动物的情况下,在处死之日取样。在尸检当天,用氯胺酮使动物镇静,称重并用静脉内注射商业戊巴比妥和苯妥英溶液麻醉,随后放血。在第8天进行存活动物的最终尸检。在多黏菌素b组中在第4天对一只接受18mg/kg/天(第1组)的动物和两只接受24mg/kg/天(第2组)的动物,以及在第5天对两只接受18mg/kg/天(第1组)的动物进行事先未安排的尸检。在第5天,对接受36mg/kg/天(第4组)的nab739组中的一只动物也进行了事先未安排的尸检。尸检时,记录总体观察值和器官重量,并收集特定组织。在用苏木精和伊红(h&e)染色的肾脏切片上进行组织病理学。在蛋白质沉淀后,通过使用与质谱仪连接的液相色谱仪确定毒代动力学(tk)研究的血浆和尿液浓度。将样品(100μl)与水∶甲酸(99∶1体积/体积;50ml)中的内标溶液混合。然后添加600μl的100∶1乙腈∶甲酸。将板以3200rpm离心5分钟。使用tomtecquadra96,将450μl等分试样转移到新的96孔板中并在氮气下于40℃下干燥。然后,添加200μl的水∶甲醇∶甲酸(85∶15∶1体积/体积),并将板密封用于lc-ms/ms注射。lc-ms系统由与thermoscientifictsq定量三重四极ms(离子化为正离子模式)连接的watersacquity液相色谱仪组成。将每个样品(20μl)注入到在50℃下平衡的watersacquitybehshieldrp18柱(2.1×50mm;1.7μm)上。流动相a为85∶15∶1体积/体积的水∶甲醇∶甲酸。流动相b为50∶50∶1体积/体积的乙腈∶甲醇∶甲酸。适用于量化所有化合物的梯度示于表2中。时间(分钟)流速(ml/分钟)a%b0.000.400100.00.01.000.400100.00.01.100.40088.02.03.000.40088.02.03.100.40084.06.06.000.40084.06.06.100.40050.00.07.900.40050.00.08.000.400100.00.010.00.400100.00.0每种化合物的质量转换和保留时间示于表3中。表3化合物保留时间q1m/zq3m/z多粘菌素b2.97602.67101.123nab7395.08539.11120.77nab8155.32588.67101.121粘杆菌素2.78585.6786.206使用黏菌素作为内标,使用多黏菌素b的(1/浓度2)线性拟合对校正标准响应的峰面积比进行回归。对于nab739和nab815,使用(1/浓度2)二次拟合(不使用内标)对校正标准响应的峰面积进行回归。根据分析物在开发过程中使用的浓度范围内的行为来选择回归模型。通过使用winnonlinphoenix6.3版软件(pharsight,cary,nc)进行毒代动力学分析。对于血浆tk,使用非区室iv输注模型。附图示出了在治疗前的动物中和在随后接受多黏菌素b、nab739或nab815的相同动物中的血尿素氮(bloodureanitrogen)(s-bun;图1)和血肌酸酐(s-crea;图2)(肾损伤的两种血液标志物)水平。附图还示出了这些动物中的尿n-乙酰基-β-d-氨基葡糖苷酶/尿肌酸酐比(u-nag/crea;图3)和尿γ-谷氨酰转移酶/尿肌酸酐比(u-ggt/crea;图4)(肾损伤的两种尿生物标志物)。通过使用olympus分析仪(olympusanalyzer,oa)和改进的jaffe方法测量s-crea和u-crea,通过使用oa和脲酶/l-谷氨酸脱氢酶测量s-bun。通过使用oa/酶法测量u-nag,以及通过使用oa和谷氨酰基-羧基对硝基苯胺ifcc测量u-ggt。在图1至4中,“*”表示动物由于严重的肾毒性作用而必须被安乐死。可得出结论,nab815较nab739具有显著更好的耐受性。一只以36mg/kg/天接受nab739的动物由于严重的肾毒性作用而必须被安乐死。在该动物中,所有四种标志物都显著提高。在另一只以36mg/kg/天接受nab739的动物中,两种尿生物标志物都显著提高。相比之下,nab815动物仅显示四种参数轻微提高(如果有的话),并且未经历预先安排的尸检。在24mg/kg/天的剂量下,一只接受nab739的动物表现出s-crea显著提高。在接受等量剂量的nab815的动物中,参数均不提高。正如预期的,多黏菌素b明显具有毒性。两只以24mg/kg/天接受多黏菌素b的动物和所有三只以18mg/kg/天接受多黏菌素b的动物都必须被安乐死。在所有六只动物中,s-bun、s-crea和u-ggt/crea显著提高。在五只动物中,u-nag/crea显著提高。由同样高剂量(36mg/kg/天)的nab739和nab815诱导的形态学研究结果的组织病理学比较显示nab815的肾病改变不太严重。在每只动物中记录以下肾病理参数的存在:管状嗜碱性粒细胞增多(再生)、管状退化/坏死、浸润(通过单核细胞和/或混合炎性细胞)、管状扩张和管状管型。每个参数得分如下:等级代码=0:无显著发现;1:最小;2:轻微;3:中等;4:显著。显著发现仅记录在安乐死的nab739处理的动物中,并且为如下:显著的管状退化/坏死以及明显存在管状管型。在处理中存活的nab739处理的动物在两个参数中均有中等发现。nab815处理的动物中的两只均仅在一个参数中具有中等发现。第三nab815处理的动物仅有最小或轻微发现。因此,nab815处理的动物相对于在nab739处理的动物中观察到的组织改变不太严重。当在第1天测定时,输注8mg/kg后,nab815在从时间0小时至8小时(auc0-8小时,小时*μg/ml)的浓度时间下的面积为102(sd=5),以及当在第7天测定时为110(sd=12)。在等量剂量(8mg/kg)的nab739后,对应的值为108(sd=2)和137(sd=2)。在等量剂量的多黏菌素b(8mg/ml)后,当在第1天测定时,值为112(sd=5)。因此,三种化合物各自的auc值彼此非常接近。非常显著地,在输注后8小时(0-8小时回收)内,极大部分剂量的nab815被排泄到尿液中。在输注8mg/kgnab815后,0至8小时回收率高达剂量的38%、55%和88%(对于每只动物给出的百分比)。nab739的对应回收率高达20%、91%和92%,以及多黏菌素b的回收率高达1%、2%和2%。尿液中所得的nab815和nab739浓度非常高。在以8mg/kg输注nab815后,在0至4小时或4至8小时样品中发现浓度高达175、225和260μg/ml(对于每种动物给出的浓度)。nab739的对应浓度为80、140和155μg/ml,以及多黏菌素b的对应浓度为7、9和15μg/ml。总之,nab815较nab739具有显著更小的肾毒性。两种化合物的auc彼此非常接近。两者都以非常显著的程度被排泄到尿液中,导致在尿液中浓度非常高。实施例4:另外的药代动力学数据数据来自实施例3中描述的食蟹猴研究,其中每日三次以1小时静脉内输注施用肽。如实施例3中所述确定肽的血浆和尿液水平。当肽以36mg/kg/天给药时,nab815的auc(小时*μg/ml)在第1天和第7天分别为153(sd,32)和205(sd,56)。nab739的对应值为239(sd,9)和302(无sd,动物数目,2)。在该剂量下,对于三种动物,在第1天,nab815的尿回收率(0至8小时尿液收集)分别为14.3%、20.9%和36.3%,在第7天为33.9%、40.5%和41.9%。在第1天,nab739的对应值为15.4%、20.4%和26.4%,在第7天为30.6%和55.8%(仅两只动物)。此外,对于三只动物,在第1天,nab815的尿液浓度(μg/ml,0至8小时尿液收集)分别为114、173和265,在第7天为17、62和149。在第1天,nab739的对应值为33、82和92,在第7天为268和348(仅两只动物)。实施例5:nab815和多黏菌素b在鼠类尿路感染中的比较效力该研究使用64只重量为28至32克的远交of-1雌性小鼠(charlesriver,法国)和大肠杆菌c175-94(血清型o8:k48:h4)(阐明1型菌毛的临床分离株)。肽为nab815(批号1054308)和多黏菌素b(sigma-aldrich,批次bcbf8382v)。该研究由丹麦哥本哈根的statensseruminstitut进行。研究开始前三天和研究期间,小鼠可自由获取5%葡萄糖作为饮用水。在第0天,通过轻轻按压腹部从膀胱中取出尿液。此后,用约0.15ml的舒泰(zoletil)混合物皮下(s.c.)麻醉小鼠。将具有含有细菌悬液的聚乙烯导管(bectondickison)的注射器通过尿道插入膀胱中并将50μl的细菌接种物缓慢注入到膀胱中。之后,将小鼠置于笼中。将小鼠放在加温箱中并监视直至完全清醒。测量菌落形成单位(colonyformingunit,cfu)后,确定接种物含有9.38log10cfu/ml,对应于8.08log10cfu/小鼠。在感染后第1天和第2天,用含有nab815、多黏菌素b或载剂(0.9%nacl)的溶液(0.2ml)经皮下处理小鼠,每天两次。治疗组(每组6只小鼠)如下:载剂对照;nab815,0.25mg/kg/剂量;nab815,0.5mg/kg/剂量;nab815,1mg/kg/剂量;nab815,2mg/kg/剂量;多黏菌素b,0.25mg/kg/剂量;多黏菌素b,0.5mg/kg/剂量;多黏菌素b,1mg/kg/剂量;和多黏菌素b,2mg/kg/剂量。此外,一组充当预处理对照以帮助评估在感染后第1天治疗开始前感染进展如何。在感染后第1天、第2天和第3天,对尿液进行取样用于菌落计数。在感染后第1天(预处理对照组)和感染后第3天(其他所有组),取尿样后,通过颈椎脱位处死小鼠并无菌地取出膀胱和肾脏。将膀胱和肾脏储存在-80℃下,随后分别在0.5ml和1ml盐水中匀浆。在取样后2至3小时内,立即对尿液中的cfu进行测定。将冷冻器官解冻并在组织裂解器上用钢珠匀浆。将所有样品、尿液、肾脏和膀胱在盐水中稀释10倍,并将20μl斑点一式两份地施涂于血琼脂平板上。此外,将未稀释的尿液样品(2至100μl,取决于尿液量)涂布在单独的琼脂平板上以确定菌落计数的最低可能检测水平。将所有琼脂平板在环境空气中于35℃下孵育18至22小时。当将感染后第1天的预处理对照组中的水平与在第3天治疗开始后2天的水平进行比较时,用1mg/kg/剂量和2mg/kg/剂量nab815治疗导致尿液中的cfu水平显著降低(分别为**p<0.01和*p<0.05(annovadunnett多重比较检验))。相比之下,在载剂对照组中,在接受0.25mg/kg/剂量和0.5mg/kg/剂量的nab815组中和在任何多黏菌素b组中未发现对应水平之间的显著差异。用nab815治疗在膀胱和肾脏中显示出cfu的剂量反应倾向,而用多黏菌素b治疗未显示出任何剂量反应倾向。在所有24只用0.25至2mg/kg/剂量的nab815处理的小鼠中,在8只小鼠的尿液和20只小鼠的肾脏中细菌水平低于检出限,而用多黏菌素b处理的小鼠的对应数量分别为1和10。对于本领域技术人员明显的是,随着技术进步,本发明构思可以以多种方式实现。本发明及其实施方案不限于上述实施例,而是可在权利要求书的范围内变化。序列表<110>北方抗生素有限公司<120>多粘菌素衍生物及其用途<130>2141858fi<160>1<170>patentinversion3.5<210>1<211>10<212>prt<213>人工序列<220><223>细菌<220><221>未确定<222>(1)..(1)<223>dbu<220><221>未确定<222>(3)..(3)<223>d-thr<220><221>unsure<222>(4)..(5)<223>dbu<220><221>unsure<222>(6)..(6)<223>d-phe<220><221>unsure<222>(8)..(8)<223>abu<220><221>unsure<222>(9)..(9)<223>dbu<400>1xaathrxaaxaaxaaxaaleuxaaxaathr1510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1