新型表达调节性RNA分子及其用途的制作方法
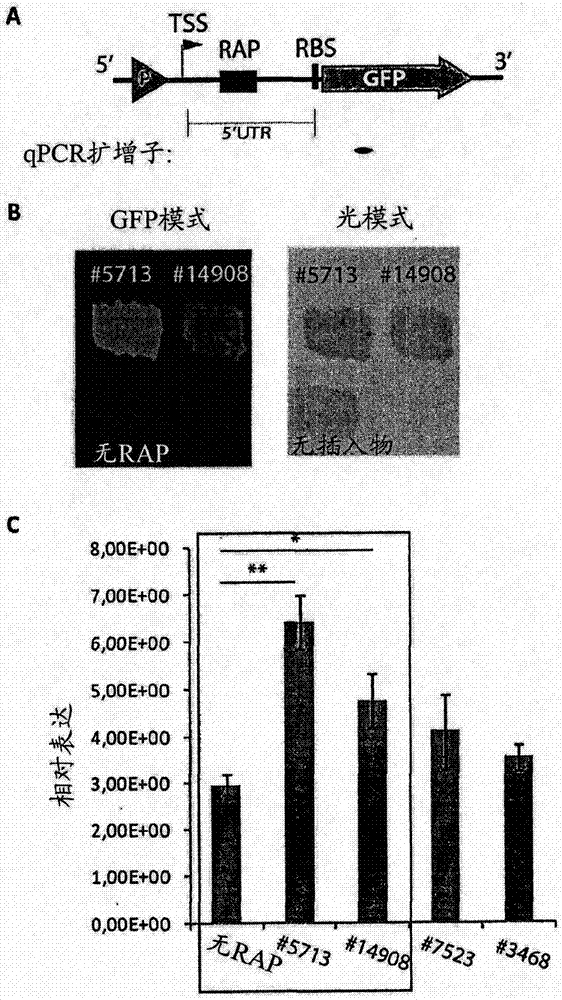
发明的
技术领域:
本发明涉及生物学领域,特别是生物
技术领域:
。更具体地,本发明涉及rna-生物学领域及其在调节基因表达中的意义,例如用于在宿主细胞中表达目标基因。发明背景在细菌中,从起始至延伸和终止的所有转录步骤均倾向于受反式作用蛋白和小rna的调节。此外,新生rna自身含有许多顺式作用调节信号。核糖开关是主要编码于新生rna的5’utr中的顺式作用rna元件,其直接感知小的代谢物、离子、温度或ph,导致转录、翻译或rna加工的调节(a.serganov,e.nudler,cell.152,17-24(2013);和s.proshkin,a.mironov,e.nudler,biochim.biophys.acta(2014),doi:10.1016/j.bbagrm.2014.04.002)。终止信号是调节性rna信号的另一实例,其可以分为两个大组:内在终止子和依赖因子的终止子(e.nudler,m.e.gottesman,genestocells.7,755-768(2002);和j.m.peters,a.d.vangeloff,r.landick,j.mol.biol.412,793-813(2011))。富含gc的rna发卡,之后是一段尿苷,这是独立于辅因子而引起终止的内在信号。依赖因子的信号处的终止需要存在识别特定rna区域的蛋白因子,如rho。新生rna还可以增加rnap的持续合成能力,提供依赖因子的或不依赖因子的抗终止信号。例如,噬菌体hk022putrna在整个延伸过程中直接结合rnap,使其抵抗终止(r.sen,r.a.king,r.a.weisberg,mol.cell.7,993-1001(2001);和n.komissarova等人,mol.cell.31,683-94(2008))。在进行性抗终止期间,依赖因子的顺式作用nutrna(boxa+boxb)协助噬菌体λn蛋白以及细菌nusa、nusb、s10。迄今为止未能发现共同属性。但是,所有已知的调节元件要求独特的二级结构,这使得它们难以设计。因此,对不需要独特的二级结构的调节性rna序列存在需求。当引入宿主细胞中用于表达时,在宿主细胞中异源表达的序列通常倾向于具有调节作用的序列。它们可以抑制表达,例如在转录或翻译的终止方面。例如,异源序列可以含有对在宿主细胞中的表达具有抑制作用的序列。这将导致对表达的非需要的限制。此外,宿主细胞中靶序列表达的输出可受在宿主细胞中具有调节作用的周围序列的影响。此外,由于转录相对链的聚合酶的互相妨碍,反向互补链的非需要的转录(例如,通过未鉴定的启动子序列进行的)可能引起转录效率的损失。因此,需要与待表达的序列内可能存在的抑制性元件无关的、允许目标序列在宿主细胞中适当表达的工具。具体地,允许重组蛋白在宿主细胞中高效产生的工具缺失或者被需要。尽管利用启动子(如诱导型启动子)通常可以调节或增强转录的起始和量,翻译效率的调节仍未充分解决。此外,当产生的蛋白对于宿主细胞具有有害作用时,异源宿主细胞中例如产生蛋白的某些序列的表达可能造成困难。现今,采用利用诱导型启动子的表达系统。此类启动子仅在存在某些刺激的情况下有效起始转录,例如向培养基中添加某种化合物。但是,此类启动子通常在未刺激的环境中促进基础表达,导致启动子的一定的泄露。如果蛋白具有有害作用,一旦诱导表达,这可能具有不利影响,并且可能导致无效表达。本发明的发明人现在提供一类新型调节性rna适配子,其在克服以上概述的缺陷中提供强大的作用。发明描述本发明的发明人有趣地发现了以高亲和力与rna-聚合酶相互作用的短的rna-聚合酶结合适配子(称为rap)。本发明的发明人确实鉴定了一些天然存在的rap。此外,他们发现这些适配子能够调节编码它们的dna-序列的表达。因此,提供了调节rna-聚合酶的全新工具,并因此提供了用于调节宿主细胞中dna编码的分子,如rna和/或蛋白的表达的工具。因此,本发明一方面涉及包含rna-聚合酶结合适配子的rna分子,其中所述rna-聚合酶结合适配子的长度为15至60nt,并且其中所述rna-聚合酶结合适配子以高亲和力结合rna-聚合酶,优选以50nm或更低的kd,优选以10nm或更低的kd结合rna-聚合酶。本发明还涉及编码本发明所述的rna-聚合酶结合适配子的dna-分子。本发明还涉及表达盒,其包含编码本发明所述的rna-聚合酶结合适配子的序列和启动子,其中编码所述适配子的序列可操作地连接至所述启动子。此外,本发明涉及载体,优选用于表达目标序列的载体,所述载体包含编码本发明所述的rna-聚合酶结合适配子的序列。在优选实施方案中,载体还包含启动子、用于整合目标序列的多克隆位点。载体可以包含本发明所述的dna-分子,优选本发明所述的表达盒。此外,在本发明的一个方面,表达盒包含编码启动子下游的抑制型rna-聚合酶结合适配子的序列的反向互补序列。在本发明的一个方面,表达盒包含启动子、待表达的dna序列或用于插入待表达的dna序列的多克隆位点以及编码所述待表达的dna序列或所述多克隆位点下游的3’utr的dna序列,其中编码3’utr的dna序列包含编码本发明所述的抑制型rna-聚合酶结合适配子的dna序列的反向互补序列。本发明还涵盖包含本发明所述的rna-聚合酶结合适配子的宿主细胞。此外,本发明涉及包含dna分子的宿主细胞,所述dna-分子包含编码本发明所述的rna-聚合酶结合适配子的序列。此外,本发明涉及表达目标序列,优选dna序列的方法,其包括下述步骤:提供本发明所述的载体,所述载体包含本发明所述的表达盒,将所述载体引入宿主细胞,以及在诱导或允许来自表达载体的启动子转录的条件下于培养基中培养所述宿主细胞。此外,本发明涉及本发明的rna-分子或dna-分子或表达盒或载体用于调节待表达的序列的表达的用途。换言之,在表达待表达的序列的方法中使用本发明所述的rna-聚合酶结合适配子,例如通过在编码待表达的序列的同一dna分子上编码所述适配子而顺式使用。附图说明图1.大肠杆菌基因组中rna-聚合酶结合适配子(rap)的分布。(a)根据rap在大肠杆菌基因组上的位置对rap进行的分类。灰色箭头显示带注释的基因。将rap的位置描绘为三角形。(b)来自大肠杆菌基因组内不同分类的rap的分布。(c)-(d)带注释的基因内正义(c)和反义(d)rap位置的分析。亮线显示所有注释的orf的各区域(+10%上游/下游)中存在的rap的计数。背景(黑色)显示来自1000次随机运行的各信号。图2.gfp报告系统(由细菌rna-聚合酶(rnap)驱动)中的激活型rap的作用。(a)用于检测位于gfp报告基因(gfp)上游的激活型rna-聚合酶结合适配子(rap;长方形)的作用的报告构建体的示意图。“p”(灰色三角形)指示组成型细菌rnap启动子的位置。tss:转录起始位点;rbs:核糖体结合位点。下方描绘了qrt-pcr扩增子的位置(透镜状的条)。(b)使转化有含有不同rap的gfp报告质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度测量(左图-gfp模式)。也在可见光下对同一平板进行捕获,其显示含有rap-gfp构建体的菌株的相等的细菌密度(右图-光模式)。(c)当通过细菌rnap转录时,含有不同rap(用其rapid表示)的报告基因转录本的水平。标准化至看家gapa水平的qrt-pcr数据。与不含rap的构建体相比,rapid#5713和#14908显著上调转录。与不含rap的构建体相比,对照构建体#7523和#3468未改变转录本的水平。数值代表平均值±sd,n≥3;**p<0.01;*p<0.05;ns:不显著(用t-检验进行检验,等方差)。图3.gfp报告系统(由噬菌体t7rnap驱动)中的激活型rap的作用。(a)用于检测位于gfp报告基因上游的激活型rna-聚合酶结合适配子(rap;长方形)的作用的报告构建体的示意图。“t7p”(三角形)指示由噬菌体t7rnap识别的噬菌体启动子的位置。tss:转录起始位点;rbs:核糖体结合位点。下方描绘了qrt-pcr扩增子的位置(透镜状的条)。(b)使转化有含有不同rap的gfp报告质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度测量(gfp模式)。(c)当通过噬菌体t7rnap转录时,上游含有不同rap(用其编号表示)的报告基因转录本的水平。标准化至看家gapa水平的qrt-pcr数据。与不含rap的构建体相比,rapid#5713和#14908未改变转录本的水平。数值代表平均值±sd,n≥3;ns:不显著(用t-检验进行检验,等方差)。图4.检测rap启动子的活性。(a)用于检测rap启动子活性的报告构建体的示意图。gfp报告基因上游原有的组成型细菌启动子(三角形)被rap(长方形)替代。tss:转录起始位点;rbs:核糖体结合位点。下方描绘了qrt-pcr扩增子的位置(透镜状的条)。(b)含有不同rap代替组成型细菌rnap启动子的报告基因转录本的水平。标准化至看家gapa水平的qrt-pcr数据。数值代表平均值±sd,n≥2。图5.检测启动子上游rapid#5713(seqidno:2)的活性。(a)用于分析的报告构建体的示意图。检测的rapid#5713或对照反向互补序列(rap-用长方形表示)位于原有组成型细菌启动子(灰色三角形)的上游。tss:转录起始位点;rbs:核糖体结合位点。下方描绘了qrt-pcr扩增子的位置(透镜状的条)。(b)分析中报告基因转录本的水平。标准化至看家gapa水平的qrt-pcr数据。数值代表平均值±sd,n≥2;**p<0.01;ns,不显著(用t-检验进行检验,等方差)。图6.rapid#5713促进通读内在终止子。(a)用于检测位于内在终止子“term”(图示显示为发卡)上游的rap(红色长方形)的抗终止作用的报告构建体的示意图。“p”(灰色三角形)指示组成型细菌rnap启动子的位置。tss:转录起始位点;rbs:核糖体结合位点。下方描绘了qrt-pcr扩增子的位置(透镜状的条)。(b)无rap序列不含内在终止子(无rap_无term)或者含有rrnb内在终止子(无rap_rrnb)/含有t7t内在终止子(无rap_t7t)的报告子转录本的水平。标准化至看家gapa水平的qrt-pcr数据。数值代表平均值±sd,n=3。(c)使转化有所述含有异源内在终止子的报告质粒的大肠杆菌细胞(在上方标记)在lb琼脂平板上生长,随后进行荧光强度的测量(左图-gfp模式)。也在可见光下对同一平板进行捕获,其显示相等的菌株细菌密度(右图-光模式)。(d)通过rna折叠软件(viennarna程序包)获得的rapid#5713-内在终止子构建体的二级结构预测(含有rrnb-上方的图,含有t7t-下方的图)。rapid#5713的序列离内在终止子111nt,并且不影响其折叠。(e)在rapid#5713存在和不存在的情况下,含有rrnb终止子的报告基因转录本的水平。标准化至看家gapa水平的qrt-pcr的数据。与不含rap的构建体相比,rapid#5713激活通读rrnb终止子(=rap作为抗终止子)高至8倍。数值代表平均值±sd,n=3。(f)在rapid#5713存在或不存在的情况下,含有t7t终止子的报告基因转录本的水平。标准化至看家gapa水平的qrt-pcr的数据。与不合rnp的构建体相比,rapid#5713激活通读t7t终止子(=rap作为抗终止子)高至14倍。数值代表平均值±sd,n=3。图7.rapid#5713(seqidno:2)促进依赖rho的终止子的抗终止。(a)用于检测位于依赖rho的终止位点rut(rut-用长方形表示)上游的rap(长方形)的抗终止作用的报告构建体的示意图。“p”(灰色三角形)指示组成型细菌rnap启动子的位置。tss:转录起始位点;rbs:核糖体结合位点。下方描绘了qrt-pcr扩增子的位置(透镜状的条)。(b)在bcm不存在的情况下,使转化有含有rut的报告质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度的测量(左图-gfp模式)。也在可见光下对同一平板进行捕获,其显示相等的菌株细菌密度(右图-光模式)。(c)在bcm存在的情况下(添加高至8μg/ml,终浓度),使转化有含有rut的报告质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度的测量(左图-gfp模式)。也在可见光下对同一平板进行捕获,其显示相等的菌株细菌密度(右图-光模式)。图8.激发rapid#5713(seqidno:2)的抗终止活性。(a)用于检测位于3个异源终止子t7t-tr2-rrnb(图示显示为发卡,对于序列,参见seqidno:45)区段上游的rap(长方形)的抗终止作用的报告构建体的示意图。“p”(灰色三角形)指示组成型细菌rnap启动子的位置。tss:转录起始位点;rbs:核糖体结合位点。(b)使转化有所述三终止子报告质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度的测量(左图-gfp模式)。也在可见光下对同一平板进行捕获,其显示相等的菌株细菌密度(右图-光模式)。(c)用于检测位于rrnb终止子(图示显示为发卡)上游串联克隆的一些rapid#5713(seqidno:2)(长方形,n=1、2或3)的抗终止作用的报告构建体的示意图。“p”(灰色三角形)指示组成型细菌rna-聚合酶(rnap)启动子的位置。tss:转录起始位点;rbs:核糖体结合位点。(d)使转化有所述1x、2x或3xrapid#5713报告质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度的测量(左图-gfp模式)。也在可见光下对同一平板进行捕获,其显示相等的菌株细菌密度(右图-光模式)。图9.检测rapid#5713在体外转录系统中的抗终止作用。(a)用于检测rap的体外抗终止活性的模板的示意图。“p”(灰色三角形)指示组成型强细菌rnap启动子t7a1的位置;tss:转录起始位点。rap(长方形)位于内在终止子rrnb(图示显示为发卡)的上游。(b)代表性的单轮失控转录分析(6%tbe-urea凝胶)。将含有rapid#5713的模板上的内在转录终止的效率与含有反向互补序列rev#5713的对照模板进行比较。用箭头标示内在终止的产物。上方的线(“失控”)指示失控产物。(c)利用如(b)中所述的单轮失控转录分析进行终止效率的量化。为了计算终止效率,将内在终止的强度除以总强度(内在终止+失控)。当在体外检测时,与对照rev#5713相比,含有rapid#5713的模板上的rnap的终止活性至少降低两倍。数值代表平均值±sd,n=3。图10.鉴定的转录增强型rap的计算机模拟分析。(a)rapid#5713(seqidno:2)二级结构的计算机模拟分析。rna折叠预测(折叠算法和基本设置:“最小自由能(mfe)和配分函数”,暗示除了最小自由能(mfe)结构外,计算配分函数和碱基配对概率矩阵)。(b)序列分析的序列标识呈现(schneidertd,stephensrm(1990).″sequencelogos:anewwaytodisplayconsensussequences″.nucleic.acids.res.18(20):6097-6100)。用基于基序的序列分析工具memesuite4.10.0进行预测。将报告激活型rap序列提交至使用下述参数的meme程序:“位点分布”-每条序列一个;“仅检索给定链”。序列宽度为23nt。e-值是8.8e-009。图11.导致转录终止的rap。(a)用于检测rap(长方形)的作用的报告构建体的示意图。“p”(三角形)指示用于不同实验设置的一些启动子的位置(诱导型/组成型细菌rnap启动子或噬菌体t7启动子)。tss:转录起始位点;rbs:核糖体结合位点。下方描绘了qrt-pcr扩增子和nothernblot探针的位置(透镜状的条;对于northernblot,分别命名为p1和p2)。(b)+(c)上游含有不同rap(以其rapid表示)的报告基因转录本的水平。标准化至看家gapa水平的qrt-pcr数据:(b)来自rnap启动子的转录;(c)来自噬菌体t7启动子的转录。(d)来源于含有rap的报告构建体的转录本的northernblot分析。上方的编号指示克隆进报告构建体的rap。上方的图“p2”:与位于rap下游的探针杂交的结果。中间的图“p1”:与位于rap上游的探针杂交的结果。箭头指示~150nt长的稳定转录本。下方的图:加载对照(sybr染色的尿素变性page)。图12.rap引起依赖rho的转录终止。(a)bcm(rho抑制剂)对含有不同rap的报告基因的表达的影响。终浓度为24μg/ml的bcm处理之前(深灰色条)和处理20’之后(浅灰色条),标准化至看家gapa水平的qrt-pcr数据。底部的编号指示克隆进报告构建体的rap。(b)用于用检测rap(显示为长方形)进行体外转录的模板的示意图。(c)-(d)代表性的失控转录分析。在rho不存在的情况下(泳道1、4、7、10、13),在rho存在的情况下(泳道2、5、8、11、14)或者在rho和nusg存在的情况下(泳道3、6、9、12、15),用ntp追踪预先形成的延伸复合物。使用15mut序列作为阴性对照。灰色条指示失控产物(上方部分)和初步转录终止的产物(下方部分)。图13.在对应激的应答中,rapid#15诱导其宿主基因内依赖rho的终止。(a)nadd基因orf以及用于测量rapid#15结构域上游(较亮的条)和下游(深色条)的内源nadd转录本的水平的qrt-pcr引物的位置的示意图。(b)qrt-pcr数据,在不同生长条件下rapid#15上游和下游的naddmrna水平。将上游mrna水平设定为100%,并将下游水平标准化至上游水平。图14.rap序列分析。(a)meme预测的基序占所有鉴定的rap的10%。(b)基因组selex深度测序结果的示例性屏幕截图。定位的读取形成峰,代表基因内rapid#15的rapid#15数据,其使用两种不同的比例呈现(参见踪迹注释)。上部:含有rap#15(图示用红色箭头显示)的整个nadd基因的视图。下部:含有rap#15检测序列的nadd基因的放大片段。图15.gfp报告系统中抑制型rap的作用。(a)用于检测位于gfp报告基因上游的rap(长方形)的作用的报告构建体的示意图。“p”(灰色三角形)指示组成型细菌rnap启动子的位置。rbs是核糖体结合位点。(b)-(i)使转化有含有不同rap(用rapid编码标记)的gfp报告质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度的测量(gfp模式,上方的图)。在可见光下对同一平板进行捕获,其显示含有rap-gfp融合物的菌株的细菌密度(光模式,下方的图)。(j)导致下调活性丢失的rapid#15(seqidno:25)最小序列内的突变。在改变的核苷酸(转换突变)加下划线,并以灰色显示(15mut)。(k)将rapid#15序列(seqidno:25)翻译成对应的蛋白序列。rapid#15位于编码烟酰胺-单核苷酸腺苷转移酶的保守区域的nadd的必要部分内。有趣的是,引入的突变在编码1/3的保守的催化氨基酸(加下划线)的序列内。(f)β-半乳糖苷酶分析的结果。上方的图:用于检测位于报告基因lacz上游的rap(长方形)的作用的报告构建体的示意图。下方的图:由含有不同rap-lacz报告子的大肠杆菌表达的β-半乳糖苷酶的活性。底部的编号指示报告构建体中的插入物(rap或突变体)。图16.含有rapid#15(seqidno:25)的转录本的3’race分析。(a)3’race程序的示意图。使5’-磷酸化的适配子连接至分离自转化有rap-lacz报告构建体的大肠杆菌的总rna的3’端。将获得的产物进行逆转录,随后利用用颜色指示的引物进行pcr。将pcr产物用凝胶分离、纯化并克隆,用于后续测序。(b)通过3’race获得的序列的比对,所述序列为含有rap的转录本,其表示初步依赖rap的转录终止的产物。(c)bcm处理之前和之后,含有rapid#15(seqidno:25)的转录本的3’race分析。在6.5%的聚丙烯酰胺凝胶上分离来自两次生物重复的3’racepcr产物。用st标记含有rapid#15的主要短转录本。用星号(*)标记非特异性扩增产物。向细菌培养物中添加bcm(rho抑制剂)导致较长的含有rap的转录本的明显累积(用条标记),同时降低了st转录本的水平(用箭头指出)。图17.抑制型rap顺式促进rnap中止。(a)上方的图:用于体外转录分析的含有rap的模板的示意图。“p”(灰色三角形)指示t7a1启动子。下方的图:利用含rap#15(泳道1-8)和反向互补对照15rev(泳道9-16)的模板的代表性的单轮失控分析(在溶液中)。在转录起始之后10、20、30、40、60以及>110秒,对转录本进行分析。分别通过深灰色和浅灰色的长方形指示转录本中的rap#15结构域和15rev对照序列。转录本的累积提示rap#15促进中止(比较泳道3-6vs.11-14)。与终止相对,中止导致较短转录本的最初累积,所述转录本随后随时间的推移而消失,因为rnap逃离中止并继续延伸以产生全长的失控转录本。扁豆状的条指示失控产物。(b)定位rap#15的位置。如实施例部分所述制备rna测序梯。在6%的测序凝胶上分离获得的转录本。将在追踪40秒之后停止的转录反应(参见图4a,泳道5)用作参照,并将其标记为“40s”。(c)(a)中所示的单轮失控转录的量化。对于各反应,基于在特定的时间点(0至60秒)达到的相对于累积的不含rap的较短转录本(长方形下的部分)的总信号的凝胶上的条带强度(%)来计算含有rap的转录本的丰度。图18.在抑制型rap中搜索共有中止g-10y-1g+1基序。(a)正义rap中g-10y-1g+1基序的富集分析。来自5’utr、3’utr和基因内分类的元件包含一组正义rap。红线描绘了含有该基序的正义rap的数目。柱状图显示了10,000个随机打乱的rap集合各自的数目。在打乱期间,使rap的数目、长度和链保持恒定,仅改变基因组位置。虚线显示分布的95%分位数,指示g-10y-1g+1基序在我们的正义rap集合中富集。(b)反义rap中g-10y-1g+1基序的富集分析。描述与(a)中相同。对于反义rap,未能观察到g-10y-1g+1基序的富集。图19.检测的抑制型rap内的核苷酸分布。数值代表一组序列内的平均值±sd。图20.抑制型rna-聚合酶结合适配子的鉴定的共有序列的序列标识呈现。用基于基序的序列分析工具memesuite4.10.0进行预测。将报告激活型rap序列提交至使用下述参数的meme程序:“位点分布”-每条序列一个;“仅检索给定链”。图中给出了e值。详见实施例2.图21.评估rap#5713反式过表达的影响。(a)用于评估反式激活型rap(rapid#5713;seqidno:2)对转录的影响的实验设计。用两种携带不同抗性标志物的相容质粒重转化大肠杆菌细胞(图示显示为圆环)。第一质粒(pmw)编码含有两个表征良好的终止子之一的gfp报告基因;即携带依赖rho的rrnb(pwm_rrnb)或rut内在终止子(pwm_rut)。第二质粒携带阿拉伯糖诱导型启动子,用于过表达细菌小(srna)形式的rap#5713。(b)左图:srna设计:不含rap的srna(srna)和含有rap的srna(rap_srna)。通过用相对应的rap序列替代碱基配对区域,将dsra、rpra及其杂交体的支架用于产生3种不同的含有rap的srna(分别为rap_srna1、rap_srna2和rap_srna3)。将用于含有rap的srna的检测的探针的位置描绘为椭圆形的条。右图:利用与rap#5713杂交的探针对来自转化的大肠杆菌细胞的总rna进行的northernblot分析。northernblot显示了l-阿拉伯糖(1%)诱导时,从rap_srna(基于pbad30)质粒过表达的,含有rap#5713的全长稳定转录本的累积(用箭头指示的较粗(主要)条带)。对加载对照进行5srna的探针检测。(c)-(d)用下述两种质粒共转化的结果:在报告gfp上游含有内在rrnb终止子(c)或rut位点(d)(图示分别显示为发卡或长方形)的pwm。此外,基于pbad30的rap_srna质粒用于过表达含有rap的srna(上方的图)。“p”(灰色三角形)指示组成型细菌rnap启动子的位置。tss:转录起始位点;rbs:核糖体结合位点。中间的图和下方的图:使共转化有所述gfp报告质粒和用于rap_srna过表达的不同质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度的测量(中间的图-gfp模式)。也在可见光下对同一平板进行捕获,其显示不同菌株的细菌密度(下方的图-光模式)。图22:转录增强型rap(酵母和人源的)基序(seqidno:138)的glam2输出,其调节大肠杆菌中的转录。图23:抑制型rap使得rho能够在翻译区内发挥作用。(a)用于检测rap15(seqidno:25)在翻译区内的抑制作用的报告构建体的示意图。上方的图:将内源环境中的rap15(蓝色三角形)(nadd基因的前168nt)与gfp报告蛋白融合。下方的图:含有rap15的反向互补序列-rev#15(绿色三角形)的对照构建体。“p”(灰色三角形)指示启动子的位置。tss:转录起始位点;rbs:核糖体结合位点。(b)-(c)大肠杆菌gfp平板分析。左图:在(b):不含双环霉素(bcm),(c):在bcm存在的情况下,使转化有nad(rap#15)-gfp或nad(rev#15)-gfp报告质粒的大肠杆菌细胞在lb琼脂平板上生长,随后进行荧光强度的测量(gfp模式)。右图:在可见光下对相应的板进行捕获,其显示含有翻译的融合物的菌株的细菌密度(光模式)。(d)用实时荧光检测进行的大肠杆菌生长实验。使转化有nad(rap15)-gfp或nad(rev#15)-gfp报告构建体(以蓝色或绿色显示)的细胞在lb培养基中生长,同时测量细胞密度(上方的图)和gfp强度(下方的图)。灰色垂直线分隔了指数期和稳定期。在各时间点,数值代表平均值±sd,n=3。(e)rap介导的转录终止模型。(1)引导核糖体与rnap的偶联未给rho留下加载到新生转录本上的空间(s.proshkin,a.r.rahmouni,a.mironov,e.nudler,science.328,504-8(2010),b.m.burmann等人,science.328,501-4(2010));(2)从rnap出口通道出现的抑制型rap与rnap相互作用,导致核糖体中止和rna成环;(3)裸露的非结构化的rna对于rho变得可用,以用于加载和终止转录。发明详细描述本发明的发明人有趣地发现,以高亲和力与rna-聚合酶相互作用的短的rna-聚合酶结合适配子调节编码它们的dna-序列的表达。因此,提供了用于调节rna-聚合酶的全新工具,并因此提供了用于调节宿主细胞中dna编码的分子,如rna和/或蛋白的表达的工具。因此,本发明具体涉及如本文所公开的rna-聚合酶结合适配子用于调节目标序列的表达的用途。本发明的发明人发现,本发明的rna-聚合酶结合适配子出人意料地顺式作用,即它们调节编码及转录它们的核酸的表达,例如编码它们的dna链的表达。因此,在本发明所有实施方案和方面中,本发明所述的rna-聚合酶结合适配子优选顺式使用。在本发明的背景下,顺式使用意为,编码rna-聚合酶结合适配子的序列如此放置,以使其与待表达的序列共同转录,即当转录时,其形成同一rna的一部分。一般而言,这意为编码rna-聚合酶结合适配子的序列位于本发明的构建体的转录起始位点的下游和转录终止信号的上游。本发明所述的rna-聚合酶结合适配子优选rna。进一步优选地,可在另一核酸,例如并且优选dna上编码所述rna-聚合酶结合适配子。因此,本发明还涉及包含编码所述rna-聚合酶结合适配子的序列的dna分子。完善建立了确定亲和力程度的方法,并且其在rna生物化学领域是已知的。具体地,已知方法可以确定核酸分子(如rna或dna)和蛋白或多肽如rna-聚合酶之间的亲和力。相互作用的亲和力可以用解离常数表示。解离常数通常用于描述配体(“l”;在当前情况中是rna-聚合酶结合适配子)与蛋白(“p”;在当前情况中是rna-聚合酶)之间的亲和力。换言之,解离常数表达了配体如何紧密结合特定蛋白。配体-蛋白亲和力受两个分子之间的非共价分子间相互作用的影响,如氢键结合、静电相互作用、疏水力和范德华力。可以通过双态过程来描述配体-蛋白复合物(“c”)的形成各自的解离常数(kd)可以表示为[p]、[l]和[c]分别代表蛋白、配体和复合物的摩尔浓度。解离常数的单位是摩尔浓度(m),并且对应于特定蛋白上的结合位点的一半被占据的情况下配体的浓度,即配体结合的蛋白的浓度[c]等于未结合配体的蛋白的浓度[p]的情况下配体的浓度。解离常数越小,配体结合越紧密,或者配体与蛋白之间的亲和力越高。例如,具有纳摩尔(nm)解离常数的配体与特定蛋白的结合比具有微摩尔(μm)解离常数的配体更紧密。可以用本领域技术人员众所周知的方法进行本发明所述的rna-聚合酶适配子的kd的确定。例如,可以通过rna电泳迁移位移测定(rnaemsa)来分析rna-聚合酶适配子(为rna)。在这种情况下,用体外转录的rna适配子和纯化的rna聚合酶进行emsa实验。为了确定kd值,用固定浓度的放射标记的rna和增加浓度的所选蛋白(rnap)进行一个或多个结合反应。详细的分步方案提供于r.k.hartmann,a.bindereif,a.e.westhof编辑的“handbookofrnabiochemistry”(2014),第二卷,pp.975-983,wiley,将其通过引用并入本文。本发明的发明人确定,通过重复使用selex程序,适配子以期望的高亲和力结合rna-聚合酶(7个循环的基因组selex,导致约10nm的解离常数)。因此,如果需要,技术人员可以对所选(例如,体外转录的)rna适配子进行emsa实验,以确定精确的kd。此类程序例如描述于n.windbichler,f.vonpelchrzim,o.mayer,e.csaszar,r.schroeder,rnabiol.5,30-40中,以及基因组selex描述于c.lorenz,f.vonpelchrzim,r.schroeder,nat.protoc.1,2204-12(2006)中,将这两者通过引用并入本文。本发明所述的rna-聚合酶结合适配子以50nm或更低的kd,更优选以10nm或更低的kd结合rna-聚合酶。本发明所述的rna-聚合酶结合适配子作为单链rna,优选以50nm或更低的kd,更优选以10nm或更低的kd结合rna-聚合酶。技术人员将会理解,本发明所述的rna-聚合酶结合适配子能够作为单链rna结合rna-聚合酶,即不需要与其它核酸如dna或另一rna链杂交。因此,优选地,本发明所述的rna-聚合酶结合适配子作为单链rna,以50nm或更低的kd,更优选以10nm或更低的kd结合本发明所述的rna-聚合酶。本发明所述的rna-聚合酶结合适配子作为单链rna,优选以50nm或更低的kd,更优选以10nm或更低的kd结合rna-聚合酶。本发明的发明人发现结合来自大肠杆菌的rna-聚合酶的rna-聚合酶结合适配子。但是,对技术人员而言将是显而易见的是,貌似本发明同样适用于其它rna-聚合酶,例如其它原核或真核生物的rna-聚合酶。技术人员将认识到,也适用于真核生物的rna-聚合酶,因为它们与一般的原核生物,并且特别是细菌的rna-聚合酶共有高的结构相似性。此外,在所附实施例部分,本发明的发明人证实,结合适配子的真核生物的rna-聚合酶也是用于调节待表达的序列的表达的工具。因此,在本发明的一个实施方案中,所述rna-聚合酶结合适配子结合选自原核生物的rna-聚合酶和真核生物的rna-聚合酶的rna-聚合酶,特别优选地,所述rna-聚合酶是原核生物的rna-聚合酶,更优选来自大肠杆菌的rna-聚合酶。真核生物的rna聚合酶ii和iii与细菌rna-聚合酶是最紧密相关的(参见,例如ebrightrh(2000),″rnapolymerase:structuralsimilaritiesbetweenbacterialrnapolymeraseandeukaryoticrnapolymeraseii″.j.mol.biol.304(5):687-698;以及nielsens,yuzenkovay,zenkinn.(2013),mechanismofeukaryoticrnapolymeraseiiitranscriptionterminationscience,340(6140):1577-1580),对于这一点,实施例显示了数据。因此,本发明所述的真核生物的rna-聚合酶优选选自真核生物的rna-聚合酶ii和真核生物的rna-聚合酶iii,特别优选如来自酵母或哺乳动物来源的真核生物的rna-聚合酶ii。rna-聚合酶优选来自通过rna-聚合酶的表达应被调节的生物,例如,如果rna-聚合酶结合适配子意图调节酵母中待表达的序列的表达,其优选结合酵母或哺乳动物细胞的rna-聚合酶,所述哺乳动物细胞如人细胞、非人的灵长类的细胞和啮齿动物的细胞,包括仓鼠细胞,如bhk21、bhk、cho、dg44,或者这些细胞系的衍生物/后代。下述细胞也适用:来自小鼠的骨髓瘤细胞,优选ns0和sp2/0-ag14细胞;和人细胞系,如hek293或per.c6;以及这些小鼠和人细胞系的衍生物/后代,例如,来自酵母或这些哺乳动物细胞系的rna-聚合酶ii或rna-聚合酶iii。如果应当调节细菌例如大肠杆菌中的rna-聚合酶,则适配子结合的rna-聚合酶是该生物例如大肠杆菌的rna-聚合酶。在一个实施方案中,原核生物的rna-聚合酶是细菌rna-聚合酶,更优选来源于革兰氏阴性细菌或革兰氏阳性细菌的细菌rna-聚合酶,最优选来源于革兰氏阴性细菌的细菌rna-聚合酶。在一个特别优选的实施方案中,本发明所述的rna-聚合酶是大肠杆菌的rna-聚合酶。技术人员将会理解,rna-聚合酶结合适配子可以与本发明所述的rna-聚合酶的任何亚基相互作用。但是,在本发明的优选实施方案中,rna-聚合酶结合适配子优选以50nm或更低的kd,更优选以10nm或更低的kd结合rna-聚合酶全酶。例如,此类细菌(例如大肠杆菌)rna-聚合酶的rna-聚合酶全酶可以包含rna-聚合酶核心和σ70,或者由rna-聚合酶核心和σ70组成。在一个实施方案中,真核生物的rna-聚合酶是真菌或哺乳动物来源的rna-聚合酶。在一个优选实施方案中,本发明所述的rna-聚合酶是酵母或哺乳动物细胞系的rna-聚合酶,所述哺乳动物细胞系如人细胞、非人的灵长类的细胞和啮齿动物的细胞,包括仓鼠细胞,如bhk21、bhk、cho、dg44,或者这些细胞系的衍生物/后代。下述细胞也适用:来自小鼠的骨髓瘤细胞,优选ns0和sp2/0-ag14细胞;和人细胞系,如hek293或per.c6;以及这些小鼠和人细胞的衍生物/后代。技术人员将会理解,rna-聚合酶结合适配子可以与本发明所述的rna-聚合酶的任何亚基相互作用。但是,在本发明的优选实施方案中,rna-聚合酶结合适配子优选以50nm或更低的kd,更优选以10nm或更低的kd结合真核生物的rna-聚合酶ii。例如,此类rna-聚合酶ii来源于酵母或哺乳动物细胞系,如人细胞或以上所列的细胞系。本发明所述的rna-聚合酶结合适配子较短。现今,已知噬菌体rna序列调节表达dna序列。但是,此类序列却相当长,并且需要特定且独特的二级结构。存在来自噬菌体(如hk022)的实例,其中噬菌体rna序列的长度显著长于60nt,并且显示出具有两个长茎的十分特别的二级结构。但是,本发明基于下述发现,当较短的rna适配子,例如长度为23至50nt的适配子与所述rna-聚合酶直接相互作用时,它们能够调节rna-聚合酶的活性。因此,本发明所述的rna-聚合酶结合适配子的长度为15至60nt,优选20至50nt,更优选23至50nt。对之前所述的调节性噬菌体rna的结构复杂性的需求使得它们倾向于依赖于它们所连接的序列而错误折叠。但是,本发明的发明人现在发现,本发明所述的天然的细菌或原核生物的rna-聚合酶结合适配子取代了对独特的二级结构的需求。在不受理论束缚的情况下,据信,该特性由与rna-聚合酶的高亲和力传达。因此,在一个实施方案中,本发明所述的rna-聚合酶结合适配子不具有确定的二级结构,优选如通过rnfold软件(vienarna程序包,rnafold-http://rna.tbi.univie.ac.at/cgi-bin/rnafold.cgi(r.lorenz,s.h.bernhart,c.hoenerzusiederdissen,h.tafer,c.flamm,p.f.stadlerandi.l.hofacker(2011),″viennarnapackage2.0″,algorithmsformolecularbiology:6:26;和i.l.hofacker,w.fontana,p.f.stadler,s.bonhoeffer,m.tacker,p.schuster(1994),″fastfoldingandcomparisonofrnasecondarystructures″,monatsheffef.chemie:125,pp167-188)和/或mfold(http://mfold.rna.albany.edu/?q=mfold(zuker,m(2003),mfoldwebserverfornucleicacidfoldingandhybridizationprediction,nuclacidres,31:3406-3415))所预测的。本发明的发明人已经鉴定出了一些优选适配子。因此,在一个实施方案中,本发明所述的rna-聚合酶结合适配子由与选自下述的序列具有至少80%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91、seqidno:92、seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由与优选选自下述的序列具有至少80%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。在又一实施方案中,本发明所述的rna-聚合酶结合适配子由与选自下述的序列具有至少90%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91、seqidno:92、seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由与优选选自下述的序列具有至少90%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。在进一步优选的实施方案中,本发明所述的rna-聚合酶结合适配子由与选自下述的序列具有至少95%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91、seqidno:92、seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由与优选选自下述的序列具有至少95%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。在特别优选的实施方案中,本发明所述的rna-聚合酶结合适配子由与选自下述的序列具有至少99%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91、seqidno:92、seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由与优选选自下述的序列具有至少99%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。在又一具体实施方案中,本发明所述的rna-聚合酶结合适配子由具有选自下述的序列的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91、seqidno:92、seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由具有优选选自下述的序列的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。特别优选的本发明所述的rna-聚合酶结合适配子由seqidno:2的序列或者与其具有至少80%的同一性,优选至少90%的同一性,更优选至少95%的同一性,更优选至少97%的同一性,甚至更优选至少99%的同一性的序列编码。本发明还涉及在严格条件下与这些序列中的任何序列杂交的核酸,例如rna或dna。本发明的发明人出人意料地发现,可以通过引入编码本发明所述的rna-聚合酶结合适配子的序列调节dna分子的表达。以上概述的本发明所述的rna-聚合酶结合适配子的特性是rna-分子的特性。因此,在特别优选的实施方案中,本发明所述的rna-聚合酶结合适配子是rna。本文给出的序列显示了编码优选适配子的dna-序列。因此,无论何时提及dna-序列或编码序列,所述序列优选在各seqidno下给出的序列。由某一seqidno:编码,其意为rna适配子具有提及的序列中显示的序列,除了碱基胸腺嘧啶(t)被换成尿嘧啶(u),并且所述分子是rna分子而非dna分子。但是,技术人员将会容易地认识到,这些适配子尤其可用于控制和/或调节dna分子的表达,例如编码适配子的dna分子的表达。本发明的发明人发现,适配子尤其可用于顺式调节来自dna的rna的表达。因此,本发明提供包含编码本发明所述的rna-聚合酶结合适配子的序列的dna分子,并因此允许调节所述dna分子的表达以及来自所述dna分子的表达。因此,本发明涉及编码本发明所述的rna-聚合酶结合适配子的dna分子。dna分子优选还包含待表达的序列。本发明所述的此类待表达的序列优选核苷酸序列,特别优选编码目标rna分子或蛋白的dna序列。例如,编码的目标分子可以是调节性rna或者蛋白或多肽。技术人员将会立即认识到,本发明不限于特定类型的待表达序列,因为本发明的发明人已经表明,表达在转录产物水平(例如mrna)以及随后的翻译产物水平(例如蛋白或多肽)这两个水平上受rna-聚合酶结合适配子的调节和影响。然而,dna序列是特别优选的待表达序列,优选编码目标rna分子或蛋白(多肽)的dna序列。一些类型的调节性rna-元件是已知的,例如一些可以通过与mrna或基因的dna的一部分互补而下调基因的表达。微小rna(mirna;21-22nt)发现于真核生物中,并且通过rna干扰(rnai)发挥作用,其中mirna和酶的效应复合物可以切割互补mrna,阻止mrna的翻译,或者加速其降解。尽管小干扰rna(sirna;20-25nt)通常通过病毒rna的断裂产生,但是也存在内源来源的sirna。sirna以与mirna类似的方式通过rna干扰发挥作用。一些mirna和sirna可以引起它们所靶向的基因甲基化,从而降低或增加那些基因的转录。动物具有piwi-相互作用rna(pirna;29-30nt),其在生殖细胞中具有活性,并且被认为是针对转座子的防御物,且在配子形成中发挥作用。许多原核生物具有crisprrna,其是与rna干扰类似的调节系统。反义rna分布广泛;大部分下调基因,但是少数是转录的激活因子。反义rna可以发挥作用的一种方式是通过结合mrna,形成酶降解的双链rna。存在许多调节真核生物中的基因的长的非编码rna,一种此类rna是xist,其套在雌性哺乳动物的一条x染色体外,并使其失活。mrna自身在5’非翻译区或3’非翻译区还可以包含调节性元件,如核糖开关;这些顺式调节元件调节该mrna的活性。非翻译区还可以包含调节其它基因的元件。因此,在本发明的一个实施方案中,dna-分子包含编码一种或多种其它调节性rna-元件的序列。下文的dna-分子或表达盒或载体还可以包含可操作地连接至所述待表达的序列的表达控制序列。这些表达控制序列可适合于确保细菌(如大肠杆菌)或真核生物(如真菌或哺乳动物细胞系)中rna(如可翻译的rna)的转录和合成。在本发明的优选实施方案中,待表达的序列编码目标多肽或蛋白,例如待表达的蛋白。“表达”指在宿主细胞内发生的转录和翻译。可以基于细胞中存在的相应mrna的量或者宿主细胞产生的dna-编码的蛋白的量来确定宿主细胞中dna分子的表达水平。本发明上下文中术语“表达”的其它细节可以通过回顾sambrook等人,(2012),“molecularcloning:alaboratorymanual”,第四版,coldspringharborlaboratorypress,isbn:978-1-936113-42-2获得,将其通过引用并入本文。本发明的发明人发现编码本发明所述的rna-聚合酶结合适配子的序列可以位于dna-分子内的不同位点,以调节其表达。但是,在特别优选的实施方案中,编码本发明所述的rna-聚合酶结合适配子的序列可操作地连接至启动子,优选位于启动子的下游。这特别优选,因为呈现的结果显示,本发明达到的效果是存在的,特别是如果适配子位于启动子的下游并因此被转录的情况下。本发明所述的dna-分子至少包含编码本发明所述的rna-聚合酶结合适配子的序列。其还可以包含本文详尽概述的其它元件。但是,这些元件自身可不具有任何功能特性,如启动子、转录起始位点、待表达的序列。例如,本发明所述的dna分子还可以用于进入宿主细胞或有机体的基因组的整合目的。在此种情况下,rna-聚合酶结合适配子编码序列侧翼的一条或多条序列可能足以引起整合进宿主的基因组,优选位点特异地。用于整合的机制可以是,例如同源重组、病毒dna在整个宿主基因组中的非特异性并入(youngsuk等人,“currentadvancesinretroviralgenetherapy”,currgenether.2011jun;11(3):218-228)、crisp/cas9系统的适应(harrison等人,“acrisprviewofdevelopment”,10.1101/gad.248252.114genes&dev.2014.28:1859-1872)等。编码本发明所述的rna-聚合酶结合适配子的序列优选可操作地连接至本发明所述的dna分子或载体上的启动子,以调节来自所述启动子的表达。在另一实施方案中,编码本发明所述的rna-聚合酶结合适配子的序列位于本发明所述的dna-分子上,以使在dna-分子或其片段整合进核酸(例如宿主的基因组)之后,所述序列可操作地连接至启动子,以调节来自所述启动子的表达。与本发明结合使用的术语“可操作地连接(operativelylinked)”或“可操作地连接(operablylinked)”指一条或多条表达控制序列和/或待表达的多核苷酸中的编码区之间连接,这样的连接使得在与表达控制序列相容的条件下实现表达,例如使得转录增强型rna-聚合酶结合适配子增加序列的表达,或者使得转录抑制型rna-聚合酶结合适配子抑制或降低序列的表达。在特别优选的实施方案中,待表达的序列编码目标多肽或蛋白,并且rna-聚合酶结合适配子位于编码所述目标多肽或蛋白的序列的5’utr区。本发明所述的dna-分子还可以包含(整个)表达盒。表达盒可以是用于克隆和转化的载体dna的一部分。表达盒指导细胞机构产生rna和蛋白。表达盒由一个或多个基因以及控制其表达的序列组成。表达盒通常包含:启动子序列、开放阅读框,以及任选地在真核生物中通常含有聚腺苷酸化位点的3’-非翻译区。如本文所详尽概述的,本发明提供调节dna序列,例如来自表达盒的dna序列的表达的新机制。因此,本发明还涉及包含表达盒的dna-分子,所述表达盒包含编码本发明所述的rna-聚合酶结合适配子的序列、启动子和编码待表达的蛋白的开放阅读框,优选地,编码适配子的序列、启动子和开放阅读框在所述表达盒中可操作地连接在所述dna-分子上。表达盒还可以包含3’非翻译区。本发明的发明人已表明,编码适配子的序列的位置不重要,只要其被转录。因此,在本发明的优选实施方案中,本发明所述的dna-分子包含表达盒,所述表达盒包含启动子、编码待表达的蛋白的开放阅读框和编码本发明所述的rna-聚合酶结合适配子的序列,其中开放阅读框和编码所述rna-聚合酶结合适配子的序列位于所述启动子的下游。技术人员将会认识到,编码所述适配子的序列可以位于启动子和开放阅读框之间(例如,在5’-非翻译区内),或者可以位于开放阅读框内。技术人员将能够相应地重新设计编码序列。但是,在含有本发明所述的表达盒的dna-分子的优选实施方案中,编码本发明所述的rna-聚合酶结合适配子的序列位于启动子的下游和待表达的蛋白的开放阅读框的上游,即在5’-非翻译区内,特别优选在启动子的转录起始位点和开放阅读框的翻译起始位点的下游。此外,在优选实施方案中,所述编码本发明所述的rna-聚合酶结合适配子的序列编码两个或更多个,优选三个或更多个连续适配子,例如作为串联重复序列,任选地,适配子通过接头序列分隔。优选地,在启动子的下游和待表达的序列的上游编码的本发明所述的rna-聚合酶结合适配子是本发明所述的激活型rna-聚合酶结合适配子。为了增加表达,该rna-聚合酶结合适配子优选本发明所述的激活型rna-聚合酶结合适配子。还可以通过在表达盒的3’端,优选在3’非翻译区(也被称为3’utr)引入编码本发明所述的抑制型rna-聚合酶结合适配子的序列的反向互补序列来进一步增强该激活型构建体。在不受理论束缚的情况下,该抑制型适配子阻抑来自互补链的非需要的表达(例如,在普遍的转录期间),并因此通过反向转录避免阻止来自期望链的表达。将会容易地理解,本发明不限于特定的启动子或类型或待表达的序列,例如,特定的蛋白或rna。设计表达盒用于(编码蛋白的)序列的模块化克隆,以使可以容易地改变同一盒以产生不同的蛋白。为此,可以提供不包含开放阅读框但包含允许待表达的序列(例如编码目标蛋白或目标rna的序列)插入的多克隆位点的表达盒。因此,本发明还涉及包含表达盒的dna-分子,所述表达盒包含编码本发明所述的rna-聚合酶结合适配子的序列、启动子和用于插入待表达的序列的多克隆位点,优选地,所述编码适配子的序列、所述启动子和所述多克隆位点可操作地连接。在本发明的优选实施方案中,本发明所述的dna-分子包含表达盒,所述表达盒包含启动子、用于插入待表达的序列的多克隆位点和编码本发明所述的rna-聚合酶结合适配子的序列,其中所述多克隆位点和所述编码所述rna-聚合酶结合适配子的序列位于所述启动子的下游。在含有本发明所述的表达盒的dna-分子的优选实施方案中,编码本发明所述的rna-聚合酶结合适配子的序列位于启动子的下游和用于插入待表达的序列的多克隆位点的上游。表达盒还可以包含多条待表达的序列,例如多顺反子表达盒,这意味着转录由单个启动子起始。存在于细菌中的mrna主要是多顺反子mrna。这意味着单条细菌mrna链可以翻译成几种不同的蛋白。如果间隔子分隔了不同的蛋白并且各间隔子必须具有位于各起始密码子上游的翻译起始位点(核糖体结合位点,夏因-达尔加诺序列),则这将发生。转录的mrna包含多条待表达的序列,例如两个或更多个编码蛋白的开放阅读框。技术人员将会认识到,本发明所述的rna-聚合酶结合适配子也适合于增强此类多顺反子转录本的表达。在一个实施方案中,本发明所述的表达盒包含启动子、转录自所述启动子的两个或更多个开放阅读框,其中表达盒包含两条或更多条编码本发明所述的rna-聚合酶结合适配子的序列,其中所述编码所述适配子的序列可操作地连接至所述启动子和所述开放阅读框,以允许所有开放阅读框的表达。在优选实施方案中,各开放阅读框可操作地连接至编码本发明所述的rna-聚合酶结合适配子的一条或多序列,特别优选地,这两者或者开放阅读框由包含编码本发明所述的rna结合适配子的一条或多条序列分隔,并且翻译起始位点可操作地连接其上,优选地,核糖体结合位点位于所述编码适配子的序列的下游。在优选实施方案中,两条或更多条序列编码本发明所述的转录增强型rna-聚合酶结合适配子。各开放阅读框还可以连接至翻译起始位点(例如,核糖体结合位点,夏因-达尔加诺序列)。在优选实施方案中,表达盒因此包含启动子、两个或更多个开放阅读框,其中表达盒在各开放阅读框的上游包含编码本发明所述的rna-聚合酶结合适配子的序列和翻译起始位点,所述rna-聚合酶结合适配子优选本发明所述的转录增强型rna-聚合酶结合适配子。开放阅读框可以均编码相同的蛋白或者可以编码不同的蛋白。可将不同的表达盒转化进不同的有机体中,包括细菌、酵母、植物和哺乳动物细胞,只要使用正确的调节序列。特别优选细菌,优选大肠杆菌的表达盒。启动子是起始下游序列转录的dna区域。启动子位于同一条链上邻近基因的转录起始位点和dna的上游(朝向正义链的5’区)。启动子的尺寸可以不同,例如约100-1000nt长。为了使转录发生,rna聚合酶结合启动子序列或邻近的序列。启动子可以包含特定的dna序列,如为rna聚合酶和招募rna聚合酶的被称为转录因子的蛋白提供稳定的起始结合位点的应答元件。这些转录因子具有连接至特定启动子并调节基因表达的相应核苷酸的特定的激活物或阻遏物序列。在细菌中,启动子被rna聚合酶和相关的σ因子识别,其通常通过激活蛋白与邻近的其自身dna结合位点的结合依次被带至启动子dna。在真核生物中,转录起始的过程更复杂,并且对于rna聚合酶ii至启动子的结合,至少七种不同的因子是必需的。在细菌中,启动子在转录起始位点上游大约-10和-35个核苷酸处包含两个短的元件序列。在-10处的序列(-10元件)含有共有序列tataat。在-35处的序列(-35元件)含有共有序列ttgaca。尽管这些共有序列一般是保守的,但是发现在大部分启动子中其是不完整的。平均而言,在任何给定的启动子中仅存在各共有序列的6个碱基对中的3至4个。迄今为止,已鉴定了少数在-10和-35处均具有完整共有序列的天然启动子;发现具有完全保守的-10和-35元件的人工启动子以比含有少数共有序列的错配的那些启动子低的频率转录。-35和-10序列之间的最佳间隔是17bp。应当注意,以上启动子序列仅由含有σ-70的rna聚合酶全酶识别。含有其它σ因子的rna聚合酶全酶识别不同的核心启动子序列,并且同样涵盖在本发明中。如本发明的发明人所示,本发明所述的rna-聚合酶结合适配子的优良的技术效果独立于所使用的启动子而实现。技术人员将会理解,应当根据预期的宿主细胞选择启动子,即当宿主细胞是细菌时,应使用细菌启动子,并且同样地,在宿主细胞是真核细胞的情况下,应当使用真核生物的启动子。优选的启动子是在大肠杆菌中具有活性的启动子,例如大肠杆菌的启动子。本发明所述的优选启动子包括组成型启动子和诱导型启动子。分别与dna分子和表达盒结合使用的启动子就其来源和/或就待表达的基因或序列而言可以是同源的或异源的。合适的启动子是,例如使自身组成型表达的启动子。但是,也可以使用仅在由外在影响决定的时间点激活的启动子。在该背景下,可以使用人工和/或化学诱导型启动子。诱导型启动子包括阿拉伯糖-、葡萄糖-、iptg-、乙醇-、金属-诱导型启动子。组成型启动子的一个实例是pwm3110中使用的启动子(参见实施例部分)。在一个实施方案中,本发明所述的表达盒包含这样的启动子,其与seqidno:66具有至少80%的同一性,优选与seqidno:66具有至少90%的同一性,更优选与seqidno:66具有至少95%的同一性,更优选与seqidno:66具有至少99%的同一性。在特别优选的实施方案中,本发明所述的表达盒包含具有seqidno:66的序列的启动子。诱导型启动子的一个实例是阿拉伯糖诱导型启动子,例如实施例中使用的并具有seqidno:67的序列的阿拉伯糖-诱导型启动子。因此,在一个实施方案中,本发明所述的表达盒包含这样的启动子,其与seqidno:67具有至少80%的同一性,优选与seqidno:67具有至少90%的同一性,更优选与seqidno:67具有95%的同一性,更优选与seqidno:67具有至少99%的同一性。在特别优选的实施方案中,本发明所述的表达盒包含具有seqidno:67的序列的启动子。本文已经显示,rna-聚合酶结合适配子能够调节包含适配子的转录本的转录。如本文所概述的,编码本发明所述的rna-聚合酶结合适配子的序列优选可操作地连接至启动子序列和启动子的转录起始位点。它优选位于本发明所述的dna-分子上的启动子和转录起始位点的下游。认为rna-聚合酶结合适配子编码序列与转录起始位点的距离不重要。但是,具有一定的距离,可在调节转录方面观察到优良的效果。因此,在一个实施方案中,编码本发明所述的rna-聚合酶结合适配子的序列优选位于转录起始位点下游10至1000nt的距离内,优选位于转录起始位点下游50至500nt的距离内,更优选位于转录起始位点下游60至250nt的距离内,特别优选位于转录起始位点下游80至103的距离内。编码本发明所述的rna-聚合酶结合适配子的序列还优选可操作地连接至待表达的序列(例如开放阅读框)或多克隆位点。rna-聚合酶结合适配子编码序列与待表达的序列或多克隆位点的距离不重要。但是,具有一定的距离,可在调节转录和表达方面观察到优良的效果。因此,在一个实施方案中,编码本发明所述的rna-聚合酶结合适配子的序列优选位于待表达的序列或多克隆位点上游10至1000nt的距离内,优选位于待表达的序列或多克隆位点上游50至500nt的距离内,更优选位于待表达的序列或多克隆位点上游60至250nt的距离内,特别优选位于待表达的序列或多克隆位点上游70至108nt的距离内。可以使用以上提及的优选距离的任何组合,例如转录起始位点下游10至1000nt的距离和待表达的序列上游10至1000nt的距离,或者转录起始位点下游50至500nt的距离和待表达的序列或多克隆位点上游50至500nt的距离,或者转录起始位点下游60至250nt的距离和待表达的序列或多克隆位点上游60至250nt的距离,或者转录起始位点下游80至103nt的距离和待表达的序列或多克隆位点上游70至108nt的距离,或者任何其它可能的组合。技术人员将会认识到,本发明所述的dna分子适用于多种应用。因此,本发明的还涉及编码本发明所述的rna-聚合酶结合适配子的序列在调节来自dna分子的表达中的用途。在优选实施方案中,本发明涉及本发明所述的dna-分子用于调节宿主细胞或有机体中待表达的内源序列或者待表达的外源序列的表达的用途。当考虑本申请的公开内容时,技术人员能够选择各用途和应用的具体实施方案。例如,dna-分子可以包含待表达的序列的一部分或整个序列。出于在宿主基因组的合适位点的位点特异性整合(例如通过同源重组)的目的,其可以仅包含待表达的内源序列的一部分,以允许在合适且期望的位点处整合,从而得到合适的表达。因此,在一个实施方案中,本发明所述的dna-分子包含用于位点特异性整合进宿主基因组的一个或多个元件(例如序列)。当考虑本发明的公开内容时,技术人员能够选择合适的整合位点并相应地设计dna-分子。对于此类设计,技术人员将具体考虑如本文详尽描述的本发明的某些实施方案,例如关于编码本发明所述的rna-聚合酶结合适配子的序列与例如启动子/转录起始位点和/或核糖体结合位点和/或待表达的基因的起始密码子之间的距离。如上文所概述的,用于调节待表达的序列的表达的编码本发明所述的rna-聚合酶结合适配子的序列优选位于启动子的转录起始位点下游。但是,启动子可以存在于dna-分子自身内部,或者dna-分子可以包含用于使构建体位点特异性整合进宿主基因组的序列,以使编码rna-聚合酶结合适配子的序列位于启动子的内源转录起始位点的下游。因此,在本发明的一个实施方案中,本发明所述的dna-分子包含用于位点特异性整合进宿主基因组的序列,优选用于位点特异性整合进启动子和/或转录起始位点下游的序列。在一个实施方案中,dna-分子包含用于位点特异性整合进待表达的内源序列上游的序列。在此类实施方案中,dna-分子可以包含内源或外源启动子和/或转录起始位点,其优选位于编码本发明所述的rna-聚合酶结合适配子的序列的上游。可以根据需要选择rna-聚合酶结合适配子,例如如果所述内源序列的表达将下调,则可以使用本发明所述的抑制型rna-聚合酶结合适配子,即在所述dna-分子上编码。因此,本发明涉及本发明所述的抑制型rna-聚合酶结合适配子或编码所述抑制型rna-聚合酶结合适配子的dna-分子用于抑制宿主细胞内的内源序列的表达的用途。宿主细胞优选非人的宿主细胞,优选细菌来源的宿主细胞。编码本发明所述的抑制型rna-聚合酶结合适配子的dna-分子优选插入转录所述内源序列的启动子的下游。本发明还涉及本发明所述的dna-分子用于通过基因疗法治疗人类的用途。技术人员将会认识到,通过使用宿主的内源启动子,经本发明所述的rna-聚合酶结合适配子,本发明所述的dna-分子可以用于调节待表达的内源序列的表达或者用于调节外源序列的表达。如果本发明所述的dna-分子用于调节待表达的内源序列的表达,这可以通过使用待表达的序列的内源启动子或者通过引入外源启动子以控制转录的起始来进行。在后一种情况下,技术人员将会理解,本发明所述的dna-分子优选包含优选位于编码rna-聚合酶结合适配子的序列的上游的启动子,以及任选地用于适当整合的其它序列。此外,技术人员将会认识到本发明所述的适配子的多种不同的用途和应用。本发明所述的适配子或dna-分子可以用于调节宿主细胞内或者体外表达系统中待表达的序列的表达。通过应用不同的适配子,技术人员可以比现有技术中已知的更加精密的调法来调节表达。当使用基因沉默或敲除技术来抑制基因的表达时(例如,用于功能研究),结果通常是基因产物,即rna或编码的蛋白的完全丧失。但是,出于一些目的,不完全消除某种基因产物的表达和/或活性是可取的。例如,如果基因和/或基因产物对于细胞存活而言是必需的。技术人员将会立即认识到,本发明提供了允许下调基因表达,例如待表达的内源序列的基因表达,而不完全耗尽所编码的分子的细胞的优良工具。因此,本发明所述的适配子特别适用于科学研究,例如通过使用它们来下调或上调序列,例如编码目标分子的表达。技术人员将会认识到,原核以及真核细胞都是这样。对于后者,本发明提供通过sirna等进行基因沉默的优良的替代方案。因此,本文公开的方法和用途,当它们在特别优选的实施方案中涉及抑制型rna-聚合酶结合适配子时,是用于敲低宿主细胞中的目标序列(例如基因)的方法或用途。下文进一步概述了优选方法。在本发明的一个实施方案中,dna-分子的用途涉及通过使用待表达的内源序列的内源启动子来调节所述序列的表达的用途。在此类实施方案中,dna-分子优选包含编码rna-聚合酶结合适配子的序列以及用于所述编码rna-聚合酶结合适配子的序列位点特异性整合在所述内源启动子的下游和所述待表达的序列的上游的一条或多条序列。“内源”指在未插入或施加外部核酸序列的情况下,例如在外部施加本发明所述的dna-分子之前,宿主细胞或有机体中存在的任何序列、启动子、转录起始位点、基因、开放阅读框等。内源序列存在于未进行任何外部操作(例如核酸转染或转化)的细胞或有机体中。“外源”指在未插入或施加外部核酸序列的情况下,在宿主细胞或有机体中不存在或者在宿主基因组的特定座位(位点)不存在的任何序列、启动子、转录起始位点、基因等,例如“外源”元件仅在外部施加本发明所述的dna-分子之后,存在于宿主基因组的特定位点。本文使用的“待表达的序列”指编码目标分子的dna序列。如本文所概述的,本发明所述的rna-聚合酶结合适配子调节rna-聚合酶,例如并且优选dna-依赖性rna-聚合酶的活性,即它们影响dna序列转录成rna。因此,还可以影响后续步骤,如翻译成多肽的产量。因此,本文使用的“待表达的序列”优选指编码目标分子的dna序列,所述目标分子优选目标rna分子或者目标多肽或蛋白分子。“宿主细胞(hostcell)”或“宿主细胞(hostcells)”指表达或者能够表达待表达的序列的细胞。本发明的宿主细胞表达编码具有多种用途(包括生物技术、分子生物学和临床应用)的多肽或rna的多核苷酸。本发明中合适的宿主细胞的实例包括但不限于细菌、酵母、昆虫、动物和哺乳动物的细胞。此类细胞的具体实例包括大肠杆菌dh5α细胞和bl21(de3)以及多种其它细菌细胞来源,例如大肠杆菌菌株:dh10b细胞、xl1blue细胞、xl2blue细胞、top10细胞、hb101细胞和dh12s细胞;来自包括下述属的酵母宿主细胞:酵母属(saccharomyces)、毕赤酵母属(pichia)和克鲁维酵母属(kluveromyces);动物细胞系,例如哺乳动物以及甚至人细胞系,包括cho细胞、hek293细胞和hela。优选的宿主细胞是使用细菌rna-聚合酶或者真核生物的dna-依赖性rna-聚合酶ii和/或iii,优选rna-聚合酶ii,用于表达dna序列的那些细胞。在一个特别优选的实施方案中,宿主细胞是细菌细胞,优选大肠杆菌细胞;甚至更优选选自下述大肠杆菌菌株的细胞:dh5α、bl21(de3)、dh10b细胞、xl1blue细胞、xl2blue细胞、top10细胞、hb101细胞和dh12s细胞,更优选dh5α或bl21(de3)的细胞。在另一优选实施方案中,宿主细胞是真菌,更优选下述属的真菌:酵母属(saccharomyces)、裂殖酵母属(schizosaccharomyces)、曲霉菌属(aspergillus)、木霉属(trichoderma)、克鲁维酵母属(kluyveromyces)或毕赤酵母属(pichia),并且甚至更优选下述种的真菌:酿酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)、黑曲霉(aspergillusniger)、里氏木霉(trichodermareesei)、马克思克鲁维酵母(kluyveromycesmarxianus)、乳酸克鲁维酵母(kluyveromyceslactis)、毕赤酵母(pichiapastoris)、pichiatorula或pichiautilis。在另一优选实施方案中,宿主细胞是选自下述的真核宿主细胞:酵母(例如,酿酒酵母)、真菌宿主细胞、昆虫宿主细胞、哺乳动物宿主细胞,如灵长类、人或啮齿动物的宿主细胞,包括cho或cos细胞、hek293细胞和hela。技术人员将会认识到,宿主细胞还可以包含修饰,如额外的基因、突变或缺失,例如以增加表达效率。尽管鉴定的适配子实际可在基因表达中发挥作用,本发明的一个实施方案为提供用于目标序列(待表达的序列)的调节表达的dna-分子、载体和/或宿主细胞。因此,在优选实施方案中,本发明的主题涉及重组产物,如重组rna-或dna-分子、载体和/或宿主细胞。因此,本发明优选排除如自然界中所见的天然存在的宿主细胞,其利用rna-聚合酶结合适配子的调节机制表达待表达的序列。相反地,本发明的宿主细胞和本发明的方法或用途中使用的宿主细胞优选非天然存在的宿主细胞,不管其是否被遗传修饰以在其基因组中通常不存在的背景下(通过使用本发明所述的适配子的调节机制)表达(包括过表达和表达的阻抑/抑制)待表达的序列或者其是否已被工程化以过表达外源/异源酶。因此,与本发明结合使用的dna-分子、载体和宿主细胞分别优选非天然存在的dna-分子、载体和宿主细胞,即它们是与天然存在的dna-分子、载体和宿主细胞显著不同并且在自然界中不存在的dna-分子、载体和宿主细胞。还包括宿主细胞的变种。此类变种优选包括上文所述的遗传修饰的有机体,由于遗传修饰,其与天然存在的有机体不同。遗传修饰的有机体是非天然存在的有机体,即无法在自然界中找到的有机体,并且其由于外来(重组)核酸分子的引入而与天然存在的有机体显著不同。此类有机体也被称为重组体。在又一实施方案中,本发明涉及本发明所述的dna-分子用于调节dna-分子的表达的用途。本领域普通技术人员将会理解,在该实施方案中,除编码本发明所述的rna-聚合酶结合适配子的序列外,所述dna-分子还可以包含待表达的序列。本发明还涉及在严格条件下与本发明所述的rna-分子或dna-分子杂交的核酸。杂交条件对于本领域技术人员而言是已知的,并且可见于currentprotocolsinmolecularbiology,johnwiley&sons,n.y.,6.3.1-6.3.6,1991。严格条件被定义为,相当于在45℃下,于6x氯化钠/柠檬酸钠(ssc)中进行杂交,随后在65℃下,于0.2xssc、0.1%sds中洗涤。本发明所述的dna分子优选包含于载体中。如果其包含表达盒,则含有所述dna-分子的载体被称为表达载体或用于表达的载体。术语“载体”指多核苷酸或者多核苷酸以及多肽/蛋白的混合物,其能够被引入细胞中或者能够将包含的核酸引入细胞。优选的是,当引入载体时,待表达的序列和由引入的多核苷酸编码的序列在细胞中表达。在优选实施方案中,本发明的载体包括质粒,噬菌粒,噬菌体,粘粒,人工哺乳动物染色体,敲除的或敲入的构建体,病毒,特别是腺病毒、牛痘病毒、减毒的牛痘病毒、金丝雀痘病毒、慢病毒(chang,l.j.和gay,e.e.(20001)curr.genetherap.1:237-251)、疱疹病毒,特别是单纯疱疹病毒(hsv-1,carlezon,w.a.等人,(2000)crit.rev.neurobiol.)、杆状病毒、逆转录病毒、腺相关病毒(aav,carter,p.j.和samulski,r.j.(2000)j.mol.med.6:17-27)、鼻病毒、人免疫缺陷病毒(hiv)、线状病毒及其工程化形式(参见,例如,cobingerg.p.等人,(2001)nat.biotechnol.19:225-30),病毒体,“裸露的”dna脂质体以及核酸包被的颗粒,特别是金球。特别优选病毒载体,如腺病毒载体或逆转录病毒载体(lindemann等人,(1997)mol.med.3:466-76;和springer等人,(1998)mol.cell.2:549-58)。脂质体通常是小的单层或多层囊泡,其例如通过脂质体悬液的超声处理由阳离子脂质、中性脂质和/或阴离子脂质制备。dna可以,例如通过离子键结合至脂质体的表面或者被封装在脂质体内部。合适的脂质混合物在本领域是已知的,并且包括,例如dotma(1,2-二油烯基氧基丙基-3-三甲基溴化铵)和dpoe(二油酰基磷脂酰-乙醇胺),这两者已被用于多种细胞系。如本文所概述的,本发明所述的载体可以用于不同的目的。例如,其可以用于将包含编码本发明所述的rna-聚合酶结合适配子的序列的dna分子引入现有的基因中,以调节,例如增强/增加或抑制/阻抑/降低基因的表达。因此,本发明所述的载体至少包含含有编码本发明所述的rna-聚合酶结合适配子的序列的dna-分子。在优选实施方案中,载体包含dna-分子,所述dna-分子包含本发明所述的表达盒。此外,除编码本发明的rna-聚合酶结合适配子的序列外,本发明的载体的dna-分子还包含在合适的宿主中允许编码区的适当表达的表达控制元件。此类控制元件对技术人员而言是已知的,并且可以包括启动子、剪接盒(splicecassette)、翻译起始密码子、用于将插入物引入载体的翻译和插入位点(也被称为多克隆位点)。优选地,编码本发明的rna-聚合酶结合适配子的序列可操作地连接至所述其它表达控制序列,其允许待表达的序列和即将插入真核或原核细胞中的所述多克隆位点内的序列的表达。因此,本发明涉及包含含有编码本发明的rna-聚合酶结合适配子的序列的dna分子的载体,其中核酸可操作地连接至当用载体转染真核和/或原核(宿主)细胞时由宿主细胞识别的启动子。在优选实施方案中,载体优选包含核糖体结合位点,其中所述核糖体结合位点位于所述编码rna-聚合酶结合适配子的序列的下游。此外,本发明的载体优选表达载体,即包含dna-分子,所述dna-分子本发明所述的表达盒。可将本发明的dna-分子和载体设计为直接引入细胞,或者经脂质体、病毒载体(例如,腺病毒、逆转录病毒)、电穿孔、弹道(例如,基因枪)或者其它递送系统引入细胞。此外,可将杆状病毒系统用作本发明的真核表达系统。表达载体(或者被称为表达构建体)通常是设计以用于在细胞中进行蛋白表达的质粒或病毒。载体被用于将特定基因引入靶细胞,并且其可以征用细胞的蛋白合成机制以产生由所述基因编码的蛋白。将质粒工程化,以包含作为增强子和/或启动子区并导致表达载体上携带的基因有效转录的调节序列。表达载体的目的是产生大量稳定的信使rna,并因此产生大量蛋白或多肽。表达载体具有任何载体可以具有的特征,如复制起点、选择性标志物和用于插入基因的合适位点,如多克隆位点。可将克隆的基因从专门的克隆载体转移至表达载体,尽管直接克隆进表达载体是可能的。克隆过程通常在细菌(例如大肠杆菌)中进行,并且在用于克隆的有机体(例如大肠杆菌)之外的有机体中用于蛋白表达的载体,除了用于其在克隆有机体中增殖的合适的复制起点之外,还可以包含允许它们在另一有机体中维持的元件,并且这些载体被称为穿梭载体。表达载体含有蛋白表达所必需的元件。这些可以包括组成型或诱导型启动子、正确的翻译起始序列(如核糖体结合位点和/或起始密码子)、终止密码子和转录终止序列。原核生物与真核生物之间的蛋白合成机制存在区别,因此表达载体必须含有对于所选宿主而言合适的表达元件。例如,原核生物的表达载体在其翻译起始位点可以含有夏因-达尔加诺序列,以结合核糖体,而真核生物的表达载体将包含kozak共有序列。本发明所述的载体优选用于在细菌中,优选在大肠杆菌中表达目标序列的载体。启动子起始转录,并因此是克隆基因表达的控制点。在表达载体中使用的启动子是组成型或诱导型的。后一种启动子意为,蛋白合成仅在需要时,例如通过引入诱导物如iptg或阿拉伯糖起始或完全起始。但是,在一些表达载体中蛋白表达也可以是组成型的(即,转录是恒定的,并且不断地表达蛋白)。甚至在含有严密控制的启动子的表达载体中,可以发生低水平的组成型蛋白合成。在表达基因产物之后,纯化表达的蛋白通常是必需的;但是,将目标蛋白从宿主细胞的大多数蛋白中分离可以是持久的过程。为了使该纯化过程更简单,可以向克隆的基因中添加纯化标签,或者使纯化标签存在于允许克隆目标序列的表达盒或载体中,从而使基因和标签在框中,并表达为单一多肽链。任选地存在于本发明所述的载体中的此类标签包括组氨酸(his)标签,标志物肽,标志物肽和融合伴侣,如谷胱甘肽s-转移酶或麦芽糖结合蛋白或gfp或β-半乳糖苷酶。这些融合伴侣中的一些还可以帮助增加一些表达的蛋白的溶解度。诸如绿色荧光蛋白的其它融合蛋白可以作为用于鉴定成功克隆的基因的报告基因。可将包含表达盒的载体或dna-分子转化或转染(本文也称为引入)进宿主细胞用于蛋白合成。本发明的载体可以含有用于使dna转化或插入宿主染色体的元件,例如用于植物转化的vir基因和用于染色体插入的整合酶位点。本发明的载体可以包含可使表达的蛋白靶向特定位置如细菌的壁膜间隙的靶向序列。载体还可以包含确保和/或调节表达的控制元件。确保在真核和原核(宿主)细胞中的表达的控制元件对于本领域技术人员而言众所周知。如上文所提及的,它们通常包括确保转录起始的调节序列,以及任选地确保转录终止和转录本的稳定的信号。其它调节元件可以包括转录以及翻译增强子和/或天然相连的或者异源的启动子区。本发明所述的启动子优选如本文所概述的组成型或诱导型的。优选的本发明所述的启动子包括原核和真核生物的启动子,如细菌、真菌或哺乳动物的启动子。优选的哺乳动物启动子选自:cmv-hsv胸苷激酶启动子、sv40、rsv-启动子(劳斯氏肉瘤病毒)、人延伸因子1α-启动子、糖皮质激素诱导型mmtv-启动子(莫洛尼鼠肿瘤病毒)、神经丝-启动子、pgdf-启动子、nse-启动子、prp-启动子、thy-1-启动子、金属硫蛋白-诱导型启动子以及四环素-诱导型启动子。此外,本发明所述的载体或dna-分子中可以存在增强子。优选的增强子选自cmv增强子和sv40-增强子。对于在神经细胞中的表达。设想可以使用神经丝-、pgdf-、nse-、prp-或thy-1-启动子。所述启动子在本领域是已知的,并且尤其描述于charronj.biol.chem.270(1995),25739-25745中。上文概述了用于本发明所述的dna-分子的优选启动子,并且所述优选启动子也适用于载体和质粒。除了负责转录起始的元件之外,此类调节元件还可以包括转录终止信号,如待表达的序列下游的sv40-poly-a位点或tk-poly-a位点。在此背景下,合适的表达载体在本领域是已知的,如okayama-bergcdna表达载体pcdv1(pharmacia)、prc/cmv、pcdna1、pcdna3(in-vitrogene)、psport1(gibcobrl)、px(pagano,science255(1992),1144-1147)、酵母双杂交载体如peg202和dpjg4-5(gyuris,cell75(1995),791-803)、或者优选的原核表达载体如pet21a(novagen)、pwm1015(w.g.miller等人,appl.environ.microbiol.66,5426-5436(2000))、pbad24(l.m.guzman等人,177(1995),lambdagt11或者pgex(amersham-pharmacia)。载体还可以包含编码分泌信号的核酸序列。此类序列对于本领域技术人员而言众所周知。此外,根据使用的表达系统,可将能够将本发明的肽引导至细胞区室的前导序列添加至本发明的核酸分子的编码序列,并且所述前导序列在本领域众所周知。前导序列在合适的阶段与翻译、起始和终止序列组装,并且优选地,前导序列能够引导翻译的蛋白或其蛋白分泌至壁膜间隙或细胞外培养基。任选地,异源序列可以编码融合蛋白,其包含赋予期望的特征(例如表达的重组产物的稳定或简化纯化)的c-或n-末端鉴定肽。一旦将载体并入合适的宿主,则在适合维持载体以及任选地待表达的序列的表达的条件下维持宿主,并且视需要,随后可以进行如此表达的分子的收集和纯化。本发明还涉及转染或转化的宿主细胞,即包含本发明的载体或dna-分子的宿主细胞,或者携带本发明的载体的非人宿主有机体,即涉及用本发明所述的核酸分子或包含此类核酸分子的载体进行遗传修饰的宿主细胞或宿主。术语“遗传修饰的”意为,宿主细胞或宿主除其天然的基因组外,还包含被引入细胞或宿主或者引入其祖先/亲本的本发明所述的核酸分子或载体。核酸分子或载体可以作为基因组之外的独立分子,优选作为能够复制的分子存在于遗传修饰的宿主细胞或宿主中,或者其可以稳定整合进宿主细胞或宿主的基因组。技术人员将会认识到,本发明所述的dna-分子也适用于对象中的基因疗法。因此,本发明还涉及用于对象的基因疗法中的本发明所述的dna-分子。除非另外指明,否则本发明的意义上的“对象”被理解为所有的人、动物、植物或微生物,不管他们是否显示出病变。在优选实施方案中,本发明所述的患者是人。在本发明的进一步优选的实施方案中,患者是疑患待通过基因疗法治疗的疾病的人。对于医学用途,dna-分子或载体或质粒可以存在于药物组合物中。药物组合物还可以包含认为例如对于稳定dna-分子、在施加组合物时减少对象的副作用等有必要的药物赋形剂。dna-分子或载体或质粒可以以纯的形式存在或者可以作为其药学可接受的盐存在。本文使用的短语“药学可接受的盐”表示本发明的化合物的这样的盐,其对于哺乳动物中的医学用途而言是无毒、安全且有效的,并且具有期望的生物活性,其包括但不限于酸加成盐和/或碱盐。酸加成盐由本发明的碱性化合物形成,而碱加成盐由本发明的酸性化合物形成。所有这些形式均在本发明可用的化合物的范围内。对于药学可接受的盐的综述,参见berge等人(1977),j.pharm.sci.66:1-19,将其通过引用并入本文。此外,本发明涉及包含编码本发明所述的rna-聚合酶结合适配子的序列的dna-分子用于调节蛋白的表达,优选调节微生物,如原核或真核细胞系,包括细菌和哺乳动物细胞系中蛋白的表达的用途。待表达的蛋白优选在编码rna-聚合酶结合适配子的同一dna-分子上编码,其位于rna-聚合酶结合适配子序列的下游,并且优选这样放置,以使其转录成同一rna分子。在本发明的优选实施方案中,所述编码所述rna-聚合酶结合适配子的序列位于起始所述蛋白的表达的启动子的下游。这意味着,rna-聚合酶结合适配子是编码待表达的蛋白的mrna的一部分。本发明所述的用途涵盖用于调节任何目标蛋白的表达的用途。目标蛋白可以是可在表达系统中表达的任何蛋白。此类表达系统通常使用转染或转化有dna-分子(例如,本发明所述的载体)的宿主细胞。因此,本发明还涵盖本发明所述的宿主细胞用于表达目标序列(例如蛋白)的用途。本发明涉及产生目标蛋白的方法,其包括提供本发明所述的载体,优选包含本发明所述的表达盒的载体,所述载体包含可操作地连接至启动子和编码rna-聚合酶结合适配子的序列的编码目标蛋白的序列;将所述载体引入宿主细胞;和在诱导来自表达载体的启动子的转录的条件下,于培养基中培养所述宿主细胞;以及任选地,从所述宿主细胞或培养基中回收目标蛋白。技术人员将会理解,提供包含表达盒的载体可以包括将待表达的序列克隆进本发明所述的表达盒中。因此,在一个实施方案中,提供本发明所述的载体的步骤可以包括将编码所述目标蛋白的序列克隆进所述载体中,以使序列可操作地连接至启动子和编码rna-聚合酶结合适配子的序列,从而获得最终的表达载体,优选克隆进表达盒的多克隆位点中。因此,本发明还涉及产生目标蛋白的方法,其包括下述步骤:提供本发明所述的载体,优选包含本发明所述的表达盒的载体;将编码目标蛋白的序列克隆进所述载体中,优选克隆进多克隆位点中,以使序列可操作地连接至启动子和编码rna-聚合酶结合适配子的序列,从而获得最终的表达载体;将所述表达载体引入宿主细胞中;和在诱导来自所述表达载体的启动子的转录的条件下,于培养基中培养所述宿主细胞;以及任选地,从所述宿主细胞或培养基中回收目标蛋白。本发明的发明人已经发现,当转录自编码本发明所述的rna-聚合酶结合适配子的亚组的dna链时,所述适配子增加rna聚合酶的活性。如果dna区段包含编码本发明所述的rna-聚合酶结合适配子的序列,则所述dna区段的转录效率增加。因此,在本发明的一个优选实施方案中,rna-聚合酶结合适配子增加rna-聚合酶的活性。技术人员知晓测定rna-聚合酶的活性的方法、分析和系统。此类方法包括在宿主细胞中表达报告基因,或者可以应用体外转录分析,在所附实施例中详细概述了这两者。在基于宿主细胞的分析中,基本上使用这样的dna构建体,其包含允许转录开始的启动子和报告子,例如报告基因。为了检测rna-聚合酶活性的增加,测量并比较包含编码本发明所述的rna-聚合酶结合适配子的序列的构建体与不包含所述适配子的构建体之间从启动子开始的构建体的表达。可以使用技术人员通常已知的方法来测量表达。例如,可以检测由报告基因编码的蛋白的活性,例如荧光性或酶活性。另外或者可选地,可以使用常规技术如northernblot或定量逆转录(qrt)实时pcr来测定作为直接的转录产物的mrna的量。例如,为了研究编码rna-聚合酶结合适配子的序列对rna-聚合酶活性,以及从而对转录的影响,可以使用基于质粒的gfp报告系统。在当前的实施例中使用了可能的系统(参见,例如图2a)。但是,技术人员将会理解,本发明不限于某种报告子。例如,也可以使用其它荧光蛋白,如rfp、yfp等。基于酶的系统也适用。也如本发明的实施例中所概述的,研究序列对转录的影响的其它方法使用作为报告基因lacz的编码产物的β-半乳糖苷酶。在测定rna-聚合酶结合适配子的作用的分析中,编码所述适配子的dna序列优选位于启动子的下游,更优选位于转录起始位点的下游。进一步优选的是,编码所述适配子的dna序列位于报告子的上游。本发明的发明人还发现,一些增加rna-聚合酶活性的rna-聚合酶结合适配子增加了聚合酶本身的活性(本文也称为“激活型rna-聚合酶结合适配子”),并且其它rna-聚合酶结合适配子或者相同的rna-聚合酶结合适配子还以依赖终止子的方式增加表达,即阻抑终止子序列的终止作用(本文也称为“抗终止型rna-聚合酶结合适配子”)。激活型和抗终止型rna-聚合酶结合适配子这两者均被称为“转录增强型适配子”。在整个原核生物基因组中,已鉴定了两类原核生物中的转录终止子:依赖rho的和不依赖rho的。这些广泛分布的序列负责在基因或操纵子转录正常完成时引发转录结束,作为调节手段介导转录本的早期终止(如在转录弱化中所观察到的),以确保偶然成功逃离早期终止子的失控的转录复合物的终止,这阻止了细胞不必要的能力消耗。依赖rho的转录终止子需要被称为rho因子的蛋白,其显示出rna解旋酶活性以破坏mrna-dna-rna聚合酶转录复合物。依赖rho的终止子存在于细菌和噬菌体中。依赖rho的终止子存在于翻译终止密码子的下游,并且由mrna上被称为rho利用位点(rut)的非结构化的富含胞嘧啶的序列和下游的转录停止点(tsp)组成。rut作为mrna加载加载位点以及作为rho的活化因子;其活化使得rho能够有效水解atp,并将mrna转移下来,同时其维持与rut位点的接触。rho能够追上在下游的tsp位点停下的rna聚合酶(参见,例如richardson,j.p.(1996).″rho-dependentterminationoftranscriptionisgovernedprimarilybytheupstreamrhoutilization(rut)sequencesofaterminator″.journalofbiologicalchemistry271(35):21597-21603)。rho与rna聚合酶复合物之间的接触通过涉及rho对rna聚合酶的别构效应的机制来刺激转录复合物的解离(参见,例如ciampi,ms.(sep2006).″rho-dependentterminatorsandtranscriptiontermination″,microbiology,152(pt9):2515-2528;和epshtein,v;dutta,d;wade,j;nudler,e(jan14,2010).″anallostericmechanismofrho-dependenttranscriptiontermination″,nature,463(7278):245-249)。内在转录终止子或者依赖因子/rho的终止子需要在延伸的转录本上形成自身退火的发卡结构,所述结构导致mrna-dna-rna聚合酶三元复合物的破坏。终止子序列含有二重对称的20个碱基对的富含gc的区域,随后是短的poly-t段或“t拉伸”,其被转录成rna以分别形成终止发卡和7-9个核苷酸的“u段”。终止的机制假定通过经发卡与rna聚合酶的结合相互作用的别构效应直接促进解离与“竞争动力学”的组合而发生。发卡的形成致使rna聚合酶停下且去稳定,从而由于在该位置停顿花费的时间增加且复合物的稳定性降低,而导致极大的可能性是复合物的解离将在该位置发生(参见,例如vonhippel,p.h.(1998).″anintegratedmodelofthetranscriptioncomplexinelongation,termination,andediting″science281(5377):660-665;以及gusarov,ivan;nudler,evgeny(1999).″themechanismofintrinsictranscriptiontermination″molecularcell3(4):495-504)。如实施例中所示,抗终止型rna-聚合酶结合适配子阻抑终止。此类阻抑可以是通过内在终止子(不依赖因子的)和依赖因子的终止子的终止阻抑。两种类型已经,例如描述于santangelo和artsimovitch(2011),nat.rev.microbiol.9:319-329中,将其通过引用并入本文。当考虑本发明的公开内容及技术人员的公知常识时,技术人员能够检测某种适配子阻抑转录的终止的能力。技术人员知晓测定rna-聚合酶活性的方法、分析和系统,同上文。如所附实施例中详细概述的,此类方法包括在宿主细胞中表达报告基因,或者可以应用体外转录分析。在基于宿主细胞的分析中,基本上使用这样的dna构建体,其包含允许转录开始的启动子和报告子,例如报告基因。为了检测rna-聚合酶活性的增加,测量并比较包含编码本发明所述的rna-聚合酶结合适配子的序列的构建体与不包含所述适配子的构建体之间从启动子开始的构建体的表达。当检测终止的阻抑时,在对照和包含适配子的构建体这两种构建体中,构建体还应当包含终止子序列,例如rrnb或t7t终止子(参见,例如santangelo和artsimovitch(2011),nat.rev.microbiol.9:319-329)。终止子优选位于编码rna-聚合酶结合适配子的序列的下游。可以使用技术人员通常已知的方法来测量表达,同上文。例如,可以检测由报告基因编码的蛋白的活性,例如荧光性或酶活性。另外或者可选地,可以使用常规技术如northernblot或定量逆转录(qrt)实时pcr测定作为直接的转录产物的mrna的量。例如,为了研究编码rna-聚合酶结合适配子的序列对rna-聚合酶活性,以及从而对转录的影响,可以使用基于质粒的gfp报告系统。在当前的实施例中使用了可能的系统(参见,例如图5a)。但是,技术人员将会理解,本发明不限于某种报告子。例如,也可以使用其它荧光蛋白,如rfp、yfp等。基于酶的系统也适用。也如本发明的实施例中所概述的,研究序列对转录的影响的其它方法使用作为报告基因lacz的编码产物的β-半乳糖苷酶。在测定rna-聚合酶结合适配子的作用的分析中,编码所述适配子的dna序列优选位于启动子的下游,更优选位于转录起始位点的下游,并且更优选位于终止子的上游。进一步优选的是,编码所述适配子的dna序列位于报告子的上游。尽管可以鉴定激活和抗终止机制,一些鉴定的适配子具有这两种活性,即以依赖终止子的方式以及不依赖终止子的方式增强rna-聚合酶转录活性。通过这两种机制发挥作用的此类增强型适配子的实例是由seqidno:2至24编码的rna-聚合酶结合适配子,其在本文特别优选。但是,在本发明的一个实施方案中,本发明所述的增强型rna-聚合酶结合适配子是抗终止型rna-聚合酶结合适配子,并且其以依赖终止子的方式增强rna-聚合酶的活性。在又一实施方案中,本发明所述的增强型rna-聚合酶结合适配子是激活型rna-聚合酶结合适配子,并且其以不依赖终止子的方式增强rna-聚合酶的活性。在特别优选的实施方案中,本发明所述的增强型rna-聚合酶结合适配子是激活型和抗终止型rna-聚合酶结合适配子,并且其以依赖终止子的方式和不依赖终止子的方式增强rna-聚合酶的活性。转录终止子对于技术人员而言众所周知,并且包括依赖因子的终止子以及内在终止子序列。原核生物的终止子的实例例如公开于santangelo和artsimovitch(2011),nat.rev.microbiol.9:319-329中。在本发明的优选实施方案中,术语“终止子”是指选自rut(依赖rho的终止子)、rrnb、t7t和tr2终止子(内在终止子序列)的终止子。优选的终止子序列显示于表3中,并且其具有选自seqidno:42、seqidno:43和seqidno:44的序列。在本发明的优选实施方案中,rna-聚合酶结合适配子增加待表达的序列的表达(也被称为“转录增强型适配子”或“转录增强型rna-聚合酶结合适配子”),其中与未包含所述rna-聚合酶结合适配子时所述待表达的序列的表达相比,表达增加至少10%,优选增加至少20%,更优选至少100%。优选地,如本文所概述的,在报告子分析中,rna-聚合酶结合适配子增加待表达的序列的表达。当考虑本申请的公开内容时,技术人员可以检测rna-聚合酶结合适配子的抗终止活性。在本发明的优选实施方案中,抗终止型rna-聚合酶结合适配子增加包含终止子序列的待表达的序列的表达,其中与不包含所述抗终止型rna-聚合酶结合适配子时所述待表达的序列的表达相比,表达增加至少10%,优选至少20%,更优选至少100%。优选地,如本文所概述的,在报告子分析中,抗终止型rna-聚合酶结合适配子增加包含终止子序列的待表达的序列的表达。本发明鉴定了多种具有增加待表达的序列的表达这一特征的rna-聚合酶结合适配子(seqidno:2至24),这些优选是细菌来源的。序列的详细分析显示了这些序列中包含的共有基序。该rna序列由dna序列g[a/g][c/a/t][a/t][a/g/t][c/g]at[g/t/c][a/c]g[g/a][g/t][c/a][a/g][g/a/c][t/g][t/a/g][c/t/g]agca编码,并且其在本文概述为使用扩充的单字母代码的seqidno:1(参见表2)。因此,在rna-聚合酶结合适配子的一个实施方案中,rna-聚合酶结合适配子是转录增强型适配子,并且其由seqidno:1的序列编码。在进一步优选的实施方案中,rna-聚合酶结合适配子是激活型rna-聚合酶结合适配子,并且其包含由seqidno:1的序列编码的序列。在又一实施方案中,rna-聚合酶结合适配子是抗终止型rna-聚合酶结合适配子,并且其包含由seqidno:1的序列编码的序列。已经发现,该共有序列存在于编码源自细菌来源(例如,大肠杆菌)的转录增强型rna-聚合酶结合适配子的dna中。在编码源自真核生物来源的转录增强型rna-聚合酶结合适配子的dna中,鉴定了又一共有序列,即seqidno:138。由此编码的转录增强型rna-聚合酶结合适配子已经显示在细菌表达系统(如大肠杆菌)中具有转录增强特性;参见实施例。此外,使用glam2已经发现,增强型序列,即seqidno:1或seqidno:138的共有基序的序列均共有seqidno:139的共有基序。此外,如针对由seqidno:2编码的适配子进行的检测,该基序符合鉴定的必需nt;参见实施例。因此,在本发明的优选实施方案中,转录增强型rna-聚合酶结合适配子由seqidno:139(can0-3[ac][ca]n[gc][at]n[ca][ca][cat])所述的序列编码。seqidno:139所述的序列优选选自seqidno:1和seqidno:138。转录增强型rna-聚合酶结合适配子的特别优选的序列由seqidno:1所述的序列编码。落入seqidno:1的共有序列的优选序列选自:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74和seqidno:75,或者与这些序列中的任何序列至少80%相同的序列,更优选seqidno:2或与其至少80%相同的序列。落入seqidno:138的共有序列的优选序列选自:seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136和seqidno:137,或者与这些序列中的任何序列至少80%相同的序列。本发明的发明人发现了多种增强与之结合的rna-聚合酶的活性的rna-聚合酶结合适配子。此外,已将共有基序鉴定为seqidno:1。此外,本发明的发明人证实,在一种示例性适配子的序列内部某些位点处发生改变但不干扰其特性是可能的。因此,技术人员将会立即认识到,如本文所公开的某些序列的适配子保留了它们的特性。因此,在一个实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与选自下述的序列具有至少80%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由与优选选自下述的序列具有至少80%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74以及seqidno:75。在又一实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与选自下述的序列具有至少90%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由与优选选自下述的序列具有至少90%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74以及seqidno:75。在又一实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与选自下述的序列具有至少95%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由与优选选自下述的序列具有至少95%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74以及seqidno:75。在优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与选自下述的序列具有至少99%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由与优选选自下述的序列具有至少99%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74以及seqidno:75。在特别优选的实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由具有选自下述的序列的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74、seqidno:75、seqidno:93、seqidno:94、seqidno:95、seqidno:96、seqidno:97、seqidno:98、seqidno:99、seqidno:100、seqidno:101、seqidno:102、seqidno:103、seqidno:104、seqidno:105、seqidno:106、seqidno:107、seqidno:108、seqidno:109、seqidno:110、seqidno:111、seqidno:112、seqidno:113、seqidno:114、seqidno:115、seqidno:116、seqidno:117、seqidno:118、seqidno:119、seqidno:120、seqidno:121、seqidno:122、seqidno:123、seqidno:124、seqidno:125、seqidno:126、seqidno:127、seqidno:128、seqidno:129、seqidno:130、seqidno:131、seqidno:132、seqidno:133、seqidno:134、seqidno:135、seqidno:136以及seqidno:137;由具有优选选自下述的序列的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74以及seqidno:75。特别优选的本发明所述的转录增强型rna-聚合酶结合适配子由seqidno:2的序列编码,或者由与其具有至少80%的同一性,优选具有至少90%的同一性,更优选具有至少95%的同一性,更优选具有至少97%的同一性,甚至更优选具有99%的同一性的序列编码。本发明还涉及在严格条件下与这些序列中的任何序列杂交的核酸。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:2具有至少80%的同一性的序列编码,优选由与seqidno:2具有至少90%的同一性的序列编码,更优选由与seqidno:2具有至少95%的同一性的序列编码,甚至更优选由与seqidno:2具有至少99%的同一性的序列编码。在具体的实施方案中,rna-聚合酶结合适配子由seqidno:2的序列编码。在由与seqidno:2具有一定的同一性的序列编码的转录增强型rna-聚合酶结合适配子的优选实施方案中,编码适配子的序列在seqidno:2的位点1、7、8、11以及20至23的核苷酸处未改变。本发明的发明人已经表明,编码适配子的序列可以突变但不丧失其活性。具体地,已经表明,由seqidno:2编码的rapid#5713的变体,即seqidno:72至75保留了它们作为转录增强型rna-聚合酶结合适配子的特性。因此,在一个实施方案中,本发明所述的(转录增强型)rna-聚合酶结合适配子由选自seqidno:2、seqidno:72、seqidno:73、seqidno:74和seqidno:75的序列编码。seqidno:75的序列是这样的序列,其在seqidno:2的3’端减少6nt,并因而仅包含seqidno:2的对应于seqidno:1的最小共有序列的部分。由此编码的适配子保留了其功能。因此,在特别优选的实施方案中,本发明所述的(转录增强型)rna-聚合酶结合适配子由这样的序列编码,其包含与seqidno:75具有至少80%的同一性的序列,优选包含与seqidno:75具有至少90%的同一性的序列,更优选包含与seqidno:75具有至少95%的同一性的序列,甚至更优选包含与seqidno:75具有至少99%的同一性的序列。在具体实施方案中,转录增强型rna-聚合酶结合适配子由包含seqidno:75的序列的序列编码。在进一步特别优选的实施方案中,转录增强型rna-聚合酶结合适配子由具有seqidno:75的序列的序列编码。在转录增强型rna-聚合酶结合适配子(其被编码为包含与seqidno:75具有一定的同一性的序列或者由与seqidno:75具有一定的同一性的序列组成)的优选实施方案中,编码适配子的序列在seqidno:75的位点1、7、8、11以及20至23的核苷酸处未改变。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:3具有至少80%的同一性的序列编码,优选由与seqidno:3具有至少90%的同一性的序列编码,更优选由与seqidno:3具有至少95%的同一性的序列编码,甚至更优选由与seqidno:3具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:3的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:4具有至少80%的同一性的序列编码,优选由与seqidno:4具有至少90%的同一性的序列编码,更优选由与seqidno:4具有至少95%的同一性的序列编码,甚至更优选由与seqidno:4具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:4的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:5具有至少80%的同一性的序列编码,优选由与seqidno:5具有至少90%的同一性的序列编码,更优选由与seqidno:5具有至少95%的同一性的序列编码,甚至更优选由与seqidno:5具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:5的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:6具有至少80%的同一性的序列编码,优选由与seqidno:6具有至少90%的同一性的序列编码,更优选由与seqidno:6具有至少95%的同一性的序列编码,甚至更优选由与seqidno:6具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:6的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:7具有至少80%的同一性的序列编码,优选由与seqidno:7具有至少90%的同一性的序列编码,更优选由与seqidno:7具有至少95%的同一性的序列编码,甚至更优选由与seqidno:7具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:7的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:8具有至少80%的同一性的序列编码,优选由与seqidno:8具有至少90%的同一性的序列编码,更优选由与seqidno:8具有至少95%的同一性的序列编码,甚至更优选由与seqidno:8具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:8的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:9具有至少80%的同一性的序列编码,优选由与seqidno:9具有至少90%的同一性的序列编码,更优选由与seqidno:9具有至少95%的同一性的序列编码,甚至更优选由与seqidno:9具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:9的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:10具有至少80%的同一性的序列编码,优选由与seqidno:10具有至少90%的同一性的序列编码,更优选由与seqidno:10具有至少95%的同一性的序列编码,甚至更优选由与seqidno:10具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:10的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:11具有至少80%的同一性的序列编码,优选由与seqidno:11具有至少90%的同一性的序列编码,更优选由与seqidno:11具有至少95%的同一性的序列编码,甚至更优选由与seqidno:11具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:11的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:12具有至少80%的同一性的序列编码,优选由与seqidno:12具有至少90%的同一性的序列编码,更优选由与seqidno:12具有至少95%的同一性的序列编码,甚至更优选由与seqidno:12具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:12的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:13具有至少80%的同一性的序列编码,优选由与seqidno:13具有至少90%的同一性的序列编码,更优选由与seqidno:13具有至少95%的同一性的序列编码,甚至更优选由与seqidno:13具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:13的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:14具有至少80%的同一性的序列编码,优选由与seqidno:14具有至少90%的同一性的序列编码,更优选由与seqidno:14具有至少95%的同一性的序列编码,甚至更优选由与seqidno:14具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:14的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:15具有至少80%的同一性的序列编码,优选由与seqidno:15具有至少90%的同一性的序列编码,更优选由与seqidno:15具有至少95%的同一性的序列编码,甚至更优选由与seqidno:15具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:15的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:16具有至少80%的同一性的序列编码,优选由与seqidno:16具有至少90%的同一性的序列编码,更优选由与seqidno:16具有至少95%的同一性的序列编码,甚至更优选由与seqidno:16具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:16的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:17具有至少80%的同一性的序列编码,优选由与seqidno:17具有至少90%的同一性的序列编码,更优选由与seqidno:17具有至少95%的同一性的序列编码,甚至更优选由与seqidno:17具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:17的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:18具有至少80%的同一性的序列编码,优选由与seqidno:18具有至少90%的同一性的序列编码,更优选由与seqidno:18具有至少95%的同一性的序列编码,甚至更优选由与seqidno:18具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:18的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:19具有至少80%的同一性的序列编码,优选由与seqidno:19具有至少90%的同一性的序列编码,更优选由与seqidno:19具有至少95%的同一性的序列编码,甚至更优选由与seqidno:19具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:19的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:20具有至少80%的同一性的序列编码,优选由与seqidno:20具有至少90%的同一性的序列编码,更优选由与seqidno:20具有至少95%的同一性的序列编码,甚至更优选由与seqidno:20具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:20的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:21具有至少80%的同一性的序列编码,优选由与seqidno:21具有至少90%的同一性的序列编码,更优选由与seqidno:21具有至少95%的同一性的序列编码,甚至更优选由与seqidno:21具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:21的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:22具有至少80%的同一性的序列编码,优选由与seqidno:22具有至少90%的同一性的序列编码,更优选由与seqidno:22具有至少95%的同一性的序列编码,甚至更优选由与seqidno:22具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:22的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:23具有至少80%的同一性的序列编码,优选由与seqidno:23具有至少90%的同一性的序列编码,更优选由与seqidno:23具有至少95%的同一性的序列编码,甚至更优选由与seqidno:23具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:23的序列编码。在本发明的优选实施方案中,本发明所述的转录增强型rna-聚合酶结合适配子由与seqidno:24具有至少80%的同一性的序列编码,优选由与seqidno:24具有至少90%的同一性的序列编码,更优选由与seqidno:24具有至少95%的同一性的序列编码,甚至更优选由与seqidno:24具有至少99%的同一性的序列编码。在具体实施方案中,rna-聚合酶结合适配子由seqidno:24的序列编码。对于由seqidno:2至14以及72至75的序列编码的适配子,观察到了抗终止活性。因此,在本发明的优选实施方案中,抗终止型rna-聚合酶结合适配子由选自下述的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:72、seqidno:73、seqidno:74和seqidno:75,或者由与上述序列具有至少80%的同一性,优选至少90%,更优选至少95%,甚至更优选至少99%的同一性的序列编码。使用karlin和altschul(1993)proc.natl.acad.sci.usa90:5873-5877的数学算法来完成两条序列之间的同一性百分比的测定。将此类算法并入altschul等人(1990)j.mol.biol.215:403-410的blastn和blastp程序。用blastn程序进行blast核苷酸检索,得分=100,字长=12,以获得与各核苷酸序列同源的核苷酸序列。用blastp程序进行blast蛋白检索,得分=50,字长=3,以分别获得与各氨基酸序列同源的氨基酸序列。为了获得出于比较目的的空位对齐,如altschul等人(1997)nucleicacidsres.25:3389-3402中所述,利用空位blast。当利用blast和空位blast程序时,使用各程序的缺省参数。以上概述的关于dna-分子、表达盒和载体的实施方案总体适用于本发明,即也特别适用于转录增强型rna-聚合酶结合适配子。但是,其它实施方案特别适用于与所述转录增强型rna-聚合酶结合适配子相关的主题。如详尽概述的,编码rna-聚合酶结合适配子的序列优选可操作地连接至启动子和/或待表达的序列。在本发明特别优选的实施方案中,编码转录增强型rna-聚合酶结合适配子的序列可操作地连接至启动子,以及任选地可操作地连接至待表达的序列。本文已经显示,转录增强型rna-聚合酶结合适配子能够增加包含所述适配子的转录本的转录/表达。编码本发明所述的转录增强型rna-聚合酶结合适配子的序列优选可操作地连接至启动子序列和转录起始位点。其优选位于本发明所述的dna-分子上的启动子和转录起始位点下游。转录增强型rna-聚合酶结合适配子的编码序列与转录起始位点的距离不重要。但是,具有一定的距离,可在调节转录方面观察到优良的效果。因此,在一个实施方案中,编码本发明所述的转录增强型rna-聚合酶结合适配子的序列优选位于转录起始位点下游10至1000nt的距离内,优选位于转录起始位点下游50至500nt的距离内,更优选位于转录起始位点下游60至250rt的距离内,特别优选位于转录起始位点下游80至103的距离内。编码本发明所述的转录增强型rna-聚合酶结合适配子的序列还优选可操作地连接至待表达的序列,例如开放阅读框。转录增强型rna-聚合酶结合适配子的编码序列与待表达的序列的距离不重要。但是,具有一定的距离,可在调节转录和表达方面观察到优良的效果。因此,在一个实施方案中,编码本发明所述的转录增强型rna-聚合酶结合适配子的序列优选位于待表达的序列或多克隆位点上游10至1000nt的距离内,优选位于待表达的序列或多克隆位点上游50至500nt的距离内,更优选位于待表达的序列或多克隆位点上游60至250nt的距离内,特别优选位于待表达的序列或多克隆位点上游70至108nt的距离内。可以使用以上提及的优选距离的任何组合,例如转录起始位点下游10至1000nt的距离和待表达的序列或多克隆位点上游10至1000nt的距离,或者转录起始位点下游50至500nt的距离和待表达的序列或多克隆位点上游50至500nt的距离,或者转录起始位点下游60至250nt的距离和待表达的序列或多克隆位点上游60至250nt的距离,或者转录起始位点下游80至103nt的距离和待表达的序列或多克隆位点上游70至108nt的距离,或者任何其它可能的组合。必须再次注意到,术语“转录增强型rna-聚合酶结合适配子”指“激活型rna-聚合酶结合适配子”和“抗终止型rna-聚合酶结合适配子”这两者。优选的本发明所述的转录增强型适配子具有两项特征,即是激活型和抗终止型rna-聚合酶结合适配子;特别优选至少是抗终止型rna-聚合酶结合适配子。避免编码rna-聚合酶结合适配子的dna序列或转录后的rna-聚合酶结合适配子的区域内的序列(如反向互补序列)杂交是进一步有利的。在不受理论束缚的情况下,认为此类序列在某些情况下可能与dna序列或转录的rna-聚合酶结合适配子杂交,并从而阻碍其活性。因此,在优选实施方案中,包含本发明所述的rna-聚合酶结合适配子的dna分子或载体不包含在20nt或更长的一段内具有100%的同一性的序列。在优选实施方案中,dna分子或载体在编码rna-聚合酶结合适配子的同一条链上不包含此类杂交序列,优选至少在转录编码rna-聚合酶结合适配子的序列的链的部分上不包含此类杂交序列。在进一步优选的实施方案中,dna分子或载体不编码与同一rna转录本上的rna-聚合酶结合适配子杂交的rna序列,优选至少不在编码rna-聚合酶结合适配子的序列周围30nt的范围内编码与同一rna转录本上的rna-聚合酶结合适配子杂交的rna序列。此外,转录增强型rna-聚合酶结合适配子显示出抗终止活性(抗终止型rna-聚合酶结合适配子),优选地,当位于终止子序列的上游时,转录增强型rna-聚合酶结合适配子显示出抗终止活性。在本发明的优选实施方案中,抗终止型rna-聚合酶结合适配子位于表达盒内终止子序列的上游。终止子序列可以位于待表达的序列的上游、内部或下游。例如,其可以是编码目标蛋白的序列的一部分。在此种情况下,包含本发明所述的抗终止型rna-聚合酶结合适配子以允许蛋白充分表达而不需要干扰包含终止子的编码序列,这可能特别可取。因此,本发明所述的表达盒优选包含编码本发明所述的抗终止型rna-聚合酶结合适配子的序列,其优选包含选自下述的序列:seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:72、seqidno:73、seqidno:74以及seqidno:75,更优选包含选自seqidno:2、seqidno:72、seqidno:73、seqidno:74和seqidno:75的序列。上文所概述的序列的实施方案,例如关于同一性的序列的实施方案同样适用。编码抗终止型rna-聚合酶结合适配子的序列优选可操作地连接至终止子序列,更优选位于终止子序列的上游。抗终止型rna-聚合酶结合适配子的编码序列与终止子序列的距离不重要。但是,具有一定的距离,在调节转录和表达方面可以观察到优良的效果。因此,在一个实施方案中,编码本发明所述的抗终止型rna-聚合酶结合适配子的序列优选位于终止子序列上游10至1000nt的距离内,优选位于终止子序列上游15至500nt的距离内,更优选位于终止子序列上游15至250nt的距离内,特别优选位于终止子序列上游20至111nt的距离内。可以使用以上提及的优选距离的任何组合。在一个特别优选的实施方案中,抗终止型rna-聚合酶结合适配子的编码序列位于转录起始位点下游80至103nt和终止子序列上游20至111nt处。优选的终止子序列选自如本文进一步概述的内在终止子序列和依赖因子的终止子序列。在特别优选的实施方案中,本发明所述的表达盒包含编码本发明所述的转录增强型rna-聚合酶结合适配子的序列、启动子和多克隆位点,其中编码所述转录增强型rna-聚合酶结合适配子的序列位于所述启动子的转录起始位点的下游和所述多克隆位点的上游。表达盒可以包含于dna-分子中,优选包含于载体中。特别优选地,转录增强型rna-聚合酶结合适配子是本发明所述的抗终止型rna-聚合酶结合适配子。此外,本发明还涉及本发明所述的转录增强型rna-聚合酶结合适配子或编码转录增强型rna-聚合酶结合适配子的dna-分子用于增强宿主细胞中的内源序列的表达的用途。宿主细胞优选是非人的宿主细胞,更优选细菌,特别优选大肠杆菌。编码本发明所述的转录增强型rna-聚合酶结合适配子的dna-分子优选插入转录所述内源序列的启动子的下游。本发明还涉及用于增强宿主细胞中的内源序列的表达的方法,其包括下述步骤:将包含编码本发明所述的转录增强型rna-聚合酶结合适配子的序列的dna-分子插入所述宿主细胞的基因组,以使编码本发明所述的转录增强型rna-聚合酶结合适配子的序列可操作地连接至所述内源序列的启动子,优选插入所述启动子的下游。进一步优选地,将所述适配子插入所述启动子的下游和所述内源序列的上游。此外,本发明涉及抗终止型rna-聚合酶结合适配子或包含编码抗终止型rna-聚合酶结合适配子的序列的dna-分子用于阻抑宿主细胞的内源序列中存在的终止子的用途。技术人员可以选择期望的转录增强型rna-聚合酶结合适配子,尤其涉及增强的强度。因此,其可以考虑某些方面,如启动子的强度,即在无适配子的情况下转录发生的程度。此外,技术人员将考虑期望的表达的量,例如在诱导转录时。为此,其可以从随此提供的转录增强型rna-聚合酶结合适配子中进行选择,因为它们具有不同的增强程度。此外,可以使用多条编码转录增强型rna-聚合酶结合适配子的序列。因此,在本发明的一个实施方案中,表达盒包含编码两个或更多个转录增强型rna-聚合酶结合适配子的序列,优选包含三条或更多条编码转录增强型rna-聚合酶结合适配子的序列。该序列包含所述两条或更多条或者所述三条或更多条rna-聚合酶结合适配子的编码序列,优选作为连续序列,例如串联重复序列,任选地由间隔子序列分隔。由所述序列编码的适配子可以全都是相同的转录增强型rna-聚合酶结合适配子,或者它们可以编码不同的转录增强型rna-聚合酶结合适配子。本发明所述的转录增强型rna-聚合酶结合适配子适用于多种用途和方法。因此,本发明涉及本发明所述的转录增强型rna-聚合酶结合适配子用于调节核酸的表达的用途,优选涉及编码本发明所述的转录增强型rna-聚合酶结合适配子的dna序列用于调节待表达的序列的表达的用途。此外,本发明涉及本发明所述的dna-分子用于增强待表达的序列的表达的用途。此外,本发明涉及本发明所述的表达盒用于表达目标序列,优选蛋白的用途。同样地,本发明涉及本发明所述的载体用于表达目标序列,优选蛋白的用途。同样地,本发明涉及本发明所述的表达盒,即包含编码本发明所述的转录增强型rna-聚合酶结合适配子的序列的表达盒用于表达目标序列,例如编码目标蛋白的序列的用途。表达可在宿主细胞或者在体外表达系统中进行。可在宿主细胞或体外表达系统中使用本发明所述的dna-分子、表达盒和/或载体。体外表达系统对于本领域普通技术人员而言是已知的,并且其广泛用于实验室实践和分析(参见,例如spirin,a.;baranov,v.;ryabova,l.;ovodov,s.;alakhov,y.(1988).″acontinuouscell-freetranslationsystemcapableofproducingpolypeptidesinhighyield″.science242(4882):1162;jackson,am等人,(2004).″cell-freeproteinsynthesisforproteomics″.briefingsinfunctionalgenomicsandproteomics2(4):308-319;carlson,ed等人,(2011).″cell-freeproteinsynthesis:applicationscomeofage″.biotechnoladv30(5):1185;以及bundy,bradleyc.;franciszkowicz,marcj.;swartz,jamesr.(2008).″escherichiacoli-basedcell-freesynthesisofvirus-likeparticles″.biotechnologyandbioengineering100(1):28-37)。体外表达系统的一个实例是体外蛋白合成试剂盒(neb;https://www.neb.com/products/e6800-purexpress-invitro-protein-synthesis-kit),其可以与本发明结合使用。体外表达系统使用dna依赖性rna聚合酶以将dna分子转录成rna,并且任选地,如果需要,其可以使用核糖体以将rna翻译成多肽。该系统主要针对噬菌体聚合酶(t7、sp6等)而设计,但是其还可以进一步优化以用于细菌rnap,优选来自大肠杆菌的rnap。本发明所述的rna结合适配子优选以本文所概述的亲和力优选结合体外表达系统的聚合酶,优选结合非噬菌体聚合酶,更优选结合体外表达或转录系统的细菌rna聚合酶,这将是显而易见的。现今,由于高的转录产量,大部分体外系统使用噬菌体聚合酶。然而,它们倾向于影响转录的rna的二级结构和rna错误折叠。目前,可以获得含有细菌rna聚合酶的体外系统,但是其并不常用,因为rna产量通常较低。对于技术人员而言显而易见的是,本发明对其进行了改进。因此,在优选实施方案中,本发明涉及本发明所述的dna-分子,优选包含编码本发明所述的转录增强型rna-聚合酶结合适配子的序列的dna-分子用于体外转录和/或表达的用途。优选地,转录增强型rna-聚合酶结合适配子结合用于体外转录和/或表达的细菌rna聚合酶。此外,本发明涉及用于体外转录目标rna的方法,其包括:提供本发明所述的dna-分子,所述dna-分子包含编码本发明所述的rna-聚合酶结合适配子的序列,优选地,所述dna-分子包含本发明所述的表达盒,所述dna-分子包含可操作地连接至启动子和编码rna-聚合酶结合适配子的序列的编码目标rna的序列;在允许所述启动子转录的条件下,将所述dna-分子与本发明所述的rna-聚合酶孵育;以及任选地,回收所述目标rna。rna-聚合酶结合适配子可以是本发明所述的转录增强型rna-聚合酶结合适配子或者抑制型rna-聚合酶结合适配子及其组合。可以根据需要,例如增强还是抑制转录,来选择适配子的性质。在特别优选的实施方案中,rna-聚合酶结合适配子是本发明所述的转录增强型rna-聚合酶结合适配子。技术人员了解适合体外转录的条件。它们包括三磷酸核苷(ntp)和适合的缓冲剂的存在。三磷酸核苷包括天然的三磷酸核苷,如三磷酸腺苷(atp)、三磷酸鸟苷(gtp)、三磷酸胞苷(ctp)、5-甲基尿苷三磷酸(m5utp)和三磷酸尿苷(utp),但不限于此。此外,可以添加诸如镁的辅因子。在一个实施方案中,使用细胞提取物进行孵育。此外,可以添加转录抑制剂,例如大肠杆菌的rho抑制剂。这允许更加精密地控制表达。此外,本发明涉及用于体外表达目标蛋白的方法,其包括提供本发明所述的dna-分子,所述dna-分子包含编码本发明所述的转录增强型rna-聚合酶结合适配子的序列,优选地,所述dna-分子包含本发明所述的表达盒,所述dna-分子包含可操作地连接至启动子和编码转录增强型rna-聚合酶结合适配子的序列的编码目标蛋白的序列;在允许所述启动子转录和转录本翻译的条件下,将所述dna-分子与组分孵育;以及任选地,回收所述目标蛋白。体外表达也被称为无细胞表达。无细胞反应的常规组分包含细胞提取物、能源、一定量的氨基酸、细胞提取物的翻译和/或翻译机构的辅因子以及本发明所述的dna-分子。此类辅因子可以是二价阳离子,如镁。可以通过裂解目标细胞以及离心去除细胞壁、dna基因组和其它碎片获得细胞提取物。剩余的是必要的细胞机构,包括核糖体、氨酰基-trna合成酶、翻译起始和延伸因子、核酸酶等。优选的细胞提取物是来自以上概述的细胞,如适合的本发明所述的宿主细胞的提取物,优选真核或原核细胞提取物,优选细菌的细胞提取物,更优选大肠杆菌的细胞提取物。本发明还涉及包含编码本发明所述的转录增强型rna-聚合酶结合适配子的序列的dna-分子用于增加体外转录或体外表达分析的产量的用途。这可以,例如通过以上概述的方法进行,或者通过使所述dna-分子或至少所述序列包含于可用的分析中来进行。两种类型的dna-分子可以用于体外表达或转录,即质粒和线性dna-分子(线性表达模板)。质粒是环状的,并且通常使用细胞来制备。可以经pcr(参见聚合酶链式反应)更有效地制备线性dna-分子,pcr复制dna比饲养包含质粒的细胞快得多。尽管线性dna-分子的制备更容易且更快速,但是在无细胞表达中质粒的产量通常更高。因此,现今的许多研究着眼于优化无细胞表达的产量,以在使用线性dna-分子时接近质粒的产量。本发明提供了解决方案。“能源”指向反应添加的、例如除细胞提取物之外的用于转录和/或翻译的需要的能量来源。优选的能源是磷酸烯醇丙酮酸、乙酰磷酸和磷酸肌酸。本文使用的“氨基酸”包括天然和非天然的氨基酸,优选地,添加一种或多种下述蛋白氨基酸(proteinogenicaminoacid):丙氨酸、半胱氨酸、天冬氨酸、谷氨酸、苯丙氨酸、甘氨酸、组氨酸、异亮氨酸、赖氨酸、亮氨酸、甲硫氨酸、天冬酰胺、吡咯赖氨酸、脯氨酸、谷氨酰胺、精氨酸、丝氨酸、苏氨酸、硒代半胱氨酸、缬氨酸、色氨酸和以及酪氨酸。在一个实施方案中,添加列出的所有氨基酸。因此,本发明还涉及包含本发明所述的dna-分子或载体的试剂盒。试剂盒还可以包含可用于它们意图用于的各分析的组分,例如体外转录或翻译系统的组分,或者用于宿主细胞的转染或转化的试剂、缓冲剂或其它试剂,或者如本文进一步描述的宿主细胞。通过使用本发明所述的转录增强型rna-聚合酶结合适配子,可以增强序列(例如编码目标蛋白的序列)的表达。因此,在特别优选的实施方案中,本发明涉及产生目标蛋白的方法,其包括:提供本发明所述的载体,所述载体包含编码本发明所述的转录增强型rna-聚合酶结合适配子的序列,优选地,所述载体包含本发明所述的表达盒;将编码所述目标蛋白的序列克隆进所述载体中,以使所述序列可操作地连接至启动子和编码转录增强型rna-聚合酶结合适配子的序列,从而获得最终的表达载体;将所述表达载体引入宿主细胞;和在诱导来自表达载体的启动子的转录的条件下,于培养基中培养所述宿主细胞;以及任选地,从所述宿主细胞或培养基中回收所述目标蛋白。技术人员将会理解,如果初始载体包含编码所述目标蛋白的序列,则产生目标蛋白的方法的克隆步骤可以省略。在该实施方案中,本发明所述的方法包括下述步骤:提供本发明所述的载体,优选包含本发明所述的表达盒的载体,所述载体包含可操作地连接至启动子和编码转录增强型rna-聚合酶结合适配子的序列的编码目标蛋白的序列;将所述载体引入宿主细胞;和在诱导来自表达载体的启动子的转录的条件下,于培养基中培养所述宿主细胞;以及任选地,从所述宿主细胞或培养基中回收所述目标蛋白。转录增强型rna-聚合酶结合适配子可以是激活型或抗终止型rna-聚合酶结合适配子,优选本发明和以上概述的实施方案所述的抗终止型rna-聚合酶结合适配子。本发明的发明人已经发现,当转录自编码本发明所述的rna-聚合酶结合适配子的亚组的dna链时,所述适配子降低rna聚合酶的活性。如果dna区段包含编码本发明所述的rna-聚合酶结合适配子的序列,则所述dna区段的转录效率降低。因此,在本发明的一个优选实施方案中,rna-聚合酶结合适配子降低(减少或抑制)rna-聚合酶的活性。本实施方案所述的rna-聚合酶结合适配子也可被互换地称为“抑制型”或“转录抑制型”rna-聚合酶结合适配子。技术人员知晓测定rna-聚合酶的活性和其上的序列的作用的方法、分析和系统。如上文和所附实施例中详细概述的,此类方法包括在宿主细胞中表达报告基因,或者可以应用体外转录分析。在一个优选实施方案中,本发明所述的rna-聚合酶结合适配子,优选在本文公开的报告子分析中,抑制rna-聚合酶的活性。抑制可以是依赖rho的或不依赖rho的,优选依赖rho的。在本发明的优选实施方案中,抑制型rna-聚合酶结合适配子降低或减少待表达的序列的表达,其中与不包含所述抑制型rna-聚合酶结合适配子时所述待表达的序列的表达相比,表达降低至少30%,优选降低至少20%,甚至更优选降低至少50%。本发明所述的抑制型rna-聚合酶结合适配子优选包含转录中止基序,优选具有共有序列g-10y-1g+1的转录中止基序。此外,本发明的发明人已经发现,抑制型rna-聚合酶结合适配子具有33.67%的增加的c含量中值,而g含量中值是15.69%(图19)。因此,在一个实施方案中,抑制型rna-聚合酶结合适配子具有高于27%,优选高于30%,更优选高于31%的c含量,并且其中rna-聚合酶结合适配子具有低于23%,优选低于20%,更优选低于17%的g含量。已经鉴定出了共有序列,其对于不同的抑制型rna-聚合酶结合适配子是通用的。因此,在本发明所述的抑制型rna-聚合酶结合适配子的优选实施方案中,适配子包含由选自seqidno:84、seqidno:85、seqidno:86和seqidno:87的序列编码的序列。不同的序列落入这些共有序列内;参见实施例2。因此,在本发明所述的抑制型rna-聚合酶结合适配子的优选实施方案中,适配子包含由seqidno:84的序列编码的序列,以及包含由与选自seqidno:29、seqidno:35、seqidno:41、seqidno:27和seqidno:39的序列具有至少80%的同一性的序列编码的序列,优选由与选自seqidno:29、seqidno:35、seqidno:41、seqidno:27和seqidno:39的序列具有至少90%的同一性的序列编码的序列;更优选由与选自seqidno:29、seqidno:35、seqidno:41、seqidno:27和seqidno:39的序列具有至少95%的同一性的序列编码的序列;进一步优选由与选自seqidno:29、seqidno:35、seqidno:41、seqidno:27和seqidno:39的序列具有至少99%的同一性的序列编码的序列。在某一实施方案中,本发明所述的抑制型rna-聚合酶结合适配子包含由seqidno:84的序列编码的序列,以及包含由选自seqidno:29、seqidno:35、seqidno:41、seqidno:27和seqidno:39的序列编码的序列。在本发明所述的抑制型rna-聚合酶结合适配子的进一步优选的实施方案中,适配子包含由seqidno:85的序列编码的序列,以及包含由与选自seqidno:31、seqidno:91、seqidno:88、seqidno:32、seqidno:26和seqidno:36的序列具有至少80%的同一性的序列编码的序列,优选由与选自seqidno:31、seqidno:91、seqidno:88、seqidno:32、seqidno:26和seqidno:36的序列具有至少90%的同一性的序列编码的序列;更优选由与选自seqidno:31、seqidno:91、seqidno:88、seqidno:32、seqidno:26和seqidno:36的序列具有至少95%的同一性的序列编码的序列;进一步优选由与选自seqidno:31、seqidno:91、seqidno:88、seqidno:32、seqidno:26和seqidno:36的序列具有至少99%的同一性的序列编码的序列。在某一实施方案中,本发明所述的抑制型rna-聚合酶结合适配子包含由seqidno:85的序列编码的序列,以及包含由选自seqidno:31、seqidno:91、seqidno:88、seqidno:32、seqidno:26和seqidno:36的序列编码的序列。在本发明所述的抑制型rna-聚合酶结合适配子的进一步优选的实施方案中,适配子包含由seqidno:86的序列编码的序列,以及包含由与选自seqidno:89和seqidno:34的序列具有至少80%的同一性的序列编码的序列,优选由与选自seqidno:89和seqidno:34的序列具有至少90%的同一性的序列编码的序列;更优选由与选自seqidno:89和seqidno:34的序列具有至少95%的同一性的序列编码的序列;进一步优选由与选自seqidno:89和seqidno:34的序列具有至少99%的同一性的序列编码的序列。在某一实施方案中,本发明所述的抑制型rna-聚合酶结合适配子包含由seqidno:86的序列编码的序列,以及包含由选自seqidno:89和seqidno:34的序列编码的序列。在本发明所述的抑制型rna-聚合酶结合适配子的进一步优选的实施方案中,适配子包含由seqidno:87的序列编码的序列,以及包含由与选自seqidno:37、seqidno:40、seqidno:33、seqidno:25;seqidno:92、seqidno:30、seqidno:90和seqidno:38的序列具有至少80%的同一性的序列编码的序列,优选由与选自seqidno:37、seqidno:40、seqidno:33、seqidno:25;seqidno:92、seqidno:30、seqidno:90和seqidno:38的序列具有至少90%的同一性的序列编码的序列;更优选由与选自seqidno:37、seqidno:40、seqidno:33、seqidno:25;seqidno:92、seqidno:30、seqidno:90和seqidno:38的序列具有至少95%的同一性的序列编码的序列;进一步优选由与选自seqidno:37、seqidno:40、seqidno:33、seqidno:25;seqidno:92、seqidno:30、seqidno:90和seqidno:38的序列具有至少99%的同一性的序列编码的序列。在某一实施方案中,本发明所述的抑制型rna-聚合酶结合适配子包含由seqidno:87的序列编码的序列,以及包含由选自seqidno:37、seqidno:40、seqidno:33、seqidno:25;seqidno:92、seqidno:30、seqidno:90和seqidno:38的序列编码的序列。本发明的发明人发现了降低与其结合的rna-聚合酶的活性的多种抑制型rna-聚合酶结合适配子。因此,在一个实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与选自下述的序列具有至少80%的同一性的序列编码:seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。在又一实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与选自下述的序列具有至少90%的同一性的序列编码:seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。在又一实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与选自下述的序列具有至少95%的同一性的序列编码:seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。在优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与选自下述的序列具有至少99%的同一性的序列编码:seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。在具体实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由具有选自下述的序列的序列编码:seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。本发明还涉及在严格条件下与任何以上序列杂交的核酸。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:25具有至少80%的同一性的序列编码,优选由与seqidno:25具有至少90%的同一性的序列编码,更优选由与seqidno:25具有至少95%的同一性的序列编码,甚至更优选由与seqidno:25具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:25的序列编码。在由与seqidno:25具有一定的同一性的序列编码的抑制型rna-聚合酶结合适配子的优选实施方案中,编码所述适配子的序列在对应于seqidno:25的10、11、18、20、21以及24至27位点处的核苷酸未改变。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:26具有至少80%的同一性的序列编码,优选由与seqidno:26具有至少90%的同一性的序列编码,更优选由与seqidno:26具有至少95%的同一性的序列编码,甚至更优选由与seqidno:26具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:26的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:27具有至少80%的同一性的序列编码,优选由与seqidno:27具有至少90%的同一性的序列编码,更优选由与seqidno:27具有至少95%的同一性的序列编码,甚至更优选由与seqidno:27具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:27的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:28具有至少80%的同一性的序列编码,优选由与seqidno:28具有至少90%的同一性的序列编码,更优选由与seqidno:28具有至少95%的同一性的序列编码,甚至更优选由与seqidno:28具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:28的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:29具有至少80%的同一性的序列编码,优选由与seqidno:29具有至少90%的同一性的序列编码,更优选由与seqidno:29具有至少95%的同一性的序列编码,甚至更优选由与seqidno:29具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:29的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:30具有至少80%的同一性的序列编码,优选由与seqidno:30具有至少90%的同一性的序列编码,更优选由与seqidno:30具有至少95%的同一性的序列编码,甚至更优选由与seqidno:30具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:30的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:31具有至少80%的同一性的序列编码,优选由与seqidno:31具有至少90%的同一性的序列编码,更优选由与seqidno:31具有至少95%的同一性的序列编码,甚至更优选由与seqidno:31具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:31的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:32具有至少80%的同一性的序列编码,优选由与seqidno:32具有至少90%的同一性的序列编码,更优选由与seqidno:32具有至少95%的同一性的序列编码,甚至更优选由与seqidno:32具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:32的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:33具有至少80%的同一性的序列编码,优选由与seqidno:33具有至少90%的同一性的序列编码,更优选由与seqidno:33具有至少95%的同一性的序列编码,甚至更优选由与seqidno:33具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:33的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:34具有至少80%的同一性的序列编码,优选由与seqidno:34具有至少90%的同一性的序列编码,更优选由与seqidno:34具有至少95%的同一性的序列编码,甚至更优选由与seqidno:34具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:34的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:35具有至少80%的同一性的序列编码,优选由与seqidno:35具有至少90%的同一性的序列编码,更优选由与seqidno:35具有至少95%的同一性的序列编码,甚至更优选由与seqidno:35具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:35的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:36具有至少80%的同一性的序列编码,优选由与seqidno:36具有至少90%的同一性的序列编码,更优选由与seqidno:36具有至少95%的同一性的序列编码,甚至更优选由与seqidno:36具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:36的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:37具有至少80%的同一性的序列编码,优选由与seqidno:37具有至少90%的同一性的序列编码,更优选由与seqidno:37具有至少95%的同一性的序列编码,甚至更优选由与seqidno:37具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:37的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:38具有至少80%的同一性的序列编码,优选由与seqidno:38具有至少90%的同一性的序列编码,更优选由与seqidno:38具有至少95%的同一性的序列编码,甚至更优选由与seqidno:38具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:38的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:39具有至少80%的同一性的序列编码,优选由与seqidno:39具有至少90%的同一性的序列编码,更优选由与seqidno:39具有至少95%的同一性的序列编码,甚至更优选由与seqidno:39具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:39的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:40具有至少80%的同一性的序列编码,优选由与seqidno:40具有至少90%的同一性的序列编码,更优选由与seqidno:40具有至少95%的同一性的序列编码,甚至更优选由与seqidno:40具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:40的序列编码。在本发明的优选实施方案中,本发明所述的抑制型rna-聚合酶结合适配子由与seqidno:41具有至少80%的同一性的序列编码,优选由与seqidno:41具有至少90%的同一性的序列编码,更优选由与seqidno:41具有至少95%的同一性的序列编码,甚至更优选由与seqidno:41具有至少99%的同一性的序列编码。在具体实施方案中,抑制型rna-聚合酶结合适配子由seqidno:41的序列编码。如以上所一般概述的dna-分子、表达盒、载体和宿主细胞的所有实施方案同样适用于抑制型rna-聚合酶结合适配子的优选实施方案。技术人员还将认识到,利用本发明所述的rna-聚合酶结合适配子对内源或外源序列的表达的进一步调节可以通过使用依赖于发现的rho抑制因子的机制来进行。当例如使用本发明所述的抑制型rna-聚合酶结合适配子时,可以通过将表达系统(体外或体内)与rho抑制剂的抑制剂(例如双环霉素)一起孵育来控制其对表达的抑制作用。这允许精密地控制表达。因此,在本发明所述的用途和方法的一个实施方案中,添加rho转录抑制剂的抑制剂,以进一步调节表达。本发明所述的rho转录抑制剂的抑制剂优选双环霉素。其与本发明所述的抑制型rna-聚合酶结合适配子的结合特别有用。因此,在一个实施方案中,本发明涉及用于控制宿主细胞中目标序列的表达的方法,其包括下述步骤:提供包含dna-分子的宿主细胞,所述dna分子包含与启动子和目标序列可操作地连接的编码本发明所述的抑制型rna-聚合酶结合适配子的序列;在允许目标序列以期望的水平表达的条件下,于培养基中培养所述宿主细胞,其中所述培养基包含rho转录抑制剂的抑制剂,其浓度允许以期望的水平表达。目标序列可以是宿主细胞的外源序列或内源序列。因此,例如,该方法可以用于控制宿主细胞的内源序列的下调(抑制),例如用于功能分析。可以使用本发明所述的任何抑制型rna-聚合酶,优选以上所限定的那些,因为所有测试的本发明所述的抑制型rna-聚合酶结合适配子已经显示出对rho抑制剂和双环霉素(bcm)的显著依赖性。因此,在关于这一点的优选实施方案中,抑制型rna-聚合酶结合适配子由如上文所限定的序列编码。但是,优选的抑制型rna-聚合酶结合适配子由与选自seqidno:25和seqidno:92的序列具有至少80%的同一性的序列编码,优选由与选自seqidno:25和seqidno:92的序列具有至少90%的同一性的序列编码,更优选由与选自seqidno:25和seqidno:92的序列具有至少95%的同一性的序列编码,更优选地,抑制型rna-聚合酶结合适配子由选自seqidno:25和seqidno:92的序列编码。本发明所述的rho转录抑制剂的抑制剂优选双环霉素,其水平优选为1μg/ml至100μg/ml,更优选1μg/ml至50μg/ml,最优选5μg/ml至25μg/ml,包括8μg/ml、10μg/ml、15μ/ml、20μg/ml、24μg/ml。如上文所概述的,本发明还涉及包含编码本发明所述的rna-聚合酶结合适配子的序列的dna-分子。在优选实施方案中,rna-聚合酶结合适配子是抑制型rna-聚合酶结合适配子,优选选自如上文所列的抑制型rna-聚合酶适配子组。本领域技术人员将会理解,包含编码抑制型rna-聚合酶结合适配子的序列的dna-分子可以优选用于阻抑或抑制与之可操作地连接的启动子的表达。因此,在本发明的优选实施方案中,本发明所述的dna-分子包含编码抑制型rna-聚合酶结合适配子的序列和启动子,其中编码所述适配子的序列可操作地连接至所述启动子,优选可操作地连接以阻抑或减少所述启动子的转录。一些方法使用这样的启动子:其转录仅在某些条件(如在某些化合物存在的情况下)或者其它环境条件(如温度)下具有活性或者增加。但是,这些方法通常经受诱导型启动子在非诱导条件下不完全“封闭”这一事实,即即使在用于诱导启动子转录的刺激不存在的情况下,从所述启动子仍发生基础转录和表达。然而,这对于宿主细胞而言可能是有害的,特别是在目标蛋白具有有害特性的情况下。在这些情况下,提供在非诱导条件下“封闭”的表达系统或盒是可取的。本发明的发明人现今提供抑制型rna-聚合酶结合适配子,其在这方面提供出人意料的效果。通过包含可操作地连接至启动子的编码此类抑制型rna-聚合酶结合适配子的序列,可能使启动子封闭。因此,在优选实施方案中,本发明涉及包含表达盒的dna-分子,所述表达盒包含本发明所述的诱导型启动子和编码本发明所述的抑制型rna-聚合酶结合适配子的序列,其中编码所述适配子的序列可操作地连接至所述诱导型启动子,优选位于所述诱导型启动子的下游。技术人员可以选择期望的抑制型rna-聚合酶结合适配子,尤其涉及抑制的强度。因此,其可以考虑某些方面,如启动子在非诱导状态的泄露,即在无刺激的情况下转录发生的程度。此外,技术人员将会考虑诱导转录时期望的表达量。为此,其可以从随此提供的抑制型rna-聚合酶结合适配子中进行选择,因为它们具有不同程度的抑制。此外,可以使用多条编码抑制型rna-聚合酶结合适配子的序列。因此,在本发明的一个实施方案中,表达盒包含编码两个或更多个抑制型rna-聚合酶结合适配子,优选三个或更多个抑制型rna-聚合酶结合适配子的序列。这些适配子可以全部是相同的抑制型rna-聚合酶结合适配子或者它们可以是本发明所述的不同的抑制型rna-聚合酶结合适配子。在一个实施方案中,本发明涉及编码本发明所述的抑制型rna-聚合酶结合适配子的序列用于抑制蛋白表达的用途,优选用于抑制微生物,如原核或真核细胞系,包括细菌和哺乳动物细胞系中的蛋白表达的用途。在本发明的优选实施方案中,所述编码所述rna-聚合酶结合适配子的序列位于起始所述蛋白的表达的启动子的下游。这意味着,rna-聚合酶结合适配子是编码待表达的蛋白的mrna的一部分。本发明所述的用途涵盖调节任何目标蛋白表达的用途。本发明还涉及本发明所述的抑制型rna-聚合酶结合适配子或编码抑制型rna-聚合酶结合适配子的dna-分子用于抑制宿主细胞内的内源序列表达的用途,或者使用本发明所述的rna-聚合酶结合适配子或编码抑制型rna-聚合酶结合适配子的dna-分子抑制宿主细胞内的内源序列的表达的方法。宿主细胞优选非人的宿主细胞。编码本发明所述的抑制型rna-聚合酶结合适配子的dna-分子优选插入转录所述内源序列的启动子的下游。本发明还涉及抑制宿主细胞中的内源序列的表达的方法,其包括下述步骤:将包含编码本发明所述的抑制型rna-聚合酶结合适配子的序列的dna-分子插入所述宿主细胞的基因组,以使编码本发明所述的抑制型rna-聚合酶结合适配子的序列可操作地连接至所述内源序列的启动子,优选插入所述启动子的下游。进一步优选地,所述适配子插入所述启动子的下游和所述内源序列的上游。编码抑制型rna-聚合酶结合适配子的序列优选可操作地连接至启动子和/或待表达的序列或者多克隆位点。在本发明特别优选的实施方案中,编码抑制型rna-聚合酶结合适配子的序列可操作地连接至启动子,以及任选地可操作地连接至待表达的序列或多克隆位点。本文已经显示,抑制型rna-聚合酶结合适配子能够降低包含所述适配子的转录本的转录/表达。编码本发明所述的抑制型rna-聚合酶结合适配子的序列优选可操作地连接至启动子序列和转录起始位点。其优选位于本发明所述的dna-分子上的启动子和转录起始位点的下游。抑制型rna-聚合酶结合适配子的编码序列与转录起始位点的距离不重要。但是,具有一定的距离,可以在调节和抑制转录方面观察到优良的效果。因此,在一个实施方案中,编码本发明所述的抑制型rna-聚合酶结合适配子的序列优选位于转录起始位点下游10至1000nt的距离内,优选位于转录起始位点下游15至500nt的距离内,更优选位于转录起始位点下游25至250nt的距离内。编码本发明所述的抑制型rna-聚合酶结合适配子的序列还优选可操作地连接至待表达的序列,例如开放阅读框或多克隆位点。抑制型rna-聚合酶结合适配子的编码序列与待表达的序列的距离不重要。但是,具有一定的距离,可以在调节和抑制转录和表达方面观察到优良的效果。因此,在一个实施方案中,编码本发明所述的抑制型rna-聚合酶结合适配子的序列优选位于待表达的序列或多克隆位点上游至少20nt处,例如位于待表达的序列或多克隆位点上游20至1000nt的距离内,优选位于待表达的序列或多克隆位点上游30至500nt的距离内,更优选位于待表达的序列或多克隆位点上游40至250nt的距离内。可以使用以上提及的优选距离的任何组合,例如转录起始位点下游10至1000nt的距离和待表达的序列上游20至1000nt的距离,或者转录起始位点下游15至500nt的距离和待表达的序列上游15至500nt的距离,或者转录起始位点下游25至250nt的距离和待表达的序列上游40至250nt的距离,或者任何其它可能的组合。本发明的发明人已经发现,一种功能机制是使转录与翻译暂时解偶联。在结合rna聚合酶的表面时,抑制型rna结合适配子产生核糖体前进的物理屏障(图23e);参见,例如图23e。因此,在一个实施方案中,本发明所述的抑制型rna-聚合酶结合适配子在待表达的序列内编码,优选在待表达的蛋白的orf内编码。在一个实施方案中,抑制型rna-聚合酶结合适配子由seqidno:25的序列编码或者由与seqidno:25的序列具有至少80%的同一性,优选至少90%的同一性,更优选至少95%的同一性,更优选至少99%的同一性的序列编码。本发明还涉及产生目标蛋白的方法,其包括下述步骤:提供包含本发明所述的表达盒的载体,所述表达盒包含编码本发明所述的抑制型rna-聚合酶结合适配子的序列;将所述载体引入宿主细胞;和在诱导来自表达盒的启动子的转录的条件下,于培养基中培养所述宿主细胞;以及任选地,从所述宿主细胞或培养基中回收所述目标蛋白。启动子优选选自本发明所述的组成型启动子或诱导型启动子,优选本发明所述的诱导型启动子。此外,待表达的蛋白优选对所述宿主细胞具有有害影响。该方法可以包括下述步骤:在诱导来自表达盒的诱导型启动子的转录的条件下,于培养基中培养所述宿主细胞之前,在不诱导来自表达盒的诱导型启动子的转录的条件下培养所述宿主细胞。在本说明书中,引用了多个文件,包括专利申请。这些文件的公开内容,尽管不认为与本发明的可专利性相关,但是在此仍将其通过引用整体并入。更具体地,所有引用的文件均通过引用并入,其程度如同明确且分别指示将各单独的文件通过引用并入。现在将通过参考下述实施例描述本发明,所述实施例仅是示例性的,并且不被解释为限制本发明的范围。实施例通用材料和方法以及rna-聚合酶相互作用适配子(rap)的鉴定深度测序首先将来自第7轮selex的rna文库逆转录成cdna,并且根据p.parameswaran等人,nucleicacidsres.35,e130(2007)和n.windbichler,f.vonpelchrzim,o.mayer,e.csaszar,r.schroeder,rnabiol.5,30-40(2008),利用具有固定部分和添加的用于多重测定的条形码的引物(fixfw:tataggggaattcggagcggg(seqidno:45,fixrv_multi:tagcccgggatcctcggggctg(sigma;seqidno:46)),用phusion聚合酶(newenglandbiolabs)通过16个循环的pcr进行扩增。在csfngs单元http://csf.ac.at/进行文库制备(适配子连接步骤)和深度测序。用solexa技术,在具有双端76个碱基对的读取的gaiix上,对selex文库进行多重测定和测序。利用trimmomatic对读取进行修整(a.m.bolger,m.lohse,b.usadel,bioinformatics.30,2114-20(2014)),并利用nextgenmap将其定位于大肠杆菌菌株k12(亚株mg1655,genbankid:u00096.3)的参考基因组(f.j.sedlazeck,p.rescheneder,a.vonhaeseler,bioinformatics.29,2790-1(2013))。用允许高至20%的序列趋异的许可设置进行读取定位,以解释通过selex程序引入的相当大量的序列改变(b.zimmermann,i.bilusic,c.lorenz,r.schroeder,methods.52,125-32(2010);和b.zimmermann,t.gesell,d.chen,c.lorenz,r.schroeder,plosone,5,e9169(2010))。然后用20的最低定位质量将定位的读取进行过滤,这产生915,594个双端读取。从ecogene3.0下载相应的orf注释(j.zhou,k.e.rudd,nucleicacidsres.41,d613-24(2013)),以及从regulondb下载相应的5’和3’utr注释(j.zhou,k.e.rudd,nucleicacidsres,41,d613-24(2013))。寻峰提取来自k12对齐的链特异的覆盖度信号,并向这些信号应用自定义的寻峰方法,以鉴定发现在各selex循环中富集的mrna片段的原始基因组区域。简言之,我们的寻峰方法由下述步骤组成:(1)利用移动的高斯核的信号平滑,(2)通过三次埃尔米特插值粗略估计各信号位置处的一阶导数,(3)基于导数的符号改变和确定的最小/最大峰维度寻峰(最小宽度:10bp,最大宽度:500bp,最低(平滑的)峰高:t.l.bailey等人nucleicacidsres.37,w202-8(2009))。间隔注释和分类根据其是否与注释的orf或utr重叠而将峰间隔进行分类。当将间隔定位至现有的orf或utr注释的相反链时,将其注释为“反义的”。基于基因组位置,将其分为几类:5’utr(对应序列在任何注释的5’utr内对齐)、3’utr(对应序列在任何注释的3’utr内对齐)、基因内的(正义的)(对应序列在注释的基因内对齐,排除5’-和3’utr的情况)、反义的(对应序列在注释基因的相反链上对齐)以及基因间的(正义的)(对应序列在注释的基因之间)。为了表征rap在转录本内的位置,在注释的转录本内计算它们的相对位置(图1c-1d)。数据指示rap在翻译起始位点周围的富集和rap在5’/3’utr区域的缺失。此外,观察到rap在转录本中点周围和反义rap的后一半orf中的轻度富集。rap内的基序检索利用meme算法鉴定rap序列内的基序(t.l.bailey等人,nucleicacidsres.37,w202-8(2009))。利用缺省设置,在总共鉴定的15,724种rap中,有1010种鉴定出了具有长度为29bp的(can)n基序(6.4%)。绝大多数(89%)包含该基序的rap与注释的orf是反义的。另一基序发现工具homer(s.heinz等人,mol.cell.38,576-89(2010))运行时确认15,724种rap中有1909种具有基序长度为30bp的(can)n基序(12.14%)。此外,对rap进行共有的rna聚合酶中止序列分析(参见m.h.larson等人,science,344,1042-1047(2014);和i.o.vvedenskaya等人,science,344,1285-1289(2014))。在4656种(在5439种中)正义rap和8324种(在9956种中)反义rap中鉴定了g-10y-1g+1基序。为了评估是否富含该基序,进行了蒙特卡罗模拟,其中我们随机打乱检测的rap在基因组上的位置(保持rap的数目、长度和方向恒定),并计数对于各试验,g-10y-1g+1基序在该随机设定中出现的次数。对于正义和反义rap,分别进行10,000次试验,以得到期望的出现次数的分布,假定rap在基因组上随机分布。对于正义rap而言,这些分布的95%分位数是4483,以及对于反义rap而言是8532。通过将这些数值与包含所述基序的rap的实际数目进行比较,可以表明,正义抑制型rap中g-10y-1g+1基序比例过高。细菌菌株和生长条件使用两种大肠杆菌菌株:dh5α[δ(laczya-argf)u169reca1enda1hsdr17(rk-,mk+)phoasupe44λ-thi-1gyra96rela1]和bl21(de3)plyss[f-,ompt,hsdsb(rb-,mb-),dcm,gal,λ(de3),plyss,cmr]。在37℃下,使细胞在lb培养基中生长至对数期(od600=0.5-0.6)或稳定期(od600=1.6-1.8),同时通风(以200rpm摇动)。当需要时,例如为了质粒选择,向培养物中补充氨苄青霉素(100μg/ml)或卡那霉素(30μg/ml)。用0.2%的l-阿拉伯糖(sigma)诱导含有pbad报告子的细胞。用1mm的iptg诱导含有pet报告子(由噬菌体t7rna-聚合酶转录)的bl21细胞。在用双环霉素(bcm)对液体培养物进行处理的实验中,培养物首先生长至早期稳定期(od600≈0.4)。添加bcm至25μg/ml或75μg/ml的终浓度(如所指示的),并在收获之前培养20分钟。在用双环霉素对(bcm)平板进行处理的实验中,使细胞在补充有8μg/ml(允许细胞生长的低浓度)终浓度的bcm的lb琼脂平板上生长。在有应激诱导的生长实验中,在收获之前将细胞培养20分钟(如果未另外提及)。蛋白报告子分析为了监测rap-lacz融合物的表达,使大肠杆菌培养物在37℃下,于lb培养基中生长过夜,同时摇动,然后从新鲜培养基中的1∶100稀释物开始新的培养物。使培养物生长至对数期(od600=0.5-0.6)。为了测定β-半乳糖苷酶的活性,如(h.miller,experimentsinmoleculargenetics(1972);http://books.google.at/books/about/experiments_in_molecular_genetics.html?id=ptvpaaaamaaj&pgis=1)中所述一式三份进行相应的β-半乳糖苷酶分析。为了监测含有rap-gfp融合物的转化的大肠杆菌中的gfp荧光性,通过划线将细胞铺于补充有卡那霉素(30μg/ml)的lb琼脂平板中,并在37°下孵育16-20小时。用460nm的激发波长,在gfp模式下对平板进行拍摄(fusionfx7imager,peqlab,germany)。为了比较细胞密度,用510nm的激发波长,在可见光模式下对平板进行成像(fusionfx7imager,peqlab,germany)。rna分离利用热酚法进行总rna的分离。收集生长至特定od600(对数期)的细菌细胞,并将其与终止溶液(95%的乙醇,5%的苯酚)以8∶1的比例混合,随后在4℃下,以3,000×g离心5min。将获得的细菌团在液体n2中冷冻。将细菌团在添加有终浓度为0.1%的sds的裂解缓冲液(10mmtris-hcl,ph8.0,1mmedta,0.5mg/ml溶菌酶)中重悬。将获得的裂解物在64℃下孵育2min,随后添加naoac(ph5.2)至终浓度0.1m。然后添加等体积的苯酚(水饱和的,phca4.0,applichemgmbh),轻轻混合并在64℃下孵育6min,同时颠倒6-8次。之后,将样品在冰上冷却,并以16,100×g离心(4℃,10min)。将水相与等体积的苯酚/氯仿/异戊醇(25∶24∶1,phca4.0,applichemgmbh)混合,并在phaselockgelheavy管(5prime)中以16,100×g(4℃)离心5min。然后,将水相与氯仿/异戊醇(24∶1)混合,随后以16,100×g(4℃)离心5min。从水相乙醇沉淀rna(3体积乙醇,1/10体积3m乙酸钠,1/100体积0.5medta)。为了移除dna痕迹,根据制造商的方案用turbodnasei(roche)处理总rna。在琼脂凝胶上检测rna完整性。qrt-pcr为了测量转录本的水平,根据制造商的方案,利用随机寡聚物9-mer(sigma)和superscripttmii逆转录酶(lifetechnologies)将总共1-2μg不含dna的rna进行逆转录。根据靶序列,用以下所述的引物(参见表4)扩增cdna。在各情况下,如之前所述,在单色检测系统中,利用标准曲线法估计实时pcr扩增的效率(l.jolla,87-112(2004))。如制造商所建议的,利用来自medibena的eppendorfrealplex2和5xhotqpcrmixplus(无rox)进行qpcr。将gapa基因水平用于内部标准化。nothernblot分析对于northernblotting(nb),利用变性的8%聚丙烯酰胺-tbe-尿素(8m)凝胶,在1xtbe中,通过凝胶电泳分离总共10μgrna。在70℃下,于2xrna加载染料(fermentas)中变性(持续10min),随后转移至冰上之后,将rna加载至凝胶上。通过在0.5xtbe中,于12v下,进行湿的电转移印迹持续1小时而将凝胶分离的rna转移至hybondxl膜(ambion)上。通过uv(150mj/cm2)将膜交联,并根据制造商的说明书,在杂交缓冲液(ambion)中,用5’-端γ32p-标记的dna寡核苷酸探针(参见序列列表)对其进行探测。根据制造商的说明书,用t4pnk(newenglandbiolabs)进行dna标记反应。3’race为了精确测定转录本的3’端,根据制造商的说明书,利用用于ssrna的ligase1(newenglandbiolabs)将550pmol的5’-磷酸化的rna适配子(适配子序列-5’p-aauggacucguaucacacccgacaa-idt(seqidno:61))与总共6μg的rna在16℃下连接过夜。将反应物与等体积的苯酚/氯仿/异戊醇(25∶24∶1,phca4.0,applichemgmbh)混合,并在phaselockgelheavy管(5prime)中以16,100×g(4℃)离心5min。然后将水相与氯仿/异戊醇(24∶1)混合,随后以16,100×g(4℃)离心5min。根据制造商的方案,从水相中乙醇沉淀核酸(3体积乙醇,1/10体积3m乙酸钠,1/100体积0.5medta),并利用superscripttmii逆转录酶(lifetechnologies)将其进行rt,随后进行rnaseh处理(promega)。利用报告构建体上游rap的正向引物(5’-ttgggctagaattctgttgtta-3’(seqidno:62))和连接的适配子的反向引物(5’-ttgtcgggtgtgatacgagtccatt-3’(seqidno:63)),用phusion高保真dna聚合酶(neb)扩增cdna。通过凝胶电泳,在6%的paa/1xtbe的凝胶中分离并检测获得的pcr扩增文库。将获得的条带进行凝胶纯化,利用pgem-t简单载体系统(promega,根据制造商的说明书)进行ta克隆,并将其进行sanger测序。使用clustalw2以产生对齐。体外转录利用含有不同rap的报告质粒和合适的合成引物(sigmaaldrich),用phusion聚合酶(newenglandbiolabs),通过pcr合成用于体外转录实验的含有融合的强t7a1启动子(seqidno:58)的dna模板。转录反应在溶液中进行。在分析中使用野生型大肠杆菌his6rnap(evgenynudlerlab)和野生型大肠杆菌rnap全酶(affymetrix)。为了组装转录起始复合物,将2-4pmolhis6rnap与1-2pmoldna模板在20μl转录缓冲液100(10mmmgcl2,40mmtris-hcl,ph7.9,100mmnacl)(在来自affymetrix的rnap的情况下,如公司所建议的,用相同量的酶在含有20mmnacl、20mmmgcl2、14mm2-巯基乙醇和0.1mmedta的20mmtris·hclph8.0中组装复合物)中混合,并在37℃下孵育5min。然后添加高至10μm的aucrna引物(dharmacon)以及gtp(25μm)和atp(25μm),随后在37℃下孵育5分钟。接下来,添加[α-32p]-ctp(800ci/mmol,2μl,hartmannanalytic),另外持续2min。为了使rna的降解最小化,向反应中添加10u核糖核酸酶抑制剂(promega)。对于含有rho和nusg的反应,在指示的情况下,向转录复合物中添加浓度高至0.5μm的纯化的转录因子,随后在37℃下额外孵育5分钟。用添加至10-50μm终浓度的所有四种ntp进行追踪反应。为了防止再起始,在该步骤同时添加利福平(sigma)至10μm的终浓度。在指示的时间点,用含有100mmedta、8murea、0.025%的xylenthianol和0.025%的溴酚蓝的3x终止溶液使等分的追踪反应淬灭。通过6%的变性tbe-page(8m尿素)分离产物。通过下述进行rap序列在转录本内的定位:在四种不同的转录反应中,将含有rap的模板以及与四种3’dntp(3’dgtp、3’datp、3’dutp或3’dctp)中的一种以3∶1的比例混合的25μm的ntp进行转录,持续10min。报告构建体pwm3110的构建本文进行的分析使用由本发明的发明人构建的基于质粒pwm3110的报告系统。该构建体通过改造表征良好的包含gfp的质粒pwm1015获得(w.g.miller等人,appl.environ.microbiol.66,5426-36(2000),和c.h.eggers等人,mol.microbiol.43,281-95(2002),将这两者通过引用并入本文)。pwm1015包含受细菌组成型启动子(seqidno:66)控制的卡那霉素抗性基因(kanr)和编码绿色荧光蛋白(gfp)的基因。通过将gfp基因的5’utr延伸另外的108nt以引入唯一的xhoi和saci限制酶识别位点用于在5’utr内成功克隆来改造pwm1015。出于该目的,在原始pwm1015质粒的ecori位点之间克隆seqidno:64的插入物。根据制造商的方案,利用ecori(thermoscientific)消化pwm1015。根据制造商的方案,利用ecori和apoi(thermoscientific)消化合成产生的seqidno:64的双链寡核苷酸(sigmaaldrich),导致与ecori突出相容的突出,以允许构建体的合适定向。根据制造商的方案,用t4dna连接酶(newenglandbiolabs)连接消化产物。通过细菌克隆pcr和随后的sanger测序确认正确且单一的插入。给出的得到的pwm3110的序列为seqidno:65。利用唯一的xhoi和saci限制位点,将编码rna-聚合酶结合适配子的不同序列克隆进pwm3310,同上文。根据制造商的方案,用saci(位点位于各构建体5’端)和bsihkai(alw21i)(在3’端的saci相容性限制位点,其允许saci作为唯一的限制位点保留在最终的构建体内)消化合成产生的(sigmaaldrich)双链seqidno:68(包含rutrho终止插入物)、seqidno:69(包含rrnb内在终止子插入物)、seqidno:70(包含t7t内在终止子插入物)或seqidno:71(包含三种t7t-tr2-rrnb内在终止子的组合)。此后,根据制造商的方案,通过用t4dna连接酶(newenglandbiolabs)连接而将消化和纯化的构建体克隆进saci-线性化的pwm3310。通过细菌克隆pcr和随后的sanger测序确认正确且单一的插入。根据构建体包含的终止子序列将构建体分别命名为pwm3110rut、pwm3110_rrnb、pwm3110_t7t和pwm3110_三终止子。对于使用lacz作为报告基因的分析,构建pbad24的衍生物。pbad24包含细菌阿拉伯糖-诱导型启动子(seqidno:67)和氨苄青霉素抗性基因(ampr)(l.m.guzman等人177(1995),将其通过引用并入本文)。通过用nhei/ecori进行限制而将pbad24的原始核糖体结合位点从多克隆位点移除,随后进行dna聚合酶i大(klenow)片段处理和平端连接(再循环),以获得pbad13。将新的+70ntrbs(seqidno:80)克隆进pbad13的xbai/psti限制位点之间,并将lacz基因(seqidno:79)克隆进pbad13的psti/hindiii限制位点之间,以获得pbad13_lacz。将不同的rna-聚合酶结合适配子克隆进pbad13_lacz的ecori/ncoi限制位点之间,以获得pb13_rap_lacz。为了确保观察到的效果不受起始rap3’端-侧翼序列的影响,通过ncoi/xbai限制位点插入又一+99nt插入物(cobc来源的,不含rap的seqidno:80)。得到的质粒是pb13_rap_+99_lacz。为了确保观察到的效果也不受起始rap5’-侧翼序列的影响,通过包含位于rap的5’端的另外49nt(seqidno:81)和rap插入物的构建体,利用ecori/ncoi限制位点交换各rap序列,得到pb13_+49rap_+99_lacz。产生另一构建体以检测对t7启动子的表达的影响。为此,通过xba/ndei限制从pet21a(novagen)的mcs移除原始rbs,随后进行dna聚合酶i大(klenow)片段处理和平端连接(再循环)。将得到的构建体命名为pet21_minrbs。将pb13_rap_+99_lacz作为模板,并将pet21_insert_fw_nhei(seqidno:82)和pet21_insert_rv_hindiii:(seqidno:83)作为引物,通过扩增在转录起始位点包含另外5nt的全长的rap_+99_lacz,将rap克隆进pet21_minrbs。利用nhei/hindiii限制位点将扩增产物克隆进pet21_minrbs。实施例1:转录增强型rna-聚合酶结合适配子促进转录的激活的rap的鉴定为了监测鉴定的rap对转录的可能作用,利用基于质粒的gfp报告子pwm3110对它们进行检测(参见图2a,并且同上文)。将一些代表性的rap克隆进报告构建体的5’utr(距离tss下游-72nt,距离gfp的rbs上游-56nt)。在大肠杆菌gfp平板分析中对获得的克隆进行检测,以评估各种情况下合成的荧光蛋白的量。通过该方法,如表1中所列的多种rap可被鉴定为具有新的活性模式-例如rapid#5713(seqidno:2)和#14908(seqidno:4):它们显著增加产生的gfp的量(图2b)。本发明的发明人还进行了qrt-pcr,以直接测量全长gfp转录本的量,确认蛋白分析的结果:例如,rap#5713和#14908增加的转录水平分别超过2和1.5倍(图2c)。我们将增加gfp转录/表达至少20%(与不含rap的对照相比)的rap分类为激活型rap。相应的序列呈现于表1中。为了对特异性进行检测,利用噬菌体t7rna聚合酶,从噬菌体t7启动子表达同样的包含rap的报告构建体(图3a)。在这种情况下,对于蛋白(图3b)和rna(图3c)的水平这两者均未能检测到上调。因为与不含rap的对照相比,表达水平不存在差异,因此我们推论,rap的激活活性对于细菌rna聚合酶是特异的,并且对于来自噬菌体的疏远rnap不是特异的。进行对照实验以检测观察到的转录激活是否可以通过启动子样rnap至编码rap的dna序列的增强的招募来解释。为了排除它,在启动子活性分析中检测激活型rap。将rap各自克隆进报告构建体,替代组成型启动子(图4a)。通过qrt-pcr评估来自这些构建体的转录的效率。这些测量的结果(图4b)提示,激活型rap不显示启动子活性。当激活型rap#5713在非转录区,位于启动子的上游时,进一步检测其是否激活转录(图5a)。通过qrt-pcr未观察到转录水平的差异(图5b)。综合在一起,数据显示,当从上游启动子转录成rna时,本发明所述的rna-聚合酶结合适配子可以上调转录。促进转录的抗终止的rap的鉴定为了进一步表征,对激活型rap阻抑终止的能力进行研究。描述了细菌中两种类型的终止信号:不依赖因子的(内在的)终止信号和依赖因子的(依赖rho的)终止信号(santangelo和artsimovitch,2011)。首先,检测激活型rap对通读内在终止信号的效率的影响。将两种不同的异源rnap内在终止子克隆进rap信号和gfp报告子之间(图6a)。当与不含内在终止子相比时,在rap不存在的情况下,所选表征良好的内在终止子rrnb和t7t分别将gfp转录本的水平降低至18%和13%(图6b)。出人意料地,检测的激活型rap强烈增强了通读终止子。如图6c中所示,在rap#5713不存在的情况下,由于终止子(rrnb或t7t终止子)的存在,gfp的表达较低,但是rap#5713一存在于终止子发卡的上游,rna聚合酶就不再有效终止。rap#5713的反向互补序列(标记为rev#5713)对于转录无激活/抗终止作用,其用作对照序列。通过qrt-pcr进行的精确定量确认rap#5713作为抗终止子,当与不含rap的对照相比时,其增加通读终止子的效率8-14倍(图6e一6f)。重要的是,rap#5713序列不干扰终止子发卡的折叠(图6d)。阻抑依赖rho的终止的rap激活型rap在检测时作为信号能够激活通读依赖rho的终止信号。依赖rho的终止需要rho结合名为rho利用(rut)位点的特定新生rna区域。将表征良好的rut位点(krebs等人,“lewin′sgenesx”,2009)之一插入rap#5713和报告基因gfp之间(图7a)。在rap#5713不存在的情况下,报告子gfp以低水平表达。但是,rap#5713在rut位点上游的插入导致增加的gfp表达(图7b)。通过经qrt-pcr测量转录本的水平进一步确认这些数据(数据未显示)。此外,为了控制rho依赖性,使用双环霉素(bcm)-一种抑制rho的高度特异性抗生素(zwiefka等人,1993)。在bcm存在的情况下,在没有rap的情况下,gfp仍从启动子有效表达;在bcm存在的情况下,rap#5713不再激活转录,并且表达水平未改变(图7c)。这明确证实,rap#5713干扰依赖rho的终止。通过在gfp上游插入连续的3个异源内在终止子,进一步分析rap#5713(seqidno:2)的抗终止潜力(图8a;参见seqidno:45)。和在之前实验中一样(同上文),当与不含rap的对照相比时,rap#5713的存在导致gfp的高水平表达(图8b)。数条rap#5713序列的串联插入(图8c)导致抗终止活性线性增加,导致更高的gfp表达(图8d)。其利用特别适合于生物
技术领域:
的激活型/抗终止型rap。这明确显示rap的作用模式不依赖于特定的终止子。通过体外转录分析证实rap的抗终止活性为了获得对rap介导的转录抗终止的机制的初步了解,进行体外转录研究,以检测直接的rap#5713-rnap相互作用分别对于有效抗终止和转录增强是否足够。将含有内在终止子rrnb的模板用于这些研究。将rap#5713或对照rev#5713(序列,其与rap#5713反向互补)置于终止子的上游(图9a)。仅用纯化的大肠杆菌rnap进行转录,而无任何其它转录因子。当与对照构建体相比时,来自包含rap#5713的模板的单轮转录导致较少量的内在终止产物和较高水平的失控产物(图9b)。精确定量揭示,rap#5713的存在将rnap的终止活性降低超过2倍,导致全长失控产物的较高累积(图9c)。这些数据证实,rap#5713的抗终止活性被rap与rnap的直接相互作用促进。激活型rap的大规模测序为了获得对第7轮selex池中激活型rap的频率的了解,将它们克隆进图2a中显示的报告构建体中。根据总rap池的该深度筛选,表1中概括的转录增强型rap被鉴定为克隆进报告构建体时增强转录。综合在一起,现有的数据明确显示了rap的高转录增强潜力,导致高度有效地通读所有类型的细菌rnap终止信号和升高的蛋白表达。鉴定的转录增强型rap的结构和突变分析为了鉴定转录增强型rap的其它共同特征,进行序列和二级结构分析。与已知的抗终止噬菌体序列不同,本发明所述的转录增强型rna-聚合酶结合适配子(a)短的多、(b)对于根据用专业软件(如viennarna软件包,rnafold-http://rna.tbi.univie.ac.at/cgi-bin/rnafold.cgi;或mfoldhttp://mfold.rna.albany.edu/?q=mfold)预测的复杂二级结构无常见的特定要求。rapid#5713(seqidno:2)的二级结构的分析显示于图10a中。用seqidno:2至14的序列以及rapid#5713突变变体(seqidno:72-75)的序列进行序列分析,以鉴定共有基序。将所有序列与rapid#5713(seqidno:2)组合。用基于基序的序列分析工具memesuite4.10.0(t.bailey,m.bodén,f.buske,m.frith,c.charlese.grant,l.clementi,j.ren,w.li,w.noble,″memesuite:toolsformotifdiscoveryandsearching″,nucleicacidsresearch,37:w202-w208,2009)进行预测。将报告的激活型rap序列提交至使用下述参数的meme程序:“位点分布”-每条序列一个;“仅检索给定链”。分析揭示了增强型rap的共有序列seqidno:1(参见图10b,和表7)。表7显示了鉴定的不同增强型rap及其突变变体中共有序列的位置以及p值。反式rap#5713活性的缺乏为了检测命名为反式激活型rap在体内的潜在活性,设计由适合于在大肠杆菌中共转化的两种相容的质粒组成的报告系统(图21a)。第一质粒包含gfp报告子,以及位于gfp-orf上游的转录起始位点与核糖体结合位点之间的表征良好的转录终止子(内在的(rut)或依赖rho-因子的(rrnb)。第二质粒被设计用于阿拉伯糖诱导的作为稳定的srna形式的代表性实例的rap#5713的过表达。通过利用分别编码dsra、rpra及其杂交srna的rna支架的dna来构建三种不同的rap_srna(rap_srna1-rap_srna3),并用编码rap#5713的相应dna序列替代编码碱基配对区域的序列,以使整体折叠不受影响。通过对来自l-阿拉伯糖诱导的转化宿主细胞的总rna进行nothernblot分析确认稳定rap_srna的过表达和累积。使用不含srna的pbad30质粒作为对照(图21b)。有趣的是,尽管在这种情况下,rap#5713位于一些终止子的正上游,其仍然允许rnap进行一些通读(参见图21b,涂布在主带上游)。在报告子gfp上游含有内在的(图21c)和依赖rho的(图21d)终止子这两者的系统中,对反式过表达的三种rap_srna的潜在的抗终止作用进行检测。在转化的菌株之间未观察到gfp强度的差异,显示rap#5713不具有反式活性。在所有阶段,含有过表达的rap_srna的菌株的生长也未受影响-不管在平板上(图21c-d)还是在液体培养基中(数据未显示),这也支持了当反式作用时,rap#5713不影响转录这一假说。呈现的结果为激活型rap的靶向用途提供重要优势,因为尽管顺式激活期望的序列的表达,但是它们未反式影响其它宿主基因的表达。来源于真核生物的具有转录增强特性的rap依据定义,rap是以高亲和力结合rnap的天然rna适配子。以上rap来源于细菌(大肠杆菌)基因组。利用基因组selex,用酵母和智人(homosapiens)的rnapii进行进一步的研究。对真核生物的rnap具有高亲和力的这些酵母/人rap序列已被命名为yh1至yh45(seqidno:93至137)。考虑所有细胞有机体之间rnap机构的保守性,由此推断获得的酵母/人rap能够顺式激活并抗终止原核生物rnap的转录,具有如之前以上细菌来源的rap的相应活性。为了证明这一点,对多种真核生物的rap对细菌中转录激活的影响进行检测。将含有gfp报告子的pwm3110_rrnb构建体(在图6a中示出)用于快速且有效地检测人/酵母rap对细菌转录的活性。结果,已经显示非细菌序列(非细菌rap)增加大肠杆菌中的转录输出,推测通过raprna-细菌rnap相互作用(类似细菌rap利用的机制)。可用基序的正规表达方式来描述呈现的序列:[ac][ac][ag]can[ac][at][ctg]a[ct][at]ccna[ac]n[at]c[ac](seqidno:138;用glam2预测,参见图3)。此外,利用glam2预测,已经鉴定出原核生物和真核生物的所有增强型适配子的共有基序,其反映在seqdino:139中。技术人员将会认识到,该基序也非常良好地反映了所鉴定的由seqidno:2编码的rap的核心基序的必要核苷酸。实施例2:转录抑制型rna-聚合酶结合适配子抑制转录的rap的鉴定将在最严格的选择条件下(7个循环的selex)获得的富集序列进行深度测序,并将~1.0百万个读取定位至大肠杆菌k12mg1655基因组,随后利用自定义算法寻峰。整体而言,在大肠杆菌基因组中,我们鉴定了超过15,000种对rnap具有高亲和力的rap-rna适配子(表s1)。总选择池的kd显示低于10nm(参见n.windbichler,f.vonpelchrzim,o.mayer,e.csaszar,r.schroeder,rnabiol.5,30-40)。大部分rap(64.3%)定位至反义基因,并且它们中大约1/3(31.5%)是基因内的(图1,a-b)。在鉴定的rap中检测到了阳性对照6srna(rap#10012,表s1)(参见k.m.wassarman,g.storz,cell.101,613-23(2000);和a.t.cavanagh,k.m.wassarman,annu.rev.microbiol.(2014),doi:10.1146/annurev-micro-092611-150135),验证了全基因组检索rnap结合rna的策略。有趣的是,rap在翻译起始位点附近出现过多,且在基因间区域出现不足。观察到与orf的3’-近端部分相反的反义rap富集(图1,c-d)。使用不同的工具(meme和homer)检索rap内的共有序列基序,并且仅能在12%的峰中鉴定出富含ca的基序(图14a)。根据这些结果,我们推断rnap可以结合大部分rna分子。为了阐明rap对转录的可能影响,利用基于质粒的lacz报告子检测代表性的正义和反义rap的活性(图11a)。通过经定量rt-pcr(qrt-pcr)监测lacz活性和rna水平的变化来评估rap对基因表达的影响。一些rap可被鉴定为强烈减少转录输出;例如,反义rap#1086和基因内的rap#15引起转录本水平的大量减少(图11b)。为了确保观察到的抑制作用不是启动子或序列环境依赖性的,在来源于不同质粒的另一gfp报告系统中对这些rap进行检测(图15,a-i)。为了估计具有转录抑制特性的rap的总分数,我们检测了76种rap,并发现20种(~26%)显示出该活性。表1的seqidno:25至41;见下文;给出了这些抑制型rap的概述,其表明它们来自深度测序的基因座位、分类、序列和定位的碱基数目。这些抑制型rap中超过一半是基因内的,表示编码蛋白的基因内的rna结构域。通过外推,获得的数目提示,所有鉴定的rap中的1/4可能具有转录阻抑活性。为了检测观察到的rap对细菌rnap的作用的特异性,将“抑制型”rap克隆进含有噬菌体t7启动子的类似报告系统中。使用iptg-诱导型大肠杆菌bl21菌株来确保噬菌体t7rnap的转录。在这种情况下,在针对rap的应答中,我们未观察到转录水平的任何显著减少(图2c)。因此,rap对基因表达的抑制作用是细菌rnap特异的,并且不是由于降低的rna稳定性。为了获得对由rap导致的转录抑制的机制的进一步了解,对包含rap的转录本进行northernblot分析。用在rap之前和之后退火的寡核苷酸对来自对数生长细胞的总rna进行探针检测(探针位置在图11a中指出)。与下游探针p2的杂交(图2d)确认了我们的rt-qpcr数据,即在抑制型rap(#15和#1086)的情况下,几乎没有检测到rna。但是,与上游探针p1的杂交揭示了稳定的截短rna产物的累积(图11d)。根据尺寸判断,这些转录本在插入的rap下游大约30nt处终止。相应条带的模糊形状也提示不存在精确的终止点。用定位准确终止位点的3’race实验补充这些数据(图16,a-b):所获得的主要转录本包含完整的rap序列,并且含有定位至rap下游27至38个核苷酸的3’端。为了确认抑制作用是由于rap序列,将一些点突变引入rap#15中(图15,d-e),这消除了其对转录的抑制作用(图15,f)。为了阐明rap引发的转录终止的机制,检索报告构建体中在rap与下游序列之间形成的可能的终止子发卡。未能鉴定出潜在的内在终止子。因此,rap介导的终止可能是依赖rho的。为了对此进行检测,使用双环霉素(bcm)-一种抑制rho(14)的高度特异性抗生素。通过将bcm(25μg/ml)添加至转化有以上所述的rap构建体的细胞,通过rap#1086和#15的转录抑制被消除(图12a)。通过无抑制作用的rap#2667和#7768的转录受bcm的影响少得多。这指示,rap介导的转录的早期终止是依赖rho。也通过在bcm存在的情况下的3’race实验补充这些数据,其显示包含全长rap的转录本的累积(图16,c)。为了直接确认rap作用的rho依赖性,利用合成的含有所选rap和强t7a1启动子的dna模板进行单轮体外转录分析。在无rho的情况下,用大肠杆菌rnap进行的体外转录收获了全长失控转录本(图12b,泳道1、4、7)。在抑制型rap的情况下,rho的添加导致包含较短rap的转录本的形成(例如,#15和#2136-图12b,泳道2、8vs.泳道5)。在nusg存在的情况下,终止产物增加,nusg是已知增加依赖rho的终止的效率的辅因子(图12b,泳道3、9)。体外转录实验显示,向含有突变的rap#15(15mut)模板的反应物中添加rho因子未导致依赖rho的终止(图12c)。这些数据证实,rap#15的抑制作用是由于依赖rho的终止。为了研究rap是否影响大肠杆菌rnap的延伸,利用含有rap#15的dna模板以及在同一位点含有其反向互补序列的dna模板作为对照,进行单轮时间进程转录分析。精确定位rap的位置(图17b)。在rap#15序列及下游数个核苷酸内,我们检测到了强的rnap中止(图17a)。我们将观察到的作用量化为含有全长rap的转录本的量与在各时间点未并入rap序列的转录本的比例。与对照序列相比,在rap#15的情况下,含有整个rap序列的转录本的累积的效率至少低两倍(图17c)。该实验显示,rap#15诱导转录中止。有趣的是,最近用net-seq方法鉴定的并且被报道为用于中止的共有序列的g-10y-1g+1基序(m.h.larson等人,science.344,1042-7(2014);和i.o.vvedenskaya等人,science.344,1285-9(2014))在正义rap的亚组中过度存在(图18,a-b)。为了了解该现象的生理作用,对rap#15在其天然基因组环境中的活性进行研究。在大肠杆菌中,rap#15在烟酰胺-单核苷酸腺苷转移酶(nadd)基因的orf内编码。nadd是从头生物合成和氧化还原辅因子nad+和nadp+的补救途径所需的重要酶(r.a.mehl,c.kinsland,t.p.begley,j.bacteriol.182,4372-4(2000);和h.zhangetal.,structure.10,69-79(2002))。这导致rap#15将引发其nadd基因内的转录终止这一假说。在这种情况下,rap#15序列上游naddmrna的稳态水平应当高于紧邻rap#15的下游。我们设计了rap侧翼引物,以扩增naddmrna的各区域,并将rap#15上游和下游mrna的量进行比较(图13a)。从在不同条件下生长的大肠杆菌中分离总rna,并将其进行qrt-pcr。如图13b所示,在对数期,与上游的量相比,临近rap#15下游的rna的量减少至60%。当细胞到达稳定期时,下游rna水平进一步降低(34%vs100%)。用4mmh2o2激发细胞20’也导致下游rna的大量减少(减少至21%)。显著的是,在将对数生长的细胞短暂暴露于bcm(75μg/ml)之后,早期终止消除,导致rap#15上游和下游几乎相同的mrna水平。这些实验可以提示,在其天然基因组环境中,在针对应激的应答中,rap#15经依赖rho的转录终止,抑制其宿主nadd基因的表达。引人注意的是,rap15介导的rho终止发生在nadd的编码区内。因为在细菌中转录和翻译直接偶联(s.proshkin,a.r.rahmouni,a.mironov,e.nudler,science.328,504-8(2010)),引导核糖体通常紧跟rnap之后,以防止依赖rho的终止。为了证实在rap15介导的终止期间,确实发生有效翻译,构建了构建的nad(rap15)-gfp翻译融合物,将rap15置于其天然基因组环境中与报告基因同框(图23a)。使用含有rap15的反向互补序列的类似构建体nad(rev15)-gfp作为对照。gfp平板分析的结果确认,不管是否伴随翻译,rap15均促进转录终止:与对照相比,rap15构建体的荧光强度显著减少(图23b)。bcm恢复了gfp信号,消除了两种构建体之间的差异(图23c)。在液体培养物中不同生长阶段期间,将两种构建体的荧光强度进行比较。尽管未观察到生长速率的差异(图23d,上方的图),但是在携带rap15构建体的细胞中检测到gfp强度大幅降低,从早期指数期开始,并且在过渡到稳定期时逐渐变得更加明显(图23d,下方的图)。因此,rap15使得rho能够在编码区内发挥作用,不管是否有活性翻译。rap15能够在编码区内进行rho介导的终止的可能机制是核糖体的终止,从而使转录与翻译暂时解偶联。确实,在结合rnap的表面时,rap15可以产生核糖体前进的物理屏障(图23e)。从该数据可以推断,天然的rna聚合酶适配子是以可控的方式影响转录的特异性信号。对鉴定的抑制型rap的亚组中共有序列的存在进行分析。利用核酸序列的clustalw2的缺省参数,可以鉴定出相关序列的集群以及seqidno:84([a/t][t/c][g/t/a]a[a/c][g[a/c/t][a/c][g/c][a/c/t][g/t][g/a][a/c][a/t][g/c][g/t/a][a/t][a/c])、seqidno:85(g[a/c][g/t/a/c][g/t]at[t/c][g/c/a][g/c][g/t/a/c]t[g/t]、seqidno:86(gcca[g/t]ga[g/t]cg)和seqidno:87([g/t/c][a/c/t][a/c][g/c/a][g/t/a][g/c][g/c/a][g/a][g/c][g/a][a/t]的共有序列。seqidno:84的共有序列至少存在于rapidno:5039、9533、10822、10070和1510中;seqidno:85的共有序列至少存在于rapidno:1800、1760、4599、3930、683、803和4599中;seqidno:86的共有序列至少存在于rapidno:1436和15003中;以及seqidno:87的共有序列存在于rapidno:9505、10243、11599、15、1086、2136、6819和9559中。结果也显示于图20中(a:seqidno:84;b:seqidno:85;cseqidno:86;d:seqidno:87)。提供的体外和体内研究显示了rho在rap介导的转录抑制中的作用。rho是环状六聚rna解旋酶,其作用于延伸复合物以促进转录终止(e.nudler,m.e.gottesman,genestocells.7,755-768(2002);和j.w.roberts,nature.224,1168-74(1969))。在抑制型rap中,c含量中值是33.67%,而g含量中值是15.69%(图19)。但是,检测的rap序列的长度不超过45个核苷酸(例如,rap#15仅39nt),这几乎比rut所需的长度(至少70-80个核苷酸)短两倍(j.p.richardson,cell.114,157-9(2003);和a.q.zhu,p.h.vonhippel,biochemistry.37,11202-14(1998))。最近,应用瓦片阵列(tilingmicroarray)和ngs获得大肠杆菌中依赖rho的终止的高分辨率图谱(j.m.peters等人,genesdev.26,2621-33(2012))。20种包含抑制型rap的基因中仅一种基因在报道的通过bcm抑制rho时,上调的1264个“重要转录本”的列表中。因此,可以推断,rap不是真正的rut位点,但很可能通过直接调节rnap针对rho的应答来发挥作用。rap对转录中止的刺激作用与该假说一致,并且提示,rap至少部分通过促进rho与rnap之间的动力学偶联来促进rho终止(d.j.jin,r.r.burgess,j.p.richardson,c.a.gross,proc.natl.acad.sci.u.s.a.89,1453-7(1992))。综合在一起,对广泛分布的rap作为一类新的转录调节性rna信号的鉴定揭示,新生rna与rnap的直接相互作用广泛影响大肠杆菌转录组的组成。rap实现了rna作为自我调节系统的可能性。表1:编码本发明所述的优选rna-聚合酶相互作用适配子的dna序列在此,使用扩充的字母代码显示核苷酸序列。当限定序列时,除常规gatc符号之外,使用扩充的字母代码,以指示序列内可以变通的位置。下表概述了使用的字母,并说明了在序列的各个位置可以包含哪些核苷酸;例如,如果在位置1使用字母h,则这指示序列的位置1可以是a、c或t。表2:扩充的字母代码字母包含的核苷酸aattggccrg或ayt或cma或ckg或tsg或cwa或tha或c或tbg或t或cvg或c或adg或t或ang或t或a或c表3:优选的终止子序列:表4:使用的寡核苷酸引物、适配子和质粒:表5:seqidno:2的活性变体相对于seqidno:2的突变加下划线。在seqidno:1和2中,seqidno:1的共有序列中不存在替代选择的核苷酸为斜体。与seqidno:2相比,seqidno:75在3’端短了6nt。因此,其仅包含与seqidno:1的共有序列相对应的序列。表6:seqidno:2的失活变体:表7:但是本发明不限于以上,尤其涉及下述项目:项目1:包含rna-聚合酶结合适配子的rna分子,其中所述rna-聚合酶结合适配子的长度为15至60nt,优选20至50nt,更优选23至50nt,并且其中所述rna-聚合酶结合适配子以50nm或更低的kd,优选以10nm或更低的kd结合rna-聚合酶。项目2:如项目1所述的rna-分子,其中所述rna-聚合酶是原核生物的rna-聚合酶,优选细菌rna-聚合酶,更优选来源于革兰氏阴性细菌的细菌rna-聚合酶,甚至更优选大肠杆菌的rna-聚合酶。项目3:如项目1或项目2所述的rna-分子,其中所述rna-聚合酶结合适配子与所述rna-聚合酶的全酶,优选rna-聚合酶核心和σ70相互作用。项目4:如项目1至3中任一项所述的rna-分子,其中所述适配子包含seqidno:1所述的序列。项目5:如项目4所述的rna-分子,其中所述rna-聚合酶结合适配子是转录增强型rna-聚合酶结合适配子。项目6:如项目5所述的rna-分子,其中所述转录增强型rna-聚合酶结合适配子增加待表达的序列的表达,其中与不包含所述rna-聚合酶结合适配子时所述待表达的序列的表达相比,表达增加至少10%,优选增加至少20%,更优选增加至少100%。项目7:如项目3至6中任一项所述的rna-分子,其中所述转录增强型rna-聚合酶结合适配子由seqidno:1的序列编码;优选由与选自下述的序列具有至少80%的同一性的序列编码:seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、seqidno:16、seqidno:17、seqidno:18、seqidno:19、seqidno:20、seqidno:21、seqidno:22、seqidno:23、seqidno:24、seqidno:72、seqidno:73、seqidno:74以及seqidno:75。项目8:如项目1至3中任一项所述的rna-分子,其中所述rna-聚合酶结合适配子是抑制型rna-聚合酶结合适配子。项目9:如项目8所述的rna-分子,其中所述抑制型rna-聚合酶结合适配子降低待表达的序列的表达,其中与不包含所述rna-聚合酶结合适配子时所述待表达的序列的表达相比,表达降低至少30%,优选降低至少20%,甚至更优选降低至少50%。项目10:如项目8或项目9所述的rna-分子,其中所述抑制型rna-聚合酶结合适配子具有高于27%,优选高于30%,更优选高于31%的c含量,并且其中所述rna-聚合酶结合适配子具有低于23%,优选低于20%,更优选低于17%的g含量。项目11:如项目8至10中任一项所述的rna-分子,其中所述抑制型rna-聚合酶结合适配子由选自seqidno:84、seqidno:85、seqidno:86和seqidno:87的序列编码,优选地,所述抑制型rna-聚合酶结合适配子由与选自下述的序列具有至少80%的同一性的序列编码:seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:30、seqidno:31、seqidno:32、seqidno:33、seqidno:34、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:88、seqidno:89、seqidno:90、seqidno:91以及seqidno:92。项目12:dna-分子,其包含编码项目1至11中任一项所限定的rna-聚合酶结合适配子的序列。项目13:如项目12所述的dna-分子,其中所述dna-分子包含表达盒、所述编码rna-聚合酶结合适配子的序列以及待表达的序列或者用于引入所述待表达的序列的多克隆位点,所述表达盒包含启动子,其中所述启动子、编码所述rna-聚合酶结合适配子的序列和所述待表达的序列可操作地连接,优选地,编码所述rna-聚合酶结合适配子的序列和所述待表达的序列或所述多克隆位点位于所述启动子的下游。项目14:如项目13所述的dna-分子,其中所述待表达的序列编码蛋白,并且所述rna-聚合酶结合适配子位于开放阅读框的上游。项目15:如项目14所述的dna-分子,其中所述表达盒包含编码一种或多种待表达的蛋白的两个或更多个开放阅读框,其中所述表达盒对于各开放阅读框包含可操作地连接至所述开放阅读框的编码项目1至11中任一项所限定的rna-聚合酶结合适配子的序列,优选地,所述两个或更多个开放阅读框由均可操作地连接至所述开放阅读框的编码所述一种或多种rna-聚合酶结合适配子的序列和翻译起始位点分隔。项目16:如项目12至15中任一项所述的dna-分子,其中所述rna-聚合酶结合适配子是项目5至7中任一项所述的转录增强型rna-聚合酶结合适配子。项目17:如项目12至15中任一项所述的dna-分子,其中所述rna-聚合酶结合适配子是项目8至12中任一项所述的抑制型rna-聚合酶结合适配子。项目18:表达载体,其包含项目12至17中任一项所述的dna-分子。项目19:宿主细胞,其包含项目1至11中任一项所述的rna-分子、或项目12至17中任一项所述的dna-分子或项目18所述的载体。项目20:项目1至11中任一项所述的rna-分子或项目12至17中任一项所述dna-分子或项目18所述的载体或项目20所述的宿主细胞用于调节待表达的序列的表达的用途。项目21:产生目标蛋白或rna的方法,其包括:提供项目12至17中任一项所述的dna-分子或项目18所述的载体,所述载体包含项目13至17中任一项所限定的表达盒,将所述载体引入宿主细胞,和在诱导来自所述表达盒的启动子的转录的条件下,于培养基中培养所述宿主细胞,以及任选地,从所述宿主细胞或培养物中回收所述目标蛋白或rna。项目22:如项目21所示的方法,其中提供载体的步骤包括将编码所述目标蛋白或rna的序列插入所述载体中包含的表达盒的多克隆位点的步骤。项目23:如项目21或项目22所述的方法,其中培养所述宿主细胞的步骤包括与rho转录抑制剂的抑制剂,优选双环霉素孵育。项目24:体外转录目标rna的方法,其包括下述步骤:提供项目12至17中任一项所述的dna-分子或项目18所述的载体,所述dna-分子包含可操作地连接至启动子和编码本发明所述的rna-聚合酶结合适配子的序列的编码所述目标rna的序列,在允许所述启动子转录的条件下,将所述dna-分子与本发明所述的rna-聚合酶孵育,以及任选地,回收所述目标rna。项目25:体外表达目标蛋白的方法,其包括下述步骤:提供项目12至17中任一项所述的dna-分子或项目18所述的载体,所述dna-分子包含可操作地连接至启动子和编码所述rna-聚合酶结合适配子的序列的编码所述目标蛋白的序列,在允许所述启动子转录和转录本翻译的条件下,将所述dna-分子与组分孵育,以及任选地,回收所述目标蛋白。项目26:如项目25所述的方法,其中所述组分包括来自大肠杆菌的细胞提取物,以及任选地能源、一定量的氨基酸、所述细胞提取物的转录和/或翻译机构的辅因子。项目27:如项目24至26中任一项所述的方法,其中所述rna-聚合酶结合适配子是转录增强型rna-聚合酶结合适配子,优选如项目4至7中任一项所限定的转录增强型rna-聚合酶结合适配子。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1