治疗HIV的工具的制作方法
本发明涉及在治疗疾病如病毒感染中的联合及其用途。
相关技术简述
术语“免疫疗法”定义了通过刺激、诱导、增强或抑制免疫应答来治疗疾病。免疫疗法的策略是通过活化免疫系统来对抗疾病,如癌症、传染病、过敏和哮喘。
病毒感染可导致称为病毒潜伏期的状态,其特征在于个体细胞可逆的非增殖性感染状态。病毒潜伏期为病毒持续性和逃避免疫识别提供了重要机制(Pemg and Jones,Interdiscip Perspect Infect Dis,2010,p 262415)。
已知例如疱疹病毒利用遗传程序,允许其病毒基因组以最小的病毒基因表达持续。对于逆转录病毒,逆转录病毒cDNA稳定整合到宿主细胞基因组中是病毒基因组在感染细胞寿命期间持续的重要步骤。有逆转录病毒建立潜伏感染状态。术语潜伏期最初用于临床意义上的HIV-1,来描述初始感染与发展成艾滋病之间的长期无症状期。然而,清楚的是,即使在无症状期间,HIV-1在整个感染过程中都会积极复制。HIV-1逃避免疫应答的主要机制之一是通过逃逸突变的快速进化以通过中和抗体和溶细胞性T淋巴细胞消除识别(Bailey et al.,Curr Opin Immunol 16,p.470-476,2004)。然而,已经清楚的是,HIV-1可以在单个T细胞水平上建立潜伏感染状态。因此,去除潜伏储存库可能是改善HIV治疗的主要因素。
抗逆转录病毒疗法(ART)是指用于治疗逆转录病毒感染(如HIV感染)的药疗法。药物不会消除病毒,因此治疗后患者将无病毒。但是,当这些药物-或它们的选择联合给予时,它们可阻止病毒的生长。当病毒减慢时,艾滋病病毒也会减慢。抗逆转录病毒药物被称为ARV。联合的ARV疗法(cART)被称为高效ART(HAART)。
ARV药物以不同方式攻击HIV,且它们被分成所谓的类别。开发的第一类抗HIV药物是“核苷逆转录酶抑制剂”(也称为NRTI或“nukes”)。这些药物阻断利用HIV的遗传物质从RNA中创建DNA。AZT是这类最突出的成员。
另一类是“非核苷逆转录酶抑制剂”,也称为非-nukes或NNRTI,其也阻断RNA转录成DNA。
属于“蛋白酶抑制剂”类的成员阻断了将新HIV病毒的原料切割成特异性片段的步骤。最后,有阻止HIV进入细胞的“进入抑制剂”类和阻止HIV遗传物质整合到宿主基因组中的“HIV整合抑制剂”类。在本公开的含义内,cART指联合使用这些ARV类别的至少两个成员。
最近显示,通过潜伏期逆转剂(LRA),特别是组蛋白去乙酰化酶抑制剂(HDACi)联合抗逆转录病毒疗法(cART),可以安全地破坏患者中HIV-1潜伏状态((Archin et al.,2012,Nature 487(7408):482-485;Rasmussen et al.,2013,Hum Vaccin Immunother 9(5))。然而,在大多数患者中明显的是,单独的潜伏感染细胞的再活化并不能减少HIV-1储存库。这似乎与免疫介导的杀伤再活化的细胞不足有关。然而,先天性和适应性免疫的活化具有活化HIV感染细胞的风险,从而使疾病进展。因此,免疫系统的活化是否会帮助HIV患者是有问题的。
最近的体外研究支持免疫疗法支持的HIV治疗的概念,该研究显示来自cART治疗的病毒血症(aviremic)HIV患者的CD8+ T细胞能够杀伤再活化的感染自体CD4+ T细胞,但只有当CD8+ T细胞已经在共培养之前被抗原刺激(Shan et al.,2012,Immunity 36(3):491-501)。
因此,需要这样的化合物,其将通过它们的活化和靶向再活化的细胞而暴露HIV感染细胞的潜伏储存库,用于通过药理学干预进行免疫介导杀伤。
基于这种技术的状态,本公开目的是提供免疫刺激化合物用于再活化潜伏HIV感染细胞及其被免疫系统识别和破坏,以及它们作为药物的用途。
发明概述
关于现有技术,本公开的目的是提供包含至少一个序列基序N1N2CGN3N4的脱氧核糖核酸的非编码序列,其中N是包含A、C、T或G的核苷酸,C是脱氧胞苷、G是脱氧鸟苷、A是脱氧腺苷、T是脱氧胸苷,其用于治疗病毒感染。
旨在将本发明的脱氧核糖核酸的非编码序列与联合的抗逆转录病毒疗法和/或组蛋白去乙酰化酶抑制剂联合用于病毒感染,其中病毒感染可能是潜伏的。
本公开的脱氧核糖核酸的非编码序列旨在提供用于治疗HIV-1,特别是用于治疗潜伏的HIV-1感染。
对于本公开的脱氧核糖核酸的非编码序列,N1N2可以是取自GT、GG、GA、AT和AA的元素,N3N4可以是取自CT、TG和TT的元素。
脱氧核糖核酸的非编码序列可以是在两边的线性开链,在双链部分的一边上的线性开链且在双链的各一边上具有单链发夹,或者脱氧核糖核酸的哑铃形部分单链共价封闭链。
脱氧核糖核酸的非编码序列可以包含至少三个所述序列基序N1N2CGN3N4。
脱氧核糖核酸的非编码序列还可以是包含至少一个L-构型的核苷酸的脱氧核糖核酸的线性开链非编码序列。
位于脱氧核糖核酸的线性开链非编码序列的DNA单链的5'和/或3'端的5个末端核苷酸中的至少一个是L-构型。本领域普通技术人员清楚,此对末端的限制指包含仅L-构型的5'-和/或3'-端核苷酸上的末端5个核苷酸内。
指定脱氧核糖核酸的非编码序列可包含以下序列中的至少一个:
a.GTTCCTGGAG ACGTTCTTAG GAACGTTCTC CTTGACGTTG GAGAGAAC(SEQ ID NO:1)或
b.ACCTTCCTTG TACTAACGTT GCCTCAAGGA AGGTTGATCT TCATAACGTT GCCTAGATCA(SEQ ID NO:2),或
c.AACGTTCTTCGGGG CGTT(SEQ ID NO:3),或
d.AGGTGGTAAC CCCTAGGGGT TACCACCTTC ATCGTCGTTT TGTCGTTTTG TCGTTCTT(SEQ ID NO:4)。
本公开的脱氧核糖核酸的非编码序列可具有40至200个核苷酸或更具体地48至116个核苷酸的长度。
以上显示的AACGTTCTTCGGGG CGTT序列可是序列CCTAGGGGTT ACCACCTTCA TTGGAAAACG TTCTTCGGGG CGTTCTTAGG TGGTAACC CCTAGGGGTT ACCACCTTCA TTGGAAAACG TTCTTCGGGG CGTTCTTAGG TGGTAACC(SEQ ID NO:5)的一部分。
旨在序列基序N1N2CGN3N4可是脱氧核糖核酸的非编码序列的单链区域的一部分。
本公开的另一目的是一种方法,其包括提供本公开的脱氧核糖核酸的非编码序列,同时、交替或依次提供联合的抗逆转录病毒疗法和/或组蛋白去乙酰化酶抑制剂的步骤。
脱氧核糖核酸的非编码序列可在联合的抗逆转录病毒治疗和/或组蛋白去乙酰化酶抑制剂之前提供。或者,旨在可交替提供脱氧核糖核酸的非编码序列联合抗逆转录病毒治疗和/或组蛋白去乙酰化酶抑制剂。
本公开的另一目的是具有上述公开特征的脱氧核糖核酸的非编码序列,其用作药物。
本公开的另一目的本公开的脱氧核糖核酸的非编码序列在制备包含脱氧核糖核酸的非编码序列,以及可能的额外ARV和/或组蛋白去乙酰化酶抑制剂的药物组合物中的用途。
所述药物组合物可是疫苗,并且旨在使用具有如上所公开的特征的脱氧核糖核酸的非编码序列作为用于治疗HIV-1的治疗性或预防性疫苗接种的佐剂。
附图说明
本公开将通过实施例和附图进一步说明,而不限于所公开的实施方案。本发明的脱氧核糖核酸的非编码序列在图1-3中标记为“MGN1703”,在图4中标记为“dSLIM”。其显示:
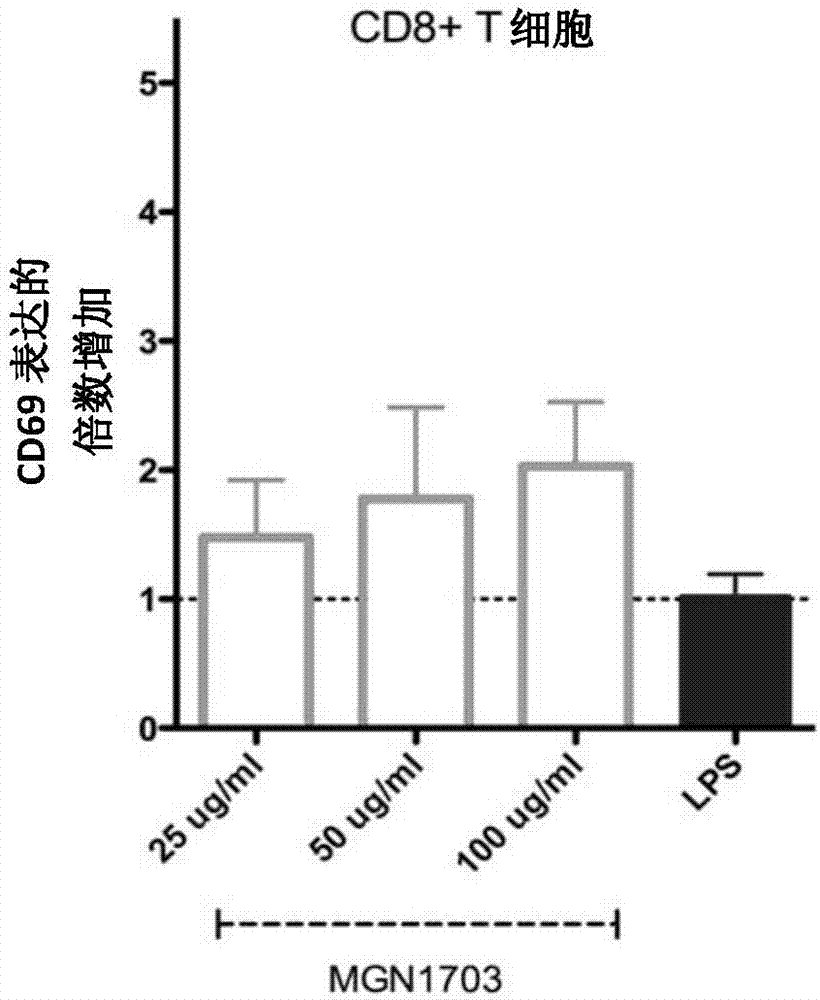
图1A/B MGN1703上调外周血免疫效应细胞(天然杀伤细胞和CD8 T细胞)中CD69的表达,其为细胞活化的标记
图2 MGN1703刺激NK细胞抑制HIV的传播
图3本发明的非编码DNA构建体引起促炎细胞因子IL-6和TNFα的微小变化
图4A/B用DNA的非编码免疫刺激序列刺激NK细胞的活化作用
图5A/B/C用非编码DNA构建体处理NK细胞。非编码DNA构建体增强NK细胞介导的HIV-1杀伤,产生自体CD4+ T细胞
发明详述
本发明提供了用于治疗病毒感染的化合物和方法。具体而言,本发明涉及逆转录病毒感染和病毒潜伏期的治疗。提供的脱氧核糖核苷酸的非编码序列应大幅增加NK细胞活性和HIV特异性CD8+细胞毒性活性,导致增强的对HIV表达细胞的杀伤。
在本公开的含义内,线性开链DNA序列被称为寡核苷酸,缩写为ODN。所述DNA序列可以是单链的或部分或完全双链的。术语寡(oligo)、寡核苷酸和寡脱氧核苷酸是同义使用的,并不表示限制相应DNA序列的长度。寡核苷酸的单个组成是核苷酸。
寡核苷酸可以合成制备或部分或完全由生物来源制备,其中生物来源包括基于遗传学的DNA序列制备方法。
L-DNA或L-构型的核苷酸是指核苷酸,其包含L-脱氧核糖作为糖残基而不是天然存在的D-脱氧核糖。L-脱氧核糖是D-脱氧核糖的对映体(镜像)。部分或完全由L-构型的核苷酸组成的寡核苷酸可以是部分或完全单链或双链的;然而,L-构型的核苷酸不能与D-构型中的核苷酸杂交(Hauser et al.,Nucleic Acid Res.2006 34:5101-11)。L-DNA的可溶性和选择性与D-DNA等同。然而,L-DNA对天然存在的酶特别是核酸外切酶的酶外切活性(enzymatic exoactivity)具有抗性,所以L-DNA被保护免于细胞内降解((Urata et al.,Nucleic Acids Res.199220:3325-32)。因此,L-DNA的应用非常广泛。
根据本公开的“茎”应理解为通过在相同的寡核苷酸内(其然后部分自我互补)或在不同的寡核苷酸内(其部分或完全互补)碱基配对形成的DNA双链。分子内碱基配对指在相同寡核苷酸内的碱基配对,并且不同寡核苷酸之间的碱基配对被称为分子间碱基配对。
本公开含义内的“环”应理解为茎结构内或端处的不配对的单链区。“发夹”是茎和环的独特结合,当相同寡核苷酸的两个自我互补区域杂交以形成在一端具有不配对环的茎时发生。
核苷酸共价或非共价附着的“固相”是指但不限于柱、基质、珠、包括改性或官能化玻璃的玻璃、包括硅和改性硅的二氧化硅或二氧化硅基材料、塑料(包括聚丙烯、聚乙烯、聚苯乙烯以及苯乙烯和其它材料的共聚物、丙烯酸树脂、聚丁烯、聚氨酯等)、尼龙或硝化纤维素、树脂、多糖、碳以及无机玻璃和塑料。因此,根据本公开,微量滴定板也在固相的范围内。
根据本公开的免疫调节是指免疫刺激和免疫抑制。免疫刺激优选指刺激免疫系统的效应细胞以增殖、迁移、分化或变成以任何其他形式活化。例如B细胞增殖可以通过免疫刺激性寡核苷酸诱导而没有共刺激信号,免疫刺激性寡核苷酸通常需要来自辅助胸腺细胞的共刺激信号。
另一方面,免疫抑制应理解为降低免疫系统的活化或效力。一般有意诱导免疫抑制以预防例如移植器官的排斥、在骨髓移植后治疗移植物抗宿主疾病、或用于治疗自身免疫性疾病(例如类风湿性关节炎或克罗恩氏病)。
本公开含义内且根据其通用定义的激动剂代表结合另一分子如受体或配体并因此活化分子的化学品或分子。与活化的激动剂相反,拮抗剂应理解为阻断拮抗剂结合的分子与各自的激动剂相互作用的化学品或分子。取决于上下文,理解本发明的拮抗剂也可导致过程的活化,因为例如拮抗剂阻断另一拮抗剂与受体的相互作用。
如本文所用的术语“药学上可适用的或可接受的盐”包括联合中的化合物的盐,其用相对无毒的(即药学上可接受的)酸或碱制备,其取决于在本发明化合物上发现的特定取代基。例如,如果本发明化合物含有酸性官能团,则碱性加成盐可通过将这种化合物的中性形式与足够量的所需碱在净或在合适的惰性溶剂中接触而获得。药学上可接受的碱加成盐的非限制性实例包括钠盐、钾盐、钙盐、铵盐、有机氨基盐或镁盐或类似的盐。如果本发明的化合物含有碱性官能团,则可以通过将这种化合物的中性形式与足够量的所需酸在净或在合适的惰性溶剂中接触而获得。药学上可接受的酸加成盐的非限制性实例包括衍生自无机酸如盐酸、氢溴酸、硝酸、碳酸、磷酸、部分中和的磷酸、硫酸、部分中和的硫酸、氢碘酸或亚磷酸等,以及衍生自相对无毒的有机酸如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯基磺酸、柠檬酸、酒石酸、甲磺酸等。还包括氨基酸如精氨酸等的盐,以及有机酸如葡糖醛酸或半乳糖醛酸等的盐。本发明的某些具体化合物可含有碱性和酸性官能团,使得化合物转化为碱或酸加成盐。将盐与碱接触可再生本发明化合物或酸的中性形式并以常规方式分离母体化合物。化合物的母体形式在某些物理性质上(例如在极性溶剂中的溶解性)不同于各种盐形式,但是在其他方面盐等同于本发明目的的化合物的母体形式。本发明的化合物可具有手性或不对称碳原子(光学中心)和/或双键。本发明包括外消旋物、非对映异构体、几何异构体和单独的光学异构体。本发明的化合物可以非溶剂化形式以及溶剂化形式(包括水合形式)存在。通常,溶剂化形式等同于非溶剂化形式,并且也包含在本发明中。本发明的化合物还可以多晶或无定形形式存在。
由脱氧核糖核苷残基的部分单链哑铃形共价闭合链组成的脱氧核糖核酸分子应与抗逆转录病毒药物和/或组蛋白去乙酰化酶抑制剂联合使用,所述脱氧核糖核酸分子含有碱基序列N1N2CGN3N4的一个或多个序列,其中N1N2是取自GT、GG、GA、AT或AA组的元素,N3N4是取自CT或TT组的元素,以及C脱氧胞嘧啶、G脱氧鸟苷、A脱氧腺苷和T脱氧胸苷。
与本公开有关的脱氧核糖核酸分子可具有至多200个核苷酸的长度。具体而言,旨在长度在48至116个核苷酸之间的序列。
脱氧核糖核酸分子的哑铃形非编码序列可在其单链区域包含碱基序列N1N2CGN3N4。
免疫刺激可在体外、离体或体内发生。
本公开还提供线性开链DNA序列,其包含至少一个CpG基序和至少一个L-构型的核苷酸。由于部分/完全的L-构型,DNA序列对外切核酸酶部分或完全具有抗性。如果构建体在双链的一个末端具有单链环,则末端也被保护免于降解。因此,ODN完全被保护免于细胞降解,而不需要使用已显示出有毒性的硫代磷酸酯主链。另外,ODN仅由最小数量的核苷酸组成,这使得它们很小并且因此易于转染入细胞。
包含至少一个序列基序N1N2CGN3N4的脱氧核糖核酸的非编码序列可是单链的或部分或完全双链的。这包括在同一分子内(分子内)或在不同分子内(分子间)或其任何组合内的碱基配对。构建体还可能包含至少一个未配对的单链区域。作为另一个实施方案,包括发夹结构。由于部分或完全的L-构型,确保了构建体的更长半衰期,因为L-构型的核苷酸不遭遇降解。
同样在本公开的范围内的是,单链或部分或完全双链的至少两个分子可彼此连接以形成多聚体构建体。因此,这些多聚体构建体至少掺入与连接伴侣一样多的CpG基序,紧密包装在一个分子内,因此预期也会引起相当大的免疫应答,作为与T细胞调节剂联合的一部分。所得的单链或部分或完全双链多聚体构建体可以共价闭合,包含分子内的L-构型的核苷酸或在5'-和/或3'-端包含L-构型核苷酸的开放多聚体构建体,以防止细胞降解。
本公开还包括脱氧核糖核酸的非编码序列中的至少一个核苷酸的化学修饰,其包含至少一个具有选自羧基、胺、酰胺、醛亚胺、缩酮、缩醛、酯、醚、二硫化物、巯基和醛基的官能团的序列基序N1N2CGN3N4。这允许DNA构建体通过例如吸附、共价键或离子键与选自肽、蛋白质、碳水化合物、抗体、合成分子、聚合物、微粒(micro projectile)、金属粒子或固相的化合物偶联。
为了相应的目的可以具体选择修饰。因此,该构建体可用于例如将其他分子穿梭至对应于掺入的CpG基序的具体细胞。另外,可通过这种修饰可以将构建体与微粒偶联,微粒可以用来将构建体转移到细胞中。构建体也可以与固相(例如微量滴定板)偶联。
图1显示MGN1703上调外周血免疫效应细胞上的CD69表达(细胞活化的标记)。用MGN1703或LPS刺激总PBMC(n=5个独立的供体)。刺激后,通过流式细胞术分析细胞,并且表征NK细胞(左)和CD8+ T细胞(右)上的CD69表达。描述的是平均倍数高于培养基对照。
图2显示MGN1703刺激NK细胞抑制HIV的扩散。用MGN1703或LPS刺激CD4耗竭的PBMC(一个代表性供体,显示SD)。刺激后,将细胞与自体HIV感染的CD4+细胞一起孵育。HIV衣壳蛋白(Gagp24)在培养上清液中随时间定量,作为病毒传播的量度。
图3显示非编码DNA构建体对促炎细胞因子IL-6(图3A)和TNFα(图3B)几乎没有影响。“UT”表示未处理的对照,“MGN1703”表示从左至右以0.75μM、1.5μM和3μM的浓度应用的非编码DNA构建体。因此,使用脱氧核糖核苷酸的非编码免疫刺激序列活化病毒感染的细胞而不引发基于细胞因子的非期望炎症。
为了证实用脱氧核糖核苷酸的非编码免疫刺激序列刺激NK细胞的活化作用,研究了NK细胞的活化受体或抑制受体的作用。图4A和4B显示只有非编码DNA序列增加活化受体的表达。
图5显示了进行的实验结果,以证实图2中显示的病毒抑制是HIV特异性杀伤而不是非特异性CD4T细胞死亡的结果。在第6天收集HIV感染的细胞并对细胞内P24抗原染色。图5A显示单独培养的CD4 T细胞,图5B显示与未处理的NK细胞一起培养的CD4 T细胞,图5C显示与dSLIM处理的NK细胞一起培养的CD4 T细胞。每个图中的方框圈出HIV感染的细胞群。它们占总数的百分比显示在方框上方。
图5中的结果证实根据本公开用非编码DNA构建体处理NK细胞适合大量减少HIV感染细胞的数量。
实质上,本公开证明通过根据本公开的非编码DNA构建体的治疗可支持导致潜伏期的病毒感染的治疗。感染的细胞将被活化或“去除掩盖”,以便免疫系统能够杀伤它们。因此,例如通过应用免疫刺激非编码DNA支持用cART联合治疗HIV感染。
参考将cART和HDACi联合的现有技术描述的结果,这两种HIV治疗的组成与免疫刺激非编码DNA构建体联合治疗将可能有利于HIV治疗。目前正在进行旨在证明这种有益效果的相应实验。
必须注意,本公开的非编码免疫刺激DNA构建体具有避免促炎细胞因子刺激的优点。相反,已知通过化学修饰稳定非编码DNA构建体以免于核酸酶降解会引起促炎细胞因子释放。
令人惊讶的是潜伏逆转录病毒感染细胞的刺激不会导致HIV感染加速进展为AIDS。用根据上述公开的构建体的刺激增强用cART和/或HDACi治疗HIC的成功率是不可预测的。
- 还没有人留言评论。精彩留言会获得点赞!