治疗病理性淋巴管生成的微RNA184调节的制作方法
本申请要求2015年10月21日提交的美国临时申请号62/244,542的优先权。上面引用的该临时申请的全部内容据此以引用的方式并入。
政府资助
本发明是在美国国立卫生研究院(National Institutes of Health)颁发的EY017392下由美国政府资助完成的。美国政府对本发明具有一定的权利。
发明背景
淋巴管网络穿透大多数组织,并且其功能障碍与广泛的病症有关,诸如癌症转移、炎症、移植排斥、高血压、肥胖症和淋巴水肿(Alitalo K.The lymphatic vasculature in disease.Nature medicine 2011;17:1371-1380;Chen L.Ocular lymphatics:state-of-the-art review.Lymphology 2009;42:66-76)。由于历史原因和技术局限而被忽视了几个世纪后,淋巴管研究在近年来得到了重大关注和巨大进展。然而,目前对眼睛中的淋巴管疾病没有有效的治疗。因此,为了开发新的治疗策略,识别新的淋巴管生成(LG;淋巴管形成)调节因子势在必行。
概述
在某些实施方案中,本发明提供了一种遏制有需要的哺乳动物体内的组织或器官中的病理性淋巴管形成的方法,所述方法包括施用治疗剂,所述治疗剂包括Mir-184、pri-Mir-184、Mir-184模拟物或包含表达盒的载体,所述表达盒包含启动子和编码Mir-184、pri-Mir-184或Mir-184模拟物的核酸。
在某些实施方案中,本发明提供了一种抑制有需要的哺乳动物体内的癌症转移的方法,所述方法包括施用治疗剂,所述治疗剂包括Mir-184、pri-Mir-184、Mir-184模拟物或包含表达盒的载体,所述表达盒包含启动子和编码Mir-184、pri-Mir-184或Mir-184模拟物的核酸。
在某些实施方案中,本发明提供了一种抑制有需要的哺乳动物体内的移植排斥的方法,所述方法包括施用治疗剂,所述治疗剂包括Mir-184、pri-Mir-184、Mir-184模拟物或包含表达盒的载体,所述表达盒包含启动子和编码Mir-184、pri-Mir-184或Mir-184模拟物的核酸。
在某些实施方案中,本发明提供了一种抑制淋巴管内皮细胞(LEC)的粘附、迁移和/或管形成的方法,所述方法包括向有需要的哺乳动物施用治疗剂,所述治疗剂包括Mir-184、pri-Mir-184、Mir-184模拟物或包含表达盒的载体,所述表达盒包含启动子和编码Mir-184、pri-Mir-184或Mir-184模拟物的核酸,其中与未经治疗的LEC相比所述抑制达到约10%。在某些实施方案中,抑制达到至少40%。
在某些实施方案中,本发明提供了一种预防或治疗有需要的哺乳动物体内的角膜淋巴管生成(LG)的方法,所述方法包括施用治疗剂,所述治疗剂包括Mir-184、pri-Mir-184、Mir-184模拟物或包含表达盒的载体,所述表达盒包含启动子和编码Mir-184、pri-Mir-184或Mir-184模拟物的核酸。在某些实施方案中,角膜淋巴管生成由炎症、感染、干眼症、创伤或化学损伤诱导。
在某些实施方案中,本发明提供了一种在移植之前或之后修改角膜以改善移植物存活的方法,所述方法包括施用治疗剂,所述治疗剂包括Mir-184、pri-Mir-184、Mir-184模拟物或包含表达盒的载体,所述表达盒包含启动子和编码Mir-184、pri-Mir-184或Mir-184模拟物的核酸。
在某些实施方案中,组织是眼组织。
在某些实施方案中,眼组织是角膜组织。
在某些实施方案中,组织是内皮组织。
在某些实施方案中,内皮组织属于淋巴管内皮组织。
在某些实施方案中,哺乳动物是人。
在某些实施方案中,治疗剂存在于药物组合物中。
在某些实施方案中,施用通过局部或全身施用进行。
在某些实施方案中,施用通过结膜下、眼内、眼周、眼球后、肌内、局部、静脉内或皮下施用进行。
在某些实施方案中,药剂是长度为22个核苷酸的Mir-184模拟物。
在某些实施方案中,药剂是长度为100-200bp的pri-Mir-184。
在某些实施方案中,药剂是与SEQ ID NO:1具有至少90%互补性的Mir-184模拟物。
在某些实施方案中,药剂是载体并且启动子是polII或polIII启动子。
在某些实施方案中,药剂是载体并且启动子是H1或U6启动子。
在某些实施方案中,药剂是载体并且启动子是组织特异性启动子。
在某些实施方案中,药剂是载体并且启动子是诱导型启动子。
在某些实施方案中,药剂是载体,为腺伴随病毒(AAV)载体或腺病毒载体。
在某些实施方案中,本发明提供了一种用于对组织或器官中的病理性淋巴管形成进行治疗性治疗的组合物,所述组合物包含治疗剂,所述治疗剂包括Mir-184、pri-Mir-184、Mir-184模拟物或包含表达盒的载体,所述表达盒包含启动子和编码Mir-184、pri-Mir-184或Mir-184模拟物的核酸。
在某些实施方案中,本发明提供了Mir-184、pri-Mir-184、Mir-184模拟物或包含表达盒的载体在制备可用于抑制哺乳动物的LG的药物中的用途,所述表达盒包含启动子和编码Mir-184、pri-Mir-184或Mir-184模拟物的核酸。
附图简述
图1A-1C.Mir-184表达在角膜炎性淋巴管生成中下调。(图1A)实时PCR结果,其显示mir-184在缝合线放置后2周在发炎角膜中显著下调。(图1B)免疫荧光显微镜分析的代表性图像,其显示在mir-184模拟物治疗后发炎角膜中的淋巴管显著减少。白色虚线:角膜和结膜之间角膜缘的分界。比例尺:200μm。(图1C)中展示了淋巴管侵袭区域的汇总数据。数据表示为平均值±SEM,*P<0.05。
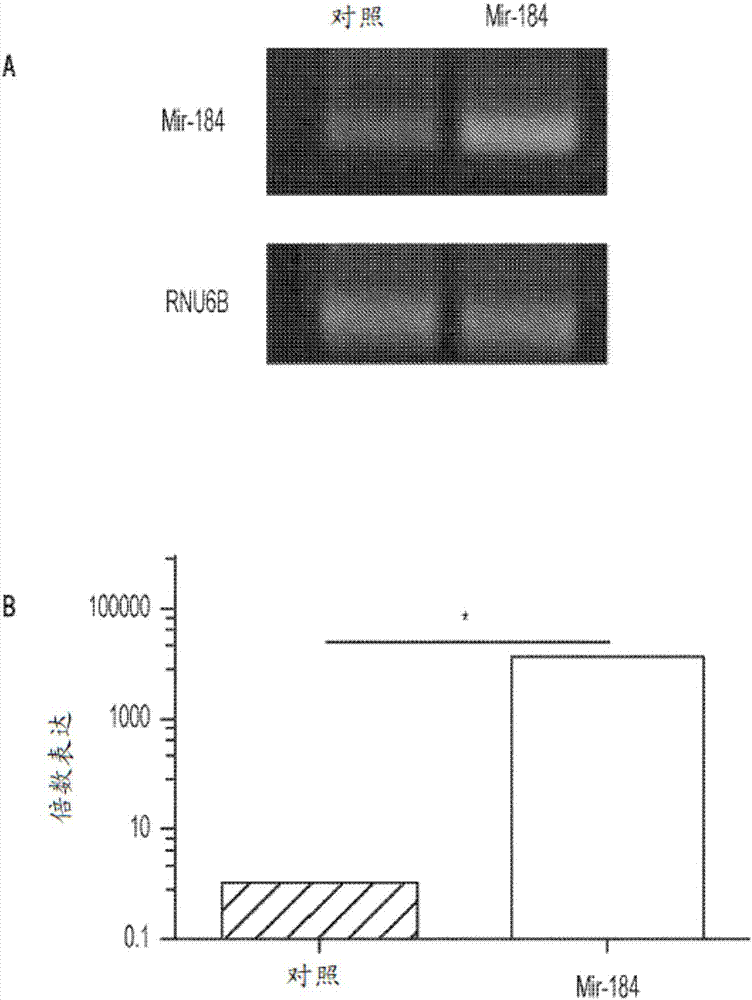
图2A-2B.mir-184在人淋巴管内皮细胞中的体外过表达。(图2A)在用mir-184合成模拟物转染后48小时的mir-184PCR产物的凝胶图像。(图2B)定量实时PCR结果,其显示转染后LEC中的mir-184显著增加。数据表示为平均值±SEM,*P<0.05。
图3A-3C.Mir-184过表达抑制淋巴管内皮细胞的粘附和迁移功能。(图3A)显示在用mir-184模拟物转染后显著遏制了LEC与I型胶原蛋白粘附的汇总数据。(图3B)和(图3C)汇总数据(图3B)和代表性图像(图3C),其示出在用mir-184模拟物转染后在伤口愈合测定中显著抑制了LEC迁移。比例尺:500μm。数据表示为平均值±SD,*P<0.05。
图4A-4B.Mir-184过表达抑制淋巴管内皮细胞管形成。
(图4A)代表性显微照片,其显示在用mir-184模拟物转染后显著抑制了基质胶上的LEC毛细血管形成。比例尺:200μm。(图4B)总小管长度测量的汇总数据。数据表示为平均值±SD,*P<0.05。
具体实施方式
与过去几个世纪研究的血管不同,淋巴管研究标志着一个新的发现领域并且近年来经历了指数增长(Alitalo,K.The lymphatic vasculature in disease.Nat.Med.2011;17:1371-1380;Tammela T,Alitalo K:Lymphangiogenesis:Molecular mechanisms and future promise.Cell2010;140:460‐476;Chen L:Ocular Lymphatics:State‐of‐the‐Art Review.Lymphology 2009;42:66‐76;Alitalo K,Tammela T,Petrova TV:Lymphangiogenesis in development and human disease;Nature 2005;438:946‐953;Brown P:Lymphatic system:unlocking the drains.Nature2005;436:456‐458;Folkman J,Kaipainen A:Genes tell lymphatics to sprout or not.Nat Immunol 2004;5:11‐12;Rockson SG:The broad spectrum of lymphatic health and disease.Lymphat Res Biol;8:101)。淋巴管网络穿透身体中的大多数组织,并在诸如免疫监视、体液调节以及脂肪和维生素吸收的广泛功能中发挥关键作用。因此,许多疾病和病状与淋巴功能障碍相关联,这些疾病和病症包括但不限于癌症转移、组织和主要器官(心脏、肾脏和肺脏)移植排斥、炎性和免疫性疾病、感染、哮喘、肥胖症、糖尿病、艾滋病、高血压和淋巴水肿。这些病症可能会致残、毁容,甚至威胁生命。迄今为止,淋巴管病症的有效治疗手段很少,因此这是一个迫切需要新治疗方案的领域。与淋巴管疾病相关联的负担是巨大的。例如,仅淋巴水肿(原发性或继发于癌症疗法)就影响美国至少600多万人,全球超过1.7亿人。
角膜为淋巴管研究提供了理想的部位,因为角膜具有可触及位置、透明性质以及无淋巴管但具备诱导性的特征(Chen L:Ocular Lymphatics:State‐of‐the‐Art Review.Lymphology 2009;42:66‐76;Rogers MS,Birsner AE,D'Amato RJ:The mouse cornea micropocket angiogenesis assay.Nat Protoc 2007;2:2545‐2550;Cursiefen C,Chen L,Dana MR,Streilein JW:Corneal lymphangiogenesis:evidence,mechanisms,and implications for corneal transplant immunology.Cornea 2003;22:273‐281;Chen L,Hann B,Wu L:Experimental models to study lymphatic and blood vascular metastasis,in“From local invasion to metastatic cancer”.Stanley P.L.Leong(编辑),Humana Press.2011)。使用角膜进行淋巴管研究的成功可以从以下事实预测得出:据Judah Folkman(肿瘤血管生成研究的先辈)估计,在过去的几个世纪中,超过三分之一的血管基础知识是从角膜研究中获得的。
尽管在正常条件下不由淋巴管产生,但淋巴管形成(淋巴管生成,LG)在炎症、感染、创伤、免疫原性或化学损伤后伴随有许多角膜疾病。一旦被诱导,它们就会增强免疫细胞的大量递送并且还介导移植排斥。来自我们和其他研究人员的集总数据表明,淋巴管途径是角膜移植排斥的主要介导物(Dietrich T,Bock F,Yuen D等人:Cutting edge:lymphatic vessels,not blood vessels,primarily mediate immune rejections after transplantation.J Immunol 2010;184:535‐539;Zhang H,Grimaldo S,Yuen D,Chen L:Combined blockade of VEGFR‐3and VLA‐1markedly promotes high‐risk corneal transplant survival.Invest Ophthalmol Vis Sci 2011)。此外,LG在体内其他部位(例如肾脏、心脏、肺脏、骨植入物)中与移植排斥相关联(Kerjaschki D:Lymphatic neoangiogenesis in renal transplants:a driving force of chronic rejection?J Nephrol 2006;19:403‐406;Kerjaschki D,Huttary N,Raab I等人:Lymphatic endothelial progenitor cells contribute to de novo lymphangiogenesis in human renal transplants.Nat Med 2006;12:230‐234;Jell G,Kerjaschki D,Revell P,Al‐Saffar N:Lymphangiogenesis in the bone‐implant interface of orthopedic implants:importance and consequence.J Biomed Mater Res A 2006;77:119‐127;Geissler HJ,Dashkevich A,Fischer UM等人:First year changes of myocardial lymphatic endothelial markers in heart transplant recipients.Eur J Cardiothorac Surg 2006;29:767‐771)。
角膜移植是所有实体器官和组织移植中最常见的形式。尽管其在未发炎和无淋巴管的宿主红细胞中存活率很高,但在发炎和富含淋巴管的角膜上进行移植时排斥率可高达50%-90%。迄今为止,对这种高排斥情况的有效管理仍然很少。不幸的是,许多因角膜疾病而失明的患者属于这种高排斥类别(在创伤、炎症、感染或化学损伤后)。由于预后不佳,这些患者甚至不被视为移植外科手术的良好候选者,并且不得不放弃他们恢复视力的希望。因此,我们有兴趣确定治疗LG及其相关疾病(包括移植排斥)的新治疗靶点。角膜为LG研究提供了理想的部位。由于角膜在正常情况下具有可触及位置、透明性质以及无淋巴管特征,因此该组织为研究诱导性淋巴管生长提供了有利的模型,而不必与预先存在的脉管或背景脉管区分开来(Chen L.Ocular lymphatics:state-of-the-art review.Lymphology 2009;42:66-76)。角膜LG可以由许多病理性损伤(诸如炎症、感染、创伤和化学灼伤)诱导,并且它是移植排斥的主要介导物(Chen L.Ocular lymphatics:state-of-the-art review.Lymphology 2009;42:66-76;Dietrich T,Bock F,Yuen D等人Cutting edge:lymphatic vessels,not blood vessels,primarily mediate immune rejections after transplantation.J Immunol2010;184:535-539;Yuen D,Pytowski B,Chen L.Combined blockade of VEGFR-2and VEGFR-3inhibits inflammatory lymphangiogenesis in early and middle stages.Invest Ophthalmol Vis Sci 2011;52:2593-2597)。
本发明具有许多潜在的应用,例如预防或治疗由炎症、感染、干眼症、创伤或化学损伤诱导的角膜淋巴管生成;在移植之前或之后修改角膜以改善移植物存活;遏制淋巴管生成并促进移植物在身体其他组织或器官中的存活;或管理眼睛内部和外部出现的淋巴管病症(诸如癌症转移、炎症和免疫性疾病以及淋巴水肿)。
目前,对眼睛中的淋巴管疾病没有有效的治疗。Mir-184通常存在于无淋巴管的角膜中,因此提供了一种新颖且天然的淋巴管生成抑制剂。过去几十年来,尽管皮质类固醇功效有限并且伴随严重的副作用,诸如青光眼、白内障和机会性感染,但角膜移植排斥的药物疗法几乎没有变化。在发炎和富含淋巴的移植床中移植物排斥的临床负担是巨大的,因为无论目前的治疗方式如何,高达50%-90%的移植物都会被排斥。
微RNA是一类小的非编码RNA,其通过RNA沉默和转录后调节来调控基因表达(Hammond SM.An overview of microRNAs.Advanced drug delivery reviews 2015;Ambros V.The functions of animal microRNAs.Nature 2004;431:350-355)。它们在眼睛和眼睛相关疾病中的具体作用仍然大部分未知。最近一项使用微RNA阵列比较成年小鼠角膜和富含上皮的足垫的研究发现微RNA-184(mir-184)是小鼠角膜中表达最丰富的微RNA(Ryan DG,Oliveira-Fernandes M,Lavker RM.MicroRNAs of the mammalian eye display distinct and overlapping tissue specificity.Mol Vis 2006;12:1175-1184)。mir-184在正常和无淋巴管的角膜中的限制性表达特征促使我们评估其在角膜LG中的潜在作用以及它是否可用作抗淋巴管生成因子(Ryan DG,Oliveira-Fernandes M,Lavker RM.MicroRNAs of the mammalian eye display distinct and overlapping tissue specificity.Mol Vis 2006;12:1175-1184;Karali M,Peluso I,Marigo V,Banfi S.Identification and characterization of microRNAs expressed in the mouse eye.Invest Ophthalmol Vis Sci 2007;48:509-515)。
本发明人取得的新发现是微RNA-184(Mir-184)关键性地涉及病理性淋巴管形成。Mir-184表达在角膜炎性淋巴管生成中显著下调,并且其合成模拟物在体内遏制角膜淋巴管生长。此外,人微真皮淋巴管内皮细胞中的Mir-184异位表达在体外抑制粘附、迁移和管形成的关键细胞功能。这些数据表明Mir-184是淋巴管生成的抑制剂,它的调节被作为调控淋巴管生长和治疗眼睛淋巴相关疾病(如炎症、感染、干眼和角膜移植排斥反应)的新策略使用。或者,其还表明抗Mir-184策略可用于促进淋巴管形成并治疗淋巴管缺陷病症,诸如淋巴水肿。
本发明的重要性在于:1)在炎性、传染性、免疫原性、毒性、创伤或化学损伤后,许多疾病诱导病理性淋巴管生成;2)一旦被诱导,淋巴管生成就会成为移植排斥的主要介导物。在高风险移植中移植排斥的临床负担是巨大的,因为无论目前的治疗方式如何,高达50%-90%的移植物都会被排斥。过去几十年来,尽管皮质类固醇功效有限并且伴随严重的副作用,诸如青光眼、白内障和机会性感染,但移植排斥的药物疗法几乎没有变化;3)Mir-184通常在无淋巴管的角膜中表达并且用作淋巴管生成的天然抑制剂;以及4)动物和人类细胞工作的组合为患者状况提供可翻译的信息。该策略为治疗眼睛内部和外部出现的许多淋巴管疾病提供了新的治疗策略。
目前的数据表明,Mir-184模拟物可用于遏制角膜中的病理性淋巴管形成。Mir-184模拟物或其衍生物可以局部或全身施用以治疗眼睛疾病(结膜下、眼内、眼周、眼球后、肌内、局部、静脉内、皮下等)。本发明还可以用于治疗身体中的其他淋巴管病症,例如癌症转移以及炎性和免疫性疾病。或者,抗Mir-184策略可以潜在地用于促进淋巴管形成并治疗淋巴管缺陷病症,诸如淋巴水肿。在某些实施方案中,淋巴管生成被遏制至少10%。在某些实施方案中,淋巴管生成被遏制至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。在某些实施方案中,以足以引起治疗效果的水平遏制淋巴管生成。如本文所用,术语“治疗效果”是指疾病状态相关异常的变化,包括病理和行为缺陷;疾病进展时间的改变;减少、减轻或改变疾病的症状;或患有病状的人的生活质量的改善。治疗效果可以由医生定量测量,或由罹患微RNA所靶向的LG的患者定性测量。
在一个实施方案中,本发明的特征在于一种用于治疗或预防受试者或生物体的LG的方法,所述方法包括通过局部施用至相关组织或细胞来使受试者或生物体与本发明的微RNA分子接触,例如通过施用本发明的载体或表达盒向相关细胞提供本发明的微RNA分子。
递送病毒载体的方法包括但不限于静脉内施用和直接施用到患者眼睛中。通常,AAV病毒体可以使用体内或体外转导技术引入细胞中。如果体外转导,则将期望的受体细胞从受试者中移出,用AAV病毒体转导并再次引入受试者中。或者,可使用同基因或异基因的细胞,在这种情况下这些细胞在受试者中不会产生不当的免疫应答。
在一个实施方案中,药物组合物将包含足够的遗传物质以产生治疗有效量的目标微RNA,即足以减轻或改善所述疾病状态的症状的量或足以赋予所需益处的量。药物组合物还可以含有药学上可接受的赋形剂。这样的赋形剂包括本身不诱导产生对接受组合物的个体有害的抗体并且可以被施用而没有不适当的毒性的任何药剂。药学上可接受的赋形剂包括但不限于山梨醇、吐温80和液体诸如水、盐水、甘油和乙醇。其中可以包括药学上可接受的盐,例如,无机酸盐如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;和有机酸的盐如乙酸盐、丙酸盐、丙二酸盐、苯甲酸盐等。另外,诸如润湿剂或乳化剂的pH缓冲物质等的辅助物质可以存在于这些媒介物中。药学上可接受的赋形剂的全面讨论可获自REMINGTON'S PHARMACEUTICAL SCIENCES(Mack Pub.Co.,N.J.1991)。
鉴于本说明书的教导,对于本领域技术人员显而易见的是,必须加入的有效量的病毒载体可以凭经验确定。施用可在整个治疗过程中以一次剂量、连续或间歇地实现。确定最有效的施用方法和剂量的方法是本领域技术人员熟知的,并且将随着病毒载体、疗法组合物、靶细胞和正被治疗的受试者而变化。可根据治疗医生选择的剂量水平和方式进行单次和多次施用。
应该理解,可以通过递送的病毒载体来表达多于一种的转基因。或者,也可以如本文所述递送各自表达一种或多种不同转基因的单独载体。此外,还意图将通过本发明的方法递送的病毒载体与其他合适的组合物和疗法组合。
本发明还提供了用于医学治疗或诊断的如本文所述的微RNA、表达盒和/或载体。
本发明提供了如本文所述的微RNA、表达盒和/或载体在制备用于治疗LG的药物中的用途。
本发明还提供用于疗法的本发明的核酸、表达盒、载体或组合物。
本发明还提供了用于治疗LG的本发明的核酸、表达盒、载体或组合物。
如本文所用,“治疗”是指改善LG的至少一种症状、治愈LG和/或预防LG的产生。
术语“核酸”是指单链或双链形式的脱氧核糖核酸(DNA)或核糖核酸(RNA)及其聚合物,其由含有糖、磷酸和作为嘌呤或嘧啶的碱基的单体(核苷酸)组成。除非特别限制,否则该术语涵盖含有天然核苷酸的已知类似物的核酸,所述类似物具有与参考核酸相似的结合性质并且以与天然存在的核苷酸相似的方式代谢。除非另有说明,否则特定核酸序列还隐含地涵盖其经保守性修饰的变体(例如,简并密码子取代)和互补序列以及明确指出的序列。具体而言,可通过产生其中一个或多个所选(或所有)密码子的第三位置被混合碱基和/或脱氧肌苷残基取代的序列来实现简并密码子取代“核酸片段”是给定核酸分子的一部分。
“核苷酸序列”是可以是单链或双链的DNA或RNA聚合物,其任选含有能够并入DNA或RNA聚合物的合成、非天然或改变的核苷酸碱基。
术语“核酸”、“核酸分子”、“核酸片段”、“核酸序列或片段”或“多核苷酸”可互换使用,并且也可与基因、基因编码的cDNA、DNA和RNA互换使用。
本发明包括分离的或基本上纯化的核酸的核酸分子和含有这些分子的组合物。在本发明的上下文中,“分离的”或“纯化的”DNA分子或RNA分子是除其天然环境外存在的DNA分子或RNA分子,因此不是天然产物。分离的DNA分子或RNA分子可以以纯化形式存在或可以存在于非天然环境中,例如转基因宿主细胞。例如,“分离的”或“纯化的”核酸分子或其生物活性部分在通过重组技术产生时可基本上不含其他细胞物质或培养基,或在通过化学方法合成时基本上不含化学前体或其他化学品。在一个实施方案中,“分离的”核酸不含在所述核酸的来源生物体的基因组DNA中天然侧接核酸的序列(即,位于核酸5'和3'末端的序列)。例如,在各实施方案中,分离的核酸分子可以含有小于约5kb、4kb、3kb、2kb、1kb、0.5kb或0.1kb的在所述核酸的来源细胞的基因组DNA中天然侧接核酸分子的核苷酸序列。所公开的核苷酸序列的片段和变体也涵盖于本发明中。所谓“片段”或“部分”是指全长或少于全长的核苷酸序列。
“天然存在的”、“天然的”或“野生型”用于描述可以在自然界发现的有别于人工生产的物体。例如,存在于生物体(包括病毒)中的蛋白质或核苷酸序列是天然存在的,所述蛋白质或核苷酸序列可以从自然界中分离出来并且没有在实验室中被人有意修改。
“转基因”是指通过转化被引入基因组中的基因。转基因包括例如与要转化的特定细胞的DNA异源或同源的DNA。另外,转基因可以包括插入非天然生物体的天然基因或嵌合基因。术语“内源基因”是指在生物体基因组中处于其天然位置的天然基因。
“野生型”是指在自然界中发现的正常基因或生物体。
“载体”被定义为特别包括任何病毒载体,以及双链或单链线性或环状形式的任何质粒、粘粒、噬菌体或二元载体,其可以是或可以不是自传递或可移动的,并且其可以通过整合到细胞基因组中或存在于染色体外(例如具有复制起点的自发制质粒)而转化原核或真核宿主。
本文所用的“表达盒”是指能够指导特定核苷酸序列在合适的宿主细胞中表达的核酸序列,其可以包括可操作地连接至目标核苷酸序列的启动子,所述目标核苷酸序列可以可操作地连接至终止信号。该编码区通常编码目标功能性RNA,例如微RNA。包含目标核苷酸序列的表达盒可以是嵌合的。表达盒也可以是天然存在的但是已经以可用于异源表达的重组形式获得的表达盒。表达盒中的核苷酸序列的表达可在组成型启动子或可调控启动子的控制下,所述启动子仅在宿主细胞暴露于一些特定外部刺激时起始转录。在多细胞有机体的情况下,启动子还可以是对特定组织或器官或发育阶段特异性的。
这种表达盒可以包括与目标核苷酸序列连接的转录起始区。这种表达盒提供有用于插入目标基因以处于调控区的转录调控下的多个限制位点。所述表达盒可另外含有选择性标记基因。
“调控序列”是位于编码序列的上游(5'非编码序列)、内部或下游(3'非编码序列)的核苷酸序列,并且其影响相关编码序列的转录、RNA加工或稳定性或翻译。调控序列包括增强子、启动子、翻译前导序列、内含子和多腺苷酸化信号序列。它们包括天然序列和合成序列以及可能是合成序列和天然序列组合的序列。如本文所述,术语“合适的调控序列”不限于启动子。然而,可用于本发明的一些合适的调节序列将包括但不限于组成型启动子、组织特异性启动子、发育特异性启动子、可调控启动子和病毒启动子。
“启动子”是指通常在其编码序列上游(5′)的核苷酸序列,其通过提供对RNA聚合酶和正确转录所需的其他因子的识别来指导和/或控制编码序列的表达。“启动子”包括最小启动子,其是由TATA盒和其他用于指定转录起始位点的序列所构成的短DNA序列,向所述转录起始位点加入调控元件以控制表达。“启动子”还指包括能够控制编码序列或功能性RNA表达的最小启动子加上调控元件的核苷酸序列。这种类型的启动子序列由近端和更远端的上游元件组成,后者通常称为增强子。因此,“增强子”是DNA序列,所述DNA序列可刺激启动子活性并且可以是该启动子的先天元件或是插入以增强启动子的水平或组织特异性的异源元件。它能够在两个取向(正常的或翻转的)上操作,并且甚至能够在被从该启动子移动至上游或下游时起作用。增强子和其他上游启动子元件都与介导其作用的序列特异性DNA结合蛋白结合。启动子可整个源自天然基因,或由源自自然界发现的不同启动子的不同元件组成,或甚至包含合成DNA片段。启动子也可含有参与蛋白质因子结合的DNA序列,所述蛋白质因子响应生理或发育条件而控制转录起始的有效性。可用于本发明的启动子的实例包括小鼠U6RNA启动子、合成人H1RNA启动子、SV40、CMV、RSV、RNA聚合酶II和RNA聚合酶III启动子。
“组成型表达”是指使用组成型或调控型启动子的表达。“有条件的”和“经调控的表达”是指调控型启动子控制的表达。
“可操作地连接”是指核酸序列在单个核酸片段上关联,使得其中一个序列的功能受到另一个序列的影响。例如,如果两条序列的位置使得调控DNA序列影响编码DNA序列的表达,则称调控DNA序列与对RNA或多肽编码的DNA序列“可操作地连接”或“关联”(即,编码序列或功能性RNA处于启动子的转录控制之下)。编码序列可以在有义或反义方向上与调控序列可操作地连接。
“表达”是指细胞中的内源基因、异源基因或核酸片段或转基因的转录和/或翻译。例如,在微RNA构建体的情况下,表达可能仅指微RNA的转录。
“改变的水平”是指转基因细胞或生物体中与正常或未转化的细胞或生物体不同的表达水平。
“过表达”是指超过正常或未转化的细胞或生物体中表达水平的转基因细胞或生物体中的表达水平。
术语多核苷酸序列的“基本同一性”意指多核苷酸包含与使用标准参数描述的比对程序之一的参考序列相比具有至少70%、71%、72%、73%、74%、75%、76%、77%、78%或79%,优选至少80%、81%、82%、83%、84%、85%、86%、87%、88%或89%,更优选至少90%、91%、92%、93%或94%,以及最优选至少95%、96%、97%、98%或99%序列同一性。
术语“转化”是指将核酸片段转移到宿主细胞的基因组中,从而导致遗传稳定的遗传。“宿主细胞”是已被外源核酸分子转化或能够转化的细胞。含有转化的核酸片段的宿主细胞被称为“转基因”细胞。
“转化的”,“转导的”,“转基因的”和“重组的”是指其中引入了异源核酸分子的宿主细胞。如本文所用,术语“转染”是指将DNA递送到真核(例如哺乳动物)细胞中。术语“转化”在本文中用于指将DNA递送到原核(例如大肠杆菌)细胞中。术语“转导”在本文中用于指用病毒颗粒感染细胞。核酸分子可以稳定整合到本领域通常已知的基因组中。已知的PCR方法包括但不限于使用配对引物、巢式引物、单一特异性引物、简并引物、基因特异性引物、载体特异性引物、部分错配引物等的方法。例如,“转化”、“转化体”和“转基因”细胞已经经历了转化过程,并且包含整合到其染色体中的外源基因。术语“未转化的”是指尚未经过转化过程的正常细胞。
“遗传改变的细胞”表示已通过引入重组或异源核酸(例如,一种或多种DNA构建体或它们的RNA对应物)而被修饰的细胞,并且还包括保留部分或全部此类基因修饰的这些细胞的子代。
如本文所用,关于核苷酸分子的术语“衍生”或“针对”意指该分子与特定目标分子具有互补序列同一性。
本发明的微RNA可以通过本领域已知的任何方法产生,例如通过体外转录、重组或通过合成手段。在一个实例中,可以通过使用重组酶如T7RNA聚合酶和DNA寡核苷酸模板在体外产生微RNA。
微RNA
微RNA(微RNA或mir)是一类高度保守的小RNA分子,其从植物和动物基因组中的DNA转录但不会翻译成蛋白质。将Pre-微RNA加工成微RNA(Zhang等人,J.Controlled Release 172(2013)962-974)。加工的微RNA是单链~17-25个核苷酸(nt)RNA分子,其被整合到RNA诱导的沉默复合物(RISC)中并且已被鉴定为发育、细胞增殖、凋亡和分化的关键调节物。据信它们通过结合特异性mRNA的3'-非翻译区而在基因表达的调节中发挥作用。RISC通过翻译抑制、转录物切割或两者介导基因表达的下调。RISC还牵涉广泛真核生物的细胞核中的转录沉默。
单链寡核苷酸,包括描述和/或鉴定为可用作靶标或可用作本发明寡核苷酸设计的模板的微RNA或mir的那些。本领域技术人员将理解,本文描述的任何寡核苷酸化学修饰或变化也适用于单链寡核苷酸。
成熟的人Mir-184(hsa-miR-184)具有以下序列:
5′-UGGACGGAGAACUGAUAAGGGU-3′(SEQ ID NO:1)
人Pri-Mir-184具有以下序列:
5′-CCAGUCACGUCCCCUUAUCACUUUUCCAGCCCAGCUUUGUGACUGUAAGUGUUGGACGGAGAACUGAUAAGGGUAGGUGAUUGA-3′(SEQ ID NO:2)
微RNA模拟物
微RNA模拟物代表一类可用于模拟一种或多种微RNA的基因沉默能力的分子。因此,术语“微RNA模拟物”是指能够进入RNAi途径并调节基因表达的合成非编码RNA(即,不通过从内源微RNA的来源纯化得到的微RNA)。微RNA模拟物可以设计为成熟分子(例如单链)或模拟前体(例如pri-或pre-微RNA)。微RNA模拟物可由核酸(修饰或修饰的核酸)组成,包括但不限于RNA、修饰的RNA、DNA、修饰的DNA、锁核酸或2'-O,4'-C-亚乙基桥连的寡核苷酸核酸(ENA)或以上的任何组合(包括DNA-RNA杂合体)。另外,微RNA模拟物可包含可影响递送、胞内区室化、稳定性、特异性、功能性、链使用和/或效力的缀合物。在一个设计中,微RNA模拟物是双链分子(例如,具有长度介于约16和约31个核苷酸之间的双链体区)并且含有一个或多个与给定微RNA的成熟链具有同一性的序列。修饰可以包括在分子的一条或两条链上的2'修饰(包括2'-O甲基修饰和2'F修饰)和增强核酸稳定性和/或特异性的核苷酸间修饰(例如硫代磷酸酯修饰)。此外,微RNA模拟物可包括突出。突出可以由任一链的3'或5'末端上的1-6个核苷酸组成,并且可以被修饰以增强稳定性或功能性。在一个实施方案中,微RNA模拟物包含介于16和31个之间的核苷酸和以下化学修饰模式中的一个或多个的双链体区:有义链含有核苷酸1和2的2'-O-甲基修饰(从有义寡核苷酸的5'末端计数)以及所有的Cs和Us;反义链修饰可包括所有Cs和Us的2'F修饰、寡核苷酸5'末端的磷酸化,以及与2核苷酸3'突出相关的稳定的核苷酸间键。
微RNA替代疗法
微RNA替代疗法用含有与成熟内源微RNA相同的序列的寡核苷酸模拟物补充较低水平的微RNA。与单链微RNA模拟物相比,由引导链和过客链构成的双链微RNA模拟物具有100至1000倍的效力Zhang等人,J.Controlled Release 172(2013)962-974)。引导链含有与成熟微RNA相同的序列,并且过客链序列与成熟微RNA互补。除了与内源性成熟微RNA具有相同序列的微RNA模拟物之外,还可以使用合成微RNA前体模拟物,其具有范围从少量额外核苷酸到全长pri-微RNA的较长序列。
本发明的核酸分子
术语“分离的和/或纯化的”是指核酸例如DNA或RNA分子从其天然细胞环境以及从与细胞的其他组分如核酸或多肽的关联中体外分离,使得其可以被排序、复制和/或表达。RNA或DNA是“分离的”其不含至少一种在RNA或DNA的天然来源中通常与其关联的污染性核酸并且优选地基本上不含任何其他哺乳动物RNA或DNA。短语“不含至少一种通常与其关联的污染源核酸”包括这样的情况,其中核酸被重新引入到来源或天然细胞中但在不同染色体位置或以其他方式被并非天然存在于来源细胞(例如在载体或质粒中)的核酸序列侧接。
本发明的表达盒
为了制备表达盒,重组DNA序列或片段可以是环状或线性的、双链或单链的。通常,DNA序列或链段是嵌合DNA的形式,例如质粒DNA或载体,其也可以含有侧接有促进所得转化细胞中存在的重组DNA表达的控制序列的编码区。
如本文所用,“嵌合”载体或表达盒意指包含来自至少两种不同物种的核酸序列的载体或盒,或具有来自相同物种的核酸序列,所述核酸序列以不存在于“天然”或野生型物种中的方式连接或关联。
除用作RNA转录物的转录单位的重组DNA序列或其部分外,重组DNA的一部分可以是未转录的,用于调节或结构功能。例如,重组DNA可以具有在哺乳动物细胞中有活性的启动子。
在宿主细胞中起作用的其他元件,诸如内含子、增强子、多腺苷酸化序列等也可以是重组DNA的一部分。这些元件对于DNA的功能可能是也可能不是必要的,但是可以通过影响转录、微RNA的稳定性等来提供改善的DNA表达。这些元件可以根据需要包含在DNA中以获得细胞中微RNA的最佳性能。
控制序列是在具体宿主生物体中表达可操作地连接的编码序列所需的DNA序列。适用于原核细胞的控制序列例如包括启动子、以及任选地操纵子序列和核糖体结合位点。已知真核细胞利用启动子、多腺苷酸化信号和增强子。
可操作地连接的核酸是与另一核酸序列以功能性关系放置的核酸。例如,如果启动子或增强子影响序列的转录,则该启动子或增强子与编码序列可操作地连接;或者如果核糖体结合位置被定位以便于翻译,则该核酸体结合位点与编码序列可操作地连接。通常,可操作地连接的DNA序列是指连接的DNA序列是连续的。然而,增强子不必是连续的。连接是通过连接于适宜的限制位点处来实现。如果不存在此类位点,则根据常规实践使用合成的寡核苷酸适配子或接头。
待引入细胞的重组DNA可以含有选择性标记基因或报告基因或两者,以促进从待通过病毒载体转染或感染的细胞群中鉴定和选择表达细胞。在其他实施方案中,选择性标记可以在单独的DNA片段上携带并用于共转染程序中。选择性标记和报告基因都可以侧接有适当的调控序列以使其能够在宿主细胞中表达。有用的选择性标记是本领域已知的,并且包括例如抗生素抗性基因,例如neo等。
报告基因用于鉴定潜在转染的细胞并评估调控序列的功能。编码易测定蛋白质的报告基因是本领域众所周知的。通常,报告基因是不存在于受体生物体或组织中或由受体生物体或组织表达,并且编码蛋白质的基因,所述蛋白质的表达通过一些易于检测的性质例如酶活性体现。例如,报告基因包括来自大肠杆菌Tn9的氯霉素乙酰转移酶基因(cat)和来自萤火虫Photinus pyralis的萤光素酶基因。在将DNA引入受体细胞后,在合适的时间测定报告基因的表达。
构建可转染靶细胞的重组DNA的一般方法是本领域技术人员熟知的,并且可以使用相同的组合物和构建方法来产生可用于本文的DNA。
重组DNA可以通过用由编码微RNA的DNA构成的表达载体转染,通过任何可用于引入特定细胞的程序(例如物理或生物方法)而被容易地引入诸如哺乳动物、细菌、酵母或昆虫细胞的宿主细胞中,以获得具有该重组DNA的细胞,所述重组DNA被稳定整合到该细胞基因组中或以附加元件存在,使得本发明的DNA分子或序列被该宿主细胞表达。优选地,通过载体将DNA引入宿主细胞中。宿主细胞优选来自真核生物,例如植物、哺乳动物、昆虫、酵母或真菌来源,但也可以采用非真核来源的宿主细胞。
将预选DNA引入宿主细胞的物理方法包括磷酸钙沉淀,脂质转染,粒子轰击,显微注射,电穿孔等。将目标DNA引入宿主细胞的生物学方法包括使用DNA和RNA病毒载体。对于哺乳动物基因疗法,如下文所述,期望使用将复制基因插入宿主基因组中的有效手段。病毒载体,特别是逆转录病毒载体已经成为将基因插入哺乳动物例如人细胞的最广泛使用的方法。其他病毒载体可以来源于痘病毒、单纯疱疹病毒I、腺病毒和腺伴随病毒等。
如本文所讨论的,“转染的”或“转导的”宿主细胞或细胞系是其中基因组由于存在至少一种异源或重组核酸序列而改变或增强的细胞系。本发明的宿主细胞通常由DNA序列转染产生,所述DNA序列是在质粒表达载体、病毒表达载体中,或作为分离的线性DNA序列。转染的DNA可以成为染色体整合的重组DNA序列,其由编码微RNA的序列组成。
为了确认重组DNA序列在宿主细胞中的存在,可以进行各种测定。这样的测定包括,例如,本领域技术人员熟知的“分子生物学”测定,例如Southern和Northern印迹,RT-PCR和PCR;“生物化学”测定,如检测是否存在特定肽,例如通过免疫学手段(ELISA和蛋白质印迹)或通过本文所述的测定,以识别落入本发明范围内的药剂。
为了检测和定量引入的重组DNA链段产生的RNA,可以采用RT-PCR。在这种PCR应用中,首先需要使用酶如逆转录酶将RNA逆转录成DNA,并随后通过使用常规PCR技术扩增DNA。在大多数情况下,PCR技术虽然有用,但不能证明RNA产物的完整性。有关RNA产物性质的更多信息可以通过Northern印迹获得。这项技术证明了RNA物质的存在,并提供了有关该RNA完整性的信息。RNA物质的存在或不存在还可以使用点印迹或狭缝印迹Northern杂交确定。这些技术是Northern印迹的修改形式并且仅证明RNA物质的存在或不存。
本发明提供了一种用于在哺乳动物受体中表达外源核酸物质的细胞表达系统。该表达系统(也称为“基因修饰细胞”)括用于表达所述外源核酸物质的细胞和表达载体。基因修饰细胞适于施用于哺乳动物受体,其中这些细胞取代受体的内源细胞。因此,优选的基因修饰细胞是非永生化的并且是非致瘤性的。
根据一个实施方案,细胞被离体转染或以其他方式被离体基因修饰。从哺乳动物(优选人)分离细胞,用载体引入(即体外转导或转染)核酸以表达编码治疗剂的异源(例如重组)基因,然后施用于哺乳动物受体,以原位递送治疗剂。哺乳动物受体可以是人,并且待修饰的细胞是自体细胞,即,细胞从哺乳动物受体中分离。
根据另一个实施方案,细胞被转染或转导或以其他方式被体内基因修饰。用含有外源核酸物质的载体体内转导或转染来自哺乳动物受体的细胞,用于表达编码治疗剂的异源(例如重组)基因,并原位递送所述治疗剂。
如本文所用,“外源核酸物质”是指这样的天然或合成的核酸或寡核苷酸,其并非天然存在于细胞中;或如果其天然存在于细胞中,则在其原始或天然形式上经过修饰。因此,“外源核酸物质”包括例如可以被转录成反义RNA、微RNA的非天然存在的核酸以及“异源基因”(即,编码在同一类型的天然存在的细胞中不表达或以生物学上不显著的水平表达的蛋白质的基因)。譬如,相对于人腹膜间皮细胞,编码人促红细胞生成素(EPO)的合成或天然基因将被视为“外源核酸物质”,因为该细胞不天然表达EPO。“外源核酸物质”的仍另一个实例是仅引入基因的一部分以生成重组基因,如通过同源重组将可调控启动子与内源编码序列结合。
适合基因抑制疗法的状况可能是预防方法,即用于预防疾病或不期望的医学病症的方法。因此,本发明包括用于将具有预防功能的微RNA(即,预防剂)递送至哺乳动物受体的系统。
将本发明的表达盒引入细胞的方法
可以通过基因转移方法(如转染或转导)将抑制性核酸物质(例如,编码针对目标基因的微RNA的表达盒)离体或体内引入细胞中,以提供基因修饰细胞。各种表达载体(即,用于促进将外源核酸递送到靶细胞中的载体)是本领域普通技术人员已知的。
如本文所用,“细胞转染”是指细胞通过并入所添加的DNA而获得新的核酸物质。因此,转染是指使用物理或化学方法将核酸插入细胞中。本领域普通技术人员已知几种转染技术,包括磷酸钙DNA共沉淀、DEAE-葡聚糖、电穿孔、阳离子脂质体介导的转染、钨颗粒促进的微粒轰击和磷酸锶DNA共沉淀。
相比之下,“细胞转导”是指使用DNA或RNA病毒将核酸转移到细胞中的方法。用于将核酸转移到细胞中的RNA病毒(即逆转录病毒)在本文中被称为转导嵌合逆转录病毒。包含在逆转录病毒内的外源核酸物质被整合到转导细胞的基因组中。已经用嵌合DNA病毒(例如,携带编码治疗剂的cDNA的腺病毒)转导的细胞将不会把外源核酸物质整合到其基因组中,但将能够表达该外源核酸物质,所述外源核酸物质以染色体外的形式保留在细胞内。
外源核酸物质可包含编码微RNA的核酸连同控制转录的启动子。启动子的特征在于具有起始转录所必需的特定核苷酸序列。外源核酸物质还可包括获得所需基因转录活性所需的额外序列(即增强子)。对于本讨论的目的而言,“增强子”只是任何非翻译DNA序列,其与编码序列一同作用(顺式)以改变由启动子决定的基础转录水平。外源核酸物质可被引入到细胞基因组中紧接着启动子的下游,使得启动子与编码序列可操作地连接,以便允许编码序列的转录。表达载体可包含外源启动子元件以控制所插入外源基因的转录。此类外源启动子同时包括组成型启动子和可调控启动子。
天然存在的组成型启动子控制基本细胞功能的表达。因此,处于组成型启动子控制之下的核酸序列在所有细胞生长条件下均被表达。组成型启动子包括下列基因(其编码某些组成型或“持家”功能)的启动子:次黄嘌呤磷酸核糖转移酶(HPRT)、二氢叶酸还原酶(DHFR)、腺苷脱氨酶、磷酸甘油激酶(PGK)、丙酮酸激酶、磷酸甘油变位酶,β-肌动蛋白启动子以及本领域技术人员已知的其他组成型启动子。这些包括:SV40的早期和晚期启动子;莫洛尼氏白血病毒(Moloney Leukemia Virus)及其他逆转录病毒的长末端重复序列(LTR);和单纯疱疹病毒的胸苷激酶启动子,等等。
处于可调控启动子控制下的核酸序列仅在存在诱导剂或抑制剂的情况下表达或以更高或更低程度表达(例如,处于金属硫蛋白启动子控制下的转录在存在某些金属离子的情况下大幅提高)。可调控启动子包括当其诱导因子结合时刺激转录的反应元件(RE)。例如,存在针对下列物质的RE:血清因子、类固醇激素、视黄酸、环AMP,以及四环素和多西环素。可以选择含有特定RE的启动子以获得可调控的反应,并且在一些情况下,所述RE本身可被附接至不同的启动子,从而给所编码的核酸序列赋予可调控性。因此,通过选择适当的启动子(组成型对可调控;强对弱),有可能控制核酸序列在基因修饰细胞中的存在和表达水平。如果核酸序列处于可调控启动子的控制下,则通过将基因修饰细胞原位暴露于允许该核酸序列转录的条件以触发治疗剂的原位递送,例如,通过腹腔内注射控制所述试剂转录的可调控启动子的特定诱导物。例如,在基因修饰细胞中处于金属硫蛋白启动子控制下的核酸序列的原位表达通过将所述基因修饰细胞与含有适当(即,诱导)金属离子的溶液原位接触而增强。
因此,原位生成的微RNA的量通过控制诸如以下的因素来调控:用于指导核酸序列转录的启动子的性质(即,该启动子是组成型还是可调控的、是强还是弱)以及细胞中编码微RNA序列的外源核酸序列的拷贝数。
除了至少一个启动子和至少一个编码微RNA的异源核酸序列之外,表达载体可包含选择基因,例如,新霉素抗性基因,以促进选择已经用表达载体转染或转导的细胞。
还可以用两种或多种表达载体转染细胞,至少一种载体含有编码微RNA的核酸序列,另一种载体含有选择基因。选择合适的启动子、增强子、选择基因和/或信号序列被视为在本领域普通技术人员的能力范围内而无需过度实验。
本发明提供了用于对哺乳动物受体的细胞进行体内基因修饰的方法。根据一个实施方案,所述方法包括通过例如将载体注射到受体中而原位引入用于在哺乳动物受体的细胞中表达微RNA序列的表达载体。
用于本发明表达盒的递送媒介物
将化合物递送到组织中可能受到化合物的大小和生化性质的限制。目前,只有当分子很小(通常小于600道尔顿)时,才能在体内有效地将化合物递送到细胞中。
选择和优化用于在细胞中表达特定微RNA的特定表达载体可以通过如下方式实现:获得微RNA的核酸序列,有可能的话,连同一个或多个适当的控制区(例如,启动子、插入序列);制备包含载体的载体构建体,所述载体中插入了编码所述微RNA的核酸序列;用载体构建体体外转染或转导培养的细胞;以及确定所述微RNA是否存在于所培养的细胞中。
用于细胞基因疗法的载体包括病毒,诸如复制缺陷型病毒。示例性的病毒载体来源于哈维肉瘤病毒(Harvey Sarcoma virus)、劳氏肉瘤病毒(ROUS Sarcoma virus)、(MPSV)、莫洛尼小鼠白血病病毒(Moloney murine leukemia virus)和DNA病毒(例如,腺病毒)。
复制缺陷型逆转录病毒能够指导所有病毒粒子蛋白质的合成,但不能制造感染性颗粒。因此,这些遗传学上改变的逆转录病毒表达载体对于核酸序列在培养细胞中的高效转导具有一般实用性,而对于用在本发明的方法中具有特别实用性。此类逆转录病毒还对于将核酸序列有效体内转导至细胞中具有实用性。逆转录病毒已经被广泛用于将核酸物质转移至细胞中。用于生产复制缺陷型逆转录病毒的方案(包括以下步骤:将外源核酸物质并入质粒中,用所述质粒转染包装细胞系,由所述包装细胞系生产重组逆转录病毒,从组织培养基中收集病毒颗粒,以及用所述病毒颗粒感染靶细胞)是本领域众所周知的。
将逆转录病毒用于基因疗法的优点在于:病毒将编码微RNA的核酸序列插入到宿主细胞基因组中,从而允许编码微RNA的核酸序列在细胞分裂时被传递给该细胞的子代。LTR区内的启动子序列可以在各种细胞类型中增强所插入编码序列的表达。使用逆转录病毒表达载体的一些缺点在于:(1)插入诱变,即,将编码微RNA的核酸序列插入到靶细胞基因组中不期望的位置,其例如导致不受调控的细胞生长;以及(2)需要靶细胞增殖以使得载体携带的编码微RNA的核酸序列被整合到靶基因组中。
可用作表达载体以转化细胞的另一病毒候选是腺病毒,一种双链DNA病毒。腺病毒可感染广泛的细胞类型,包括例如肌肉细胞和内皮细胞。
腺病毒(Ad)是具有36kb基因组的双链线性DNA病毒。腺病毒的若干特征已使其可用作转基因递送媒介物,用于治疗应用,如促进体内基因递送。已经证明,重组腺病毒载体能够有效原位基因转移至各种器官(包括肺、脑、胰腺、胆囊和肝)的实质细胞。这已允许在用于治疗遗传的基因疾病(如囊性纤维化)的方法中使用这些载体,其中载体可被递送至靶器官。
类似于逆转录病毒,腺病毒基因组适于用作基因疗法的表达载体,即,通过移除控制病毒自身生产的基因信息。因为腺病毒以染色体外的方式起作用,所以重组腺病毒理论上没有插入诱变的问题。
在传统上已经使用了若干种方法生成重组腺病毒。一种方法涉及将含有目标核酸序列的限制性核酸内切酶片段直接连接至腺病毒基因组的部分。或者,可通过同源重组结果将目标核酸序列插入缺陷型腺病毒中。通过筛选在互补细胞的菌苔上生成的单独菌斑而识别出所需重组体。
通过转染合成的微RNA、体外合成的RNA或表达微RNA的质粒来实现微RNA的应用。最近,近来,病毒已经被用于体外研究并用于生成转基因小鼠的靶基因敲低。重组腺病毒、腺伴随病毒(AAV)和猫免疫缺陷病毒(FIV)可用于体外和体内递送基因。各有其优点和缺点。腺病毒是具有大基因组(36kb)的双链DNA病毒,并且经工程改造以在不同区包含表达盒。
腺伴随病毒具有包被的基因组,类似于Ad但大小和包装容量更小(~30nm对~100nm;包装极限~4.5kb)。AAV含有+或-链的单链DNA基因组。已经广泛研究了AAV的八种血清型(1-8)。本申请的一个重要考量是AAV5转导纹状体和皮质神经元,并且不与任何已知病理相关联。
腺伴随病毒(AAV)是细小病毒科的一种小型非致病性病毒。AAV不同于此家族的其他成员,因为其复制依赖于辅助病毒。在不存在辅助病毒的情况下,AAV可以基因座特异性方式整合到染色体19的q-臂中。AAV的大约5kb的基因组由正或负极性的单链DNA的一个链段组成。基因组的端部是短的末端反向重复序列,其可以折叠成发夹结构并充当病毒DNA复制的起点。在物理上,细小病毒的病毒粒子是无包膜的并且其二十面体衣壳的直径为大约20nm。
本发明还提供了嵌合病毒,其中AAV可以与疱疹病毒、疱疹病毒扩增子、杆状病毒或其他病毒结合以实现与另一种病毒相关的所需嗜性。例如,可将AAV4ITR插入疱疹病毒中并可感染细胞。感染后,在系统中或单独媒介物中提供的AAV4rep可作用于AAV4的ITR以从基因组中拯救AAV4。因此,单纯疱疹病毒的细胞嗜性可以与AAV4rep介导的靶向整合相结合。可用于构建嵌合病毒的其他病毒包括:慢病毒、逆转录病毒、假型逆转录病毒载体和腺病毒载体。
本发明还提供了变体AAV载体。例如,可以在单个核苷酸水平修饰天然AAV的序列。本发明包括天然和突变AAV载体。本发明还包括所有AAV血清型。
FIV是在人类中具有强安全概况的有包膜病毒;被FIV感染的猫咬伤或抓伤的个体不会血清转化并且尚未报道表现出任何病征。类似于AAV,FIV在小鼠和非人灵长类的神经元中提供持续的转基因表达,并且转导可以通过假型化(将病毒的天然包膜替换成另一种病毒的包膜的方法)而指向不同的细胞类型。
因此,对于本领域普通技术人员来说显而易见的是,多种合适的病毒表达载体可用于将外源核酸物质转移到细胞中。选择适当的表达载体以表达针对适于基因沉默疗法的特定状况的治疗剂并且优化将所选表达载体插入细胞中的条件,是在本领域普通技术人员的能力范围内而无需过度实验。
在另一个实施方案中,表达载体是质粒的形式,其通过下列各种方法之一被转移至靶细胞中:物理的(例如,显微注射、电穿孔、划痕负载、微粒轰击)或作为化学复合物(例如,钙或锶共沉淀、与脂质复合、与配体复合)由细胞吸收。若干商业产品可用于阳离子脂质体复合,包括LipofectinTM(Gibco-BRL,Gaithersburg,Md.)和TransfectamTM(Madison,Wis.)。然而,这些方法的转染效率高度依赖于靶细胞的性质,因此,使用本文提及的程序将核酸转染到细胞中的最佳条件必须经过优化。此类优化是在本领域普通技术人员的能力范围内而无需过度实验。
本发明的试剂的剂量、制剂和施用途径
优选施用本发明的试剂以导致减少至少一种与疾病相关的症状。施用量将根据各种因素而变化,所述因素包括但不限于:所选组合物、具体疾病、哺乳动物的重量、身体状况和年龄、以及想要实现预防还是治疗。此类因素可以由临床医生采用本领域熟知的动物模型或其他测试系统容易地确定。如本文所用,术语"治疗性微RNA"指代对受体具有有益效果的任何微RNA。因此,"治疗性微RNA"同时包括治疗性和预防性微RNA。
微RNA的施用可通过施用编码该微RNA的核酸分子而实现。核酸的药物制剂、剂量和施用途径是众所周知的。
本发明设想了通过施用本发明的药剂(例如,核酸组合物、表达载体或病毒颗粒)来治疗哺乳动物的LG。根据本发明施用治疗剂可以是连续的或间歇的,取决于例如受体的身体状况、施用目的是治疗性还是预防性、以及技术人员已知的其他因素。施用本发明的药剂可以是在预选的时间段上基本上连续的或可以是一系列间隔的剂量。设想了局部和全身施用。
含有本发明的治疗剂的一种或多种合适的单位剂型,如下所述,可任选地被配制成持续释放(例如使用微胶囊化,参见WO 94/07529和美国专利No.4,962,091,其公开内容以引用方式并入本文),其可以通过各种途径施用,包括胃肠外,包括通过静脉内和肌内途径,以及通过直接注射到病变组织中。例如,治疗剂可以直接注射入眼睛中。或者,可以全身性地(例如静脉内)引入治疗剂。所述制剂(在适当情况下)可以离散单位剂型方便地制备,并且可通过药剂学领域熟知的任何方法制备。此类方法可包括以下步骤:使治疗剂与液体载体、固体基质、半固体载体、细分的固体载体或其组合缔合,然后,如果有必要,将产物引入或成形到所需递送系统中。
当制备本发明的治疗剂用于施用时,优选地将其与药学上可接受的载体、稀释剂或赋形剂组合以形成药物制剂或单位剂型。此类制剂中包含的总活性成分按制剂的重量计为0.1至99.9%。"药学上可接受的"是指载体、稀释剂、赋形剂和/或盐与制剂的其他成分相容并且对其受体无害。用于施用的活性成分可以粉末或颗粒、溶液、悬浮液或乳液的形式提供。
含有本发明的治疗剂的药物制剂可以通过本领域已知的程序使用熟知并容易获得的成分制备。本发明的治疗剂还可以被配制成适于胃肠外施用的溶液,例如通过肌内、皮下或静脉内途径。
本发明的治疗剂的药物制剂还可以采取水溶液或无水溶液或分散液的形式,或者采取乳液或悬浮液的形式。
因此,治疗剂可被配制成用于胃肠外施用(例如,通过注射,例如,快速推注(bolus injection)或连续输注)并且可以单位剂型在安瓿、预装填注射器、小容量输液容器或含有添加的防腐剂的多剂量容器中提供。活性成分可采取如在油性或水性媒介物中的悬浮液、溶液或乳液的形式,并且可含有配方药剂如悬浮剂、稳定剂和/或分散剂。或者,活性成分可以是粉末形式,其通过无菌分离灭菌固体或通过冻干溶液而获得,用于在使用前与合适的媒介物(例如,灭菌的、无热原的水)复构。
应当理解,各剂型的单个气溶胶剂量中所含的单位活性成分含量其本身不必构成用于治疗特定指征或疾病的有效量,因为必要的有效量可以通过施用多个剂量单位而达到。此外,有效量可使用小于剂型中的剂量单独地或在一连串施用中实现。
本发明的药物制剂可包含药学上可接受的载体、稀释剂、增溶剂或乳化剂以及本领域熟知类型的盐作为任选成分。可用于本发明的药物制剂中的载体和/或稀释剂的具体非限制性实例包括:水和生理上可接受的缓冲盐水溶液(如磷酸盐缓冲盐水溶液)、pH7.0-8.0的盐水溶液和水。
现在将通过以下非限制性实施例说明本发明。
实施例1
本发明人已经发现mir-184在角膜炎性LG中显著下调,因此其合成模拟物在体内抑制角膜淋巴管生长。此外,人淋巴管内皮细胞(LEC)中的mir-184过表达在体外遏制其粘附、迁移和管形成的功能。这些结果一起揭示了mir-184是淋巴管生成过程的负调节物。
方法
动物、淋巴管内皮细胞和试剂
六至八周龄的正常成年雄性BALB/c小鼠购自Taconic Farms(Germantown,NY)。根据动物在眼科和视觉研究中的使用(Use of Animals in Ophthalmic and Vision Research)的ARVO声明和该机构的动物护理和使用委员会(Animal Care and Use Committee)批准的方案对所有小鼠进行治疗。对于每种外科手术,使用氯胺酮、赛拉嗪和乙酰丙嗪(分别为50mg、10mg和1mg/体重kg)的混合物麻醉小鼠。根据制造商的说明书,从Lonza(Walkersville,MD)购买人新生儿初级微真皮LEC并将其维持在EGM-2MV细胞培养基(Lonza)中。基质胶、I型胶原和钙黄绿素AM购自BD Biosciences(San Jose,CA)。Mir-184模拟物和对照RNA购自Dharmacon,Inc.(Lafayette,CO)和Ambion(Austin,TX)。
角膜淋巴管生成诱导和药物干预
如前所述进行实验(Grimaldo S,Yuen D,Ecoiffier T,Chen L.Very late antigen-1mediates corneal lymphangiogenesis.Invest Ophthalmol Vis Sci 2011;52:4808-4812;Yuen D,Grimaldo S,Sessa R等人Role of angiopoietin-2in corneal lymphangiogenesis.Investigative ophthalmology&visual science 2014;55:3320-3327)。使用标准缝合线放置模型诱导角膜炎性LG。简而言之,将三根11-0尼龙缝合线(AROSurgical,Newport Beach,CA)置于角膜中央的基质中而不穿透前房。缝合线放置后的第0天和第3天将小鼠随机分组来接受结膜下注射mir-184模拟物(10μg;Dharmacon,Inc.)或对照。实验重复两次,每组共六只小鼠。
免疫荧光显微测定和淋巴管定量
如先前报道的那样进行实验(Grimaldo S,Yuen D,Ecoiffier T,Chen L.Very late antigen-1mediates corneal lymphangiogenesis.Invest Ophthalmol Vis Sci 2011;52:4808-4812;Yuen D,Grimaldo S,Sessa R等人Role of angiopoietin-2in corneal lymphangiogenesis.Investigative ophthalmology&visual science 2014;55:3320-3327)。简而言之,在缝合线放置后一周对整装角膜进行取样,并将其固定在丙酮中进行免疫荧光染色。通过纯化的兔抗小鼠LYVE-1抗体识别淋巴管,将其用Cy3-缀合的驴抗兔二抗显色。将样品用Vector Shield封固剂(Vectashield;Vector Laboratories,Burlingame,CA)覆盖。用落射荧光显微镜(AxioImager M1;Carl Zeiss AG,Germany)拍摄数字图像,并将其使用NIH ImageJ软件(由National Institutes of Health,Bethesda,MD,USA不受版权限制地提供)分析。LG覆盖区域的百分比评分是通过针对定义为100%的对照组进行归一化而获得的。使用Mann-Whitney检验分析差异,其中p<0.05为显著的。
逆转录和实时PCR
使用miRNeasy微型试剂盒(Qiagen,Valencia,CA)提取来自LEC或中央角膜上皮的总RNA。使用miScript II RT试剂盒(Qiagen)进行逆转录。使用miScript SYBR Green PCR试剂盒、用针对成熟mir-184的特异性引物、使用mir-184_1miScript Primer Assay(Qiagen)来进行实时PCR,并通过CFX96实时检测系统(Bio-Rad Herecules,CA)进行测量。根据针对RNU6B参考基因的δ-Ct归一化的靶向基因的δ-Ct(阈值循环)来计算mir-184的相对表达(Chien KH,Chen SJ,Liu JH等人Correlation between microRNA-34a levels and lens opacity severity in age-related cataracts.Eye(Lond)2013;27:883-888)。传统PCR产物也在2%琼脂糖凝胶上运行。
Mir-184在淋巴管内皮细胞中的异位表达
根据制造商的说明书用Lipofectamine RNAiMax(Invitrogen,Carlsbad,CA)进行转染。如先前报道的,在5%CO2加湿空气孵育箱中在37℃过夜转染mir-184模拟物或对照RNA(Grimaldo S,Yuen D,Ecoiffier T,Chen L.Very late antigen-1mediates corneal lymphangiogenesis.Invest Ophthalmol Vis Sci 2011;52:4808-4812)。
粘附测定
如前所述进行实验(Grimaldo S,Yuen D,Ecoiffier T,Chen L.Very late antigen-1mediates corneal lymphangiogenesis.Invest Ophthalmol Vis Sci 2011;52:4808-4812)。转染后七十二小时,将100μl细胞(3×105个细胞/ml)加入至I型胶原涂覆的96孔板中并在37℃下孵育30分钟。然后将板洗涤数次,并在室温下在汉克斯缓冲盐溶液(hanks buffered salt solution,HBSS)中用钙黄绿素(1μg/ml)孵育30分钟。用PBS洗涤板,并用Spectramax M5e微板读数器(Molecular Devices,Sunnyvale,CA)测量所结合细胞的荧光强度。测定一式三份地进行并重复至少三次。
迁移测定
转染后七十二小时,使用200μl移液器吸头在LEC单层内产生线性伤口。使用Zeiss Axio Observer A1倒置显微镜(Carl Zeiss Inc.,Germany)在时间0和29小时拍摄划痕的相位图像。为了在29小时研究结束时更好地可视化划痕区域,将细胞用结晶紫染色。使用TScratch程序(Tobias和Martin Michael Peter Schulz,Swiss Federal Institute of Technology,ETH Zurich,Zurich,Switzerland)来确定开口区域的百分比(Geback T,Schulz MM,Koumoutsakos P,Detmar M.TScratch:a novel and simple software tool for automated analysis of monolayer wound healing assays.Biotechniques 2009;46:265-274)。
管形成测定
如先前报道的,转染后七十二小时,将LEC(2×104个细胞/孔)接种到含有固化基质胶的96孔板上,并在Zeiss Axio Observer A1倒置显微镜(Carl Zeiss Inc.,Germany)下监测24小时(Grimaldo S,Yuen D,Ecoiffier T,Chen L.Very late antigen-1mediates corneal lymphangiogenesis.Invest Ophthalmol Vis Sci 2011;52:4808-4812;Yuen D,Grimaldo S,Sessa R等人Role of angiopoietin-2in corneal lymphangiogenesis.Investigative ophthalmology&visual science 2014;55:3320-3327)。拍摄管的相位图像,并通过NIH ImageJ软件分析总管长度。测定一式三份地进行并重复至少三次。
统计分析
除非另有说明,否则使用Prism软件(GraphPad,La Jolla,CA)通过学生t检验来分析平均差。当p<0.05时,治疗组与对照组之间的差异被认为具有统计学显著性。
结果
Mir-184在角膜淋巴管生成中下调
为了研究mir-184在角膜炎性LG中的作用,首先在缝合线放置和淋巴管向内生长后评估发炎角膜中mir-184的表达变化。如通过实时PCR分析的图1A所示,与正常状况相比,发炎角膜中mir-184的表达水平显著下调(*P<0.05)。该结果表明mir-184可以用作角膜LG的天然抑制剂。
mir-184的合成模拟物在体内遏制角膜淋巴管生成
为了进一步探究mir-184是否可用作角膜LG的抑制剂,使用合成的mir-184模拟物来评估mir-184施用对炎性LG的效应,所述合成的mir-184模拟物用于模拟mir-184的作用。如图1B和1C所示,来自整装角膜免疫荧光显微镜分析的结果表明,mir-184模拟物的结膜下递送显著减少了发炎角膜中的淋巴管侵袭区域(*P<0.05)。
mir-184在淋巴管内皮细胞中的体外异位表达
使用人LEC培养系统研究mir-184在体外的获得功能。为了解决这个问题,首先用mir-184模拟物转染LEC,并通过传统和实时PCR分析证实mir-184在这些细胞中的表达增强(图2)。如图2A中的琼脂糖凝胶图像所揭示的,具有mir-184模拟物的经转染的LEC显示对应于成熟mir-184的丰富PCR产物。图2B描述了实时PCR分析,其证实转染后LEC中mir-184表达显著地成倍增加(*P<0.05)。这些结果表明,该方法适合在LEC中异位表达mir-184以进行进一步的获得功能研究,如下所示。
Mir-184过表达抑制淋巴管内皮细胞粘附
粘附是LEC在淋巴管生成过程中的重要功能。确定mir-184是否在体外调控LEC粘附。用mir-184模拟物或对照RNA转染七十二小时后,对LEC进行胶原蛋白I粘附测定,如先前所报道(Grimaldo S,Yuen D,Ecoiffier T,Chen L.Very late antigen-1mediates corneal lymphangiogenesis.Invest Ophthalmol Vis Sci 2011;52:4808-4812)。这些结果显示LEC中mir-184过表达导致细胞粘附显著减少(图3A,*P<0.05),这表明mir-184在该功能中具有负向抑制作用。
Mir-184过表达减少淋巴管内皮细胞迁移
为了评估mir-184是否也参与体外LEC迁移,在用mir-184模拟物或对照RNA转染后七十二小时进行伤口愈合划痕测定。如图3B和3C所示,mir-184转染的细胞显示较大开口区域的伤口闭合速率显著降低(*P<0.05)。这些结果表明mir-184也负向调控LEC迁移。
Mir-184过表达遏制淋巴管内皮细胞管形成
检查了mir-184过表达对LEC使用三维(3D)培养系统组织成毛细管型管的能力的作用。用mir-184模拟物或对照RNA转染后七十二小时,将LEC接种在基质胶(基膜基质)上并观察24小时。如图4A和4B所示,mir-184异位表达揭示了总小管长度显著减小(*P<0.05),从而证实mir-184在这种重要的LEC功能中的体外抑制作用。
讨论
概括地说,这项工作提供了mir-184负向调控LG过程的第一个证据。报道了两个重要发现:1)在角膜炎性LG中mir-184表达显著下调;和2)mir-184模拟物可用于在体内遏制角膜LG和在体外遏制LEC功能。总之,本研究不仅揭示了mir-184作为LG的遏制剂,而且还提出将mir-184模拟物用作LG疗法的新策略。
Mir-184在角膜、脑和睾丸中具有限制性表达谱(Ryan DG,Oliveira-Fernandes M,Lavker RM.MicroRNAs of the mammalian eye display distinct and overlapping tissue specificity.Mol Vis 2006;12:1175-1184;Karali M,Peluso I,Marigo V,Banfi S.Identification and characterization of microRNAs expressed in the mouse eye.Invest Ophthalmol Vis Sci 2007;48:509-515;Nomura T,Kimura M,Horii T等人MeCP2-dependent repression of an imprinted miR-184released by depolarization.Hum Mol Genet 2008;17:1192-1199)。先前报道的微阵列分析显示它是角膜上皮中表达最丰富的微RNA之一(Ryan DG,Oliveira-Fernandes M,Lavker RM.MicroRNAs of the mammalian eye display distinct and overlapping tissue specificity.Mol Vis 2006;12:1175-1184)。在目前的研究中,显示mir-184在角膜炎性LG期间显著下调;并且高度表明这种微RNA可以在正常条件下用作保持角膜的无淋巴管状态。与此推测相关的是额外的数据显示,将mir-184重新引入角膜遏制淋巴管形成。作为免疫赦免组织,角膜已经形成在正常条件下主动维持其无淋巴管状态的机制,这些机制尚未被充分研究和理解。近来,据报道,可溶性VEGFR-2由角膜上皮分泌并起到遏制LG的作用(Albuquerque RJ,Hayashi T,Cho WG等人Alternatively spliced vascular endothelial growth factor receptor-2is an essential endogenous inhibitor of lymphatic vessel growth.Nature medicine 2009;15:1023-1030)。本研究不仅揭示了mir-184作为LG的新抑制剂,而且还表明多种机制和因素参与维持角膜的无淋巴管状态。
已知Mir-184突变导致圆锥形角膜中的角膜病变和EDICT综合征(Hughes AE,Bradley DT,Campbell M等人Mutation altering the miR-184seed region causes familial keratoconus with cataract.Am J Hum Genet 2011;89:628-633;Iliff BW,Riazuddin SA,Gottsch JD.A single-base substitution in the seed region of miR-184causes EDICT syndrome.Investigative ophthalmology&visual science 2012;53:348-353)。迄今为止,尚未有研究将mir-184与角膜病理性LG联系起来。先前有报道,mir-184参与局部缺血诱导的视网膜血管生成,并且mir-184介导的血管生成的下游靶标是Wnt-受体卷曲蛋白7(Fzd7)和血管内皮生长因子-A(VEGF-A)(Shen J,Yang X,Xie B,等人MicroRNAs regulate ocular neovascularization.Mol Ther 2008;16:1208-1216;Takahashi Y,Chen Q,Rajala RV,Ma JX.MicroRNA-184modulates canonical Wnt signaling through the regulation of frizzled-7expression in the retina with ischemia-induced neovascularization.FEBS Lett 2015;589:1143-1149)。在本研究中,没有检测到与mir-184模拟物治疗LG一样的角膜血管生成的显著变化。
对角膜LG的机制研的研究具有广泛的意义。使用合成的微RNA模拟物作为治疗剂(也被称为“微RNA替代疗法”),已经成为用于疾病治疗的有前景的方法,并且已经在癌症疗法中获得了广泛关注(Bader AG,Brown D,Winkler M.The promise of microRNA replacement therapy.Cancer Res 2010;70:7027-7030)。微RNA替代疗法的重点是重新引入微RNA以恢复功能缺失。在此研究中,使用体内鼠LG模型和体外人原代LEC培养系统,针对LG干预采用类似的治疗方法,使得mir-184用于治疗眼睛的淋巴管相关疾病。
所有出版物,专利和专利申请均以引用的方式并入本文。虽然在前述说明书中已经关于本发明的某些实施方案描述了本发明,并且为了说明的目的已经阐述了许多细节,但对于本领域技术人员而言显而易见的是,在不脱离本发明的基本原理的情况下,本发明容易具有另外的实施方案并且本文所述的某些细节可发生相当大的变化。
在描述本发明的上下文中,术语“一个/种(a/an)”和“所述”以及类似指代物的使用意图解释为涵盖单数和复数两者,除非在本文另外地指示或明显地与上下文矛盾。除非另有说明,否则术语“包含”、“具有”、“包括”和“含有”将被解释为开放式术语(即,意味着“包括但不限于”)。本文中值的范围的描述仅旨在用作单独地参考落在该范围内的每个单独值的速记方法,除非本文另有说明,并且将每个单独的值并入本说明书中,如同在本文中单独列举一样。除非本文另外指明或以其他方式与上下文明显矛盾,否则可按任何合适的顺序来执行本文所述的所有方法。除非另有说明,否则本文所提供的任何和所有实例或示例性语言(例如“例如”)的使用仅旨在更好地阐明本发明,并且不对本发明的范围构成限制。本说明书中的语言不应解释为将任何非要求的元素指示为实践本发明所必需。
本文描述了本发明的实施方案,包括本发明人已知用于执行本发明的最佳模式。在阅读前面的描述之后,这些实施例的变化对于本领域普通技术人员来说可能变得显而易见。本发明人期望本领域技术人员视情况采用此类变化,并且本发明人打算以不同于本文具体描述的方式实践本发明。因此,本发明包括适用法律所容许的所附权利要求书中叙述的主题的所有修改和等效案。而且,在其所有可能的变更中,上述要素的任何组合均由本发明涵盖,除非本文另外指出或与上下文明显矛盾。
- 还没有人留言评论。精彩留言会获得点赞!