一种基于RbsB信号肽的双功能DNA元件及其应用的制作方法
本发明涉及分子生物学领域,更特别地涉及一种基于RbsB信号肽的双功能DNA元件及其应用,以及包括该双功能DNA元件的双启动子DNA元件和蛋白表达系统。
背景技术:
大肠杆菌是基因工程蛋白表达的常用菌之一。大肠杆菌具有极快的增殖速度和高效的转录、翻译能力,能够在短时间内合成大量外源蛋白。目前多数基因工程蛋白表达系统都是将外源蛋白表达在大肠杆菌的细胞质里。如果所表达的蛋白质具有良好的可溶性和稳定性,一般工程菌在几个小时内就能生产出与它们自身蛋白总量相当的外源蛋白。
虽然把外源蛋白表达在细菌的细胞质里能获得极高的产量,但这种方法也存在缺点。一个问题是外源蛋白合成后必须在细菌的伴侣蛋白协助下才能折叠成构像正确、溶解性好、具有活力的蛋白,而细胞质里的伴侣蛋白是有限的,所以一旦所表达的外源蛋白不容易折叠,而细菌又不能提供足够的伴侣蛋白进行协助时,那些折叠不正确的蛋白就会聚结在一起,在细胞质里形成不溶性的包涵体。另一个问题是细菌的细胞质是一个还原性的环境,不利于二硫键的形成,因此表达含有二硫键的外源蛋白时成功率很低。
除了细胞质,目前也有表达系统能在外源蛋白的N-端加上信号肽,将新合成的蛋白转运到大肠杆菌细胞壁和细胞膜之间的空隙里,然后折叠成具有活力的蛋白。这个空隙,称周质空间(Periplasm),是一个氧化性较强的环境,能促进二硫键的形成,对含有二硫键的外源蛋白表达比较有利。另一方面,细菌也有限制周质空间蛋白合成速度的机制,能大幅度降低带有信号肽的外源蛋白合成,避免无法正确折叠的外源蛋白在周质空间形成不溶性的包涵体。因此,虽然周质空间表达系统所表达的蛋白水平较低,但比较容易形成正确的三维构像。
由于细胞质和周质空间表达系统各有利弊,人们在表达外源蛋白时往往都需要分别尝试,然后决定采用哪一条途径。目前这两种表达系统的质粒载体并不兼容。以Merck Sigma公司(原EMD Millipore公司)的pET系列表达载体为例,其中pET23、pET28是细胞质表达载体,而pET22是周质空间表达载体。这些载体里,控制外源基因表达的都是T7启动子。将克隆有外源基因的表达载体转化到含有T7RNA聚合酶(T7RNA Polymerase,简称T7RNP)基因的菌株,如BL21(DE3)里,可以通过在菌液里加入IPTG诱导T7RNP的表达,从而激活载体中的T7启动子,导致外源基因的表达。这些载体的差别在于pET22载体的外源基因上游含有编码细菌pelB蛋白的信号肽序列,而pET23、pET28载体里没有。这一差别决定了所表达外源蛋白的最终定位在周质空间还是细胞质。
虽然建立一种既可以将外源蛋白表达在细胞质,也可以转运到周质空间的细菌表达载体能明显降低蛋白表达中条件优化阶段的工作量,但目前还没有成功的例子。其难度在于周质空间表达载体必须含有信号肽编码序列,而且该序列必须设计在外源基因的上游才能起作用,但这种安排也使该表达载体很难被用来表达不含有信号肽、在细胞质里积累的外源蛋白。
技术实现要素:
发明人在研究过程中,通过突变大肠杆菌核糖结合蛋白(Ribose-binding Protein,简称RbsB)基因的信号肽编码区域,获得了含有T7启动子的嵌合信号肽编码序列(简称T7SP)。这个特殊的T7SP序列不仅能编码具有正常功能的信号肽,同时也是T7启动子,能被T7RNA聚合酶(T7RNP)所识别,激活下游基因的转录表达。
基于以上研究,本发明提供了一种基于RbsB信号肽的双功能DNA元件,其序列如SEQ ID NO:1所示,或者其序列为SEQ ID NO:1所示序列的同义突变体,并且所述同义突变体的第16-36位核苷酸未发生突变。
本发明还提供了上述双功能DNA元件在启动基因转录中的应用。
本发明还提供了上述双功能DNA元件在编码带有信号肽的蛋白质中的应用。
本发明还提供了一种双启动子DNA元件,其包括上述双功能DNA元件以及连接在所述双功能DNA元件上游的大肠杆菌启动子。
优选地,所述大肠杆菌启动子为可诱导启动子。
优选地,所述可诱导启动子为非IPTG可诱导启动子。
优选地,所述非IPTG可诱导启动子为四环素启动子,所述四环素启动子的序列如SEQ ID NO:2所示。
本发明还提供了一种蛋白表达系统,其包括上述双启动子DNA元件和蛋白编码序列。
优选地,所述蛋白编码序列为未确知是否需要在周质空间中进行折叠的蛋白质。
通过将本发明的双功能DNA元件与待研究的外源基因编码序列连接,形成融合基因,并将该融合基因的上游安置一个大肠杆菌的诱导型启动子,如四环素启动子,即可通过激活该启动子,转录产生含有全长信号肽序列的外源基因mRNA,从而表达带有信号肽的外源蛋白质,积累在大肠杆菌的周质空间。而另一方面,通过激活T7SP编码序列中的T7启动子,该DNA构建体又能转录产生只含有T7SP 3’端序列的外源基因mRNA,并以T7SP序列末端的AUG密码子作为翻译起始位点,表达不含信号肽的外源蛋白质,积累在大肠杆菌的细胞质。该DNA构建体使研究人员能通过构建一种表达载体,而不需要分别构建细胞质和周质空间表达载体,就能比较两种表达方式的优劣。
附图说明
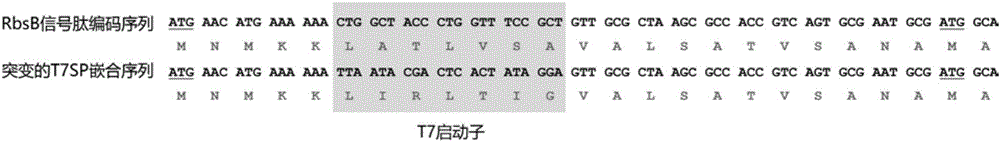
图1为T7SP嵌合信号肽与野生型RbsB信号肽的DNA序列和氨基酸序列的比较;
图2为由T7SP和四环素启动子PTetB、GFP纳米抗体基因序列所组成的双启动子蛋白表达系统结构示意图;
图3为pACYC-TetR-PTetB-T7SP-GFPNb载体和pACYC-TetR-PTetB-SP(WT)-GFPNb载体经去水四环素(ATc)诱导表达后的蛋白电泳分析结果;
图4为pACYC-TetR-PTetB-T7SP-GFPNb载体和pACYC-TetR-PTetB-SP(WT)-GFPNb载体经IPTG诱导表达后的蛋白电泳分析结果;
图5为pACYC-TetR-PTetB-T7SP-GFPNb载体与常用的细胞质、周质空间表达载体经去水四环素(ATc)诱导表达后的蛋白电泳分析结果;
图6为pACYC-TetR-PTetB-T7SP-GFPNb载体与常用的细胞质、周质空间表达载体经IPTG诱导表达后的蛋白电泳分析结果。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
1.双功能元件T7SP的构建
本发明的工作基于对RbsB信号肽序列的研究。如图1所示,发明人在将野生型RbsB信号肽序列中的第16-36位核苷酸突变成T7启动子序列,得到双功能元件T7SP,其序列如SEQ ID NO:1所示。
2.双启动子蛋白表达系统的构建
将T7SP编码序列的上游配置一个大肠杆菌诱导型启动子,而在其下游融合所需表达的外源基因,可形成一个双启动子的蛋白表达系统。在此处,以联合使用T7SP和四环素启动子PTetB(SEQ ID NO:2)表达GFP的纳米抗体(GFPNb)(SEQ ID NO:3)为例,说明双启动子蛋白表达系统的构建过程。首先通过DNA合成,获得含有T7SP序列的双链DNA片段,克隆到pACYC-TetR载体的EcoRI和SpeI酶切位点之间,获得pACYC-TetR-T7SP。其中TetR基因可表达四环素抑制蛋白(Tetracycline Repressor Protein,简称TetR),抑制四环素启动子的表达。然后通过PCR扩增GFPNb基因序列,克隆到T7SP序列3’端的SpeI和HindIII酶切位点之间,与T7SP形成融合基因。最后通过PCR扩增大肠杆菌TetB基因中的四环素启动子(PTetB)序列,克隆到T7SP上游的XbaI和EcoRI酶切位点之间,得到pACYC-TetR-PTetB-T7SP-GFPNb载体(图2)。将该载体转化到携带T7 RNA聚合酶基因的蛋白表达菌株,如BL21(DE3)、Shuffle T7 Express、Origami(DE3)中,可用四环素类似物ATc抑制TetR,激活PTetB启动子,转录产生含有全长T7SP-GFPNb编码序列的mRNA,从而表达含有信号肽的GFPNb蛋白,并转运到细菌的周质空间里;而用IPTG诱导细菌合成T7 RNA聚合酶,可启动T7SP序列中的T7启动子,所产生的mRNA虽然含有全长的GFPNb编码序列,但只含有T7SP中的第37-75位核苷酸序列,从而以T7SP末端的AUG(对应于T7SP DNA序列中的第70-72位核苷酸ATG)作为翻译起始密码子,表达不含信号肽的GFPNb蛋白,分布在细胞质里。
3.结果验证
1)T7SP嵌合信号肽序列与野生型RbsB信号肽序列的功能比较
为了验证该双启动子表达系统的有效性,发明人构建了pACYC-TetR- PTetB-T7SP-GFPNb双启动子蛋白表达载体,如上述具体实施方式2。
用野生型的RbsB信号肽序列代替pACYC-TetR-PTetB-T7SP-GFPNb中的T7SP序列,得到pACYC-TetR-PTetB-SP(WT)-GFPNb载体,作为对照。
分别将以上两载体转化到BL21(DE3)菌株中,挑取单菌落,接种到含有34μg/ml氯霉素的LB液体培养基中,37℃培养。当OD600达到0.6时,用两种不同方法进行蛋白表达诱导:A.用20ng/ml ATc诱导表达12小时,提取周质空间蛋白,然后用镍离子柱纯化GFPNb;B.用1mM IPTG诱导表达4小时,然后超声破碎细胞,提取细胞质蛋白,然后用镍离子柱纯化GFPNb。
结果如图3和4所示,当用ATc诱导时,两种载体都能在周质空间表达GFPNb,而且表达水平相近;而当用IPTG诱导时,pACYC-TetR-PTetB-T7SP-GFPNb载体能在细胞质表达GFPNb,而pACYC-TetR-PTetB-SP(WT)-GFPNb载体不能。因此,T7SP DNA序列不仅具有正常的信号肽编码功能,而且也能具有T7启动子功能,能被T7RNA聚合酶激活,表达下游外源基因。
2)用双启动子表达系统与常用pET载体进行GFPNb表达、纯化的结果比较。
将GFPNb基因克隆到目前常用的周质空间表达载体pET22b和细胞质表达载体pET28b中,分别得到pET22b-GFPNb和pET28b-GFPNb载体;将它们和pACYC-TetR-PTetB-T7SP-GFPNb载体一起分别转化到蛋白表达菌株BL21(DE3)中。
挑取pACYC-TetR-PTetB-T7SP-GFPNb克隆,接种到含有34μg/ml氯霉素的LB培养基中;挑取pET22b-GFPNb、pET28b-GFPNb克隆,接种到含有50μg/ml卡那霉素的LB培养基中。将各菌株置于37℃培养,当OD600达到0.6时,用两种不同方法进行诱导:A.用20ng/ml ATc诱导表达12小时,提取周质空间蛋白;B.用1mM IPTG诱导表达4小时,然后超声破碎细胞,提取细胞质蛋白。分别用SDS-PAGE分离和考马斯亮蓝染色检测GFPNb表达情况。
结果如图5和6所示,当用ATc诱导时,含有pACYC-TetR-PTetB-T7SP-GFPNb的细菌在周质空间表达GFPNb,而含有pET22b-GFPNb和pET28b-GFPNb的细菌不表达GFPNb。当用IPTG诱导时,含有pACYC-TetR-PTetB-T7SP-GFPNb的细菌能在细胞质中表达GFPNb,而含有pET22b-GFPNb和pET28b-GFPNb的细菌分别在周质空间和细胞质表达GFPNb。因此通过使用不同诱导剂,pACYC-TetR-PTetB-T7SP-GFPNb能分别在细菌周质空间和细胞质表达GFPNb,功能上替代pET22b-GFPNb和pET28b-GFPNb表达载体。
虽然以上实施例中以四环素启动子和GFP纳米抗体基因为例子,但是本发明的保护范围不应受限于此。本领域技术人员可知道,将T7SP编码序列与任何其它大肠杆菌诱导型启动子以及GFP纳米抗体基因以外的其它基因联合使用,都能构建形成所用基因的双功能表达系统。因此凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 成都分子脉象生物科技有限公司
<120> 一种基于RbsB信号肽的双功能DNA元件及其应用
<130> 1
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 75
<212> DNA
<213> 人工序列
<400> 1
atgaacatga aaaaattaat acgactcact ataggagttg cgctaagcgc caccgtcagt 60
gcgaatgcga tggct 75
<210> 2
<211> 113
<212> DNA
<213> 人工序列
<400> 2
atgattaatt cctaattttt gttgacactc tatcattgat agagttattt taccactccc 60
tatcagtgat agagaaaagt gaaatgaata gttcgacaag aaggagatat acc 113
<210> 3
<211> 390
<212> DNA
<213> 人工序列
<400> 3
gcgcaggttc aactggtcga atcgggtggt gccctggttc agccgggtgg ctctctgcgt 60
ctgagctgcg cggcgagctc gagcgatttt tcgcgtaatg ccattggttg gtttcgccag 120
gccccgggta aagaacgcga aggtgtgtcg tgtattaact ggaccggttc tggctacgcg 180
tatgcagact ccgtgaaggg tcgctttacc atttcgcgtg atgacgcacg caacacggtg 240
tacctgcaac tgaatagtct gaaaccggaa gataccgcgg tgtactattg ccatggctcg 300
accgtttttg cggaaattac gggtctggca ggttatcaat cgggtagcta tgagatctgg 360
ggccagggca cccaggtcac ggtgtcgtcc 390
- 还没有人留言评论。精彩留言会获得点赞!