一种以苯硼酸、胺与多聚甲醛合成曼尼希碱和苯并噁嗪衍生物的方法与流程
本发明属于曼尼希碱和苯并噁嗪衍生物的合成领域,具体涉及一种以苯硼酸、胺与多聚甲醛合成曼尼希碱和苯并噁嗪衍生物的方法。
背景技术:
曼尼希碱(mannichbases)及其衍生物是一类重要的含氮化合物,具有潜在的生物活性,可以广泛被应用于医药、炸药、缓蚀剂、推进剂、油品添加剂等领域,同时也是很多有机合成及天然产物合成的中间体。
专利文献cn1761715a公布了一种新型的可以作为固化剂作用在双组份环氧树脂和聚氨酯组合物中曼尼希碱,同时发现一种制备曼尼希碱的两步制备方法。首先将至少一种酚类化合物与甲醛一起在叔胺存在下进行反应;然后在随后的步骤中与至少一种多胺反应。
专利文献cn101717320a公布了一种以三组分醛、胺、酮或者萘酚为原料,以水为溶剂,使用液体超强酸为催化剂来合成曼尼希碱的方法。
苯并噁嗪及衍生物是一种重要的含氮杂环类化合物,也是一类新型的酚醛树脂,具有良好的热稳定性、阻燃性、机械性能,被广泛应用于开环聚合等反应中。
专利文献cn104177579a公布了一种以酚类、胺类化合物、甲醛水溶液或多聚甲醛为反应起始原料,获得较高产率且可直接应用于制造层压饭的产品。但步骤较多,对温度控制有一定要求。
上述技术方法有其优势,也有不足。我们希望寻求一种相对简便的、易操作、一锅煮、一步合成的方式。而以相对稳定的固体苯硼酸为原料,三组分一锅法合成曼尼希碱或者苯并噁嗪还未见报道。
技术实现要素:
本发明的目的在于克服现有技术不足,提供一种以苯硼酸、胺与多聚甲醛合成曼尼希碱和苯并噁嗪衍生物的方法。
本发明以对湿度和空气更稳定的苯硼酸及其衍生物为起始原料,一锅法、一步合成曼尼希碱与苯并噁嗪及其衍生物,具有产率较高、时间短、易于操作和实现等特点。
本发明采用以下技术方案。
一种以苯硼酸、胺与多聚甲醛合成曼尼希碱和苯并噁嗪衍生物的方法,包括以下步骤:
(1)在反应装置中依次加入苯硼酸、多聚甲醛、碱、胺、氧化剂和溶剂;
(2)搅拌下反应;
(3)反应完成后,对反应液进行减压蒸馏、有机溶剂萃取,得到曼尼希碱或苯并噁嗪衍生物。
优选的,所述苯硼酸为苯硼酸或苯硼酸衍生物。
优选的,所述苯硼酸衍生物为邻甲基苯硼酸、间甲基苯硼酸、对甲基苯硼酸、对乙基苯硼酸、对正丙基苯硼酸、对异丙基苯硼酸、对氟苯硼酸、对氯苯硼酸、对溴苯硼酸、对三氟甲基苯硼酸、间氯苯硼酸或对乙酰基苯硼酸。
优选的,该方法选择性合成曼尼希碱和苯并噁嗪衍生物;当反应合成曼尼希碱时,反应的胺为二级胺;当反应合成苯并噁嗪或苯并噁嗪衍生物时,反应的胺为一级胺。
优选的,反应合成苯并噁嗪或苯并噁嗪衍生物时,所加的碱为k2co3。
优选的,步骤(1)所述氧化剂为过氧化叔丁醇或双氧水。
优选的,步骤(1)所述溶剂为二氯甲烷、苯、乙醇、二甲基亚砜、n,n-二甲基甲酰胺、乙腈或水。
优选的,步骤(1)所述苯硼酸、多聚甲醛、胺的摩尔比为1:1:1;氧化剂、苯硼酸的摩尔比为3:1,当反应合成苯并噁嗪或苯并噁嗪衍生物时,所加碱、苯硼酸的摩尔比为4:1。
优选的,步骤(2)所述反应的温度为25-80℃,进一步优选为40-80℃,最优选为80℃。
优选的,步骤(2)所述反应的时间为6-10h,进一步优选为8h。
优选的,本发明的原理如下式所示:
结构式中,r、r1、r2可以为烷基、芳基或包括含有氧的杂环基。
与现有技术相比,本发明具有如下优点与技术效果:
1、本发明以化学性质相对更稳定、更易于操作的苯硼酸替代苯酚原料,无需额外添加任何酸性物质,一锅法、一步合成曼尼希碱与苯并噁嗪及其衍生物。
2、本发明为曼尼希碱和苯并噁嗪衍生物的合成提供了一条简单、产率较高、时间短、选择性好、易于实现、有价值的途径。
附图说明
图1为实施例1制备的2-吗啉甲基-酚的1h-nmr图谱。
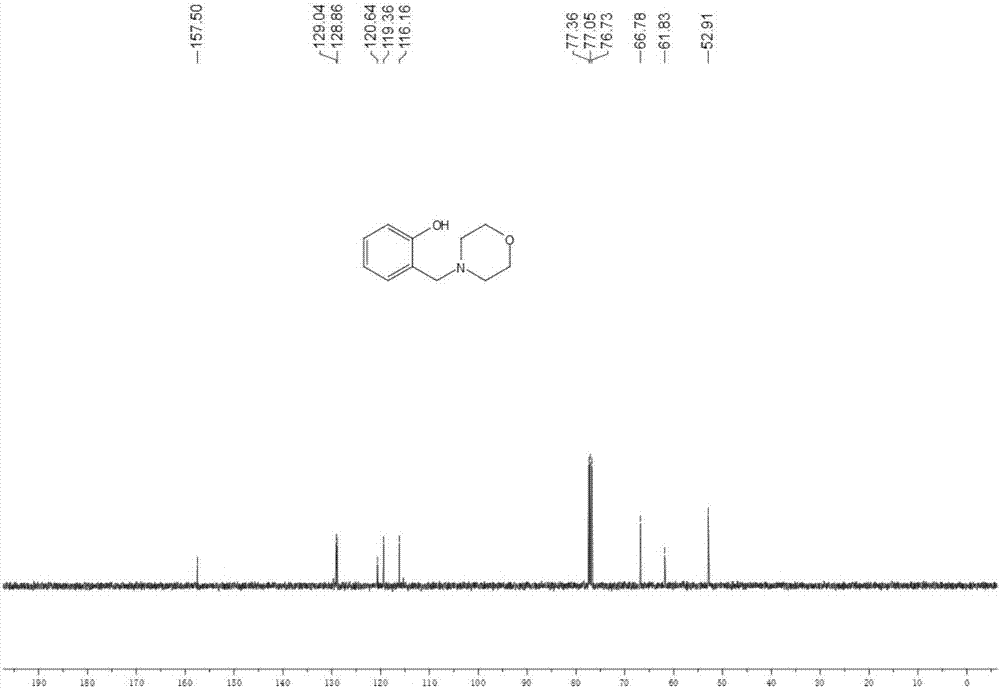
图2为实施例1制备的2-吗啉甲基-酚的13c-nmr图谱。
图3为实施例12制备的4-甲基2-吗啉甲基-酚的1h-nmr图谱。
图4为实施例12制备的4-甲基2-吗啉甲基-酚的13c-nmr图谱。
图5为实施例13制备的4-氯2-吗啉甲基-酚的1h-nmr图谱。
图6为实施例13制备的4-氯2-吗啉甲基-酚的13c-nmr图谱。
图7为实施例14制备的2-二丙胺甲基-酚的1h-nmr图谱。
图8为实施例14制备的2-二丙胺甲基-酚的13c-nmr图谱。
图9为实施例15制备的3-四氢呋喃-2-亚甲基-3,4-二氢-2h-苯并噁嗪的1h-nmr图谱。
图10为实施例15制备的3-四氢呋喃-2-亚甲基-3,4-二氢-2h-苯并噁嗪的13c-nmr图谱。
图11为实施例16制备的3-对甲苯基-3,4二氢-2h-苯并噁嗪的1h-nmr图谱。
图12为实施例16制备的3-对甲苯基-3,4二氢-2h-苯并噁嗪的13c-nmr图谱。
图13为实施例17制备的3-丙基-3,4-二氢-2h-苯并噁嗪的1h-nmr图谱。
图14为实施例17制备的3-丙基-3,4-二氢-2h-苯并噁嗪的13c-nmr图谱。
具体实施方式
以下结合实施例对本发明作进一步说明,但本发明要求保护的范围并不限于此。
实施例1
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在80℃的油浴锅中反应8h;反应结束后,冷却至室温,将所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为98%。1hnmr(400mhz,cdcl3):δ7.18(t,j=8.4hz,1h),6.98(d,j=7.2hz,1h),6.78-6.84(m,2h),3.71-3.76(m,4h),3.71(s,2h),2.57(s,4h).13cnmr(100mhz,cdcl3):δ157.5,129.0,128.9,120.6,119.4,116.2,66.8,61.8,52.9。本实施例制备的2-吗啉甲基-酚的1hnmr、13cnmr图谱见图1、图2。
实施例2
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化氢、2ml的二氯甲烷、磁力搅拌子,在80℃的油浴锅中反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为78%。
实施例3
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在80℃的油浴锅中反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为92%。
实施例4
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、0.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在80℃的油浴锅中反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为59%。
实施例5
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在60℃的油浴锅中反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为81%。
实施例6
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在40℃的油浴锅中反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为77%。
实施例7
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的苯、磁力搅拌子,在80℃的油浴锅中反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为96%。
实施例8
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的二甲基亚砜、磁力搅拌子,在80℃的油浴锅中反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为84%。
实施例9
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的水、磁力搅拌子,在80℃的油浴锅中反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为55%。
实施例10
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在80℃的油浴锅中反应6h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为89%。
实施例11
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在80℃的油浴锅中反应10h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。2-吗啉甲基-酚的产率为98.5%。
实施例12
在20ml的反应器中,一次性加入0.5mmol的对甲基苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在室温下反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物4-甲基2-吗啉甲基-酚。
所得产品结构由1hnmr、13cnmr和gc-ms确定。4-甲基2-吗啉甲基-酚的产率为93%。1hnmr(400mhz,cdcl3):δ9.30(s,1h),6.96(dd,j=8.2,1.7hz,1h),6.77(d,j=1.3hz,1h),6.71(d,j=8.2hz,1h),3.72(t,j=4.5hz,4h),3.63(s,2h),2.53(s,4h),2.22(s,3h).13cnmr(100mhz,cdcl3):δ154.9,129.2,128.2,120.2,115.7,115.0,66.6,61.7,52.8,20.3。本实施例制备的4-甲基2-吗啉甲基-酚的1hnmr、13cnmr图谱见图3、图4。
实施例13
在20ml的反应器中,一次性加入0.5mmol的对氯苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的吗啉、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在室温下反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物4-氯2-吗啉甲基-酚。
所得产品的结构由1hnmr、13cnmr和gc-ms确定。4-氯2-吗啉甲基-酚的产率为83%。1hnmr(400mhz,cdcl3):δ7.15-7.11(m,1h),6.96(d,j=2.3hz,1h),6.75(t,j=4.4hz,1h),3.75(d,j=4.1hz,4h),3.66(s,2h),2.56(s,4h);13cnmr(100mhz,cdcl3):δ156.1,128.8,128.5,123.8,122.0,117.4,66.6,61.3,52.8。本实施例制备的4-氯2-吗啉甲基-酚的1hnmr、13cnmr图谱见图5、图6。
实施例14
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、0.5mmol的二丙胺、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在室温下反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物2-二丙胺甲基-酚。
所得产品的结构由1hnmr、13cnmr和gc-ms确定。2-二丙胺甲基-酚的产率为83%。1hnmr(400mhz,cdcl3):δ10.06(s,1h),7.14(td,j=8.0,1.6hz,1h),6.95(d,j=7.3hz,1h),6.77(m,2h),3.75(s,2h),2.47(dd,j=9.6,5.7hz,4h),1.61-1.51(m,4h),0.89(t,j=7.4hz,6h).13cnmr(100mhz,cdcl3):δ158.1,128.4,128.3,122.2,118.8,116.0,58.2,55.3,19.4,11.7。本实施例制备的2-二丙胺甲基-酚的1hnmr、13cnmr图谱见图7、图8。
实施例15
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、2mmolk2co3、0.5mmol的四氢糠胺、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在室温下反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物3-四氢呋喃-2-亚甲基-3,4-二氢-2h-苯并噁嗪。
所得产品的结构由1hnmr、13cnmr和gc-ms确定。3-四氢呋喃-2-亚甲基-3,4-二氢-2h-苯并噁嗪的分离产率为75%。1hnmr(400mhz,cdcl3):δ7.08-7.17(m,1h),6.96(dd,j=17.2,7.0hz,1h),6.85(td,j=7.4,1.0hz,1h),6.76(dd,j=10.5,4.5hz,1h),4.89-4.94(m,2h),3.96-4.13(m,3h),3.71-3.92(m,2h),2.89(dd,j=13.5,3.5hz,1h),2.78(dd,j=13.5,8.2hz,1h),1.46-2.00(m,4h).13cnmr(100mhz,cdcl3):δ154.1,127.6,127.5,120.4,120.2,116.3,83.2,77.6,68.0,55.9,50.9,29.6,25.4。本实施例制备的3-四氢呋喃-2-亚甲基-3,4-二氢-2h-苯并噁嗪的1hnmr、13cnmr图谱见图9、图10。
实施例16
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、2mmolk2co3、0.5mmol的对甲基苯胺、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在室温下反应8h;反应结束后,冷却至室温,,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物3-对甲苯基-3,4二氢-2h-苯并噁嗪。
所得产品的结构由1hnmr、13cnmr和gc-ms确定。3-对甲苯基-3,4-2h-苯并噁嗪的分离产率为71%。1hnmr(400mhz,cdcl3):δ7.04(qd,j=16.2,7.6hz,6h),6.85(dd,j=10.7,4.1hz,1h),6.76(dd,j=18.5,8.3hz,1h),5.30(s,2h),4.57(s,2h),2.25(d,j=6.6hz,3h).13cnmr(100mhz,cdcl3):δ154.4,146.1,131.0,129.8,127.8,126.7,120.9,120.7,118.6,116.9,79.9,50.6,20.5。本实施例制备的3-对甲苯基-3,4二氢-2h-苯并噁嗪的1hnmr、13cnmr图谱见图11、图12。
实施例17
在20ml的反应器中,一次性加入0.5mmol的苯硼酸、0.5mmol的多聚甲醛(聚合度为3)、2mmolk2co3、0.5mmol的正丙胺、1.5mmol的过氧化叔丁醇、2ml的二氯甲烷、磁力搅拌子,在室温下反应8h;反应结束后,冷却至室温,所得反应液减压下蒸馏,然后用乙醚萃取三次,乙醚挥发后得到目标产物3-丙基-3,4-二氢-2h-苯并噁嗪。
所得产品的结构由1hnmr、13cnmr和gc-ms确定。3-丙基-3,4-二氢-2h-苯并噁嗪的分离产率为78%。
1hnmr(400mhz,cdcl3):δ7.10(t,j=7.5hz,1h),6.93(d,j=7.3hz,1h),6.84(t,j=7.4hz,1h),6.76(d,j=8.2hz,1h),4.85(s,2h),3.97(s,2h),2.68-2.72(m,2h),1.58(dd,j=14.8,7.4hz,2h),0.92(dd,j=9.8,4.9hz,3h).13cnmr(100mhz,cdcl3):δ154.2,127.5,127.5,120.4,120.3,116.3,82.4,53.2,50.2,21.2,11.6。本实施例制备的3-丙基-3,4-二氢-2h-苯并噁嗪的1hnmr、13cnmr图谱见图13、图14。
- 还没有人留言评论。精彩留言会获得点赞!