一种基于微滴式数字PCR的牛、猪源性成分定量检测方法、引物和探针及试剂盒与流程
本发明涉及分子生物学领域,具体来说是一种利用微滴式数字PCR技术对牛、猪源性成分进行定量检测的方法,以及在该方法中用到的引物和探针组合、相应的试剂盒。
背景技术:
近年来,遭到媒体曝光的阿胶不含驴皮成分,假牛肉,假猪蹄,用鸭肉制成涮羊肉和烤串,花旗参里掺萝卜干,山寨蜂胶,假鱼丸、假燕窝、假虫草等掺假售假事件,涉及集贸市场、餐饮饭馆,乃至深受消费者信赖的知名超市以及各大电商平台。面对这些真假难辨的食品和保健品,消费者总是一筹莫展。该如何鉴别这些商品是否掺假或假冒已成为食品安全监管和检测机构迫切需要解决的问题。事实上,相关的检测并不困难,利用DNA检测技术鉴别动、植物源性成分早已应用于物种资源的鉴定工作中。
针对市面上掺杂、掺假牛肉普遍的现象,经过调查分析我们发现,牛肉制品中最普遍的掺假成分是猪肉,因为猪肉成本低廉,并且容易获得。
目前常用的DNA检测手段是PCR(聚合酶链式反应)技术。不同的动、植物DNA都具有唯一性,根据这一特性采用PCR技术对相应物种的DNA进行特异性扩增,可迅速准确地鉴定产品中是否含有其他外源性成分。但是同时存在一个问题,由于PCR技术非常灵敏,尤其是实时荧光PCR,这样就有可能在加工过程被污染了其他动物成分,或用的调味料中带进了其他成分,从而造成误判的情况发生,因此有必要针对此类样品开发定量检测方法。
微滴式数字PCR(droplet digital polymerase chain reaction,ddPCR)作为DNA定量的新技术,克服了实时荧光定量PCR(real time quantitative PCR,qPCR)的一系列缺点,实现了单分子DNA的绝对定量。该技术是潜在的核酸测量基准方法,并从原理上为核酸计量提供了保证。相比其他方法,ddPCR作为绝对定量方法能准确定量目标DNA和提供可靠的定量数据。
qPCR是目前DNA定量研究的主要技术,该技术通过在PCR反应体系中加入荧光结合染料(SYBR green I)或荧光标记的探针(如TaqMan Probes),利用实时积累的荧光信号监测整个扩增过程,最后通过标准曲线对未知模板进行定量分析,以此来评估PCR的扩增效果。qPCR主要依赖于校准物制备的标准曲线,进而确定未知样品的浓度或含量,因此是一种相对定量的方法。该技术存在以下问题:(1)校准品和样品间背景的不同将引入偏差,并且影响PCR的效率和测量响应;(2)低拷贝数的目标DNA分子可能通过扩增检测不到;(3)样品的PCR扩增效率可能与校准物的扩增效率存在差异;(4)DNA提取时引入DNA溶液的杂质或者DNA的降解影响了PCR动态扩增过程。
ddPCR不同于传统的qPCR,因为其采用直接计数目标DNA分子数而不依赖任何校准物或外标,ddPCR通过计数单个分子从而实现绝对定量。ddPCR将传统PCR的指数数据转换成数字信号,仅仅通过程序设定的循环数后显示扩增是否发生,克服了qPCR的缺点,达到核酸的绝对定量。ddPCR在进行扩增反应前,将含有DNA模板的PCR体系分布到大量的独立反应单元,单分子间通过稀释分离,并且独自进行PCR扩增,最后分析每个扩增产物,这种通过先于PCR扩增的样品分离,可以消除本底信号的影响,从而提高低丰度靶标的扩增灵敏度,由检测结果即可计算出DNA的模板拷贝数而不需要采用参考标准物或者外标。ddPCR的准确定量依赖于40~45个循环的扩增,错误的阴性检出水平(单分子DNA模板出现在单一反应单元而未被检出)非常低。
ddPCR技术操作方便、检测通量高、特异性强、灵敏度高、定量准确等优点使其成为了现代分子生物学研究的重要工具。ddPCR在临床诊断方面已应用于癌症的等位基因突变和拷贝数变异等方面的检测,为癌症检测提供了新的诊断工具。ddPCR技术用于单细胞基因表达的研究是ddPCR发展的里程碑,基于这项技术,目前中山大学肿瘤防治中心已推出多项肿瘤检测项目,能精确检测人体的基因突变位点。在环境微生物方面,ddPCR的高通量扩增和分析的优点使同时研究自然界中多个细菌单细胞的多个不同基因得以实现,ddPCR将为环境研究领域提供新的契机。另外核酸测序将是基于ddPCR的单分子扩增技术最重要的应用领域,下一代测序技术如454,Solexa和SOLiD平台均需要通过测序校正分子数量,基于ddPCR的单分子测序技术的研究,使ddPCR能为高通量测序提供灵敏和绝对的校准。
技术实现要素:
本发明的目的是提供一种基于微滴式数字PCR的牛、猪源性成分定量检测方法,所要解决的技术问题是克服现有技术实时荧光定量PCR的不足,根据牛的生长激素基因(BGH)序列特征设计了一组牛特异性引物和荧光探针,根据猪的肌动蛋白基因(β-Actin)序列特征设计了一组猪特异性引物和荧光探针,这两个基因在牛、猪肉组织中的拷贝数相对稳定,适合用于微滴式数字PCR的定量检测。经过PCR反应体系和反应程序的优化后,建立了一种牛、猪源性成分定量检测方法。本发明提供的方法适用于掺杂了猪肉的牛肉及其制品中牛成分的定量检测,检测结果稳定、准确。
为达到上述目的,本发明采用以下技术方案:
一种基于微滴式数字PCR的牛、猪源性成分定量检测的引物和探针,包括:
两条检测牛源性成分的引物,其序列分别为
Bov-BGH-F:5′-CCGATGGATGTGTTCAGAGCT-3′;(SEQ ID No.1)
Bov-BGH-R:5′-GCCAAATGTCTGGGTGTAGATACC-3′;(SEQ ID No.2)
一条检测牛源性成分的探针,其序列为
Bov-BGH-Pr:5′-TGGGCTTTAGGGCTTCCGAATGTGAA-3′;(SEQ ID No.3)
两条检测猪源性成分的引物,其序列分别为
Sus-β-Actin-F:5′-CGAGACCTTCAACACCCCAG-3′;(SEQ ID No.4)
Sus-β-Actin-R:5′-GGCGTACCCCTCGTAGATG-3′;(SEQ ID No.5)
一条检测猪源性成分的探针,其序列为
Sus-β-Actin-Pr:5′-TGTGGGTGACCCCGTCTCCGGA-3′。(SEQ ID No.6)
进一步地,所述Bov-BGH-Pr的5′端标记有荧光报告基团FAM,3′端标记有荧光淬灭基团BHQ1;所述Sus-β-Actin-Pr的5′端标记有荧光报告基团HEX,3′端标记有荧光淬灭基团BHQ1。
一种基于微滴式数字PCR的牛、猪源性成分定量检测的试剂盒,所述试剂盒包括上述的引物和探针。
一种基于微滴式数字PCR的牛、猪源性成分定量检测方法,包括使用上述引物和探针进行PCR扩增的步骤。
进一步地,该测试方法包括以下步骤:
S1、提取样品基因组DNA;
S2、将上述引物和探针加入反应体系中进行双重PCR扩增反应;
S3、将PCR产物置于数字PCR仪中读数分析。
进一步地,所述步骤S2中,PCR反应体系总体积为20μL,各组分如下:2×ddPCR Supermix混合反应液10μL,引物Bov-BGH-F、Bov-BGH-R、Sus-β-Actin-F、Sus-β-Actin-R各1μL,探针Bov-BGH-Pr、Sus-β-Actin-Pr各1μL,模板DNA 2μL,加ddH2O补足至20μL。
进一步地,所述步骤S2中,PCR扩增反应条件为:95℃预变性10min;95℃变性15s,55℃退火10s,68℃延伸20s,40个循环;扩增结束后进行98℃10min的酶热失活。
进一步地,所述引物Bov-BGH-F、Bov-BGH-R、Sus-β-Actin-F、Sus-β-Actin-R的使用终浓度均为900nmol/L,所述探针Bov-BGH-Pr、Sus-β-Actin-Pr的使用终浓度均为250nmol/L。
本发明具有以下有益效果:
本发明设计了一组牛的特异性引物和荧光探针以及一组猪的特异性引物和荧光探针,建立了一套牛、猪源性成分定量检测方法体系。本发明方法克服了实时荧光定量PCR的一系列缺点,在不依赖于任何标准物或参照物的情况下,能对样品中的牛肉和猪肉含量进行准确定量,而且特异性强、灵敏度高,具有非常重要的实际意义。
附图说明
图1为实施例1对一系列参照样品中牛肉含量进行检测的结果分析图;
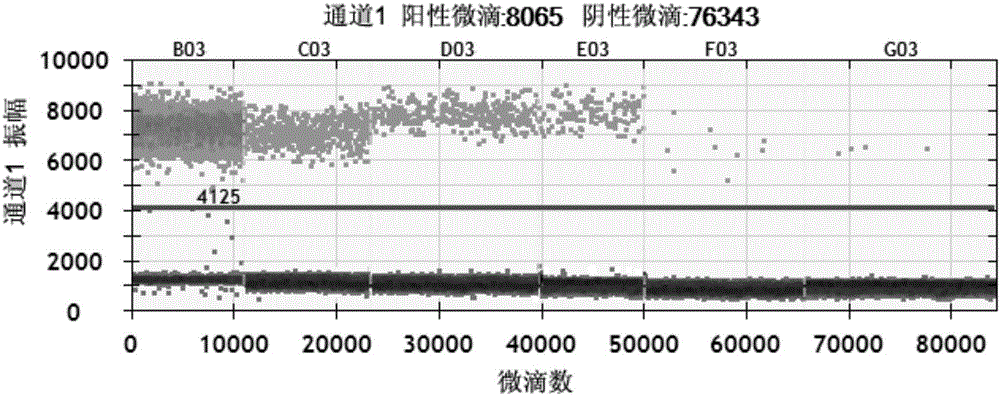
图2为实施例2灵敏度荧光检测信号图谱;
图3为实施例3牛引物、探针扩增信号图谱;
图4为实施例3猪引物、探针扩增信号图谱;
图5为实施例3牛肉含量检测结果。
具体实施方式
下面结合具体实施例对本发明做进一步的说明。
实施例1
测试方法的准确性验证
1、仪器、试剂与供试样品
仪器:伯乐QX200微滴数字PCR仪,全自动核酸提取系统,微量分光光度计,超速冷冻离心机。
试剂:2×Droplet PCR Supermix,Droplet generation oil(购自伯乐生物有限公司)。
引物、探针由大连宝生物技术有限公司合成,序列如下:
两条检测牛源性成分的引物
Bov-BGH-F:5′-CCGATGGATGTGTTCAGAGCT-3′;
Bov-BGH-R:5′-GCCAAATGTCTGGGTGTAGATACC-3′;
一条检测牛源性成分的探针Bov-BGH-Pr:5′-TGGGCTTTAGGGCTTCCGAATGTGAA-3′;
两条检测猪源性成分的引物
Sus-β-Actin-F:5′-CGAGACCTTCAACACCCCAG-3′;
Sus-β-Actin-R:5′-GGCGTACCCCTCGTAGATG-3′;
一条检测猪源性成分的探针Sus-β-Actin-Pr:5′-TGTGGGTGACCCCGTCTCCGGA-3′。
Bov-BGH-Pr的5′端标记有荧光报告基团FAM,3′端标记有荧光淬灭基团BHQ1;Sus-β-Actin-Pr的5′端标记有荧光报告基团HEX,3′端标记有荧光淬灭基团BHQ1。
供试样品:将牛肉和猪肉样品烘干至恒重后研磨成肉粉,按质量比9:1、3:1、1:1、1:3、1:9的比例混合成牛肉含量分别90%、75%、50%、25%、10%的参照样品。
2、DNA的提取和模板的制备
分别称取各参照样品1.0g,采用改良CTAB磁珠法提取基因组DNA,得到的DNA溶液经微量分光光度计测定后定量至50ng/uL,即为上样模板。
3、反应体系的配制
PCR反应体系总体积为20μL,各组分如下:2×ddPCR Supermix混合反应液10μL,浓度为18μmol/L的引物Bov-BGH-F、Bov-BGH-R、Sus-β-Actin-F、Sus-β-Actin-R各1μL,浓度为5μmol/L的探针Bov-BGH-Pr、Sus-β-Actin-Pr各1μL,模板DNA 2μL,加ddH2O补足至20μL;引物的终浓度为900nmol/L,探针的终浓度为250nmol/L。
4、微滴的生成
将充分混匀的反应体系小心地转移至微滴发生卡相应孔中,在每个对应油孔中分别加入70μL Droplet generation oil,盖上橡胶垫后放入微滴发生器中生成油包水的反应微滴。再小心地将反应微滴转移至96孔反应板中,并封好铝膜。
5、反应程序
将装有反应微滴的96孔反应板置于PCR仪中,反应程序为:95℃预变性10min;95℃变性15s,55℃退火10s,68℃延伸20s,40个循环;扩增结束后进行98℃10min的酶热失活。
6、读数与结果分析
反应结束后,将96孔板放入伯乐QX200微滴数字PCR仪中进行检测,检测结果见图1,其中C02、C03牛肉含量为90%,C04、C05牛肉含量为75%,C06、C07牛肉含量为50%,C08、C09牛肉含量为25%,C10、C11牛肉含量为10%。牛肉含量计算方法为:由检测结果可知本方法测定的数值与参照样品实际含量非常接近,绝对偏差不超过4%。
实施例2
测试方法的灵敏度试验
1、仪器与试剂
仪器:伯乐QX200微滴数字PCR仪,全自动核酸提取系统,微量分光光度计,超速冷冻离心机。
试剂:2×Droplet PCR Supermix,Droplet generation oil(购自伯乐生物有限公司);引物、探针(同实施例1)。
2、DNA模板的制备
将牛肉DNA和猪肉DNA按体积比分别配成牛含量为50%、10%、5%、1%、0.1%、0.01%的DNA溶液,作为上样模板。
3、反应体系的配制
PCR反应体系总体积为20μL,各组分如下:2×ddPCR Supermix混合反应液10μL,引物Bov-BGH-F、Bov-BGH-R、Sus-β-Actin-F、Sus-β-Actin-R各1μL,探针Bov-BGH-Pr、Sus-β-Actin-Pr各1μL,模板DNA 2μL,加ddH2O补足至20μL;引物的终浓度为900nmol/L,探针的终浓度为250nmol/L。
4、微滴的生成
将充分混匀的反应体系小心地转移至微滴发生卡相应孔中,在每个对应油孔中分别加入70μL Droplet generation oil,盖上橡胶垫后放入微滴发生器中生成油包水的反应微滴。再小心地将反应微滴转移至96孔反应板中,并封好铝膜。
5、反应程序
将装有反应微滴的96孔反应板置于PCR仪中,反应程序为:95℃预变性10min;95℃变性15s,55℃退火10s,68℃延伸20s,40个循环;扩增结束后进行98℃10min的酶热失活。
6、读数与结果分析
反应结束后,将96孔板放入伯乐QX200微滴数字PCR仪中进行检测,荧光信号图谱见图2,其中B03为牛含量50%,C03为牛含量10%,D03为牛含量5%,E03为牛含量1%,F03为牛含量0.1%,G03为牛含量0.01%,可知本方法的灵敏度可检测到0.01%以下。
实施例3
对市售牛肉丸样品进行检测
1、仪器与试剂
仪器:伯乐QX200微滴数字PCR仪,全自动核酸提取系统,微量分光光度计,超速冷冻离心机。
试剂:2×Droplet PCR Supermix,Droplet generation oil(购自伯乐生物有限公司);引物、探针(同实施例1)。
供试样品:购自市场的牛肉丸样品。
2、DNA的提取和模板的制备
取样品约200g,烘干至恒重后研磨成肉粉,称取2g采用改良CTAB磁珠法提取基因组DNA,得到的DNA溶液作为上样模板。
3、反应体系的配制
PCR反应体系总体积为20μL,各组分如下:2×ddPCR Supermix混合反应液10μL,引物Bov-BGH-F、Bov-BGH-R、Sus-β-Actin-F、Sus-β-Actin-R各1μL,探针Bov-BGH-Pr、Sus-β-Actin-Pr各1μL,模板DNA 2μL,加ddH2O补足至20μL;引物的终浓度为900nmol/L,探针的终浓度为250nmol/L。
4、微滴的生成
将充分混匀的反应体系小心地转移至微滴发生卡相应孔中,在每个对应油孔中分别加入70μL Droplet generation oil,盖上橡胶垫后放入微滴发生器中生成油包水的反应微滴。再小心地将反应微滴转移至96孔反应板中,并封好铝膜。
5、反应程序
将装有反应微滴的96孔反应板置于PCR仪中,反应程序为:95℃预变性10min;95℃变性15s,55℃退火10s,68℃延伸20s,40个循环;扩增结束后进行98℃10min的酶热失活。
6、读数与结果分析
反应结束后,将96孔板放入伯乐QX200微滴数字PCR仪中进行检测,牛引物、探针扩增信号图谱见图3,猪引物、探针扩增信号图谱见图4,牛肉含量检测结果见图5,其中C02、D02分别为两次重复试验,M01为平均值,由检测结果可知该样品中的牛肉含量为45.1%。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求的保护范围为准。
SEQUENCE LISTING
<110> 珠海出入境检验检疫局检验检疫技术中心
<120> 一种基于微滴式数字PCR的牛、猪源性成分定量检测方法、引物和探针及试
剂盒
<130>
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> 人工序列
<400> 1
ccgatggatg tgttcagagc t 21
<210> 2
<211> 24
<212> DNA
<213> 人工序列
<400> 2
gccaaatgtc tgggtgtaga tacc 24
<210> 3
<211> 26
<212> DNA
<213> 人工序列
<400> 3
tgggctttag ggcttccgaa tgtgaa 26
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<400> 4
cgagaccttc aacaccccag 20
<210> 5
<211> 19
<212> DNA
<213> 人工序列
<400> 5
ggcgtacccc tcgtagatg 19
<210> 6
<211> 22
<212> DNA
<213> 人工序列
<400> 6
tgtgggtgac cccgtctccg ga 22
- 还没有人留言评论。精彩留言会获得点赞!