一种检测人肾透明细胞癌细胞的核酸适体及其在制备检测制剂中的应用的制作方法
本发明涉及一种核酸适体及其应用,特别是涉及一种可用于人肾透明细胞癌细胞及临床样本组织检测的核酸适体及其在制备检测试剂的用途。
背景技术:
肾癌是起源于肾实质泌尿小管上皮系统的恶性肿瘤,学术名词全称为肾细胞癌,又称肾腺癌,简称为肾癌,是最常见的肾脏实质恶性肿瘤。由于平均寿命延长和医学影像学的进步,肾癌的发病率比以前增加,临床上并无明显症状而在体检时偶然发现的肾癌日见增多,可达50%~70%。肾癌包括起源于泌尿小管不同部位的各种肾细胞癌亚型。
肾癌分为多种类型,其中透明细胞肾癌(conventional or clear cell renal carcinoma) 为最常见的类型,占肾细胞癌的70%~80%。显微镜下肿瘤细胞体积较大,圆形或多边形,胞质丰富,透明或颗粒状,间质富有毛细血管和血窦。还有乳头状癌(papillary carcinoma) 占肾细胞癌的10%~15%。包括嗜碱性细胞和嗜酸性细胞两个类型。肿瘤细胞立方或矮柱状,呈乳头状排列。乳头中轴间质内常见砂粒体和泡沫细胞,并可发生水肿。再而嫌色细胞癌(chromophobe renal carcinoma) 在肾细胞癌中约占5%。显微镜下细胞大小不一,胞质淡染或略嗜酸性,近细胞膜处胞质相对浓聚,核周常有空晕。此型肿瘤可能起源于集合小管上皮细胞,预后较好。
肾癌识别和治疗中存在着许多问题,比如缺乏早期识别或判断的症状;对放化疗不敏感,但免疫治疗有一定作用;目前已有一些针对抗血管生成的靶向治疗,但没有特异性针对肾癌细胞的靶向治疗。所以靶向肾癌细胞的适体筛选可能会提供了一种识别和治疗肾癌的有利分子工具,并对阐释调节肾癌的新分子机制以及发现新的分子探针和药物靶标提供新的思路,为研发检测和治疗肾癌的药物提供理论依据。因此,寻找出一种理想的标记物进而能够开发出快速、准确诊断以及治疗肾癌的方法就显得尤为重要。
核酸适体(nucleic acid aptamer)是从人工合成的随机单链核酸库中筛选出来的能高亲和性结合靶分子的20-50碱基的寡聚核苷酸,包括DNA适体和RNA适体。适配体因其结构的多样性而具有靶分子广、亲和力高、特异性强等特点,同时,相比传统抗体,适配体分子量小、易改造修饰、制备方便且无免疫原性。因此,适体在基础研究、临床诊断、药物研制等方面展现了广阔的应用前景。利用这些适体对其所结合的细胞表面的靶分子进行表征和检测,有助于发现新的生物标志物。核酸适体已经被广泛应用于识别各种癌症靶标分子,发现新的生物标志物。
技术实现要素:
本发明人建立了一个新的文库——Swan Library(参看plos one,2014, 9(1): e87002-e87002),我们将已发表的能够结合肿瘤细胞的核酸适体,进行同源性建模分析,设计出全新的核酸序列。本组所有筛选获得的这些序列明确,但功能不明确的核酸序列构成了Swan Library。Swan Library目前包含近100条ssDNA,且正在不断扩增。与普通的筛选文库相比的优点,我们的文库序列清晰无需高通量测序便能得到全新的的核酸适体。
我们将人肺癌细胞系(H1299),肝癌细胞系(HepG2),人胰腺癌细胞系(PL45),人肾癌细胞系(786-O)以及其各自的对照细胞人支气管上皮细胞系(HBE),人肝脏细胞系(HL7702),胰腺导管永生化细胞系(HPNE),人肾成纤维细胞系(KFB)与Swan Library中的所有ssDNA进行结合验证,进行近千次的结合验证实验后,最终得到一条与人肾癌细胞系(786-O)结合且不与人肾成纤维细胞系(KFB)结合的ssDNA,并将其命名为RCC-H1。
因而,本发明的目的提供一种高度特异性、稳定性、可用于人肾透明细胞癌细胞检测的适体及其制备检测试剂的应用方法。
一种检测人肾透明细胞癌细胞的核酸适体RCC-H1,序列如下:
5’-ACCGACCGTGCTGGACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGAGCGAGCCTGGCG -3’( 如SEQ ID NO.1所示)。
所述的检测人肾透明细胞癌细胞的核酸适体,还可以是在保持下划线部分的保守核苷酸序列RCC-H1不变的情况下将核酸适体进行修饰和改造,具体包括以下三种中的任一种:
a)核酸适体下划线部分的保守核苷酸序列RCC-H1不变,不变序列两端的核苷酸进行删减;
b)核酸适体下划线部分的保守核苷酸序列RCC-H1不变,不变序列两端核苷酸的碱基进行人工碱基替换;
c)核酸适体连接上荧光物质、放射性物质、治疗性物质、生物素、或者酶标记。
同时,本发明还提供检测人肾透明细胞癌细胞的核酸适体在制备检测人肾透明细胞癌细胞的制剂的用途。
与现有技术相比,本发明的优点在于:本发明通过筛选得到的核酸适体具有比蛋白抗体更高的亲和力与特异性;无免疫原性;能够体外化学合成,分子量小,可以对不同部位进行修饰和取代,且序列稳定,易于保存;便于标记等优势。采用本发明的核酸适体进行人肾透明细胞癌细胞检测时,操作更为简单、迅速,并且本发明核酸适体的合成成本较抗体制备成本低,且周期短,重现性好。
附图说明
图1为swan library中的ssDNA与人肾透明细胞癌细胞(786-O)的结合情况;
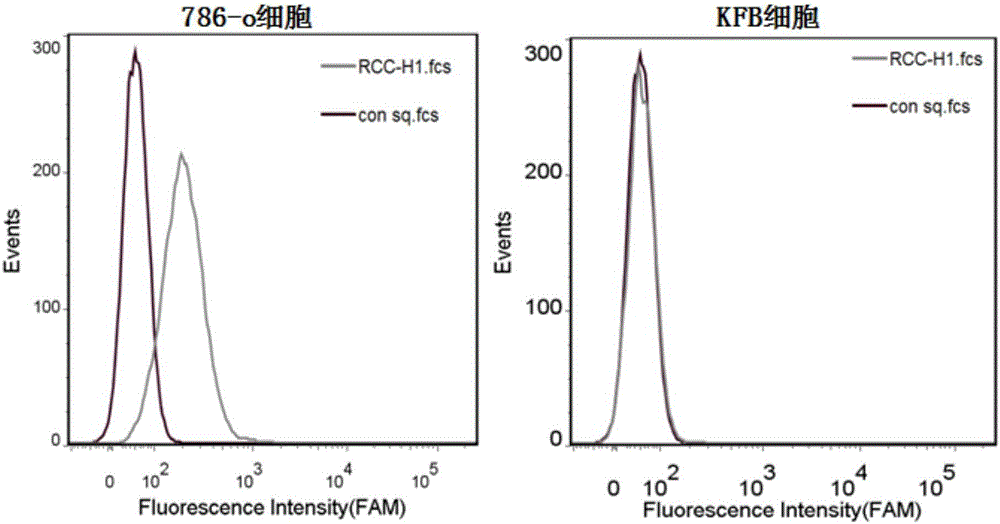
图2为RCC-H1与786-O、人肾成纤维KFB细胞的结合情况;
图3 RCC-H1序列经过一系列的删减后与人肾透明细胞癌细胞(786-O)的结合情况;
图4 RCC-H1b的稳定性表征;
图5 RCC-H1b对肾癌裸鼠模型活体成像应用;
图6 核酸适体RCC-H1b与肾正常组织、肾癌组织染色荧光强度差异比较。
具体实施方式
以下的实施例便于更好的理解本发明,但并不限定于本发明。以下实施例中的实验方法如无特殊说明,均为常规方法。下属实施例中所用的实验材料如无特殊说明,均为自常规生化试剂商店购买所得到的。
细胞来源:
本实验所用到的细胞系人肾透明细胞癌细胞(786-O),正常的人肾成纤维细胞(KFB)均来自中科院上海细胞库。
实施例1:确定与786-O细胞系特异性结合能力最强的序列
首先,用0.2%EDTA将贴壁状态的786-O细胞从培养皿上消化下来,分别将细胞收集到离心管中,并用洗涤缓冲液(PBS,含0.45 % 的葡萄糖,5 mM氯化镁)离心洗涤几次;其次,将终浓度为250nM的Swan Library中的所有序列分别加入到结合缓冲液(DPBS,含0.45%的葡萄糖,5 mM 氯化镁,100mg/L tRNA,1g/L BSA)浸泡的786-O细胞中;然后放置于4℃摇床孵育60min;孵育完成之后并用洗涤缓冲液(PBS,含0.45 % 的葡萄糖,5 mM氯化镁)离心洗涤两次,并通过流式细胞仪术进行荧光检测(结果见图1)。检测结果如图所示,位移最大的即与786-O细胞结合能力最强的序列,我们将其命名为RCC-H1。
实施例2 :RCC-H1特异性识别肾透明细胞癌细胞786-O
该实验与实施例1中的某些处理步骤有相似之处。首先,用0.2%EDTA分别将贴壁状态的786-O和KFB从培养皿上消化下来,分别将细胞收集到离心管中,并用洗涤缓冲液(PBS,含0.45 % 的葡萄糖,5 mM氯化镁)离心洗涤几次;分别向786-O和KFB中加入等量的结合缓冲液(D-PBS,含0.45%的葡萄糖,5 mM 氯化镁,100mg/L tRNA,1g/L BSA),并分别投入终浓度为250nM的RCC-H1与对照序列;然后放置于4℃摇床孵育60min;孵育完成之后并用洗涤缓冲液(PBS,含0.45 % 的葡萄糖,5 mM氯化镁)离心洗涤两次,并通过流式细胞仪进行荧光检测(结果见图2)。结果显示RCC-H1具有高亲和力且特异的与786-O细胞结合,而几乎不与KFB细胞结合。
实施例3:RCC-H1序列加上两边的引物全序列的删减方法
由于我们不清楚全序列当中到底是哪一段序列与786-O结合强,所以我们通过如下的删减方法来进行序列的优化:
(下划线部分为RCC-H1的保守核苷酸序列)
RCC-H1序列加上两边的引物全序列为:
ACCGACCGTGCTGGACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGAGCGAGCCTGGCG(SEQ ID NO.1)
RCC-H1a:(左边引物区删减5个碱基,右边引物区删减4个碱基)
CCGTGCTGGACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGAGCGAGCCT(SEQ ID NO.2)
RCC-H1b:(左边引物区删减15个碱基,右边引物区删减11个碱基)
ACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGA(SEQ ID NO.3)
RCC-H1c:(左边引物区删减19个碱基,右边引物区删减19个碱基)
TAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTT (SEQ ID NO.4)
RCC-H1d:(左边引物区删减9个碱基,右边引物区删减7个碱基)
GCTGGACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGAG(SEQ ID NO.5)
RCC-H1e:(左边引物区删减21个碱基,右边引物区删减19个碱基)
GGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTT (SEQ ID NO.6)
我们将上述一系列删减后的序列和加上两边的引物全序列与786-O孵育后进行流式细胞仪检测,并计算出删减后的相对结合情况。(结果见图3),发现删减后RCC-H1b的结合能力最强。
实施例4: 核酸适体的稳定性
稳定性是影响核酸适体应用范围的重要条件之一,本实验利用琼脂糖凝胶电泳技术研究了核酸适体RCC-H1b在完全培养基中的稳定性情况,具体实验步骤如下:将终浓度为3μM的RCC-H1b溶于1mL完全培养基中,1640加10%FBS,RCC-H1b在37°C分别孵育0h,2h,4h,6h,10h,12h,24h,36h,48h,72h;每次取出30μL的样品,立即95°C变性10min,变性完之后立即置于-80°C保存。待所有样品收集完之后,用3%的琼脂糖凝胶电泳检测,用凝胶成像仪成像(结果见图4)。结果显示,核酸适体RCC-H1b,72小时以后仍旧还有少量核酸适配体存在,证明所得到的核酸适体稳定性很好,不需要做额外的修饰来维持其稳定性。
实施例5:Cy5标记的核酸适体在裸鼠模型中的应用测试
购买四周大的裸鼠,待裸鼠适应新环境后,每只裸鼠皮下注射5百万个786-O细胞,使裸鼠成瘤,约2周裸鼠长成瘤。通过尾静脉注射的方法,给裸鼠注射Cy5标记的RCC-H1b或对照序列4.5 nmol后,用小动物成像仪进行拍照观察。 结果如图5所示,Cy5标记的核酸适体在裸鼠肿瘤部位有富集,对照序列没有富集。
实施例6:3-吲哚菁类染料(Cy5)标记的核酸适体在临床肾癌组织切片中的应用测试
(1) 临床样本组织切片于60℃烤箱中烘烤1小时后,立刻置于第一缸二甲苯中15分钟,而后置入第二缸二甲苯中15 分钟进行脱蜡;再将已脱蜡的组织切片依次放置于无水乙醇中10分钟,95% 乙醇5分钟,70% 乙醇5分钟;蒸馏水润组织切片后对将其置于TE buffer (pH 8.0),将切片放入盛有抗原修复液的容器中,于微波炉内加热至沸腾,然后停止加热,使其温度保持在95℃~ 98℃之间。15 分钟后,取出切片,蒸馏水冲洗后,再用PBS(0.01M,pH7.4)浸泡3次,每次5分钟。
(2) 将已抗原修复的组织切片与含20% FBS 和1mg/ml 鲑鱼精DNA 的结合缓冲溶液室温孵育60分钟;洗涤后与200μL含0.25微摩 Cy5标记的核酸适配体序列2或起始文库于室温孵育60分钟。用洗涤缓冲液洗涤三次后,将组织切片晾干,并用20%甘油封片,观察。由图6可见:在临床实际标本切片的检测中可看到RCC-H1b适体对肾癌具有良好的识别检测能力,而与肾正常组织基本不结合。
<110> 湖南大学
<120>一种检测人肾透明细胞癌细胞的核酸适体及其在制备检测制剂中的应用
<160> 6
<210> 1
<211> 80
<212> DNA
<213> RCC-H1
<400> 1
ACCGACCGTGCTGGACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGAGCGAGCCTGGCG 80
<210> 2
<211> 71
<212> DNA
<213> RCC-H1a
<400> 2
CCGTGCTGGACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGAGCGAGCCT 71
<210> 3
<211> 54
<212> DNA
<213> RCC-H1b
<400> 3
ACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGA 54
<210> 4
<211> 42
<212> DNA
<213> RCC-H1c
<400> 4
TAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTT 42
<210> 5
<211> 60
<212> DNA
<213> RCC-H1d
<400> 5
GCTGGACTCATAGGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTTACTATGAG 60
<210> 6
<211> 40
<212> DNA
<213> RCC-H1e
<400> 6
GGGTTAGGGGCTGCTGGCCAGATATTCAGATGGTAGGGTT 40
- 还没有人留言评论。精彩留言会获得点赞!