一种抗新加坡石斑鱼虹彩病毒的药物筛选方法与流程
本发明涉及一种药物筛选方法,尤其是一种基于细胞活性分析的抗新加坡石斑鱼彩虹病毒(sgiv)药物筛选方法。
背景技术:
新加坡石斑鱼虹彩病毒(sgiv)隶属于虹彩病毒科蛙病毒属,是造成亚洲石斑鱼水产养殖业巨大经济损失的主要病原体之一。虽然sgiv感染石斑鱼给养殖者造成了严重的经济损失,但是目前可用来治疗sgiv的方法却十分有限。目前,有两种sgiv疫苗被证明能有效的降低石斑鱼被sgiv感染的风险,包括福尔马林灭活疫苗和β-丙内酯灭活疫苗。但是,给鱼,尤其是幼鱼,接种疫苗既费时又繁琐,导致这些疫苗很难普及及商业化。因此,迫切需要开发其他有效的抗sgiv的方法。
小分子化合物是一种与许多生物过程相关的低分子量有机化合物,比如,新陈代谢,信号转导和免疫。多种小分子化合物已经被证明能作为抗病毒药物,通过不同机制有效对抗病毒感染。虽然有许多证据显示小分子化合物在人类或其他动物体内有抗多种病毒的作用,但目前仍然没有关于抗sgiv的小分子药物的报导。
抗病毒化合物的鉴定需要可靠的筛选方法。目前已有多种筛选方法用于抗病毒药物的筛选,比如细胞病变效应的分析,基因组或亚基因组复制子的分析,空斑形成实验和荧光标记的重组病毒检测。但是这些方法存在过程复杂,分析复杂等问题。
技术实现要素:
本发明的目的是提供一种简单有效的抗sgiv药物的筛选方法,首次应用定量sgiv感染引起的致细胞病变效应(cpe)可以被量化,优化了抗sgiv药物筛选的细胞筛选体系,并利用ddpcr对药物筛选结果进行定量的描述。
一种基于细胞活性分析的抗sgiv药物筛选的细胞筛选体系,包括:血清浓度5%,当需要添加dmso为溶剂时,dmso浓度不高于1%,病毒感染复数为0.3,病毒感染时间为48h。
一种基于细胞活性分析的抗sgiv药物筛选的细胞筛选体系的优化方法,包括以下步骤:
1、定量sgiv感染引起cpe,确定感染复数及感染时间;
2、基于cpe的细胞活性培养条件的优化。
一种基于所述细胞筛选体系的抗sgiv药物筛选方法,包括以下步骤:
1、体外筛选细胞株的建立及细胞培养;
2、病毒感染所述细胞株及细胞培养;
3、被筛选药物的添加及细胞培养;
4、通过检测细胞活性进行药物筛选。
优选的,所述步骤1中的细胞株可以为任意鱼类细胞株,进一步的,本申请还保护一种基于体外细胞活性分析的抗sgiv药物筛选的斑马鱼胚胎细胞株zeb(danioreriozeb),于2017年1月9日保藏于中国典型培养物保藏中心(cctcc),地址:湖北省武汉市武昌珞珈山,武汉大学,保藏编号为c201708。
优选的,所述步骤1、2、3的细胞培养使用的培养基为dmem培养基,血清浓度5%,当需要添加dmso为溶剂时,浓度不高于1%。
优选的,步骤2中所述病毒感染时病毒感染复数为0.3,病毒感染时间为48h。
优选的,本发明所述药物筛选方法还包括使用ddpcr对药物筛选结果的检测,具体为使用ddpcr来检测sgiv基因编码的衣壳蛋白(mcp)复制数量来定量检测筛选药物的效果。
进一步的,ddpcr来检测sgiv基因编码的衣壳蛋白(mcp)复制数量的计算公式为:
cnmcp=countmcp/countactin=mcp数量/肌动蛋白数量。
本发明的有益效果是:
本发明方法的优点在于首次应用定量sgiv感染引起的致细胞病变效应(cpe)可以被量化,优化了抗sgiv药物筛选的细胞筛选体系,并利用该体系建立了简单的筛选方法,使用ddpcr用于筛选结果的检测,准确快捷。
附图说明
图1为定量sgiv感染引起的cpe数据;
图2为不同条件下培养的细胞cpe数据;
图3为不同条件下细胞活性数据;
图4为不同条件下的cpe数据;
图5为不同条件下ddpcr结果。
具体实施方式
下面通过具体的实施例对本发明的技术方案进行详细的说明,但是本发明的范围不受这些实施例的限制。
实施例中,以斑马鱼胚胎细胞株zeb(danioreriozeb)为例。zeb细胞用含10%胎牛血清(fbs)的dmem培养基于28℃培养。sgiv在zeb细胞繁殖扩增后收集,于-80℃保存。
实施例1定量sgiv感染引起cpe,确定感染复数及感染时间
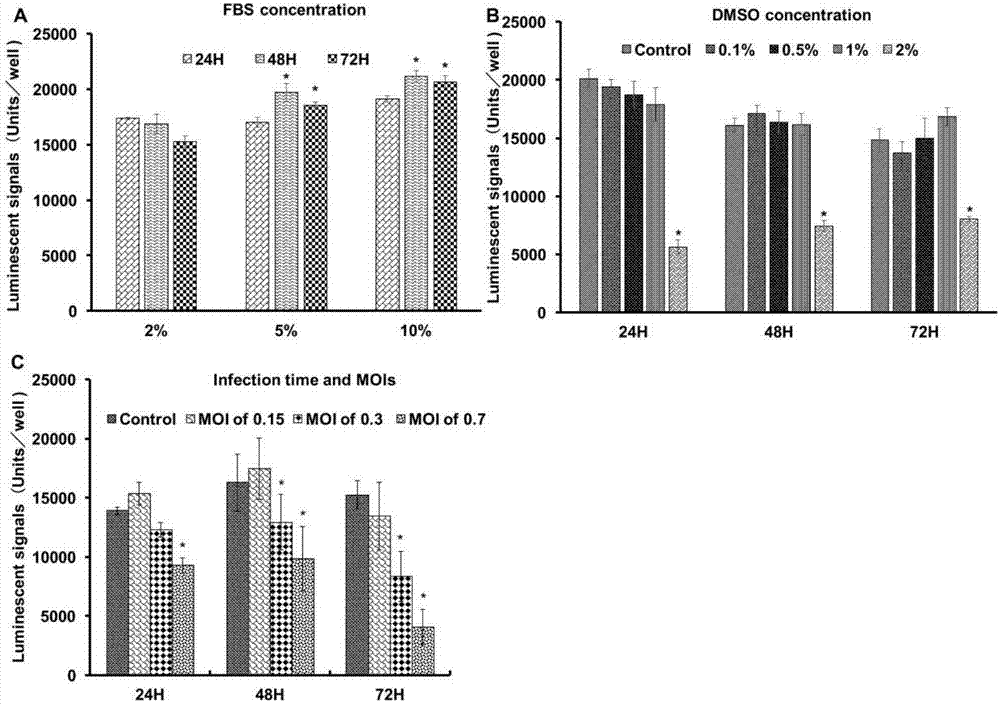
将zeb细胞传到96孔板上,并以不同感染复数(0.15,0.3和0.7)的sgiv来感染zeb细胞。感染24,48和72h后,用celltiter-gloluminescentcellviabilitykit试剂盒检测sgiv感染诱导的cpe。结果表明24,48和72h后,感染复数为0.3和0.7的zeb细胞的荧光信号(相当于细胞活性)与未感染病毒的细胞相比显著减少。而感染复数为0.15的细胞在感染后24和48h细胞活性没有明显降低(图1)。结果表明,sgiv感染诱导cpe可以被量化。
病毒感染时间及感染复数(moi)的确定:将zeb细胞以5000/孔的密度传至96孔板,用含5%血清浓度的dmem培养基培养。并用不同moi(0.15,0.3和0.7)的sgiv感染细胞。感染24,48和72h后,用celltiter-glo试剂盒测试细胞活性。实验重复三次,所得实验数据为8个平行样数据的平均值。结果显示当感染复数为0.3和0.7,且感染时间为48和72h,细胞活性最好且与对照组存在显著性差异。
为了在最低的感染复数下得到相对较高的荧光信号,使用不同感染复数的sgiv感染了zeb细胞(感染复数分别为0.15,0.3和0.7)。分别检测了感染后24,48和72h的细胞活性。如图2c,显示了荧光信号与moi和感染时间的关系。在感染后24h,感染复数为0.3和0.7的zeb细胞的荧光信号分别为对照细胞的0.21和0.33。在感染48h后,感染复数为0.3和0.7的zeb细胞的荧光信号分别为对照细胞的0.21和0.4。在感染72h后,感染复数为0.3和0.7的zeb细胞的荧光信号分别为对照细胞的0.45和0.74。感染复数为0.3的细胞荧光信号在感染48h后比感染72h后高。基于这一结果,病毒量和检测时间分别设定为moi为0.3和感染后48h。
实施例2基于cpe的细胞培养条件的优化
血清浓度的确定:将zeb细胞以5000/孔的密度传至96孔板,用含不同血清浓度(2%,5%,10%)的dmem培养基培养。传代后24,48,72h用celltiter-glo试剂盒测试细胞活性。实验重复三次,所得实验数据为8个平行样数据的平均值。
fbs含量较高的细胞培养基可能会造成细胞过度增殖从而导致细胞活性的降低。通过对fbs浓度对zeb细胞活性影响的检测可以确定fbs的最佳浓度。分析表明,将zeb细胞接种到含5%和10%的fbs的dmem培养基中,接种后48h和72h的荧光信号比接种后24h强。然而,当zeb细胞用含2%fbs的dmem培养基培养时,从24到72h,荧光信号逐渐减弱(图2a)。已有研究表明一些病毒和化合物会受fbs浓度的影响,在抗病毒筛选实验中产生假阴性。为了使fbs的干扰最小化,选择5%为fbs的最佳浓度,并用于今后所有的筛选实验。
dmso浓度的确定:将zeb细胞以5000/孔的密度传至96孔板,用含5%血清浓度的dmem培养基培养。用不同浓度dmso(0.1%,0.5%,1%和2%)处理细胞,处理后24,48,72h用celltiter-glo试剂盒测试细胞活性。dmso的细胞毒性由不同浓度dmso处理细胞与未用dmso处理细胞比较得出。实验重复三次,所得实验数据为8个平行样数据的平均值。
分析表明,当zeb细胞用浓度为1%或者更低浓度的dmso处理24,48和72h后,与没有用dmso的对照细胞相比细胞活性没有明显的降低。然而,当zeb细胞用浓度为2%的dmso处理后,与未处理的对照组相比,细胞活性显著降低(图2b)。细胞活性实验结果显示,dmso的浓度应不超过1%。
实施例3被筛选药物的添加及通过细胞活性对药物的筛选
被筛选药物为:利巴韦林,盐酸阿比朵尔和羟基十四烷酸从sigma(st.louis,mo)购买。竹红菌甲素和三尖杉酯碱从abcam(cambridge,uk)购买。三尖杉酯碱用dmso溶解为浓度9.4×103μm。竹红菌甲素溶解到dmso中,浓度为1.83×103μm。羟基十四烷酸(20.4×103μm),盐酸阿比朵尔(1×103μm),利巴韦林(40.95×103μm)用dmso溶解,储存于-20℃。
将zeb细胞以5000/孔的密度传至96孔,用不同浓度的利巴韦林,盐酸阿比朵尔,羟基十四烷酸,竹红菌甲素或者三尖杉酯碱于28℃预先孵育24h。在上述化合物存在情况下,向预处理过及未处理过的细胞中加入sgiv(moi=0.3),28℃孵育48h后用cytation3(biotek,usa)测试荧光信号。每个筛选评估测试质量的z因子根据已有文献报道的方法确定。
根据说明书准备好celltiter-glo试剂后,每孔加入等体积(100μl)的celltiter-glo试剂。室温下孵育10分钟,使荧光信号稳定。用cytation3的plate-readingluminometer测试荧光信号,间隔时间为0.1s。
利用优化后的筛选条件,首先分析5种化合物对zeb细胞的的细胞毒性。图3显示,zeb细胞活性与被检测的化合物成剂量依赖性降低。在盐酸阿比朵尔的浓度为1μm,2-羟基十四烷酸,三尖杉酯碱和竹红菌甲素的浓度为0.5μm,病毒唑的浓度为20μm时zeb细胞的活性高于90%。因此1μm的盐酸阿比朵尔,0.5μm的2-羟基十四烷酸,三尖杉酯碱和竹红菌甲素和20μm的病毒唑被用于抗病毒化合物的筛选。
抗病毒实验的结果显示,预先用0.5μm的2-羟基十四烷酸,0.5μm三尖杉酯碱和20μm的病毒唑处理过的zeb细胞的荧光信号明显的比没用化合物处理过的zeb细胞高,说明2-羟基十四烷酸,三尖杉酯碱和病毒唑对sgiv感染有显著的抑制作用(图4)。然而,用0.5μm盐酸阿比朵尔和0.5μm竹红菌甲素处理细胞后,sgiv的感染现象没有明显的减少(图4)。所有抗病毒实验的z’>0.5,表明筛选实验的结果是可信的。
实施例4ddpcr对药物筛选结果的检测
zeb细胞传代至24孔板,待细胞铺满70%-80%时,用不同浓度的利巴韦林,羟基十四烷酸或者三尖杉酯碱在28℃预处理24h。将预处理过及未处理的zeb细胞在上述化合物存在情况下加入sgiv(moi=1)28℃处理24h。然后收集细胞,提取rna,所提取rna按说明用cdna合成试剂盒(thermoscientific)合成cdna。通过ddpcr来检测sgiv基因编码的衣壳蛋白(mcp)复制数量。
ddpcr所需引物列于附表s1。
mcp-f:aacgcataggttacgacaac(seqidno.1)
mcp-r:gtagcagagataggaatcac(seqidno.2)
actin-f:gctttatgccagcaacgact(seqidno.3)
actin-r:gagggactttagactatcgg(seqidno.4)
ddpcr的反应体系为:
ddpcr反应体系为22μl,包括:2xddpcrevagreensupermix(11μl),cdna模版(1μl),22μm引物(0.1μl),灭菌双蒸水(9.9μl)。
ddpcr的反应过程为:通过qx200微滴生成器(bio-rad)将22μl的ddpcr混合物转化成微滴然后,按照以下程序在热循环仪中进行pcr:95℃,5min;95℃,30s;60℃,1min,循环40次;最后3步4℃,5min;90℃,5min;最终维持在4℃。
利用qx200reader(bio-rad)读channels。sgivmcp和石斑鱼β-actin被选作目标基因和内参基因。quantasoft分析软件分析ddpcr的数据。该软件通过泊松分布计算含目标物的微滴占总液滴的比率来决定每微升含目标物的微滴的数量,每个实验包含一个阴性对照和无模板对照。对于一个给定样品,每微升所含的目标复制物由所有重复孔的平均数计算所得。sgivmcpcopynumber(cn)由以下公式计算所得,并代表每微升病毒数量。
cnmcp=countmcp/countactin=mcp数量/肌动蛋白数量
ddpcr结果表明,同未经化合物处理的zeb细胞相比,使用2-羟基十四烷酸,三尖杉酯碱和病毒唑预处理过的zeb细胞内的病毒数量显著减少(图5)。
需要指出的是,以上的两个实施例只是对本发明的解释,并非是对发明的限定,在不违背本发明的精神的情况下,本发明可以作任何形式的修改,例如简单的加热系统的更换或者反应釜的变化都应在本发明技术方案保护范围之内。
sequencelisting
<110>中山大学
<120>一种抗新加坡石斑鱼虹彩病毒的药物筛选方法
<130>2010
<160>4
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>人工序列
<400>1
aacgcataggttacgacaac20
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
gtagcagagataggaatcac20
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
gctttatgccagcaacgact20
<210>4
<211>20
<212>dna
<213>escherichiacoli
<400>4
gagggactttagactatcgg20
- 还没有人留言评论。精彩留言会获得点赞!