一种基于惯性原理分离细胞的芯片的制作方法
本发明属于微流控领域,更具体地,涉及一种基于惯性原理分离细胞的芯片。
背景技术:
微流控芯片技术是一种在微尺度空间中对流体进行操控的科学技术,利用该技术分离细胞时,方法简单、分离成功率高,易于推广普及,受到广泛关注。
在现有的文献和专利中提出的依据惯性原理分离细胞的流道结构一般为:螺旋型和缩扩阵列结构。这两种结构具有一些缺陷。对于螺旋型结构来说,由于芯片所能承受的压强有限,所以该结构提供的fd(即,迪恩力)和fl(即,惯性升力)较小,限制了分离效率。对于缩扩阵列结构来说,虽然其依靠缩扩阵列能够提供较大的fd和fl,但是不能在整个流道中一直提供fd,只有当细胞从拓宽段流入收缩段时才能受到fd的影响。
以螺旋结构为例,现有技术文献【3】公开了一种基于惯性分离原理的螺旋结构用于从血液中分离出红细胞。该结构采用一个样品入口,一个螺旋式流道和一个二叉出口。该螺旋流道由5圈阿基米德螺旋形微通道组成,通道的横截面为矩形面,该矩形面的宽为100um,高为50um,曲线总长13cm,螺旋最内侧的曲率半径为3mm。该学者将血液以0.15m/s的速率从样品入口注入,在二叉口的下出口处收集7.32um颗粒,在二叉口的上出口处收集1.9um颗粒。
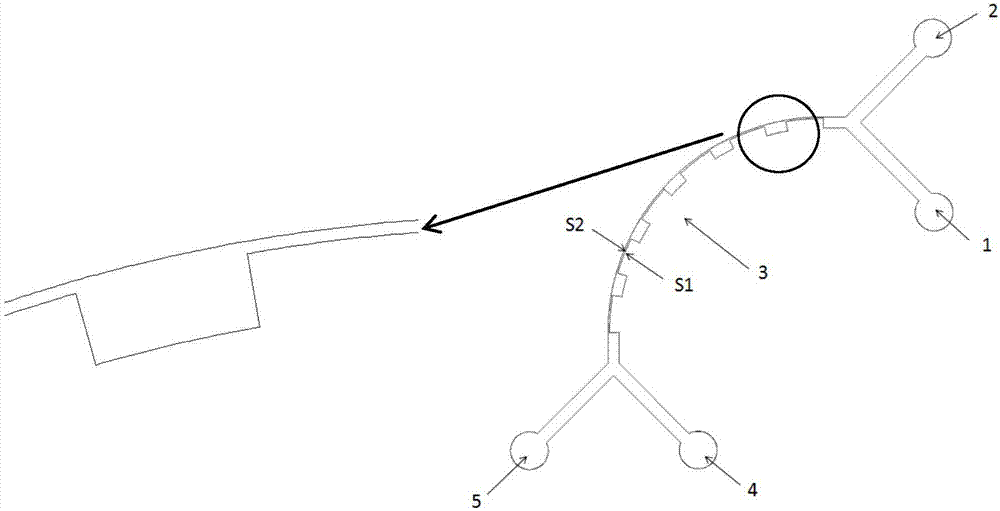
如图3所示,该螺旋结构实现细胞分离原理为:在弯形流道中细胞会受到惯性升力fl和迪恩力fd两个力的共同作用。fl和fd之间的平衡决定了细胞在微通道的平衡位置。当fl≥fd时,细胞往侧壁s1移动,当fl<fd时,细胞往侧壁s2移动;尺寸较大的细胞所受fl较大,尺寸较小的细胞所受fd较大。经过一定长度的流道,大粒子与小粒子就分离开来。
在上述方法中,由于芯片所能承受的压强有限,所以该结构提供的fd和fl较小,限制了分离效率。再者,受其流道结构的限制,不同细胞所处的横向平衡位置之间的间距较小。最后为了达到预期的分离效果,所需流道总长度往往较长,有其他文献设计了单侧缩扩阵列结构用于细胞分离,该结构所需的流道总长度较短,但是在该设计中,细胞只有在从拓宽段进入压缩段时,才会受到fd和fl两个力的共同作用。其余阶段仅受惯性升力fl的影响。fd作用在细胞上的时间十分短暂,且不能保证在如此之短的时间内是否所有的细胞都受到了fd的影响。
下面针对单侧缩扩阵列结构进行详细分析,现有技术文献【1】公开了一种单侧缩扩阵列结构,该结构采用一个样品入口,一个鞘液流入口,两个出口,六个单侧拓宽腔和五个收缩段,用以分离血细胞和血浆(尺寸为2um及2um以下的细胞);该学者以1.2ml/h的速率往样品入口注入血液样品,以12ml/h的速率往鞘液流入口注入磷酸盐缓冲液,在两个出口处分别收集到了血细胞(尺寸为2um以上的细胞)和血浆(尺寸为2um及2um以下的细胞),但是血浆(尺寸为2um及2um以下的细胞)分离效率仅为62.2%。
单侧缩扩阵列结构实现细胞分离原理为:如图4所示,在长直型矩形微通道中,细胞主要受惯性升力fl的影响,从而使细胞聚焦在靠近矩形长边的上下两个平衡位置;在弯形流道中,细胞会受到惯性升力fl和迪恩力fd两个力的共同作用。当液体从拓宽段进入压缩段时,拓宽段的液体以弯曲的路径加速进入压缩段,产生了迪恩涡流,细胞在此迪恩涡流中会受到迪恩力fd的影响,所以细胞在从拓宽段进入压缩段时,将会受到fl和fd两个力的共同作用。fl与fd的大小均与细胞在沟道的横截面上所处的位置有关。fl和fd之间的平衡决定了细胞在微通道中的平衡位置。当fl≥fd时,细胞往侧壁s1移动,当fl<fd时,细胞往侧壁s2移动;尺寸较大的细胞所受fl较大,尺寸较小的细胞所受fd较大。经过若干个缩扩阵列,血细胞(尺寸为2um以上的细胞)和血浆(尺寸为2um及2um以下的细胞)就分离开来。
在上述方法中,细胞只有在从拓宽段进入压缩段时,才会受到fd和fl两个力的共同作用。其余阶段仅受惯性升力fl的影响。fd作用在细胞上的时间十分短暂,且不能保证在如此之短的时间内是否所有的细胞都受到了fd的影响。
其次,由于在其他阶段,细胞仅受fl的影响,fl会将移向侧壁s1和s2的细胞拉向流道中心,使得已处于预期平衡位置的细胞偏离平衡位置,从而在一定程度上降低了分离效率。
参考文献如下:
【1】"inertialbloodplasmaseparationinacontraction–expansionarraymicrochannel";
【2】"enhancedbloodplasmaseparationbymodulationofinertialliftforce";
【3】"continuousparticleseparationinspiralmicrochannelsusingdeanflowsanddifferentialmigration";
【4】"improvedunderstandingofparticlemigrationmodesinspiralinertialmicrofluidicdevices";
【5】"continuousinertialmicroparticleandbloodcellseparationinstraightchannelswithlocalmicrostructures"。
技术实现要素:
针对现有技术的以上缺陷或改进需求,本发明的目的在于提供一种基于惯性原理分离细胞的芯片,其中通过对其关键的流道结构的设置方式等(尤其是对流道内拓宽段与压缩段的形状及相关参数)进行改进,与现有技术相比能够有效解决单一螺旋结构、以及单一单侧缩扩阵列结构两者细胞分离效率低的问题,并且本发明通过控制流道内每段拓宽段与压缩段的长度、宽度、以及流道总长及高度,使得该芯片尤其能以3um和6um尺寸为界限,分离细胞。
为实现上述目的,按照本发明,提供了一种基于惯性原理分离细胞的芯片,其特征在于,包括基体、以及位于该基体内的流道(3),该芯片还包括与所述流道(3)相连的样品入口(1)、鞘液流入口(2)、大尺寸细胞出口(4)和小尺寸细胞出口(5);
其中,
所述样品入口(1)用于向所述流道(3)的入口输入待分离处理的细胞溶液;
所述鞘液流入口(2)用于向所述流道(3)的入口输入鞘液流,该鞘液流用于与所述细胞溶液混合;
所述流道(3)为螺旋形或弧形;该流道(3)具有相对设置的第一侧壁(s1)和第二侧壁(s2),其中所述第一侧壁(s1)位于靠近螺旋中心或弧形中心的内侧,所述第二侧壁(s2)位于远离螺旋中心或弧形中心的外侧;所述第一侧壁(s1)上设置有沿该流道(3)间隔分布的凸槽,使得该流道(3)形成交错分布的拓宽段与压缩段,所述拓宽段对应第一侧壁上分布有凸槽的区域,所述压缩段则对应第一侧壁上没有凸槽的区域;该流道(3)用于对混合有鞘液流的细胞溶液中的细胞按大小进行分离;
所述大尺寸细胞出口(4)位于靠近螺旋中心或弧形中心的一侧,用于从所述流道(3)的出口输出含有大尺寸细胞的细胞分离液;
所述小尺寸细胞出口(5)位于远离螺旋中心或弧形中心的一侧,用于从所述流道(3)的出口输出含有小尺寸细胞的细胞分离液;
此外,所述流道(3)的入口和出口分别位于该流道(3)的两端。
作为本发明的进一步优选,所述流道(3)中,任意一段所述拓宽段的弧长为300~700um,任意一段所述压缩段的弧长为300~1200um;优选的,所述拓宽段的宽度为350um,所述压缩段的宽度为50um;该流道(3)的流道高度为20~25um;优选的,该流道(3)上第二侧壁(s2)最靠近所述螺旋中心或所述弧形中心部分的曲率半径为5mm~7mm。
作为本发明的进一步优选,所述流道(3)中,任意一段所述拓宽段的弧长为700um,任意一段所述压缩段的弧长为1200um;所述流道(3)的高度为25um,该流道(3)的总长为23mm,所需压缩段的个数为11个,所述拓宽段的个数为12个,该流道(3)上第二侧壁(s2)最靠近所述螺旋中心或所述弧形中心部分的曲率半径为7mm,所述大尺寸细胞的粒径不小于6um,所述小尺寸细胞的粒径不超过3um。
作为本发明的进一步优选,从所述样品入口(1)输入的所述待分离处理的细胞溶液的流速与从所述鞘液流入口(2)输入的所述鞘液流的流速之比为1:5。
作为本发明的进一步优选,当所述流道(3)为螺旋形时,该流道(3)优选按阿基米德螺线分布。
作为本发明的进一步优选,所述基体包括上下叠加的上基体和下基体,所述流道(3)设于所述上基体和所述下基体之间。
作为本发明的进一步优选,所述鞘液流为磷酸盐缓冲液。
作为本发明的进一步优选,所述流道(3)的截面为矩形。
本发明中基于惯性原理分离细胞的芯片通过将流道设置成具有单侧缩扩阵列的螺旋/弧形结构,能够有效提高细胞分离效率。本发明是在靠近流道螺旋中心或弧形中心的内侧壁上设置沿该流道间隔分布的凸槽,形成具有交错分布的拓宽段与压缩段结构的流道,进一步挖掘了缩扩阵列结构与螺旋流道结构(或弧形流道结构)这两种流道结构的优势,充分利用流道不同区域内迪恩力与惯性升力的特点,使得缩扩阵列结构与螺旋流道结构(或弧形流道结构)两者有机结合,有效的提高了细胞分离效率。
本发明是在靠近流道螺旋中心或弧形中心的内侧壁上设置沿该流道间隔分布的凸槽,若沿外侧壁上设置沿该流道间隔分布的凸槽则不能达到分离细胞的目的。当沿外侧壁设置凸槽时,大颗粒所受的惯性升力是由侧壁s1指向侧壁s2,此时的惯性升力会将大粒子拽向侧壁s2;与此同时,该沟道中小颗粒在拓宽段进入压缩段时,受的迪恩力也从侧壁s1指向侧壁s2,从而将小颗粒也从侧壁s1拽向侧壁s2,达不到预期的分离效果。
表1:3um与6um颗粒在向内弯单侧扩缩阵列圆弧结构与向外弯单侧扩缩阵列圆弧结构相隔距离
注:此时的相隔距离为6um颗粒最下端与3um颗粒最上端在出口处的相隔距离,此圆弧形外侧壁的曲率半径均为7mm。表中所述6个拓宽段表示的是该沟道有6个拓宽段和5个压缩段(压缩段的数量一般比拓宽段的数量少一)。
本发明最靠近所述螺旋中心或所述弧形中心部分的曲率半径为5mm~7mm。当本发明的曲率半径小于5mm时,会导致最内侧的沟道内容纳不下入口1,入口2,就结构设计合理性而言,本发明的曲率半径不小于5mm。当曲率半径大于7mm时,会降低本发明的分离效率。
表2:3um与6um颗粒在不同曲率半径下的分离效果
本发明的结构的高度一般在20~25um。当分离2um及2um以上的颗粒时,本结构的高度是25um。当分离2um以下的颗粒时,本结构的高度是20um。为保证粒子可在惯性升力作用下聚焦形成单列粒子束,颗粒直径ap与流道特征尺寸即流道高度h需要满足ap/h≥0.07。由于大颗粒在沟道中主要受惯性升力的影响,要想让大颗粒在沟道中呈一条直线从出口流出,必须满足ap/h≥0.07。故当分离颗粒尺寸变小时,沟道高度也应随之变矮。
表3:3um与6um颗粒在不同高度下的相隔距离
注:此圆弧形外侧壁的曲率半径均为7mm。
相对于单一的螺旋结构,本发明中的单侧缩扩阵列螺旋结构能够在更短的流道中分离细胞。当细胞运动至拓宽流道段时,流道的拓宽使得细胞受到的壁面诱导惯性升力突然减小,小尺寸细胞会向s2侧壁运动,并稳定在新的平衡位置,大尺寸细胞会向s1侧壁运动,并稳定在新的平衡位置,造成大尺寸细胞的平衡位置与小尺寸的细胞平衡位置之间的间距变大。当液体从拓宽段进入压缩段时,拓宽段的液体以弯曲的路径加速进入压缩段,该加速会使细胞所受的fl和fd在一定程度上加强,从而让细胞能够更快分离。
本发明中基于惯性原理分离细胞的芯片,其单侧缩扩阵列螺旋形流道(或单侧缩扩阵列弧形流道),能够让细胞在整个流道中都受到迪恩力的影响,相对于现有基于惯性原理分离细胞的缩扩阵列结构,能够有效克服现有缩扩阵列结构只有当细胞从拓宽段流入收缩段时才能受到迪恩力的影响这一缺陷。
现有基于惯性原理分离细胞的缩扩阵列结构中,处于压缩段中后部位的细胞仅受惯性升力的影响,粒子在纯惯性升力作用下会如图4所示聚焦在靠近长边中心的两个平衡位置上,故处于压缩段中后部位的细胞会向流道中心偏移,偏离预期的聚焦平衡位置;而本发明中所采用的具有单侧缩扩阵列螺旋形结构(或弧形结构)的流道,能够让细胞在整个流道中一直受到迪恩力和惯性升力的耦合作用,从而使细胞固定在预期的平衡位置上。
本发明采用单侧缩扩阵列螺旋形流道,在一定程度上提高了螺旋结构的分离效率。对于螺旋结构来说,如图5所示当细胞处于平衡位置时,不同细胞所处的横向平衡位置之间的间距较小,易造成部分细胞混合,导致分离效率降低。本发明设计的单侧缩扩阵列结构螺旋形流道中特殊的单侧缩扩阵列能够让小尺寸细胞向s2侧壁运动,大尺寸细胞会向s1侧壁运动,造成大尺寸细胞的平衡位置与小尺寸的细胞平衡位置之间的间距变大,从而提高分离效率。
对于现有单一的螺旋结构,为达到预期的分离效果,所需流道总长度一般较长。在分离效果一致的情况下,本发明所设计的流道能够在一定程度上缩短流道总长度。
对于单一的螺旋结构,由于该沟道尺寸较长,芯片所能承受的压强有限,在一定流速内,该结构提供的fd和fl较小,限制了分离效率。本发明设计的缩扩阵列能解决这一缺陷,当细胞从拓宽段流入压缩段时,流道突然变小使得流体加速进入压缩段,且此时流体的速度呈几倍增长,流速的增快提供能够提供一个较大的fd和fl,使得细胞能够更快的达到平衡位置。
另外,本发明中基于惯性原理分离细胞的芯片还具有以下优点:
(1)、微型化。整个芯片面积仅为几平方厘米。所需试剂体积仅为微升级别。
(2)、提高了分离效率。应用上述微流控芯片使得大小不同的细胞经过若干个圆弧形压缩拓宽阵列就能分离。
(3)、在线观测。该微流控芯片可以直接在ccd倒置显微镜下进行观察,用高速摄像机进行图像记录,操作方便。
(4)、价格低廉。芯片材质可以采用pdms和有机玻璃。试剂用量少,明显地降低了试剂成本。
附图说明
图1是本发明具有单侧缩扩阵列螺旋结构的分离细胞芯片其整体结构示意图及局部放大示意;
图2是本发明具有单侧缩扩阵列圆弧结构的分离细胞芯片其整体结构示意图及局部放大示意;
图3是现有技术中螺旋结构的芯片实现细胞分离的原理示意图;
图4是现有技术中单种颗粒在直通道中只受惯性升力时所处位置示意图;
图5是现有技术中螺旋结构的芯片实现细胞分离的示意图;
图6a是6um的颗粒在沿外侧壁分布凸槽的圆弧形结构中的分布仿真图,图6b是图6a的局部放大图;
图7a是3um的颗粒在沿外侧壁分布凸槽的圆弧形结构中的分布仿真图,图7b是图7a的局部放大图。
图中各附图标记的含义如下:1为样品入口,2为鞘液流入口,3为细胞分离单元(即,流道),4为大尺寸细胞出口,5为小尺寸细胞出口,s1为内侧壁(即,第一侧壁),s2为外侧壁(即,第二侧壁)。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明公开了一种基于惯性原理分离细胞的微流控芯片,该微流控芯片自上而下包括上基体、下基体,所述上基体可以通过键合的方法和下基体固联为一体;流道凸槽位于上基板中(该流道凸槽在芯片平面上的投影如图1所示;下基体在与上基体接触的表面上可以不设置任何凸槽,同时下基体在与上基体接触的表面平行于芯片平面),如图1所示,所述流道层是一条单侧缩扩阵列结构螺旋形流道,包括一个样品入口1、一个鞘液流入口2、大尺寸细胞出口4以及小尺寸细胞出口5。细胞在流道中会受到迪恩力fd和惯性升力fl的耦合作用,流经一定长度的流道之后,不同尺寸的细胞聚焦于不同的横向平衡位置,最终分离出不同尺寸的细胞。本芯片能够在流速较高的情况下实现细胞分离,且所需流道结构简单,操作简单,通量极高,并在一定程度上提高了细胞分离效率。
本发明中基于惯性原理分离细胞的芯片,是种具有新型流道结构的细胞分离芯片,能够高效、简便、快速的分离细胞,该芯片的制备及使用方法可以采用如下步骤进行:
1、设计流道结构。该流道为一段具有单侧缩扩阵列结构的螺旋流道,流道一端为一y字型的样品和鞘液流入口,1为样品入口,2为鞘液流入口,另一端为一y字型的大小细胞出口,3为大尺寸细胞的出口,4为小尺寸细胞的出口。所述的微通道截面为矩形。
2、设计流道尺寸。该流道缩扩阵列中,拓宽段弧长为300~700um,宽度为350um,压缩段弧长为300~1200um,宽度为50um,流道高度为20~25um。
3、制作芯片。该芯片包括上基体和下基体,上基体的材质可以为聚二甲基硅氧烷(pdms),下基体材质可以为玻璃。两个基体通过键合的方式结合在一起。流道凸槽设于上基体中。
4、处理细胞溶液。在该方案中一定程度稀释的细胞样品会大大减少流道堵塞的风险。
5、在该技术方案中,微流控芯片进样需要动力系统。使用动力系统将细胞样品和鞘液流以合适的速度同时从进样口1和进样口2注入。
6、观察实验结果。
以下为具体实施例:
实施例1
结合图2所示,该细胞分离芯片包括基体、以及基体上的微通道,该通道包括细胞样品进样口1、鞘液流进样口2、细胞分离单元3、大尺寸细胞出口4以及小尺寸细胞出口5。在该技术方案中,微流控芯片进样需要动力系统,动力系统用于将细胞溶液和鞘液流分别从进样口1和进样口2连续注入到芯片中,本实例中的动力系统为注射器泵。鞘液流用于在入口之后的第一个拓宽段将细胞聚焦成一束并贴近s1侧壁进入压缩段。
细胞分离单元3为圆弧形通道,该通道自细胞进样口1向内弯。外侧壁s2向内弯的曲率半径为7mm,该通道的尺寸为流道的任一拓宽段弧长为700um,宽度为350um,任一压缩段弧长为1200um,宽度为50um,整个流道高度为25um,细胞分离单元3的长度23mm(还包括了入口部分和出口部分的长度)。细胞进样口1、鞘液流进样口2、大尺寸粒子出口4的直径可优选为400um,以及小尺寸细胞出口5的直径可优选为400um。
结合图2所示,应用该流道分离不同尺寸的细胞原理为:在连续弯曲的微通道中,细胞主要受升力fl和迪恩力fd两种力。fl和fd之间的平衡决定了细胞在微通道的平衡位置。当fl≥fd时,细胞往侧壁s1移动,当fl<fd时,细胞往侧壁s2移动;尺寸较大的细胞所受fl较大,尺寸较小的细胞所受fd较大。当细胞运动至拓宽流道段时,流道的拓宽使得细胞受到的壁面诱导惯性升力突然减小,小尺寸细胞会向s2侧壁运动,并稳定在新的平衡位置,大尺寸细胞会向s1侧壁运动,并稳定在新的平衡位置,造成大尺寸细胞的平衡位置与小尺寸的细胞平衡位置之间的间距变大。当液体从拓宽段进入压缩段时,拓宽段的液体以弯曲的路径加速进入压缩段,该加速会使细胞所受的fl和fd在一定程度上加强,从而让细胞能够更快分离。
该技术方案中两个样品的流速会影响细胞分离效果,不同的流速比所产生的分离效率也不同。本实例中细胞样品与鞘液流的速度比为1:5。使用两个注射器泵将细胞样品(稀释的血液)和鞘液流(磷酸盐缓冲液)分别以0.012m/s、0.06m/s的速度同时从进样口1和进样口2注入。(此时对应沟道中最大速度为0.8m/s)
检测时,采用ccd倒置显微镜进行观察,用高速摄像机进行视频记录。通过观察,可以看见血细胞(尺寸为6um以上的细胞)逐渐往侧壁s1移动,血浆(尺寸为3um及3um以下的细胞)逐渐往侧壁s2移动。
微流控芯片工作流程包括:
1、准备好两台注射器泵,将注射器分别抽取已稀释的血液细胞和磷酸盐缓冲液,放在注射器泵上通过特氟龙管与芯片连接好。
2、将芯片放在ccd倒置显微镜下合适位置,调节焦距,进行清晰观察。
3、打开注射器泵,调节流速,实现观测不同尺寸的细胞分离。
表4:不同速度下,3um与6um颗粒在直沟道与单侧扩缩阵列圆弧结构分离的距离
注:此时的相隔距离为6um颗粒最下端与3um颗粒最上端在出口处的相隔距离。此圆弧形结构的曲率半径均为7mm。表中所述6个拓宽段表示的是该沟道有6个拓宽段和5个压缩段。表中所述12个拓宽段表示的是该沟道有12个拓宽段和11个压缩段。
表5:2um与7um颗粒在单侧扩缩圆弧形结构与螺旋形结构中分离的距离
注:此时的相隔距离为7um颗粒最下端与2um颗粒最上端在出口处的相隔距离,此圆弧形结构的曲率半径均为7mm。该螺旋形结构为continuousparticleseparationinspiralmicrochannelsusingdeanflowsanddifferentialmigration即文献【3】中的结构,该结构模型高为50um,宽为100um,最内侧曲率半径为3mm,总长为13cm.,该表中的速度为对应模型分离效率最佳时的速度。
表6:3um与7um颗粒在三种不同模型中分离的距离
注:此时的相隔距离为6um颗粒最下端与3um颗粒最上端在出口处的相隔距离。两个圆弧形结构的曲率半径均为7mm。圆弧结构的尺寸为:宽50um,弧长21.6mm。此时这两种圆弧形的弧长与直通道的长相等。
由上表可知,当次三种模型尺寸一致,速度一致时,本发明3um与7um颗粒相隔距离为141.6mm,大于另两种结构分离距离之和。
本发明中,入口(包括样品入口1、鞘液流入口2)与出口(包括大尺寸细胞出口4、小尺寸细胞出口5)的位置可以互换,此时,流道拓宽段对应的凸槽仍位于内侧壁s1上,大尺寸细胞出口4仍位于内侧壁s1的同一侧上,小尺寸细胞出口5仍位于外侧壁s2的同一侧上。
本发明中的流道既可以是螺旋形,也可以是弧形,可根据具体待分离的细胞颗粒大小而定,例如,由表4可以看到,当单侧扩缩螺旋形结构越长,粒子分离所需的最优速度就越小,如6个拓宽段单侧扩缩阵列圆弧结构分离3um与6um颗粒所需最优速度为1.3m/s,而12个拓宽段单侧扩缩阵列圆弧结构分离3um与6um颗粒所需最优速度为0.8m/s。由于芯片尺寸较小,且是由键和的方式将上下基体结合在一起,故芯所承受的压强有限,当最优速度降低时,能够有效降低由于沟道内部水压过大,导致液体从入口处渗出的概率。在实际使用时,若对速度要求不那么高时,可以采用较长的沟道,用以降低由于芯片内压强过大,而导致破裂和渗水的概率。
本发明中的流道的弧形可以为椭圆弧或正圆弧;当弧形为圆弧形时,弧形中心即圆弧圆心。另外,本发明中的流道高度也根据待分离粒子的直径灵活调整,例如,分离10um到2um的粒子可使用高度为25um,分离1.7um到0.5um的粒子可使用高度为20um。
本发明中流道的曲率半径均是以流道第二侧壁s2的曲率半径为基准;当流道为圆弧形,则流道各处的曲率半径保持不变;当流道为螺旋形时,第二侧壁s2最靠近螺旋中心部分的曲率半径为5mm~7mm(即对应流道靠近螺旋中心的一端)。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!