单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精的制备和应用的制作方法
本发明涉及一种β-环糊精修饰苯达莫司汀而得到的化合物,还涉及β-环糊精修饰的苯达莫司汀偶联物在制备抗肿瘤药物中的应用,属于苯达莫司汀偶联物的制备及应用领域。
背景技术
苯达莫司汀(英文名bendamustine),是由烷基化氮芥(一种非功能烷化剂)连接一个嘌呤和氨基酸得到的一种双功能基烷化剂。在上世纪60年代,盐酸苯达莫司汀由前东德研制而成。2008年3月,美国fda首先批准盐酸苯达莫司汀用于治疗慢性淋巴细胞性白血病(cll)。盐酸苯达莫司汀单独或与其它抗肿瘤药物联合用药被广泛用于非霍奇金淋巴瘤、霍奇金病、多发性骨髓瘤和乳腺癌等恶性肿瘤。目前多个苯达莫司汀的临床试验表明苯达莫司汀在抗肿瘤方面的应用成为当下研究的热点,尽管苯达莫司汀是一个非常活跃的烷化剂,其药理作用由于其溶解度差和生物利用度受到阻碍。此外苯达莫司汀在中性或碱性ph的水溶液中不稳定,容易发生水解,所以市场销售的盐酸苯达莫司汀为冻干粉剂,使用前临时配制。为了达到治疗效果,需要高剂量或者重复剂量。因此,许多方法已被用来克服阻碍苯达莫司汀治疗的局限性问题。
环糊精是一类d-型吡喃葡萄糖以1,4-糖苷键首尾相连的环状分子,具有疏水的内腔和亲水的外壁。天然环糊精的主面和侧面羟基可以被各种基团选择修饰生成功能性环糊精衍生物。将适当的疏水药物基团连接到环糊精空腔的边臂上时,根据修饰基团的柔韧性和长度,疏水药物基团可以与环糊精的空腔通过超分子自组装在体内受各种不同的生理环境的调控形成基于分子内或分子间配合物的各种纳米结构体系(liu,y.;fan,z.;zhang,h.y.;diao,c.h.orglett.2003,5,251-254)。这种由药物载体通过自组装逐渐放大形成纳米体系的过程不仅有利于药物运输,同时药物载体的疏水空腔可以使药物在存储和体内运输过程中免受各种酶的侵袭,提高药物的稳定性,改善药物的生物利用度。
天然β-环糊精与苯达莫司汀的包结能力弱,这种超分子复合物在还没有到达病变位点之前就有可能在体液环境中解离。因此,将苯达莫司汀引入β-环糊精的边臂对其进行修饰,以提高苯达莫司汀的水溶性,增强其稳定性,改善药物的生物利用度,使其在低剂量下发挥抗肿瘤作用,将为临床肿瘤治疗提供新的途径。
技术实现要素:
本发明所要解决的第一个技术问题是提供一种化学名称为单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精的化合物;
本发明所要解决的第二个技术问题是提供一种所述单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精的制备方法;
本发明所要解决的第三个技术问题是提供所述的单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精在制备抗肿瘤药物中的应用。
为解决上述技术问题,本发明所采取的技术方案是:
本发明首先公开了一种单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精,其结构式为式ⅰ所示:
式中,β-cd为β-环糊精。
本发明进一步公开了一种制备所述的单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精的方法,包括以下步骤:
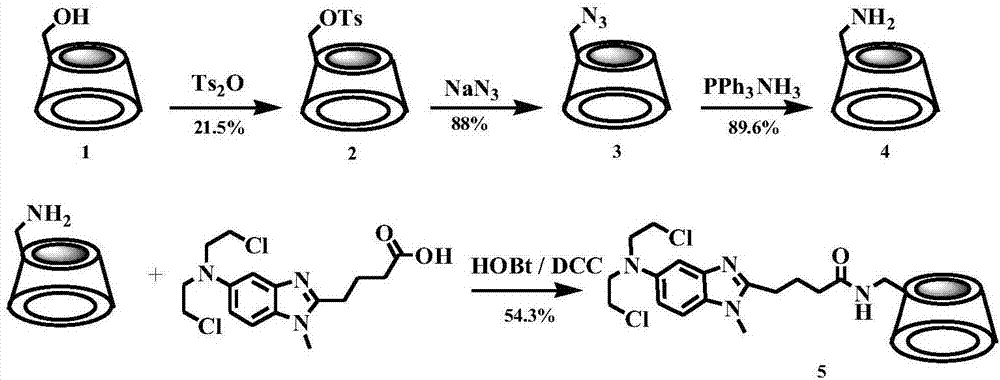
(1)在蒸馏水中,用ts2o将β-环糊精的单个6位羟基对甲苯磺酰化生成6-o-(p-甲苯磺酰基)-β-环糊精;
(2)在蒸馏水中,6-o-(p-甲苯磺酰基)-β-环糊精与叠氮化钠反应生成单-(6-叠氮基-6-脱氧)-β-环糊精;
(3)无水dmf(n,n-二甲基甲酰胺)存在下,单-(6-叠氮基-6-脱氧)-β-环糊精与三苯基膦和氨水反应生成单-(6-氨基-6-脱氧)-β-环糊精;
(4)将苯达莫司汀与单-(6-氨基-6-脱氧)-β-环糊精进行缩合生成单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精,即得。
其中,步骤(1)按照摩尔比计,β-环糊精:ts2o=88:13;所述反应的条件为低温下搅拌反应2h。步骤(2)按照摩尔比计,6-o-(p-甲苯磺酰基)-β-环糊精:叠氮化钠=1:12.3;所述反应的条件为80℃油浴下搅拌反应(冷凝回流)5h。步骤(3)按照摩尔比计,单-(6-叠氮基-6-脱氧)-β-环糊精:三苯基膦=1:2.2;按照mmol/ml计,单-(6-叠氮基-6-脱氧)-β-环糊精:浓氨水=1:3.5。所述反应的条件为:在0.5h内向用dmf溶解的单-(6-叠氮基-6-脱氧)-β-环糊精中滴加三苯基磷,滴加浓氨水。
步骤(4)按照摩尔比计,苯达莫司汀:单-(6-氨基-6-脱氧)-β-环糊精=3:1。步骤(4)在n,n-二甲基甲酰胺(dmf)溶液中,用1-羟基苯并三唑(hobt),n,n'-二环己基碳二亚胺(dcc)将苯达莫司汀与单-(6-氨基-6-脱氧)-β-环糊精脱水缩合。其中,按照摩尔比计,苯达莫司汀:1-羟基苯并三唑:n,n'-二环己基碳二亚胺=1:1:1;所述反应的条件为冰盐浴下加入n,n-二甲基甲酰胺将盐酸苯达莫司汀溶解,加入dcc,hobt冰浴下活化反应1h,撤冰浴室温下加入单-(6-氨基-6-脱氧)-β-环糊精进行搅拌反应8h。
本发明进一步公开了所述的单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精在制备抗肿瘤药物中的应用。
本发明所制备的单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精的稳定性比苯达莫司汀有显著性提高。
体内抗肿瘤活性实验表明,本发明所述的单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精具有优秀的抗肿瘤活性,在低于苯达莫司汀100倍的低剂量下达到了与苯达莫司汀自身相当的抗肿瘤活性。说明,本发明所述的单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精具有优于苯达莫司汀的抗肿瘤活性。
本发明所述的新型抗肿瘤化合物单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精,因其药效团与β-环糊精空腔间的自组装相互作用,使得药效团在运输过程中被环糊精空腔所保护,稳定性得到显著提高,在到达病变位点能有效实施其抗肿瘤活性,因此在低于苯达莫司汀100倍的低剂量下表现出与苯达莫司汀自身相当的抗肿瘤活性。
本发明所述的单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精具有优秀的抗肿瘤活性,为苯达莫司汀的临床应用提供了新的路径,在肿瘤治疗领域展现出潜在的应用前景。
本发明技术方案与现有技术相比,具有以下有益效果:
本发明将β-环糊精主面6位上的羟基通过亚胺基与苯达莫司汀偶联,形成的苯达莫司汀衍生物,不仅可以提高苯达莫司汀的水溶性,而且药效团苯达莫司汀可能通过与环糊精空腔间的自组装作用被环糊精空腔所保护,增强其稳定性,改善药物的生物利用度。药效团在体内能够被安全运输,到达病变位点时能有效地发挥其抗肿瘤作用,使其在低剂量下发挥抗肿瘤作用,为临床肿瘤治疗提供了一种新的途径。
附图说明
图1为本发明单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精的合成路线;
图2为苯达莫司汀的结构式;
图3为本发明单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精体外稳定性提高图;其中,a为苯达莫司汀(bdh);b为本发明化合物(5)。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
实施例1制备单(6-氧-6-对甲苯磺酰基)-β-环糊精(2)
β-环糊精(1)(9.99g,88mmol)溶解在220ml水中,加入碾细的ts2o(4.26g,13mmol)结晶在冰浴下搅拌反应2h。向反应液中滴加10%naoh水溶液,搅拌20min后过滤。用nh4cl调滤液ph值到中性,析出大量白色固体,冰箱中冷藏过夜,过滤得到白色固体2.97g,产率26.1%。esi/ms(m/z):1290.30[m+h]+。
实施例2制备单-(6-叠氮基-6-脱氧)-β-环糊精(3)
将单(6-氧-6-对甲苯磺酰基)-β-环糊精(2)(1.34g,1mmol)和叠氮化纳(0.82g,12.3mmol)用13.5ml蒸馏水溶解,在80℃油浴下搅拌反应(冷凝回流)。5h后将茄形瓶取出冷却至室温,过滤得到白色固体粉末(1.02g,83%)。esi-ms(m/z):1187.40[m+h]+。
实施例3制备单-(6-氨基-6-脱氧)-β-环糊精(4)
将单-(6-叠氮基-6-脱氧)-β-环糊精(3)(1.21g,1mmol)用5mldmf溶解加入50ml茄形瓶中,在0.5h内往反应液中滴加三苯基磷(0.58g,2.2mmol)。滴加3.5ml浓氨水,过滤得白色固体粉末(0.81g,70%)。esi-ms(m/z):1135.20[m+h]+。
实施例4制备单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精(5)
在50m茄形瓶中加入盐酸苯达莫司汀(1.30g,3.3mmol),冰盐浴下加入n,n-二甲基甲酰胺(30ml)将其溶解,加入dcc(0.70g,3.3mmol),hobt(0.40g,3.3mmol)冰浴下活化反应1h,撤冰浴室温下加入单-(6-氨基-6-脱氧)-β-环糊精(4)(1.31g,1.1mmol)进行搅拌反应8h点板监测反应完全。进行柱层析分离得到纯品(0.86g54.3%)。qtof/ms(m/z):1418.5802[m-x]+;1h-nmr(500mhz,d2o):δ=7.323(d,j=7hz,1h),7.147(s,1h),6.971(d,j=6hz,1h),5.105-5.155(m,7h),3.813-3.994(m,28h),3.502-3.687(m,14h),3.330-3.370(m,8h),3.245-3.272(m,3h),2.282(d,j=9hz,2h),2.012(d,j=6hz,2h),1.261(t,j=9hz,2h).13c-nmr(125mhz,dmso-d6)δ/ppm=172.44,148.37,143.15,130.74,114.11,110.02,105.57,102.44,82.14,73.50,72.74,70.29,63.27,60.73,51.84,45.98,34.80,31.72,29.88,29.06。
本发明所述单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精(化合物(5))的合成路线见图1。
实施例5本发明化合物(5)体外稳定性
以ph=7.4(c=0.1mol/l)的tris-hcl缓冲溶液为溶剂,分别配制浓度为2.0×10-4mol/l的苯达莫司汀(bdh)(苯达莫司汀的结构式见图2)和本发明化合物(5)的溶液。分别测定各组样品随时间变化的紫外吸收光谱。
从图3可以看出苯达莫司汀在320nm处的最大吸收峰的吸光度随时间变化明显下降。而本发明化合物(5)在300nm处的最大吸收峰的吸光度随时间基本不发生变化。说明本发明化合物(5)的稳定性比苯达莫司汀都有显著性提高。
苯达莫司汀和本发明化合物(5)的降解符合一级反应动力学,其吸光度的变化符合公式ln(a0/at)=kt。其中a0、at分别代表时间0点和t点时的紫外最大吸收强度,k表示降解速率常数,半衰期τ1/2可以通过公式τ1/2=0.693/k计算得到。降解动力学数据见表1。
表1各化合物在ph=7.4tris-hcl缓冲溶液中室温下的降解回归方程
注:其中苯达莫司汀(bdh)的半衰期为64.36min,本发明化合物(5)的半衰期为2166.08min,表明与苯达莫司汀相比,本发明化合物(5)的稳定性有显著性提高。
实验例1评价本发明化合物(5)的体内抗肿瘤活性
体内抗肿瘤实验采用荷s180肉瘤icr小鼠(4-6周龄,体重20±2g)。取传代接种后7天之瘤源小鼠,无菌条件下从腹腔抽出瘤液荷s180瘤细胞液,用灭菌理盐水调整瘤细胞数至1.2×107个/ml。健康icr雄性小鼠静息一天后,在每只小鼠右腋皮下接种s180细胞液0.2ml,并在接种后随机分为6组,每组12只。给药组分别为空白对照组(生理盐水组ns)、阳性对照组阿霉素(dox,2μmol/kg)、苯达莫司汀(bdh,2μmol/kg)、本发明化合物组(5)(分别为2μmol/kg,0.2μmol/kg和0.02μmol/kg)。接种第三日起同时灌胃给药,每日给药一次,连续10天。每天记录小鼠的生存状态,第十三天脱椎处死,称体重,解剖剥离皮下瘤体,称瘤重。按抑瘤率和存活率,同时剖取每只小鼠的肿瘤。最后统计各组动物的抑瘤率。实体瘤的疗效以瘤重抑制百分率表示,计算如下:瘤重抑制率%=(1-给药组瘤重/空白组瘤重)×100%。统计学方法:独立样本t检验和方差分析。结果列入表2。
表2本发明化合物(5)对icr雄性小鼠肿瘤的影响
注:瘤重用
在体内小鼠移植性肿瘤模型中,分别对阿霉素(dox)、苯达莫司汀(bdh)、不同剂量的本发明化合物(5)进行抗肿瘤评价。抑瘤率按公式计算:抑瘤率=(生理盐水组平均瘤重-实验组平均瘤重)/生理盐水组平均瘤重;统计学方法:独立样本t检验和方差分析。得到以下结果:
(1)阿霉素(dox)在2μmol/kg的给药剂量下,抑瘤率为60.55%,与生理盐水组瘤重相比p<0.01,两组差别有非常显著性意义,并且生理盐水组瘤重为2.227±0.432g,说明小鼠移植性肿瘤模型建立成功。
(2)苯达莫司汀(bdh)在2μmol/kg的给药剂量下,抑瘤率为29.46%,与生理盐水组瘤重相比p<0.01,两组差别有非常显著性意义,说明苯达莫司汀具有一定的抗肿瘤活性。
(3)本发明化合物(5)在2μmol/kg的给药剂量下,抑瘤率为52.15%,与生理盐水组瘤重相比p<0.01,两组差别有非常显著性意义,说明本发明化合物(5)具有优秀的抗肿瘤活性。本发明化合物(5)在0.2μmol/kg的给药剂量下,抑瘤率为43.19%,与苯达莫司汀(bdh)在2μmol/kg的给药剂量下相比p<0.05,两组差别有显著性意义。继续降低本发明化合物(5)的给药剂量至0.02μmol/kg,抑瘤率为31.98%,与苯达莫司汀(bdh)在2μmol/kg的给药剂量下相比p>0.05,两组差别无显著性意义,表明本发明化合物(5)在低于苯达莫司汀100倍的低剂量下达到了与苯达莫司汀自身相当的抗肿瘤活性。说明本发明化合物(5)具有优于苯达莫司汀的抗肿瘤活性。
综上所述,本发明的新型抗肿瘤化合物单-6-(苯达莫司汀酰胺基)-6-脱氧-β-环糊精因其药效团与β-环糊精空腔间的自组装相互作用使得药效团在运输过程中被环糊精空腔所保护,稳定性得到显著提高,在到达病变位点能有效实施其抗肿瘤活性,因此在低于苯达莫司汀100倍的低剂量下表现出与苯达莫司汀自身相当的抗肿瘤活性。本发明化合物(5)具有优秀的抗肿瘤活性,为苯达莫司汀的临床应用提供新的路径,在肿瘤治疗领域展现出潜在的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!