一种由炔酰胺和噁二唑酮制备胺基咪唑衍生物的方法与流程
本发明涉及一种由炔酰胺和噁二唑酮制备噁唑衍生物的方法。由炔酰胺和噁二唑酮为原料,酸存在的条件下,通过[3+2]环加成构建得到的。
背景技术
氨基官能化的杂环化合物往往表现出特殊的生物活性(文献1::munk,s.a.;harcourt,d.a.;arasasingham,p.n.;burke,j.a.;kharlamb,a.b.;manlapaz,c.a.;padillo,e.u.;roberts,d.;runde,e.;williams,l.;wheeler,l.a.;garst,m.e.j.med.chem.1997,40,18-23;kokatla,h.p.;sil,d.;malladi,s.s.;balakrishna,r.;hermanson,a.r.;fox,l.m.;wang,x.k.;dixit,a.;david,s.a.j.med.chem.2013,56,6871-6885.)。目前,它们主要通过简单杂环和胺化试剂在过渡金属催化下进行c-n偶联得到(文献2:sun,k.;wang,x.;liu,l.l.;sun,j.j.;liu,x.;li,z.d.;zhang,z.g.;zhang,g.s.acscatal.2015,5,7194-7198.;su,m.j.;hoshiya,n.;buchwald,s.l.org.lett.2014,16,832-835.)。由于炔酰胺结构本身就带有氮原子,如果将其用于杂-环加成反应,就可直接得到氨基取代的杂环化合物,不需要进行额外的c-n偶联反应。本专利提供了一种非金属催化的[3+2]环加成,实现了胺基咪唑衍生物的制备。
技术实现要素:
为解决上述问题,本发明提供了一种由炔酰胺和噁二唑酮制备胺基咪唑衍生物的方法,技术方案如下:
1.一种由炔酰胺和噁二唑酮制备胺基咪唑衍生物的方法以炔酰胺1为原料,与噁二唑酮2,得到胺基咪唑衍生物3反应式如下:
其中r、r1、r2、r3、r4分别为c1-c8烷基、c1-c8烷氧基、萘基、呋喃基、苯基、或取代的苯基中的任意一种或二种以上,上述取代的苯基中,苯基上的取代基为c1-c8烷基、c1-c8烷氧基、-cf3、-f、-cl、-br、-i、-no2中的一种或二种以上;z是-co-,-(ch3)2c-中的一种或两种。
具体操作步骤如下:
在惰性气体环境中,按摩尔比1.2:1炔酰胺1和噁二唑酮2,加入溶剂,再加入酸,tcl监测,反应结束后,用旋转蒸发仪蒸干溶剂,所得固体即为胺基咪唑衍生物3。
本发明有以下优点:
1.所用催化剂为酸,不需要金属催化剂;
2.当溶剂为四氢呋喃时,不能得到目标产物,实施例1溶剂为dce,收率为77%;
3.当酸为三氟甲磺酸时,收率为61%,实施例1酸为双三氟甲磺酰亚胺,收率为77%;
4.当酸是对甲苯磺酸时,不反应。
5.生成的噁唑衍生物3的反应操作简单,迅速,只通过简单的一步反应就可已得到产物,不需要进行多步反应。
附图说明
图1为实施例1底物3a的核磁氢谱;
图2为实施例1底物3a的核磁碳谱;
图3为实施例2底物3b的核磁氢谱;
图4为实施例2底物3b的核磁碳谱;
图5为实施例3底物3c的核磁氢谱;
图6为实施例3底物3c的核磁碳谱;
图7为实施例4底物3d的核磁氢谱;
图8为实施例4底物3d的核磁碳谱;
图9为实施例5底物3e的核磁氢谱;
图10为实施例5底物3e的核磁碳谱;
图11为实施例6底物3f的核磁氢谱;
图12为实施例6底物3f的核磁碳谱;
图13为实施例7底物3g的核磁氢谱;
图14为实施例7底物3g的核磁碳谱;
图15为实施例8底物3h的核磁氢谱;
图16为实施例8底物3h的核磁碳谱。
具体实施方式
(1)参照文献,经三步合成炔酰胺:第一步,苯磺酰氯和苄胺在二氯甲烷中反应生成二级胺(式1,反应方程式1);第二步,炔与nbs在丙酮中,硝酸银为催化剂,得到炔溴(式1,反应方程式2);第三步,炔溴与二级胺在五水硫酸铜做催化剂,甲苯作溶剂,无水碳酸钾做碱的条件下得到炔胺。(式3,反应方程式3)。(文献2:zhang,y.s.;hsung,r.p.;tracey,m.r.;kurtz,k.m.org.lett.,2004,6,1151-1154.)
(1)苯甲腈与羟胺盐酸盐在碳酸钾的作用下生成n-羟基苯脒,之后在dbu的作用下与cdi生成噁二唑酮(yu,x.l.;chen,k.h.;yang,f.;zha,s.k.;zhu,j.org.lett.2016,18,5412-5415.),之后在碱的作用下将n保护得到保护的噁二唑酮2(式1,反应方程式4,反应方程式5,反应方程式6,反应方程式7,反应方程式8,反应方程式9)
式1.炔酰胺及噁二唑酮的合成步骤
(2)由炔酰胺制备胺基咪唑衍生物
式4.噁唑衍生物的合成步骤
反应方程式见式4,于反应器中进行反应,反应器与手套箱中,完全氩气环境中,加入0.2mmol的炔酰胺1,1.2eq.的噁二唑酮2,然后加入2ml溶剂,加入酸,10℃-120℃下反应5min-24h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到胺基咪唑衍生物3。
实施例1
于10ml反应管中进行反应,加入1.2eq.(86.6mg)的1a,0.2mmol(36.2mg)的噁二唑酮2a,然后加入2ml溶剂,加入酸(15%,8.4mg)90℃下反应12h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到噁唑衍生物3a(75.8mg,77%)。
核磁数据均来自于bruker400mhz核磁,核磁氢谱内标为tms,cdcl3为7.26ppm,碳谱cdcl3为77.16ppm。
3a的表征数据如下:
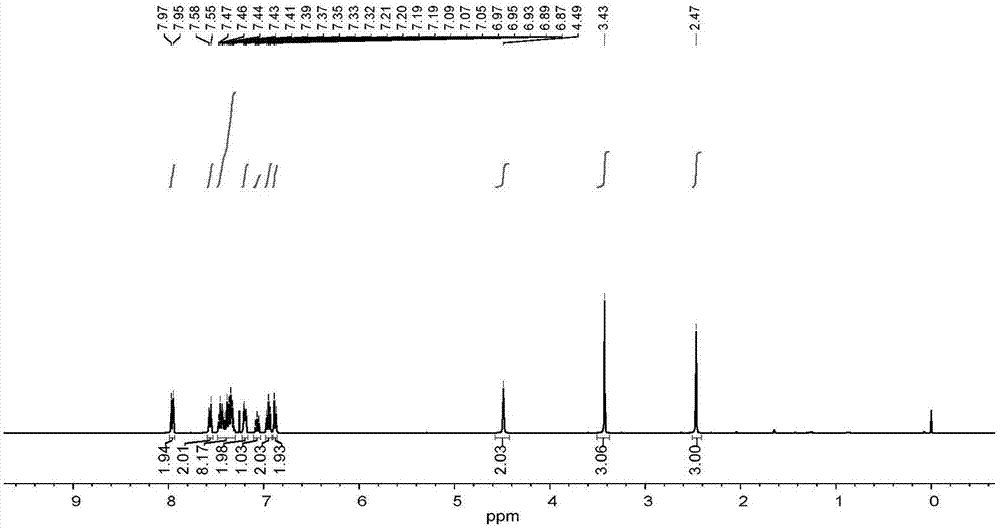
1hnmr(400mhz,cdcl3)δ7.96(d,j=8.2hz,2h),7.57(d,j=8.3hz,2h),7.49–7.30(m,8h),7.23–7.17(m,2h),7.07(t,j=7.3hz,1h),6.95(t,j=7.6hz,2h),6.88(d,j=7.3hz,2h),4.49(s,2h),3.43(s,3h),2.47(s,3h).(谱图见说明书附图1)
13cnmr(100mhz,cdcl3)δ145.8,143.6,136.5,135.5,134.0,133.4,130.6,130.3,129.5,129.03,129.00,128.97,128.95,128.7,128.4,128.3,127.9,127.2,54.6,34.1,21.8.(谱图见说明书附图2)
实施例2
于10反应管中进行反应,加入1.2eq.(90mg)的1b,0.2mmol(35.2mg)的噁二唑酮2a,然后加入2ml溶剂,加入酸(15%,8.4mg)90℃下反应12h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到噁唑衍生物3b(71.3mg,70%)。
3b的表征数如下:
1hnmr(400mhz,cdcl3)δ7.91(d,j=8.2hz,2h),7.58(d,j=6.9hz,2h),7.49–7.39(m,3h),7.37–7.28(m,3h),7.23–7.19(m,2h),7.16(t,j=7.4hz,1h),7.10(d,j=7.5hz,1h),7.05(t,j=7.6hz,2h),6.98(d,j=7.3hz,2h),4.68(d,j=13.8hz,1h),4.37(d,j=13.9hz,1h),3.28(s,3h),2.46(s,3h),1.56(s,3h).(谱图见说明书附图3)
13cnmr(100mhz,cdcl3)δ145.4,143.5,138.9,136.6,136.2,134.0,132.7,132.7,130.7,129.7,129.4,129.2,129.0,128.9,128.7,128.1,128.0,127.4,125.8,54.5,32.9,21.8,19.1.(谱图见说明书附图4)。
实施例3
于10ml反应管中进行反应,加入1.2eq.(90mg)的1c,0.2mmol(35.2mg)的噁二唑酮2a,然后加入2ml溶剂,加入酸(15%,8.4mg)90℃下反应12h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到噁唑衍生物3c(78mg,77%)。
3c的表征数如下:
1hnmr(400mhz,cdcl3)δ7.95(d,j=8.2hz,2h),7.55(d,j=6.9hz,2h),7.47–7.39(m,3h),7.36(d,j=8.1hz,2h),7.14(d,j=7.9hz,2h),7.11–7.03(m,3h),6.97(t,j=7.6hz,2h),6.91(d,j=7.3hz,2h),4.49(s,2h),3.41(s,3h),2.46(s,3h),2.40(s,3h).(谱图见说明书附图5)
13cnmr(100mhz,cdcl3)δ145.6,143.5,138.1,136.6,135.7,133.8,133.4,130.7,130.2,129.4,129.1,129.0,128.91,128.87,128.7,127.8,127.2,125.5,54.6,33.9,21.8,21.5.(谱图见说明书附图6)
实施例4
于10ml反应管中进行反应,加入1.2eq.(95mg)的1c,0.2mmol(35.2mg)的噁二唑酮2a,然后加入2ml溶剂,加入酸(15%,8.4mg)90℃下反应12h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到噁唑衍生物3d(92mg,87%)。
3d的表征数如下:
1hnmr(400mhz,cdcl3)δ7.95(d,j=8.2hz,2h),7.55(d,j=9.3hz,2h),7.49–7.41(m,3h),7.38(d,j=8.1hz,2h),7.30(d,j=8.4hz,2h),7.15–7.07(m,3h),6.99(t,j=7.6hz,2h),6.90(d,j=7.2hz,2h),4.47(s,2h),3.41(s,3h),2.47(s,3h).(谱图见说明书附图7)
13cnmr(100mhz,cdcl3)δ146.2,143.7,136.4,135.5,134.4,134.2,132.3,131.5,130.3,129.5,129.2,129.1,129.0,128.9,128.8,128.6,127.9,127.4,126.8,54.6,34.0,21.8.(谱图见说明书附图8)。
实施例5
于10ml反应管中进行反应,加入1.2eq.(81.8mg)的1a,0.2mmol(35.2mg)的噁二唑酮2a,然后加入2ml溶剂,加入酸(15%,8.4mg)90℃下反应12h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到噁唑衍生物3e(40mg,42%)。
3e的表征数如下
1hnmr(400mhz,cdcl3)δ7.81(d,j=8.0hz,2h),7.46–7.37(m,5h),7.36–7.29(m,5h),7.25–7.22(m,2h),4.61(s,2h),3.48(s,3h),2.44(s,5h),1.20–1.13(m,2h),0.92–0.83(m,2h),0.80(t,j=7.3hz,3h).(谱图见说明书附图9)
13cnmr(100mhz,cdcl3)δ144.6,143.4,136.9,136.4,132.8,132.7,130.8,129.4,129.4,128.9,128.7,128.61,128.56,128.2,127.6,54.1,32.4,30.8,23.2,23.0,21.7,13.9.(谱图见说明书附图10)。
实施例6
于10ml反应管中进行反应,加入(1.2eq.)(86.6mg)的1a,0.2mmol(50.6mg)的噁二唑酮2b,然后加入2ml溶剂,加入酸(15%,8.4mg)90℃下反应12h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到噁唑衍生物3f(93.7mg,82%)。
3f的表征数如下
1hnmr(400mhz,cdcl3)δ7.87(d,j=8.1hz,2h),7.66(d,j=8.1hz,1h),7.43(d,j=3.9hz,2h),7.35–7.29(m,6h),7.13(t,j=7.2hz,1h),7.08(d,j=6.3hz,2h),7.03(t,j=7.5hz,2h),6.97(d,j=7.3hz,2h),4.48(s,2h),3.20(s,3h),2.41(s,3h).(谱图见说明书附图11)
13cnmr(100mhz,cdcl3)δ144.3,143.6,136.1,135.4,133.1,132.9,132.7,132.4,131.3,130.4,129.8,129.5,128.8,128.3,128.22,128.17,128.0,127.7,127.4,124.9,54.3,32.7,21.7.(谱图见说明书附图12)。
实施例7
于10ml反应管中进行反应,加入(1.2eq.)(86.6mg)的1a,0.2mmol(41.2mg)的噁二唑酮2c,然后加入2ml溶剂,加入酸(15%,8.4mg)90℃下反应12h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到噁唑衍生物3g(77.4mg,74%)。
3g的表征数如下
1hnmr(400mhz,cdcl3)δ7.95(d,j=8.2hz,2h),7.49(d,j=8.7hz,2h),7.40–7.29(m,5h),7.22–7.17(m,2h),7.06(t,j=7.3hz,1h),7.00–6.92(m,4h),6.88(d,j=7.3hz,2h),4.48(s,2h),3.86(s,3h),3.40(s,3h),2.47(s,3h).(谱图见说明书附图13)
13cnmr(100mhz,cdcl3)δ160.2,145.8,143.6,136.6,135.6,133.7,133.1,130.4,130.3,129.5,129.02,128.96,128.6,128.2,128.2,127.8,127.2,123.1,114.2,55.5,54.6,34.0,21.8.(谱图见说明书附图14)。
实施例8
于10ml反应管中进行反应,加入(1.2eq.)(86.6mg)的1a,0.2mmol(41.2mg)的噁二唑酮2d,然后加入2ml溶剂,加入酸(15%,8.4mg)90℃下反应12h。反应结束后旋蒸掉溶剂后,固体进行硅胶柱层析,得到噁唑衍生物3h(78.0mg,77%)。
3h的表征数如下
1hnmr(400mhz,cdcl3)δ7.83(d,j=7.8hz,2h),7.33–7.23(m,8h),7.11(d,j=7.5hz,3h),7.06–7.00(m,2h),6.97(t,j=8.4hz,4h),4.51(s,2h),4.05(s,2h),3.11(s,3h),2.42(s,3h).(谱图见说明书附图15)
13cnmr(100mhz,cdcl3)δ144.2,143.4,137.0,136.3,135.6,132.3,132.1,130.3,129.4,129.3,128.72,128.69,128.5,128.3,128.10,128.05,127.9,127.3,126.7,54.1,33.9,31.5,21.7.(谱图见说明书附图16)。
- 还没有人留言评论。精彩留言会获得点赞!