一种识别HPV18和/或HPV45的单克隆抗体及其应用的制作方法
本发明属于生物诊断及医药领域,具体地说,本发明涉及识别由人乳头状瘤病毒(hpv)18和/或45持续感染引起的癌(前)变肿瘤细胞,包括人宫颈上皮癌(前)变细胞的单克隆抗体及其免疫组化染色应用。
背景技术
宫颈癌(前)病变的最终诊断是以病理组织细胞形态学作为金标准。宫颈病变级别,分为宫颈上皮内瘤变(cervicalintraepithelialneoplasia,cin)(cin1,cin2和cin3)、原位癌和浸润癌。其中低度上皮内瘤变cin1是hpv急性感染的表现,病变消退转为正常组织的概率很高。高度上皮内瘤变cin3具有进展为癌的显著风险,因此临床治疗方案明确。目前临床上对cin2的处理存在争议,因为精确诊断有困难,适合的治疗方案也不确定。观察者对cin2诊断有较大程度的差异,即使是在受训严格的美国,对cin2的判读也存在明显不一致。cin2不仅仅是一种独立的中间病变,似乎更是低级别和高级别病变的混合,而通过组织学很难对此进行简单的区分。因此如何区分低级别和高级别病变,精确诊断宫颈恶性病变,为临床干预和治疗提供更精准的信息,成为临床宫颈诊疗中亟待解决的问题。
在人类所有肿瘤中,宫颈癌是目前病因唯一明确的肿瘤,同时也是唯一可以预防的肿瘤。它是人乳头瘤病毒(humanpapillomavirus,hpv)持续感染的结果。癌症发生过程中hpvdna整合入人体细胞基因组内,转化型细胞内开始持续表达hpve6和e7蛋白。这两个致癌蛋白是导致宫颈癌的重要原因,这些小分子蛋白分别含158个和98个氨基酸,具有锌指结构(色氨酸-x-x-色氨酸),此结构与细胞的恶性转化密切相关。hpve6蛋白通过e6-ap(e6associatedprotein)的介导,结合并降解抑癌蛋白p53。hpve7蛋白与抑癌蛋白prb结合,使prb释放核转录因子e2f,致使细胞过度增殖,细胞周期调控失控,导致细胞的永生化并促进宫颈癌的发生,这使得e7可作为高度宫颈损伤和宫颈癌检测的一个肿瘤标志物。
hpv是一种小dna病毒,具有很强的嗜鳞状上皮的特性,主要侵犯鳞状上皮的基底层细胞和位于宫颈转化区的化生细胞。目前已知的有一百多个型别,根据致癌性,分为高危型hpv和低危型hpv两类。与人类肿瘤相关的高危型hpv有四十几种,其中常见的主要包括hpv18、hpv45等型别。在宫颈鳞癌中hpv18的感染率位居第二,但在宫颈腺癌中hpv18却为主要的感染型别(47.4%)。因此hpv18是子宫颈癌中最主要分布的高危hpv型别之一。
本领域技术人员致力于开发一种不依赖于病理组织细胞形态学的检测方法和技术,以检测由hpv18和/或hpv45引起的宫颈癌,特别是高度宫颈上皮内瘤变。同时一方面区分非恶性病变的细胞发育异常,另一方面也可提示具有高度恶变风险的早期宫颈病变,为临床诊疗提供更为客观、精准的诊断方案。
技术实现要素:
本发明的目的在于提供一种由识别hpv18和/或hpv45的单克隆抗体及其应用。
在本发明的第一方面,提供了一种抗体的重链可变区,所述的重链可变区包括以下三个互补决定区cdr:
seqidno.:4所示的cdr1,
seqidno.:6所示的cdr2,和
seqidno.:8所示的cdr3。
在另一优选例中,所述重链可变区具有seqidno.:10所示的氨基酸序列。
本发明的第二方面,提供了一种抗体的重链,所述的重链具有如本发明第一方面所述的重链可变区,和重链恒定区。
在另一优选例中,所述的重链恒定区为人源、鼠源、兔源或嵌合抗体。
本发明的第三方面,提供了一种抗体的轻链可变区,所述轻链可变区具有选自下组的互补决定区cdr:
seqidno.:12所示的cdr1',
seqidno.:14所示的cdr2',和
seqidno.:16所示的cdr3'。
在另一优选例中,所述的轻链可变区具有seqidno.:18所示的氨基酸序列。
本发明的第四方面,提供了一种抗体的轻链,所述的轻链具有如本发明第三方面所述的轻链可变区,和轻链恒定区。
在另一优选例中,所述的轻链恒定区为人源、鼠源、兔源或嵌合抗体。
本发明的第五方面,提供了一种抗体,所述抗体具有:
(1)如本发明第一方面所述的重链可变区;和/或
(2)如本发明第三方面所述的轻链可变区。
在另一优选例中,所述抗体具有:如本发明第二方面所述的重链;和/或如本发明第四方面所述的轻链。
在另一优选例中,所述的抗体为特异性抗hpv的抗体;优选地,所述抗体为特异性抗hpv18和hpv45的抗体;更优选地,所述抗体为特异性抗hpv18e7和hpv45e7蛋白的抗体。
在另一优选例中,所述的抗体包括:单链抗体、双链抗体、单克隆抗体、嵌合抗体(如人兔嵌合抗体)、鼠源抗体、兔源抗体或人源化抗体。
在另一优选例中,所述“hpv18e7蛋白”可以为野生型hpv18e7蛋白,也可以为野生型hpv18e7蛋白的衍生蛋白。所述“hpv45e7蛋白”可以为野生型hpv45e7蛋白,也可以为野生型hpv45e7蛋白的衍生蛋白。
在另一优选例中,所述抗体为能够特异性结合hpv18e7蛋白和hpv45e7蛋白的单克隆抗体。
在另一优选例中,所述抗体不与其它hpv型别结合或者与其它hpv亚型的亲和力较低。
在另一优选例中,所述抗体还具有以下特性:
(3)能够与hpv18e7和hpv45e7的空间构象的蛋白特异性结合。
本发明的第六方面,提供了一种重组蛋白,所述的重组蛋白具有:
(i)如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体;以及
(ii)任选的协助表达和/或纯化的标签序列。
在另一优选例中,所述的标签序列包括6×his标签。
在另一优选例中,所述的重组蛋白特异性抗hpv;优选地,特异性抗hpv18和hpv45;更优选地,特异性抗hpv18e7和hpv45e7蛋白。
本发明的第七方面,提供了一种多核苷酸,它编码选自下组的多肽:
(1)如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体;或
(2)如本发明第六方面所述的重组蛋白。
在另一优选例中,所述的多核苷酸具有seqidno.:3、5、7、9、11、13、15、或17、所示的序列。
本发明的第八方面,提供了一种载体,它含有本发明第七方面所述的多核苷酸。
在另一优选例中,所述的载体包括:细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒、或其他载体。
本发明的第九方面,提供了一种遗传工程化的宿主细胞,它含有本发明第八方面所述的载体或基因组中整合有本发明第七方面所述的多核苷酸。
本发明的第十方面,提供了一种免疫偶联物,该免疫偶联物含有:
(a)如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体;和
(b)选自下组的偶联部分:可检测标记物、药物、毒素、细胞因子、放射性核素、或酶。
在另一优选例中,所述偶联物选自:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶、放射性核素、生物毒素、细胞因子(如il-2等)、抗体、抗体fc片段、抗体scfv片段、金纳米颗粒/纳米棒、病毒颗粒、脂质体、纳米磁粒、前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl))、化疗剂(例如,顺铂)或任何形式的纳米颗粒等。
本发明的第十一方面,提供了一种药物组合物,其特征在于,它含有:
(i)如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体、如本发明第六方面所述的重组蛋白、或如本发明第十方面所述的免疫偶联物;以及
(ii)药学上可接受的载体。
在另一优选例中,所述的药物组合物为注射剂型。
在另一优选例中,所述的药物组合物用于制备治疗肿瘤的药物,所述的肿瘤选自下组:胃癌、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、宫颈癌、子宫内膜癌、阴茎癌、肾上腺肿瘤、或膀胱肿瘤。
本发明的第十二方面,提供了如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体、如本发明第六方面所述的重组蛋白、或如本发明第十方面所述的免疫偶联物的用途,其特征在于,用于制备药剂、试剂、检测板或试剂盒;
所述试剂、检测板或试剂盒用于:
(1)检测样品中hpv18和/或hpv45e7蛋白;和/或
(2)检测肿瘤细胞中内源性的hpv18和/或hpv45e7蛋白;和/或
(3)检测表达hpv18和/或hpv45e7蛋白的肿瘤细胞;和/或
(4)鉴别hpv的类型;
所述药剂用于治疗或预防表达hpv18和/或hpv45e7蛋白的肿瘤。
在另一优选例中,所述样品中含有hpv18和/或hpv45e7蛋白。
在另一优选例中,所述肿瘤包括:泌尿生殖系统的肿瘤,呼吸道系统的肿瘤,消化道系统的肿瘤,包括:宫颈癌、子宫内膜癌、阴茎癌、小细胞肺癌、黑色素瘤或头颈肿瘤、胃癌、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、或肾上腺肿瘤。
在另一优选例中,所述“泌尿生殖系统的肿瘤”包括:宫颈癌、膀胱癌、子宫内膜癌或阴茎癌。
在另一优选例中,所述的试剂包括芯片、包被抗体的免疫微粒。
本发明的第十三方面,提供了一种检测样品中hpve7蛋白的方法,所述方法包括步骤:
(1)将样品与本发明第五方面所述的抗体接触;
(2)检测是否形成抗原-抗体复合物,其中形成复合物就表示样品中存在hpve7蛋白。
在另一优选例中,在步骤(2)中通过elisa法进行检测。
在另一优选例中,所述hpve7蛋白包括hpv18和/或hpv45e7蛋白。
在另一优选例中,在步骤(1)中,将样品与两种针对hpve7蛋白的抗体接触,并且在步骤(2)中通过elisa法进行检测,所述两种针对hpve7蛋白的抗体中的至少一种为本发明第五方面所述的抗体。
在另一优选例中,所述“抗原-抗体复合物”为“第一抗体-抗原-第二抗体”三元复合物,其中,所述第一抗体是本发明第五方面所述的抗体,并且所述第二抗体的结合表位与所述第一抗体的结合表位不同。
在另一优选例中,所述在步骤(1)中,将样品与本发明第五方面所述的抗体接触后,在反应体系中再加入抗所述第一抗体的第三抗体,并且在步骤(2)中检测“抗原-第一抗体-第三抗体”复合物的形成。
在另一优选例中,所述第一抗体、所述第二抗体或所述第三抗体上带有可检测标记。
在另一优选例中,所述可检测标记为生物素标记、胶体金标记、辣根过氧化物酶标记、放射性核素标记、荧光素标记。
在另一优选例中,所述样品包括:人或动物组织样品、肿瘤切除样品、脱落细胞样品。
在另一优选例中,所述方法用于非诊断性的目的。
本发明的第十四方面,提供了一种检测板,所述的检测板包括基片(支撑板)和测试条,所述的测试条含有本发明第五方面所述的抗体或本发明第六方面所述的免疫偶联物。
在另一优选例中,所述的测试条还含有抗原点样区。
在另一优选例中,所述的测试条由滤样纸、层析材料、硝酸纤维素膜和吸水纸依次搭接组成。
本发明的第十五方面,提供了一种试剂盒,所述试剂盒中包括:
(1)第一容器,所述第一容器中含有本发明第五方面所述的抗体;和/或
(2)第二容器,所述第二容器中含有抗本发明第五方面所述的抗体的二抗;和/或
(3)第三容器,所述第三容器中含有细胞裂解试剂;
或者,
所述试剂盒含有本发明第十四面所述的检测板。
在另一优选例中,所述第一容器中的抗体带有可检测标记。
在另一优选例中,所述第二容器中的抗体带有可检测标记。
本发明的第十六方面,提供了一种制备重组多肽的制备方法,该方法包含:
(a)在适合表达的条件下,培养本发明第九方面所述的宿主细胞;
(b)从培养物中分离出重组多肽,所述的重组多肽是本发明第五方面所述的抗体或本发明第六方面所述的重组蛋白。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
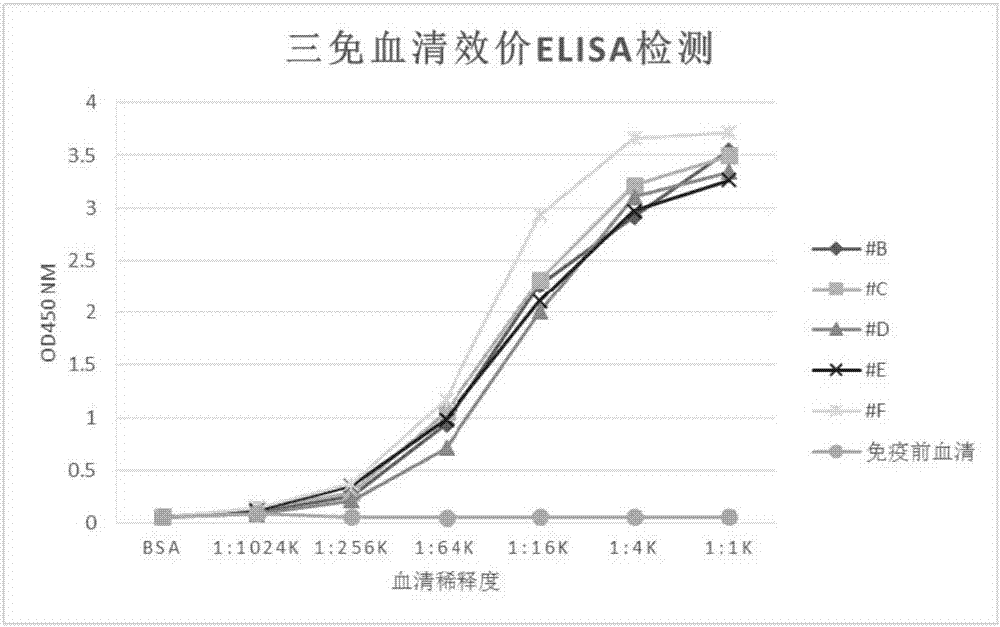
图1为用免疫原蛋白elisa检测三免血清的效价结果图。结果以his-hpv18e7为检测抗原时,编号#f的小鼠血清效价最高,达到融合标准。
图2为筛选得到的九株单克隆细胞培养上清活性及交叉elisa检测结果。结果有六株单克隆培养上清mab-01,06,07,11,13,14可特异性结合his-hpv18e7重组蛋白,且与his标签无关蛋白不结合。其余三株mab-03,04,10除与his-hpv18e7重组蛋白结合外,同时与his标签无关蛋白也有较强的结合。
图3为hpv18e7鼠单克隆抗体mab-14活性elisa检测结果。结果mab-14能够高亲和力的结合his-hpv18e7重组蛋白。
图4为抗体亚型检测,结果mab-14抗体亚型为igg1,kappa。
图5为鼠单克隆抗体mab-14交叉elisa检测结果。结果mab-14不仅高亲和力的特异性结合重组蛋白his-hpv18e7,而且高亲和力的特异性结合his-hpv45e7。同时与his-hpv16e7、his-hpv31e7、his-hpv52e7、his-hpv58e7均无明显的交叉反应。
图6a和图6b为单抗免疫球蛋白igg的重链、轻链可变区cdr基因序列,具体实验细节见实施例1,2.3小节。图6a显示了mab-14单抗免疫球蛋白igg的重链可变区cdr基因序列。图6b显示了mab-14单抗免疫球蛋白igg的轻链可变区cdr基因序列。
图7a、图7b、和图7c为hpv18e7鼠单克隆抗体免疫组织化学染色检测结果图。图7a为mab-06的组织切片染色结果;图7b为mab-13的组织切片染色结果;图7c为mab-14的组织切片染色结果。结果mab-14对肿瘤细胞表现强染色,且肿瘤细胞旁间质区域背景干净。mab-14在特异度上明显优于其它株抗体。
具体实施方式
本发明人通过深入的研究,经过大量筛选,成功获得一株特异性抗his-hpv18e7的单克隆抗体mab-14,实验结果表明,该针对his-hpv18e7蛋白的单克隆抗体,亲和力强,能够特异地结合重组蛋白his-hpv18e7,并同时结合重组蛋白his-hpv45e7。因此该抗体不仅能够用于检测高危型hpv18e7蛋白,还能够用于检测高危型hpv45e7蛋白。进一步研究表明,该抗体还可用于福尔马林固定,石蜡包埋的临床宫颈组织样本切片的检测。本发明还提供了检测和/或鉴定hpv18/45e7蛋白的方法,该方法稳定性好,检测灵敏度极高。本发明还提供了包含上述抗体的试剂盒以及检测板。
具体地,本发明采用重组his-hpv18e7融合蛋白免疫balb/c小鼠,并使用his-hpv18e7重组蛋白作为筛选抗原,筛选获得阳性单克隆杂交瘤细胞株。并用his无关蛋白进行复筛,最终获得6株能特异性结合his-hpv18e7重组蛋白的克隆株。
为筛选出在宫颈组织学鉴定上具有临床检验价值的抗体试剂,将6株单克隆细胞株进行鼠腹水抗体生产纯化,进行进一步的临床验证:福尔马林固定,石蜡包埋的宫颈癌组织切片的检测,最终获得一株能够特异性识别e7蛋白阳性宫颈癌石蜡切片的单克隆抗体mab-14。为了探索该抗体与其他高危型别hpv的交叉情况,使用his-hpv16,31,45,52,58e7重组蛋白对mab-14进行elisa检测,结果发现mab-14单克隆抗体不仅高亲和力的特异性识别hpv18e7,同时高亲和力的特异性识别hpv45e7。基于该抗体的特异性开发了能够识别由hpv18和/或hpv45引起的人宫颈上皮癌变或癌前病变的方法,这种方法能够用于辅助临床宫颈病理组织细胞形态学的诊断。
在本发明的一个优选的实施方式中,所述hpv18e7蛋白的氨基酸序列如下:
mhgpkatlqdivlhlepqneipvdllcheqlsdseeendeidgvnhqhlparraepqrhtmlcmcckcearielvvessaddlrafqqlflntlsfvcpwcasqq(seqidno.:1)。
在本发明的一个优选的实施方式中,所述hpv45e7蛋白的氨基酸序列如下:
mhgpratlqeivlhlepqneldpvdllcyeqlseseeendeadgvshaqlparraepqrhkilcvcckcdgridltvessaddlrtlqqlflstlsfvcpwcatnq(seqidno.:2)。
如本文所用,术语“抗体”或“免疫球蛋白”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。
如本文所用,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nihpubl.no.91-3242,卷i,647-669页(1991))。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。
脊椎动物抗体(免疫球蛋白)的“轻链”可根据其恒定区的氨基酸序列归为明显不同的两类(称为κ和λ)中的一类。根据其重链恒定区的氨基酸序列,免疫球蛋白可以分为不同的种类。主要有5类免疫球蛋白:iga,igd,ige,igg和igm,其中一些还可进一步分成亚类(同种型),如igg1,igg2,igg3,igg4,iga和iga2。对应于不同类免疫球蛋白的重链恒定区分别称为α、δ、ε、γ、和μ。不同类免疫球蛋白的亚单位结构和三维构型是本领域人员所熟知的。
如本文所用,术语“单克隆抗体(单抗)”指从一类基本均一的群体获得的抗体,即该群体中包含的单个抗体是相同的,除少数可能存在的天然发生的突变外。单克隆抗体高特异性地针对单个抗原位点。而且,与常规多克隆抗体制剂(通常是具有针对不同决定簇的不同抗体)不同,各单克隆抗体是针对抗原上的单个决定簇。除了它们的特异性外,本文中的兔单克隆抗体是通过噬菌体文库筛选后通过分子生物的方法构建全长兔单克隆抗体基因表达载体,将该载体转入真核表达系统,培养后收取细胞上清而获得,不会被其它免疫球蛋白污染。修饰语“单克隆”表示了抗体的特性,是从基本均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来生产抗体。
本发明还包括具有所述的抗hpv18/45e7蛋白单克隆抗体的相应氨基酸序列的单克隆抗体、具有所述的抗hpv18/45e7蛋白单克隆抗体可变区链的单克隆抗体,以及具有这些链的其他蛋白质或蛋白质偶联物及融合表达产物。具体地,本发明包括具有含超变区(互补决定区,cdr)的轻链和重链的任何蛋白质或蛋白质偶联物及融合表达产物(即免疫偶联物及融合表达产物),只要该超变区与本发明的轻链和重链的超变区相同或至少90%同源性,较佳地至少95%同源性。
如本领域技术人员所知,免疫偶联物及融合表达产物包括:药物、毒素、细胞因子(cytokine)、放射性核素、酶和其他诊断或治疗分子与所述的hpv16e7蛋白单克隆抗体或其片段结合的而形成的偶联物。本发明还包括与所述的抗hpv16e7蛋白单克隆抗体或其片段结合的细胞表面标记物或抗原。
本发明不仅包括完整的单克隆抗体,还包括具有免疫活性的抗体片段,如fab或(fab')2片段;抗体重链;抗体轻链。
如本文所用,术语“重链可变区”与“vh”可互换使用。
如本文所用,术语“可变区”与“互补决定区(complementaritydeterminingregion,cdr)”可互换使用。
在本发明的一个优选的实施方式中,所述抗体的重链可变区包括以下三个互补决定区cdr:
cdr1,其氨基酸序列为gftfnryd(seqidno.:4),其编码核苷酸序列为ggattcactttcaatagatatgac(seqidno.:3);
cdr2,其氨基酸序列为irndgskt(seqidno.:6),其编码核苷酸序列为atcagaaatgatggtagtaagact(seqidno.:5);
cdr3,其氨基酸序列为trdsygtvfay(seqidno.:8),其编码核苷酸序列为acaagggactcctatggtaccgtgtttgcttac(seqidno.:7)。
在另一优选例中,所述重链可变区的氨基酸序列为:
qlelvqsgggsvkpggslklscaasgftfnrydmswfrqspekrlewvaeirndgskthysdtvtgrftisrdnakntlylemsslrsedtamyyctr(seqidno.:10);
其编码核苷酸序列为:
cagctcgagctggtgcagtcagggggaggctcagtgaagcctggagggtccctgaaactctcctgtgcagcctctggattcactttcaatagatatgacatgtcttggtttcgccagtctccagagaagaggctggagtgggtcgcagagatcagaaatgatggtagtaagactcactattcagacactgtgacgggccgattcaccatctccagagacaatgccaagaacaccctgtacctggaaatgagcagtctgaggtctgaggacacggccatgtattactgtacaagg(seqidno.:9)。
在本发明的一个优选的实施方式中,所述抗体的重链包括上述重链可变区和重链恒定区,所述重链恒定区可以为鼠源、人源或兔源。
如本文所用,术语“轻链可变区”与“vl”可互换使用。
在本发明的一个优选的实施方式中,根据本发明的抗体的轻链可变区,具有选自下组的互补决定区cdr:
cdr1',其氨基酸序列为qsllysngkty(seqidno.:12),其编码核苷酸序列为cagagcctcttatatagtaatggaaaaacctat(seqidno.:11);
cdr2',其氨基酸序列为lvs(seqidno.:14),其编码核苷酸序列为ctggtgtct(seqidno.:13)
cdr3',其氨基酸序列为vqgthfpqt(seqidno.:16),其编码核苷酸序列为gtgcaaggtacacattttcctcagacg(seqidno.:15)
在另一优选例中,所述的轻链可变区的氨基酸序列为:
elvmtqtpltlsvtigqpasisckssqsllysngktylnwllqrpgqspkrliylvskldsgvpdrftgsgsgtdftlkisrveaedlgvyycvqgthfp(seqidno.:18),
其编码核苷酸序列为:
gagctcgtcatgacccagactccactcactttgtcggttaccattggacaaccagcctctatctcttgcaagtcaagtcagagcctcttatatagtaatggaaaaacctatttgaattggttattacagaggccaggccagtctccaaagcgcctaatctatctggtgtctaaactggactctggagtccctgacaggttcactggcagtggatcaggaacagattttacactgaaaatcagcagagtggaggctgaggatttgggagtttattactgcgtgcaaggtacacattttcct(seqidno.:17)。
在本发明的一个优选的实施方式中,所述抗体的轻链包括上述轻链可变区和轻链恒定区,所述轻链恒定区可以为鼠源、人源或兔源。
在本发明中,术语“本发明抗体”、“本发明蛋白”、或“本发明多肽”可互换使用,都指特异性结合hpv18/45e7蛋白的抗体,例如具有重链可变区(如seqidno.:10的氨基酸序列)和/或轻链可变区(如seqidno.:18的氨基酸序列)的蛋白或多肽。它们可含有或不含起始甲硫氨酸。
在另一优选例中,所述的抗体为抗hpv18/45e7蛋白的鼠或人鼠嵌合单克隆抗体,它的重链恒定区和/或轻链恒定区可以是人源化的重链恒定区或轻链恒定区。更优选地,所述的人源化的重链恒定区或轻链恒定区为人igg1、igg2等的重链恒定区或轻链恒定区。
本发明还提供了具有本发明抗体的其他蛋白质或融合表达产物。具体地,本发明包括具有含可变区的重链和轻链的任何蛋白质或蛋白质偶联物及融合表达产物(即免疫偶联物及融合表达产物),只要该可变区与本发明抗体的重链和轻链的可变区相同或至少90%同源性,较佳地至少95%同源性。
一般,抗体的抗原结合特性可由位于重链和轻链可变区的3个特定的区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了fr或cdr区域。
本发明抗体的重链和/或轻链的可变区特别令人感兴趣,因为它们中至少部分涉及结合抗原。因此,本发明包括那些具有带cdr的单克隆抗体轻链和重链可变区的分子,只要其cdr与此处鉴定的cdr具有90%以上(较佳地95%以上,最佳地98%以上)的同源性。
本发明不仅包括完整的单克隆抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。
如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明抗体相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或与6his标签形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
本发明抗体指具有hpv18/45e7蛋白结合活性的、包括上述cdr区的多肽。该术语还包括具有与本发明抗体相同功能的、包含上述cdr区的多肽的变异形式。这些变异形式包括(但并不限于):一个或多个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括本发明抗体的活性片段和活性衍生物。
该多肽的变异形式包括:同源序列、保守性变异体、等位变异体、天然突变体、诱导突变体、在高或低的严紧度条件下能与本发明抗体的编码dna杂交的dna所编码的蛋白、以及利用抗本发明抗体的抗血清获得的多肽或蛋白。
本发明还提供了其他多肽,如包含人抗体或其片段的融合蛋白。除了几乎全长的多肽外,本发明还包括了本发明抗体的片段。通常,该片段具有本发明抗体的至少约50个连续氨基酸,较佳地至少约50个连续氨基酸,更佳地至少约80个连续氨基酸,最佳地至少约100个连续氨基酸。
在本发明中,“本发明抗体的保守性变异体”指与本发明抗体的氨基酸序列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。
表a
本发明还提供了编码上述抗体或其片段或其融合蛋白的多核苷酸分子。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码成熟多肽的编码区序列可以与seqidno.:3、5、7、9、11、13、15、17所示的编码区序列相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码具有与本发明的多肽相同的氨基酸序列,但与seqidno.:3、5、7、9、11、13、15、17所示的编码区序列有差别的核酸序列。
编码本发明的成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。
术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2×ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与seqidno.:10和/或seqidno.:20所示的成熟多肽有相同的生物学功能和活性。
本发明的抗体的核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。一种可行的方法是用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。此外,还可将重链的编码序列和表达标签(如6his)融合在一起,形成融合蛋白。
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。本发明所涉及的生物分子(核酸、蛋白等)包括以分离的形式存在的生物分子。
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
本发明还涉及包含上述的适当dna序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母;果蝇s2或sf9的昆虫细胞;cho、cos7、293细胞的动物细胞等。
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔,脂质体包装等。
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
本发明的抗体可以单独使用,也可与可检测标记物(为诊断目的)、治疗剂、pk(蛋白激酶)修饰部分或任何以上这些物质的组合结合或偶联。
用于诊断目的的可检测标记物包括但不限于:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶。
可与本发明抗体结合或偶联的治疗剂包括但不限于:1.放射性核素(koppe等,2005,癌转移评论(cancermetastasisreviews)24,539);2.生物毒(chaudhary等,1989,自然(nature)339,394;epel等,2002,癌症免疫学和免疫治疗(cancerimmunologyandimmunotherapy)51,565);3.细胞因子如il-2等(gillies等,1992,美国国家科学院院刊(pnas)89,1428;card等,2004,癌症免疫学和免疫治疗(cancerimmunologyandimmunotherapy)53,345;halin等,2003,癌症研究(cancerresearch)63,3202);4.金纳米颗粒/纳米棒(lapotko等,2005,癌症通信(cancerletters)239,36;huang等,2006,美国化学学会杂志(journaloftheamericanchemicalsociety)128,2115);5.病毒颗粒(peng等,2004,基因治疗(genetherapy)11,1234);6.脂质体(mamot等,2005,癌症研究(cancerresearch)65,11631);7.纳米磁粒;8.前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl));10.化疗剂(例如,顺铂)或任何形式的纳米颗粒等。
本发明还提供了一种组合物。在优选例中,所述的组合物是药物组合物,它含有上述的抗体或其活性片段或其融合蛋白,以及药学上可接受的载体。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地ph约为6-8,尽管ph值可随被配制物质的性质以及待治疗的病症而有所变化。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):瘤内、腹膜内、静脉内、或局部给药。
本发明的药物组合物可直接用于结合hpv16e7蛋白分子,因而可用于预防和治疗肿瘤。此外,还可同时使用其他治疗剂。
本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的本发明上述的单克隆抗体(或其偶联物)以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1微克/千克体重-约5毫克/千克体重。此外,本发明的多肽还可与其他治疗剂一起使用。
使用药物组合物时,是将安全有效量的免疫偶联物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约8毫克/千克体重,较佳地该剂量是约10微克/千克体重-约1毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
单克隆抗体的制备
本发明的抗体可以通过本领域内技术人员已知的各种技术进行制备。例如,本发明抗原,可被施用于动物以诱导单克隆抗体的产生。对于单克隆抗体,可利用杂交瘤技术来制备(见kohler等人,nature256;495,1975;kohler等人,eur.j.immunol.6:511,1976;kohler等人,eur.j.immunol.6:292,1976;hammerling等人,inmonoclonalantibodiesandtcellhybridomas,elsevier,n.y.,1981),噬菌体展示技术或可用重组dna法(美国专利号4,816,567)制备。
代表性的骨髓瘤细胞是有效融合、通过选择的抗体产生细胞支持抗体的稳定高水平产生、且对培养基(hat培养基基质)敏感的那些骨髓瘤细胞,包括骨髓瘤细胞株,例如鼠类的骨髓瘤细胞株,包括衍生自mopc-21和mpc-11小鼠肿瘤的骨髓瘤细胞株(可购自salkinstitutecelldistributioncenter,圣地亚哥,加利福尼亚,美国)以及sp-2、nz0或x63-ag8-653细胞(可购自americantypeculturecollection,洛克维尔,马里兰,美国)。人骨髓瘤和小鼠-人杂合骨髓瘤细胞株也已被描述用于产生人单克隆抗体[kozbor,j.immunol.,133:3001(1984);brodeur等,单克隆抗体的生产技术和应用(monoclonalantibodiesproductiontechniquesandapplications),51-63页(marceldekker,inc.,纽约,1987)]。
对杂交瘤细胞生长于其中的培养基进行分析以检测具有所需特异性的单克隆抗体的产生,如,通过体外结合分析例如,酶联免疫吸附分析(elisa)或放射免疫分析(ria)。表达抗体的细胞的位置可用facs进行检测。然后,可将杂交瘤克隆通过有限稀释步骤形成亚克隆(subcloned),并通过标准方法生长(goding,单克隆抗体(monoclonalantibodies):原则和实践(principlesandpractice),academicpress(1986)59-103页)。为了达到这一目的而使用的适合的培养基包括,例如,dmem或rpmi-1640培养基。此外,杂交瘤细胞可在动物体内作为腹水瘤生长。
由亚克隆分泌的单克隆抗体从培养基、腹水或血清中通过常规的免疫球蛋白纯化工艺适当地得到分离,这些纯化工艺为例如,蛋白a-琼脂糖法(proteina-sepharose)、羟基磷灰石层析、凝胶电泳、透析或亲和层析。
噬菌体展示技术是一项筛选技术,将外源多肽或蛋白与噬菌体的衣壳蛋白融合表达,融合蛋白展示在病毒颗粒的表面,而编码该融合子的dna则位于病毒粒子内,从而使大量多肽与其dna编码序列之间建立了直接联系,使各种靶分子(抗体、酶、细胞表面受体等)的多肽配体通过淘选得以快速鉴定。
本发明提供了一种针对hpve7蛋白的单克隆抗体,特别是针对hpv18/45e7蛋白的单克隆抗体。在本发明的一个优选的方案中,单克隆抗体采用培养杂交瘤细胞方法制备。取杂交瘤细胞培养的上清液,经亲和层析柱(proteina/g-sephrose)进行纯化。
本发明的一个优选的方案中,单克隆抗体采用balb/c小鼠腹水生产单克隆抗体的方法制备。将杂交瘤细胞接种到致敏的小鼠腹腔内,抽取腹水,经亲和层析柱(proteina/g-sephrose)进行纯化。
本发明的一个优选的方案中,单克隆抗体采用重组dna方法组建真核表达系统,瞬转hek293细胞来表达抗体,再将分泌于培养基中的抗体经亲和层析柱(proteina/g-sephrose)进行纯化。
方法和样本
本发明涉及用于在组织样本检测宫颈癌的方法。该方法步骤大致如下:获得组织样本;检测在所述样本中hpv癌蛋白的水平。本发明方法所使用的样本是临床病理通常应用的福尔马林固定,石蜡包埋的宫颈组织切片。
本发明可以用于hpv感染相关癌症中hpv癌蛋白的检测,其中hpv感染相关的癌症例如宫颈癌、膀胱癌、子宫内膜癌、阴茎癌等泌尿生殖系统的肿瘤,小细胞肺癌、黑色素瘤以及头颈肿瘤以及这些癌症的前期阶段。
根据本发明,使用hpv癌蛋白分子标记可以支持或甚至取代组织学检测方法。在特殊病例中,蛋白分子标记可以被用作诊断工具而不需要进一步的基于细胞的形态检测的支持。本发明所采用的生物标记是hpv癌蛋白,该生物标记来源于病毒,因为组织中病毒存在的标记特性不会发生在未感染的人组织中,因此对hpv感染的样本的检测具有特异性。
本发明中所采用的样本(样品)包括组织样本和活检标本。本发明使用的术语“活检”应包括本领域技术人员已知的所有种类的活检。因此本发明中使用的活检可以包括例如肿瘤的切除样本、通过内窥镜方法或器官的穿刺或针刺活检制备的组织样本。
本发明中使用的样本可以包括固定的或保存的组织样本。组织样本可以例如被保存在标准的样本收集、储存或运输介质中,例如那些本领域技术人员已知的商业可以获得保存介质(福尔马林、cytyc“preservcyt”或tripathimaging“cytorich”等)。合适的保存介质可以包括一个或多个选自醇、醛、酮、酸、金属离子或汞、醚等的用于保存细胞组分的混合物。醇包括甲醇、乙醇、(正或异)丙醇、(正、异或叔)丁醇或高支链或无支链的醇。醛包括甲醛、乙醛、戊二醛等。也可以使用诸如丙酮的酮类。在标准的样本介质中使用的酸包括有机酸(乙酸、三氯乙酸、水杨酸和苦味酸)或诸如铬酸的无机酸。标准的样本溶液中可以包括金属例如银、铜、铬、汞、锇和铀。诸如乙酸铀酰、二铬酸钾、硫酸铵等的盐溶液可以是保存介质的组分。
试剂盒
本发明还提供了一种只含有本发明的抗体(或其片段)或本发明的检测板的试剂盒,在本发明的一个优选例中,所述的试剂盒还包括容器、使用说明书、缓冲剂等。
本发明进一步设计用于检测高危型hpve7癌蛋白的检测试剂盒,该试剂盒包括识别高危型hpve7癌蛋白的抗体,检测所需的通用试剂和缓冲液,如各种缓冲液、酶联标记的二抗、检测标记、检测底物等。所述的抗体优选是抗hpve7抗体,更优选是抗hpv18和/或hpv45e7单克隆抗体。该检测试剂盒可以是体外诊断装置。
本发明进一步设计开发用于对来自宫颈活检样本的hpv感染相关情况诊断评估的试剂盒,该试剂盒可以检测存在于样本中的高危型hpve7癌蛋白。将组织进行福尔马林固定,石蜡包埋处理,并且被用于开发在基于非细胞形态分析基础上的对样本的hpv感染相关肿瘤进行检测的检测试剂盒和体外诊断装置。
本发明的目的之一在于提供一种检测hpv18/45e7蛋白表达的方法,并且所述的方法可用于检测hpv感染相关癌症特别是宫颈癌的检测。
本发明的发明人等制作了针对人乳头瘤病毒hpv18/45e7蛋白质的单克隆抗体mab-14并研究其反应性。使用此抗hpv18/45e7单克隆抗体mab-14对hpv18和/或hpv45感染阳性的宫颈癌组织样本进行免疫组织化学染色,结果发现mab-14在肿瘤细胞中有强染色反应,同时肿瘤细胞旁间质细胞和反应性细胞背景干净。
根据该发现结果,本发明的发明人完成了本发明。
也就是说,本发明的方法是检测肿瘤标记物的方法,其特征在于:包括检测样本中的hpv18/45e7的步骤。
在本发明的方法中,所述检测样本优先是宫颈上皮损伤有可能患宫颈病变的患者,也可以是宫颈已经发生病变的患者。
所述hpv18/45e7优选是hpv18/45e7蛋白质或其片段。在此情况时,检测所述的hpv18/45e7的步骤优选是使用hpv18/45e7的免疫组织化学染色分析。所使用的抗hpv18/45e7抗体优选是抗hpv18/45e7单克隆抗体。
所述方法免疫检测所采用的来自hpv18/45e7癌基因表达的蛋白作为hpv18/45相关的恶性或恶变前细胞发生的可靠指标。本发明最有用的方面之一是在对子宫颈癌、鳞状上皮细胞损伤和腺癌及与致癌hpv18/45感染相关的任何上皮细胞异常的诊断中的应用,所示的致癌hpv18/45感染包括中空细胞病;角化过度症;包括上皮内瘤形成或上皮内病变的癌前期病症;高度发育不良;和侵染性或恶性癌症。除宫颈癌外,对hpv18/45e7的检测对检测膀胱癌、子宫内膜癌、阴茎癌等泌尿生殖系统的肿瘤,小细胞肺癌、黑色素瘤以及头颈肿瘤也是有用的。
本发明的另一个目的通过本发明的方法提供一种检测试剂盒。该试剂盒可以是诊断试剂盒或研究试剂盒。
本发明的试剂盒是用以检测肿瘤标记物的试剂盒,其特征在于具有抗hpv18/45e7单克隆抗体。本发明的试剂盒优先是具有用以检测所需的通用试剂和缓冲液,如各种缓冲液、酶联标记的二抗、检测标记、检测底物等。所述的抗体优选是抗hpv18/45e7抗体,更优选是抗hpv18/45e7单克隆抗体,尤其优选是通过重组dna技术,获得用于真核表达系统的抗hpv18/45e7单克隆抗体基因重组表达载体。由真核表达系统产生的抗hpv18/45e7鼠单克隆抗体或是与该抗hpv18/45e7鼠单克隆抗体具同等的结合活性的单克隆抗体。
本发明提供了一种方法通过检测细胞内源的hpv18/45e7蛋白,区分宫颈非恶性病变的肿瘤细胞,并且在临床上广泛采用的中性福尔马林固定,石蜡包埋的组织切片中匹配使用,从而能够在癌症演变的早期作出诊断,为及时治疗提供依据。
进一步,本发明还提供一种采用该检测方法所形成的检测试剂盒。
本发明的主要优点在于:
(1)本发明提供的针对hpv18/45e7蛋白的抗体,特异性高,亲和力强,并且可以大量制备、单克隆抗体质量容易控制。
(2)本发明提供的针对hpv18/45e7蛋白的抗体能够特异性的与hpv18/45e7蛋白进行结合,因此该抗体不仅能够用于检测hpv18e7蛋白,还能够用于检测hpv45e7蛋白。
(3)本发明提供的检测hpve7蛋白的方法中使用本发明提供的抗体,稳定性好,检测灵敏度极高。
(4)本发明提供的单克隆抗体以及检测方法,适用于相关癌症的早期诊断,并可用于监测复发病人。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1
1人乳头瘤病毒hpv18e7单抗制备
1.1动物免疫
取五只4-6周雌性balb/c小鼠,免疫原为his-hpv18e7蛋白,免疫程序见表1。每次免疫前进行小鼠断尾采血,采用his-hpv18e7重组蛋白(5μg/ml)作为检测抗原包被间接elisa法检测小鼠血清效价,待免疫小鼠血清效价滴度〉1:10,000时取脾细胞进行融合。结果#f小鼠血清效价最高,达到融合标准(图1),取#f小鼠进行融合。
表1小鼠免疫程序
1.2细胞融合与培养
按常规方法收集免疫小鼠的脾细胞与骨髓瘤细胞sp2/0进行融合,融合比率脾细胞:sp2/0=5:1,融合细胞分装于96孔培养板,置于37℃,5%co2恒温培养箱中选择性培养。融合后用hat培养基全换液3次;待杂交瘤细胞长满一个显微镜视野时,进行elisa检测。
1.3阳性杂交瘤的筛选
检测时,采用间接elisa筛选:抗原选用免疫原蛋白混合液,5μg/ml和1μg/ml分别包板,4℃过夜,pbst洗涤拍干后,加入5%脱脂奶粉封闭,37℃作用2h或4℃过夜,pbst洗涤拍干后,加入杂交瘤上清并设置阳性(p)、阴性(n)及空白对照(空白直接加入酶标二抗),37℃反应1h,pbst洗涤拍干后再加入羊抗鼠-hrp二抗(sigmaa2554)(1:10,000)37℃反应45~60min,pbst洗涤拍干后tmb显色和2mh2so4终止。
elisa筛选结果以od值大于1的为阳性孔,并进行复检。经过两次连续检测为阳性后,将该阳性孔细胞进行扩增,及时冻存和亚克隆。
1.4杂交瘤细胞亚克隆
对于2次筛选都为阳性的孔,采用有限稀释法进行亚克隆,取一块96孔细胞培养板,每孔中加入150μlhat培养液;对需亚克隆的阳性孔轻轻吹打悬浮,吸取100μl细胞悬液加到96孔细胞板中,从第一孔开始倍比稀释。细胞计数选取孔中约有100个细胞的孔并加入到含有6mlhat培养液的加样槽中,按100μl/孔加到铺饲养层的细胞板中,加前三列;再补加hat培养基3ml,100μl/孔加到铺饲养层的细胞板中,加中三列;再补加hat培养基5ml,100μl/孔加到铺饲养层的细胞板中,加后六列。计算每块板的阳性率达到100%时,可以得到稳定细胞株。共获得九株结合免疫原蛋白的稳定单克隆抗体株mab-01,03,04,06,07,10,11,13,14。并对这九株单克隆抗体株分别用his-hpv18e7、his标签无关蛋白进行复筛,结果拿到六株特异性结合his-hpv18e7蛋白的单克隆抗体株mab-01,06,07,11,13,14(图2)。转移到细胞培养板中,扩大培养并冻存。
1.5单克隆抗体的生产(腹水制备)
大量培养杂交瘤细胞,8-10周龄的balb/c雌性小鼠预先用液体石蜡致敏,然后腹腔注射1x106杂交瘤细胞/只,一周后观察,待小鼠腹部明显膨大到一定程度后,用9号针头抽取腹水。收获的腹水用his-hpv18e7包被通过elisa检测腹水效价达到1:10,000以上。腹水液经去除纤维蛋白处理后,以proteina/g亲和柱层析法纯化。收集蛋白峰流出液,用磷酸盐缓冲液(pbs)透析后用紫外分光光度计od260,280测定抗体蛋白浓度,间接elisa检测抗体效价。结果mab-14单抗对his-hpv18e7重组蛋白表现出高亲和力的免疫反应(图3)。
2.单抗的鉴定
2.1单抗ig亚类的鉴定:
纯化单抗采用pbs1:10000稀释,按照sigma公司的亚型鉴定试剂盒说明书操作,mab-14单抗为igg1,kappa(图4)。
2.2elisa检测单克隆抗体交叉反应:
抗原分别选用his-hpv16e7(hpv16e7氨基酸序列mhgdtptlheymldlqpettdlycyeqlsdsseeedeidgpagqaepdrahynivtfcckcdstlrlcvqsthvdirtledllmgtlgivcpicsqkp,seqidno.19)、his-hpv18e7(seqidno.1)、his-hpv31e7mrgetptlqdyvldlqpeatdlycyeqlpdssdeedvidspagqakpdtsnynivtfccqcestlrlcvqstqvdirilqellmgsfgivcpncstrl,seqidno.20)、his-hpv45e7(seqidno.2)、his-hpv52e7mrgdkatikdyildlqpettdlhcyeqlgdssdeedtdgvdrpdgqaeqatsnyyivtychscdstlrlcihstatdlrtlqqmllgtlqvvcpgcarl,seqidno.21)、his-hpv58e7mrgnnptlreyildlhpeptdlfcyeqlcdssdedeigldgpdgqaqpatanyyivtccytcgttvrlcinstttdvrtlqqllmgtctivcpscaqq,seqidno.22)融合蛋白,2μg/ml包板,4℃过夜,pbst洗涤拍干后,加入5%脱脂奶粉封闭,37℃作用2h或4℃过夜,pbst洗涤拍干后,加入单抗mab-14(1μg/ml),37℃反应1h,pbst洗涤拍干后再加入羊抗鼠-hrp二抗(sigmaa2554)(1:10000)37℃反应45~60min,pbst洗涤拍干后tmb显色和2mh2so4终止,od450nm处读数。结果见图5:mab-14单抗不仅高亲和力的特异性结合重组蛋白his-hpv18e7,而且高亲和力的特异性结合his-hpv45e7。同时与其它高危型别e7蛋白无明显的交叉反应。
2.3克隆抗体基因克隆及测序
2.3.1杂交瘤细胞总rna提取
参照invitrogen“trizolreagent”操作手册提取杂交瘤细胞总rna。
2.3.2反转录及抗体基因克隆测序
参照fermantas“revertaidfirststrandcdnasynthesiskit”说明书进行反转录,并设计合成5’和3’端引物,用所得到的cdna为模板扩增抗体基因,反应条件:
94℃,1min;94℃,30s;55℃,30s;72℃,1min(30个cycle);72℃,5min。回收pcr产物条带后连接至pmd-19t载体上,并转化top10感受态细胞,涂布到带有iptg,x-gal的lb平板进行蓝白斑筛选培养(37℃,过夜)。挑取白色单菌落接种到2mllb培养基(amp+),37℃培养过夜后抽提菌液dna送去测序,结果见图6。
2.4单克隆抗体免疫组织化学染色法检测宫颈癌组织中的hpv18/45e7蛋白
分别以鼠单抗mab-01,06,07,11,13,14为一抗对宫颈正常组织和hpv18和/或hpv45感染阳性的宫颈癌组织进行免疫组织化学染色。方法如下:将病理石蜡切片先浸泡在二甲苯中两次,每次10分钟;然后依次浸泡在100%乙醇、95%乙醇、90%乙醇、80%乙醇、70%乙醇中,各5分钟,最后去离子水洗两次;将组织切片放入煮沸的0.01m枸橼酸钠缓冲溶液(ph6.0)中,高温高压2分钟;室温冷却30分钟,tbst洗三次,每次5分钟;为了使内源过氧化物酶失活加入3%h2o2室温处理10分钟;tbst洗涤3次,每次5分钟;加入含10%小牛血清的tbst室温封闭20分钟;弃去封闭液,分别加入上述6株抗体,浓度为15ug/ml,室温孵育1小时;经充分洗涤后滴加anti-mouse/rabbitigg-hrp(dakok5007),室温孵育30分钟;经充分洗涤后dab(dako)显色2-5分钟(显微镜下观察),流水冲洗5分钟;苏木素复染1分钟,自来水冲洗干净并返蓝;分步脱水,依次70%乙醇、80%乙醇、95%乙醇、无水乙醇各浸泡5分钟;最后二甲苯浸泡两次,每次5分钟;再中性树胶封片;最后显微镜观察拍照。
结果见图7:鼠单抗mab-14在宫颈癌组织癌变细胞中有明显的深棕色染色,染色定位于胞质,且组织中间质细胞和反应性细胞背景干净;鼠单抗mab-13、mab-06在宫颈癌组织癌变细胞中有明显的深棕色染色,同时在组织中间质细胞和反应性细胞也存在较明显的棕色背景着色;mab-01,07,11在宫颈癌组织中无棕色染色。综上所述,仅鼠源单克隆抗体mab-14能够特异的识别宫颈癌组织中的hpv18/45e7蛋白从而使宫颈癌变细胞呈特异性染色,且染色定位于胞质中。
讨论:
本发明人采用上述方法制备hpv18e7鼠源单克隆抗体,通过杂交瘤上清在hpve7及标签无关蛋白的初步筛选,及腹水生产纯化抗体在宫颈组织上的免疫组化应用筛选了九株抗体株最终拿到一株亲和力高,能高亲和力的特异性结合his-hpv18e7,且同时高亲和力的特异性结合his-hpv45e7重组蛋白的单抗mab-14,并且能识别宫颈癌变组织中hpv18/45e7致癌蛋白。本研究表明mab-14单抗可以特异性结合宫颈癌变细胞中的hpv18和/或hpv45e7致癌蛋白,通过二抗信号放大和催化dab色原底物显色,使宫颈癌组织切片中的恶性癌变细胞呈现胞质特异性棕色染色,使癌变细胞直观、客观的被标记出来。
宫颈由hpv持续感染最终进展为宫颈癌一般需要10年左右的时间,整个宫颈病变进展过程分为宫颈上皮内瘤变(cin)、原位癌和浸润癌。宫颈上皮内瘤变(cin)根据病变程度又分为低度病变(cini)、中度病变(cinii)和高度病变(ciniii),而宫颈癌早期干预的最佳治疗窗口是cinii和ciniii。目前临床宫颈组织病理诊断金标准仍是细胞形态学诊断,因此病理诊断结果的准确性往往取决于病理医生的经验和水平,特别是对cinii级别样本的诊断上,即使是在受训严格的美国,cinii样本的判读仍存在较明显的不一致性。中国病理医生缺乏,而有经验的病理医生更是少之又少,因此对cin特别是cinii样本的诊断迫切需要更有效的辅助手段,能客观的辅助临床诊断。在中国,导致宫颈鳞癌的hpv感染主要型别仍为hpv16和hpv18,占到宫颈鳞癌中hpv感染型别的85%左右。而hpv16e7,hpv18e7蛋白氨基酸同源性仅为42%,因此单一型别的抗体难以覆盖检测临床上绝大部分的病例。本发明提供免疫组化染色抗体试剂和方法,可以特异性标记宫颈上皮内瘤变细胞及癌变细胞中的hpv18e7致癌蛋白,提示hpv18感染的组织宫颈癌变的高风险,对降低漏诊和过度诊疗都有一定的临床应用意义。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>艾托金生物医药(苏州)有限公司
<120>一种识别hpv18和/或hpv45的单克隆抗体及其应用
<130>p2017-0439
<160>22
<170>patentinversion3.5
<210>1
<211>105
<212>prt
<213>hpv18e7
<400>1
methisglyprolysalathrleuglnaspilevalleuhisleuglu
151015
proglnasngluileprovalaspleuleucyshisgluglnleuser
202530
aspsergluglugluasnaspgluileaspglyvalasnhisglnhis
354045
leuproalaargargalagluproglnarghisthrmetleucysmet
505560
cyscyslyscysglualaargilegluleuvalvalgluserserala
65707580
aspaspleuargalapheglnglnleupheleuasnthrleuserphe
859095
valcysprotrpcysalaserglngln
100105
<210>2
<211>106
<212>prt
<213>hpv45e7
<400>2
methisglyproargalathrleuglngluilevalleuhisleuglu
151015
proglnasngluleuaspprovalaspleuleucystyrgluglnleu
202530
serglusergluglugluasnaspglualaaspglyvalserhisala
354045
glnleuproalaargargalagluproglnarghislysileleucys
505560
valcyscyslyscysaspglyargileaspleuthrvalgluserser
65707580
alaaspaspleuargthrleuglnglnleupheleuserthrleuser
859095
phevalcysprotrpcysalathrasngln
100105
<210>3
<211>24
<212>dna
<213>人工序列
<400>3
ggattcactttcaatagatatgac24
<210>4
<211>8
<212>prt
<213>人工序列
<400>4
glyphethrpheasnargtyrasp
15
<210>5
<211>24
<212>dna
<213>人工序列
<400>5
atcagaaatgatggtagtaagact24
<210>6
<211>8
<212>prt
<213>人工序列
<400>6
ileargasnaspglyserlysthr
15
<210>7
<211>33
<212>dna
<213>人工序列
<400>7
acaagggactcctatggtaccgtgtttgcttac33
<210>8
<211>11
<212>prt
<213>人工序列
<400>8
thrargaspsertyrglythrvalphealatyr
1510
<210>9
<211>294
<212>dna
<213>人工序列
<400>9
cagctcgagctggtgcagtcagggggaggctcagtgaagcctggagggtccctgaaactc60
tcctgtgcagcctctggattcactttcaatagatatgacatgtcttggtttcgccagtct120
ccagagaagaggctggagtgggtcgcagagatcagaaatgatggtagtaagactcactat180
tcagacactgtgacgggccgattcaccatctccagagacaatgccaagaacaccctgtac240
ctggaaatgagcagtctgaggtctgaggacacggccatgtattactgtacaagg294
<210>10
<211>98
<212>prt
<213>人工序列
<400>10
glnleugluleuvalglnserglyglyglyservallysproglygly
151015
serleulysleusercysalaalaserglyphethrpheasnargtyr
202530
aspmetsertrppheargglnserproglulysargleuglutrpval
354045
alagluileargasnaspglyserlysthrhistyrseraspthrval
505560
thrglyargphethrileserargaspasnalalysasnthrleutyr
65707580
leuglumetserserleuargsergluaspthralamettyrtyrcys
859095
thrarg
<210>11
<211>33
<212>dna
<213>人工序列
<400>11
cagagcctcttatatagtaatggaaaaacctat33
<210>12
<211>11
<212>prt
<213>人工序列
<400>12
glnserleuleutyrserasnglylysthrtyr
1510
<210>13
<211>9
<212>dna
<213>人工序列
<400>13
ctggtgtct9
<210>14
<211>3
<212>prt
<213>人工序列
<400>14
leuvalser
1
<210>15
<211>27
<212>dna
<213>人工序列
<400>15
gtgcaaggtacacattttcctcagacg27
<210>16
<211>9
<212>prt
<213>人工序列
<400>16
valglnglythrhispheproglnthr
15
<210>17
<211>300
<212>dna
<213>人工序列
<400>17
gagctcgtcatgacccagactccactcactttgtcggttaccattggacaaccagcctct60
atctcttgcaagtcaagtcagagcctcttatatagtaatggaaaaacctatttgaattgg120
ttattacagaggccaggccagtctccaaagcgcctaatctatctggtgtctaaactggac180
tctggagtccctgacaggttcactggcagtggatcaggaacagattttacactgaaaatc240
agcagagtggaggctgaggatttgggagtttattactgcgtgcaaggtacacattttcct300
<210>18
<211>100
<212>prt
<213>人工序列
<400>18
gluleuvalmetthrglnthrproleuthrleuservalthrilegly
151015
glnproalaserilesercyslysserserglnserleuleutyrser
202530
asnglylysthrtyrleuasntrpleuleuglnargproglyglnser
354045
prolysargleuiletyrleuvalserlysleuaspserglyvalpro
505560
aspargphethrglyserglyserglythraspphethrleulysile
65707580
serargvalglualagluaspleuglyvaltyrtyrcysvalglngly
859095
thrhisphepro
100
<210>19
<211>98
<212>prt
<213>hpv16e7
<400>19
methisglyaspthrprothrleuhisglutyrmetleuaspleugln
151015
progluthrthraspleutyrcystyrgluglnleuseraspserser
202530
gluglugluaspgluileaspglyproalaglyglnalagluproasp
354045
argalahistyrasnilevalthrphecyscyslyscysaspserthr
505560
leuargleucysvalglnserthrhisvalaspileargthrleuglu
65707580
aspleuleumetglythrleuglyilevalcysproilecyssergln
859095
lyspro
<210>20
<211>98
<212>prt
<213>人工序列
<400>20
metargglygluthrprothrleuglnasptyrvalleuaspleugln
151015
proglualathraspleutyrcystyrgluglnleuproaspserser
202530
aspglugluaspvalileaspserproalaglyglnalalysproasp
354045
thrserasntyrasnilevalthrphecyscysglncysgluserthr
505560
leuargleucysvalglnserthrglnvalaspileargileleugln
65707580
gluleuleumetglyserpheglyilevalcysproasncysserthr
859095
argleu
<210>21
<211>99
<212>prt
<213>人工序列
<400>21
metargglyasplysalathrilelysasptyrileleuaspleugln
151015
progluthrthraspleuhiscystyrgluglnleuglyaspserser
202530
aspglugluaspthraspglyvalaspargproaspglyglnalaglu
354045
glnalathrserasntyrtyrilevalthrtyrcyshissercysasp
505560
serthrleuargleucysilehisserthralathraspleuargthr
65707580
leuglnglnmetleuleuglythrleuglnvalvalcysproglycys
859095
alaargleu
<210>22
<211>98
<212>prt
<213>人工序列
<400>22
metargglyasnasnprothrleuargglutyrileleuaspleuhis
151015
progluprothraspleuphecystyrgluglnleucysaspserser
202530
aspgluaspgluileglyleuaspglyproaspglyglnalaglnpro
354045
alathralaasntyrtyrilevalthrcyscystyrthrcysglythr
505560
thrvalargleucysileasnserthrthrthraspvalargthrleu
65707580
glnglnleuleumetglythrcysthrilevalcysprosercysala
859095
glngln
- 还没有人留言评论。精彩留言会获得点赞!