一种微量抽测植物悬浮培养细胞液浓度的方法与流程
本发明属于植物细胞组培技术领域,具体涉及一种微量抽测植物悬浮培养细胞液浓度的方法。
背景技术:
植物细胞悬浮培养过程中,细胞均匀分散在液体培养基中,营养利用率高、增殖速度快,并且悬浮培养的方式能够利用大型生物反应器进行植物细胞及其代谢物的大规模工厂化生产。
植物细胞悬浮培养的收获目标是植物细胞或其代谢物,然而植物细胞仅能在一定的浓度范围内保持较快的生长,所以对细胞液的浓度进行实时监测具有重要意义。植物细胞多为胚性胚柄细胞团结构,且透明、较大、易沉淀,难以使用浊度法进行浓度测量。
目前,悬浮初代培养过程中,研究者多使用细胞沉降体积(scv)测量细胞生物量,进行定量研究,经过多次培养后,植物细胞分散在细胞液中,细胞液浓度变稀、不易沉降;所以面对悬浮细胞继代培养的低浓度、高分散的特点,定量测定细胞生物量更加难以进行。同时悬浮初代实验中发现过滤称重、测量细胞scv每次需要的细胞量多,测后就不能再继续培养;测较长时间细胞的生长曲线时,再加上实验重复的设计,需要做的实验非常多。显然,scv法测量细胞液的浓度还不能完全满足需求。
技术实现要素:
发明目的:针对现有技术中存在的不足,本发明的目的是提供一种微量抽测植物悬浮培养细胞液浓度的方法,需要的细胞液少,可批量数据处理,节约时间和减少人工判断误差。
技术方案:为了实现上述发明目的,本发明采用的技术方案为:
一种微量抽测植物悬浮培养细胞液浓度的方法,步骤如下:
1)配制悬浮继代细胞的系列标准浓度细胞液;染色,拍摄获得图片;
2)使用image-proplus软件处理拍摄的图片,获得细胞液中染色细胞的面积数据;
3)将获得的染色细胞面积数据与其标准浓度一一对应,绘制散点图、标准曲线并得到回归方程,并对标准曲线进行相关性评价;
4)建立植物悬浮培养细胞继代培养的生长模型;
5)应用生长模型计算获得悬浮培养细胞液浓度。
步骤1)中,配制悬浮继代细胞的系列标准浓度细胞液;染色,拍摄获得图片;具体过程如下:
(1)收集13-1悬浮继代的细胞,测量细胞鲜重并配制3g/30ml原始浓度细胞液,摇晃均匀,取0ml、2ml、4ml、6ml、8ml原始浓度液体,分别加无菌水至10ml,制成0g/ml、0.02g/ml、0.04g/ml、0.06g/ml、0.08g/ml、0.1g/ml的标准浓度细胞液;
(2)在超净工作台中对各浓度的细胞液各取0.1ml加到5ml的离心管中;使用0.2ml1%醋酸洋红染色1-2个小时,加水洗去染色液,将洗净后的细胞液倒入35mm直径的培养皿中;在白色底板上放置一透明洁净的60mm玻璃平皿盖,将35mm培养皿中的细胞液置于平皿盖上,每个标准浓度抽测6个样,使用相机对每个样拍摄清晰的细胞染色照片。
步骤2)中,使用image-proplus软件处理拍摄的图片,获得细胞液中染色细胞的面积数据;具体过程如下:
(1)拍摄的照片中13-1悬浮细胞染成红色,采用imageproplus6.0软件打开拍摄的染色细胞照片;单击measure>count/size>点选手动选色manul选项>点击selectcolors>设置hsi取色模式改变s值范围为88-255>单击file保存命名取色设置数据;单击measure>打开datacollector>设置输出的选项为图片名、目标数目、目标总面积;设置好选色和输出数据后单击count便可在datacollector中返回相应的数据;
(2)image-proplus制作相应的宏程序,批量处理拍摄获得的图片,获得细胞液中染色细胞的面积数据。
步骤2)中,制作批量处理的宏程序过程如下:设置datacollector参数同上>随机打开一张图片>单击macro>单击recordmacro>对macro命名>对打开的图片加载保存命名的取色文件,单击count>结束宏记录>将记录下的宏语句复制粘贴到预制的宏processdirectory的第121行后面并保存;当需要对文件夹中的图片进行处理时,选中修改后的processdirectory并运行,按照提示选中文件夹中的第一张照片,就可以自动处理其他的照片并将数据返回到datacollector中。
步骤3)中,绘制标准曲线,并得到回归方程,回归方程为y=0.0076x,线性相关系数r2=0.968。
步骤4)中,建立的生长模型的曲线方程为:
式中,x代表培养的时间,y代表细胞液浓度。
有益效果:与现有技术相比,本发明的微量抽测植物悬浮培养细胞液浓度的方法具有以下优点:
1)采用微量抽测的方式测量细胞液浓度,每次仅需吸取0.1ml的待测细胞液,控制无菌的条件下该细胞液仍可继续培养增殖;本方法使用image-proplus进行计数,可批量数据处理节约时间和减少人工判断误差。
2)通过单位面积平皿中悬浮细胞所占的面积,换算出植物细胞液的浓度,每次仅需要抽测0.1ml的悬浮液,在无菌操作下其他的细胞液仍然能够继续培养,以供不同培养时间的测量,以及继续生产。通过该方法制作的细胞浓度与image-proplus提取的面积数据线性相关,其相关性系数r2=0.968,具有极高的相关性。
3)针对抗性赤松继代悬浮细胞符合种群生长的特点,初期主要受种群数量影响,后期受到环境条件限制,稳定于环境最大容纳量;使用悬浮微测的方法,测量悬浮继代培养22天的细胞生长曲线,并借助spss17.0进行曲线拟合,其中s型曲线的拟合度最高r2=0.918,并得到相应的生长曲线方程;使用微量抽测的方法连续监测悬浮细胞生长浓度的变化仅需要培养3瓶细胞液,而且能够测量早期细胞较稀时的细胞浓度,节约了试验成本提高了试验研究效率。
附图说明
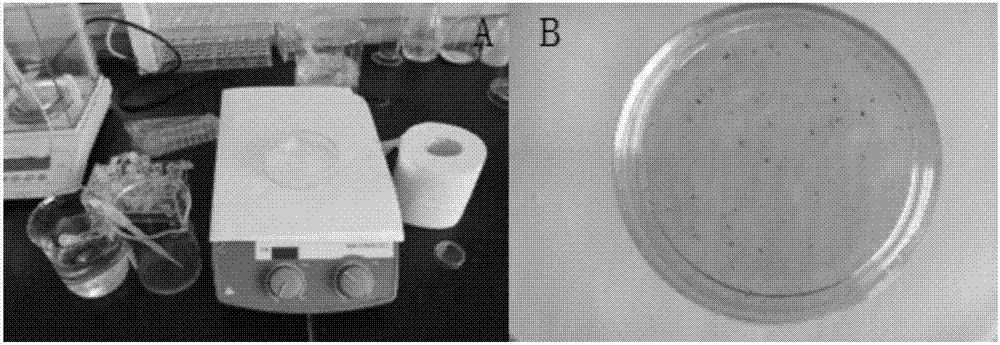
图1是拍摄抗性赤松13-1细胞染色照片图;
图2是抗性赤松悬浮细胞浓度与染色面积标准曲线图;
图3是抗性赤松悬浮细胞的生长曲线模型图。
具体实施方式
下面结合具体实施例对本发明做进一步的说明。
以下实施例中,以2003年吴静诱导出的抗性赤松胚性细胞团13-1悬浮培养多次的悬浮细胞为材料[吴静,朱丽华,许建秀,吴小芹,叶建仁(2015).抗松材线虫病赤松胚性愈伤组织的诱导及增殖.南京林业大学学报(自然科学版),39(01):17-21doi10.3969/j.issn.1000-2006.2015.01.004];培养瓶为无菌封口的250ml锥形瓶,每瓶细胞液的量为60ml;细胞液在infors
实施例1
一种微量抽测植物悬浮培养细胞液浓度的方法,步骤如下:
(1)收集13-1悬浮继代的细胞,测量细胞鲜重并配制3g/30ml原始浓度细胞液,摇晃均匀,取0ml、2ml、4ml、6ml、8ml原始浓度液体,分别加无菌水至10ml,制成0g/ml、0.02g/ml、0.04g/ml、0.06g/ml、0.08g/ml、0.1g/ml的标准浓度细胞液。
(2)在超净工作台中对各浓度的细胞液各取0.1ml加到5ml的离心管中;使用0.2ml1%醋酸洋红染色1-2个小时,加水洗去染色液,将洗后的细胞液倒入35mm直径的培养皿中。在白色底板上放置一透明洁净的60mm玻璃平皿盖,将35mm培养皿中的细胞液置于平皿盖上,每个标准浓度抽测6个样,使用尼康相机对每个样拍摄清晰的细胞染色照片。
图1是拍摄抗性赤松13-1细胞染色照片,图a为拍摄时为使染色细胞更好的显色出来,将35mm平皿置于皿盖与白底上;图b为使用尼康相机拍摄的小平皿中染色细胞的照片。
(3)拍摄的照片中13-1悬浮细胞染成红色,采用imageproplus6.0软件[image-proplus(以下简称image-proplus)是image-pro
(4)image-proplus可制作相应的宏,批量处理文件夹中的照片;设置datacollector参数同上>随机打开一张图片>单击macro>单击recordmacro>对macro命名>对打开的图片加载保存命名的取色文件,单击count>结束宏记录>将记录下的宏语句复制粘贴到预制的宏processdirectory的第121行后面并保存;当需要对文件夹中的图片进行处理时,选中修改后的processdirectory并运行,按照提示选中文件夹中的第一张照片,就可以自动处理其他的照片并将数据返回到datacollector中。
(5)将获得的image-proplus染色细胞面积数据与其标准浓度一一对应,绘制散点图、标准曲线并得到回归方程,并对标准曲线进行相关性评价。
(6)利用该方法建立抗性赤松13-1悬浮继代培养的生长模型
取过筛后0.6g继代过5次的13-1细胞团,放置在装有60ml营养液的250ml锥形瓶中;测量培养2、4、6…18、22天的细胞团染色image-proplus面积,每次抽测6组细胞液样品;采用上述拍摄细胞染色照片和提取面积数据的方法,得到个样品的染色细胞面积;通过制作的标准曲线回归方程,换算出细胞液的浓度;使用spss17.0进行线性、s型曲线和logistics曲线的模拟,并建立抗性赤松13-1胚性细胞的生长模型。
上述方法获得的具体结果如下:
1)悬浮细胞浓度标准曲线的绘制
配制的标准浓度梯度的细胞液,各浓度梯度吸取0.1ml细胞液为一个重复,每个浓度梯度设置6个重复,通过image-proplus对每个浓度梯度的6个重复进行计算,提取该样品中的细胞染色面积,通过excel2007做出染色面积与浓度的标准曲线,并求出回归方程。
从图2中可以看出,染色面积与细胞浓度的线性相关较高r2=0.968,回归方程为y=0.0076x,该回归方程具有较强的线性关系。
2)悬浮细胞的生长曲线绘制
图3是抗性赤松悬浮细胞的生长曲线模型,横坐标为培养的时间,纵坐标为相应的细胞浓度;使用线性(linear标志曲线,r2=0.690)、s型曲线(s标志曲线,r2=0.918)、逻辑斯特方程(logistics标志曲线,r2=0.685)模拟悬浮细胞生长变化,其中s曲线的模拟效果最好r2=0.918。
可见,继代5次后细胞生物量随培养时间的变化,使用image-proplus进行细胞微测,得到不同培养时间下初始接种浓度为0.6g/60ml的细胞浓度,在spss17.0中用线型、s型和logistics曲线模型拟合抗性赤松悬浮培养继代第五次的生长数据,发现s型曲线的拟合效果最好r2=0,918,相应的曲线方程为:
式中,x代表培养的时间,单位是天,y代表细胞液浓度,单位是gm/ml。
可见,本发明通过image-proplus对悬浮植物细胞生长量进行微量抽测。该方法通过单位面积平皿中悬浮细胞所占的面积,换算出植物细胞液的浓度,每次仅需要抽测0.1ml的悬浮液,在无菌操作下其他的细胞液仍然能够继续培养,以供不同培养时间的测量,以及继续生产。通过该方法制作的细胞浓度与image-proplus提取的面积数据线性相关,其相关性系数r2=0.968,具有极高的相关性。
- 还没有人留言评论。精彩留言会获得点赞!