一种用于诊断PRCC‑TFE3易位性肿瘤的PCR引物组合及其应用的制作方法
本发明属于生物检验领域,涉及一种用于诊断prcc-tfe3易位性肿瘤的pcr引物组合及其在制备tfe3易位性肿瘤诊断试剂中的应用。
背景技术:
2004年who对1997年肾细胞癌病理组织学分类进行了修改,新增了xp11.2易位/tfe3基因融合相关性肾癌(xp11.2易位性肾癌)。tfe3基因是xp11.2易位性肾癌的唯一驱动基因,其致病机理清晰明确:这类肿瘤均涉及位于xp11.2的tfe3基因同其它染色体易位及其所致形成融合基因,通过启动子变换从而高表达tfe3融合蛋白,而tfe3作为一个转录因子,通过与特异的dna结构相结合,转录调控体内多种基因表达最终致病。目前至少有10种不同的易位伴侣和融合基因被报道,包括aspl-tfe3、prcc-tfe3、sfpq-tfe3、nono-tfe3、cltc-tfe3、luc7l3-tfe3、khsrp-tfe3、parp14-tfe3、dvl2-tfe3和rbm10-tfe3等,每例肿瘤内仅存在单一的易位形式。除肾细胞癌外,一些软组织间叶肿瘤同样存在tfe3基因致病性的基因易位,包括腺泡状软组织肉瘤、部分上皮样血管周细胞肿瘤等,这些间叶肿瘤和xp11.2易位性肾癌一起统称为xp11.2易位性肿瘤。
xp11.2易位性肿瘤是一罕见类型肿瘤,虽然其总体发病率很低,但在儿童肾癌患者中约1/3为此类肾癌,并且回顾性研究表明此类肿瘤在我国并不罕见。该疾病以发病年龄轻为突出特征,因此造成极其沉重的家庭及社会负担。且研究已证实,xp11.2易位性肾癌预后要比非xp11.2易位性肾癌预后差,并且不同基因类型xp11.2易位性肾癌的预后有所区别。此外,有明确证据表明xp11.2易位性肿瘤的患者对血管内皮生长因子受体(vascularendothelialgrowthfactorreceptor,vegfr)或哺乳动物雷帕霉素(mammaliantargetofrapamycin,mtor)分子靶向治疗敏感。另有研究表明,met酪氨酸激酶为aspl-tfe3融合基因的靶基因,并有望成为xp11.2易位性肿瘤的治疗靶点。因此,根据基因型来精确诊断此类肿瘤显得十分重要。
目前常用的诊断xp11.2易位性肿瘤的检测方法主要包括免疫组织化学和荧光原位杂交。免疫组织化学检测细胞核tfe3融合蛋白直观、快捷、价格低,但其缺点是该方法容易受到多种因素影响,如组织固定时间、组织修复方式、抗体克隆号以及人为的判读因素等等,使得结果可能出现假阳性或假阴性。染色体荧光原位杂交(fish)始于传统的细胞遗传学和dna技术的结合,快速灵敏、特异性好,可以检测隐匿或微小的染色体畸变以及复杂核型;还可以使用多种荧光标记,显示dna片段及基因之间的相对位置与方向,空间定位精确。但这两种检测方法只能提示存在tfe3蛋白的高表达或tfe3基因的易位,均不能明确肿瘤中发生的具体易位改变。精确检测xp11.2易位性肿瘤的易位伴侣和融合基因位点,不仅是患者预后预测的依据,也是未来靶向治疗的指导,因此,明确xp11.2易位性肿瘤的基因易位位点,具有重要的临床意义。
xp11.2易位性肿瘤是一种每个个体间异质性较大的肿瘤类型,目前已知的融合基因形式就包括aspl-tfe3、prcc-tfe3、sfpq-tfe3、nono-tfe3、cltc-tfe3、luc7l3-tfe3、khsrp-tfe3、parp14-tfe3、dvl2-tfe3和rbm10-tfe3等十余种,其中一种融合基因形式,又可能存在数种不同的易位位点。比如:同样是aspl-tfe3基因融合亚型,文献报道又有aspl基因7号外显子与tfe3基因6号外显子融合(e7-e6)和aspl基因7号外显子与tfe3基因5号外显子融合(e7-e5)两种易位位点。
目前高通量测序是唯一可以明确未知易位位点的检测手段,然而高通量测序费用高昂,检测周期长,检测平台稀缺,对样品质量要求高,不利于普及推广,对于大多数患者来说也不是首选检测手段。
依赖以往经验,针对已知的融合位点设计特异性的pcr引物组合,对肿瘤组织中提取出的rna逆转录之后进行pcr扩增并测序,检测融合基因具体易位位点,是最准确、便捷、经济的方法。文献报道中已发表的prcc-tfe3融合基因扩增引物如下:prccexon1f,gccggagttgcataagg,tfe3exon6r,tcaagcagattccctgacac。这一对引物只涵盖了一种prcc-tfe3融合位点(prcc外显子1-tfe3外显子6),而我们通过高通量测序方法检测发现,prcc-tfe3易位性肿瘤存在另一种易位模式(prcc外显子5-tfe3外显子4),这一位点国内外文献均未报道过,原有prcc-tfe3融合基因扩增引物也无法检测出这一融合基因,因此会导致漏诊。
进一步发现新的致病融合位点,进而设计pcr引物将有利于xp11.2易位性肿瘤检测准确度的进一步提高。
技术实现要素:
本发明的目的是针对上述技术问题提供一种用于诊断prcc-tfe3易位性肿瘤的引物组合。
本发明另一个目的是提供上述引物组合在制备prcc-tfe3易位性肿瘤诊断试剂中的应用。
本发明再一个目的是提供含有上述引物组合的诊断试剂盒。
本发明的目的是通过下列技术方案实现的:
一种prcc-tfe3融合基因,由prcc外显子5和tfe3外显子4融合形成。tfe3、prcc基因序列来自genebank,序列版本号grch38.p7,prcctranscript_id="nm_005973.4",tfe3transcript_id="nm_006521.5"。
所述的融合基因发生融合的片段序列优选如seqidno.5所示:gccgctggtgcttattatcagggtctgcagcaacatctgggccactcgcctctaaggggaatcatgagattcctgaactcaaaatctggtaaacgaacctgctttgttcccagctttgattattacagtggtggctactatcctgcacaggacccggccctggtccccccccaggaaattgccccagatgcctccttcatcgatgacgaagcagtgcagacccatctggagaacccaacgc(241bp)。
本发明所述的prcc-tfe3融合基因在制备prcc-tfe3易位性肿瘤诊断试剂中的应用。
一种检测prcc-tfe3易位性肿瘤的pcr引物,为检测本发明所述的prcc-tfe3融合基因的pcr引物。
本发明所述的检测prcc-tfe3易位性肿瘤的pcr引物,seqidno.1所示的prcc-e5-f和seqidno.2所示的tfe3-e4-r。
本发明所述的pcr引物在制备prcc-tfe3易位性肿瘤诊断试剂中的应用。
由于本发明引物组合与文献报道引物针对的是不同基因易位位点,因此应用于xp11.2易位性肿瘤检测时需联合已报道引物组合与本发明设计引物,二者作用不能互相替代。
一种prcc-tfe3易位性肿瘤诊断试剂盒,包括本发明所述的pcr引物。
一种prcc-tfe3易位性肿瘤诊断试剂盒,优选包括本发明所述的pcr引物和seqidno.3所示的prccexon1f和seqidno.4所示的tfe3exon6r。
本发明的有益效果:
本发明发现了一个新的xp11.2易位性肿瘤得融合基因,由prcc外显子5和tfe3外显子4融合形成;并针对高通量测序发现的新融合位点设计了特异性的pcr引物,扩大了原引物组合的检测范围,应用于临床,可提高诊断该类肿瘤的检出率和准确率;为诊断分型及分子靶向治疗提供依据。根据我们的实验结果,该引物组合诊断的特异性和敏感性均达到了100%,且操作对象只需要在石蜡包埋组织切片上进行,时间仅为三个工作日。采用本发明提供的探针组合进行检测prcc-tfe3易位性肿瘤,不但方便、快速、可靠而且检出率高,可用于制备prcc-tfe3易位性肿瘤诊断试剂盒,为prcc-tfe3易位性肿瘤的快速准确的诊断提供了新的工具。
附图说明
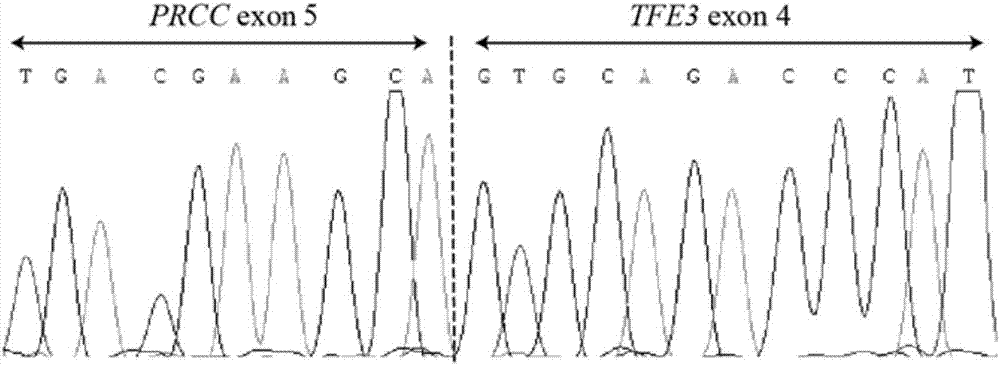
图1:在已知prcc-tfe3融合型肿瘤中应用本发明引物组合进行验证,成功检出的prcc-tfe3融合基因测序图。
图2:在未知融合对象的xp11.2肿瘤病例中应用本发明引物,成功检出的prcc-tfe3融合基因测序图。
具体实施方式
以下通过实施例对本发明作进一步的阐述。
实施例1:prcc-tfe3融合基因pcr引物组合的制备:
本发明发现一个新的prcc-tfe3融合基因,由prcc外显子5和tfe3外显子4融合形成。tfe3、prcc基因序列来自genebank,序列版本号grch38.p7,prcctranscript_id="nm_005973.4",tfe3transcript_id="nm_006521.5"。针对这一情况,我们在prcc的5号外显子和tfe3的4号外显子内分别设计引物。遵循引物设计原则,引物最好在模板cdna的保守区内设计,引物长度在15bp-30bp之间,引物gc含量在40%~60%之间,退火温度最好接近72℃,引物自身及引物之间不应存在互补序列,扩增条带单一特异。由于工作中经常需要在石蜡固定标本中开展工作,石蜡标本rna碎裂严重,因此扩增产物不宜过长,需要控制在300bp以下。
经过多次调试和验证,最终设计的引物序列为:prcc-e5-f:cccagatgcctccttcat(seqidno.1);tfe3-e4-r:cgagtgtggtggacaggt(seqidno.2),理论扩增产物长241bp。经实验验证,引物可成功扩增出目的条带,条带单一、特异。
实施例2:针对明确诊断的病例进行验证:
对于高通量测序rna-seq检测出prccexon5-tfe3exon4新融合位点的病例,使用我们设计的引物进行验证。
一、rna的提取:
严格按照rneasyffpekit操作说明进行提取。①脱蜡:将收集好的玻片进行二甲苯脱蜡,再用无水乙醇漂洗,风干后用手术刀片刮下来装入1.5mlep管中;②酶解:加入150μl消化液,再加入10μl蛋白酶k,混匀,56℃酶解15min,80℃15min,冰上冷却;③加入16μldndna酶缓冲液,再加入10μldnasei,混匀,室温静置15mimin,12000rpm离心15min,取上清;④加入320μl结合液液再加入720μl无水乙醇,混匀,分2次转移至吸附柱中,8000rpm离心1min,,弃废液;⑤洗涤:加入500μl洗涤液,8000rpm离心1min;重复洗涤一次,弃废液,将吸附柱转移到一个新的2ml收集管中,12000rpm离心5min;⑥洗脱:将吸附柱转移到1.5ml的ep管中,加入100μl的洗脱液,室温静置1min,12000rpm离心1min,将收集好的洗脱液(即dna提取液)进行浓度和纯度测定,-80℃保存存待用。
二、逆转录pcrrt-pcr
采用试剂盒(k1622,revertaidfirststrandcdnasynthesiskit,mbi)对rna进行逆转录,方法详见试剂盒说明。pcr扩增引物分别为本专利prcc-tfe3融合基因引物。反应体系包括:0.125μltakaraextaqtmhs液,2.5μl10×taqbuffer(mg2+plus),2μldntp(均购自日本takara公司),引物浓度为20μmol/l,cdna模版为100ng,无菌去离子水加至25μl。pcr扩增条件为94℃变性3min后,94℃30s、60℃30s、72℃1min,共35次循环,最后72℃延伸5min。pcr产物用3%琼脂糖,电压100v,电泳,溴化乙啶染色后于紫外光下观察结果,并送测序。
结果:pcr后可见单一特异的电泳条带,对扩增产物进行测序,得到prccexon5-tfe3exon4融合基因序列gccgctggtgcttattatcagggtctgcagcaacatctgggccactcgcctctaaggggaatcatgagattcctgaactcaaaatctggtaaacgaacctgctttgttcccagctttgattattacagtggtggctactatcctgcacaggacccggccctggtccccccccaggaaattgccccagatgcctccttcatcgatgacgaagcagtgcagacccatctggagaacccaacgc(seqidno.5),证明本发明设计的引物组合可靠且敏感。
实施例3:针对未知易位伴侣的xp11.2肿瘤进行检测
我们对35例未知易位伴侣的xp11.2肿瘤使用文献报道引物(prccexon1f/tfe3exon6r)联合本发明的引物组合(prcc-e5-f/tfe3-e4-r)进行检测,rna提取、逆转录pcr和测序方法同上。
结果:仅使用文献报道引物检测35例未知易位伴侣的xp11.2肿瘤,共4例检测出prcc-tfe3融合基因,而用文献报道引物联合本发明补充引物组合检测,共5例检测出prcc-tfe3融合基因,通过免疫组织化学、荧光原位杂交等方法验证,结果真实可靠。
评价:本发明引物组合是对原有引物的补充,涵盖了tff3融合基因的未报道位点,增加了rt-pcr方法诊断该肿瘤的检出率。
- 还没有人留言评论。精彩留言会获得点赞!