一种促黄体激素类似物及其制备方法与流程
【技术领域】
本发明属于生物技术领域,尤其涉及一种兽用促黄体激素类似物(luteinizinghormone,lh)及其制备方法。
背景技术:
黄体激素(luteinizinghormone,lh)是由垂体前叶嗜碱性粒细胞分泌的一种异二聚体糖蛋白,由lhα和lhβ两个亚基以非共价键的方式结合形成。lh和促卵泡激素(follicle-stimulatinghormone,fsh)在雌性生物的卵巢和雄性生物的睾丸的功能调控过程中协同发挥作用。fsh主要促使卵泡发育。lh主要促进卵泡成熟排卵,同时可促进黄体生成。在雌性动物生殖周期中,血液中lh和fsh的浓度周期变化曲线不同。在排卵时需要一个短暂的lh高峰,而在整个生殖周期需要持续保持较低浓度的lh以维持动物的性功能。
优质家畜品种的扩繁通常是通过超数排卵(superovulation)和胚胎移植来实现。超数排卵是应用外源激素诱导卵巢多个卵泡同时发育,并排出具有受精能力的卵子的方法。孕马血清促性腺激素(pregnantmareserumgonadotropin,pmsg)和促性腺激素释放激素(gonadotropin-releasinghormone,gnrh)是目前超数排卵中应用广泛的激素。但是pmsg同一分子同时具有lh和fsh两种促性腺激素的活性。lh和fsh又都是gnrh的下游激素,gnrh能够促使内源性lh和fsh两种激素的合成和释放。卵巢存在着大量处于不同阶段的卵泡。卵泡发育的不同阶段对于激素的需求是不尽相同的,发育后期的卵泡从fsh依赖转变为lh依赖。单用pmsg或gnrh促进超数排卵,由于lh和fsh两种激素的作用同时施加在对处于不同阶段的卵泡,导致卵泡成熟不同步,排卵时间不一致。卵子先后从卵泡排出之后继续发育,而处在不同发育阶段的卵子在同一时间人工授精的条件下受精能力不一样,影响了可移植胚胎数。所以在实践中,先采用fsh促使卵泡发育,再配合短效lh促进成熟卵子同时排出,可使反刍动物的超排率,尤其是可移植胚胎产量明显提高。
除了通过短效lh在超排方面的应用,如果将长效lh与长效fsh两者配合,在减少注射次数、降低应激的前提下,可促使母畜早期发情,缩短空怀时间,提高繁殖率。
因此,短效和长效的lh在辅助生殖技术中均具实际应用的需求。
天然提取的lh具有纯度低、产量低和成本高等缺点,更重要的是携带生物源性传染物的潜在危险,不利于在畜牧业上的推广应用。
目前专业技术人员利用dna重组技术制备lh类似物可以避免以上缺点。已知的重组技术包括:设计合理的目的蛋白编码序列、设计合理的连接序列、将lhα和lhβ两个亚基基因通过连接序列融合成为单链序列、选择合适的表达载体和表达系统。但是,目前对于“合理的蛋白编码序列”和“合理的连接序列”仅限于在理论上的认识,并无现成的普适序列。本发明利用宿主细胞内密码子偏爱性的知识对lh的密码子进行重组、对含不同氨基酸的连接序列(蕴含不同的长度、可折叠性、疏水性、电荷效应以及糖基化位点)进行重组、并对相应的各种候选序列的表达物进行功能性比较、优化而发明了现予以公开的序列。
本发明在现有技术的基础上,通过实验探索、试错验证,总结出一套制备功能性lh类似物的方法,所述的功能性lh类似物是一种新的功能性重组蛋白(recombinantprotein)。本发明公开了功能性重组蛋白中连接序列的设计和验证方法,选择合适的连接序列、使得连接的长度、可折叠性、疏水性、电荷效应以及糖基化位点等结构特点最终能够体现重组蛋白所需的生物功能,符合药典对lh生物活性的要求,所公开的制备方法具有可重复性。
技术实现要素:
本发明提供一种促黄体激素类似物及其制备方法,针对现有的技术问题,本发明根据连接序列的长度、可折叠性、疏水性、电荷效应来设计合适的连接序列从而得到不同时效的一系列兽用促黄体激类似物。所述的促黄体激素类似物是一种新的重组蛋白。
为达到上述目的,本发明的技术方案为:
一种促黄体激素类似物为携带有起始密码子和信号肽编码序列但删除终止密码子的lhβ亚基编码序列与缺少起始密码子和信号肽编码序列但携带终止密码子的lhα亚基编码序列与接头序列按照lhβ-接头序列-lhα的顺序从n末端到c-末端连接起来的单链多肽;
所述接头序列的氨基酸序列为seqid1至seqid10中的任一种;
对应所述接头序列的促黄体激素类似物的氨基酸序列为seqid11至seqid20。
进一步地,所述促黄体激素类似物的制备方法,包括以下步骤:
步骤1、从genebank获得牛(bovine)lhα亚基编码序列和lhβ亚基编码序列,删除lhβ的终止密码子和lhα的起始密码子;根据cho-k1表达系统偏爱的密码子丰度,将野生型lh的编码序列密码子进行重组;设计接头序列,根据接头序列的长度、可折叠性、疏水性、电荷效应设计不同长度的带有0个、1个、2个和4个o-糖基化和n-糖基化位点的接头序列10个,在接头序列上添加组氨酸标签(hhhhhh),接头序列两端分别添加酶切位点bamhi和ecori,以引物的形式全序列合成,纯化方式page,合成量1od,合成的接头序列单链dna-20℃保存备用;
步骤2、将含有全序列合成的野生型lh的重组载体pmd19-tsimple-lh9、含有全序列合成的密码子偏爱型lh的重组载体pmd19-tsimple-lh10和空表达载体pcdna3.1(+)分别经限制性内切酶双酶切,回收双酶切线性化的pcdna3.1(+)和lh(含接头序列)片段,经dna连接酶连接,分别形成重组表达载体pcdna3.1(+)-lh9和pcdna3.1(+)-lh10,构建的重组表达载体转染感受细胞e.colidh5α,选取抗阿莫西林阳性克隆菌落扩大培养,提取重组载体并保存菌种,提取的质粒载体限制性内切酶双酶切鉴定;
步骤3、分别置换连接序列,共构建20个含10中不同连接序列的野生型和密码子偏爱型的blh表达载体;
步骤4、采用脂质体转染法,将上述构建的含有不同接头序列的blh表达载体转入cho-k1细胞中,取上清液做westernblotting检测,选取表达量高且携带组氨酸的重组blh表达载体,线性化后转染cho-k1细胞,通过g418筛选,上清液通过westernblotting检测;
步骤5、重组blh表达株的单克隆化,取blh表达株细胞放大培养作为种子库;
步骤6、通过对相应的各种候选序列的表达物的生物活性进行比较而确定长短效序列。
进一步地,所述促黄体激素类似物的制备方法步骤2中,双酶切的限制性内切酶为hindiii和xbai。
进一步地,所述促黄体激素类似物的制备方法步骤2中,dna连接酶为t4dnaligase。
进一步地,所述促黄体激素类似物的制备方法步骤4中g418筛选浓度为150-350μg/ml,最优浓度为250μg/ml。
通过上述技术方案,本发明所制得的促黄体激素类似物为具有不同时效的功能性单链多肽,比天然促黄体激素具有列优越的实用性和商业价值。
【附图说明】
图1.1为单链融合lh表达基因的设计图;
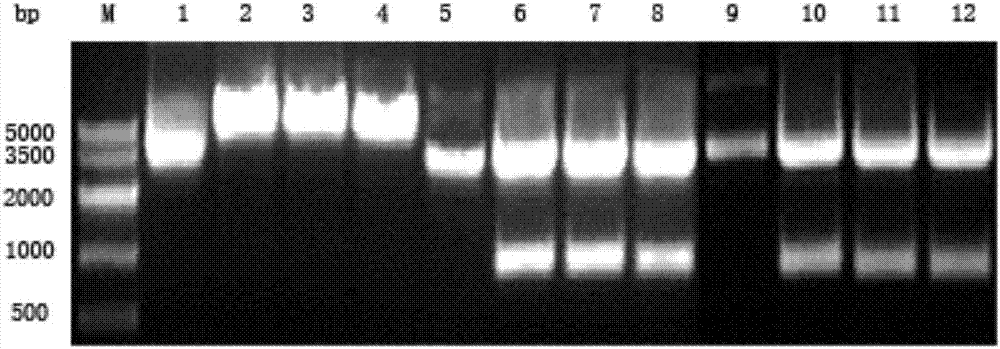
图1.2为重组载体pmd19-tsimple-lh9和pmd19-tsimple-lh10以及空表达载体pcdna3.1(+)分别经限制性内切酶hindiii和xbai双酶切产物1.5%琼脂糖凝胶电泳图;
图1.3为重组表达载体的酶切鉴定
图1.4为重组载体pcdna3.1(+)-lh10和pcdna3.1(+)-lh9分别经限制性内切酶双酶切产物1%琼脂糖凝胶电泳图;
图1.5为接头序列双酶切20%丙烯酰胺凝胶电泳图;
图1.6为含有不同接头序列的blh瞬时表达结果;
图1.7为含有不同接头序列的blh经限制性内切酶acli酶切的1.5%琼脂糖凝胶电泳图;
图1.8为经g418筛选blh表达细胞系;
图1.9为转染细胞株上清液westernblotting检测结果图,显示糖基化类型及数目对糖蛋白分子量的影响;
图1.10为接头序列中无糖基化blh表达株westernblotting检测结果图;
图1.11为接头序列中两个n-糖基化blh表达株westernblotting检测结果图;
图2为携带不同接头序列的blh通过westernblotting检测蛋白相对含量的结果图。
【具体实施方式】
下面结合具体实施例与附图对本发明方案做进一步详细说明:
实施例1、不同糖基化类型的促黄体激素类似物的制备
以牛(bovine,b)的lhα和lhβ基因序列为模板,根据促黄体激素结构与功能的关系,将lh的两个亚基按照nh2-β-linker–α-cooh的顺序连接形成单链融合lh。根据结构特点,诸如氨基酸序列的长度、可折叠性、疏水性、电荷效应和糖基化程度设计了10条不同接头(linker)序列,并分别与野生型和密码子偏爱型blhα和blhβ连接形成20条不同序列的融合蛋白。
1.1重组blh单链融合蛋白的设计
从ncbi的基因库genebank获得牛(bovine)lhα亚基编码序列(nm_173901.3)和lhβ亚基编码序列(m11506.1),将携带有起始密码子和信号肽编码序列但删除终止密码子的lhβ亚基编码序列与缺少起始密码子和信号肽编码序列但携带终止密码子的lhα亚基编码序列与接头序列(1)按照lhβ-接头序列-lhα的顺序从n末端到c-末端连接起来,如图1.1为单链融合lh表达基因的设计图。
1.1.1接头序列的设计
综合考虑接头序列(linker)的结构特点,包括氨基酸序列的长度、可折叠性、疏水性、电荷效应以及糖基化程度,设计了10条接头序列。在结构允许的情况下含有组氨酸标签(hhhhhh)以利下游的纯化工作。o-糖基化位点序列氨基酸为ptpgp,n-糖基化位点氨基酸序列为nxt/s(x为除脯氨酸外的任一氨基酸)。接头序列两端分别添加酶切位点bamhi和ecori。linker以引物的形式合成,纯化方式pag,合成量1od。linker的编号、其氨基酸序列及单链dna合成序列详细信息见表1.1。
表1.1linker的氨基酸序列及与其对应的所合成的dna序列
将合成的接头序列单链dna-20℃保存备用。
1.1.2单链融合blh编码序列
1.1.2.1定制全序列合成的pmd-19tsimpe-lh9,即在克隆载体中含野生型blh,其中单链融合blh是按照nh2-β-linker9–α-cooh的顺序连接形成,序列如下:
atggagatgttccagggactgctgctgtggctgctgctgggcgtggccggggtgtgggcttccagggggccactgcggccgctgtgccagcccatcaacgccaccctggcggctgagaaggaggcctgccctgtctgtatcactttcaccaccagcatctgcgccggctactgccccagcatgaagcgggtgctgcctgtcatcctgccgcccatgccccagcgggtgtgcacctaccatgagctgcgcttcgcctccgttcggctccccggctgcccacctggagtggacccaatggtctccttccccgtggccctcagctgtcactgtggaccctgccgcctcagcagcactgactgcgggggtcccagaacccaacccttggcctgtgaccaccccccgctcccagacatcctcttcctcggatcccctacccctggcccccaccaccatcaccatcatcctacccccggacctgaattccctgatggagagtttacaatgcagggctgtcctgaatgcaagctaaaagaaaacaaatacttctccaagccagatgctccaatctatcagtgcatggggtgctgcttctccagggcataccccactccagcgaggtctaagaagacaatgttggtccccaagaacatcacctcggaagctacatgctgtgtggccaaagcatttaccaaggccacagtgatgggaaatgtcagagtggagaaccacaccgagtgccactgcagcacttgttattatcacaaatcctaa
起始密码子:atg;终止密码子:tga
1.1.2.2定制全序列合成的pmd-19tsimpe-lh10,即在克隆载体中含密码子偏爱型blh,其中单链融合blh是按照nh2-β-linker10–α-cooh的顺序连接形成,序列如下:
atggaaatgttccagggcctgctgctgtggctgctgctgggagtggctggcgtgtgggctagtagaggacctctgaggcctctgtgccagcccatcaatgccaccctggccgccgagaaagaggcctgccctgtgtgcatcaccttcaccacctctatctgcgccggctactgcccctccatgaagagggtgctgcccgtgatcctgccccccatgcctcagagagtgtgcacctaccacgagctgagattcgcctccgtgcggctgcctggatgtcctcctggcgtggaccctatggtgtccttccctgtggccctgtcttgccactgcggcccttgcagactgtcctctaccgattgtggcggccctcggacacagcctctggcctgtgatcatccccccctgcccgatatcctgttcctgggatccaaccacaccggctcccaccatcaccatcaccatggctccaaccacacagaattccccgacggcgagtttacaatgcagggctgccccgagtgcaagctgaaagagaacaagtatttctccaagcccgacgcccccatctaccagtgcatgggctgctgtttctcccgggcctaccctaccccagcccggtccaagaaaaccatgctggtgcccaagaacatcacctccgaggccacctgttgcgtggccaaggcctttaccaaggccaccgtgatgggcaacgtgcgggtggaaaaccacaccgagtgccactgctctacctgctactaccacaagtcctga
起始密码子:atg;终止密码子:taa
1.2野生型和密码子偏爱型blh表达载体的构建
1.2.1表达载体的重组
将全序列合成的重组载体pmd19-tsimple-lh9、pmd19-tsimple-lh10和空表达载体pcdna3.1(+)分别经限制性内切酶hindiii和xbai双酶切,酶切体系见表1.2。
表1.2克隆载体及表达载体的酶切
备注:质粒即载体
将上述酶切体系混匀后,37℃水浴4h。酶切产物进行1.5%琼脂糖凝胶电泳,实验结果见图1.2,图中m:marker;1:未经酶切的pcdna3.1(+);2、3和4:均为pcdna3.1(+)经hindiii和xbai双酶切的产物;5:未经酶切的pmd-19tsimpe-lh9;6、7和8:均为pmd-19tsimpe-lh9经hindiii和xbai双酶切的产物;9:未经酶切的pmd-19tsimpe-lh10;10、11和12:均为pmd-19tsimpe-lh10经hindiii和xbai双酶切的产物。
采用行业内技术人员已知的方法,按照takara琼脂糖凝胶回收试剂盒说明书,分别回收双酶切线性化的pcdna3.1(+)、双酶切pmd-19tsimpe-lh9释放出来的野生型blh(含linker9)片段和双酶切pmd-19tsimpe-lh10释放出来的密码子偏爱型blh(含linker10)片段,分别经dna连接酶t4dnaligase连接,形成重组表达载体pcdna3.1(+)-lh9和pcdna3.1(+)-lh10。再采用行业内技术人员已知的方法将构建的重组表达载体分别转染感受态e.colidh5α,选取阿莫西林抗性阳性的克隆菌落扩大培养,提取重组表达载体并保存菌种,将提取的重组表达载体分别进行限制性内切酶hindiii和xbai双酶切和dna测序鉴定。
1.2.2重组表达载体的鉴定
所构建的重组表达载体pcdna3.1(+)-lh9和pcdna3.1(+)-lh10分别经hindiii和xbai、hindiii和bamhi和ecori和xbai双酶切结果如图1.3(1.5%琼脂糖凝胶电泳图)所示,图中:m:marker;1:未经酶切的pcdna3.1(+)空质粒;2、3和4依次为pcdna3.1(+)经过hindiii和xbai、hindiii和bamhi和ecori和xbai双酶切的产物;5:未经酶切的pcdna3.1(+)-lh9表达质粒;6、7和8:依次为hindiii和xbai、hindiii和bamhi和ecori和xbai双酶切pcdna3.1(+)-lh9表达质粒;9:未经酶切的pcdna3.1(+)-lh10表达质粒;10、11和12:依次为hindiii和xbai、hindiii和bamhi和ecori和xbai双酶切的pcdna3.1(+)-lh10表达质粒。
由图可知,pcdna3.1(+)-lh9和pcdna3.1(+)-lh10经过双酶切得到的产物分别与预期的dna长度相符(由hindiii和xbai双酶切释放790bp的lhβ-linker-lhα、由hindiii和bamhi双酶切释放437bp的lhβ和由ecori和xbai双酶切释放297bp的lhα),结果表明构建的表达载体正确。再经dna测序证实,5’端和3’端序列表明与1.1.2所设计的单链融合blh编码序列一致。
1.2.3重组lh所含linker的置换
1.2.3.1带有粘性末端不含linker的线性重组载体序列的制备
重组载体pcdna3.1(+)-lh10和pcdna3.1(+)-lh9分别经限制性内切酶bamhi和ecori双酶切,获得缺失linker的重组载体序列,酶切产物加入loadingbuffer,1%琼脂糖凝胶电泳见图1.4,其中:m:marker;1:未经酶切的环状pcdna3.1(+)-lh10;2:经bamhi和ecori双酶切的线性pcdna3.1(+)-lh10,酶切下来的linker10因分子量过小未在电泳图中体现;3:未经酶切的环状pcdna3.1(+)-lh9;4:经bamhi和ecori双酶切的线性pcdna3.1(+)-lh9,酶切下来的linker9因分子量过小未在电泳图中体现。按照takara琼脂糖凝胶回收试剂盒说明书,分别回收获得不含linker的线性重组载体序列pcdna3.1(+)-lh10和pcdna3.1(+)-lh9。
1.2.3.2候选linker的双酶切
将合成的linkerdna正负链各5μl,100nmol/ml混匀,95℃变性5分钟后缓慢退火至室温。退火后形成双链的linkerdna序列由bamhi和ecori双酶切,5’端和3’端均形成粘性末端。20%丙烯酰胺凝胶电泳,90v,180分钟,实验结果如图1.5所示,m:marker;1:未经酶切的linker1;2:经bamhi和ecori双酶切的linker1;3:未经酶切的linker2;4:经bamhi和ecori双酶切的linker2;5:未经酶切的linker3;6:经bamhi和ecori双酶切的linker3。
行业内技术人员已知双链dna经双酶切后会提高其电泳迁移率。由图1.5可知,linkerdna片段成功进行了双酶切。凝胶回收试剂盒直接回收酶切后的产物,获得带有粘性末端的linkerdna片段。针对于linkers4-8的操作如同以上所述linkers1-3的方法。
1.2.3.3候选linker分别与载体pcdna3.1(+)-lh连接
将上述回收的不含linker的pcdna3.1(+)-lh10和pcdna3.1(+)-lh9依次分别与不同的linker经dna连接酶t4dnaligase连接形成携带不同linker的野生型和密码子偏爱型的blh(连接体系见表1.3)。
表1.3linker与表达载体连接体系
连接产物成功转染大肠杆菌感受态,挑取单克隆,扩大培养,保存菌种、提取质粒后送测序。
1.3重组lh在cho-k1细胞中的表达
1.3.1cho-k1细胞的培养
1.3.1.1cho-k1细胞的复苏
取一株冻存的cho-k1细胞,37℃水浴锅中迅速融化,接种在含10ml10%血清ham’sf12细胞培养基的10cm细胞培养板中,待细胞贴壁后换取新鲜的培养基,继续培养至细胞汇合度90%。
1.3.1.2cho-k1贴壁细胞的传代
按业内技术人员已知的技术,在超净工作台内,将复苏的细胞旧培养基按规定丢弃,5mlpbs洗三遍,加入1ml细胞消化液,左右倾斜至消化液铺满底面,按规定丢弃消化液,放入5%二氧化碳培养箱2min至细胞全部脱落,加入培养基吹打均匀,分装在细胞培养瓶中培养。
1.3.2携带不同linker的blh在cho-k1细胞中的瞬时表达
采用脂质体转染法,将上述构建的含有不同linker的blh表达载体转入cho-k1细胞中,取上清液做westernblotting检测。
1.3.2.1瞬时转染cho-k1细胞
转染前一天,取长满细胞的10cm细胞培养皿,吸去旧培养基,pbs洗三次,胰酶消化1分钟,5ml含10%血清f12培养基吹打均匀后计数,将细胞稀释到1xl06个细胞/ml培养基,0.5ml/孔铺24孔板。
步骤1、1μgdna溶于25μlham’sf12无血清培养基中。
步骤2、1.5μllipofectamine2000溶于25μlham’sf12无血清培养基中。
步骤3、将上述溶液混合均匀,室温静置20min。
步骤4、混合液加入到铺有细胞的24孔板中,轻轻吹打混匀。
步骤5、24孔板置于37℃5%二氧化碳培养箱中培养,6h后换为新鲜的培养基。
步骤6、细胞培养6d后取上清液50μl做westernblotting检测。
1.3.2.2westernblotting检测blh的瞬时表达
步骤1、细胞培养上清液40μl加入10μl5×loadingbuffer煮沸。
步骤2、在电泳槽中加入约270ml电泳缓冲液,每孔上样40μl。
步骤3、电泳:5%浓缩胶,60v,30min;12%分离胶100v,120min。
步骤4、pvdf膜甲醇激活2min,胶在负极,膜在正极,250ma转膜120min。
步骤5、转膜结束后将pvdf膜用封闭液封闭2h。
步骤6、兔抗lhα多克隆抗体(1:400稀释)4℃孵育12h;tbst洗膜三次。
步骤7、山羊抗兔igg-hrp(1:5000稀释)室温孵育2h,tbst洗膜三次。
步骤8、ecl显影。
含有不同linker的blh瞬时表达结果,如图1.6所示:
图a为野生型blh在cho-k1细胞表达上清液westernblotting鉴定结果。
图b为密码子偏爱型的blh分别在cho-k1细胞表达上清液的westernblotting鉴定结果。
p:阳性对照;
n:转染了pcdna3.1(+)的细胞培养上清液;
1:转染了linker为gsgpvpgpspgpvpe的重组blh细胞培养上清液;
2:转染了linker为gshhhhhhe的重组blh细胞培养上清液;
3:转染了linker为gsnatgsgsnate的重组blh细胞培养上清液;
4:转染了linker为gsnathhhhhhe的重组blh细胞培养上清液;
5:转染了linker为gsntsngstnntsne的重组blh细胞培养上清液;
6:转染了linker为gsptpgphhhhhhe的重组blh细胞培养上清液;
7:转染了linker为gsptpgpptpgpe的重组blh细胞培养上清液;
8:转染了linker为gsptpsptpsptpspte的重组blh细胞培养上清液;
9:转染了linker为gsptpgphhhhhhptpgpe的重组blh细胞培养上清液;
10:转染了linker为gsnhtgshhhhhhgsnhte的重组blh细胞培养上清液。
由实验结果可知:①重组蛋白的表达量与linker的长度不呈线性关系。②糖基化位点超过2个糖蛋白的分子量几乎不再增加。③密码子偏爱型的blh与野生型blh在cho-k1细胞中的表达无显著性差异,说明蛋白表达量除了与密码子优化及gc含量有关外还受其他因素的影响,有可能密码子的优化造成的蛋白序列的改变导致了转录及翻译有关调控原件的改变。另外,密码子优化同样造成了低频率使用的trna的资源浪费。因此密码子优化并不是密码子适应指数越高蛋白表达量就越高,除了需要考虑gc含量外还应该综合考虑各种顺式作用原件、dna甲基化和核苷酸序列对翻译的影响。
1.3.3携带不同linker的blh在cho-k1细胞中的稳定表达
选取表达量高且携带组氨酸标签的重组blh表达载体稳定转染cho-k1细胞。将携带不同linker的blh表达载体线性化,采用脂质体包裹表达载体dna进入cho-k1细胞,通过g418筛选获得稳定表达重组blh的细胞系。
1.3.3.1表达载体的线性化
将空载体pcdna3.1(+)和含有不同linker的pcdna3.1(+)-blh表达载体线性化(酶切体系见表1.4)。
表1.4表达载体的线性化体系
上述体系混匀后,37℃水浴锅中酶切4h。
将酶切过的表达载体加入sybrgreeni和6×dnaloadingbuffer1.5%琼脂糖凝胶电泳,见图1.7,图中:m:marker;1:未经酶切的pcdna3.1(+);2和3:均为经acli单酶双切的pcdna3.1(+);4:未经酶切的pcdna3.1(+)-lh10;5和6:均为经acli单酶双切的pcdna3.1(+)-lh10;7:未经酶切的pcdna3.1(+)-lh9;8和9:均为经acli单酶双切的pcdna3.1(+)-lh9。pcdna3.1(+)表达载体有两个acli酶切位点均存在amp抗性基因上,acli酶切载体后产生373bp的小片段,由图1.7可知,表达载体线性化成功。
待电泳结束后,采用行业内技术人员已知的方法,切取含有线性化blh表达载体的凝胶,回收线性化blh表达载体,测定回收产物的dna浓度。
1.3.3.2细胞筛选g418浓度的选择
在24孔板中接种cho细胞(1xl05个细胞每孔),待细胞长到50%汇合度时,换成含有g418的培养基,使培养基g418的终浓度分别为0、50、100、150、200、250、300、350、400、450、500、550、600、650和700μg/ml,每个浓度设3复孔。每隔三天换液,10天后,选取使cho-k1细胞完全死亡的最小g418浓度作为cho细胞的g418筛选浓度。
结果表明g418浓度大于200μg/ml的细胞培养基均可以使cho-k1细胞完全死亡,因此细胞筛选培养基的g418浓度选择250μg/ml。
1.3.3.3稳定转染cho-k1细胞
转染前一天,从co2培养箱中取一皿cho-k1细胞放进超净工作台中,5ml移液器吸取旧培养基并丢弃,加入5mlpbs,左右倾斜细胞培养皿,丢弃pbs,重复三次。加入1ml细胞消化液将细胞在37℃co2培养箱消化2min。加入5ml含10%新生牛血清的ham’sf12培养基,用移液器将细胞吹打均匀。将细胞稀释后滴加在血球计数板上,盖上盖玻片,在显微镜下进行细胞计数,将细胞用含10%新生牛血清的ham’sf12培养基稀释到1xl06细胞/ml,0.5ml/孔铺24孔板。
重组lh表达载体转染cho-k1细胞方法如下:
1、将1μgdna溶于25ulham’sf12无血清培养基中,得a液。
2、将1.5μllipofectamine2000溶于25μlham’sf12无血清培养基中。得b液。
3、将ab两管液体混合得c液,将c液室温放置20min。
4、将c液加入到长有细胞的24孔板中,轻轻晃动使c液与培养基混合混匀。
5、将24孔板置于二氧化碳培养箱中培养7h,丢弃就培养基,加入0.5ml新鲜的培养基。
6、培养24小时后换为含250μg/mlg418的筛选培养基。
7、每两天换液一次(含g418的筛选培养基),待无质粒转染组细胞完全死亡后传代至6孔板。
8、用筛选培养基将转染后的细胞传代培养20天。
9、取细胞培养上清液40μl做westernblotting检测。
转染cho-k1后经g418加压筛选第8天,无质粒转染组细胞完全死亡,转染组细胞不再死亡,结果如图1.8所示,其中:a:无质粒转染组;b:pcdna3.1(+)转染组;c:pcdna3.1(+)-lh转染组。
1.3.4linker中的糖基化类型及数目对blh分子量的影响
稳定转染细胞株上清液westernblotting检测结果如图1.9所示,m:marker;1:linker无糖基化位点;2:linker中1个n-糖基化位点;3:linker中两个n-糖基化位点;4:linker无糖基化位点;5:linker中1个o-糖基化位点;6:linker中2个o-糖基化位点。
由图1.9可知,随着n-糖基化和o-糖基化位点的增多,糖蛋白blh的分子量显著提高,且单个n-糖基化位点的糖链分子量比o-糖基化位点的分子量大。但是,表达量并不随分子量提高而增加。
1.4重组lh表达株的单克隆化
选取两个细胞株进行单克隆化,分别为linker中无糖基化和linker中携带两个n-糖基化的blh表达株。取一瓶长满的blh表达株细胞,细胞消化液处理后加蛋白表达培养基稀释至10个细胞/ml,100μl/孔接种于96孔板,显微镜下观察单克隆孔并标记,培养15d,取上清液20μl做westernblotting检测,实验结果见图1.10和1.11。
由图1.10可知,7号细胞株表达linker中无糖基化的blh,选取该细胞株放大培养,作为种子库。
由图1.11可知,8号和9号细胞株均表达linker中携带两个n-糖基化的blh,但是9号细胞株表达量较高,选取该细胞株放大培养,作为种子库。
实施例2、携带不同接头序列的重组lh相对生物活性的测定
将接头序列中携带0、1和2个n-糖基化位点和o-糖基化位点的重组blh,按照药典中黄体生成素生物测定法测定生物活性。
2.1实验材料的准备
2.1.1pcdna3.1(+)转染cho-k1细胞培养上清液和携带不同linker的blh转染细胞上清液(见表2.1)。
表2.1各blh蛋白样品性质
2.1.210×溶媒的配制
500mgbsa,4.5gnacl,加蒸馏水至40ml,氢氧化钠调节ph至7.2,定容50ml,震荡混匀。
2.1.3标准品注射液的配置:
实验当日,取尿促性素标准品,割开安瓿,用1×溶媒将标准品干粉洗出,按高、中、低剂量组(sh、sm和sl)制成3种浓度的标准品溶液各13ml,相邻两浓度之比值(r)为1:0.5。高浓度标准品溶液每lml中含12单位。标准品溶液置4℃贮存,可供4日使用。
供试品溶液的配置
根据westernblotting测定的各种blh的相对浓度,最低浓度样品加入1/9体积的10×溶媒,其他样品用10×溶媒和1×溶媒制成蛋白含量相等的blh,成为高剂量的供试品溶液(th)。按照相邻浓度的比值1:0.5的依次稀释成中剂量组和低剂量组溶液(tm和tl),4℃保存,配制量供4日使用。
2.1.4不同重组blh相对含量的测定
测定不同blh样品的相对浓度,将不同的样品调整至相同的浓度,测定各个样品对大鼠精囊增重的显著性。选取对大鼠精囊显著增重的blh,以尿促性素标准品为对照,测定blh的生物活性。
依次取6、5.5、5、4.5、4、3.5μl样品1a,20μl样品37,23μl样品24,11μl样品16和18μl样品56。分别加入1/4体积的5×loadingbuffer,补加1×loadingbuffer至30μl,混匀后煮沸5min,上样,12%聚丙烯酰胺凝胶电泳,电泳结束后将蛋白转移到pvdf膜上,封闭液封闭pvdf膜,将pvdf膜转移到1:400稀释的兔抗lhα亚基多克隆抗体中,4℃孵育过夜,tbst洗膜三次,放入1:5000稀释的山羊抗兔igg-hrp中,常温孵育2h,tbst洗膜三次,ecl显影。
不同blh的westernblotting检测结果如图2所示,1、2、3、4、5和6泳道依次为6、5.5、5、4.5、4、3.5μl样品1a;7和8为20μl样品37;9和10为23μl样品24;11和12为11μl样品16;13和14为18μl样品56。
分析每个泳道的灰度,减去背景灰度,然后以不同上样量的1a为x轴、灰度为y轴制作标准曲线。将其他样品的灰度代入标准曲线,得到相对于样品1a的量,并计算出相对样品1a的blh浓度,分析结果见表2.2。
表2.2各样品相对1a的浓度
由表2.2可知,样品1a的lh含量最高,样品24的lh含量最低。
2.1.5不同重组blh对大鼠精囊增重的影响
根据各样品相对于样品1a的浓度,将blh浓度最低的样品24加入1/9体积的10×溶媒,其他各样品试用10×溶媒和1×溶媒稀释至相同的浓度。各样品稀释方法见表2.3。
表2.3不同样品注射液的配制方法
实验当日,将动物编号、称重,根据体重将所有动物按照体重随机分到6个组中。将配好的供试品溶液在注射前取出,放置至室温。按照下表将不同的blh注射给每组大鼠。每日于相同时间分别给每鼠皮下注射一种供试品0.5ml,每日一次,连续注入四次,于最后一次注入24小时后,将动物处死,称重,解剖,摘出整个前列腺,由前叶和精囊交界处剥离出精囊,去除附着的组织,用滤纸吸去周围的液体,称取两个精囊的重量(天平精密度0.1mg),换算成每10g体重的精囊重,通过两独立样本非参数检验(mann-whitneyu检验),检验不同给药组相对于不给药组动物精囊重量差异的显著性。
表2.4不同blh对大鼠精囊增重的显著性影响
说明:显著水平0.05下否定无效假设的可靠程度为95%。设
h0:相对于对照组,实验组每10g体重精囊重无显著差异
h1:相对于对照组,实验组每10g体重精囊重有显著差异
由表2.4中两独立样本非参数检验mann-whitneyu检验结果可知:2、3和4组大鼠每10g体重精囊重相对于对照组(1组)有显著差异(sig≤0.05说明h0不成立,接受h1),第4组差异最显著。从以上数据分析发现,在blh上增加n-糖基化可以显著提高blh的生物活性,而blh增加o-糖基化位点并没有提高blh的生物活性。
2.2按照药典对重组lh的生物活性测定
选取重组lh样品37(接头序列中无糖基化位点)和1a(接头序列中有两个n-糖基化位点),按照中华人民共和国药典1217黄体生成素生物测定法测定重组lh的生物活性,按照药典通则1431中量反应平行线测定法对实验数据进行方差分析和可靠性测验并计算重组lh效价。
每日于相同的时间,按照表2.5的设计分别给每组大鼠皮下注入同样浓度的标准品溶液或样品溶液0.5ml,每日1次,连续注射4次,于最后1次注射24小时后,按药物注射顺序将动物处死,称重,解剖,摘出整个前列腺,由前叶和精囊交界处剥离出精囊,去除附着的组织,用滤纸吸去周围的液体,称重(天平精密度0.lmg)并换算成每10g体重的精囊重。
表2.5不同实验组动物的处理
2.2.1接头序列中无糖基化的重组lh(样品37)生物活性测算
将反应值(每10g体重精囊重)按标准品(s)和重组lh样品37的剂量分组列成方阵(见表2.6),按照药典中生物活性测定法的量反应平行测定法处理数据。本次实验命名为t1。
表2.6t1动物实验结果
∑y(k):各剂量组内求和;∑ym:各区组内求和
按照药典中量反应平行线测定法处理数据,计算供试品相对于标准品的方差及方差的可靠性,并计算供试品的效价,数据处理结果见表2.7,效价计算结果见表2.8。
表2.7t1方差分析及可靠性检测
由表2.7显著性检测实验结果可知,试品间差异性显著,回归非常显著,偏离平行、二次曲线和反向二次曲线均不显著,符合药典要求。
表2.8t1效价测定
样品37效价测定加过见表2.8,可信限率24.54%符合药典要求,本次实验结果可信。
2.2.2接头序列携带两个n-糖基化的重组lh(样品1a)生物活性的测算
将反应值(每10g体重精囊重)按标准品(s)和重组lh样品1a的剂量分组列成方阵(见表2.9)。
表2.9t2动物实验结果
∑y(k):各剂量组内求和;∑ym:各区组内求和
按照药典中量反应平行线测定法处理数据,计算供试品相对于标准品的方差及方差的可靠性,并计算供试品的效价,数据处理结果见表2.10,效价计算结果见表2.11。
表2.10t2方差分析及可靠性检测
由表2.10显著性检测实验结果可知,试品间差异性不显著,回归非常显著,偏离平行、二次曲线和反向二次曲线均不显著,符合药典要求。
表2.11t2效价测定
样品1a效价测定加过见表2.11,可信限率27.44%符合药典要求,本次实验结果可信。
2.3单次注射重组lh的生物活性测定
将出生19-21日体重40-50g的雄性sd大鼠,按照体重随机分为10组,每组6只。将接头序列中无糖基化位点的重组lh(样品37)作为供试品1(t1)、接头序列中携带两个n-糖基化位点的重组lh(样品1a)作为供试品2(t2)和标准品(s)按照组间剂量比1:0.6用样品稀释液配制成高剂量组(h)、中剂量组(m)和低剂量组(l)。将标准品及供试品高中低剂量组溶液按照表2.12的设计方案对每组大鼠注射0.5ml。样品37和样品1a只在第一天注射一次,标准品每天注射一次,连续注射4天,于最后一次注入24小时后,将动物处死,称重,解剖,摘出整个前列腺,由前叶和精囊交界处剥离出精囊,去除附着的组织,用滤纸吸去周围的液体,称取两个精囊的重量(天平精密度0.1mg)。
表2.12不同组大鼠的给药情况
将精囊重换算成每10g体重的精囊重,将反应值(每10g体重精囊重)按标准品(s)、供试品1(t1,样品37)和供试品2(t2,样品1a)分组列成方阵(见表2.4)。通过两独立样本非参数检验u检验,检验不同给药组相对于不给药组动物精囊重量差异的显著性。
表2.13不同给药组动物精囊增重差异显著性分析
说明:显著水平0.05下否定无效假设的可靠程度为95%。设
h0:相对于对照组,实验组每10g体重精囊重无显著差异
h1:相对于对照组,实验组每10g体重精囊重有显著差异
由表2.13可知,给动物单次注射相同剂量的样品37(接头序列中无糖基化位点)和样品1a(接头序列中携带2个n-糖基化位点)对大鼠增囊增重的药效不同。单次注射样品1a能够显著提高大鼠的精囊重,而单次注射相同剂量的样品37对大鼠的精囊重量无显著性影响。
按照药典中量反应平行线测定法处理数据,计算供试品相对于标准品的方差及方差的可靠性,并计算供试品的效价,数据处理结果见表2.14,效价计算结果见表2.15。没有表2.15
表2.14单次注射1a的方差分析及可靠性检测
由表2.10显著性检测实验结果可知,试品间差异性显著,回归非常显著,偏离平行、二次曲线和反向二次曲线均不显著,符合药典要求。
根据2.2.和2.3的生物活性测定,证明接头序列中不含糖基化位点的lhβ-接头序列-lhα的表达物为短效lh类似物;接头序列中携带2个n-糖基化位点的lhβ-接头序列-lhα的表达物为长效lh类似物。
虽然以上描述了本发明的具体实施方式,但是熟悉本技术领域的技术人员应当理解,本发明所描述的具体实施例只是说明性的,而不是用于对本发明的范围的限定,熟悉本领域的技术人员在依照本发明的精神所作的等效的修饰以及变化,都应当涵盖在本发明的权利要求所保护的范围内。
核苷酸和/或氨基酸序列表
<110>华侨大学;太平洋贯连有限公司
<120>一种促黄体激素类似物及其制备方法
<160>20
<210>seqid1
<211>15
<212>prt
<213>人工合成
<400>
glyserglyprovalproglyproserproglyprovalproglu
115
<210>seqid2
<211>9
<212>prt
<213>人工合成
<400>
glyserhishishishishishisglu
19
<210>seqid3
<211>12
<212>prt
<213>人工合成
<400>
glyseralathrglyserglyserasnalathrglu
112
<210>seqid4
<211>12
<212>prt
<213>人工合成
<400>
glyserasnalathrhishishishishishisglu
112
<210>seqid5
<211>15
<212>prt
<213>人工合成
<400>
glyserasnthrserasnglyserthrasnasnthrserasnglu
115
<210>seqid6
<211>14
<212>prt
<213>人工合成
<400>
glyserprothrproglyprohishishishishishisglu
114
<210>seqid7
<211>13
<212>prt
<213>人工合成
<400>
glyserprothrproglyproprothrproglyproglu
113
<210>seqid8
<211>17
<212>prt
<213>人工合成
<400>
glyserprothrproserprothrproserprothrproserpro
115
thrglu
17
<210>seqid9
<211>19
<212>prt
<213>人工合成
<400>
glyserprothrproglyprohishishishishishisprothr
115
proglyproglu
19
<210>seqid10
<211>19
<212>prt
<213>人工合成
<400>
glyserasnhisthrglyserhishishishishishisglyser
115
asnhisthrglu
1619
<210>seqid11
<211>252
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserglyprovalproglyproser
140145150
proglyprovalproglupheproaspglygluphethrmetgln
155160165
glycysproglucyslysleulysgluasnlystyrpheserlys
170175180
proaspalaproiletyrglncysmetglycyscyspheserarg
185190195
alatyrprothrproalaargserlyslysthrmetleuvalpro
200205210
lysasnilethrserglualathrcyscysvalalalysalaphe
215220225
thrlysalathrvalmetglyasnvalargvalgluasnhisthr
230235240
glucyshiscysserthrcystyrtyrhislysser*
245250252
<210>seqid12
<211>246
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserhishishishishishisglu
140145150
pheproaspglygluphethrmetglnglycysproglucyslys
155160165
leulysgluasnlystyrpheserlysproaspalaproiletyr
170175180
glncysmetglycyscyspheserargalatyrprothrproala
185190195
argserlyslysthrmetleuvalprolysasnilethrserglu
200205210
alathrcyscysvalalalysalaphethrlysalathrvalmet
215220225
glyasnvalargvalgluasnhisthrglucyshiscysserthr
230235240
cystyrtyrhislysser*
245246
<210>seqid13
<211>250
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserasnalathrglyserglyser
140145150
asnalathrglupheproaspglygluphethrmetglnglycys
155160165
proglucyslysleulysgluasnlystyrpheserlysproasp
170175180
alaproiletyrglncysmetglycyscyspheserargalatyr
185190195
prothrproalaargserlyslysthrmetleuvalprolysasn
200205210
ilethrserglualathrcyscysvalalalysalaphethrlys
215220225
alathrvalmetglyasnvalargvalgluasnhisthrglucys
230235240
hiscysserthrcystyrtyrhislysser*
245250
<210>seqid14
<211>249
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserasnalathrhishishishis
140145150
hishisglupheproaspglygluphethrmetglnglycyspro
155160165
glucyslysleulysgluasnlystyrpheserlysproaspala
170175180
proiletyrglncysmetglycyscyspheserargalatyrpro
185190195
thrproalaargserlyslysthrmetleuvalprolysasnile
200205210
thrserglualathrcyscysvalalalysalaphethrlysala
215220225
thrvalmetglyasnvalargvalgluasnhisthrglucyshis
230235240
cysserthrcystyrtyrhislysser*
245249
<210>seqid15
<211>252
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserasnthrserasnglyserthr
140145150
asnasnthrserasnglupheproaspglygluphethrmetgln
155160165
glycysproglucyslysleulysgluasnlystyrpheserlys
170175180
proaspalaproiletyrglncysmetglycyscyspheserarg
185190195
alatyrprothrproalaargserlyslysthrmetleuvalpro
200205210
lysasnilethrserglualathrcyscysvalalalysalaphe
215220225
thrlysalathrvalmetglyasnvalargvalgluasnhisthr
230235240
glucyshiscysserthrcystyrtyrhislysser*
245250252
<210>seqid16
<211>251
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserprothrproglyprohishis
140145150
hishishishisglupheproaspglygluphethrmetglngly
155160165
cysproglucyslysleulysgluasnlystyrpheserlyspro
170175180
aspalaproiletyrglncysmetglycyscyspheserargala
185190195
tyrprothrproalaargserlyslysthrmetleuvalprolys
200205210
asnilethrserglualathrcyscysvalalalysalaphethr
215220225
lysalathrvalmetglyasnvalargvalgluasnhisthrglu
230235240
cyshiscysserthrcystyrtyrhislysser*
245250251
<210>seqid17
<211>250
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserprothrproglyproprothr
140145150
proglyproglupheproaspglygluphethrmetglnglycys
155160165
proglucyslysleulysgluasnlystyrpheserlysproasp
170175180
alaproiletyrglncysmetglycyscyspheserargalatyr
185190195
prothrproalaargserlyslysthrmetleuvalprolysasn
200205210
ilethrserglualathrcyscysvalalalysalaphethrlys
215220225
alathrvalmetglyasnvalargvalgluasnhisthrglucys
230235240
hiscysserthrcystyrtyrhislysser*
245250
<210>seqid18
<211>254
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserprothrproserprothrpro
140145150
serprothrproserprothrglupheproaspglygluphethr
155160165
metglnglycysproglucyslysleulysgluasnlystyrphe
170175180
serlysproaspalaproiletyrglncysmetglycyscysphe
185190195
serargalatyrprothrproalaargserlyslysthrmetleu
200205210
valprolysasnilethrserglualathrcyscysvalalalys
215220225
alaphethrlysalathrvalmetglyasnvalargvalgluasn
230235240
histhrglucyshiscysserthrcystyrtyrhislysser*
245250254
<210>seqid19
<211>256
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserprothrproglyprohishis
140145150
hishishishisprothrproglyproglupheproaspglyglu
155160165
phethrmetglnglycysproglucyslysleulysgluasnlys
170175180
tyrpheserlysproaspalaproiletyrglncysmetglycys
185190195
cyspheserargalatyrprothrproalaargserlyslysthr
200205210
metleuvalprolysasnilethrserglualathrcyscysval
215220225
alalysalaphethrlysalathrvalmetglyasnvalargval
230235240
gluasnhisthrglucyshiscysserthrcystyrtyrhislys
245250255
ser*
256
<210>seqid20
<211>256
<212>prt
<213>人工合成
<400>
metglumetpheglnglyleuleuleutrpleuleuleuglyval
151015
alaglyvaltrpalaserargglyproleuargproleucysgln
202530
proileasnalathrleualaalaglulysglualacysproval
354045
cysilethrphethrthrserilecysalaglytyrcysproser
505560
metlysargvalleuprovalileleuproprometproglnarg
657075
valcysthrtyrhisgluleurrophealaservalrroleupro
808590
glycysproproglyvalaspprometvalserpheprovalala
95100105
leusercyshiscysglyprocysargleuserserthraspcys
110115120
glyglyproargthrglnproleualacysasphisproproleu
125130135
proaspileleupheleuglyserasnhisthrglyserhishis
140145150
hishishishisglyserasnhisthrglupheproaspglyglu
155160165
phethrmetglnglycysproglucyslysleulysgluasnlys
170175180
tyrpheserlysproaspalaproiletyrglncysmetglycys
185190195
cyspheserargalatyrprothrproalaargserlyslysthr
200205210
metleuvalprolysasnilethrserglualathrcyscysval
215220225
alalysalaphethrlysalathrvalmetglyasnvalargval
230235240
gluasnhisthrglucyshiscysserthrcystyrtyrhislys
245250255
ser*
256
- 还没有人留言评论。精彩留言会获得点赞!