HBs-α317ScFv重组蛋白、其编码序列、表达载体及应用的制作方法
本发明涉及免疫技术领域,具体涉及一种hbs-α317scfv重组蛋白、其编码序列、表达载体及应用。
背景技术:
乙型肝炎病毒(hepatitisbvirus,hbv)是引发慢性乙型肝炎的“罪魁祸首”,易导致肝硬化,甚至于肝癌。乙肝病毒一般通过血液、性接触和母婴三种途径传播,其中血液传播是最主要的传播途径。
虽然预防性乙肝疫苗、抗病毒治疗药物已经上市,但是全球每年仍然有65万人死于hbv感染所致的肝衰竭、肝硬化和肝癌。而作为乙肝大国,中国约有9,300万慢性hbv感染者,其中慢乙肝患者约2,000万例。在我国肝硬化和肝癌患者中,由hbv感染引起的比例分别高达60%和80%以上。这主要与疫苗覆盖率、治疗手段有限有关。目前商品化的乙肝重组疫苗是pres1、pres2及s蛋白的混合物,在预防hbv感染方面效果显著。但仍有5%左右的健康人对疫苗不应答,这部分人仍是乙肝易感人群。针对慢乙肝患者,现有的治疗药物主要有干扰素(ifn-α)和口服核苷类似物(nas)两类,虽然能够有效抑制病毒,但不能彻底治愈,存在长期用药、病毒耐药性、易复发等问题。因此,深入研究、积极探寻行之有效的治疗方式,是当前急需解决的科学及社会问题。
hbv病毒感染包括病毒入侵、cccdna形成、病毒dna转录、衣壳组装、病毒包装及排出等过程,这些环节已经被用于抗病毒策略的开发并展现了一定的疗效,但也存在局限性(c.shih,s.f.chou,c.c.yang,j.y.huang,g.choijilsuren,r.s.jhou,controlanderadicationstrategiesofhepatitisbvirus,trendsinmicrobiology,24(2016)739-749)。
此外,机体免疫系统在抵抗hbv感染过程中发挥重要的作用。多数感染者可通过机体的天然免疫和适应性免疫的急性免疫反应将病毒及时清除,并获得抵抗hbv再次感染的能力(b.rehermann,m.nascimbeni,immunologyofhepatitisbvirusandhepatitiscvirusinfection,natrevimmunol,5(2005)215-229)。而大约有5%的感染者由于机体免疫系统不能将进入机体内的hbv病毒完全清除从而造成乙肝病毒在体内的慢性持续感染,形成免疫耐受(immunologictolerance),进而发展为慢性乙型肝炎患者(f.v.chisari,c.ferrari,hepatitisbvirusimmunopathogenesis,annurevimmunol,13(1995)29-60.)。因此,旨在增强免疫功能、打破免疫耐受的治疗性疫苗一直被认为是最有可能治愈慢乙肝的方法。科学家希望通过注射治疗性疫苗特异性激活与hbv不应答的t细胞。但是相关临床ⅰ期试验结果却不佳,无论是病毒e抗原、血清转化还是病毒dna指标变化都不显著。近期,有研究团队开发出依赖于乙肝表面抗原-乙型肝炎免疫球蛋白复合体和明矾佐剂的疫苗,并通过了临床ⅲ期试验,但是仍然需要后续试验以确定其有效性。虽然,通过拉米夫定结合各类hbvorfs和免疫调节剂il-12的dna疫苗在治疗白种人hbv感染患者表现出良好的效果,但是,结合疫苗和阿德福韦(adefovir)治疗韩国患者却未能出现预期效果。其他如abx203(临床ⅱ/ⅲ期,主要成分hbs和hbc)、tg1050(临床ⅰ期,编码hbvl抗原及部分c抗原的假病毒)等尚在研究过程中,有效性和安全性有待考究。因此,目前尚没有真正意义上的治疗性疫苗。
浆细胞样树突状细胞(plasmacytoiddendriticcells,pdcs),是一类特殊的树突状细胞,细胞形态与浆细胞类似,约占人外周血单核细胞的0.2%-0.8%。尽管所占比例不高,但在机体自身免疫稳态维持、抗病毒免疫调节等方面不可或缺。研究发现,病毒感染后pdc减少、功能异常是免疫耐受的机制之一(z.zhang,f.s.wang,plasmacytoiddendriticcellsactasthemostcompetentcelltypeinlinkingantiviralinnateandadaptiveimmuneresponses,cellmolimmunol,2(2005)411-417;j.martinet,t.dufeu-duchesne,j.brudercosta,s.larrat,a.marlu,v.leroy,j.plumas,c.aspord,alteredfunctionsofplasmacytoiddendriticcellsandreducedcytolyticactivityofnaturalkillercellsinpatientswithchronichbvinfection,gastroenterology,143(2012)1586-1596e1588.)。isogawam等研究发现,cpgodna和b可以通过tlr9受体刺激pdc产生大量i型干扰素,抑制hbv复制(m.isogawa,m.d.robek,y.furuichi,f.v.chisari,toll-likereceptorsignalinginhibitshepatitisbvirusreplicationinvivo,jvirol,79(2005)7269-7272.)。临床研究也发现,针对儿童chb患者的ifn-α治疗效果与血循环中的pdcs功能恢复密切相关(z.zhang,h.zhang,d.chen,j.yao,j.fu,l.jin,f.s.wang,responsetointerferon-alphatreatmentcorrelateswithrecoveryofbloodplasmacytoiddendriticcellsinchildrenwithchronichepatitisb,jhepatol,47(2007)751-759.)。因此,靶向pdcs的免疫疗法代表了hbv治疗的一个新方向。
pdcs是最有潜力的i型ifn(ifn-a/β)产生细胞,在抗病毒固有免疫阶段,其分泌ifn-a/β的能力是其他细胞的1000倍(liuyj.ipc:professionaltype1interferon-producingcellsandplasmacytoiddendriticcellprecursors.annurevimmunol,23(2005)275-306.)。pdcs通过tlr7/9受体识别病毒核酸后迅速活化,产生大量的i型干扰素。后者在早期抗病毒免疫反应过程中发挥关键作用。正因为如此,通过cpgodn激活pdcs可以抑制hbv复制。
pdcs除了在固有免疫阶段通过i型干扰素发挥抗病毒作用,还可以作为专职抗原递呈细胞,激活适应性免疫反应。但由于其对可溶性抗原的摄取、递呈能力较差,提供的活化信号往往不足以激活t细胞导致t细胞无能、调节性t细胞产生,最终发展成免疫耐受(j.hong,z.j.gong,humanplasmacytoiddendriticcellsfrompatientswithchronichepatitisbvirusinfectioninducethegenerationofahigherproportionofcd4(+)andcd25(+)regulatorytcellscomparedwithhealthypatients,hepatologyresearch:theofficialjournalofthejapansocietyofhepatology,38(2008)362-373.)。尽管如此,最近的研究发现,通过pdcs表面的标记分子将抗原靶向传递可以有效促进其抗原递呈效率,诱发高强度的特异性体液及细胞免疫应答(j.loschko,a.schlitzer,d.dudziak,i.drexler,n.sandholzer,c.bourquin,w.reindl,a.b.krug,antigendeliverytoplasmacytoiddendriticcellsviabst2inducesprotectivetcell-mediatedimmunity,jimmunol,186(2011)6718-6725;j.m.moffat,e.segura,g.khoury,i.caminschi,p.u.cameron,s.r.lewin,j.a.villadangos,j.d.mintern,targetingantigentobonemarrowstromalcell-2expressedbyconventionalandplasmacytoiddendriticcellselicitsefficientantigenpresentation,europeanjournalofimmunology,43(2013)595-605.)。因此,通过抗体靶向技术使pdcs高效递呈病毒抗原,可能是打破chb患者免疫耐受状态、清除hbv的有效手段。
pdcs表面的cd317、dec205、siglec-h、bdca-2、fcγriia以及dcir等分子已被证实可以作为抗原输送的靶点(a.l.blasius,m.colonna,samplingandsignalinginplasmacytoiddendriticcells:thepotentialrolesofsiglec-h,trendsimmunol,27(2006)255-260;a.dzionek,y.inagaki,k.okawa,j.nagafune,j.rock,y.sohma,g.winkels,m.zysk,y.yamaguchi,j.schmitz,plasmacytoiddendriticcells:fromspecificsurfacemarkerstospecificcellularfunctions,humimmunol,63(2002)1133-1148.)。cd317高表达于人、小鼠的pdcs细胞上,病毒感染产生的ifn能够显著上调cd317的表达水平。jessicam.moffat等则通过系统研究发现,与dec205、siglec-h相比,cd317介导抗原递呈的效率更高,可以诱导更强的特异性免疫应答(j.m.moffat,e.segura,g.khoury,i.caminschi,p.u.cameron,s.r.lewin,j.a.villadangos,j.d.mintern,targetingantigentobonemarrowstromalcell-2expressedbyconventionalandplasmacytoiddendriticcellselicitsefficientantigenpresentation,europeanjournalofimmunology,43(2013)595-605.)。因此,cd317作为抗原靶向递送靶点更具优势:1)表达水平更高,且能被ifn进一步诱导上调,形成良性反馈回路;2)抗原递呈效率更高,可以激活更强的特异性免疫应答。尽管目前尚没有靶向cd317递送疫苗用于治疗hbv的相关报道,但是从已知的线索可以推测,该策略极可能通过增强pdcs抗原递呈效率,激活更强的抗病毒免疫应答,打破chb患者免疫耐受状态,抑制甚至清除hbv。
现有的治疗药物主要有干扰素(ifn-α)和口服核苷类似物(nas)两类,虽然能够有效抑制病毒,但不能彻底治愈,存在长期用药、病毒耐药性、易复发等问题。而在研的蛋白类治疗性疫苗,如abx203(临床ⅱ/ⅲ期,主要成分hbs和hbc),都是不具备靶向能力的可溶性抗原,很难被pdcs细胞摄取、加工和递呈,因此,无法打破chb患者因pdcs细胞功能缺失导致的免疫耐受状态。
技术实现要素:
本发明提供一种能够预防hbv感染hbs-α317scfv重组蛋白、其编码序列、表达载体及应用。
根据第一方面,一种实施例中提供一种hbs-α317scfv重组蛋白,其包括如seqidno:1所示的核苷酸序列所编码的氨基酸序列部分,以及如seqidno:3所示的核苷酸序列所编码的氨基酸序列部分。
进一步地,其编码序列还包括如seqidno:2所示的辅助序列,其位于seqidno:1所示的核苷酸序列的5’端。
进一步地,其编码序列还包括如seqidno:4所示的核苷酸序列,其编码的氨基酸序列连接seqidno:3所示的核苷酸序列所编码的氨基酸序列的重链和轻链;以及如seqidno:5所示的核苷酸序列,其位于上述轻链编码序列的3’端。
进一步地,其编码序列还包括如seqidno:6所示的间隔序列,其位于seqidno:1所示的核苷酸序列与seqidno:3所示的核苷酸序列之间。
进一步地,其包括如seqidno:7所示的核苷酸序列所编码的氨基酸序列。
根据第二方面,一种实施例中提供一种hbs-α317scfv重组蛋白的核苷酸编码序列,其包括如seqidno:1所示的核苷酸序列,以及如seqidno:3所示的核苷酸序列。
进一步地,还包括如seqidno:2所示的辅助序列,其位于seqidno:1所示的核苷酸序列的5’端。
进一步地,还包括如seqidno:4所示的核苷酸序列,其编码的氨基酸序列连接seqidno:3所示的核苷酸序列所编码的氨基酸序列的重链和轻链;以及如seqidno:5所示的核苷酸序列,其位于上述轻链编码序列的3’端。
进一步地,还包括如seqidno:6所示的间隔序列,其位于seqidno:1所示的核苷酸序列与seqidno:3所示的核苷酸序列之间。
进一步地,其包括如seqidno:7所示的核苷酸序列,或者与seqidno:7所示的核苷酸序列编码相同氨基酸序列的核苷酸序列。
根据第三方面,一种实施例中提供一种hbs-α317scfv重组蛋白的表达载体,其包括载体骨架,以及如seqidno:7所示的核苷酸序列或者与seqidno:7所示的核苷酸序列编码相同氨基酸序列的核苷酸序列。
进一步地,上述载体骨架是真核表达载体,优选pcdna3.1(+)质粒。
根据第四方面,一种实施例中提供一种如第一方面的hbs-α317scfv重组蛋白、如第二方面的核苷酸编码序列或如第三方面的表达载体在制备预防和/或治疗hbv感染相关疾病的药物中的用途。
本发明的hbs-α317scfv重组蛋白能够预防hbv感染,由于抗原递呈效率高,可以降低疫苗使用量,降低成本。作为治疗性疫苗,相较于在研的可溶性非靶向病毒抗原,激活免疫应答的能力更强。
附图说明
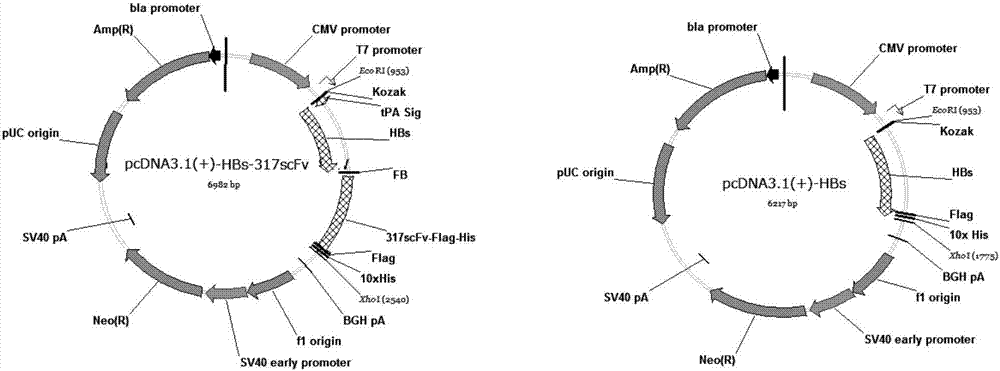
图1是本发明实施例的hbs-α317scfv和hbs重组蛋白真核表达质粒图谱。
图2是本发明实施例的hbs-α317scfv、hbs重组蛋白表达验证结果图;转染后72h收集细胞上清,westernblot检测结果显示,重组蛋白表达质粒能够在真核细胞中表达、分泌。
图3是本发明实施例的小鼠血清表面抗原(hbs)及表面抗体(hbsabs)表达水平结果图;第3次免疫后3天采血,elisa检测血清中hbs水平,结果显示hbs、hbs-α317scfv重组蛋白表达质粒在小鼠体内表达水平没有明显差异;第3次免疫后7天采血,elisa检测血清中表面抗体水平,结果显示hbs-α317scfv产生更强的体液免疫;nhbs=3,nhbs-α317scfv=5。
图4是本发明实施例的免疫小鼠脾细胞体外hbs刺激后干扰素分泌情况;小鼠脾细胞再次用hbs蛋白刺激48h,elisa检测上清中ifn-γ水平,结果显示hbs-α317scfv小鼠脾细胞能产生更多的ifn-γ;nhbs=3,nhbs-α317scfv=5。
图5是本发明实施例的免疫小鼠脾细胞体外hbs刺激后分裂能力检测结果;小鼠脾细胞用hbs蛋白再次刺激72h,facs检测脾细胞分裂能力,结果显示hbs-α317scfv小鼠脾细胞再次接受抗原刺激能更快速活化、分裂能力更强;nhbs=3,nhbs-α317scfv=5。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。在以下的实施方式中,很多细节描述是为了使得本发明能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他元件、材料、方法所替代。在某些情况下,本发明相关的一些操作并没有在说明书中显示或者描述,这是为了避免本发明的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,他们根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。
本发明涉及的hbs-α317scfv重组蛋白,通过pdcs细胞表面的cd317靶向输送病毒抗原,提高pdcs抗原摄取、加工和递呈能力,激活更强的抗病毒免疫应答。一方面可以作为乙肝增强型预防疫苗,使那些对现有乙肝疫苗不应答的健康人获得抗病毒免疫力;另一方面可以作为chb的治疗性疫苗,抑制甚至清除患者体内hbv。
需要说明的是,本发明中hbs-α317scfv重组蛋白的编码序列并不限于seqidno:1至seqidno:7中部分或者全部序列,而是包括任何与上述序列编码相同氨基酸序列的核苷酸序列。类似地,hbs-α317scfv重组蛋白的核苷酸编码序列也不限于seqidno:1至seqidno:7中部分或者全部序列,而是包括任何与上述序列编码相同氨基酸序列的核苷酸序列。
以下通过实施例详细说明本发明的技术方案,应当理解,实施例仅是示例性的,不能理解为对本发明保护范围的限制。
实施例1:hbs-α317scfv重组蛋白真核表达载体构建,其质粒图谱结构如图1所示
(1)hbs编码基因来源于sh1203-c2毒株基因组序列(jx661494),从1550到2227共计678个碱基(seqidno:1)。通过invitrogen公司合成,5’端加入一段辅助序列(seqidno:2)以方便载体改造、蛋白分泌表达,该序列包含ecor1酶切位点、kozak序列、信号肽(humantissue-typeplasminogenactivator,tpa,nm_000930,258-323)等元素。
其中,seqidno:1序列如下:
atggagaacacaacatcaggattcctaggacccctgctcgtgttacaggcggggtttttcttgttgacaagaatcctcacaataccacagagtctagactcgtggtggacttctctcaattttctagggggagcacccacgtgtcctggccaaaattcgcagtccccaacctccaatcactcaccaacctcttgtcctccaatttgtcctggctatcgttggatgtgtctgcggcgttttatcatattcctcttcatcctgctgctatgcctcatcttcttgttggttcttctggactaccaaggtatgttgcccgtttgtcctctacttccaggaacatcaactaccagcacgggaccatgcaagacctgcacgattcctgctcaaggaacctctatgtttccctcttgttgctgtacaaaaccttcggacggaaactgcacttgtattcccatcccatcatcctgggctttcgcaagattcctatgggagtgggcctcagtccgtttctcctggctcagtttactagtgccatttgttcagtggttcgtagggctttcccccactgtttggctttcagttatatggatgatgtggtattgggggccaagtctgtacaacatcttgagtccctttttacctctattaccaattttcttttgtctttgggtatacatt。
seqidno:2序列如下:
5′-cggaattcgccaccatggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtttcgcccagctccttcaccatcaaggccaac-3′。
(2)α317scfv序列(seqidno:3)来源于发明人构建的分泌抗人、鼠cd317单克隆抗体的杂交瘤细胞,通过pcr扩增获得重、轻链并测序验证。重、轻链之间以(g4s)3片段(seqidno:4)连接,轻链末端添加flag、10×his标签及xho1酶切位点(seqidno:5)。各段序列采用重叠pcr连接,并进行测序验证。
其中,seqidno:3序列如下:
gaggtgcagctggtggagtctgggggaggcttagtgcagcctggagggtccctgaaactctcctgtgcagcctctggattcactttcagtagttatggcatgtcttgggttcgccagactccagacaagaggctggagtgggtcgcaaccattaatagtaatggtgctaacacctattatccagacagtgtgaagggccgattcaccatctccagagacaatgccaagaacaccctgtacctgcaaatgagcagtctgaagtctgaggacacagccatgtattactgtgcaaggatctatgatgcttactcctcctggtttacttactggggtgaaggaacttttgtcacagtcaatctcggtggcggtggctcgggcggtggtgggtcgggtggcggcggatctgatattgttctgacacagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagtgcaagtcaggggattaaaaattatttaaactggtatcagcagaaaccagatggaactgttaaactcctgatctattacacatcaagtttacactcaggagtcccatcaaggttcagtggcagtgggtctgggacagattattctctcaccatcagcaacctggaacctgaagatattgccacttactattgtcagcagtatagtaagcttccgtacacgttcggcgcaggcacaaaattggaaatcaatgattacaaggatgacgacgataaggcgcaccatcaccaccatcatcaccaccatcactgactcgag
seqidno:4序列如下:
ggtggcggtggctcgggcggtggtgggtcgggtggcggcggatct
seqidno:5序列如下:
gattacaaggatgacgacgataaggcgcaccatcaccaccatcatcaccaccatcactgactcgag
(3)hbs与α317scfv序列之间以一个间隔序列(seqidno:6)隔开,片段直接连接采用重叠pcr的方法进行,最终测序验证。
其中,seqidno:6序列如下:
gccaagaaactgaacgacgctcaggcgccgaagagtgat
(4)最终获得hbs-α317scfv编码序列(seqidno:7),并通过ecor1×xho1双酶切后,插入pcdna3.1(+)质粒,完成真核表达载体构建。
其中,seqidno:7序列如下:
gaattcgccaccatggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtttcgcccagctccatggagaacacaacatcaggattcctaggacccctgctcgtgttacaggcggggtttttcttgttgacaagaatcctcacaataccacagagtctagactcgtggtggacttctctcaattttctagggggagcacccacgtgtcctggccaaaattcgcagtccccaacctccaatcactcaccaacctcttgtcctccaatttgtcctggctatcgttggatgtgtctgcggcgttttatcatattcctcttcatcctgctgctatgcctcatcttcttgttggttcttctggactaccaaggtatgttgcccgtttgtcctctacttccaggaacatcaactaccagcacgggaccatgcaagacctgcacgattcctgctcaaggaacctctatgtttccctcttgttgctgtacaaaaccttcggacggaaactgcacttgtattcccatcccatcatcctgggctttcgcaagattcctatgggagtgggcctcagtccgtttctcctggctcagtttactagtgccatttgttcagtggttcgtagggctttcccccactgtttggctttcagttatatggatgatgtggtattgggggccaagtctgtacaacatcttgagtccctttttacctctattaccaattttcttttgtctttgggtatacattgccaagaaactgaacgacgctcaggcgccgaagagtgatgaggtgcagctggtggagtctgggggaggcttagtgcagcctggagggtccctgaaactctcctgtgcagcctctggattcactttcagtagttatggcatgtcttgggttcgccagactccagacaagaggctggagtgggtcgcaaccattaatagtaatggtgctaacacctattatccagacagtgtgaagggccgattcaccatctccagagacaatgccaagaacaccctgtacctgcaaatgagcagtctgaagtctgaggacacagccatgtattactgtgcaaggatctatgatgcttactcctcctggtttacttactggggtgaaggaacttttgtcacagtcaatctcggtggcggtggctcgggcggtggtgggtcgggtggcggcggatctgatattgttctgacacagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagtgcaagtcaggggattaaaaattatttaaactggtatcagcagaaaccagatggaactgttaaactcctgatctattacacatcaagtttacactcaggagtcccatcaaggttcagtggcagtgggtctgggacagattattctctcaccatcagcaacctggaacctgaagatattgccacttactattgtcagcagtatagtaagcttccgtacacgttcggcgcaggcacaaaattggaaatcaatgattacaaggatgacgacgataaggcgcaccatcaccaccatcatcaccaccatcactgactcgag
对比例1:hbs重组蛋白真核表达载体构建,其质粒图谱结构如图1所示
(1)hbs编码基因来源于sh1203-c2毒株基因组序列(jx661494),从1550到2227共计678个碱基(seqidno:1)。通过invitrogen公司合成,5’端加入一段辅助序列(seqidno:2)方便载体改造、蛋白分泌表达,序列包含ecor1酶切位点、kozak序列、信号肽(humantissue-typeplasminogenactivator,tpa,nm_000930,258-323)等元素。
(2)末端添加flag、10×his标签及xhoi酶切位点(seqidno:5),各段序列采用重叠pcr连接,并进行测序验证。
(3)最终获得hbs重组蛋白编码序列(seqidno:8),并通过ecor1×xho1双酶切后,插入pcdna3.1(+)质粒,完成真核表达载体构建。
其中,seqidno:8序列如下:
gaattcgccaccatggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtttcgcccagctccatggagaacacaacatcaggattcctaggacccctgctcgtgttacaggcggggtttttcttgttgacaagaatcctcacaataccacagagtctagactcgtggtggacttctctcaattttctagggggagcacccacgtgtcctggccaaaattcgcagtccccaacctccaatcactcaccaacctcttgtcctccaatttgtcctggctatcgttggatgtgtctgcggcgttttatcatattcctcttcatcctgctgctatgcctcatcttcttgttggttcttctggactaccaaggtatgttgcccgtttgtcctctacttccaggaacatcaactaccagcacgggaccatgcaagacctgcacgattcctgctcaaggaacctctatgtttccctcttgttgctgtacaaaaccttcggacggaaactgcacttgtattcccatcccatcatcctgggctttcgcaagattcctatgggagtgggcctcagtccgtttctcctggctcagtttactagtgccatttgttcagtggttcgtagggctttcccccactgtttggctttcagttatatggatgatgtggtattgggggccaagtctgtacaacatcttgagtccctttttacctctattaccaattttcttttgtctttgggtatacattgattacaaggatgacgacgataaggcgcaccatcaccaccatcatcaccaccatcactgactcgag
效果实验例1:重组蛋白表达验证
(1)pei法将pcdna3.1(+)-hbs-α317scfv、pcdna3.1(+)-hbs表达载体及pcdna3.1(+)空载体分别转入hek293f细胞,具体实施方案如下:
(a)将30mlhek293f细胞悬液(1×106细胞/ml)接种于125ml细胞摇瓶中,37℃,8%co2,120rpm振荡培养过夜;
(b)pei转染:取30μg质粒以及30μlpei25000(2mg/ml)加入到3mlpbs(ph7.4)中,轻轻混匀后室温静置15min,然后逐滴加入到细胞中,边加边晃动培养瓶;
(2)培养细胞72h后收集细胞培养上清(500g×5min后吸取上清到新的离心管,然后4℃,10000g×5min去除碎片);
(3)取200μl上清加入蛋白loadingbuffer至1×,100℃变性5min;通过westenblot对hbs-α317scfv及hbs重组蛋白的表达情况进行检测,结果如图2所示。
为说明hbs-α317scfv重组蛋白在hbv预防、治疗的效果,进行如下实验:
(4)体内电转hbs-α317scfv重组蛋白表达质粒免疫小鼠模型构建:
(a)用无菌生理盐水将pcdna3.1(+)-hbs-α317scfv、pcdna3.1(+)-hbs稀释至1μg/μl,备用;
(b)取6-8周龄spf级balb/c雄性小鼠,随机分成2组;
(c)异氟烷进行吸入性麻醉,往小鼠后腿内侧股大肌注射pcdna3.1(+)-hbs-α317scfv,或pcdna3.1(+)-hbs质粒,100μl/只;
(d)将电转移(nepa21electroporator)电极插入注射质粒部位的两端,形成电流通路,开启电转移(电压80v,脉冲时长50ms,间隔400ms,脉冲次数8,衰减率10%);
(e)电转结束后,将小鼠放回笼中,注意保暖,待小鼠醒转后,送回动物房继续饲养观察;
(f)每隔2周免疫一次,共免疫三次;
(g)第3次免疫后第3天,脸颊采血检测血清hbs水平;
(h)第3次免疫后第7天,处死小鼠,取血清检测血清中抗hbs抗体水平;取脾脏,分离脾细胞后进行细胞分裂、γ干扰素分泌能力检测。
(5)elisa检测小鼠血清hbs、抗hbs抗体水平检测:
分别采用商品化乙型肝炎病毒表面抗原诊断试剂盒、乙型肝炎病毒表面抗体诊断试剂盒(达安基因)对小鼠血清中hbs及抗hbs抗体水平进行检测,结果如图3所示,hbs-α317scfv与hbs组的血清表面抗原水平没有明显差别,但是hbs-α317scfv重组蛋白诱导的表面抗体水平显著高于hbs。
(6)检测小鼠脾细胞分裂、γ干扰素(ifn-γ)分泌能力:
1)小鼠脾细胞分离:
a)颈椎脱臼处死小鼠,75%酒精浸泡5min;
b)无菌条件下分离小鼠脾脏,去除脂肪及表面粘附组织;
c)置于预冷的无菌pbs中;
d)研磨脾脏,0.22μm细胞滤网过虑;
e)收集细胞悬液于15ml离心管中,室温下1500rpm离心5min,弃上清;
f)加如2ml红细胞裂解液,轻轻吹打混匀,室温下静置3-5min,加入10ml无菌pbs终止反应;
g)室温下1500rpm室温离心5min,去上清;
h)无菌pbs洗涤3次后,rpmi1640培养液重悬细胞,计数。
2)将脾细胞直接或cfse染色后接种于96孔圆底培养板中,每孔5×105细胞:
a)脾细胞用无菌pbs重悬,加入终浓度为0.3μm的cfse染液,37℃染色12min;
b)加入3倍体积的含fbs培养基终止染色,1500rpm室温离心5min,去上清;
c)无菌pbs洗涤1遍;
d)rpmi1640培养液重悬细胞,接种于96孔圆底培养板中。
3)过夜培养后,每孔加入终浓度5μg/mlhbs蛋白;
4)48h后收集细胞上清,elisa检测ifn-γ水平,结果如图4所示;
5)72h后收集cfse预染组的脾细胞,流式细胞术检测细胞分裂情况,结果如图5所示。
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
sequencelisting
<110>中国科学院深圳先进技术研究院
<120>hbs-α317scfv重组蛋白、其编码序列、表达载体及应用
<130>17i24672
<160>8
<170>patentinversion3.3
<210>1
<211>678
<212>dna
<213>人工序列
<400>1
atggagaacacaacatcaggattcctaggacccctgctcgtgttacaggcggggtttttc60
ttgttgacaagaatcctcacaataccacagagtctagactcgtggtggacttctctcaat120
tttctagggggagcacccacgtgtcctggccaaaattcgcagtccccaacctccaatcac180
tcaccaacctcttgtcctccaatttgtcctggctatcgttggatgtgtctgcggcgtttt240
atcatattcctcttcatcctgctgctatgcctcatcttcttgttggttcttctggactac300
caaggtatgttgcccgtttgtcctctacttccaggaacatcaactaccagcacgggacca360
tgcaagacctgcacgattcctgctcaaggaacctctatgtttccctcttgttgctgtaca420
aaaccttcggacggaaactgcacttgtattcccatcccatcatcctgggctttcgcaaga480
ttcctatgggagtgggcctcagtccgtttctcctggctcagtttactagtgccatttgtt540
cagtggttcgtagggctttcccccactgtttggctttcagttatatggatgatgtggtat600
tgggggccaagtctgtacaacatcttgagtccctttttacctctattaccaattttcttt660
tgtctttgggtatacatt678
<210>2
<211>104
<212>dna
<213>人工序列
<400>2
cggaattcgccaccatggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtg60
gagcagtcttcgtttcgcccagctccttcaccatcaaggccaac104
<210>3
<211>792
<212>dna
<213>人工序列
<400>3
gaggtgcagctggtggagtctgggggaggcttagtgcagcctggagggtccctgaaactc60
tcctgtgcagcctctggattcactttcagtagttatggcatgtcttgggttcgccagact120
ccagacaagaggctggagtgggtcgcaaccattaatagtaatggtgctaacacctattat180
ccagacagtgtgaagggccgattcaccatctccagagacaatgccaagaacaccctgtac240
ctgcaaatgagcagtctgaagtctgaggacacagccatgtattactgtgcaaggatctat300
gatgcttactcctcctggtttacttactggggtgaaggaacttttgtcacagtcaatctc360
ggtggcggtggctcgggcggtggtgggtcgggtggcggcggatctgatattgttctgaca420
cagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagtgca480
agtcaggggattaaaaattatttaaactggtatcagcagaaaccagatggaactgttaaa540
ctcctgatctattacacatcaagtttacactcaggagtcccatcaaggttcagtggcagt600
gggtctgggacagattattctctcaccatcagcaacctggaacctgaagatattgccact660
tactattgtcagcagtatagtaagcttccgtacacgttcggcgcaggcacaaaattggaa720
atcaatgattacaaggatgacgacgataaggcgcaccatcaccaccatcatcaccaccat780
cactgactcgag792
<210>4
<211>45
<212>dna
<213>人工序列
<400>4
ggtggcggtggctcgggcggtggtgggtcgggtggcggcggatct45
<210>5
<211>66
<212>dna
<213>人工序列
<400>5
gattacaaggatgacgacgataaggcgcaccatcaccaccatcatcaccaccatcactga60
ctcgag66
<210>6
<211>39
<212>dna
<213>人工序列
<400>6
gccaagaaactgaacgacgctcaggcgccgaagagtgat39
<210>7
<211>0
<212>dna
<213>人工序列
<400>7
<210>8
<211>828
<212>dna
<213>人工序列
<400>8
gaattcgccaccatggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtgga60
gcagtcttcgtttcgcccagctccatggagaacacaacatcaggattcctaggacccctg120
ctcgtgttacaggcggggtttttcttgttgacaagaatcctcacaataccacagagtcta180
gactcgtggtggacttctctcaattttctagggggagcacccacgtgtcctggccaaaat240
tcgcagtccccaacctccaatcactcaccaacctcttgtcctccaatttgtcctggctat300
cgttggatgtgtctgcggcgttttatcatattcctcttcatcctgctgctatgcctcatc360
ttcttgttggttcttctggactaccaaggtatgttgcccgtttgtcctctacttccagga420
acatcaactaccagcacgggaccatgcaagacctgcacgattcctgctcaaggaacctct480
atgtttccctcttgttgctgtacaaaaccttcggacggaaactgcacttgtattcccatc540
ccatcatcctgggctttcgcaagattcctatgggagtgggcctcagtccgtttctcctgg600
ctcagtttactagtgccatttgttcagtggttcgtagggctttcccccactgtttggctt660
tcagttatatggatgatgtggtattgggggccaagtctgtacaacatcttgagtcccttt720
ttacctctattaccaattttcttttgtctttgggtatacattgattacaaggatgacgac780
gataaggcgcaccatcaccaccatcatcaccaccatcactgactcgag828
- 还没有人留言评论。精彩留言会获得点赞!