粒子捕获用微装置以及使用它的粒子的捕获、浓缩或分离方法与流程
本公开涉及一种用于捕获试样中的粒子的微装置、捕获试样中的粒子的方法以及使用它的浓缩或分离粒子的方法。本公开的微装置以及捕获、浓缩及分离方法在一个或者多个实施方式中,能够用于试样中的细胞的捕获、浓缩或分离。
背景技术:
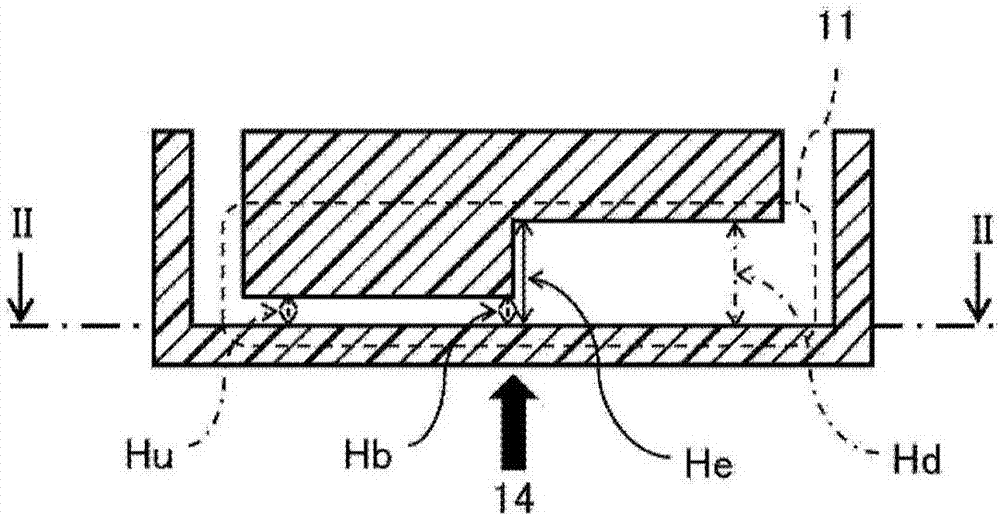
:进行着浓缩含有细胞等各种粒子的液体,或者从该液体中回收粒子。例如,日本专利文献特开第2012-34641号公报中公开了一种能够在单个孔中进行使用介电泳(dep)的检查对象物的捕获和使用细胞破碎(ep)的检查对象的破碎的微腔阵列装置。另外,日本专利文献特开第2008-249513号公报中公开一种使用介电泳而将含有微粒子的液体分为微粒子浓度高的浓缩液和微粒子浓度低的稀释液的装置。技术实现要素:将疾病的早期发现和诊断以及学术性研究等作为目的,进行着从活体采集的待测体中的粒子(例如,细胞等)以及各种成分的分析。例如,血液中含有被称为血循环肿瘤细胞/ctc(circulatingtumorcell,循环肿瘤细胞)以及免疫细胞等稀有细胞的医学上重要的细胞。例如,ctc是从原发性肿瘤组织或者转移性肿瘤组织中游离,并且浸润到血液中的细胞,从而报告了血液中的ctc数量与癌的转移的可能性以及预后相关的内容。因此,要求准确地分析这些细胞。但是,在试样内仅仅存在数个左右的极其少量的上述ctc等稀有细胞。因此,从用于分析时的便利性出发,要求在浓缩了试样中含有的粒子的状态下进行回收。在浓缩这样的试样的情况下,作为一般的浓缩方法的离心分离中发生的细胞的损失成为非常大的问题。另外,在使用离心分析来浓缩的情况下,存在作业者间或者实验间等中产生的损失程度差别大,再现性也有问题。本公开在一个或多个实施方式中,涉及一种能够高精度地捕获试样中的稀有细胞等粒子的装置以及方法,优选涉及一种能够浓缩试样中的稀有细胞等粒子的装置以及方法。本公开在一个方式中,涉及一种粒子捕获用微装置,其用于通过介电泳来捕获试样中的粒子,所述粒子捕获用微装置具有流入口、流出口以及连通所述流入口和所述流出口的流路腔,所述流路腔具有流路的截面积从流入口向流出口扩大的扩大部,在所述流路腔中,至少在所述扩大部或者所述扩大部的附近配置有电场产生单元。本公开在其他方式中涉及一种捕获试样中的粒子的方法,其在微装置的流路腔内捕获试样中的粒子,所述微装置是上述的粒子捕获用微装置,所述捕获试样中的粒子的方法包括:使所述微装置的所述电场产生单元产生电场;以及从所述微装置的所述流入口向所述流路腔内导入所述试样。本公开在其他方式中,涉及一种浓缩、分离、观察或者回收试样中的粒子的方法,其包括:通过本公开的粒子的捕获方法来捕获试样中的粒子。根据本公开,在一个方式中,能够高精度地捕获试样中的稀有细胞等粒子。另外,根据本公开,在一个方式中,可以发挥能够以降低损失的同时以高的再现性捕获或回收试样中的稀有细胞等粒子的效果。另外,根据本公开,在一个方式中,可以很好地发挥能够浓缩、分离、观察或者回收试样中的稀有细胞等粒子的效果。附图说明图1a、图1b、图1c是本公开的微装置的一个例子的简略图。在图1a是微装置1的俯视图,图1b是图1a的i-i方向的截面图,图1c是图1b的ii-ii方向的截面图;图2是示出实施例2以及比较例3中的捕获后的癌细胞的分布的图像的一个例子;图3是示出实施例7中的捕获后的癌细胞以及白细胞的分布的图像的一个例子。具体实施方式本公开在一个方式中基于如下本发明者们发现的新发现:使具有扩大部的流路腔产生不均匀的电场,其中,扩大部的流路的截面积从上游侧向下游侧扩大,当在该状态下从流路腔的上游侧向流路腔内导入细胞液时,能够在扩大部中通过介电泳力容易捕获流速减少的细胞,并且能够进行细胞的浓缩。另外,本公开在一个方式中基于如下本发明者们发现的新发现:通过利用具有流路的截面积扩大的扩大部的流路腔和细胞的介电泳力,能够提高细胞的浓缩效率。通过本公开,虽然能够高精度地捕获细胞等粒子的原理不明确,但可以如下推测。当向具有扩大部的流路腔内导入试样时,由于流路截面积在扩大部中扩大,试样的流速降低。其结果可以考虑为如下:由于能够在使试样的流速降低的状态下,向试样中的粒子施加介电泳力,因此粒子变得容易捕获。尤其可以考虑为如下:由于形成流路腔的高度从流路腔的高度低的扩大部前的部分向高度方向扩大的扩大部,能够在接近电场产生单元(例如,电极)的状态下(即,在形成提高了粒子所受的介电泳力的状态下)使粒子的流速降低,由此能够进一步提高粒子的捕获率。在流路内,产生流路的壁面侧(例如,上面侧以及底面侧)的流速比流路中央部慢的流速分布,因此降低扩大部前的流路的高度从而形成粒子物理地接近底面侧的状态,使得粒子在接近流速慢的底面侧的状态下到达扩大部或者附近。进一步,与电场产生单元之间的距离越接近,介电泳力作用力越强,因此通过在流路的底面设置电场产生单元,对位于靠近底面的位置的粒子作用强的介电泳力。根据这样的状态,当扩大流路腔内的流路截面积时,试样整体的流速减少,底面附近的试样的流速也进一步减少。其结果为,能够高效地捕获粒子。即,与不设置扩大部的结构相比,设置了扩大部的结构的捕获效率更高,与宽度方向的扩大相比,高度方向的扩大更高效地得到上述效果。但是,解释本公开时可以不局限于这些原理。[微装置]本公开在一个方式中涉及一种用于通过介电泳来捕获试样中的粒子的微装置(本公开的微装置)。本公开的微装置具有流入口、流出口、以及连通所述流入口和所述流出口的流路腔,所述流路腔具有流路的截面积从流入口向流出口扩大的扩大部,在所述流路腔中,至少在所述扩大部或者所述扩大部的附近配置有电场产生单元。根据本公开的微装置,在一个或多个实施方式中,能够高精度地捕获试样中的稀有细胞等粒子。另外,根据本公开的微装置,在一个或多个实施方式中,能够高效地进行粒子的浓缩。本公开的微装置在一个或多个实施方式中,能够进行已捕获或者浓缩的粒子的观察、分析或者回收。本公开的微装置中的流路腔与流入口以及流出口连通,能够从流出口排出从流入口导入的试样。另外,通过从流入口或者流出口导入回收液,能够从流路腔回收流路腔内捕获的粒子。本公开的微装置中的流路腔具有流路的截面积从流入口向流出口扩大的扩大部。由此,本公开的微装置在一个或多个实施方式中,能够在使导入到流路腔内的试样中的粒子接近电场产生单元(例如,电极)的状态下急剧减少试样的流速(粒子的速度),进一步,能够对减速的粒子作用通过电场产生单元而在流路腔内产生的介电泳力。因此,根据本公开的微装置,在一个或多个实施方式中,能够高精度地捕获试样中的粒子。扩大部在一个或多个实施方式中,流路的截面积相对于流路腔的底面,向高度方向、宽度方向、或者高度方向和宽度方向两者扩大。作为向高度方向的流路的扩大,在一个或多个实施方式中,可以举出流路腔的上面的高度变高的情形。作为向高度方向的流路的扩大,在一个或多个实施方式中,可以是向高度方向的90度(相对于试样流入方向的垂直方向)或者大致90度的扩大,也可以是从流入口向流出口的向高度方向的直线性、阶梯性、或者曲线性扩大或者它们的组合。作为阶梯性扩大,在一个或多个实施方式中,可以举出阶梯状(也包括一段)的扩大。作为向宽度方向的流路的扩大,在一个或多个实施方式中,可以举出流路腔的宽度变宽的情况。作为向宽度方向的流路的扩大,在一个或多个实施方式中,流路的宽度可以扩大180度(相对于试样流入方向向水平方向)或者大致180度,也可以是向从流入口朝向流出口的宽度方向的直线性、阶梯性、或者曲线性扩大或者它们的组合。作为阶梯性扩大,在一个或多个实施方式中,可以举出阶梯状(也包括一段)的扩大。在本公开中,在扩大部从流入口向流出口向高度方向以及/或者宽度方向以直线性或者曲线性扩大的情况下,将从上述扩大开始的部分至高度最高的部分以及/或者宽度最宽的部分为止的区域称为扩大部。关于扩大部,从能够进一步缩小流路腔的底面积、其结果能够提高浓缩率、或者使用微装置而能够进一步缩小观察粒子时的观察面的观点出发,优选向高度方向扩大流路。作为扩大部,在一个或多个实施方式中,可以举出与流入口和流出口的直线方向(试样流入方向)正交的截面的流路截面积扩大的部分。在本公开中,“流路的截面积(流路截面积)”是指,与试样流入的方向正交的方向上的截面的流路腔的面积。截面积扩大是指,在一个或多个实施方式中,流路腔的流路截面积只要比扩大部正前(直前,justbefore)的流路截面积大即可。只要根据捕获粒子、试样以及流速等来适当决定流路截面积即可。在一个或多个实施方式中,流路腔的流路截面积为扩大部正前的流路截面积的1.5倍以上、2倍以上、2.5倍以上、3倍以上、3.5倍以上、4倍以上、4.5倍以上、5倍以上、5.5倍以上或者6倍以上。因此,在一个或多个实施方式中,扩大部和扩大部正前的流路截面积比([扩大部的流路截面积]/[扩大部正前的流路截面积])为1.5以上、2以上、2.5以上、3以上、3.5以上、4以上、4.5以上、5以上、5.5以上或者6以上,或者10以下、9以下、8以下或者7以下。在本公开中,“扩大部的流路截面积”是指,扩大部中流路截面积最宽的流路截面积。在本公开中,“扩大部正前的流路截面积”是指,比扩大部更靠近上游侧、且流路截面积变化(扩大)正前的流路截面积。[扩大部相对于流路腔的底面而向高度方向扩大的方式]在扩大部相对于流路腔的底面而向高度方向扩大的方式中,关于扩大部的高度(he)和扩大部正前(扩大变化点)的高度(hb)的比(he/hb),只要根据捕获粒子、试样以及流速等来适当决定即可,但在一个或多个实施方式中,为1.5以上,从扩大部中降低流速并进一步提高捕获率的观点出发,优选为1.5以上、2以上、2.5以上、3以上、3.5以上、4以上、4.5以上、5以上、5.5以上或者6以上。另外,上在一个或多个实施方式中,上述比(he/hb)的上限为10以下、9以下、8以下或者7以下。在本公开中,“扩大部的高度(he)”是指,在扩大部中流路腔的高度最高的部分的高度。在本公开中,“扩大部正前的高度(hb)”是指,比扩大部更靠近上游侧、且流路截面积变大的正前的流路腔的高度。扩大部的高度(he)为100μm以上,从在扩大部中降低流速并进一步提高捕获率的观点出发,在一个或多个实施方式中,为100μm以上、200μm以上、300μm以上、400μm以上、500μm以上或者600μm以上。在一个或多个实施方式中,扩大部的高度为1000μm以下、900μm以下、800μm以下或者700μm以下。从在扩大部中降低流速并进一步提高捕获率的观点出发,在一个或多个实施方式中,扩大部正前的高度(hb)为200μm以下、150μm以下、100μm以下、50μm以下或者40μm以下。在一个或多个实施方式中,扩大部正前的高度(hb)为20μm以上或者30μm以上。关于该方式中的流路腔的宽度,在一个或多个实施方式中,从进一步提高捕获率的观点出发,为0.05mm以上、0.1mm以上或者0.5mm以上,从进行粒子的浓缩的观点出发,为50mm以下、40mm以下、30mm以下、20mm以下、10mm以下、9mm以下、8mm以下、7mm以下、6mm以下、5mm以下、4mm以下、3mm以下、2mm以下或者1mm以下。本公开中的流路腔的宽度是指,在与试样流入方向正交的方向上的流路的长度。此外,关于扩大部的高度(he)、扩大部正前的高度(hb)以及流路腔的宽度等,只要根据捕获粒子、试样以及流速等来适当决定即可。[扩大部相对于流路腔的底面而向宽度方向扩大的方式]在扩大部相对于流路腔的底面而向宽度方向扩大的方式中,在一个或多个实施方式中,扩大部的宽度(we)和扩大部正前的宽度(wb)的比(we/wb)为1.5以上,从在扩大部中降低流速并进一步提高捕获率的观点出发,优选为1.5以上、2以上、2.5以上、3以上、3.5以上、4以上、4.5以上、5以上、5.5以上或者6以上。另外,在一个或多个实施方式中,上述比(we/wb)的上限为10以下、9以下、8以下或者7以下。在本公开中,“扩大部的宽度(we)”是指,在扩大部中流路腔的宽度最宽的部分的宽度。在本公开中,“扩大部正前的宽度(wb)”是指,比扩大部更靠近上游侧、且流路截面积变大正前的流路腔的宽度。扩大部的宽度(we)为0.075mm以上,从在扩大部中降低流速并进一步提高捕获率的观点出发,在一个或多个实施方式中,为0.1mm以上、0.2mm以上、0.3mm以上、0.4mm以上、0.5mm以上、1mm以上、2mm以上、3mm以上、4mm以上、5mm以上、6mm以上、7mm以上、8mm以上、9mm以上或者10mm以上。在一个或多个实施方式中,扩大部的宽度(we)为500mm以下、400mm以下、300mm以下、200mm以下、100mm以下、90mm以下、80mm以下、70mm以下、60mm以下、50mm以下、40mm以下、30mm以下或者20mm以下。从在扩大部中降低流速并进一步提高捕获率的观点出发,在一个或多个实施方式中,扩大部正前的宽度(wb)为50mm以下、40mm以下、30mm以下、20mm以下、10mm以下、9mm以下、8mm以下、7mm以下、6mm以下、5mm以下、4mm以下、3mm以下、2mm以下或者1mm以下。在一个或多个实施方式中,扩大部的正前的宽度(wb)为0.05mm以上、0.1mm以上或者0.5mm以上。在将粒子接近流路腔的底面的状态下,在扩大部中进一步降低流速,由此从进一步提高粒子的捕获率的观点出发,在一个或多个实施方式中,从流入口侧至扩大变化点为止的流路腔的高度为200μm以下、150μm以下、100μm以下、50μm以下、40μm以下、30μm以下或者20μm以下。在一个或多个实施方式中,流路腔的高度为20μm以上或者30μm以上。对形成于流路腔的扩大部的数量,没有特别限制,只要形成至少一个即可。在一个或多个实施方式中,从进一步提高捕获率的观点出发,流路腔的长度为0.05mm以上、0.1mm以上、0.5mm以上或者1mm以上,从进行粒子的浓缩的观点出发,为100mm以下、50mm以下、40mm以下、30mm以下、20mm以下、10mm以下、9mm以下、8mm以下、7mm以下、6mm以下、5mm以下、4mm以下、3mm以下或者2mm以下。在本公开中,流路腔的长度是指,试样流入方向上的流路腔的长度。在一个或多个实施方式中,流路腔的体积(容量)为10pl以上、100pl以上、1nl以上、10nl以上、0.1μl以上、0.2μl以上、0.3μl以上、0.4μl以上、0.5μl以上、0.6μl以上、0.7μl以上、0.8μl以上、0.9μl以上或者1μl以上,或者10ml以下、5ml以下、1ml以下、0.5ml以下、0.3ml以下、0.1ml以下、90μl以下、80μl以下、70μl以下、60μl以下、50μl以下、40μl以下、30μl以下、20μl以下或者10μl以下。此外,关于扩大部的宽度(we)、扩大部正前的宽度(wb)、流路腔的长度、流路腔的体积等,只要根据捕获粒子、试样以及流速等而适当决定即可。从进一步提高粒子的捕获率、且容易进行捕获后的粒子的观察的观点出发,流路腔的底面优选为平面。在流路腔中配置有用于产生介电泳的电场产生单元。本公开的微装置在一个或多个实施方式中,能够通过对配置于流路腔的该电场产生单元施加电场来产生不均匀的电场,并能够产生介电泳。从进一步提高粒子的捕获率的观点出发,在一个或多个实施方式中,电场产生单元只要至少配置于扩大部或者其附近即可。作为配置于扩大部或者其附近的情况,在一个或多个实施方式中,可以举出在扩大部具有只有一侧壁面向上侧扩大的形状时,在与扩大部对置的位置配置电场产生单元的情况。从进一步提高粒子的捕获率、且容易进行捕获后的粒子的观察的观点出发,电场产生单元优选配置于流路腔的底面。在将粒子接近流路腔的底面的状态下,在扩大部流速降低,由此从进一步提高粒子的捕获率的观点出发,电场产生单元优选至少配置于与扩大部对置的流路腔的底面。作为电场产生单元,在一个或多个实施方式中,可以举出用于介电泳的对电极。从进一步提高粒子的捕获率的观点出发,在一个或多个实施方式中,在流路腔的底面配置有用于介电泳的对电极。本公开的微装置能够通过向配置于流路腔的底面的对电极施加电场而产生不均匀的电场,能够产生介电泳。在一个或多个实施方式中,电极可以至少配置于扩大部附近,从进一步提高粒子的捕获率的观点出发,优选配置于从流路腔的底面的上游侧至下游侧的整体。在一个或多个实施方式中,电极优选配置于流路腔的内壁面的底面。电极的形态没有特别的限制,在一个或多个实施方式中,可以举出梳形电极(交叉手指状电极)。在一个或多个实施方式中,如图1c所示,梳形电极优选被配置成梳形电极的各电极手指的长边方向与流入口和流出口的直线方向(试样流入方向)正交。在一个或多个实施方式中,电极的宽度为0.1μm以上、0.5μm以上、1μm以上、2μm以上、3μm以上、4μm以上、5μm以上、6μm以上、7μm以上、8μm以上、9μm以上或者10μm以上,或者5000μm以下、1000μm以下、900μm以下、800μm以下、700μm以下、600μm以下、500μm以下、400μm以下、300μm以下、200μm以下或者100μm以下。电极的宽度可以相同,也可以不相同。在本公开中,电极的宽度是指,试样流入的方向的电极的长度。在一个或多个实施方式中,电极之间的间隙为1μm以上、2μm以上、3μm以上、4μm以上、5μm以上、6μm以上、7μm以上、8μm以上、9μm以上或者10μm以上,或者1000μm以下、900μm以下、800μm以下、700μm以下、600μm以下、500μm以下、400μm以下、300μm以下、200μm以下或者100μm以下。在本公开中,电极之间的间隙是指,在试样流入的方向上相邻的电极和电极之间的间隔(距离)。在一个或多个实施方式中,电极的厚度为0.1nm以上、0.5nm以上、1nm以上、2nm以上、3nm以上、4nm以上、5nm以上、6nm以上、7nm以上、8nm以上、9nm以上或者10nm以上,或者1000nm以下、900nm以下、800nm以下、700nm以下、600nm以下或者500nm以下。在一个或多个实施方式中,能够根据流路腔的宽度来适当决定各电极手指的长度。在一个或多个实施方式中,各电极手指的长度为流路腔的宽度的10%以上、20%以上、30%以上、40%以上、50%以上、60%以上或者70%以上,或者100%以下、95%以下、90%以下或者85%以下。从进一步提高粒子的捕获率的观点出发,在一个或多个实施方式中,各电极手指优选配置于流路腔的宽度方向整体。关于电极的材质,在一个或多个实施方式中,可以举出铟锡氧化物(ito)、钛、铬、金、铂、zno(氧化锌)、氟掺杂氧化锡(fto)、银、铜、导电性的物质(导电性聚合物等)等。在一个或多个实施方式中,从容易进行对已捕获的粒子的观察或者分析的观点出发,电极优选为透明。对流入口以及流出口的形成位置,没有特别的限制。作为流入口以及流出口的位置,在一个或多个实施方式中,可以举出微装置的侧面、上面或者下面等。对微装置的材质,没有特别的限制,在一个或多个实施方式中,可以举出玻璃、熔融石英、塑料等树脂等。作为塑料,例如可以举出聚甲基丙烯酸甲酯(pmma)、聚碳酸酯、聚苯乙烯、聚四氟乙烯(ptfe)、聚醚醚酮(peek)、硅酮等。在一个或多个实施方式中,从容易进行捕获的粒子的观察或者分析的观点出发,微装置优选为透明。[制造微装置的方法]本公开的微装置例如能够通过在基板上形成电极、以及通过接合形成了电极的基板和形成有包含扩大部的流路腔(流路)的基板来制造,其中,扩大部是流路的截面积从上游侧向下游侧扩大的部位。因此,本公开在其他方式中,涉及一种微装置的制造方法,其包括:在基板上形成电极;以及接合形成了电极的基板和形成有包含扩大部的流路腔(流路)的基板,所述扩大部的流路的截面积从上游侧向下游侧扩大。在一个或多个实施方式中,基板的接合以使得流路腔(流路)覆盖形成于基板上的电极的方式进行。在一个或多个实施方式中,电极的形成能够通过现有公知的方法来进行。作为形成方法,在一个或多个实施方式中,可以举出光刻技术、丝网印刷、凹版印刷、以及柔版印刷等印刷技术等。在一个或多个实施方式中,能够通过现有公知的方法来进行流路的形成。作为形成方法,在一个或多个实施方式中,可以举出切割技术、铸造技术等。[捕获粒子的方法]本公开在其他方式中涉及一种捕获试样中的粒子的方法(本公开的捕获方法),其包括:在具有流路的截面从上游侧向下游侧扩大的扩大部的流路腔内,产生对粒子作用介电泳力的电场;以及从所述流路腔的上游侧向所述流路腔内导入含有粒子的试样。此外,电场的产生和向试样的注入口的导入的开始时间可以是同时,只要是试样到达扩大部正前,就也可以在试样导入后产生电场。根据本公开的捕获方法,在具有流路的截面积从上游侧向下游侧扩大的扩大部的流路腔内,从该流路腔的上游侧导入含有粒子的试样,因此能够高精度地捕获粒子,并能够简单地进行粒子的浓缩。关于本公开的捕获方法,在一个或多个实施方式中,能够使用本公开的微装置进行。因此,本公开在其他方式中涉及捕获粒子的方法,在微装置的流路腔内捕获试样中的粒子的方法,所述微装置是本公开的微装置,所述捕获所述粒子的方法包括:使所述微装置的所述电场产生单元产生电场;以及从所述微装置的所述流入口向所述流路腔内导入所述试样。在一个或多个实施方式中,关于电场,只要至少在与扩大部对应的部分产生即可。在一个或多个实施方式中,本公开的捕获方法包括在流路腔的底面的至少一部分或者全部产生对粒子作用介电泳力的电场,从进一步提高捕获率的观点出发,包括:在与扩大部对应的流路腔的底面产生对粒子作用介电泳力的电场;或者在流路腔的底面整体产生对粒子作用介电泳力的电场。在一个或多个实施方式中,从提高处理效率的观点出发,试样的流量为1μl/分以上、2μl/分以上、3μl/分以上、4μl/分以上、5μl/分以上、6μl/分以上、7μl/分以上、8μl/分以上、9μl/分以上、或者10μl/分以上。另外,从进一步提高捕获率的观点出发,为1000μl/分以下、900μl/分以下、800μl/分以下、700μl/分以下、600μl/分以下、500μl/分以下、400μl/分以下、300μl/分以下、200μl/分以下、或者100μl/分以下。在一个或多个实施方式中,导入到流路腔内的试样的量优选为超过流路腔的容量的量。在一个或多个实施方式中,本公开的捕获方法包括导入超过流路腔的容量的量的试样。在一个或多个实施方式中,能够通过向配置于流路腔的底面的电极施加交流电压来进行电场的产生。在一个或多个实施方式中,施加电压为0.1v以上、0.5v以上、1v以上、2v以上、3v以上、4v以上、5v以上、6v以上、7v以上、8v以上、9v以上或者10v以上,在一个或多个实施方式中,施加电压为100v以下、90v以下、80v以下、70v以下、60v以下、50v以下、40v以下或者30v以下。关于施加频率,只要是能够在电极捕获粒子的频率即可,在一个或多个实施方式中,为1khz以上、5khz以上、10khz以上、50khz以上、100khz以上、200khz以上、300khz以上、400khz以上、500khz以上、600khz以上、700khz以上、800khz、900khz以上或者1mhz以上,或者100mhz以下、90mhz以下、80mhz以下、70mhz以下、60mhz以下、50mhz以下、40mhz以下、30mhz以下、20mhz以下或者10mhz以下。在一个或多个实施方式中,试样包括粒子、以及悬浮或者分散粒子的介质(液体)。在本公开的没有特别限定的一个或多个实施方式中,作为粒子,可以举出细胞。作为细胞,在一个或多个实施方式中,可以举出ctc等稀有细胞。作为稀有细胞,在没有特别限定的一个或多个实施方式中,可以举出人结肠癌细胞、人胃癌细胞、人大肠癌细胞以及人肺癌细胞等。关于悬浮或者分散粒子的介质(液体),作为一个或多个实施方式,从抑制粒子中的极化的产生的减少、从减少由于电流流动的对细胞的破坏、或者从进一步提高通过介电泳的捕获率的观点出发,希望电气传导率(电导率)尽量低。从相同观点出发,作为一个或多个实施方式,介质优选为电解质的含量少。从相同观点出发,在粒子为活细胞的情况下,作为一个或多个实施方式,介质优选为蔗糖等渗溶液等非电解质的等渗溶液。根据本公开的捕获方法,在一个或多个实施方式中,能够进行粒子的浓缩,进一步能够进行粒子的分析。因此,本公开在其他方式中涉及一种浓缩试样中的粒子的方法,其包括通过本公开的捕获方法来捕获试样中的粒子。在一个或多个实施方式中,本公开的浓缩的方法也可以包括向捕获了粒子的流路腔导入回收液,并从所述流路腔回收所述流路腔中捕获的粒子。因此,进一步在其他方式中,本公开涉及一种回收试样中的粒子的方法,其包括:通过本公开的捕获方法来在流路腔中捕获试样中的粒子;以及向流路腔导入回收液,并从所述流路腔回收所述流路腔中捕获的粒子。进一步在其他方式中,本公开涉及一种分析试样中的粒子的方法,其包括通过本公开的捕获方法来捕获试样中的粒子。根据本公开的捕获方法,在一个或多个实施方式中,能够进行粒子的浓缩,进一步能够进行捕获的粒子的观察或者分析。因此,在其他方式中,本公开涉及一种观察或者分析粒子的方法,其包括:通过本公开的捕获方法来在所述流路腔中捕获试样中的粒子;以及观察或者分析所述流路腔中捕获的粒子。关于粒子的观察,在一个或多个实施方式中,能够通过显微镜观察等进行。关于粒子的分析,例如,能够在本公开的微装置中进行,例如,能够在流路腔中捕获了所述粒子之后,在该流路腔中进行。根据本公开的微装置以及捕获方法,在一个或多个实施方式中,能够在不同的捕获区域捕获从电场受到的介电泳力与从液体流动受到的阻力之间的平衡不同的粒子。即,根据本公开的微装置以及捕获方法,在一个或多个实施方式中,在试样中含有多种粒子的情况下(例如,在含有两种以上的从电场受到的介电泳力与从液体流动受到的阻力之间的平衡不同的粒子的情况下),能够在不同的捕获区域内捕获它们。因此,在其他方式中,本公开还涉及一种分离试样中的粒子的方法,该粒子的分离方法包括:在具有流路的截面积从上游侧向下游侧扩大的扩大部的流路腔内,产生对粒子作用介电泳力的电场;以及从所述流路腔的上游侧向所述流路腔内导入含有粒子的试样。根据本公开的分离方法,在一个或多个实施方式中,能够在不同的捕获区域捕获从电场受到的介电泳力与从液体流动受到的阻力之间的平衡不同的粒子。根据本公开的分离方法,在一个或多个实施方式中,在试样含有ctc和白细胞的情况下,能够在比截面流速快的扩大部更靠近上游侧的位置捕获从液体流动受到的阻力小的白细胞,能够在截面流速慢的扩大部附近捕获从液体流动受到的阻力比白细胞大的ctc。本公开的分离方法在一个或多个实施方式中,能够分离试样中所含的多种粒子。因此,本公开进一步在其他方式中,涉及一种分离试样中的粒子的方法,其包括:在具有流路的截面积从上游侧向下游侧扩大的扩大部的流路腔内的至少所述扩大部或者所述扩大部的附近,产生对粒子作用介电泳力的电场;以及从所述流路腔的上游侧向所述流路腔内导入含有粒子的试样,并分离所述试样中所含的多种粒子。在本公开的微装置的一个实施方式中,基于附图进行说明。图1a、图1b、图1c是本公开的微装置的一个实施方式的简略图。在图1a是微装置1的俯视图,图1b是图1a的i-i方向的截面图,图1c是图1b的ii-ii方向的截面图。如图1a~图1c所示,微装置1具有流入口10、流路腔11、流出口12以及梳形电极13。流入口10以及流出口12形成于微装置1的上面,并与在长边方向上沿着微装置1的底面形成的流路腔11连通。如后面叙述的图2所示,在与流路腔11的流入口10接触的部分,为了在流路腔11均匀地展开从流入口10导入的细胞液、且抑制壁面上的气相的残留,可以设置有锥形部。此外,也可以是不具有锥形部的结构。流路腔11具有流路的截面积向高度方向扩大的扩大部14。在图1a~图1c的微装置1中,扩大部14被形成在流路腔11的大致中央部分。扩大部14的高度(he)和扩大变化点的高度(hb)之比(he/hb)大致为3。扩大部14的上游侧的流路腔11的高度(hu)和扩大变化点的高度(hb)相同。即,在图1a~图1c的微装置1中,从流路腔11的最上游部至扩大变化点为止的高度大致恒定。另外,扩大部14的高度(he)和扩大部14的下游侧的流路腔11的高度(hd)相同。即,在图1a~图1c的微装置1中,从扩大部14至流路腔11的最下游部为止的高度大致恒定。在本实施方式中,扩大部14的流路的高度(流路的截面积)急剧扩大。扩大变化点的高度(hb)优选能够尽量减少由于到达扩大部14而细胞的流速急剧减少时与电极之间的距离,其结果,为了进一步提高细胞的捕获率,优选尽量低。扩大部14的高度(he)能够根据扩大变化点的高度(hb)来适当决定。梳形电极13被形成在构成流路腔11的底面的基板的上面。本公开可以涉及以下的一个或多个实施方式。〔1〕一种微装置,其用于通过介电泳来捕获试样中的粒子,所述微装置具有:流入口;流出口;以及流路腔,所述流路腔连通所述流入口和所述流出口,所述流路腔具有流路的截面积从流入口向流出口扩大的扩大部,在所述流路腔中,至少在所述扩大部或者所述扩大部的附近配置电场产生单元。〔2〕根据〔1〕所述的微装置,其中,所述扩大部中,流路的截面积相对于所述流路腔的底面向高度方向扩大。〔3〕根据〔1〕所述的微装置,其中,所述扩大部中,流路的截面积相对于所述流路腔的底面,向宽度方向以阶梯状扩大。〔4〕根据〔1〕至〔3〕中任一项所述的微装置,其中,所述流路腔的底面是平面。〔5〕根据〔1〕至〔4〕中任一项所述的微装置,其中,所述电场产生单元被配置在所述流路腔的底面。〔6〕一种试样中的粒子的捕获方法,其包括:在具有流路的截面积从上游侧向下游侧扩大的扩大部的流路腔内的至少所述扩大部或者所述扩大部的附近,产生对粒子作用介电泳力的电场;以及从所述流路腔的上游侧向所述流路腔内导入含有粒子的试样。〔7〕根据〔6〕所述的捕获方法,其包括:在所述扩大部中,对所述粒子作用介电泳力。〔8〕根据〔6〕或〔7〕所述的捕获方法,其包括:从所述扩大部的上游侧至扩大部,对所述粒子作用介电泳力。〔9〕根据〔6〕至〔8〕中任一项所述的捕获方法,其中,所述流路腔是〔1〕至〔5〕中任一项所述的微装置的流路腔。〔10〕一种粒子的捕获方法,其向微装置的流路腔内捕获试样中的粒子,其中,所述微装置是〔1〕至〔5〕中任一项所述的微装置;使所述微装置的所述电场产生单元产生电场;以及从所述微装置的所述流入口向所述流路腔内导入所述试样。〔11〕根据〔10〕所述的捕获方法,其中,所述试样的导入通过导入超过所述流路腔的容量的量的所述试样来进行。〔12〕试样中的粒子的浓缩方法,其包括:通过〔6〕至〔11〕中任一项所述的捕获方法来捕获试样中的粒子。〔13〕根据〔12〕所述的浓缩方法,其包括:向所述流路腔导入回收液,并从所述流路腔回收所述流路腔中捕获的粒子。〔14〕一种试样的浓缩方法,其包括:通过〔6〕至〔11〕中任一项所述的捕获方法,在所述流路腔内捕获试样中的粒子;以及向所述流路腔导入回收液,并从所述流路腔回收所述流路腔中捕获的粒子。〔15〕一种观察或者分析粒子的方法,其包括:通过〔6〕至〔11〕中任一项所述的捕获方法,在所述流路腔内捕获试样中的粒子;以及观察或者分析所述流路腔中捕获的粒子。〔16〕一种回收试样中的粒子的方法,其包括:通过〔6〕至〔11〕中任一项所述的捕获方法,在所述流路腔内捕获试样中的粒子;以及向所述流路腔导入回收液,并从所述流路腔回收所述流路腔中捕获的粒子。〔17〕一种粒子的分离方法,其分离试样中的粒子,所述粒子的分离方法包括:在具有流路的截面积从上游侧向下游侧扩大的扩大部的流路腔内的至少所述扩大部或者所述扩大部的附近,产生对粒子作用介电泳力的电场;以及从所述流路腔的上游侧向所述流路腔内导入含有粒子的试样,并分离所述试样中所含的多种粒子。示例以下,使用实施例,对本公开进行进一步的说明。但是,本公开的解释不局限于以下的实施例。(实施例1)[微装置的制作]按照以下的顺序制作图1a~图1c所示的微装置。1)在ito基板上以湿蚀刻形成电极图案。2)在硅晶片上,使用光刻技术以su-8制作流路的模型。3)使用上述模型,以pdms制作流路。4)通过氧等离子体将形成了电极图案的ito基板和以pdms制作的流路的表面活化,将在ito基板上形成图案的电极与流路彼此面对的方式粘贴。此外,扩大部的上游侧(流入口侧)(扩大部正前)的高度约为50μm、扩大部的高度约为100μm、流路腔体积约为4μl。[细胞的捕获率评价]将已由celltrackergreen(细胞示踪绿色)染色的snu-1细胞添加到下述分散液(介电泳用缓冲液)中,在下述条件下向微装置输送,并进行细胞的捕获。在输送结束之后,使用显微镜来计测流路腔内捕获的细胞数,并将其值除以添加的细胞数,由此求出捕获率。下述表1示出其结果。<输送条件>流量:200μl/分处理液量:200μl施加条件:20vp-p,1mhz,正弦波,ac电压细胞:snu-1(人胃癌细胞、活细胞)分散液:10mmhepes,0.1mmcacl2,59mmd-葡萄糖,236mm蔗糖,0.2%bsa(约40μs/cm(4ms/m))(比较例1以及2)除了不具有扩大部、且流路腔的高度一定以外,以与实施例1相同的方式制作微装置,与实施例1相同地进行细胞的捕获。下述表1示出其结果。表1实施例1比较例1比较例2扩大部有无无高度(μm)50→10010050宽度(mm)777长度(mm)101010体积(μl)3.95.32.6捕获率(%)954142如表1所示,具有扩大部的实施例1的装置能够以比不具有扩大部的比较例1以及2的装置更高的捕获率捕获细胞。另外,如表1所示,实施例1的装置的流路腔内的体积为3.9μl,因此通过向实施例1的装置导入细胞液,能够将细胞液的体积大幅浓缩至导入(处理)前的50分之1以下(50倍浓缩)。此外,在上述实施例1中,以200μl的处理液量进行实验,但即使处理液量为1ml以上时同样也可以高的捕获率处理,通过本方法能够进行250倍以上的浓缩。(实施例2)除了使用进行如下处理过的细胞以外,与实施例1相同地进行:在下述处理条件下,使用多聚甲醛(pfa)和tween20对已由celltrackergreen染色的snu-1细胞进行处理,并进行固定以及膜渗透处理。下述表2以及图2示出其结果。<固定和膜渗透处理条件>1.固定:使用1%pfa(pbs溶液),在室温下反应15分钟2.膜渗透处理:使用0.175%tween20,在室温下反应20分钟(比较例3以及4)除了使用进行了实施例2的固定以及膜渗透处理的细胞以外,与比较例1或2相同地进行。下述表2以及图2示出其结果。表2实施例2比较例3比较例4扩大部有无无高度(μm)50→10010050宽度(mm)777长度(mm)101010体积(μl)3.95.32.6捕获率(%)83534如表2所示,具有扩大部的实施例的装置能够以比不具有扩大部的比较例3和4的装置更高的捕获率来捕获细胞。另外,实施例2的装置的流路腔内的体积为3.9μl,因此通过向实施例2的装置导入细胞液,能够将细胞液的体积减少至导入(处理)前的50分之1以下,其结果为,能够简单地大幅度浓缩细胞。图2是示出实施例2以及比较例3的捕获后的细胞的分布的图像。图2的(a)是实施例2的图像,图2的(b)是比较例3的图像。图2的(c)和(d)示出放大了图2的(a)和(b)中以白色虚线围绕的部分。图2的(a)~(d)中白点示出被捕获的细胞。如图2的(b)和(d)所示,在比较例3的装置中细胞被捕获的位置分散。与此相对,如图2的(a)和(c)所示,在实施例2的装置中,在装置的中央部、即扩大部附近捕获了大量的细胞。即,在实施例2的装置中,可以进行局部细胞的捕获,容易进行捕获的细胞的观察。(实施例3)将含有进行了实施例2的固定和膜渗透处理的细胞的细胞液,以下述表3所示的流量导入到如下述表3所示的具有扩大部的高度不同的流路腔的两种微装置,除此以外,与实施例1相同地进行。下述表3示出其结果。表3如表3所示,通过使用具备扩大部的本公开的微装置,不管在什么情况,都能够以超过75%的高的捕获率捕获细胞。另外,与在扩大部中高度设置为2倍(50μm→100μm)的装置相比,设置为6倍(50μm→300μm)的装置能够以更大的流量且更高的捕获率捕获细胞。由此,只要根据目标处理流量来改变扩大部的高度,就能够以更大的流量处理。(比较例5)将含有进行了实施例2的固定和膜渗透处理的细胞的细胞液1ml添加到微型离心管并以200×g进行5分钟的离心分离,并回收细胞。计测回收到的细胞数并求出其回收率。其结果为,回收率是22%。(实施例4)与实施例1同样,通过本公开的微装置来对与比较例5相同的1ml的细胞液进行浓缩。其结果为,装置内回收的细胞的回收率为98%(处理流量:50μl/分)。即,确认了通过使用具备扩大部的本公开的微装置,能够以比离心分离更高的捕获率回收细胞。(实施例5)与实施例1同样,通过本公开的微装置来对含有已由celltrackergreen染色的sw620细胞(人结肠癌细胞)的细胞液1ml进行浓缩(处理流量:20μl/分)。接着,从微装置的流出口以移液管输送pbs(-)10μl,并从微装置回收微装置内捕获的细胞。使用显微镜来计测回收到的细胞数,并将其值除以输送前的细胞液中的细胞数(大概数目),由此求出回收率。下述表4示出其结果。(实施例6)与实施例4同样,通过本公开的微装置来对含有在下述条件下处理的sw620细胞的细胞液1ml进行浓缩,并使用显微镜对装置内捕获的细胞数进行计测。接着,从微装置的流出口以移液管输送pbs(-)20μl,并从微装置回收微装置内捕获的细胞。使用显微镜来对回收到的细胞数进行计测,并将其值除以输送前的细胞液中的细胞数(大概数目),由此求出回收率。下述表4示出其结果。<细胞处理条件>1.固定:使用2%pfa(pbs溶液),在室温下反应15分钟2.膜渗透处理:使用0.1%tween20,在室温下反应15分钟3.染色:使用抗细胞角蛋白抗体和hoechst33342,在室温下反应15分钟表4实施例5实施例6回收率110%98%如表4所示,通过使用具备扩大部的本公开的微装置,不仅能够通过介电泳来捕获细胞并将其回收到装置内,而且在观察之后能够以几乎接近100%的高的回收率将装置内捕获的细胞作为浓缩液而回收。另外,再现性也高。此外,在从入口吸引装置内液体全量的回收方法中,也能够以85%的高的回收率来回收细胞。通过使用本公开的微装置,能够以少量的回收液抑制细胞的损失的同时容易回收细胞。即,根据本公开的微装置,能够容易地进行细胞的浓缩。(实施例7)与实施例1同样,通过本公开的微装置来对混合了下述条件下处理的sw620细胞和白细胞的细胞液进行浓缩(处理流量:20μl/分)。<sw620细胞处理条件>1.固定:使用0.05%pfa(pbs溶液),在室温下反应15分钟2.膜渗透处理:使用0.4%tween20,在室温下反应20分钟3.染色:使用抗细胞角蛋白抗体和hoechst33342,在室温下反应30分钟<白细胞处理条件>1.固定:使用0.05%pfa(pbs溶液),在室温下反应15分钟2.一次染色:使用抗cd45等抗体,在室温下反应15分钟3.二次染色:使用标记用的二次抗体和hoechst33342,在室温下反应30分钟图3示出其结果。图3是示出实施例7的捕获后的细胞的分布的图像。在图3中,通过以三角形围绕癌细胞、以圆形来围绕白细胞。示意性示出捕获后的细胞的分布的状态。如图3所示,白细胞大部分在比扩大部更靠近上游侧(流入口侧)(图3的以长链线围绕的区域)的位置被捕获,癌细胞大多在扩大部附近(图3的以虚线围绕的区域)被捕获。这可以考虑如下情况:由于白细胞从液体流动受到的阻力小,因此在比扩大部更靠近上游侧的位置被捕获,由于癌细胞从液体流动受到的阻力比白细胞大,因此没有在比扩大部更靠近上游侧的位置被捕获而是在扩大部附近被捕获。此外,即使在混合了两种细胞的状态下进行了染色等处理的样品的情况下,也观察到同样的现象。通过实施例7的结果,可以得到如下启示:根据本公开的装置,在试样中可以含有多个细胞的情况下,利用从细胞的液体流动受到的阻力和受到的介电泳力之间的平衡的差异,可以知道每个细胞的捕获位置。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1