刺葡萄转录因子VdWRKY70及其在培育植物抗性品种中的应用的制作方法
本发明属于农业生物技术领域,具体涉及刺葡萄转录因子vdwrky70及其在培育植物抗性品种中的应用。
背景技术:
植物在生长发育过程中常受到真菌、细菌、病毒、支原体、线虫等生物胁迫,表现为抗病或感病。植物免疫系统由两个免疫反应组成:病原相关分子模式激发的免疫反应(pamp-triggeredimmunity,pti)和效应蛋白激发的免疫反应(effectortriggeredimmunity,eti)。pti和eti都属于系统获得性抗性(systemicacquiredresistance,sar),sar是sa介导的植物对病原菌的抗病反应,wrky转录因子是sa信号传递过程中的重要转录因子,在调控与植物防御反应相关基因的表达上起着非常重要的作用。
葡萄是我国栽培最广泛的水果之一,葡萄病害随着葡萄产业的发展越发严重,白腐病是由真菌(coniothyriumdiplodiella)引起的,是葡萄最严重的四大病害之一。白腐病对葡萄的危害包括减弱树势、破坏枝蔓、减产甚至引起绝收,严重威胁葡萄的生产。刺葡萄是葡萄科葡萄属东亚种群的一种野生种质资源,其对黑痘病、白腐病、炭疽病等具有很强的抗性已成为葡萄耐湿热、抗病育种的宝贵资源。利用现代分子生物技术手段从我国特有的种质资源中寻找抗性基因、鉴定抗性品种,是葡萄产业化生产和我国优异资源保护的迫切需要。
葡萄全基因组中属于wrky家族有80个成员,vdwrky70的cds序列931bp,属于典型的wrky转录因子第ⅲ家族成员。一个或少数几个转录因子可以调控一系列下游抗病防御反应基因的表达,有可能通过导入或改良转录因子的基因工程方法来综合改良植物抗病性状。因此,探寻在刺葡萄抗病防御反应中具有正调控作用的转录因子基因对鉴定抗病转基因刺葡萄新品种有着非常重要的意义。
技术实现要素:
本发明目的是提供刺葡萄转录因子vdwrky70及其在培育植物抗性品种中的应用,通过实时荧光定量pcr技术,发现转基因型拟南芥对pstdc3000有一定地抗性,可以培育出拟南芥抗pstdc3000品种,同时也为深入了解转录因子vdwrky70在刺葡萄体内的生化特征及生理功能奠定基础。
为实现上述目的,本发明采用以下技术方案:
本发明提供一种刺葡萄转录因子vdwrky70,所述刺葡萄转录因子vdwrky70的编码核苷酸序列如序列表seqidno.1所示,其长度为931bp。
本发明还提供一种刺葡萄转录因子vdwrky70在培育植物抗性品种中的应用。
进一步地,所述植物抗性品种为植物抗pstdc3000品种。
进一步地,所述植物抗性品种为拟南芥抗pstdc3000品种。
进一步地,培育拟南芥抗pstdc3000品种的方法如下:应用农业生物技术方法,将刺葡萄转录因子vdwrky70转化入拟南芥细胞,得到表达vdwrky70的转基因型拟南芥,在表达vdwrky70的转基因型拟南芥上接种pstdc3000,几天后,采用实时荧光定量pcr技术分析转录因子vdwrky70基因的相对表达量,对比野生型拟南芥,相对表达量较高的为拟南芥抗pstdc3000品种。
进一步地,所述实时荧光定量pcr技术中采用的引物如下:
上游引物vdwrky70-f:5’-atggcaaccaaacaggtccagat-3’;
下游引物vdwrky70-r:5’-ggcgttgctatcatcttgattgttt-3’。
进一步地,所述实时荧光定量pcr技术中采用的内参基因如下:
atactin-f:gaaatcacagcacttgcacc;
atactin-r:aagcctttgatcttgagagc。
相比现有技术,本发明的有益效果在于:
1.转录因子vdwrky70基因能增强拟南芥对白腐菌、白粉菌及pstdc3000的抗性,本发明通过在转基因型拟南芥和野生型拟南芥上依次接种白腐菌、白粉菌或pstdc3000,通过表型观察、数量性状统计、台盼蓝染色观察及实时荧光定量pcr技术,发现转基因型拟南芥对白腐菌、白粉菌或pstdc3000有一定地抗性,因此可以培育出拟南芥抗白腐菌、白粉菌及pstdc3000品种。
2.本发明通过将转录因子vdwrky70与其他已知植物wrky70及拟南芥第ⅲ族所有wrky基因的聚类分析,得出vdwrky70和fcwrky70、cawrky70、atwrky70、atwrky54、clwrky70在功能上具有一定的相似性,也说明了vdwrky70在生物胁迫和非生物胁迫中的作用与这几个基因具有一定的相似性。另外通过亚细胞定位技术,将vdwrky70蛋白定位在转基因型拟南芥的细胞核中,因此本发明为深入了解转录因子vdwrky70在刺葡萄体内的生化特征及生理功能奠定基础。
附图说明
图1为本发明实施例三中转基因型拟南芥和野生型拟南芥接种白腐菌后的表型观察对比图。
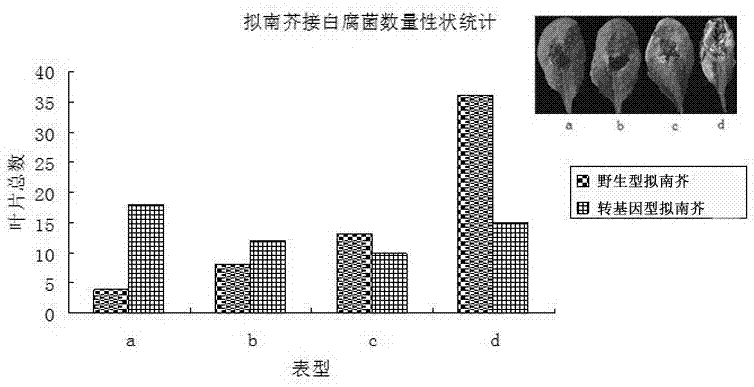
图2为本发明实施例三中转基因型拟南芥和野生型拟南芥接种白腐菌后的数量性状统计对比图。
图3为本发明实施例三中转基因型拟南芥和野生型拟南芥接种白腐菌后进行台盼蓝染色的抗病情况示意图。
图4为本发明实施例三中转基因型拟南芥和野生型拟南芥接种白腐菌后在不同时期转录因子vdwrky70的表达状况示意图。
图5为本发明实施例四中转基因型拟南芥和野生型拟南芥接种白粉菌后的表型观察对比图。
图6为本发明实施例四中转基因型拟南芥和野生型拟南芥接种白粉菌后的数量性状统计对比图。
图7为本发明实施例四中转基因型拟南芥和野生型拟南芥接种白粉菌后进行台盼蓝染色的抗病情况示意图。
图8为本发明实施例四中转基因型拟南芥和野生型拟南芥接种白粉菌后在不同时期转录因子vdwrky70的表达状况示意图。
图9为本发明实施例五中转基因型拟南芥和野生型拟南芥接种pstdc3000后的表型观察对比图。
图10为本发明实施例五中转基因型拟南芥和野生型拟南芥接种pstdc3000后的数量性状统计对比图。
图11为本发明实施例五中转基因型拟南芥和野生型拟南芥接种pstdc3000后进行台盼蓝染色的抗病情况示意图。
图12为本发明实施例五中转基因型拟南芥和野生型拟南芥接种pstdc3000后在不同时期转录因子vdwrky70的表达状况示意图。
图13为本发明转录因子vdwrky70与其他已知植物wrky70及拟南芥第ⅲ族所有wrky基因的聚类分析图。
图14为本发明转录因子vdwrky70在拟南芥中的亚细胞定位图。
具体实施方式
以下实施例用于说明本发明,但不用来限定本发明的保护范围。若为特别指明,实施例中所用技术手段为本领域技术人员所熟知的常规手段。
lb培养基(以1l为单位)配制:在10g的tryptone(胰蛋白胨)、5g的yeastextract(酵母提取物)、10g的nacl中加800ml去离子水,充分搅拌溶解,用koh调ph至7.0,加去离子水将培养基定容至1l加入到15g的琼脂,灭菌。
pda培养基的配制(以1l为单位):取200g土豆去皮,切块儿,用八层纱布过滤,加20g葡萄糖定容至1l,倒入加15g琼脂的锥形瓶中,灭菌。
实施例一转录因子vdwrky70的克隆
1.1引物设计
采用同源克隆法,根据ncbi中的vvwrky70基因,序列使用vectornti11中的primerfind设计引物克隆mrna序列,序列为:
vdwrky70f:atgcactgcacctggtcggaaa
vdwrky70r:acactcaaaccgataaaacatcatc
1.2rna提取
选取‘刺葡萄0943’的幼嫩叶片,利用bioteke植物rna提取试剂盒提取植物总rna。使用thermoscientificnanodrop1000微量紫外可见光分光光度计测量浓度并经琼脂糖凝胶电泳确定rna的完整性。利用takara公司的rr047反转录试剂盒得到cdna的第一条链。
1.3pcr扩增
pcr扩增使用neb的phusiontm超保真酶扩增,反应体系为:hfbuffer10μl,2.5mmol/l的dntps2.5μl,模板2μl,上下游引物(10mmol/l)各2.5μl,phusiontm超保真酶0.5μl,双蒸水补至50μl。pcr反应程序为:98℃预变性3min;98℃变性10s,58℃退火10s,72℃延伸30s,共31个循环;最后72℃延伸10min,4℃保存。
1.4胶回收
pcr产物用2%的琼脂糖胶跑电泳,用天根的琼脂糖胶回收试剂盒进行胶回收。之后将纯化后的产物用takara的extaqtm聚合酶加a,反应体系:10xbuffer2μl,2.5mmol的mg2+2μl,2.5mmol/l的dntps2μl,模板14μl。反应程序:72℃反应10min。
1.5ta克隆连载体
参照pgemt-easytm载体构建说明书构建vdwrky70-t载体,转化e.colidh5α大肠杆菌进行蓝白斑筛选,挑单克隆送生工生物工程(上海)股份有限公司测序,测序结果使用vectornti拼接比对,得到转录因子vdwrky70的编码核苷酸序列如序列表seqidno.1所示,其长度为931bp。
实施例二拟南芥超表达载体的构建
拟南芥选取哥伦比亚型拟南芥;pcr扩增模板使用测序验证过的t质粒;植物表达载体选用pcambia1303;农杆菌菌株为lba4404;neb的ncoⅰ和bsteⅱ内切酶,axygen小量质粒提取试剂盒购于郑州博美公司;1/2ms、潮霉素b、卡那霉素等购于郑州宝赛生物公司;peg4000、cellulaser10、mecerozymr10、mannitol、氯化钾、mes、bsa、0.45μm滤头等购于郑州超研生物公司。
拟南芥原生质体制备转化参考maasc的方法(maasetal,1995),使用激光共聚焦显微镜观察转化培养好的拟南芥原生质体。核定位信号分析预测使用nucpre(http://www.sbc.su.se/~maccallr/nucpred/cgi-bin/single.cgi)。
农杆菌lba4404感受态制备:在含有50mg/l利福平的lb固体培养基上划板,挑取单胞在含有50mg/l利福平的lb液体培养基中摇菌48h至菌液浑浊,按1:100比例接种到50ml新鲜的含有50mg/l利福平的lb液体培养基上摇菌5h。将菌液置于冰上冰浴30min,4℃,5000g离心5min;弃上清加入1ml0.1%的氯化钙悬浮,冰浴5min,4℃,5000g离心5min;弃上清加入800μl0.02%的氯化钙重悬浮,分装8管每管100μl冰浴备用。
制备好的农杆菌感受态中加入2μg需要转化的质粒,混匀,液氮速冻1min,37℃水浴5min,加入1mllb液体培养基,28℃,200rpm,摇菌5h。离心浓缩涂到含有50mg/l利福平和50mg/l的卡那霉素的lb平板上,28℃培养48h,挑取单菌落验证。
拟南芥种植条件为22℃,16h光照,8h黑暗,转化前两天浇足水。转化的农杆菌摇菌至od值为2.0左右,5000g室温浓缩离心5min,弃上清加10%的蔗糖溶液重悬浮,5000g室温离心5min加10%的蔗糖溶液重悬浮至od1.0,添加sillwetl-77至终浓度0.02%。选择拟南芥花刚露白时转化,将花序浸泡到农杆菌菌液中1min,取出用滤纸沾吸茎上多余的菌液。22℃黑暗条件下放置两天,注意保湿,隔7天再转化一次。转化后三周左右,待果夹成熟收取种子。
干燥的种子放在2mlep管中加入900μl含0.2%的吐温20的70%的乙醇摇9min。弃上清加入90%的乙醇洗3遍,最后用100%乙醇悬浮倒在灭菌的滤纸上干燥。配置1/2ms培养基,倒板前添加潮霉素b至终浓度25mg/l。将灭菌的拟南芥种子均匀的洒在1/2ms培养基上,密封放4℃冰箱中两天再转到22℃培养箱中培养,一周后观察筛选结果,可以正常生长为转基因型拟南芥阳性植株。
实施例三拟南芥中转录因子vdwrky70基因对白腐菌的反应
3.1表型观察
选取生长状况良好的转基因型拟南芥和野生型拟南芥,采用针刺法接白腐菌(whiterot),七天后分别观察其表型,结果如图1所示,其中a1为野生型拟南芥侵染白腐菌的抗病情况,a2为转基因型拟南芥侵染白腐菌的抗病情况。从图1中可以看出,野生型拟南芥比转基因型拟南芥侵染更严重。
七天后,根据转基因型拟南芥和野生型拟南芥中叶片侵染白腐菌的四种程度状况进行数量性状统计,结果如图2所示。从图2中也可以看出,转基因型拟南芥比野生型拟南芥的抗白腐菌能力更强。
3.2台盼蓝染色观察
对接种白腐菌0h、24h、48h、72h、96h的叶片进行台盼蓝染色,放入加有染色液的50ml离心管中,95℃水浴3min,室温静置几个小时或过夜。用水合氯醛洗涤,低速震荡,使其褪色,换液2~3次,等对照(无细胞死亡的叶片)脱色完全,用60%甘油保存。在显微镜下观察转基因型拟南芥和野生型拟南芥的抗病情况,结果如图3所示,其中b1为野生型拟南芥叶片进行台盼蓝染色的抗病情况,b2为转基因型拟南芥叶片进行台盼蓝染色的抗病情况。从图3中可以看出,接菌48h,野生型拟南芥已有少量的细胞坏死的情况;接菌72h,野生型拟南芥有大面积的细胞坏死情况,而转基因型拟南芥的细胞坏死面积明显小很多,说明vdwrky70基因具有一定地抗白腐菌的能力。
3.3拟南芥中转录因子vdwrky70基因对白粉菌的反应
3.3.1总rna提取及纯化
分0h、24h、48h、72h、96h采叶片,用液氮冷冻之后,-80℃保存。采用ctab法,将研磨碎的转基因型拟南芥叶片加入2ml无rna酶的ep管里,迅速加入1mlctab提取液,20μl的β-巯基乙醇,震荡混匀,65℃水浴15min,期间颠倒1-2次。加200μl氯仿-异戊醇(氯仿:异戊醇=24:1),上下颠倒,混匀5min,4℃条件12000rpm离心10min,吸上清于新离心管,加等体积的氯仿,震荡5min。4℃条件下,12000rpm离心10min,吸取上清于新离心管,加1/3至1/4体积1mol/l的licl,-20℃沉淀过夜。4℃条件下,12000rpm离心30min,弃上清,沉淀用500-700μl的75%乙醇洗涤,重复2次。晾干沉淀5-8min,用50μl无rnase(depc水)溶解沉淀。rna纯化,参照taktra公司dnaseⅰ操作说明。之后在pcr仪中37℃条件下30min。加540μldepc水,加等体积600μl氯仿,震荡摇匀3-5min,12000rpm离心10min,取上清(约500μl),加两倍体积无水乙醇,-70℃沉淀30-60min。12000rpm离心10min(4℃),弃上清,沉淀用500μl的75%乙醇洗涤,重复2次。晾干沉淀5-8min,使乙醇完全挥发,用适量无rnase的depc水溶解rna,-80℃保存。
3.3.2cdna合成
以提取、纯化得到总rna为模板,参照takara公司的primescriptrtreagentkitwithgdnaeraser(perfectrealtime)的使用方法进行葡萄cdna第一链合成。
3.3.3引物序列
根据vdwrky70基因序列使用vectornti11中的primerfind设计引物:
上游引物vdwrky70-f:5’-atggcaaccaaacaggtccagat-3’;
下游引物vdwrky70-r:5’-ggcgttgctatcatcttgattgttt-3’;
内参基因:
atactin-f:gaaatcacagcacttgcacc;
atactin-r:aagcctttgatcttgagagc。
3.3.4实时定量pcr
用roche公司的lightcycler®480sybrgreenimaster试剂盒进行操作,反应体系为:lightcycler®480sybrgreenⅰ:10μl,上游引物和下游引物各0.5μl,cdna模板2μl,无菌水4μl。反应条件为95℃预变性5min;95℃变性20s,60℃20s,72℃延伸20s,共45个循环。每个处理三个生物学重复,每个时间点的荧光值有三个技术重复,取均值。数据分析采用相对定量的方法。最后采用2-△△ct方法分析基因相对表达量,结果如图4所示。
从图4可以看出,野生型拟南芥接种白腐菌后转录因子vdwrky70几乎不表达,转基因型拟南芥表达量逐渐升高,72h达到最高峰,而后降低,说明转录因子vdwrky70基因受白腐菌的诱导。
实施例四拟南芥中转录因子vdwrky70基因对白粉菌的反应
4.1表型观察
选取生长状况良好的转基因型拟南芥和野生型拟南芥,采用针刺法接白粉菌(powderymildew),八天后分别观察其表型,结果如图5所示,其中c1为野生型拟南芥侵染白粉菌的抗病情况,c2为转基因型拟南芥侵染白粉菌的抗病情况。从图5中可以看出,野生型拟南芥比转基因型拟南芥侵染更严重。
八天后,根据转基因型拟南芥和野生型拟南芥中叶片侵染白腐菌的四种程度状况进行数量性状统计,结果如图6所示。从图6中也可以看出,转基因型拟南芥比野生型拟南芥的抗白粉菌能力更强。
4.2台盼蓝染色观察
对接种白粉菌0d、1d、2d、3d、4d叶片进行台盼蓝染色,放入加有染色液的50ml离心管中,95℃水浴3min,室温静置几个小时或过夜。用水合氯醛洗涤,低速震荡,使其褪色,换液2~3次,等对照(无细胞死亡的叶片)脱色完全,用60%甘油保存。在显微镜下观察转基因型拟南芥和野生型拟南芥的抗病情况,结果如图7所示,其中d1为野生型拟南芥叶片进行台盼蓝染色的抗病情况,d2为转基因型拟南芥叶片进行台盼蓝染色的抗病情况。从图7可以看出,接菌1d,野生型拟南芥已有少量的细胞坏死的情况,接菌第3d,野生型拟南芥有大面积的细胞坏死情况,而转基因型拟南芥的细胞坏死面积明显小很多,说明vdwrky70基因具有一定地抗白粉菌的能力。
4.3拟南芥中转录因子vdwrky70基因对白粉菌的反应
总rna提取及纯化、cdna合成、引物序列、实时定量pcr的步骤与实施例一中1.3.1~1.3.4相同,所用引物与实施例一中1.3.3相同,在此不再赘述,结果如图8所示。
从图8可以看出,野生型拟南芥接种白粉菌后转录因子vdwrky70几乎不表达,转基因型拟南芥表达量逐渐升高,3d达到最高峰,而后逐渐降低,说明转录因子vdwrky70基因受白粉菌的诱导。
实施例五拟南芥中转录因子vdwrky70基因对pstdc3000的反应
5.1表型观察
先将保存的pstdc3000用加rif的lb培养基活化,用枪头挑适量pstdc3000菌株(p.syringaepv.tomatodc3000)),直接打入已灭菌的摇菌管中,放入摇床中(超净工作台操作)摇14h左右。之后,将摇菌管放入离心机中,离心力2500g,10min离心收集菌体。重复上个步骤。用10mmmgcl2稀释100倍至od600≈0.002,用注射器头注射叶片背面(使整个叶片浸湿),用注射mgcl2的叶片做空白对照,观察叶片发病情况,结果如图9所示,其中e1为野生型拟南芥侵染pstdc3000的抗病情况,e2为转基因型拟南芥侵染pstdc3000的抗病情况。从图9可以看出,转基因型拟南芥和野生型拟南芥分别接种pstdc3000,野生型拟南芥比转基因型拟南芥侵染更严重。
五天后,根据转基因型拟南芥和野生型拟南芥中叶片侵染白腐菌的五种程度状况进行数量性状统计,结果图10所示。从图10可以看出,转基因型拟南芥比野生型拟南芥抗pstdc3000能力更强。
5.2台盼蓝染色观察
对接种pstdc3000的叶片进行台盼蓝染色,,放入加有染色液的50ml离心管中,95℃水浴3min,室温静置几个小时或过夜。用水合氯醛洗涤,低速震荡,使其褪色,换液2~3次,等对照(无细胞死亡的叶片)脱色完全,用60%甘油保存。在显微镜下观察转基因型拟南芥和野生型拟南芥的抗病情况,结果如图11所示,其中f1为野生型拟南芥叶片进行台盼蓝染色的抗病情况,f2为转基因型拟南芥叶片进行台盼蓝染色的抗病情况。从图11可以看出,接菌6h,野生型拟南芥和转基因型拟南芥都有少量的细胞坏死的情况,接菌12h,野生型拟南芥的细胞坏死情况比转基因型拟南芥较为严重,说明vdwrky70基因具有一定地抗pstdc3000的能力。
5.3拟南芥中转录因子vdwrky70基因对pstdc3000的反应
分0d(注射前)、0d(注射后)、1d、2d、3d采叶片,用液氮迅速冷冻,-80℃保存。总rna提取及纯化、cdna合成、引物序列、实时定量pcr的步骤与实施例一中1.3.1~1.3.4相同,所用引物与实施例一中1.3.3相同,在此不再赘述,结果如图12所示。
从图12可以看出,野生型拟南芥接种白粉菌后转录因子vdwrky70几乎不表达,转基因型拟南芥表达量逐渐升高,12h达到最高峰,而后逐渐降低,说明转录因子vdwrky70基因受pstdc3000的诱导。
实施例六转录因子vdwrky70与其他已知植物wrky70及拟南芥第ⅲ族所有wrky基因的聚类分析
利用‘刺葡萄0943’中vdwrky70、模式植物拟南芥、金柑(fortunellacrassifolia)vdwrky70、甜辣椒(capsicumannuum)cawrky70、西瓜(citrulluslanatus)clwrky70、小麦(triticumaestivum)tawrky70、陆地棉(gossypiumhirsutum)ghwrky70、玉米(zeamays)zmwrky70、水稻(oryzasativa)oswrky70、模式植物拟南芥(arabidopsisthaliana)atwrky70以及拟南芥第ⅲ族所有wrky基因蛋白序列构建系统发育树,以分析wrky基因家族成员的进化关系。首先使用mega7.0软件的clustal程序对氨基酸序列进行多重序列联配,将clustal多序列联配的结果输出到mega7.0软件中,利用mega7.0软件构建了邻接树,并利用bootstrapmethod检验1000次对这些进化树进行置信度分析,结果如图13所示。
参见图13,该进化树分为四大类,其中vdwrky70和fcwrky70、cawrky70、atwrky70、atwrky54、clwrky70聚在一起。而烟草和柠檬中过表达的fcwrky70使两者的抗干旱胁迫的能力增强。此外,fcwrky70通过调节精氨酸脱羧酶(adc)的表达促进腐胺的产生。cawrky70在青枯病(r.solanacearun)、辣椒疫霉病(p.capsici)和烟草花叶病毒(tmv)的作用下诱导表达。过表达atwrky70导致sa诱导pr基因的表达,从而增加抗铜绿假单胞菌、软腐病、黄瓜白粉病能力,但抑制sa介导的抗黑斑病菌的能力。atwrky70和atwrky54共同作用,在非生物胁迫中增强拟南芥渗透胁迫的耐受性。沉默slwrky70减轻mi-1-介导的抗马铃薯蚜虫、根结线虫病的能力。从图13可以看出,vdwrky70和fcwrky70、cawrky70、atwrky70、atwrky54、clwrky70在功能上具有一定的相似性,说明vdwrky70在生物胁迫和非生物胁迫中的作用与这几个基因具有一定的相似性。
实施例七转录因子vdwrky70的亚细胞定位
蛋白质是生物功能的直接体现者,蛋白质的分布和调控与植物个体的生长、发育密切相关。因此,了解该过程中的蛋白质亚细胞定位对了解植物的生命进程十分必要。vdwrky70是与葡萄抗病相关的基因,因此了解vdwrky70在植物中的表达部位,对于了解该基因在葡萄中的抗病机理具有十分重要的作用。
由武汉伯远生物科技有限公司,通过克隆vdwrky70开放阅读框序列,利用绿色荧光蛋白基因(gfp)为报告基因,构建融合表达的细胞定位检测载体pbwa(v)hs-wrky70-glosgfp,将上述载体进行拟南芥原生质体转化,具体步骤如下:取25℃左右培养7~15天转基因型拟南芥拟南芥幼苗若干,加入5~10ml酶解液(1.5%cellulaser10,0.75%macerozymer10,0.6mmannitol,10mmmesph=5.7,10mmcacl2and0.1%bsa)。全部浸泡组织为宜,28℃缓慢震荡(100rpm)酶解5~6h。40μm滤网过滤后50g离心5min,去上清,用预冷w5(154mmnacl,125mmcacl2,5mmkcland2mmmesph5.7)溶液10ml洗涤2次,50g离心5min,离心温度4~25度均可。加入500μlmmg(0.4mmannitol,15mmmgcl2and4mmmesph=5.7)溶液悬浮。取200μl原生质体悬液加入10μl质粒dna、210μl的peg溶液[40%(w/v)peg4000,2mmannitoland0.1mcacl2],均匀混合。室温静置30min。用1ml的w5溶液稀释终止反应。50g离心5min收集原生质体。加入1mlw5溶液洗1~2次。最后加入1mlw5溶液,28℃暗培养24~48h,通过共聚焦激光扫描显微镜观察vdwrky70在拟南芥中的表达部位,同时观察野生型拟南芥的原生质体,结果如图14所示,其中g1为野生型拟南芥的亚细胞定位图,g2为转基因型拟南芥的亚细胞定位图。从图14可以看出,没有导入目的基因的野生型拟南芥原生质体,整个原生质体内都有绿色荧光,而导入目的基因的转基因型拟南芥原生质体,只有在细胞核中有绿色荧光,说明vdwrky70蛋白定位在转基因型拟南芥的细胞核中,此举为深入了解转录因子vdwrky70在刺葡萄体内的生化特征及生理功能奠定基础。
以上所述之实施例,只是本发明的较佳实施例而已,仅仅用以解释本发明,并非限制本发明实施范围,对于本技术领域的技术人员来说,当然可根据本说明书中所公开的技术内容,通过置换或改变的方式轻易做出其它的实施方式,故凡在本发明的原理及工艺条件所做的变化和改进等,均应包括于本发明申请专利范围内。
sequencelisting
<110>中国农业科学院郑州果树研究所
<120>刺葡萄转录因子vdwrky70及其在培育植物抗性品种中的应用
<130>2017.9.30
<160>7
<170>patentinversion3.3
<210>1
<211>931
<212>dna
<213>人工序列(vdwrky70)
<400>1
atggagtgcacctggtcggaaaagatctccggcgatcggaaaagagccatcgacgagctg60
cttcgaggtcgctccatcaccaagcagcttcgcagcgtcctcgtcggaggggatcaacag120
gagtcgacccaggatcttctagcgaaaatcttgaggtcattcaccgacactctttctata180
ttgaattccggcgagtccgacgaggccgtctcacagattccggcgagtggtcagctgtat240
tcgccgggttggcatggccggaggtcggaggaatcttgcgagagtggtaagagttccacc300
aaggatcgcaggggctgttacaagcgaaggaagaattcgcaatcttggatcagaatcacc360
cctaattttcacgatgacggttatgcctggcggaagtacggacaaaaagtcatactcaat420
gctaaacatcaaagaagctactataggtgcacccacaagcatgaccagggctgcatggca480
accaaacaggtccagatgactgaagaggagcccccaatgtacaaaaccacataccacggc540
cagcacacatgcaaaagcatgctgaagtcatctcagattatggtggaaaattctactgca600
agagattcttccattctgctcagctttgaatcaaacaatcaagatgatagcaacgccttt660
ttctcatcattccccttgataaaacaagaggaagagatcccaaatgatgatcaggaggtg720
acctacaataaccataccaataacaacaacaagaacaacaactcctcatcctctgattat780
cttctgtcactggagctcaccacatttgaatccaatctggggtctgatcatggcgatgtc840
ctttctggggttaactcttcttgtacggacagcactcacagtttggatgatatgatgatg900
gactttgatgatgtttttatcggttttgagt931
<210>2
<211>22
<212>dna
<213>人工序列(vdwrky70f)
<400>2
atgcactgcacctggtcggaaa22
<210>3
<211>25
<212>dna
<213>人工序列(vdwrky70r)
<400>3
acactcaaaccgataaaacatcatc25
<210>4
<211>23
<212>dna
<213>人工序列(上游引物vdwrky70-f)
<400>4
atggcaaccaaacaggtccagat23
<210>5
<211>25
<212>dna
<213>人工序列(下游引物vdwrky70-r)
<400>5
ggcgttgctatcatcttgattgttt25
<210>6
<211>20
<212>dna
<213>人工序列(atactin-f)
<400>6
gaaatcacagcacttgcacc20
<210>7
<211>20
<212>dna
<213>人工序列(atactin-r)
<400>7
aagcctttgatcttgagagc20
- 还没有人留言评论。精彩留言会获得点赞!