一种引达省A‑D‑A型小分子化合物及其制备方法与流程
本发明属光电功能材料领域,具体涉及一种引达省a-d-a型小分子化合物及其制备方法,以及该类分子作为光活性层中的n型材料在有机光伏(opv)器件中的应用。
背景技术:
太阳能电池是一种能将太阳能直接转化为电能的光电器件,其中有机太阳能电池拥有成本低、重量轻、柔性、可溶液加工并且可以大面积制备等优点,已经成为光伏研究中最为活跃的领域之一,发展迅速,当前该领域研究的焦点是开发高效的给体和受体材料作为光活性层,应用于器件中来提高器件光电转换效率。目前光活性层材料的研究前期主要集中于富勒烯及其衍生物,但是富勒烯及其衍生物有一定缺点,如可见光区吸收较弱、能级调控困难、溶解度差不利于纯化等[g.li,r.zhu,y.yangnat.photonics2012,6,153.]。近年来,非富勒烯类小分子电子受体材料因为其能级可调、合成简便、制作成本低、溶解性能优异等吸引了众多关注,主要有基于酰亚胺、芴基衍生物、苯噻唑、吡咯并吡咯二酮、并五苯等新型n-型电子受体材料用于光伏电池,此类材料在太阳光光谱中比富勒烯及其衍生物材料具有更宽的吸收范围。但是大多此类材料在制作opv器件时有能隙较宽、电荷传输速率较低、薄膜形态不易调控等缺点。2015年zhan等[j.mater.chem.a.2015,3:1910]合成了基于二噻吩并引达省受体分子,稠环有利于π共轭框架的延伸,得到高的电子迁移率,且这类分子的推拉结构,能诱导更高效的分子内电荷转移,从而拓宽材料的吸收光谱,其与窄带系的给体聚合物材料ptb7-th共混,器件效率达到了6.31%。目前小分子受体材料研发与富勒烯受体材料已经旗鼓相当,用于制备光伏器件取得了理想的转换效率,作为电子受体用于制备有机光伏电池,其性能已经达到甚至超越富勒烯类电子受体。
为了进一步拓宽这类a-d-a型小分子的吸收波段,hou等人报道了具有近红外吸收特性的a-d-a型非富勒烯受体材料[adv.mater.2016,28,8283-8287],由于这类材料的吸收光谱处于近红外波段,难以找寻吸收光谱匹配性好的单一聚合物给体材料与之形成光谱互补,应用于两元共混的单层有机光伏电池中取得的光电转换效率一般小于10%,通过引入第二种聚合物给体或者第二种受体材料的方法实现光谱匹配,能够将光电转换效率进行提升。但是第三组分的引入使得调节活性层形貌和结晶性、三元组分表界面以及能级匹配等较为复杂,也增加了电池制备工艺的难度。
技术实现要素:
针对现有技术存在的缺陷或不足,本发明提供一种引达省a-d-a型小分子化合物,以满足光伏电池光活化层电子受体材料的需要,这种结构可以实现对光电性能的调节,以满足光伏电池光活化层电子受体材料的需要,将其用于高效有机光伏电池,利用位阻效应、取代基的推拉电子特性等,调节材料的homo和lumo能级以及光谱吸收范围,实现器件光电转换效率的提升。
为了实现上述任务,本发明设计的引达省a-d-a型小分子化合物通式结构如下:
其中,r1独立地为氢原子、碳原子数为1~20的烷基、碳原子数为1~20的烷氧基、碳原子数为1~20的烷基酯基,r2独立地为碳原子数为1~20的烷基、碳原子数为1~20烷基或烷氧基取代的苯基、碳原子数为1~20烷基或烷氧基取代的噻吩基,其中拉电子单元a1及a2为独立自选如下结构之一:
a1及a2结构中r3为碳原子数为1~12的烷基。
上述引达省a-d-a型小分子化合物,制备采用如下所示的反应方程式进行:
具体合成步骤如下:
将带有r2取代基茚并噻吩稠环有机锡试剂,与带有r1取代基的5-溴-3-噻吩甲醛,加入到反应器中,氩气保护下加入5%-10%的催化剂四(三苯基膦)钯,以甲苯为溶剂,回流12-24h,反应结束后,萃取干燥并过滤,浓缩滤液得到固体,通过柱层析提纯即可制备相应茚并噻吩稠环双醛,然后将上述茚并噻吩稠环双醛与4-6倍量的拉电子a单元单体在氯仿溶液中加入吡啶回流6-12小时,氯仿萃取,甲醇沉降,硅胶柱层析,氯仿洗脱,即可得到产物,或将上述茚并噻吩稠环双醛与1-1.5倍量的含有a1单元拉电子单体在氯仿溶液加入一定量吡啶回流8-12小时,柱层析纯化得到中间体再与2-4倍量的含有a2单元拉电子单体在氯仿溶液加入吡啶回流6-12小时,氯仿萃取,甲醇沉降,硅胶柱层析,氯仿洗脱,即可得到式ⅰ所示的引达省a-d-a型小分子化合物。
本发明的优选方案,r1为碳原子数为1~20的烷基,碳原子数为1~20的烷氧基,或碳原子数为1~20的烷基酯基;r2碳原子数为1~20的4-烷基苯基,或碳原子数为1~20的烷基,或碳原子数为1~20的5-烷基噻吩基,或碳原子数为1~20的4-烷氧基苯基。
本发明所述的引达省a-d-a型小分子化合物,可作为光活性层材料,应用于有机光伏电池的制备。
本发明的有益效果:本发明将缺电子单元引入到桥联噻吩环的4位,在分子主链上引入了一定的扭曲,有效调节材料的吸收光谱和能级。这类引达省a-d-a型小分子化合物具有宽幅可调的光谱吸收、强的吸光系数,较好的电荷传输性能以及合适的分子轨道能级,与光学带隙为1.7~1.9ev的聚合物电子给体共混,制作单层两元光伏器件,光电转换效率>10%。这些宽带隙的聚合物电子给体包括基于双氟苯并三唑的d-a型给体聚合物、基于噻唑并噻唑的d-a型给体聚合物、基于苯并[1,2-c:4,5-c']二噻吩-4,8-二酮的d-a型给体聚合物等。
附图说明
图1为本发明实施例1的化合物a1的吸收光谱图。
图2为本发明实施例1的化合物a1与聚合物j52的i-v曲线;
具体实施方式
以下给出本发明的具体实施例,需要说明的是本发明并不局限于以下具体实施例,凡在本申请技术方案基础上做的等同变换均落入本发明的保护范围。
实施例1:化合物a1的合成:
合成路线如下:
scheme.1化合物a1的合成路线
(1)化合物3的合成:
100ml三口瓶中加入1化合物616mg/0.5mmol,5-溴-3-(2-乙基-己氧基)噻吩甲醛478mg/1.5mmol,pd(pph3)440mg,甲苯30ml,氮气保护下开启加热,回流14h,产物萃取、洗涤、柱层析(正己烷:乙酸乙酯=100:1),得到540mg化合物3(液相含量>99%),产率76%。1hnmr(500mhz,cdcl3),δ9.93(s,2h),7.42(s,2h),7.25(s,2h),7.16(d,8h),7.09(d,8h),6.86(s,2h),4.05(d,4h),2.57(t,8h),1.76(m,2h),1.60-1.42(m,16h),1.34-1.27(m,32h),0.95-0.86(m,24h).13cnmr(125mhz,cdcl3),δ180.24,164.72,157.18,153.87,146.60,143.00,141.92,141.07,139.08,135.22,128.51,127.77,121.78,119.31,117.75,111.17,74.50,63.11,39.48,35.55,31.69,31.31,30.38,29.12,29.00,23.79,22.95,22.57,14.07,14.03,11.11.anal.calcdfor(c90h110o4s4):c78.10,h8.01,found:c78.52,h7.92.
(2)化合物a1的合成:
取896mg上述化合物3,730mg化合物a,置于100ml三口瓶中,溶于50ml氯仿中,然后加入1.5ml吡啶,加热回流12h,停止加热中止反应,冷却、萃取、洗涤、甲醇沉降,将萃取液滴加到甲醇中沉降,过滤之后将所得固体柱层析纯化,氯仿洗脱,得到黑色固体765mg,产率68%,液相含量>99%。1hnmr(500mhz,cdcl3),δ9.13(s,2h),8.51(dd,2h),7.61(t,2h),7.53(s,2h),7.49(s,2h),7.17(d,8h),7.12(d,8h),6.91(s,2h),4.16(m,4h),2.60(t,8h),1.90(m,2h),1.62-1.53(m,16h),1.34-1.29(m,32h),0.97-0.86(m,24h).13cnmr(125mhz,cdcl3),δ186.63,169.96,158.69,158.42,154.68,154.08,145.95,142.21,140.67,139.30,135.68,134.24,132.83,128.68,127.78,123.86,118.25,117.38,117.18,115.14,114.58,109.15,75.86,67.35,63.21,39.30,35.59,31.75,31.35,30.02,29.12,28.95,23.45,23.01,22.60,14.10,10.92.anal.calcdfor(c114h114f4n4o4s4):c75.71,h6.35.found:c75.60,h6.67.
化合物a1溶液及薄膜的紫外-可见-近红外吸收光谱如附图1所示。根据比尔朗伯定律,测定的化合物a1的溶液摩尔消光系数为3.89×105m-1cm-1,利用薄膜吸收边(806nm)测试得到的光学能隙为1.54ev。
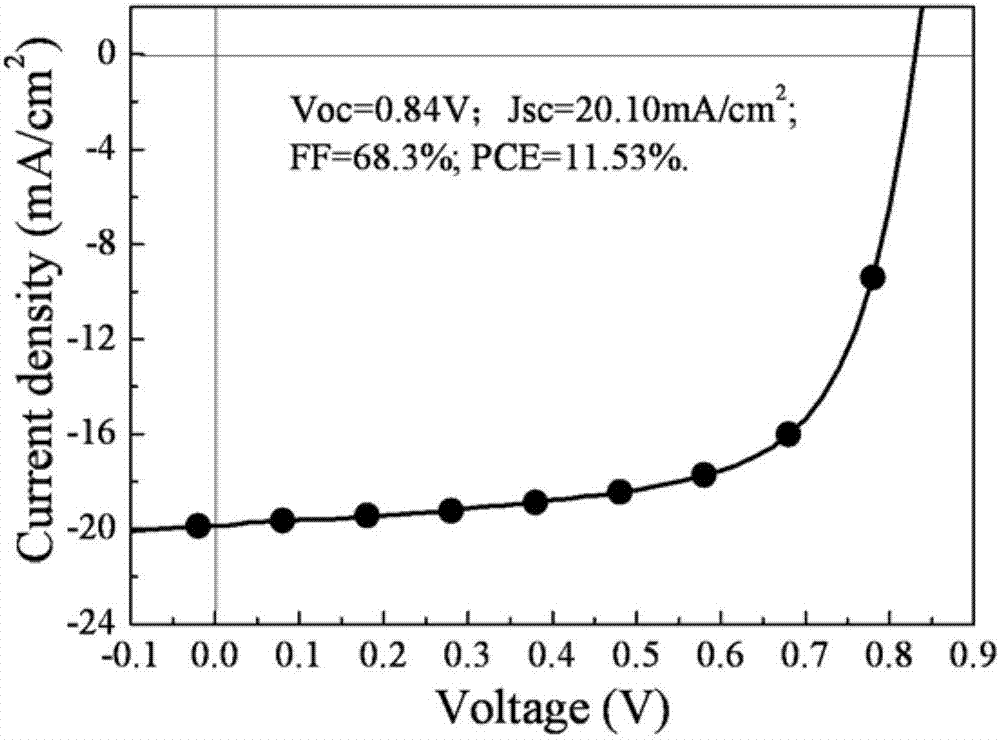
光伏性能研究:采用ito/zno/j52:受体材料/moo3/al的电池结构,将聚合物j52按照一定的重量比与受体材料制成聚合物光伏电池,有效面积0.16cm2,在模拟太阳光源(orielmodel91192;100mw/cm2)下进行电流-电压测试,利用keithley2400源表采集,测得器件的短路电流jsc为20.10macm-2,开路电压voc为0.84v,填充因子68.3%,能量转换效率pce为11.53%。附图2为本发明实施例1化合物a1与j52按照一定的重量比制成聚合物光伏电池的i-v曲线。
j52的结构式如下所示:
实施例2:化合物a2的合成
合成路线如下:
scheme.2化合物a2的合成路线
取605mg上述化合物3,485mg化合物b,置于100ml三口瓶中,溶于40ml氯仿中,然后加入吡啶1.5ml,加热回流6h,停止加热,冷却、萃取、洗涤、将萃取液滴加到甲醇中沉降,过滤之后将所得固体柱层析纯化,氯仿洗脱,得到黑色固体530mg,产率71%,液相含量>99%。1hnmr(500mhz,cdcl3,ppm),δ9.16(s,2h),8.65(d,2h),7.85(d,2h),7.70(m,4h),7.51(d,4h),7.18(d,8h),7.12(d,8h),6.91(s,2h),4.16(m,4h),2.60(t,8h),1.92(m,2h),1.61-1.45(m,16h),1.36-1.29(m,32h),0.98-0.86(m,24h),13cnmr(125mhz,cdcl3),δ188.97,154.50,142.14,140.80,140.12,136.73,134.51,133.67,128.66,127.80,124.91,123.13,118.31.114.82,75.68,63.37,39.32,35.60,31.74,31.35,30.04,29.12,28.97,23.47,23.02,22.60,14.11,10.93.anal.calcdfor(c114h118n4o4s4):c78.85,h6.85.found:c78.52,h6.84.
实施例3:化合物a3的合成
合成路线如下:
scheme.3化合物a3的合成路线
(1)化合物5的合成:
将616mg/0.5mmol化合物4加入100ml三口瓶中,同时加入5-溴-3-(2-乙基-己氧基)噻吩甲醛478mg/1.5mmol,pd(pph3)440mg,甲苯30ml,氮气保护下开启加热,回流14h,产物萃取、洗涤、柱层析(正己烷:乙酸乙酯=100:1),得到540mg化合物5(lc>99%),产率76%。1hnmr(500mhz,cdcl3),δ9.85(s,2h),8.61(s,2h),8.06(s,2h),7.98(s,2h),6.83(d,j=10hz,8h),6.75(d,j=10hz,8h),4.02(d,j=5hz,2h),2.78(t,j=5hz,8h),1.72-1.68(m,16h),1.39-1.27(m,32h),0.95-0.86(m,24h).13cnmr(125mhz,cdcl3),δ182.81,160.18,149.26,147.03,141.78,140.83,136.38,131.74,129.85,128.03,125.49,124.13,114.61,80.24,69.01,35.09,33.69,31.57,29.23,28.76,27.48,25.74,22.60,14.03,10.02.
(2)化合物a3的合成:
取605mg上述化合物5,485mg化合物b,吡啶1.5ml,氯仿40ml,置于100ml三口瓶中,加热回流6h,中止反应,冷却、萃取、洗涤、甲醇沉降,将所得固体过硅胶柱,氯仿洗脱,得到产物甲醇再次沉降,得到黑色固体530mg,产率71%,液相含量>99%。1hnmr(500mhz,cdcl3),δ8.68(s,2h),8.37(d,2h),7.72(d,2h),7.35(m,4h),6.67(s,2h),4.12(q,4h),2.61(t,8h),1.89(m,2h),1.62-1.55(m,16h),1.36-1.29(m,32h),0.96-0.86(m,24h).13cnmr(125mhz,cdcl3),δ185.83,160.18,149.26,147.63,142.10,140.80,140.12,138.91,138.51,137.66,136.92,136.73,134.51,133.67,128.66,127.80,124.91,123.13,114.27,75.68,68.92,39.32,35.60,31.74,31.35,30.04,29.12,28.97,23.47,23.02,22.60,14.11,10.93.
实施例4:化合物a4的合成
合成路线如下:
scheme.4化合物a4的合成路线
(1)化合物7的合成:
将422mg/0.5mmol化合物6加入到100ml三口瓶中,然后加入5-溴-3-(2-乙基-己氧基)噻吩甲醛478mg/1.5mmol,pd(pph3)440mg,甲苯30ml,氮气保护下开启加热,回流12h,产物萃取、洗涤、柱层析(正己烷:乙酸乙酯=100:1),得到化合物7,产率71%。1hnmr(500mhz,cdcl3),δ9.95(s,2h),7.83(s,2h),7.65(s,2h),6.99(s,2h),4.03(d,4h),1.82(m,2h),1.75(t,8h),1.60-1.42(m,16h),1.34-1.27(m,32h),0.95-0.86(m,24h).13cnmr(125mhz,cdcl3),δ180.24,166.62,146.70,145.10,139.08,135.22,128.58,128.50,127.67,124.30,121.88,119.61,75.50,50.12,40.48,35.55,31.69,31.41,30.36,29.42,29.01,23.89,22.87,22.66,14.09,14.05,11.16.
(2)化合物a4的合成
取539mg上述化合物7,485mg化合物b,置于100ml三口瓶中,溶于40ml氯仿中,然后加入吡啶1.5ml,加热回流6h,停止加热,冷却、萃取、洗涤、将萃取液滴加到甲醇中沉降,过滤之后将所得固体柱层析纯化,氯仿洗脱,得到黑色固体,产率69%,液相含量>99%。1hnmr(500mhz,cdcl3,ppm),δ9.12(s,2h),8.53(d,4h),7.85(d,2h),7.68(m,4h),7.51(m,2h),6.98(s,2h),4.05(d,4h),1.86(m,2h),1.73(t,8h),1.60-1.43(m,16h),1.34-1.23(m,32h),0.94-0.87(m,24h).13cnmr(125mhz,cdcl3),δ180.24,165.21,154.50,140.80,140.12,136.73,135.51,134.51,133.67,128.66,127.66,124.91,123.13.121.31,119.54,114.82,75.80,51.21,41.28,35.56,31.68,31.41,30.38,29.39,29.00,23.87,22.79,22.66,14.09,14.03,11.12.
实施例5:化合物a5的合成:
合成路线如下:
scheme.5化合物a5的合成路线
取691mg上述化合物3,115mg化合物a,置于100ml三口瓶中溶于50ml氯仿中,然后加入0.3ml吡啶,加热回流12h,停止加热中止反应,将所得产物柱层析纯化,所得产物加入到50ml三口瓶中溶于30ml氯仿中,然后加入500mg化合物c,以及1.2ml吡啶,加热回流6h,冷却、萃取、洗涤、甲醇沉降,过滤之后将所得固体柱层析纯化,氯仿洗脱,得到黑色固体,产率36%,液相含量>99%。δ9.15(s,2h),8.53(dd,2h),7.59(t,2h),7.48(s,1h),7.43(s,1h),7.15(d,8h),7.11(d,8h),6.96(s,2h),4.15(m,4h),2.63(t,8h),1.91(m,2h),1.62-1.51(m,16h),1.33-1.28(m,32h),0.96-0.88(m,24h).13cnmr(125mhz,cdcl3),δ187.14,169.87,158.73,157.92,155.01,154.08,148.33,145.95,142.21,139.30,135.68,134.24,132.83,128.68,127.69,123.87,118.32,117.29,114.88,109.54,75.99,67.36,63.42,39.73,35.63,31.65,31.38,30.05,29.12,28.96,23.43,23.06,22.63,14.23,10.32.
- 还没有人留言评论。精彩留言会获得点赞!