一种提高毕赤酵母分泌表达菌丝霉素表达量的方法与流程
本发明涉及生物技术和基因工程技术领域,特别涉及一种提高毕赤酵母分泌表达菌丝霉素表达量的方法。
背景技术:
菌丝霉素(plectasin)是从腐生子囊菌假黑盘菌(pseudoplectanianigrella)中分离得到的首例真菌防御素。菌丝霉素对革兰氏阳性细菌具有明显杀伤作用,包括:链球菌属、葡萄球菌属、肠球菌属、棒状杆菌属和杆状菌属。nz2114是菌丝霉素的突变体,包含3个氨基酸突变,与菌丝霉素相比,nz2114突变体对金黄色葡萄球菌的抑制作用提高了30倍。将nz2114基因转化至毕赤酵母得到ple-2工程菌株,该菌株可分泌表达菌丝霉素,表达量达到4.9g/l。制备的菌丝霉素样品对金黄色葡萄球菌、魏氏梭菌、无乳链球菌、诺卡氏菌有明显的抑制作用。具体的菌丝霉素表达菌株构建方法已于2017年10月11日申请中国专利,申请号:201710939331.5,申请名称:《一种表达重组菌丝霉素的毕赤酵母》。
毕赤酵母表达系统是最常用的蛋白表达系统之一,已有上千种蛋白质在毕赤酵母中成功表达,并有多种蛋白质实现工业化生产。毕赤酵母表达系统具有遗传背景清晰、基因操作简便、发酵工艺成熟、蛋白表达水平高、具有翻译后修饰等优点,适合菌丝霉素的大规模生产。菌丝霉素蛋白由3对二硫键形成稳定的空间结构,研究表明这3对二硫键对菌丝霉素的活性至关重要。上述专利通过提高菌丝霉素表达盒的基因拷贝数,从而提高菌丝霉素的表达量。但是蛋白质表达水平超过细胞本身的处理能力时,过量的蛋白质会由于来不及正确折叠(正确形成3对二硫键等)而滞留在内质网中,从而引发未折叠蛋白响应(upr),导致蛋白表达量下降,使菌丝霉素工程菌未能充分发挥其蛋白质分泌表达的能力。目前还没有对菌丝霉素进行蛋白折叠等相关辅助表达的案例报道。
可见,现有技术还有待改进和提高。
技术实现要素:
鉴于上述现有技术的不足之处,本发明的目的在于提供一种提高毕赤酵母分泌表达菌丝霉素表达量的方法,旨在在菌丝霉素毕赤酵母分泌表达工程菌中表达蛋白质二硫键异构酶,促进菌丝霉素的蛋白折叠,减弱未折叠蛋白响应,提高菌丝霉素表达量。
为了达到上述目的,本发明采取了以下技术方案:
一种提高毕赤酵母分泌表达菌丝霉素表达量的方法,包括:
a.以毕赤酵母基因组为模板,扩增蛋白质二硫键异构酶pdi基因,双酶切处理pdi片段,连接至同样经过双酶切处理的载体片段,得到蛋白质二硫键异构酶表达载体;
b.热激转化步骤a得到的表达载体,涂布于lb抗性平板,培养出单菌落,利用验证引物挑单菌落pcr验证阳性转化子,挑取阳性转化子测序,保存正确菌株与甘油管中;
c.单酶切处理蛋白质二硫键异构酶表达载体后,切胶回收线性化表达载体,电转至ple-2菌丝霉素毕赤酵母表达菌株,培养至长出菌丝霉素的表达菌株毕赤酵母的单菌落;
d.挑取步骤c中所述的菌丝霉素的表达菌株毕赤酵母的单菌落,培养评价菌丝霉素的表达,检测发酵上清液的抑菌圈大小,筛选得到pdi菌株;
e.将步骤d筛选得到的pdi菌株接种于bmgy培养基中,培养一级种子液;
f.取步骤e中培养的一级种子液接种于bmgy培养基中,培养二级种子液;
g.将步骤f中的二级种子液接种于含有bsm培养基的发酵罐中,控制温度30℃±0.5℃,溶氧20%±5%,ph=5.0±0.5,基础甘油耗尽后,流加10%甘油,甘油耗尽后直至溶氧上升至90%,饥饿半小时,流加甲醇诱导菌丝霉素表达,共诱导72小时。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的蛋白质二硫键异构酶pdi的基因序列包括如序列表seqidno.1所示的dna序列。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的步骤a中扩增蛋白质二硫键异构酶pdi基因的扩增物分别为:
pdi-f:5’-tattcgaaatgcaattcaactggaatat-3’和
pdi-r:5’-gtgaattcttaaagctcgtcgtgagcgt-3’。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的步骤a中双酶切pdi片段的酶为bstbi和ecori。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的bstbi和ecori酶切处理pdi片段的酶切位点分别是基因的5’端ttcgaa和基因的3’gaattc。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的步骤a中的载体片段为ppic6αa。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的步骤b中挑单菌落pcr验证阳性转化子所使用的验证引物为:
5aox-f:5’-gactggttccaattgacaagc-3’和
3aox-r:5’-gcaaatggcattctgacatcc-3’。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的步骤b中单酶切处理表达载体的内切酶为pmei限制性内切酶。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的步骤c中发酵上清液的抑菌圈的大小的检测采用的指示菌为金黄色葡萄球菌cmcc26003。
所述的提高毕赤酵母分泌表达菌丝霉素表达量的方法中,所述的表达菌丝霉素的毕赤酵母菌株的保藏编号为:gdmccno.60262。
有益效果:
本发明提供了一种提高毕赤酵母分泌表达菌丝霉素表达量的方法,通过在菌丝霉素表达菌株中表达蛋白质二硫键异构酶,促进菌丝霉素的3对二硫键形成正确的空间结构,进而使菌丝霉素顺利分泌表达至细胞外,达到提高菌丝霉素表达量的目的,使用所述方法使菌丝霉素的表达量提高了30%;进一步地,此方法也适用于含有二硫键蛋白质的表达量的提高。
附图说明
图1为本发明提供的所述提高毕赤酵母分泌表达菌丝霉素表达量的方法流程图。
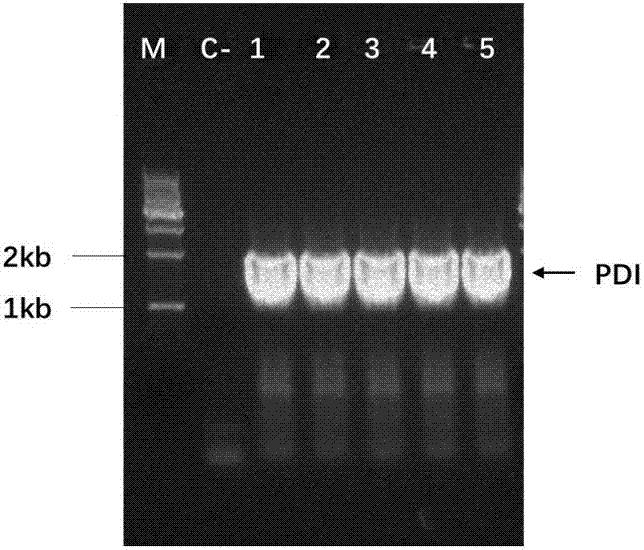
图2为top10/ppic-pdi菌落pcr电泳验证图。
其中,m:1kbplusdnamarker;c-:空菌株对照,e.colitop10,无条带;1-5:筛选菌株验证,扩增条带约1.9kb。
图3为pdi菌株筛选图。
其中,c:原菌丝霉素菌株;x33:毕赤酵母野生型菌株,空白对照;1-46:pdi筛选菌株。
图4为pdi菌株发酵上清液蛋白电泳图。
其中,marker:蛋白标准分子量marker;1:原菌丝霉素菌株;2:pdi菌株
具体实施方式
本发明提供一种提高毕赤酵母分泌表达菌丝霉素表达量的方法,为使本发明的目的、技术方案及效果更加清楚、明确,以下参照附图并举实施例对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
本发明提供一种提高毕赤酵母分泌表达菌丝霉素表达量的方法,包括:
a.以毕赤酵母基因组为模板,扩增蛋白质二硫键异构酶pdi基因,双酶切处理pdi片段,连接至同样经过双酶切处理的载体片段,得到蛋白质二硫键异构酶表达载体;
b.热激转化步骤a得到的表达载体,涂布于lb抗性平板,培养出单菌落,利用验证引物挑单菌落pcr验证阳性转化子,挑取阳性转化子测序,保存正确菌株与甘油管中;
c.单酶切处理蛋白质二硫键异构酶表达载体后,切胶回收线性化表达载体,电转至ple-2菌丝霉素毕赤酵母表达菌株,培养至长出菌丝霉素的表达菌株毕赤酵母的单菌落;
d.挑取步骤c中所述的菌丝霉素的表达菌株毕赤酵母的单菌落,培养评价菌丝霉素的表达,检测发酵上清液的抑菌圈大小,筛选得到pdi菌株;
e.将步骤d筛选得到的pdi菌株接种于bmgy培养基中,培养一级种子液;具体地,所述pdi菌株在30℃,220rpm培养24小时得到一级种子液;
f.取步骤e中培养的一级种子液接种于bmgy培养基中,培养二级种子液;具体地,取20ml的一级种子液接种于200mlbmgy培养基中,30℃,220rpm培养24小时得到二级种子液。
g.将步骤f中的二级种子液接种于含有bsm培养基的发酵罐中,控制温度30℃±0.5℃,溶氧20%±5%,ph=5.0±0.5,基础甘油耗尽后,流加10%甘油,甘油耗尽后直至溶氧上升至90%,饥饿半小时,流加甲醇诱导菌丝霉素表达,共诱导72小时;诱导表达后的发酵液,6000×g离心5min,取上清液检测菌丝霉素的蛋白浓度和蛋白电泳。
上述方法通过在菌丝霉素表达菌株中表达蛋白质二硫键异构酶,促进菌丝霉素的3对二硫键形成正确的空间结构,进而使菌丝霉素顺利分泌表达至细胞外,大大地提高了菌丝霉素的表达量。
进一步地,所述的蛋白质二硫键异构酶pdi的基因序列包括如序列表seqidno.1所示的dna序列。
进一步地,所述的步骤a中扩增蛋白质二硫键异构酶pdi基因的扩增物分别为:
pdi-f:5’-tattcgaaatgcaattcaactggaatat-3’(seqidno.2)和
pdi-r:5’-gtgaattcttaaagctcgtcgtgagcgt-3’(seqidno.3);
进一步地,所述的步骤a中双酶切pdi片段的酶为bstbi和ecori。
进一步地,所述的bstbi和ecori酶切处理pdi片段的酶切位点分别是基因的5’端ttcgaa和基因的3’gaattc。
进一步地,所述的步骤a中的载体片段为ppic6αa,与经过bstbi和ecori双酶切处理的pdi片段连接后得到蛋白质二硫键异构酶表达载体ppic-pdi。
具体地,所述的步骤b中挑单菌落pcr验证阳性转化子所使用的验证引物为:
5aox-f:5’-gactggttccaattgacaagc-3’(seqidno.4)和
3aox-r:5’-gcaaatggcattctgacatcc-3’(seqidno.5)。
进一步地,所述的步骤b中单酶切处理表达载体的内切酶为pmei限制性内切酶。
具体地,所述的步骤c中发酵上清液的抑菌圈的大小的检测采用的指示菌为金黄色葡萄球菌cmcc26003;金黄色葡萄球菌是革兰氏阳性菌的代表,在自然界中无处不在,是人和动物感染中最常见的病原菌,选用金黄色葡萄球菌作为指示菌,能够很好地代表所述菌丝霉素对革兰氏阳性菌的抑制作用。
具体地,所述的表达菌丝霉素的毕赤酵母菌株pichiapastorisx33(plt-07),分类学名称pichiapastoris,现已保藏于广东省微生物菌种保藏中心,地址:广州市先烈中路100号大院59号楼5楼,广东省微生物研究所,邮编510075,保藏日期2017年10月26日,保藏编号gdmccno.60262。
下列实施例中未注明具体条件的实验操作,均参照《分子克隆实验指南》(molecμlarcloning:alaboratorymanual,2002)中所述的条件进行。
dna聚合酶、限制性内切酶、dna连接酶购于newenglandbiolabs公司,毕赤酵母表达载体购于invitrogen公司。
实施例1构建蛋白质二硫键异构酶表达载体
根据毕赤酵母蛋白质二硫键异构酶pdi基因序列,设计扩增引物
pdi-f:5’-tattcgaaatgcaattcaactggaatat-3’和
pdi-r:5’-gtgaattcttaaagctcgtcgtgagcgt-3’;
在基因的5’端添加bstbi酶切位点ttcgaa,在基因的3’端添加ecori酶切位点gaattc;
以毕赤酵母基因组为模板,扩增蛋白质二硫键异构酶基因pdi,基因大小为1554bp。bstbi和ecori双酶切处理pdi片段,连接至同样经过bstbi和ecori双酶切处理的ppic6αa载体片段,得到蛋白质二硫键异构酶表达载体ppic-pdi。连接产物42℃热激转化至大肠杆菌top10感受态细胞,涂布于lb抗性平板,37℃过夜培养至长出单菌落。利用验证引物:
5aox-f:5’-gactggttccaattgacaagc-3’和
3aox-r:5’-gcaaatggcattctgacatcc-3’
挑单菌落菌落pcr验证阳性转化子,目的条带如图2所示,约1.9kb,挑取阳性转化子测序,正确菌株保存于甘油管中。
实施例2转化菌丝霉素工程菌
pmei限制性内切酶单酶切处理ppic-pdi表达载体,切胶回收线性化表达载体,电转(1.5-2.5kv)至ple-2菌丝霉素毕赤酵母表达菌株,菌液涂布于ypd平板(含0.1-0.5mg/mlblasticidin),30℃培养2-3天,直至长出单菌落。
挑取单菌落,培养评价菌丝霉素的表达,检测发酵上清液的抑菌圈大小,筛选得到pdi菌株。
抑菌圈检测:将指示菌(金黄色葡萄球菌cmcc26003)接种于mh培养基中制备指示菌液。用生理盐水稀释至od600=2.3,取100μl稀释指示菌液至100mlmh固体培养基(温度50-55℃),混匀,取10.5ml固体培养基至标准培养皿,冷却凝固。利用打孔器打孔,每孔添加5μl发酵上清液,对照样品为原菌丝霉素表达菌株发酵液,盖上陶瓦盖,置于37℃培养箱培养16小时,观察结果,发酵上清液的抑菌圈大小如图3所示,由图3可以看出,所述发酵上清液对金黄色葡萄球菌有明显的抑制作用。
实施例3重组菌丝霉素的诱导表达
挑取实施例2中制备的pdi菌株单菌落,接种于25mlbmgy培养基中,30℃,220rpm培养24小时制备一级种子液。
取20ml一级种子液接种于200mlbmgy培养基中制备二级种子液,30℃,220rpm培养24小时。
二级种子液全部接种于5l发酵罐(2lbsm培养基),控制温度30℃±0.5℃,溶氧20%±5%,ph=5.0±0.5;基础甘油耗尽后,流加10%甘油,甘油耗尽后直至溶氧上升至90%,饥饿半小时,流加甲醇诱导菌丝霉素表达,共诱导72小时,离心(6000xg,5min)取发酵上清液进行检测。
实施例4重组菌丝霉素蛋白浓度检测和蛋白电泳
bradford法测定上清液总蛋白浓度,结果显示,诱导72小时,原菌丝霉素表达菌株和pdi菌株的发酵上清液总蛋白浓度分别为5.3g/l和6.9g/l。
请参阅图4,tricine-sds-page蛋白电泳分析发酵上清液菌丝霉素含量,在3-6kd之间有目标大小的蛋白条带,蛋白条带的分子量大小与菌丝霉素分子量相近,约为4.4kd,pdi菌株的目的条带比原菌丝霉素表达菌株的更为明显;通过软件分析,菌丝霉素蛋白含量90%以上,pdi菌株发酵上清液中总蛋白浓度最高为6.9g/l,其中菌丝霉素含量达到6.2g/l,比原菌株提高了30%。
综上所述,本发明通过在菌丝霉素表达菌株中表达蛋白质二硫键异构酶,促进菌丝霉素的3对二硫键形成正确的空间结构,进而使菌丝霉素顺利分泌表达至细胞外,达到提高菌丝霉素表达量的目的,使用所述方法使菌丝霉素的表达量提高了30%;进一步地,此方法也适用于含有二硫键蛋白质的表达量的提高。
可以理解的是,对本领域普通技术人员来说,可以根据本发明的技术方案及其发明构思加以等同替换或改变,而所有这些改变或替换都应属于本发明所附的权利要求的保护范围。
序列表
<110>广东海纳川生物科技股份有限公司
<120>一种提高毕赤酵母分泌表达菌丝霉素表达量的方法
<160>5
<170>siposequencelisting1.0
<210>1
<211>1554
<212>dna
<213>蛋白质二硫键异构酶pdi基因序列()
<400>1
atgcaattcaactggaatattaaaactgtggcaagtattttgtccgctctcacactagca60
caagcaagtgatcaggaggctattgctccagaggactctcatgtcgtcaaattgactgaa120
gccacttttgagtctttcatcaccagtaatcctcacgttttggcagagttttttgcccct180
tggtgtggtcactgtaagaagttgggccctgaacttgtttctgctgccgagatcttaaag240
gacaatgagcaggttaagattgctcaaattgattgtacggaggagaaggaattatgtcaa300
ggctacgaaattaaagggtatcctactttgaaggtgttccatggtgaggttgaggtccca360
agtgactatcaaggtcaaagacagagccaaagcattgtcagctatatgctaaagcagagt420
ttaccccctgtcagtgaaatcaatgcaaccaaagatttagacgacacaatcgccgaggca480
aaagagcccgtgattgtgcaagtactaccggaagatgcatccaacttggaatctaacacc540
acattttacggagttgccggtactctcagagagaaattcacttttgtctccactaagtct600
actgattatgccaaaaaatacactagcgactcgactcctgcctatttgcttgtcagacct660
ggcgaggaacctagtgtttactctggtgaggagttagatgagactcatttggtgcactgg720
attgatattgagtccaaacctctatttggagacattgacggatccaccttcaaatcatat780
gctgaagctaacatccctttagcctactatttctatgagaacgaagaacaacgtgctgct840
gctgccgatattattaaaccttttgctaaagagcaacgtggcaaaattaactttgttggc900
ttagatgccgttaaattcggtaagcatgccaagaacttaaacatggatgaagagaaactc960
cctctatttgtcattcatgatttggtgagcaacaagaagtttggagttcctcaagaccaa1020
gaattgacgaacaaagatgtgaccgagctgattgagaaattcatcgcaggagaggcagaa1080
ccaattgtgaaatcagagccaattccagaaattcaagaagagaaagtcttcaagctagtc1140
ggaaaggcccacgatgaagttgtcttcgatgaatctaaagatgttctagtcaagtactac1200
gccccttggtgtggtcactgtaagagaatggctcctgcttatgaggaattggctactctt1260
tacgccaatgatgaggatgcctcttcaaaggttgtgattgcaaaacttgatcacactttg1320
aacgatgtcgacaacgttgatattcaaggttatcctactttgatcctttatccagctggt1380
gataaatccaatcctcaactgtatgatggatctcgtgacctagaatcattggctgagttt1440
gtaaaggagagaggaacccacaaagtggatgccctagcactcagaccagtcgaggaagaa1500
aaggaagctgaagaagaagctgaaagtgaggcagacgctcacgacgagctttaa1554
<210>2
<211>28
<212>dna
<213>人工序列()
<400>2
tattcgaaatgcaattcaactggaatat28
<210>3
<211>28
<212>dna
<213>人工序列()
<400>3
gtgaattcttaaagctcgtcgtgagcgt28
<210>4
<211>21
<212>dna
<213>人工序列()
<400>4
gactggttccaattgacaagc21
<210>5
<211>21
<212>dna
<213>人工序列()
<400>5
gcaaatggcattctgacatcc21
- 还没有人留言评论。精彩留言会获得点赞!