一种可用于皮肤敷料的H2S给体化合物、海绵敷料和制备方法与流程
本发明涉及一种h2s给体化合物、海绵敷料和制备方法。
背景技术:
h2s是一种具有臭鸡蛋气味的无色气体分子,长久以来被人们认为是一种会造成环境污染的有毒气体。然而,近期的研究发现有毒气体分子h2s同一氧化氮(no)和一氧化碳(co)一样,是一种重要的内源性气体信号分子,参与到多种生理病理过程中。哺乳动物体内可以合成h2s,主要通过胱硫醚-γ-裂解酶(cse)和胱硫醚-β-合成酶(cbs)催化半胱氨酸代谢而来。在心血管系统中h2s主要由cse催化合成,而神经系统中h2s主要由cbs催化合成。生理条件下h2s的浓度为1-160μm,其中脑中达50-160μm,血液中达到10-160μm。内源性h2s具有多种生物学功能,能够调控中枢和外周神经系统、调控细胞的新陈代谢、调节免疫/炎症反应、调节心血管系统的功能,在炎症、败血症、休克、烧伤等方面的作用已经引起了人们的广泛关注。
h2s的生理功能主要是通过以下几种途径来减少炎症,保护组织器官免受伤害。h2s抑制白细胞黏附在血管内皮、抑制白细胞溢出以及水肿的形成。h2s能够代替氧气驱动线粒体呼吸,从而减弱氧化压导致的组织损伤。h2s能够抑制磷酸二酯酶(pdes)的活性从而舒张血管平滑肌,增加血流量。h2s通过启动嗜中性粒细胞凋亡,驱动巨噬细胞向抗炎症的m2型分化从而降低炎症反应。h2s可以抑制转录因子nf-kb的活性,从而降低促炎症反应过程中细胞因子的产生。h2s在创伤部位的产生量增加,进而通过刺激血管化加速创伤的愈合。
已有的研究结果表明,h2s的促进血管新生和抗炎症反应的功能对于伤口愈合具有明显的促进作用。因此,提高内源性h2s的合成或递送适当浓度的外源性h2s成为临床上加速伤口愈合的有效治疗手段。而且,h2s作为气体信号分子可以不需要任何特异性的载体就能快速通过细胞膜到达细胞内的生物靶点,从而发挥一系列的生物作用。但是,h2s同no和co一样,其生理功能具有剂量依赖性,低浓度时可以发挥生理功能和细胞保护作用,而高浓度时则具有一定的细胞毒性。因此,通过适当的载体持续、可控地释放适当浓度的h2s,可以使h2s成为一种有效的治疗试剂。一般而言,h2s载体在释放h2s气体分子后,将会产生无用的副产物。但如果将一种活性分子同时连接在h2s载体上,释放h2s气体分子后所生成的副产物将具备活性分子的功能,达到变废为宝的效果。
nas和nahs是目前经常使用的h2s给体化合物,这些硫化物盐可以在水溶液中自发地快速释放高浓度的h2s,但是这种释放方式很难控制h2s在水溶液中的浓度,而且h2s在水溶液中的浓度会由于气体的挥发而快速降低。这些性质极大地限制了h2s在临床上的使用。因此,开发新型h2s给体化合物以克服现有给体化合物的不足已经受到了广大关注。到目前为止,已经报道了几种新型的h2s给体化合物,h2s的释放可受水解、光解、细胞硫醇活性的控制。其中gyy4137是最常用的一种给体化合物,可以在水中水解并缓慢地释放h2s,但是这种释放方式过于缓慢,需要丙酮或氯仿等有机溶剂的帮助才能快速水解,而完全水解则需要71天。gyy4137的核心结构或者硫代磷酸酯被认为是设计h2s给体化合物的有效模板,但是仍然需要开发新的活化机制。同时,研究h2s的释放机制和副产物的性质可以更好地利用h2s给体化合物。
技术实现要素:
本发明的第一个目的是提供一种可用于皮肤敷料的h2s给体化合物cw-1,该化合物能够特异性地向皮肤递送h2s气体分子,其副产物同时具有抗菌作用。本发明的第二个目的是提供一种适用于皮肤的敷料,它是包括h2s给体化合物cw-1的海藻酸钙的海绵敷料。该敷料可以与皮肤伤口接触,可以有效地向伤口部位皮肤长时间稳定地递送具有治疗剂量的h2s气体分子,同时起到抗菌作用。
本发明的一种可用于皮肤敷料的h2s给体化合物,它的化学结构式为:
本发明的一种可用于皮肤敷料的h2s给体化合物的制备方法,它是按照以下步骤进行的:
一、在氩气保护、0℃条件下,向苯基硫代磷酰二氯的无水二氯甲烷溶液中加入3-羟基丙腈和三乙胺,混合均匀后得反应液;其中,3-羟基丙腈、三乙胺、苯基硫代磷酰二氯与二氯甲烷的摩尔比为1:1:1:18~19;
二、反应液在0℃反应15min后继续在室温反应3h;
三、向步骤二反应后得到的反应体系中加入6-(对乙酰胺基苯磺酰胺)-l-赖氨酸甲酯、三乙胺和无水二氯甲烷的混合溶液,继续反应3h;其中,6-(对乙酰胺基苯磺酰胺)-l-赖氨酸甲酯、三乙胺和无水二氯甲烷的摩尔比为1.1:3:18~19;
四、在步骤三反应后的溶液中加入二氯甲烷,并依次用2mh2so4洗涤、mgso4干燥,最后减压浓缩,得粗产物;其中,二氯甲烷与步骤三反应后的溶液的体积比为1:1;
五、将粗产物经过色谱柱纯化获得黄色油状中间产物,向中间产物的甲醇溶液中加入新配制的lioh溶液,室温下搅拌12h后浓缩;lioh溶液与中间产物的甲醇溶液的体积比为1:1;
六、将步骤五浓缩后的固体,重悬于无水甲醇中,经0.2μm的teflon滤膜过滤,然后浓缩冻干,得到h2s给体化合物cw-1,即为所述的可用于皮肤敷料的h2s给体化合物。
本发明的一种海绵敷料,它为包括h2s给体化合物cw-1的海藻酸钙的海绵敷料。
本发明的一种海绵敷料的制备方法,它是按照以下步骤进行的:
首先,将质量百分含量为1~2%的海藻酸钠水溶液加入模具中,经过冷冻干燥制备成海藻酸钠海绵;
然后,利用浓度为0.2~1.0m的氯化钙溶液对海藻酸钠海绵进行交联,经过水洗、再次冷冻干燥获得交联的海藻酸钙海绵;
最后,向交联的海藻酸钙海绵中滴加浓度为50mm的权利要求2制备的h2s给体化合物cw-1溶液,再次冷冻干燥,获得ca/cw-1海绵敷料。
本发明制备的可用于皮肤敷料的h2s给体化合物cw-1(下简称cw-1),可在中性及弱酸性ph条件下释放h2s,同时其副产物具有抗菌能力。该性质可使其用于皮肤敷料,在伤口部位的微酸性ph环境下特异性地释放h2s气体信号分子,促进上皮化和血管化,同时改善伤口感染情况,加速伤口愈合的过程。本发明制备的ca/cw-1海绵敷料具有高吸湿性、高透气性,可以大量吸收伤口渗液,为伤口提供湿性愈合环境,并随着渗液的吸收向伤口释放h2s。本发明涉及的h2s给体化合物及负载该分子的皮肤敷料对慢性难愈合伤口和感染伤口具有独特的治疗作用,可为患者带来康复希望,同时为敷料制备产业带来巨大商机,具有很好的社会效益和经济效益。
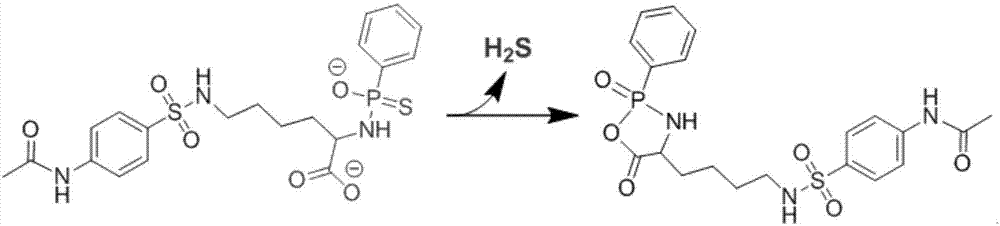
本发明的cw-1在中性或微酸性ph条件下发生质子化形成硫醇,进而被亲核羧基攻击发生分子内环化形成五元环副产物同时释放h2s。通过检测不同ph条件下cw-1释放h2s的情况发现,该结构可在弱酸性ph(ph5和ph6)条件下快速释放大量h2s,5分钟之内h2s的释放量达90%,随着时间的延长,高浓度的h2s气体会从液体中逸出,在90分钟后h2s浓度仅余50%。在中性ph(ph7.4)条件下,cw-1可缓慢持续地释放h2s,在90分钟后h2s的释放量达50%。而在弱碱性ph(ph8)条件下,cw-1仅释放痕量的h2s。cw-1这种由ph调控的h2s释放方式,使其在生理条件下能够可控释放h2s活性分子,因此具有特定的生物学应用。
本发明通过二价阳离子(如钙离子)交联使海藻酸钠水溶液变成海藻酸盐凝胶。该凝胶具有独特的ph敏感性和凝血效果,且能支持细胞的分化和生长。在藻酸盐敷料中添加h2s给体化合物cw-1,结合藻酸盐敷料孔隙率高、吸湿性强、成胶性好等诸多优势,可有效吸收大量渗出液形成水凝胶,为伤口愈合提供良好的湿性愈合环境。随着渗液的吸收,可持续释放h2s气体信号分子,从而促进细胞的增殖、爬行以及血管生成,加速伤口愈合过程,释放h2s后所产生的副产物具有抗菌作用,针对感染伤口将具有独特的疗效。
本发明包括h2s给体化合物cw-1的海藻酸钙的海绵敷料(下简称ca/cw-1海绵敷料)中h2s的释放具有良好的ph响应性,在ph5.0、6.0、7.4、8.0条件下,随着ph值的降低,敷料中释放h2s的能力逐渐增加。与游离cw-1分子相比,ca/cw-1海绵敷料中负载的cw-1可以延长h2s的释放时间并增加h2s的释放量,起到长时间可控递送h2s的目的。由于伤口部位的ph值为酸性,因此具有ph响应性的ca/cw-1敷料可随着渗液的吸收逐渐向伤口部位特异性地释放h2s,同时为伤口提供良好的湿性愈合环境和抗菌作用。
附图说明
图1为h2s给体化合物cw-1的合成路线示意图;
图2为cw-1释放h2s的示意图;
图3为cw-1在不同ph条件下的h2s释放量结果图;其中,a为ph6.0下的释放量,b为ph5.0下的释放量,c为ph7.4下的释放量,d为ph8.0下的释放量;
图4为cw-1对e.coli的生长抑制作用结果图;其中,其中,a为在ph7.1下测试,b为在ph6.0下测试;
图5为cw-1对s.aureus的生长抑制作用结果图;其中,a为在ph7.1下测试,b为在ph6.0下测试;
图6为cw-1对l929的细胞毒性测试图;其中,a为在ph7.4下测试,b为在ph6.0下测试;
图7为施用ca/cw-1海绵敷料的小鼠伤口愈合过程。
具体实施方式
具体实施方式一:本实施方式的一种可用于皮肤敷料的h2s给体化合物,它的化学结构式为:
具体实施方式二:本实施方式一种可用于皮肤敷料的h2s给体化合物的制备方法,它是按照以下步骤进行的:
一、在氩气保护、0℃条件下,向苯基硫代磷酰二氯的无水二氯甲烷溶液中加入3-羟基丙腈和三乙胺,混合均匀后得反应液;其中,3-羟基丙腈、三乙胺、苯基硫代磷酰二氯与二氯甲烷的摩尔比为1:1:1:18~19;
二、反应液在0℃反应15min后继续在室温反应3h;
三、向步骤二反应后得到的反应体系中加入6-(对乙酰胺基苯磺酰胺)-l-赖氨酸甲酯、三乙胺和无水二氯甲烷的混合溶液,继续反应3h;其中,6-(对乙酰胺基苯磺酰胺)-l-赖氨酸甲酯、三乙胺和无水二氯甲烷的摩尔比为1.1:3:18~19;
四、在步骤三反应后的溶液中加入二氯甲烷,并依次用2mh2so4洗涤、mgso4干燥,最后减压浓缩,得粗产物;其中,二氯甲烷与步骤三反应后的溶液的体积比为1:1;
五、将粗产物经过色谱柱纯化获得黄色油状中间产物,向中间产物的甲醇溶液中加入新配制的lioh溶液,室温下搅拌12h后浓缩;lioh溶液与中间产物的甲醇溶液的体积比为1:1;
六、将步骤五浓缩后的固体,重悬于无水甲醇中,经0.2μm的teflon滤膜过滤,然后浓缩冻干,得到h2s给体化合物cw-1,即为所述的可用于皮肤敷料的h2s给体化合物。
具体实施方式三:本实施方式与具体实施方式二不同的是:苯基硫代磷酰二氯的无水二氯甲烷溶液的浓度为0.76m。其它与具体实施方式二相同。
具体实施方式四:本实施方式与具体实施方式二不同的是:lioh溶液的浓度为1m。其它与具体实施方式二相同。
具体实施方式五:本实施方式与具体实施方式二不同的是:3-羟基丙腈、三乙胺、苯基硫代磷酰二氯与二氯甲烷的摩尔比为1:1:1:18.2。其它与具体实施方式二相同。
具体实施方式六:本实施方式与具体实施方式二不同的是6-(对乙酰胺基苯磺酰胺)-l-赖氨酸甲酯、三乙胺和无水二氯甲烷的摩尔比为1.1:3:18.2。其它与具体实施方式二相同。
具体实施方式七:本实施方式的一种海绵敷料,它为包括h2s给体化合物cw-1的海藻酸钙的海绵敷料。
具体实施方式八:本实施方式的一种海绵敷料的制备方法,其特征在于它是按照以下步骤进行的:
首先,将质量百分含量为1~2%的海藻酸钠水溶液加入模具中,经过冷冻干燥制备成海藻酸钠海绵;
然后,利用浓度为0.2~1.0m的氯化钙溶液对海藻酸钠海绵进行交联,经过水洗、再次冷冻干燥获得交联的海藻酸钙海绵;
最后,向交联的海藻酸钙海绵中滴加浓度为50mm的权利要求2制备的h2s给体化合物cw-1溶液,再次冷冻干燥,获得ca/cw-1海绵敷料。
具体实施方式九:本实施方式与具体实施方式八不同的是:向交联的海藻酸钙海绵中1/5~1/4倍的海藻酸钠溶液体积的h2s给体化合物cw-1溶液。其它与具体实施方式八相同。
具体实施方式十:本实施方式与具体实施方式八不同的是:向交联的海藻酸钙海绵中1/5倍的海藻酸钠溶液体积的h2s给体化合物cw-1溶液。其它与具体实施方式八相同。
本发明内容不仅限于上述各实施方式的内容,其中一个或几个具体实施方式的组合同样也可以实现发明的目的。
通过以下实施例验证本发明的有益效果:
实施例1
具有对氨基苯磺酰胺结构的磺胺类药物是第一类人工合成抗菌药,用于临床已有80余年。将磺胺结构连接在h2s给体化合物的一端,可在释放h2s气体分子后生成具有抗菌活性的副产物。
本实施例设计了基于分子内环化的h2s给体化合物,该结构通过ph调节分子内环化活化的效率,从而产生高效的ph控制的h2s释放。
本实施例的一种可用于皮肤敷料的h2s给体化合物的制备方法,它是按照以下步骤进行的:
在氩气保护、0℃条件下,向苯基硫代磷酰二氯(0.45ml,3mmol)的无水二氯甲烷(ch2cl2,3.5ml)溶液中加入3-羟基丙腈(0.2ml,3mmol)和三乙胺(0.45ml,3mmol);反应液在0℃反应15min后继续在室温反应3h;随后,向反应体系中加入6-(对乙酰胺基苯磺酰胺)-l-赖氨酸甲酯(1.178g,3.3mmol)、三乙胺(1.25ml,9mmol)和3.5ml无水ch2cl2的混合溶液,继续反应3h;反应完成后,向其中加入10ml的ch2cl2,并用10ml的2mh2so4洗涤、mgso4干燥,最后减压浓缩;所得粗产物经过色谱柱纯化获得黄色油状中间产物;之后,向中间产物的甲醇溶液中加入新配制的lioh溶液,室温下搅拌12h后浓缩;所得固体重悬于无水甲醇中,经0.2μm的teflon滤膜过滤,然后浓缩冻干得目标产物(白色固体,h2s给体化合物cw-1)。
本实施例的h2s给体化合物cw-1合成路线图如图1所示。
本实施例的cw-1在中性或微酸性ph条件下发生质子化形成硫醇,进而被亲核羧基攻击发生分子内环化形成五元环副产物同时释放h2s(释放h2s的示意图如图2所示)。通过检测不同ph条件下cw-1释放h2s的情况发现(如图3所示),该结构可在弱酸性ph(ph5和ph6)条件下快速释放大量h2s,5分钟之内h2s的释放量达90%,随着时间的延长,高浓度的h2s气体会从液体中逸出,在90分钟后h2s浓度仅余50%。在中性ph(ph7.4)条件下,cw-1可缓慢持续地释放h2s,在90分钟后h2s的释放量达50%。而在弱碱性ph(ph8)条件下,cw-1仅释放痕量的h2s。cw-1这种由ph调控的h2s释放方式,使其在生理条件下能够可控释放h2s活性分子,因此具有特定的生物学应用。
对本实施例的h2s给体化合物cw-1的抗菌特性和生物相容性进行测试,具体如下:
选用金黄色葡萄球菌(s.aureus)和大肠杆菌(e.coli)分别作为革兰氏阳性菌和革兰氏阴性菌的代表,来检测cw-1释放h2s后副产物的抗菌性(检测结果如图4和图5所示)。
通过微孔梯度稀释法检测不同浓度的cw-1对s.aureus和e.coli的生长抑制率发现,培养18小时后,8mm的cw-1分别可抑制80%的e.coli细菌生长和60%的s.aureus细菌生长。值得注意的是,ph6.0和ph7.4条件下cw-1对细菌的抑制率基本相同。虽然ph6.0和ph7.4条件下h2s的释放特性不同,但是通过18小时的培养,两者的h2s释放量趋于相近,所产生的副产物量相近,因此对细菌的抑制效率没有明显差别。该结果说明,cw-1释放h2s的副产物因具有磺胺结构而具备一定的抗菌作用。
选用l929小鼠成纤维细胞作为模型细胞来研究cw-1的生物相容性。共培养24小时后发现,cw-1浓度在1mm以下时对l929没有任何细胞毒性(如图6所示),这表明cw-1具有良好的生物相容性。
实施例2
本实施例一种海绵敷料,是按照以下步骤进行的:
首先,将质量浓度为1%、1.5%和2%的海藻酸钠水溶液分别加入适当的模具中,经过冷冻干燥制备成海藻酸钠海绵;然后利用浓度为0.2m、0.5m和1.0m的氯化钙溶液分别对海藻酸钠海绵进行交联用以选择最优的海藻酸钠与氯化钙的用量比例,(最优的海藻酸钠水溶液质量浓度为1.5%,氯化钙溶液浓度为0.2m),经过水洗、再次冷冻干燥获得交联的海藻酸钙海绵(ca海绵)。向ca海绵中滴加h2s给体化合物cw-1溶液(50mm),再次冷冻干燥获得ca/cw-1海绵敷料。
本发明包括h2s给体化合物cw-1的海藻酸钙的海绵敷料中h2s的释放具有良好的ph响应性,在ph5.0、6.0、7.4、8.0条件下,随着ph值的降低,敷料中释放h2s的能力逐渐增加。与游离cw-1分子相比,ca/cw-1海绵敷料中负载的cw-1可以延长h2s的释放时间并增加h2s的释放量,起到长时间可控递送h2s的目的。由于伤口部位的ph值为酸性,因此具有ph响应性的ca/cw-1敷料可随着渗液的吸收逐渐向伤口部位特异性地释放h2s,同时为伤口提供良好的湿性愈合环境和抗菌作用。
利用小鼠全层皮肤损伤模型检测ca/cw-1海绵敷料的促伤口愈合能力(如图7所示):从检测后的伤口愈合情况来看,与单纯ca敷料相比,可释放h2s的ca/cw-1敷料能明显加快伤口愈合的速度。通过组织学切片发现,ca/cw-1敷料组的伤口部位形成较厚的肉芽组织、较多的角蛋白阳性细胞,以及较高的胶原蛋白表达量,新生成的真皮与组织连接紧密,填充了充足的毛囊,且伴随着大量的胶原纤维沉积。而ca敷料组则形成较薄的肉芽组织层、较少的角质蛋白阳性细胞、以及较少的胶原纤维。另外,ca/cw-1敷料组表现出较高的cd31表达水平,说明h2s可以促进血管化的形成和成熟。以上结果表明,与ca敷料相比,ca/cw-1敷料通过在伤口部位释放h2s促进伤口肉芽组织的形成、伤口上皮化、胶原蛋白沉积、以及血管化,最终加快伤口的愈合速度。
- 还没有人留言评论。精彩留言会获得点赞!