人工环状RNA的通用表达框架及其应用的制作方法
本发明涉及人工环状RNA的通用表达框架及其应用。[
背景技术:
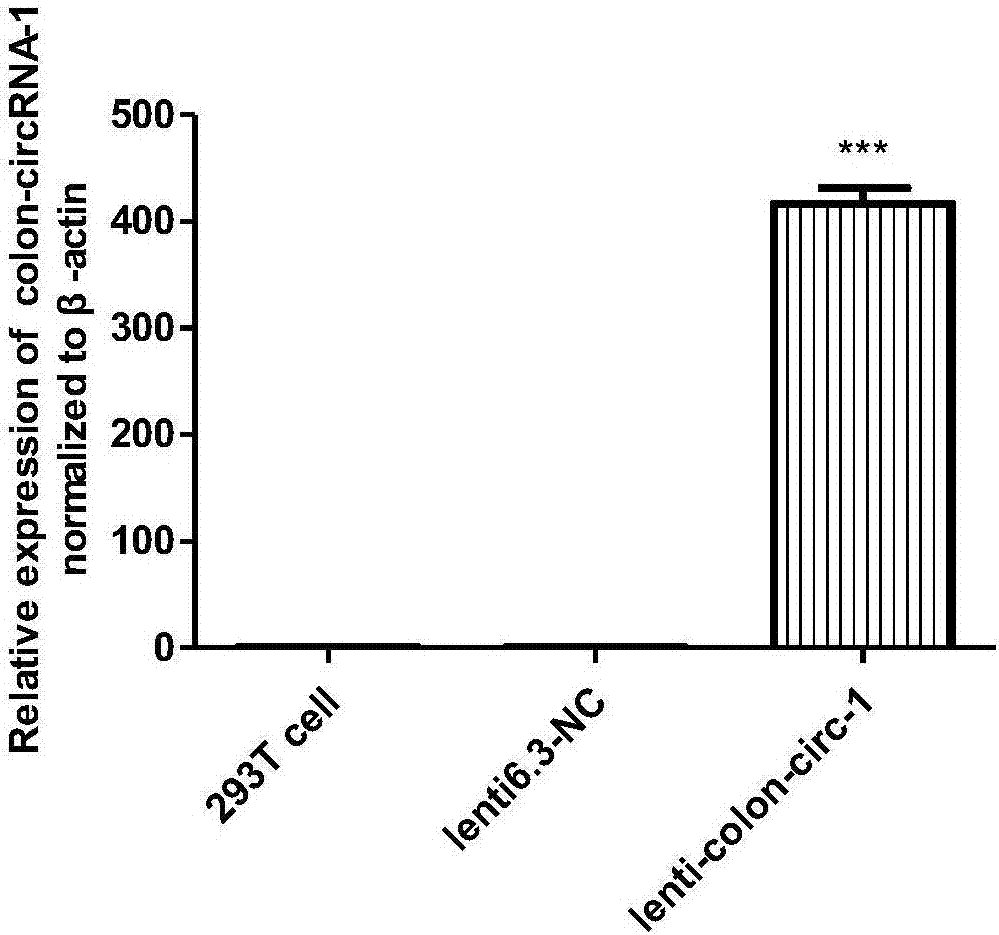
:]目前,抗肿瘤药物的开发主要集中在小分子化合物(靶向药物)、生物大分子(多肽、蛋白、抗体)以及核酸药物或基因治疗药物等。核酸小分子中microRNA和siRNA具备多靶点调控能力,近二十年的研究证实了大量的microRNA在肿瘤的发生和进展过程中发挥重要的作用。microRNA作为一类内源性核酸小分子,多数的生物学活性和基因调节机制清晰,因此microRNA作为一类重要的基因治疗药物开发靶点引起了研究人员的重视。microRNA是一类内生的、长度约为20-24个核苷酸的小RNA,其在细胞内具有多种重要的调节作用。目前的研究表明microRNA通过复杂而精细的基因调控网络参与肿瘤的发生、发展以及耐药和复发等多个病理进程。随着RNA分子输送技术的发展,以及microRNA本身的小分子单链核酸结构所具备的低免疫原性的优势,使得基于microRNA的生物药物开发更加容易实现。然而,microRNA本身的特征以及基于microRNA的药物开发仍存的诸多技术难点等因素限制了其开发的效率。首先,核酸药物在体内发挥作用的最大障碍在于核酸酶的降解作用及内吞过程中药物分子从内吞体的逃逸。虽然目前核酸分子的化学修饰技术以及核酸药物的递送技术有了很大的提高,可以提高核酸药物分子的稳定性和药物分子的输送效率,但是microRNA分子本身的结构局限决定了其在体内的半衰期难以很好的满足临床应用的要求;另外,目前常用的核酸药物递送系统本身潜在的免疫刺激作用以及对病区的靶向特异性缺失等特点也限制了核酸药物的开发效率;其次,虽然近二十年的研究证实了上百种microRNA参与了肿瘤的病理过程,但是由于肿瘤调控机制的复杂性,肿瘤的发生和进展是多基因网络调控的结果,而基于单个microRNA的核酸分子往往亦很难有效控制肿瘤在体内的恶性进展,目前仅有EnGenelC开发的MesomiR-1(miR-16mimic)和MirnaTherapeutics开发的MRX34(miR-34mimic)两种核酸小分子药物成功进入了抗肿瘤的临床1期实验也应证了基于单个microRNA的核酸药物开发的局限性。综上所述,microRNA作为抗肿瘤药物开发靶点,其本身具备多靶点调节能力和内源性的天然优势,然而亦存在半衰期短、递送系统限制以及对肿瘤调控网络的调控能力不足等条件限制。那么如何取长补短,充分利用microRNA的抗肿瘤潜力?近十年随着高通量测序能力的长足发展,另一类具备多靶点调控能力的内源性核酸分子环状RNA引起了研究人员的重视。环状RNA(circularRNA,circRNA)是区别于传统线性RNA的一类新型RNA,其不具有传统线性RNA中的5'末端帽子和3'末端poly(A)尾巴,而以闭合环状结构存在。研究认为,circRNA可以作为“sponge”海绵吸附细胞内的microRNA,阻断microRNA对其靶基因的抑制作用,这一特征使得circRNA作为抗肿瘤药物开发靶点具备与microRNA类似的价值。另外,因其具有独特的闭环结构,对核酸酶不敏感,因此与常规线性RNA、microRNA以及siRNA相比,circRNA在生物体中具有更强的稳定性,这一特征可能很好的弥补microRNA体内半衰期端的劣势。此外,对于circRNA在肿瘤中作用和发挥作用的机制研究表明,circRNA可以通过“sponge”的作用模式同时竞争性吸附多种microRNA,阻断microRNA对于其靶基因表达的负调控,从而参与恶性肿瘤的进展,这一特征能够很好的弥补单一microRNA网络调控能力的不足。上述环状RNA闭环结构带来的稳定性优势以及其对于microRNA的调控活性,使得circRNA作为一种基因调控工具在抗肿瘤基因治疗药物开发的研究中具有极大的潜在价值。然而,基于circRNA药物的开发首先必须要解决三个基础的技术问题:其一,目前circRNA的化学合成技术难以实现。因此,生物合成circRNA成为目前circRNA制备的首选方法,而circRNA在细胞内的大量表达和高效的成环效率是亟待解决的关键技术。其二,内源性circRNA中除了作为“sponge”海绵竞争性吸附抑制microRNA的靶点序列外还存在大量生物活性未知的序列,基于内源性circRNA进行基因治疗药物开发尚存在未知风险,因此,利用内源性circRNA进行抗肿瘤药物开发需要研究人员解析清楚circRNA结构中功能位置的“冗余”序列,或者剔除“冗余”序列利用有效的靶点序列。其三,虽然研究证实circRNA结构中存在多个靶点序列,具备同时吸附调控多个microRNA的能力,然而某个单一的内源性circRNA对于肿瘤microRNA的网络调控能力还是不足,需要研究人员开发出一种相比于内源性circRNA具备更多或更强的靶点吸附调控能力的circRNA。综上所述,模拟内源性circRNA利用自身反向互补序列来吸附抑制内源microRNA的生物学活性,利用多靶点结合序列组合的方式设计人工circRNA,以此人工circRNA来实现对多个microRNA的网络调控,同时规避内源性circRNA中生物活性未知的冗余序列带来的潜在生物风险是基于circRNA的基因治疗药物开发的另一关键技术和研发方向。[技术实现要素:]本发明的目的在于提供一种具备多microRNA组合抑制能力的人工环状RNA的通用表达框架,以及利用真核表达质粒、慢病毒、腺病毒、腺相关病毒、逆转录病毒等不同表达系统表达的人工环状RNA的通用表达框架及其应用。为实现上述目的,本发明包括一种式I序列的人工环状RNA的通用表达框架,其中,US为上游序列,碱基序列如SEQIDNO.1所示,DS为下游序列,碱基序列如SEQIDNO.2所示,N为microRNA吸附位点的序列,LS为连接序列,n个相同或不同的microRNA吸附位点序列通过连接序列连接并隔离,避免相邻两个吸附位点之间的干扰,n为自然数。上述人工环状RNA的通用表达框架还具有如下优化方案:连接序列主要的作用是将相邻的两个吸附点位进行连接并隔离,避免相邻两个吸附位点之间的干扰,诸如可以采用ACACAC。microRNA吸附位点的序列由待吸附microRNA成熟体的反向互补DNA序列或该反向互补DNA序列的优化序列决定。microRNA吸附位点序列的碱基数为10-30bp,或进一步的为18-30bp。而其中的n为自然数,最佳范围为5≤n≤50。本发明还包括另一种人工环状RNA的通用表达框架,碱基序列如SEQIDNO.3所示。本发明还包括又一种人工环状RNA的通用表达框架,碱基序列如SEQIDNO.5所示。本发明还包括一种上述人工环状RNA的通用表达框架的表达方法,利用真核质粒表达系统、慢病毒表达系统、腺病毒表达系统、腺相关病毒表达系统或逆转录表达系统表达。本发明还包括一种人工环状RNA,由上述人工环状RNA的通用表达框架利用真核质粒表达系统、慢病毒表达系统、腺病毒表达系统、腺相关病毒表达系统或逆转录表达系统表达。上述人工环状RNA的通用表达框架可以应用到制备基因治疗药物中。与现有技术相比,本发明的有益效果在于:1.本发明模拟内源性环状RNA进行基因调控的机制,首次设计了一个全新的具备多microRNA组合抑制能力的人工环状RNA的通用结构,此通用的人工环状RNA结构可根据不同的需求任意组合抑制靶点,实现不同肿瘤的不同定制。且具备同时吸附抑制多种microRNA成熟体的能力,能够实现生物体中多个基因表达水平的网络调控。2.本发明提供了一种具备多microRNA组合抑制能力的人工环状RNA的通用表达框架,框架中的上下游序列能够高效的表达人工设计的环状RNA结构,亦可用于内源性环状RNA的表达。所述人工环状RNA表达框架可利用真核载体、慢病毒载体、腺病毒载体、腺相关病毒载体以及逆转录病毒载体进行表达。为相应基因治疗药物提供了多种介导工具的选择。3.本发明提供的人工环状RNA结构以及人工环状RNA表达框架可以广泛的用于包含肿瘤在内的多种疾病的基因治疗和药物开发。[附图说明]图1为实施例中具备多microRNA组合抑制能力的人工环状RNA的通用表达框架;图2为人工环状RNAcolon-circ-1过表达慢病毒质粒转染后293T细胞中colon-circ-1过表达效果图;图3为人工环状RNAcolon-circ-scrambleNC-1过表达慢病毒质粒转染后293T细胞中colon-circ-scrambleNC-1过表达效果图;图4为人工环状RNAcolon-circ-2过表达慢病毒质粒转染后293T细胞中colon-circ-2过表达效果图;图5为人工环状RNAcolon-circ-scrambleNC-2过表达慢病毒质粒转染后293T细胞中colon-circ-scrambleNC-2过表达效果图;图6为人工环状RNAcolon-circ-1过表达慢病毒感染后3株结肠癌细胞中colon-circ-1过表达效果图;图7为人工环状RNAcolon-circ-scrambleNC-1过表达慢病毒感染后3株结肠癌细胞中colon-circ-scrambleNC-1过表达效果图;图8为人工环状RNAcolon-circ-2过表达慢病毒感染后3株结肠癌细胞中colon-circ-2过表达效果图;图9人工环状RNAcolon-circ-scrambleNC-2过表达慢病毒感染后3株结肠癌细胞中colon-circ-scrambleNC-2过表达效果图;图10为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因PTEN表达检测效果图;图11为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因Smad4表达检测效果图图12为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因Par4表达检测效果图图13为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因SFRP1表达检测效果图图14为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因SOX30表达检测效果图,图15为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因FOXO3A表达检测效果图,图16为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因PPP2R2A表达检测效果图,图17为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因APC表达检测效果图,图18为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后3株结肠癌细胞中靶基因DKK3表达检测效果图,图19为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染72h后结肠癌细胞HCT116的细胞活力检测效果图,图20为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染72h后结肠癌细胞HT29的细胞活力检测效果图,图21为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染72h后结肠癌细胞lovo的细胞活力检测效果图,图22为两种针对结肠癌的人工环状RNA以及相应scramble阴性对照环状RNA过表达慢病毒感染后抑制结肠癌细胞HCT116裸鼠皮下成瘤效果图。[具体实施方式]以下结合针对结肠癌中两种不同人工环状RNA表达框架设计和慢病毒介导的人工环状RNA表达的实施例来进一步解释本发明,但实施例并不对本发明做任何形式的限定。本发明所涉及的技术为基因合成、载体构建、细胞培养、质粒转染、病毒包装、qPCR、CCK8、裸鼠成瘤常规技术手段,其中涉及的酶、引物、试剂、细胞培养反应条件、细胞转染条件以及裸鼠成瘤条件在未作说明的情况下均可根据本领域技术人员的经验进行合理选择,其中涉及试剂耗材属于市售的普通产品,细胞为ATCC来源,实验动物来源于JacksonLab。其中涉及的检测手段以及仪器也均为本领域技术人员所熟知并熟练掌握。下面通过实施例和试验例对本发明的技术方案做进一步的说明,但不应理解为对本发明的限制。1.利用生物信息学分析和筛选确定在结肠癌中过表达,且具备促进结肠癌进展或耐药等恶性生物学行为的microRNA。相关筛选结果如下:has-miR-21-5p、has-miR-19b-3p、has-miR-17-3p、has-miR-27a-3p、has-miR-645、has-miR-592、has-miR-892a、has-miR-135b-5p、has-miR-153-3p、has-miR-92a-3p。2.选取has-miR-21-5p作为调控对象,has-miR-21-5p的序列为“uagcuuaucagacugauguuga”,其反向互补DNA序列为“TCAACATCAGTCTGATAAGCTA”。以该序列替换通用框架中的“N”,并将“ACACAC-”进行10倍重复,设计得到一条has-miR-21-5p单靶点10倍重复抑制的circRNA表达框架序列,命名为colon-circ-1,如SEQIDNO.3所示。同时设计一条与colon-circ-1相应的scramble阴性对照序列。scramble阴性对照序列的设计原则为将“TCAACATCAGTCTGATAAGCTA”进行随机打乱,经BLAST确定其与全基因组无同源性后替换通用框架中的“N”,并将“ACACAC-N”进行10倍重复。本次设计的scramble阴性对照序列命名为colon-circ-scrambleNC-1,如SEQIDNO.4所示。而进一步的,在其他实施例中,n还可以采用15、16、17、18、19、20、30、40、50、60、70、80、90、100、200甚至更多的倍数,其可以是相同的N或者不同的N。3.选取has-miR-21-5p、has-miR-19b-3p、has-miR-17-3p、has-miR-27a-3p、has-miR-645、has-miR-592、has-miR-892a、has-miR-135b-5p、has-miR-153-3p、has-miR-92a-3p作为调控对象,分别根据各个microRNA成熟体的序列得到各自反的向互补序列,然后利用各自的反向互补序列替换通用框架中的“N”,10个“ACACAC-N”首尾相连,设计得到一条10靶点单倍抑制的circRNA表达框架序列,命名为colon-circ-2,如SEQIDNO.5所示。同时设计一个与colon-circ-2相应的scramble阴性对照序列,命名为colon-circ-scrambleNC-2,如SEQIDNO.6将上述人工环状RNA过表达框架序列或线性对照序列通过全基因合成的方式获取序列克隆,全基因合成由南京金斯瑞公司完成。将序列插入到真核表达载体、慢病毒载体、腺病毒载体、腺相关病毒载体、逆转录病毒载体中,可形成系列相应circRNA和scramble阴性对照circRNA专用表达载体。实施例一:人工环状RNA过表达框架序列和scramble阴性对照序列慢病毒载体构建1.引物设计合成用Primer5软件进行引物设计:Circ-F:TTAGGCGCGCCTGAGATTACAGGTGTGAGCCCirc-R:GCTTTGTTTAAACGGGATTACAGGTGTGAGCTAC引物序列由上海华大基因公司进行合成。2.PCR扩增人工环状RNA过表达框架序列和scramble阴性对照序列以全基因合成得到的人工环状RNA过表达框架序列或scramble阴性对照序列DNA为模板,PCR扩增目的片段,扩增体系如下:10×Buffer10ulMgSO4(50mM)1uldNTP(10mM)1.5ultransStartFastpfuDNApolymerase(5U/ul)0.5ulCirc-F(10uM)2ulCirc-R(10uM)2ul模板DNA(50ng/ul)1ul加ddH2O至总体积50ulPCR循环程序如下:3.PCR产物回收琼脂糖凝胶电泳PCR产物,并利用胶回收试剂盒(Axygen,AP-GX-50),按照试剂盒说明书的详细操作步骤回收PCR产物。4.PCR回收产物AscI和PmeI双酶切以及酶切产物回收将PCR回收产物用AscI和PmeI进行双酶切,酶切体系如下:10×Buffer3ulPCR产物/目的质粒1ug限制性内切酶AscI0.5ul限制性内切酶PmeI0.5ul补ddH20至总体积30ul37℃酶切4-5小时后,电泳分离酶切片段,切胶回收目的片段。5.慢病毒质粒AscI和PmeI双酶切以及酶切产物回收将慢病毒质粒plenti6.3-MCS用AscI和PmeI进行双酶切,酶切体系如下:10×Buffer3ulPCR产物/目的质粒1ug限制性内切酶AscI0.5ul限制性内切酶PmeI0.5ul补ddH20至总体积30ul37℃酶切4-5小时后,电泳分离酶切片段,切胶回收线性化质粒。6.目的片段与线性化慢病毒质粒链接利用T4DNAligase连接上述酶切后的PCR产物及慢病毒载体,连接体系如下:10×T4连接酶Buffer1ulPCR酶切产物150ng慢病毒质粒酶切产物50ngT4连接酶1ul补ddH20至10ul室温连接1h。同时做阴性对照,以水代替基因与载体连接。7.连接产物的转化1)冰浴中将连接产物分别加入至50μlTran5α感受态细胞中。轻轻旋转混匀,冰浴30min。2)42℃水浴热激90s。3)快速将管转移至冰浴中,冰浴2min。4)分别加入500μlLB培养基,混匀,37℃、150g振荡培养40min。5)将150ul菌液涂布于含氨苄青霉素(Amp)(100μg/ml)的LB平板表面,室温下放置,至液体吸收。倒置平板,转移入37℃生化培养箱过夜培养。8.阳性克隆PCR鉴定转化后次日,挑取单菌落进行菌落PCR,PCR扩增体系及循环程序如下:扩增体系如下:10×ReactionBuffer1.5ulMgCl2(25mM)1.5uldNTPs(10mM)0.5ulCircF(10mM)0.5ulCircR(10mM)0.5ulTaq(5U/ul)0.1ul菌落悬液1ul补ddH20至总体积15ul循环条件如下:9.阳性克隆摇菌和质粒抽提将PCR鉴定呈阳性的克隆在含有相应抗生素的1mlLB液体培养基中培养,37℃摇菌过夜,次日利用质粒小量提取试剂盒(Axygen,AP-MN-P-50),按照说明书的详细步骤抽提质粒。10.将抽提好的质粒送至华大基因进行测序,对测序结果进行序列比对。得到构建完成的相应慢病毒质粒。实施例二:qPCR检测慢病毒质粒转染后293T细胞中人工环状RNA和scramble阴性对照circRNA的过表达效果1.colon-circ-1qPCR引物设计:divergentprimer-F1:如SEQIDNO.7所示。divergentprimer-R:如SEQIDNO.8所示。colon-circ-scrambleNC-1qPCR引物设计:divergentprimer-F2:如SEQIDNO.9所示。divergentprimer-R:如SEQIDNO.10所示。colon-circ-2qPCR引物设计:divergentprimer-F3:如SEQIDNO.11所示。divergentprimer-R:如SEQIDNO.12所示。colon-circ-scrambleNC-2qPCR引物设计:divergentprimer-F4:如SEQIDNO.13所示。divergentprimer-R:如SEQIDNO.14所示。上述引物序列由上海华大基因公司进行合成。2.转染前24h,用胰酶消化对数生长期的293T细胞,传代到接种至六孔板,37℃、5%CO2培养箱内培养。24h待细胞密度达70%~80%时即可用于转染。3.转染前将细胞培养基更换为无血清培养基。4.向一灭菌离心管中加入所制备的各质粒DNA溶液25ug,与相应体积的Opti-MEM混合均匀,调整总体积为1.5ml。5.将Lipofectamine2000试剂轻柔摇匀,取60μlLipofectamine2000试剂在另一管中与1.5mlOpti-MEM混合,在室温下温育5分钟。6.把稀释后的DNA与稀释后的Lipofectamine2000进行混合,轻轻地颠倒混匀,不要振荡。7.将DNA与Lipofectamine2000混合液转移至293T细胞的培养液中,混匀,于37℃,5%CO2细胞培养箱中培养。8.培养6小时后吸去含有转染混和物的培养基,每瓶细胞中加入含10%血清的细胞培养基10ml,于37℃、5%CO2培养箱内继续培养48小时。9.6孔板每孔加入1mlTrizol,用1ml枪头反复吹打10次,收集到EP管内;12000g离心15分钟,取上清。10.向上清中加入200ul氯仿,上下用力颠倒混匀半分钟,静置3分钟。℃11.温度4℃,12000g离心15分钟,此时可见裂解液分三层:上层为水相的RNA;中层为DNA,脂类等;下层为细胞残渣,蛋白,多糖等。12.取上清500ul到新的EP管内,167ul吸三次;加入等体积的异丙醇,混匀,静置10分钟后,4℃,12000g离心10分钟。13.小心去掉上清,注意不要丢失RNA沉淀,加入1ml75%乙醇,上下颠倒,使沉淀块重悬起。14.温度4℃,12000g离心10分钟,小心去掉上清,尽量吸干管壁的液体,注意不要丢失RNA沉淀,若沉淀松动可再次离心。晾干约15分钟,至管壁无液体。15.加入适量体积(20-30ul)的DEPC水溶解RNA,58℃水浴10分钟。16.取出2ul定量,测量buffer:10mMTrisCl(pH7.8),根据定量结果进行逆转录。(1A260=40μg/ml,A260/A280=1.8~2.1)17.RNA反转录根据操作说明书进行反转录,体系如下:在RNase-Free的PCR管中加入(总体系20ul)RNA3μgDEPC·H2O补足至11.0混匀,65℃孵育10min,立刻冰浴,然后加入2.5U/μlPolyAPolymerase1μlRTaseMix1μl5×PAP/RTBuffer5μlddH2O(RNase/Dnasefree)8μl37℃孵育60min,85℃,5min;cDNA冻存于-20℃或即刻PCR。18.qPCR检测1)在RT-PCR预实验摸索出最佳的引物退火温度和模板量的前提下,使用2×SYBRGreenMix配制PCRMix,根据需要上机的样品数和重复数,计算并配制PCRMix,体系如下:2×SYBRGreenMix10μlqPCR引物Mix1μl模板5μl超纯水4μl总体积20μl2)分装至PCR8连管,微型离心机瞬时离心混匀PCR体系。3)将上述样品放入IQ5荧光定量PCR仪,SYBRGreen法荧光定量PCR以分析各基因的表达,PCR程序设置如下:PCR反应可设成3步法:(退火温度结合引物的Tm值及RT-PCR预实验的结果自行设定,融解曲线可设60-95℃)预变性Cycle1:(1X)Datacollectionandreal-timeanalysisenabled.溶解曲线Cycle3:(71X)Step1:60.0℃-95.0℃for00:30.Increasesetpointtemperatureaftercycle2by0.5℃Meltcurvedatacollectionandanalysisenabled.qPCR相对定量结果分析目标基因的相对表达量计算公式为:2-△△Ct=2-【(△Ct)Test-(△Ct)Control】。Ct目的为目标基因Ct值,Ct内参为管家基因Ct值。△Ct=Ct目的-Ct管家,表示各样本目的基因相对管家基因的相对Ct值,△△Ct=(△Ct)Test-(△Ct)Control,表示处理组相对对照组进行归一化,2-△△Ct表示处理组相对对照组的相对表达量,表示目的基因的相对表达倍数。检测结果如图2~5所示。实施例三:人工环状RNA和scramble阴性对照circRNA以及阴性对照慢病毒(空病毒)包装1.转染前24h,用胰酶消化对数生长期的293T细胞,传代到10cm细胞培养皿,37℃、5%CO2培养箱内培养。24h待细胞密度达70%~80%时即可用于转染。细胞状态对于病毒包装至关重要,因此需要保证良好的细胞状态和较少的传代次数。2.转染前将细胞培养基更换为无血清培养基。3.向一灭菌离心管中加入所制备的各质粒DNA溶液(慢病毒质粒10μg,辅助质粒pLP1、pLP2、pLP/VSVG各5μg),与相应体积的Opti-MEM混合均匀,调整总体积为1.5ml。4.将Lipofectamine2000试剂轻柔摇匀,取60μlLipofectamine2000试剂在另一管中与1.5mlOpti-MEM混合,在室温下温育5分钟。5.把稀释后的DNA与稀释后的Lipofectamine2000进行混合,轻轻地颠倒混匀,不要振荡。6.混合后,在室温下温育20分钟,以便形成DNA与Lipofectamine2000稀释液的转染复合物。7.将DNA与Lipofectamine2000混合液转移至293T细胞的培养液中,混匀,于37℃,5%CO2细胞培养箱中培养。8.培养6小时后吸去含有转染混和物的培养基,每瓶细胞中加入含10%血清的细胞培养基10ml,于37℃、5%CO2培养箱内继续培养48小时。9.收集转染后48小时和72小时(转染即可为0小时计起)的293T细胞上清液。10.于4℃,4000g离心10min,除去细胞碎片。11.以0.45μm滤器过滤上清液于50ml离心管中。12.把病毒粗提液样品加入到过滤杯中,盖上盖子。将过滤杯插到滤过液收集管中。13.组合好后,做好平衡,放在转头上。14.在5000×g离心,至需要的病毒浓缩体积。通常需要的时间为10-15分钟。15.离心结束后,过滤杯中的即为病毒浓缩液。16.将病毒浓缩液移出,分装后保存在病毒管中,可在4℃保存一周,或-80℃长期保存。取其中一支进行病毒生物学滴度测定。实施例四:慢病毒感染结肠癌细胞后相关靶基因的qPCR检测1.复苏相应结肠癌细胞,按照相应培养条件,在37℃,5%CO2培养箱培养。2.将胞悬液接种于6孔板中(40万个/孔),37℃,5%CO2培养箱培养。3.根据结肠癌细胞MOI和各病毒滴度向细胞中分别加入适量的人工环状RNA过表达慢病毒、线性对照序列慢病毒和阴性对照慢病毒,同时加入浓度终为8ug/ml的Polybrene增强感染。4.感染24h后更换无慢病毒的完全培养基继续培养。5.感染72h后,6孔板每孔加入1mlTrizol,用1ml枪头反复吹打10次,收集到EP管内;12000g离心15分钟,取上清。6.向上清中加入200ul氯仿,上下用力颠倒混匀半分钟,静置3分钟。7.于4℃,12000g离心15分钟,此时可见裂解液分三层:上层为水相的RNA;中层为DNA,脂类等;下层为细胞残渣,蛋白,多糖等。8.取上清500ul到新的EP管内,167ul吸三次;加入等体积的异丙醇,混匀,静置10分钟后,4℃,12000g离心10分钟。9.小心去掉上清,注意不要丢失RNA沉淀,加入1ml75%乙醇,上下颠倒,使沉淀块重悬起。10.于4℃,12000g离心10分钟,小心去掉上清,尽量吸干管壁的液体,注意不要丢失RNA沉淀,若沉淀松动可再次离心。晾干约15分钟,至管壁无液体。11.加入适量体积(20-30ul)的DEPC水溶解RNA,58℃水浴10分钟。12,。取出2ul定量,测量buffer:10mMTrisCl(pH7.8),根据定量结果进行逆转录。(1A260=40μg/ml,A260/A280=1.8~2.1)13.RNA反转录根据操作说明书进行反转录,体系如下:在RNase-Free的PCR管中加入(总体系20ul)RNA3μgDEPC·H2O补足至11.0混匀,65℃孵育10min,立刻冰浴,然后加入2.5U/μlPolyAPolymerase1μlRTaseMix1μl5×PAP/RTBuffer5μlddH2O(RNase/Dnasefree)8μl37℃孵育60min,85℃,5min;cDNA冻存于-20℃或即刻PCR。14.qPCR检测4)在RT-PCR预实验摸索出最佳的引物退火温度和模板量的前提下,使用2×SYBRGreenMix配制PCRMix,根据需要上机的样品数和重复数,计算并配制PCRMix,体系如下:2×SYBRGreenMix10μlqPCR引物Mix1μl模板5μl超纯水4μl总体积20μl5)分装至PCR8连管,微型离心机瞬时离心混匀PCR体系。6)将上述样品放入IQ5荧光定量PCR仪,SYBRGreen法荧光定量PCR以分析各基因的表达,PCR程序设置如下:PCR反应可设成3步法:(退火温度结合引物的Tm值及RT-PCR预实验的结果自行设定,融解曲线可设60-95℃)预变性Cycle1:(1X)Datacollectionandreal-timeanalysisenabled.溶解曲线Cycle3:(71X)Step1:60.0℃-95.0℃for00:30.Increasesetpointtemperatureaftercycle2by0.5℃Meltcurvedatacollectionandanalysisenabled.15.qPCR相对定量结果分析目标基因的相对表达量计算公式为:2-△△Ct=2-【(△Ct)Test-(△Ct)Control】。Ct目的为目标基因Ct值,Ct内参为管家基因Ct值。△Ct=Ct目的-Ct管家,表示各样本目的基因相对管家基因的相对Ct值,△△Ct=(△Ct)Test-(△Ct)Control,表示处理组相对对照组进行归一化,2-△△Ct表示处理组相对对照组的相对表达量,表示目的基因的相对表达倍数。检测结果如图6~18所示。实施例五:人工环状RNA过表达慢病毒和scramble阴性对照circRNA过表达慢病毒以及阴性对照慢病毒(空病毒)感染后CCK8检测结肠癌细胞增殖活性。1.将细胞悬液接种于6孔培养板中,37℃,5%CO2培养箱培养。2.根据结肠癌细胞MOI和各病毒滴度向细胞中分别加入适量的人工环状RNA过表达慢病毒、线性对照序列慢病毒和阴性对照慢病毒,同时加入浓度终为8ug/ml的Polybrene增强感染。3.用胰酶消化感染24小时的细胞,制成4×104/ml细胞密度的细胞悬液,然后将100ul细胞悬液接种到96孔板中,5%CO2、37℃培养。4.分别在接种至96孔板72h后,每孔加入10ulCCK-8,混匀后培养箱中孵育2小时,测定450nm处的吸光值。5.酶标仪读取待测样品和空白对照在450nm处的OD值,将各待测样本的OD值记为测量值,空白对照的OD值记为空白值,则终值=测量值-空白值。检测结果如图19~21所示。实施例六:人工环状RNA过表达慢病毒和scramble阴性对照circRNA过表达慢病毒以及阴性对照慢病毒(空病毒)感染对结肠癌细胞裸鼠皮下成瘤效率的影响。1.复苏相应结肠癌细胞,按照相应培养条件,在37℃,5%CO2培养箱培养。2.结肠癌裸鼠皮下移植瘤模型构建:18-22g雌性BALB/c裸小鼠,随机分为空慢病毒干预组(lenti-NC)、scramble阴性对照序列慢病毒干预组(lenti-colon-circ-scrambleNC-1+lenti-colon-circ-scrambleNC-2)、colon-circ-1过表达慢病毒干预组(lenti-colon-circ-1)以及colon-circ-2过表达慢病毒干预组(lenti-colon-circ-2),每组10只,置于SPF条件下饲养;将100ulHCT116细胞(总细胞数107)接种在裸鼠右后肢背部。每天观察肿瘤生长情况和肿瘤大小,测定肿瘤体积(V=0.5×a×b2,其中a表示肿瘤长径,b表示肿瘤短径);当肿瘤体积≥100mm3时,分别利用阴性对照慢病毒lenti-NC、线性对照序列慢病毒lenti-linecontrol、人工环状RNA慢病毒lenti-circRNA进行瘤内注射,每次注射病毒量3x107TU,每3天注射一次,共注射6次;从首次注射病毒开始,每3天测量肿瘤体积,共测量7次,根据肿瘤体积大小绘制各组裸鼠肿瘤的生长曲线;病毒注射后的第18天取出肿瘤组织,测量肿瘤湿重;根据肿瘤生长曲线和湿重评估人工环状RNA抑制HCT116细胞裸鼠成瘤的活性。检测结果如图22所示。以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域技术人员对本发明的技术方案所作的各种变形和改进,均应落入本发明权利要求书确定的保护范围之内。序列表<110>上海锐赛生物技术有限公司<120>人工环状RNA的通用表达框架及其应用<160>14<170>SIPOSequenceListing1.0<210>1<211>89<212>DNA<213>artificialsequence<400>1tgagattacaggtgtgagccaccacccccggcctcactttttgtaaaggtacgtactaat60gactttttttttatacttcaggtaagtct89<210>2<211>70<212>DNA<213>artificialsequence<400>2tctctctctcttcaggtaagtagcaaggaaaagagttaggcccggcacggtagctcacac60ctgtaatccc70<210>3<211>439<212>DNA<213>artificialsequence<400>3tgagattacaggtgtgagccaccacccccggcctcactttttgtaaaggtacgtactaat60gactttttttttatacttcaggtaagtctacacactcaacatcagtctgataagctaaca120cactcaacatcagtctgataagctaacacactcaacatcagtctgataagctaacacact180caacatcagtctgataagctaacacactcaacatcagtctgataagctaacacactcaac240atcagtctgataagctaacacactcaacatcagtctgataagctaacacactcaacatca300gtctgataagctaacacactcaacatcagtctgataagctaacacactcaacatcagtct360gataagctatctctctctcttcaggtaagtagcaaggaaaagagttaggcccggcacggt420agctcacacctgtaatccc439<210>4<211>439<212>DNA<213>artificialsequence<400>4tgagattacaggtgtgagccaccacccccggcctcactttttgtaaaggtacgtactaat60gactttttttttatacttcaggtaagtctacacacgccatagactcgtaaatcattaaca120cacgccatagactcgtaaatcattaacacacgccatagactcgtaaatcattaacacacg180ccatagactcgtaaatcattaacacacgccatagactcgtaaatcattaacacacgccat240agactcgtaaatcattaacacacgccatagactcgtaaatcattaacacacgccatagac300tcgtaaatcattaacacacgccatagactcgtaaatcattaacacacgccatagactcgt360aaatcattatctctctctcttcaggtaagtagcaaggaaaagagttaggcccggcacggt420agctcacacctgtaatccc439<210>5<211>437<212>DNA<213>artificialsequence<400>5tgagattacaggtgtgagccaccacccccggcctcactttttgtaaaggtacgtactaat60gactttttttttatacttcaggtaagtctacacactcaacatcagtctgataagctaaca120cacctatctgcactagatgcaccttaacacacctacctgcactgtaagcactttgacaca180ctcacataggaatgaaaagccataacacacgcggaacttagccactgtgaaacacactca240gcagtaccagcctagaacacacacatcatcgcatattgacacaaacacacctacgcagaa300aggacacagtgacacacgatcacttttgtgactatgcaaacacacacaggccgggacaag360tgcaatatctctctctcttcaggtaagtagcaaggaaaagagttaggcccggcacggtag420ctcacacctgtaatccc437<210>6<211>437<212>DNA<213>artificialsequence<400>6tgagattacaggtgtgagccaccacccccggcctcactttttgtaaaggtacgtactaat60gactttttttttatacttcaggtaagtctacacactcaacatcagtctgataagctaaca120cacgcagtccattaactccctgatatacacacgtgaactatacgtcccgacttctacaca180cgaacgaattgaacataagaacctacacacgggaccgagtacacgcttaatacacacgcc240ccagtaaacggaacttacacacgccgttcaaactcatacaataaacacacgtcaggcaac300caacggagataacacacgctctagtatttcgcataagatacacacgcagccaaggtgacc360gaaagtatctctctctcttcaggtaagtagcaaggaaaagagttaggcccggcacggtag420ctcacacctgtaatccc437<210>7<211>21<212>DNA<213>artificialsequence<400>7acatcagtctgataagctaac21<210>8<211>20<212>DNA<213>artificialsequence<400>8gtgtagacttacctgaagta20<210>9<211>21<212>DNA<213>artificialsequence<400>9atagactcgtaaatcattaac21<210>10<211>20<212>DNA<213>artificialsequence<400>10gtgtagacttacctgaagta20<210>11<211>21<212>DNA<213>artificialsequence<400>11acgcggaacttagccactgtg21<210>12<211>20<212>DNA<213>artificialsequence<400>12gtgtagacttacctgaagta20<210>13<211>18<212>DNA<213>artificialsequence<400>13acgggaccgagtacacgc18<210>14<211>20<212>DNA<213>artificialsequence<400>14gtgtagacttacctgaagta20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1