蔗茅野生种中受低温胁迫表达的蔗茅类钙调素基因ErCML30的制作方法
本发明属于生物分子克隆技术领域,具体涉及低温胁迫下的蔗茅野生种编码类钙调素(calmodulin-like,cml)的基因,并基于该基因的序列设计引物,通过相对定量rt-pcr检测该钙结合蛋白基因在蔗茅野生种中差异表达的方法。
背景技术:
蔗茅(e.fulvus)是甘蔗属(saccharum)近缘的蔗茅属(erianthus)内的一个野生种,主要分布于我国云南、四川和西藏,生长海拔在500~2700m,具有抗寒、抗旱、耐瘠、宿根性强、抗绣病等优异特性,且易开花、花粉量极多。云南农业大学甘蔗研究所从蔗茅野生种的主要分布地区采集到不同生态类型的无性系材料150余份,并集中保育在本校的甘蔗资源圃内(海拔1930m)。甘蔗原产热带地区,适合种植于热带亚热带气候,是全世界种植面积最大的糖料作物,目前我国现在已基本形成了广西、云南和广东三大蔗区。近年来冬季极端天气频发,甘蔗在苗期生长发育过程中受低温胁迫严重影响,目前的甘蔗品种在苗期低温下常常出现生长点坏死,根系结构损伤严重,严重制约了甘蔗的生长、糖分及生物产量。因此,如何提高甘蔗品种对低温胁迫的抗性、培育抗低温的新品种,已经成为甘蔗遗传育种研究的重要课题(李富生等.开发利用蔗茅野生种质资源的思考[j].生物资源,2004,20(4):266-270;孙波,刘光玲,杨丽涛,李杨瑞.甘蔗幼苗根系形态结构及保护系统对低温胁迫的响应[j].中国农业大学学报,2014,19(06):71-80.;陆鑫等.甘蔗野生种滇蔗茅种质创新利用研究[j].植物遗传资源学报,2012,13(02):321-324.)。因此,通过发掘蔗茅野生种中的抗逆新基因,并从中克隆分离抗逆相关基因,对甘蔗抗逆育种具有重要意义。
类钙调素(calmodulin-like,cml)属于钙结合蛋白中的一类,钙离子信号是植物生长发育和逆境响应的主要调控因子,ca2+-cml信号系统参与了植物对多逆境信号的转导,当植物受到逆境胁迫时,钙离子浓度增加,钙离子与钙结合蛋白结合,导致这些钙结合蛋白疏水区外露并与生物膜或疏水性生物大分子结合,从而调节生物膜或这些靶蛋白的功能和酶促活性,即钙结合蛋白被激发而感受和传递钙信号(刘维.番茄钙调蛋白和类钙调蛋白的抗病调控功能分析[d].浙江大学,2015.;罗梅等.扶桑绵粉蚧钙调蛋白基因的克隆与生物信息学分析[j].华中农业大学学报,2012,31(03):320-324.;梁秋芬等.钙调蛋白在植物发育中的功能[j].生命科学研究,2005,(s2):1-5.)。目前类钙调素研究较少,在非生物胁迫方面,从水稻中克隆得到的水稻cml基因osmsr2和cml4受盐和干旱诱导,其作用与植物体内的激素aba介导的信号传递相关;在拟南芥中发现的cml10参与抗坏血酸的形成,维持植物体内的氧化还原平衡;在生物胁迫方面,cml调节植物对病原菌的防卫反应,拟南芥cml9的表达受病原菌和激素水杨酸诱导产生no和超敏反应,在番茄中的同源基因apr134也正向调节植物对病原菌的防卫反应(曾后清等.植物类钙调素生理功能的研究进展[j].中国科学:生命科学,2016,46(06):705-715.)。但是,目前还未见到类钙调素基因对植物低温胁迫下的作用机制报道,在甘蔗属中也尚未克隆到类钙调素基因。
技术实现要素:
本发明目的是为了提高现有栽培甘蔗品种的抗逆性,使甘蔗在低温逆境中能高产稳产从而适应近年来气候恶化的情况,提供一个新的蔗茅野生种中受低温胁迫诱导的类钙调素基因,还提供一种扩增该基因的引物,以及一种检测该基因在蔗茅野生种受低温胁迫的差异表达的方法,从而进一步为甘蔗抗寒性育种奠定基础并提供候选基因。
本研究从受低温胁迫的蔗茅野生种中利用电子克隆技术克隆获得一个类钙调素基因,在ncbi中经blastn比对分析,与已知的cml基因的同源性为95%,推测该基因编码的蛋白为类钙调素蛋白,故将该基因命名为蔗茅类钙调素基因ercml30。
本发明的技术方案如下:
1.蔗茅野生种中受低温胁迫表达的蔗茅类钙调素基因ercml30,其全长核苷酸序列如seqidno:1所示。
2.扩增技术方案1所述的蔗茅野生种中受低温胁迫表达的蔗茅类钙调素基因ercml30的专用引物,所述专用由上游引物gp-f和下游引物gp-r组成,所述上游引物gp-f的碱基序列如seqidno:2所示,所述下游引物gp-r的碱基序列如seqidno:3所示。
3.一种检测蔗茅类钙调素基因ercml30在蔗茅野生种受低温胁迫的差异表达方法,包括总rna的提取、cdna第一链的合成、相对定量rt-pcr技术检测蔗茅类钙调素基因ercml30在蔗茅野生种受低温胁迫的差异表达情况,其中:
在总rna的提取中将苗期的蔗茅野生种设为对照组和实验组,对照组在常温25℃条件下不做其他处理正常生长,实验组分为处理ⅰ和处理ⅱ,处理1在低温4℃条件下生长24h,处理ⅱ在低温4℃条件下生长72h,分别采集对照、处理ⅰ和处理ⅱ的叶片,分别加液氮快速磨碎获得三个样品,三个样品分别提取总rna;
在相对定量rt-pcr技术检测蔗茅类钙调素基因ercml30在蔗茅野生种受低温胁迫的差异表达情况中,使用所设计的特异引物作为rt-pcr引物进行不同处理和对照间的基因差异表达检测,所述特异引物由上游引物qf和下游引物qr组成,所述上游引物qf碱基序列如seqidno:4所示,所述下游引物qr的碱基序列如seqidno:5所示;所述蔗茅类钙调素基因ercml30的全长核苷酸序列如seqidno:1所示。
本发明首次提供了蔗茅野生种受低温胁迫表达的蔗茅类钙调素基因ercml30,以及扩增它的专用引物、检测该基因在蔗茅野生种受低温胁迫中差异表达的特异引物。在相对定量rt-pcr检测中该基因在没有低温胁迫的情况下几乎不表达,在24h的4℃低温处理后该基因在蔗茅中的表达量为对照的55倍,在72h的4℃低温处理后在蔗茅野生种中的表达量为对照的75倍,说明该基因在蔗茅野生种受到低温胁迫后表达量上升,且随胁迫时间的增加而增加,因此,所述蔗茅类钙调素基因ercml30属于受低温胁迫表达的诱导型表达基因,表明蔗茅类钙调素基因ercml30在蔗茅野生种受到低温胁迫后能迅速且持久的参与低温胁迫响应,为认识蔗茅类钙调素基因ercml30的抗逆机制,以及蔗茅野生种这一野生资源的利用提供了技术支撑。
本发明检测蔗茅类钙调素基因ercml30在蔗茅野生种受低温胁迫的差异表达的方法,所设计的特异性引物在相对定量rt-pcr中特异性强,无杂带产生,熔解曲线显示无引物二聚体产生。在内参基因的选择上,未选用gapdh基因、β-actin基因而是选择更适合的甘蔗的25srrna基因作为内参,其表达稳定性相对于其他内参基因更高(见图3)。本相对定量rt-pcr采用sybrgreeni嵌合荧光法进行,具有特异性强,灵敏度高,重复性好等特点。
序列表中seqidno:1所示的是蔗茅类钙调素基因ercml30的全长核苷酸序列。
序列表中seqidno:2所示的是扩增蔗茅类钙调素基因ercml30的上游引物gp-f的碱基序列。
序列表中seqidno:3所示的是扩增蔗茅类钙调素基因ercml30的下游引物gp-r的碱基序列。
序列表中seqidno:4所示的是特异引物的上游引物qf的碱基序列。
序列表中seqidno:5所示的是特异引物的下游引物qr的碱基序列。
序列表中seqidno:6所示的是内参基因25srrna的上游引物25s-f的碱基序列。
序列表中seqidno:7所示的是内参基因25srrna的下游引物25s-r的碱基序列。
附图说明
图1:蔗茅类钙调素基因ercml30的扩增结果。图1中,m:maker;泳道1、泳道2、泳道3分别为退火温度52℃、55℃、57℃下的扩增产物。
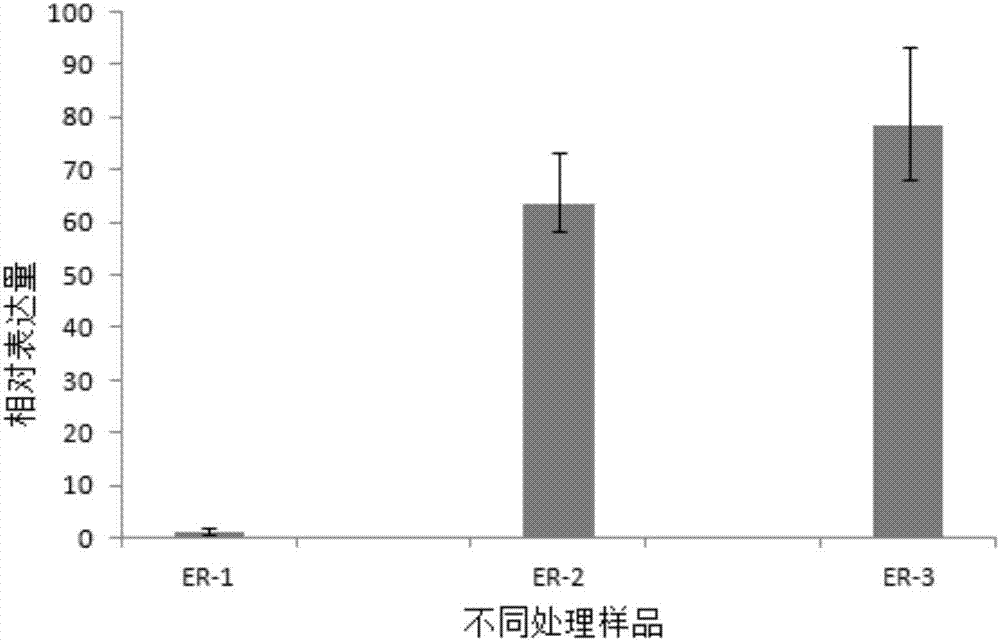
图2:不同低温胁迫时间处理下蔗茅野生种叶片中蔗茅类钙调素基因ercml30的相对荧光定量差异表达图。图2中,纵坐标表示基因的相对表达量,横坐标表示不同低温处理不同时间的样品。er-1:常温25℃处理下的蔗茅叶片,作为对照;er-2:4℃低温处理24h后的蔗茅叶片;er-3:4℃低温处理72h后的蔗茅叶片。
图3:特异性荧光定量引物检测结果。m:maker;泳道1、泳道2、泳道3分别为退火温度55℃、57℃、60℃下的扩增产物。
具体实施方式
以下实施例用于对本发明作进一步说明,但不用来限制本发明的保护范围。各实施例中无特殊说明的为常规方法。
实验材料:试验材料为蔗茅野生种(昆明蔗茅99-1),种植于云南农业大学甘蔗研究所的甘蔗资源圃内(云南昆明,海拔1930m)。
实施例1蔗茅野生种中受低温胁迫表达的蔗茅类钙调素基因ercml30的获得
一、设计扩增蔗茅野生种中受低温胁迫表达的蔗茅类钙调素基因ercml30全长序列的专用引物。
前期将不同处理后的蔗茅野生种送去进行高通量转录组测序,将返回的转录组测序结果进行生物信息学分析筛选,获得该基因转录组数据拼接的unigene序列,根据拼接得到的unigene序列利用生物软件primer5.0、oligo7设计扩增蔗茅类钙调素基因ercml30的专用引物,该专用引物由上游引物gp-f和下游引物gp-r组成,所述上游引物gp-f的碱基序列如seqidno:2所示,所述下游引物gp-r的碱基序列如seqidno:3所示,该专用引物送上海生工公司合成。
二、低温处理的蔗茅野生种叶片的总rna提取。
(1)样品的处理:取苗期生长状态基本一致的6盆蔗茅野生种使用光照培养箱进行试验处理,设对照组和实验组,2盆常温(25℃)生长其他不做处理作为对照(er-1),2盆低温处理24h(er-lt2),2盆低温处理72h(er-lt3),低温处理温度为4℃。
(2)将处理完成的叶片分别置于研钵中加液氮快速磨碎,每100mg样品加入1mltrizol提取液,涡旋振荡15s,每个时期的取样为一个处理样品,共6个处理样品。每个样品在15~30℃放置5min;加入氯仿,氯仿的用量为每使用1mltrizol加入200μl氯仿,盖好管带,涡旋振荡15s,15~30℃放置3min。
(3)4℃,12000rpm离心15min,此时溶液分为三层:黄色的是有机相,中间层和上层无色的是水相,rna主要存在水相中,把水相转移至另一新的无rnase离心管中。
(4)向得到的水相中加入等体积的异丙醇,混匀,15~30℃放置20-30min。
(5)4℃,12000rpm离心10min,弃上清。
(6)加入depc水配制的体积分数为75%的乙醇溶液洗涤沉淀,用量为每使用1mltrizol用1mldepc水配制的体积分数为75%的乙醇溶液。
(7)4℃,5000rpm离心3min,用枪头小心吸出上层液体,保留沉淀。
(8)沉淀在15~30℃晾干2-3min,加入30-100μl无rnase的双蒸水,充分溶解rna后,2个对照样品rna混合作为一个总对照样品于-70℃保存,2个时期的处理样品分别于-70℃保存;
三.cdna第一链的合成
(1)将模板rna在冰上解冻;5×gdnabuffer、fq-rtprimermix、10×fastrtbuffer、rnase-freeddh2o在室温(15-25℃)解冻,解冻后迅速置于冰上。使用前将每种溶液涡旋振荡混匀,简短离心(转速6000rpm,30s)以收集残留在管壁的液体。为了保证反应液配制的准确性,进行各项反应时,先配制成mix,然后再分装到每个反应管中。
(2)按照以下体系进行rna中的gdna去除体系配制混合液,彻底混匀。简短离心(转速6000rpm,30s),并置于42℃,孵育3min。然后置于冰上放置。
gdna去除反应体系:
5×gdnabuffer2μl
totalrna2μl
rnase-freeddh2o补足到10μl。
(3)按照以下体系的反转录反应体系配制混合液:
反转录反应体系:
10×fastrtbuffer2μl
rtenzymemix1μl
fq-rtprimermix2μl
rnase-freeddh2o补足到10μl。
(4)将反转录反应中的mix,加到gdna去除步骤的反应液中,充分混匀。42℃,孵育15min,95℃,孵育3min之后放于冰上,得到cdna用于后续实验,或低温-20℃保存。
四、蔗茅野生种的蔗茅类钙调素基因ercml30的扩增
以步骤三(4)反转录获得的cdna作为pcr反应的模板,以步骤一中设计的专用引物作为pcr反应引物,扩增蔗茅野生种叶片中受低温胁迫表达的蔗茅类钙调素基因ercml30全长,pcr反应体系:template1μl;上游引物gp-f1μl;下游引物gp-r1μl;buffer2μl;dntp2μl;pfu酶0.5μl;ddh2o补足到20μl;总体积为20μl。pcr反应程序为:95℃预变性2min;95℃变性30s;57℃退火30s;72℃延伸2min,35个循环;72℃,6min,后4℃保存。
五、目的基因的回收
pcr产物经1%琼脂糖凝胶电泳,将凝胶中的目的条带进行胶回收,步骤如下:
(1)在紫外灯下将目的条带胶块切下,尽量将不含dna片段的空白凝胶去掉后放入1.5ml离心管中。
(2)按每100μl胶块加入500μl溶胶液的比例向胶块中加入溶胶液,置60℃溶胶约10min,期间不断摇动。
(3)胶块完全溶解后将溶胶液转移到吸附柱中,18~22℃,12000rpm离心30s,去掉废液。
(4)向吸附柱中加入500μl漂洗液,18~22℃,12000rpm离心30s,倒掉废液。
(5)重复步骤(4),倒掉废液后的离心管12000rpm离心2min完全去掉废液,保留吸附柱。
(6)将吸附柱移至干净的1.5ml的离心管中,18~22℃放置2min使其残存于漂洗液中乙醇挥发干。
(7)向吸附柱膜中央加入30μl-50μl的洗脱缓冲液,18~22℃放置1-2min,12000rpm离心2min洗脱dna,离心管内收集的从吸附柱膜上洗脱的溶液即是目的片段的纯化产物回收液。
扩增结果如图1所示,其在退火温度为57℃时,扩增效果最好,无杂带产生。对扩增片段进行切胶回收后,经测序该回收片段序列与转录组获得的unigen序列一致,即该回收产物为蔗茅野生种叶片中受低温胁迫表达的蔗茅类钙调素基因ercml30,该回收产物的测序结果如序列表中seqidno:1所示。
实施例2本发明所提供的一种检测蔗茅类钙调素基因ercml30在蔗茅野生种受低温胁迫的差异表达方法,包括以下步骤:
一、样品的处理:
取苗期生长状态基本一致的6盆蔗茅野生种使用光照培养箱进行试验处理,设对照组和实验组,2盆常温(25℃)生长作为对照(er-1),2盆低温处理24h(er-2),2盆低温处理72h(er-3),低温处理温度为4℃。
二、总rna的提取
(1)将处理完成的叶片分别置于研钵中加液氮快速磨碎,每100mg样品加入1mltrizol提取液,涡旋振荡15s,每个时期的取样为一个处理样品,共6个处理样品。每个样品在15~30℃放置5min;加入氯仿,氯仿的用量为每使用1mltrizol加入200μl氯仿,盖好管带,涡旋振荡15s,15~30℃放置3min;4℃,12000rpm离心15min,此时溶液分为三层:黄色的是有机相,中间层和上层无色的是水相,rna主要存在水相中,把水相转移至另一新的无rnase离心管中;
(2)向得到的水相中加入等体积的异丙醇,混匀,15~30℃放置20-30min;4℃,12000rpm离心10min,弃上清;
(3)加入depc水配制的体积分数为75%的乙醇溶液洗涤沉淀,用量为每使用1mltrizol用1mldepc水配制的体积分数为75%的乙醇溶液;4℃,5000rpm离心3min,用枪头小心吸出上层液体,保留沉淀;
(4)沉淀在15~30℃晾干2-3min,加入30-100μl无rnase的双蒸水,充分溶解rna后,将对照和2个处理的样品rna于-70℃保存。
三.cdna第一链的合成
(1)将模板rna在冰上解冻;5×gdnabuffer、fq-rtprimermix、10×fastrtbuffer、rnase-freeddh2o在室温(15-25℃)解冻,解冻后迅速置于冰上。使用前将每种溶液涡旋振荡混匀,简短离心(转速6000rpm,30s)以收集残留在管壁的液体。为了保证反应液配制的准确性,进行各项反应时,先配制成mix,然后再分装到每个反应管中。
(2)按照以下体系进行rna中的gdna去除体系配制混合液,彻底混匀。简短离心(转速6000rpm,30s),并置于42℃,孵育3min。然后置于冰上放置。
gdna去除反应体系:
5×gdnabuffer2μl
totalrna2μl
rnase-freeddh2o补足到10μl。
(3)按照以下体系的反转录反应体系配制混合液:
反转录反应体系:
10×fastrtbuffer2μl
rtenzymemix1μl
fq-rtprimermix2μl
rnase-freeddh2o补足到10μl。
(4)将反转录反应中的mix,加到gdna去除步骤的反应液中,充分混匀。42℃,孵育15min,95℃,孵育3min之后放于冰上,得到cdna用于后续实验,或低温保存。
四、相对定量rt-pcr技术检测蔗茅野生种叶片中受低温胁迫表达的蔗茅类钙调素基因ercml30的差异表达情况,实验在abi公司7500荧光量pcr仪上进行,对低温处理前后的基因表达情况进行分析(见图2)。
(1)相对定量rt-pcr反应体系:
类钙调素基因ercml30相对定量rt-pcr反应体系的配置:
上游引物qf的碱基序列如seqidno:4所示,下游引物qr的碱基序列如seqidno:5所示。
内参基因25srrna相对定量rt-pcr反应体系的配置:
上游引物25s-f的碱基序列如seqidno:6所示,下游引物25s-r的碱基序列如seqidno:7所示。
(2)相对定量rt-pcr反应程序:
95℃预变性15min,
95℃变性10s,
60℃退火32s,40个循环;试验数据在abi公司7500荧光定量pcr仪上进行分析。
结果分析:通过相对定量rt-pcr检测了蔗茅类钙调素基因ercml30在不同低温胁迫时间下的蔗茅野生种叶片中的2个时期的差异表达情况(见图2),发现低温处理后的蔗茅野生种叶片中蔗茅类钙调素基因ercml30表达差异显著,该蔗茅类钙调素基因ercml30在没有低温胁迫的情况下几乎不表达,处理24h后蔗茅类钙调素基因ercml30在蔗茅野生种中的表达量为对照的50倍,处理72h后蔗茅类钙调素基因ercml30在蔗茅野生种中的表达量为对照的75倍,说明蔗茅类钙调素基因ercml30在蔗茅野生种受到低温胁迫后表达量上升,且随胁迫时间的增加而增加。因此该蔗茅类钙调素基因ercml30属于受低温胁迫表达的诱导型表达基因,表明该蔗茅类钙调素基因ercml30在受到低温胁迫后能迅速且持久的参与低温胁迫响应。
序列表
<110>云南农业大学
<120>蔗茅野生种中受低温胁迫表达的蔗茅类钙调素基因ercml30
<160>7
<170>siposequencelisting1.0
<210>1
<211>795
<212>dna
<213>蔗茅野生种(e.fulvus)
<220>
<221>cds
<222>(82)..(645)
<223>编码序列
<220>
<221>5’utr
<222>(1)..(81)
<223>不被翻译成蛋白质的成熟转录本的5'末端区域
<220>
<221>3’utr
<222>(646)..(795)
<223>不被翻译成蛋白质的成熟转录本的3'末端区域
<220>
<221>protein_bind
<222>(163)..(636)
<223>保守结构域ef结构域
<220>
<221>primer_bind
<222>(1)..(20)
<223>pcr引物元件的位点
<220>
<221>primer_bind
<222>(775)..(795)
<223>pcr引物元件的位点
<400>1
agaaataaccagccctcgcatccgcacgcccacaaaaccacgaagaaaagaagaggagga60
acgccgcaagttcacgcgacgatggagaacgccactcccgccatcgccaag111
metgluasnalathrproalailealalys
1510
ccgtcgctgtccaagaagccctcgccgtcgttccgcctccggaacggc159
proserleuserlyslysproserproserpheargleuargasngly
152025
agcctcaacgctctgcgcctgcgccgcgtgttcgacctcttcgaccgc207
serleuasnalaleuargleuargargvalpheaspleupheasparg
303540
aacggcgacggcgagatcaccctcgacgagatggcctcggcgctcgac255
asnglyaspglygluilethrleuaspglumetalaseralaleuasp
455055
tcgctcggcctcggcgccgaccgctccggcctggaggccgcggtgggc303
serleuglyleuglyalaaspargserglyleuglualaalavalgly
606570
gggtacatcccggccggcgccgcggggctccgcttcgacgacttcgag351
glytyrileproalaglyalaalaglyleuargpheaspasppheglu
75808590
tccctccaccgcgcgctcggggacgcgctgttcggccccatcccggag399
serleuhisargalaleuglyaspalaleupheglyproileproglu
95100105
gaggtgcctgaggacgacgacgagggggacatgaaggaggcgttccgg447
gluvalprogluaspaspaspgluglyaspmetlysglualaphearg
110115120
gtgttcgacgaggacggtgacggcttcatctcggccgccgagctgcag495
valpheaspgluaspglyaspglypheileseralaalagluleugln
125130135
gccgtgctcaagaagctcggtctgccggaggctcggaacctggccact543
alavalleulyslysleuglyleuproglualaargasnleualathr
140145150
gtgcaggagatgatctgcaacgtcgaccgcaactgcgacggccgcgtc591
valglnglumetilecysasnvalaspargasncysaspglyargval
155160165170
gacttcggcgaattcaagaacatgatgcaggggatcaccgtgtggggc639
asppheglygluphelysasnmetmetglnglyilethrvaltrpgly
175180185
gcttagctgcagagcgcctgcgttgtcagcccctctactgcgtggtttcatgtatg695
ala
tatctaggcaccgtagaatgcgcttttctacccggcgcttcttcctgttcttgatcgcgc755
agtggattcttgctgttcttggctttgctctctgactcga795
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_
<222>(1)..(20)
<223>上游引物gp-f
<400>2
agaaataaccagccctcgca20
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_
<222>(1)..(20)
<223>下游引物gp-r
<400>3
tcgagtcagagagcaaagcc20
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_
<222>(1)..(20)
<223>上游引物qf
<400>4
ccctctactgcgtggtttca20
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_
<222>(1)..(20)
<223>下游引物qr
<400>5
tcgagtcagagagcaaagcc20
<210>6
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_
<222>(1)..(22)
<223>上游引物25s-f
<400>6
ataaccgcatcaggtctccaag22
<210>7
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_
<222>(1)..(21)
<223>下游引物25s-r
<400>7
cctcagagccaatccttttcc21
- 还没有人留言评论。精彩留言会获得点赞!