重组酿酒酵母及生料发酵生产乙醇的方法与流程
本发明涉及基因工程领域,具体而言,涉及采用基因工程手段改造酿酒酵母,从而获得重组的酿酒酵母并将该重组酵母应用于生料发酵生产生物乙醇的实践中。
背景技术:
生物乙醇是一种绿色的可再生燃料,主要由纤维素质原料与淀粉质原料发酵获得,具有巨大生产潜能,成为了目前世界能源研究开发的热点之一。
我国目前在工业实践中主要以玉米和小麦等富含淀粉质的原料生产乙醇。由于生产原料来源广泛、成本低廉,因此,生物乙醇是一种很有潜力的生物资源。就大规模生产而言,对现有技术进行改进,降低原料淀粉转化为乙醇的生产成本十分重要。而酿酒酵母(saccharomycescerevisiae)是用于乙醇发酵工业中的重要微生物,但它不具备淀粉水解能力,不能直接发酵淀粉,因此淀粉质原料需要通过液化、糖化最终降解为葡萄糖后再被酿酒酵母利用来生产乙醇。生料发酵,是指原料无需先经过蒸煮液化糖化而直接在低于淀粉糊化的温度下用生料淀粉酶处理原料,使糖化、发酵同时进行,具有能源消耗低,淀粉出酒率高等优点。如果酵母菌株本身能够具备淀粉水解功能,就可以减少生产工序中的淀粉酶和糖化酶的添加量,从而降低乙醇的生产成本。
α-淀粉酶(ec3.2.1.1)作用于淀粉等多糖类物质,随机地水解分子内的α-1,4糖苷键,产生麦芽寡糖和少量葡萄糖。α-淀粉酶水解产生更多的非还原末端,为糖化酶(ec3.2.1.3)提供更多的底物,两者在水解淀粉时协同作用,促进葡萄糖的生成。因此,如果酿酒酵母能具备a-淀粉酶和糖化酶的功能,将会有助于以低成本生产生物乙醇。
为了能够降低现有的生物乙醇发酵工艺的生产成本,本领域存在如下方面的需要:通过基因工程手段改良现有的酿酒酵母菌种,以获得能够直接降解淀粉的酵母工程菌,从而实现良好的产业价值。
技术实现要素:
为了解决现有的以淀粉为原料的生物乙醇产业中存在的工艺复杂及生产成本较高的问题,本发明的一个目的是以商业化的酿酒酵母菌株作为出发菌株,通过基因工程手段对菌株进行改造,从而提供既有α淀粉酶功能又有糖化酶功能且能表现出良好的发酵性能的重组酿酒酵母。
为达到上述目的,在一个方面,本发明提供了一种重组酿酒酵母,其中,在所述酿酒酵母的基因组中整合有编码糖化酶的核苷酸序列和编码α淀粉酶的核苷酸序列。
本发明的另一目的在于提供包含上述重组酿酒酵母的组合物。
本发明的又一目的在于提供生料发酵生产乙醇的方法,其中,所述方法包括采用上述的重组酿酒酵母或组合物进行发酵来生产乙醇。
本发明的重组酿酒酵母,具有以下优点:
1.本发明的重组酿酒酵母实现了淀粉液化、糖化与酿酒酵母生长和乙醇发酵耦合,简化了发酵工艺,降低了能耗;
2.本发明的重组酿酒酵母的发酵生长适宜温度为30℃-34℃,具有一定的鲁棒性,产酒酒份为16.6%-17.1%(v/v),残总糖为2.7-3.2g/100ml,具有良好的发酵性能;
3.本发明的重组酿酒酵母的淀粉酶活性较高且表现出与淀粉水解相关的多种酶的酶活,在生物乙醇发酵工业中,可有效替代向生料中添加的淀粉酶总量的20wt%以及外源糖化酶的总量的50wt%,降低了乙醇生产成本。
附图说明
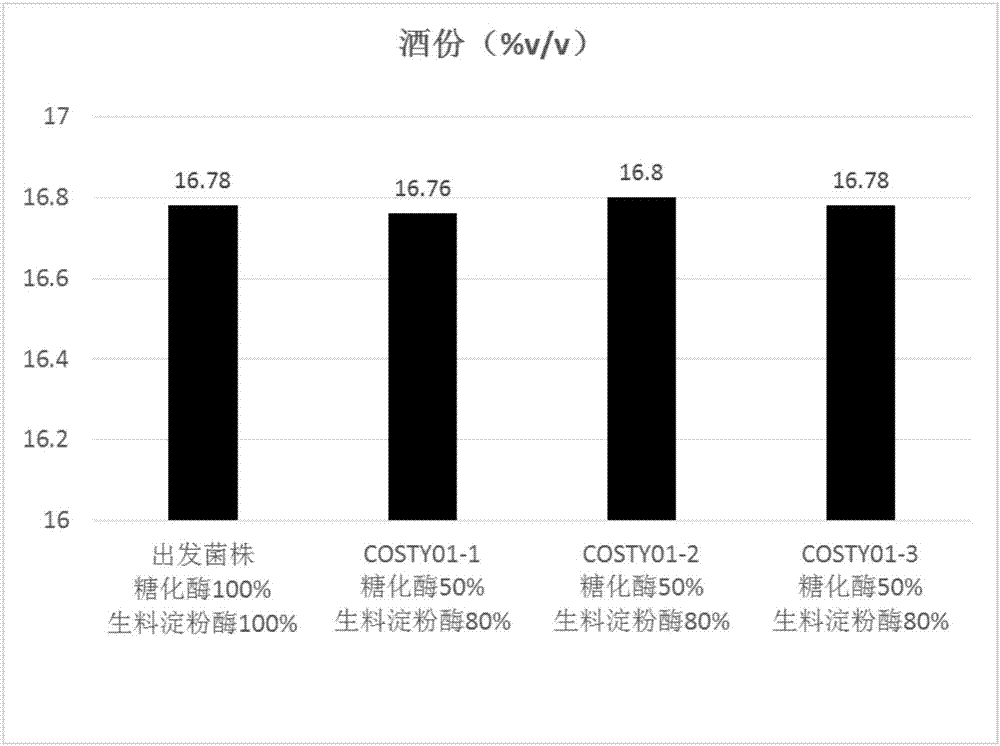
图1为示出了采用出发菌株和本发明的重组酿酒酵母进行发酵生产乙醇的酒份分析结果统计图表。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不旨在限制本发明。
在本发明中,除非另有说明,术语“核苷酸序列”、“表达基因”、“基因序列”、“基因片段”均是指核苷酸按照一定顺序排列组成的一级结构,并且可互换使用。
编码α淀粉酶的核苷酸序列
本发明可采用本领域已知的任意的编码α淀粉酶的核苷酸序列,例如,可采用genbank数据库(https://www.ncbi.nlm.nih.gov/genbank/)中公开的编码α淀粉酶的核苷酸序列,例如采用schwanniomycesoccidentalis来源的编码α淀粉酶的核苷酸序列(genbank:x73497.1)作为目标核苷酸序列。可优选将编码α淀粉酶的核苷酸序列按照酿酒酵母的密码子偏好进行优化。所述目标核苷酸序列可通过本领域已知的任意常规技术手段获得,例如,通过pcr方法从相应的菌株的基因组中扩增得到,或者根据本领域已知的相关基因的序列进行人工合成。
优选地,本发明所述的编码α淀粉酶的核苷酸序列为通过seqidno.1表示的序列。
编码糖化酶的核苷酸序列
本发明可采用本领域已知的任意的编码糖化酶的核苷酸序列,例如,可采用genbank数据库中公开的编码糖化酶的核苷酸序列,例如采用saccharomycopsisfibuligera来源的编码糖化酶的核苷酸序列作为目标核苷酸序列。可优选将编码糖化酶的核苷酸序列按照酿酒酵母的密码子偏好进行优化。所述目标核苷酸序列可通过本领域已知的任意常规技术手段获得,例如,通过pcr方法从相应的菌株的基因组中扩增得到,或者根据本领域已知的相关基因的序列进行人工合成。
优选地,本发明所述的编码糖化酶的核苷酸序列为通过seqidno.2表示的序列。
重组酿酒酵母的构建及由此获得的重组酿酒酵母
本领域已知构建重组载体的各种方法,以用来将目的基因片段连接至表达载体来制备重组载体,例如但不限于,经典的“酶切-连接”方法、invitrogen公司开发的gateway克隆系统、clontech公司开发的creator克隆系统、stephenelledge实验室开发的univector克隆系统以及基于iis型限制性内切酶的goldengate克隆法(诸如,采用thermofisher提供的genearttypeiisassemblykits试剂盒)。
另外,本发明采用的载体可为本领已知的能够用于酿酒酵母的任意商业化载体(包括但不限于pgapzαa载体、phc11载体、ppic9k载体等)或者可为本领域技术人员能够利用常规方法构建的载体。
例如,采用goldengate方法构建得到本发明的重组载体:将α-factor序列与目标核苷酸序列相连,得到目标片段,然后在该目标片段的上下游分别连接启动子和终止子,得到目标基因表达盒;同时,将启动子、抗性基因和终止子依次连接,构建得到抗性基因表达盒;基于酿酒酵母出发菌株的基因组,采用pcr方法扩增得到靶向插入部位的上下游同源臂序列;将目标基因表达盒、抗性基因表达盒及上下游同源臂序列串联连接,得到重组载体。
随后,可采用本领域已知的常规方法将该重组载体导入酿酒酵母中,例如但不限于,通过显微注射、基因枪、转化(例如电转化)、感染或转染。上述的显微注射、基因枪、转化、感染或转染均为本领域已知的常规操作。例如,转化是指通过采用分子生物学和基因工程中的一些已知方法处理细胞,使经处理后的细胞处于感受态,并由此与外源dna接触,从而使外源dna进入处于感受态的细胞中。常用的转化方法包括原生质体转化法、化学转化法和电穿孔转化法。感染是指用经人工改造的噬菌体活病毒作载体,将该载体与目的dna序列重组后,在体外用噬菌体或病毒的外壳蛋白将重组dna包装成有活力的噬菌体或病毒,从而以感染的方式使重组dna进入宿主细胞中。转染是指通过cacl2、电穿孔等方法将细胞处理成感受态细胞,然后使该感受态细胞接受重组的噬菌体dna。
在将重组载体导入酿酒酵母中之后,通过筛选标记(例如抗性基因)筛选出阳性克隆,并通过基因组pcr进行验证、或者通过对基因组dna测序进行验证,从而得到重组酿酒酵母。在所述的重组酿酒酵母的基因组中整合有编码糖化酶的核苷酸序列和编码α淀粉酶的核苷酸序列。本发明所述的重组酿酒酵母既具有淀粉酶活性又具有糖化酶活性。优选,本发明所述的重组酿酒酵母既可分泌表达淀粉酶又可分泌表达糖化酶。
重组酵母的酶活测定方法为:以可溶性淀粉为底物,与酵母培养液混合反应后,使用dns法检测反应液中的还原糖。dns溶液配制及反应条件为本领域已知,例如可参考《生物化学实验方法和技术》,陈毓荃编,2002年8月1日,科学出版社。
另外,本发明还涉及包含上述的重组酿酒酵母的组合物。例如,将本发明所述的重组酿酒酵母与乙醇发酵工序所需的其它的多种成分组合在一起使用,或者将本发明所述的重组酿酒酵母利用吸附剂等制成活菌制剂。
此外,本发明进一步涉及生料发酵生产乙醇的方法,其中,所述方法包括采用上述的重组酿酒酵母或组合物进行发酵来生产乙醇。本发明所述的生料可为本领域已知的用于乙醇生产工艺中的任意生料,例如淀粉质原料。
除非另有说明,本文所使用的实验方法均为本领域技术人员所熟知的常规方法,例如可利用下列著作中描述的标准程序来实施:sambrook等,molecularcloning:alaboratorymanual(第3版),coldspringharborlaboratorypress,coldspringharbor,n.y.,usa(2001);davis等,basicmethodsinmolecularbiology,elseviersciencepublishing,inc.,newyork,usa(1995);以及currentprotocolsincellbiology(cpcb)(juans.bonifacino等著,johnwileyandsons,inc.)。
本发明以中粮生化能源(肇东)有限公司连续发酵5代的酿酒酵母为出发菌株(但是本领域已知的任意的商业化的酵母菌株均适用本发明并能够实现本发明的目的),通过分别将糖化酶表达基因和α淀粉酶表达基因整合到酿酒酵母基因组中的多拷贝位点,通过酶活检测挑选目标酶活高的重组菌株,最后对所获得的具有液化糖化功能的重组酿酒酵母通过实际的生物乙醇发酵物料及生料发酵工艺的小试进行检查。
本发明得到的酿酒酵母工程菌命名为costy01。发酵的适宜温度为30℃-34℃,具有一定的鲁棒性,产酒酒份为16.6%(v/v)-17.1%(v/v),残总糖为2.7-3.2g/100ml。可见,本发明的重组酿酒酵母具有良好的发酵性能。
对于上述重组酿酒酵母costy01,本发明申请人已于2017年12月18日保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmccno.15102,其分类命名为酿酒酵母(saccharomycescerevisiae)。
本发明所述的酿酒酵母costy01具有α淀粉酶和糖化酶活性,可有效替代向生料中添加的淀粉酶总量的20wt%和外源糖化酶总量的50wt%,实现淀粉液化糖化与酿酒酵母生长和乙醇发酵耦合,能够应用于生产乙醇中,降低乙醇生产成本。
为了进一步理解本发明,下面结合具体实施例对本发明进行详细阐述,如无特殊说明,本发明实施例中所涉及的试剂和原料均为市售产品,均可以通过商业渠道购买获得。
实施例
接下来,通过实施例对本发明进行进一步的详细说明,但本发明的保护范围并不局限于这些实施例。
实施例中涉及的高保真pcr使用primestardna聚合酶(购于takara),涉及的基因组pcr使用2×easytaqpcrsupermix(购于transgen),所用pcr条件参考相应试剂说明书。涉及dna凝胶电泳切胶回收使用胶回收试剂盒(购于omega),涉及酿酒酵母基因组dna提取使用酵母基因组dna提取试剂盒(购自tiangen)。涉及goldengate的iis类限制性内切酶为bsmbi(购于thermo)和bsai(购于neb),连接酶为t4dna连接酶(购于neb)。
实施例1糖化酿酒酵母基因工程菌的构建
以中粮生化能源(肇东)有限公司连续发酵5代的酿酒酵母为出发菌株。
将saccharomycopsisfibuligera来源的糖化酶部分序列(genbank:cac83969.1,氨基酸27-515)按照酿酒酵母密码子偏好性进行优化,做全基因合成,得到glu基因序列(seqidno.1)。将α-factor序列(来自商业化的ppic9k质粒;其中,α-factor序列的具体信息请参见如下记载:https://www.thermofisher.com/order/catalog/product/v17520?sid=srch-srp-v17520的手册和实验方案)与上述合成的glu基因序列用goldengate方法(bsai)连接获得o-afglu质粒,进而再与fba1p启动子和cyc1t终止子用goldengate方法(bsmbi)连接获得glu表达盒pot2-fba-afglu。继续使用goldengate方法(bsai)将该glu表达盒、kanmx抗性基因表达盒(来自商业化的prs42k质粒;其中,kanmx抗性基因表达盒的具体信息参见http://www.euroscarf.de/plasmid_details.php?accno=p30637)及酿酒酵母基因组的delta位点(genbank:x00393.1)1-239bp和240-487bp分别作为两端同源臂序列进行组装,得到目的质粒k2-delta-kanmx-fba-afglu,经测序验证质粒正确。该质粒具有用于整合筛选的kanmx抗性基因、用于糖化酶表达的glu目的基因以及用于使目的基因整合入酿酒酵母基因组中的同源臂片段。
k2-delta-kanmx-fba-afglu质粒经bsmbi内切酶(购于neb)于37℃下酶切3小时线性化,进行琼脂糖凝胶电泳(tae缓冲液,琼脂糖浓度为1.0%(w/v),电场强度为4v/cm),随后,从凝胶中切下约4500bp的条带回收目的片段,采用电转化方法(电击条件为1.5kv,200w,25μf,5ms),用1μg的该回收片段对80μl的出发菌株进行重组转化,然后,将复苏后的全部菌液于5000rpm下离心5min,用100μl1m山梨醇溶液重悬后涂布在包含g418抗生素的ypd培养基上,于30℃下培养48h至菌落出现,获得转化子。挑取单菌落并接种在yps固体培养基(2wt%淀粉、2wt%蛋白胨、1wt%酵母粉、2wt%琼脂粉以及余量的水,ph7.0)上于30℃下静置培养2天,选取水解圈直径大于3mm的单菌落,接种于5mlypd培养基中在30℃和150rpm下培养过夜,分别提取酵母基因组dna,使用引物1和引物2(分别为seqidno.3和seqidno.4)扩增50ng基因组dna,将pcr产物进行琼脂糖凝胶电泳(tae缓冲液,琼脂糖浓度为1.0%(w/v),电场强度为4v/cm),得到1470bp的条带,由此确认glu基因成功整合到酵母基因组中,得到阳性转化子。
挑取阳性转化子的单菌落接种于30ml的ypd(2wt%葡萄糖、2wt%蛋白胨、1wt%酵母粉以及余量的水,ph7.0)液体培养基中,在30℃下于150rpm的转速下培养72h,取30μl培养液上清与150μl的20g/l可溶性淀粉溶液反应1小时,通过用dns法测定反应液中的还原糖来对糖化酶酶活进行检测。将表现出糖化酶活性的基因工程菌株命名为cotyh。
实施例2液化糖化酵母基因工程菌的构建
将schwanniomycesoccidentalis来源的α淀粉酶序列(genbank:caa51912.1)按照酿酒酵母的密码子偏好性进行优化,做全基因合成,得到swa2基因序列(seqidno.2)。将α-factor序列与上述合成的swa2基因序列用goldengate方法连接获得o-αfswa2质粒,进而与fba1p启动子和cyc1t终止子用goldengate方法连接获得swa2表达盒pot2-fba-afswa2。继续使用goldengate方法将swa2表达盒、nat抗性基因表达盒(来自商业化的pis419质粒;其中,nat抗性基因表达盒的相关的具体信息可参见如下的记载:http://www.euroscarf.de/plasmid_details.php?accno=p30574)及酿酒酵母基因组的rdna(nts)位点(genbank:x00486.1)的2471-1265bp和1266-2510bp分别作为两端同源臂序列进行组装,得到目的质粒k2-rdna-nat-fba-afswa2。该质粒具有用于整合筛选的nat抗性基因、用于淀粉酶表达的swa2目的基因以及用于使目的基因整合入酿酒酵母基因组中的同源臂片段。
k2-rdna-nat-fba-afswa2质粒经bsmbi内切酶(购自neb)于37℃下酶切3小时线性化后,进行琼脂糖凝胶电泳(tae缓冲液,琼脂糖浓度为1.0%(w/v),电场强度为4v/cm),随后,从凝胶中切下约6100bp的条带,回收目的片段,采用电转化方法(电击条件为1.5kv,200w,25μf,5ms),用1μg的该回收片段对80μl的酿酒酵母cotyh进行重组转化,然后,将复苏后的全部菌液于5000rpm下离心5min,用100μl1m山梨醇溶液重悬后涂布在包含nat抗生素的ypd固体培养基上,于30℃下培养48h至菌落出现,获得转化子。挑取单菌落并接种在yps固体培养基上于30℃下静置培养两天,选取水解圈直径大于10mm的单菌落接种于5mlypd培养基中在30℃和150rpm下培养过夜,分别提取酵母基因组dna,用引物3和引物4(分别为seqidno.5和seqidno.6)扩增50ng基因组dna,进行基因组pcr验证,将pcr产物进行琼脂糖凝胶电泳(tae缓冲液,琼脂糖浓度为1.0%(w/v),电场强度为4v/cm),得到1500bp的条带,由此确认swa2基因成功整合到酵母基因组中,得到阳性转化子。
挑取阳性转化子的单菌落接种于30mlypd(2wt%葡萄糖、2wt%蛋白胨、1wt%酵母粉以及余量的水,ph7.0)液体培养基中,在30℃下于150rpm的转速下培养72h,取30μl培养液上清与150μl的2wt%可溶性淀粉溶液反应0.5小时,通过用dns法测定反应液中的还原糖来对淀粉酶酶活进行检测,经检测发现,该实施例得到的基因工程菌(命名为costy01)具有比出发菌株和cotyh更高的淀粉水解能力。
实施例3通过实际的生物乙醇的生料发酵小试来对液化糖化酿酒酵母进行检测
选取3株实施例2中得到基因工程菌并分别命名为costy01-1、costy01-2和costy01-3,同时以出发菌株作为对照,通过进行发酵来证实本发明所述的重组酿酒酵母的液化糖化效果。
物料处理工艺条件为:将玉米粉在50℃下浸泡2小时,向其中加入生料淀粉酶于60℃下液化60min,转速60rpm,干物占比为32wt%,ph4.5,即为液化醪;其中,生料淀粉酶为购自诺维信的生料复合酶50103,常规添加量为1.0kg/t粮,减少20wt%的加入量(下文称为20wt%减量)即为0.8kg/t粮。将出发菌株和重组酿酒酵母的3株菌株接种于ypd液体培养基中,在30℃下于150rpm的转速下培养18h以上,取种子液用计数板计数,按初始0.125亿/ml的接种量(即350ml液化醪需要接种4.375×109个酵母)折算种子液取用量,分别在8000rpm下离心收集菌体,将菌体用无菌水洗净后接种分别将出发菌株以及重组酿酒酵母(costy01-1、costy01-2和costy01-3)接种至生料淀粉酶和糖化酶(苏红牌ga475,常规添加量为1.72kg/t粮)不减量的350ml液化醪中以及生料淀粉酶减量20wt%且糖化酶减量50wt%的350ml液化醪中,随后在32℃下于80rpm的转速下振荡培养88h。
取约10ml发酵液,用斐林试剂法检测还原糖、残总糖、过滤总糖等;取10ml发酵液用两层纱布过滤,无菌水将过滤液稀释10倍后检测酵母死亡率,并将结果示于下表1中。另取12ml发酵液倒入15ml离心管中,向其中加入65%v/v硫酸并混合均匀以使酶失活,同时调节ph值为1.0-1.5,4000rpm下离心20min,然后用注射器吸取离心上清液,用0.22μm微孔滤膜进行过滤,取2ml滤液进行hplc分析,检测器为rid,检测色谱柱为
表1发酵液的检测分析结果
注:以向生料中常规添加的α淀粉酶和糖化酶的量(即,不减量的情况)记为100%;相对于不减量的情况而言,减少50wt%的糖化酶添加量记为50%;相对于不减量的情况而言,减少20wt%的糖化酶添加量记为80%.
结果显示出,在减少20wt%的生料淀粉酶添加量且减少50wt%的糖化酶添加量条件下,本发明的重组酿酒酵母的发酵性能与常规的淀粉酶和糖化酶添加量下的出发菌株的发酵性能持平。这表明了本发明所述的重组酿酒酵母表现出了淀粉酶和糖化酶活性,并且能够实现淀粉液化、糖化与酿酒酵母生长和乙醇发酵相耦合,从而减少了现有的乙醇生产工艺中添加的淀粉酶和糖化酶的量。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
序列表
<110>吉林中粮生化有限公司
中粮营养健康研究院有限公司
中粮生化能源(肇东)有限公司
<120>重组酿酒酵母及生料发酵生产乙醇的方法
<130>shic178226-26/18
<141>2017-12-29
<160>6
<170>siposequencelisting1.0
<210>1
<211>1470
<212>dna
<213>saccharomycopsisfibuligera
<400>1
aatacaggtcattttcaagcatattcaggttatacagttgctcggtccaattttacacag60
tggattcatgaacaaccagcagtttcttggtattatttgttacaaaatattgattatcct120
gaaggtcaattcaaatctgctaaacctggtgttgttgttgcttcaccatctacttcagaa180
ccagattatttttatcagtggactagggatactgctattacatttttgtctttgattgct240
gaagttgaagatcattctttttctaatactactttggctaaagttgttgaatattatatt300
tcaaatacatatactttacaaagagtttcaaatccatcaggtaattttgattctcctaat360
catgatggtttgggtgaacctaagtttaatgttgatgatacagcttatacagcatcatgg420
ggtaggccacaaaatgatggtccagctttaagggcatacgctatttctaggtatttgaat480
gcagttgctaaacataacaacggtaaattgttgttagctggtcaaaatggtattccttat540
tcatctgcttcagacatatattggaaaattattaaaccggatctacaacatgtttctaca600
cattggtctacatcaggttttgatttgtgggaagaaaatcaaggtactcacttctttact660
gcattagttcaattgaaggccttgtcttatggtattccattgtctaaaacttataatgat720
ccaggttttacttcttggttagaaaaacaaaaagatgcactcaactcttatattaattct780
tcaggttttgttaattctggaaagaaacatattgttgaatctcctcaattgtcatctagg840
ggtggtttggattctgcaacttatattgcagctttgattacacatgatattggcgatgat900
gatacatatactccctttaatgttgataattcctatgttctaaattcattgtattatttg960
ttagttgataataagaataggtacaagattaatggtaattacaaggctggtgccgcagtt1020
ggtagatacccagaagatgtttataatggtgttggtacatcagaaggtaatccttggcaa1080
ttagcaacagcctacgcaggtcaaacattttatactttagcatataattctttgaaaaac1140
aaaaagaacttggttattgaaaaattgaattatgatttgtataattcttttattgctgat1200
ttgtctaaaattgattctagttacgcatctaaagattctttaactttaacttatggttca1260
gataattacaaaaatgttattaaatctttgttgcaatttggggattcatttttgaaagtt1320
ttgttagatcatattgatgataatggtcaattaacagaagaaattaataggtatactggt1380
tttcaagcaggtgcagtttctttaacttggtcatcaggttcattgttatctgcaaataga1440
gcaaggaataagttgattgaattgttgtaa1470
<210>2
<211>1524
<212>dna
<213>debaryomycesoccidentalis
<400>2
atgaaatttgcaactatcttaagtacaactgctcttgcgctatcaagtttggttgcatcc60
aagccaattttcttaagcaaaagggatgctggcagctctgctgctgctgcttggcgttct120
gaatctatctatcaacttgttaccgatagatttgccagaactgacggatcgacttcagct180
acttgtaatactggagatagagtatactgtgggggtactttccaaggtattattgacaaa240
ttggattacatccaaggtatgggtttcactgctatttggatttctccagttgttgaacaa300
attcctgatgatactggttatggttatgcttaccacggctattggatgaaagatatttac360
gctataaattcaaattttggtactgccgatgacttgaagaatctttcaaatgaattgcat420
aagagaaatatgaagcttatggttgatattgttactaaccattatgcttggaatggtgcc480
ggtagcagtgttgcttactccaactacaatccattcaaccaacaatcctacttccacgat540
tattgtttaattacaaattacgatgatcaaaccaatgttgaagattgctgggaaggcgat600
aatactgttagtttaccagatcttcgtactgaggattcagatgttagctctattttcaat660
ctgtgggttgctgagttagtttctaattactcaattgatggtttaaggattgacagtgct720
aagcatgttgatgaatcattctacccatcattccaaagtgctgctggtgtctatcttctt780
ggagaagtttatgacggtgatccagcttacacttgcccataccaaaactatatgtcaggg840
gttactaactatcctttgtactatccaatgttaagattctttcaaggtacttctaactct900
gtcgatgaattaaatgctatgatttcaagtttagaaagtgattgtaaggatattacttta960
ttgggtaatttcattgaaaaccatgatcaaccaagattaccatcttatacttctgatagt1020
gccttaatcaaaaatgcaattgcgtttaatttaatgtcagatggtattccaattatttac1080
tacggtcaagaacaaggttacagtggtagctccgatccaaacaacagagaagcattatgg1140
ttatctggttacagcacttctaatggttactacaaacttatctcttcagttaatcaaatt1200
agaaaccaagccatttataaggatagcaaatacactacttattggagtgatgtgttatac1260
gcttcaggtcatgttattgctcttcaaagaggtgcagacgaccaaagaattgtttctgtc1320
tttaacaatttaggctcaagcggatctcaaactgtaacattcagtactaaatacagcggt1380
ggagaaaaagtcgttgacgttttaacttgtcaaacttcatacgccaactcggatagtact1440
ttaactgtctctattagtggtggcgctccaagaatttatgctcctgcttctcttattgca1500
aattctggaatttgcaacttctaa1524
<210>3
<211>20
<212>dna
<213>artificialsequence
<400>3
aatacaggtcattttcaagc20
<210>4
<211>20
<212>dna
<213>artificialsequence
<400>4
caacaattcaatcaacttat20
<210>5
<211>23
<212>dna
<213>artificialsequence
<400>5
atgaaatttgcaactatcttaag23
<210>6
<211>23
<212>dna
<213>artificialsequence
<400>6
gaagttgcaaattccagaatttg23
- 还没有人留言评论。精彩留言会获得点赞!