工程化肠道共生细菌在其外膜囊泡(OMV)中表达异源蛋白质以递送至胃肠道的制作方法
本发明涉及使用衍生自共生细菌外膜的囊泡、能够产生这种囊泡的重组细菌以及产生这种囊泡的方法,将异源肽或蛋白质如治疗性肽、治疗性蛋白质或抗原递送至粘膜部位。本发明还涉及用于重组细菌的诱导型表达系统。
背景技术
尽管目前只有少数粘膜疫苗已获许可,包括flumist和nasovac(流感病毒(influenzaviurs))、rotateq(轮状病毒(rotavirus))、vivotif(伤寒沙门氏菌(salmonellatyphi))和dukoral(霍乱弧菌(vibriocholera)),其中口服脊髓灰质炎疫苗取得了突出的成功,但仍有大于90%的感染发生在身体的粘膜部位。粘膜疫苗有限的可用性主要与缺乏能够保存疫苗抗原(ag)完整性和强佐剂性的有效递送系统有关。
目前可用的疫苗通过注射递送,伴随着相关的安全、患者依从性、发病率和高成本问题。注射的疫苗也仅在身体的(粘膜)部位(绝大多数(90%)病原体通过其获得进入并且特别是通过胃肠道和呼吸道)提供部分或没有的保护作用。缺乏有效的疫苗在农业和保护免受如沙门氏菌和弯曲杆菌等主要肠道感染方面尤其严重,其中食物供应的污染是人类感染的主要来源和途径。更复杂的情况是增加了药物和抗生素耐药性,这限制了农场动物和人类肠道感染性疾病的治疗选择,着重需要开发更有效的疫苗。
粘膜疫苗接种可以克服目前基于注射的疫苗的主要限制,并满足对新疫苗的需求以防止肠道感染。但是,目前只有少数粘膜(口腔和鼻腔)疫苗获得许可。这种有限的可用性与缺乏能够维持疫苗完整性(特别是在肠道中)的有效递送系统密切相关。
在缺乏有效治疗的情况下,肠道感染性疾病(iid)的发生在英国人群中每年增加25%的iid患病事件,导致在工作年龄的人失去1100万天。iid的影响在农业中也是明显的,其中缺乏针对主要肠道感染的有效疫苗对牲畜健康和食品安全以及保护人类免受食源性感染具有严重后果,这通过增加多重药物和抗生素耐药性而进一步复杂。疫苗接种是预防感染性疾病的有效且有成本效益的形式,尽管目前只有少数粘膜疫苗获得许可,很大部分是由于缺乏有效的能够在通过上消化道的恶劣环境运输过程中保护抗原完整性的粘膜疫苗递送系统。
已经开发了各种控制的ag释放策略用于口服递送,包括聚合物微粒、脂质体和免疫刺激复合物,其可能需要包含佐剂以增加其免疫原性。然而,将ag纯化和包封到这些颗粒递送系统中所需的复杂制造步骤可能使这些方法在经济上不可行(ulmeretal.,2006)。
另一种策略是利用保留其侵入性的减毒、无毒的病原体作为口服递送疫苗ag的载体。重组无毒沙门氏菌疫苗已被证明在各种模式系统中成功提供针对病原体的有毒力的形式的保护(wangetal.,2013),尽管这种希望尚未在人体临床试验中证实。而且,在任何疫苗制剂中使用活减毒病原体包括残留回复和环境污染的风险。
因此仍然需要改进的抗原递送系统。
通过注射将治疗性肽或蛋白质递送至粘膜部位同样是有问题的。通过注射的递送负面地影响成本、安全性、患者依从性以及其治疗结果。此外,全身递送如注射,不提供针对医学病症的粘膜部位靶向的递送,其中靶向的递送在治疗上是有利的。口服或其他非侵入性施用避免了注射的负面影响,但存在其他问题,例如通过蛋白水解酶以及消化系统中遇到的酸性环境潜在降解肽或蛋白质。因此仍然需要改进的治疗性肽或蛋白质的递送系统。
发明概述
根据第一方面,本发明提供了包含用于在外膜囊泡(omv)中表达治疗性多肽或蛋白质或抗原的表达系统的重组革兰氏阴性共生肠道细菌。
在另一个实施方案中,本发明提供了包含用于在外膜囊泡(omv)中表达任何异源肽或蛋白质的表达系统的重组革兰氏阴性共生肠道细菌。如本文所用,术语“异源肽或蛋白质”意指由核酸序列编码且通常不存在于重组革兰氏阴性共生肠道细菌中的任何长度的氨基酸链;“异源肽或蛋白质”涵盖肽、多肽和蛋白质。
共生肠道细菌在本文中更详细地描述,并且可以包括在人或动物肠道细菌群体中发现的细菌。在本发明任何方面的一个实施方案中,革兰氏阴性共生肠道细菌来自拟杆菌属(bacteroids)。在另一个实施方案中,革兰氏阴性共生肠道细菌为多形拟杆菌(bacteroidsthetaiotaomicron)。本文提供了拟杆菌属的革兰氏阴性共生肠道细菌的其他物种的实例。
合适地,表达系统是一种促进治疗性多肽或蛋白质或抗原在革兰氏阴性共生肠道细菌中稳定表达的表达系统,例如,其中治疗性多肽或蛋白质或抗原序列整合到重组细菌中使得其在连续的细菌世代中被携带。
在一个实施方案中,表达系统包含在对共生肠道细菌的特定属或菌株如拟杆菌属特异性的载体中的治疗性多肽或蛋白质或抗原序列,其中所述治疗性多肽或蛋白质或抗原序列可操作地连接至用于抗原靶向omv的分泌信号序列。合适地,分泌信号序列是ompa,例如衍生自拟杆菌属的ompa序列。例如,当拟杆菌是多形拟杆菌(bt)时,ompa序列可以是btompa。在一个实施方案中,分泌信号序列可以是ompa的n端信号肽。在一个实施方案中,掺入表达系统的重组细菌是多形拟杆菌(bt)。其他合适的信号肽包括btminpp和btcepa。在另一个实施方案中,表达系统包含与ompa、优选与btompa的n端信号肽融合的异源肽或蛋白质。在一个实施方案中,ompa的n端信号肽是基因bt_3852的,其n端信号肽的氨基酸序列是mkkilmllafagvasvasa。
在本发明的一个实施方案中,重组革兰氏阴性共生肠道细菌中的表达系统包括组成型表达系统,意思是表达系统包含组成型启动子例如p1启动子。这种表达系统的实例在本文举例说明。
在本发明的一个实施方案中,重组革兰氏阴性共生肠道细菌中的表达系统包括诱导型基因表达系统,优选甘露聚糖控制的基因表达系统。对于本领域技术人员来说,合适的诱导型基因表达系统和构建体是熟知的。在一个实施方案中,重组革兰氏阴性共生肠道细菌中的表达系统包括α-1,2-甘露糖苷酶基因的甘露聚糖诱导型启动子区域、至少一个核糖体结合位点、多克隆位点和转录终止子。
在一个实施方案中,抗原衍生自病原体或适于产生针对特定病原体的免疫应答。本文更详细地描述了合适的抗原。
在另一个实施方案中,治疗性多肽或蛋白质是可以在个体中提供治疗效果的治疗性多肽或蛋白质。合适的治疗性多肽或蛋白质是本领域技术人员已知的并且在本文中更详细地描述。
有利地,来自拟杆菌属如bt的omv是高度稳定的。
在一个实施方案中,由重组细菌产生的omv的大小在约<50-300nm的范围内。
在本发明的另一方面,提供了制备含有异源肽或蛋白质的外膜囊泡(omv)的方法,其包括产生在其omv中表达异源肽或蛋白质的重组革兰氏阴性共生肠道细菌,在导致表达所述异源肽或蛋白质和产生omv的条件下培养该细菌,并分离由此含有所述异源肽或蛋白质的omv。在本发明的另一方面,提供了用于制备用作疫苗的外膜囊泡(omv)的方法,其包括产生在其omv中表达抗原的革兰氏阴性共生肠道细菌,在产生omv的条件下培养该细菌,并分离含有抗原的所述omv。另一方面,提供了用于制备用作治疗剂的omv的方法,其包括产生在其omv中表达治疗性多肽或蛋白质的革兰氏阴性共生肠道细菌,在产生omv的条件下培养该细菌,并分离含有治疗性多肽或蛋白质的所述omv。适当地,修饰共生肠道细菌以表达异源肽或蛋白质或治疗性多肽或蛋白质或感兴趣的抗原。用于将核酸分子引入细菌以表达肽/多肽的合适方法是已知的并且包括本文所述的那些方法。具体而言,本文描述的方法举例说明如何可将编码感兴趣的抗原的核酸引入革兰氏阴性共生肠道细菌中,使得抗原表达并使得它被包装入omv中。这些方法同样适用于治疗性多肽或蛋白质。本文描述的方法举例说明如何可将编码感兴趣的治疗性蛋白质的核酸引入革兰氏阴性共生肠道细菌中,使得治疗性蛋白质被包装入omv中。
抗原优选疫苗抗原,即通过免疫接种需要对其的免疫应答的抗原。本文描述了用作疫苗抗原的合适抗原。
合适的革兰氏阴性共生肠道细菌是多形拟杆菌(bt)。在一个实施方案中,omv的收获在细菌生长的晚期进行。
在一个实施方案中,治疗性多肽或蛋白质或抗原可以使用诱导型表达系统在革兰氏阴性共生肠道细菌中表达。有利地,诱导型表达可以允许表达被控制,使得其被最佳地表达用于omv包装。在一个实施方案中,根据本发明制备omv的方法可以使用如本文所述的甘露聚糖诱导型表达系统。有利地,已知omv主要在生长后期阶段产生,如本文所述的甘露聚糖诱导系统允许延迟重组蛋白质的表达,从而避免对细胞有潜在毒性的蛋白质的早表达。在一个实施方案中,异源肽或蛋白质的表达延迟至omv产生阶段。在另一个实施方案中,通过改变诱导组合物的浓度来调整或调节异源肽或蛋白质的表达。诱导组合物是指当向重组革兰氏阴性共生肠道细菌提供时导致由表达系统编码的基因的诱导、表达或上调的任何组合物。例如,当表达系统包含根据本发明的甘露聚糖诱导型表达系统时,可以通过改变甘露聚糖的浓度来调整异源肽或蛋白质的表达。通过选择适当浓度的诱导组合物,可以调整异源肽或蛋白质的表达水平,例如使其保持在毒性阈值以下。本文描述了诱导组合物的合适浓度和选择适当浓度的方法。
在本发明的另一方面,提供了来自重组革兰氏阴性共生肠道细菌的omv,所述细菌包含用于表达异源肽或蛋白质的表达系统。另一方面,提供了含有根据本发明方法产生的异源肽或蛋白质的omv。
另一方面,提供了用作药物的含有异源肽或蛋白质的omv。另一方面,含有异源肽或蛋白质的omv可用于治疗炎症性肠道疾病。炎症性肠道疾病的实例对于本领域技术人员而言是已知的并且在本文中举例说明。另一方面,提供了用作疫苗的含有异源肽或蛋白质的omv。在本发明的另一方面,提供了用作药物的含抗原的omv。另一方面,提供了用作药物的含有治疗性多肽或蛋白质的omv。合适地,omv由重组共生细菌产生,其包含用于表达根据本发明的任何方面的异源肽或蛋白质、治疗性多肽或蛋白质或抗原的表达系统。在一个实施方案中,含抗原的omv用作疫苗,并且特别是用作可以施用于人或动物的粘膜表面的疫苗。因此,提供了用于粘膜递送(例如肠内施用,例如口服(如片剂、胶囊或滴剂)、鼻内(如滴剂、喷雾剂))的含抗原的omv。同样,含有治疗性多肽或蛋白质的omv或含有异源性肽或蛋白质的omv可适用于粘膜递送和施用。
在一个实施方案中,施用根据本发明的含抗原的omv产生针对病原体的保护性免疫。合适地,可以产生适应性免疫应答。例如,可以针对特定病原体产生抗体(igg/iga)和/或cd4t细胞应答。
另一方面,本发明提供了药物组合物,其包含从根据本发明的任何方面或实施方案的重组细菌分离的omv。在一个实施方案中,药物组合物可以进一步包含药学上可接受的赋形剂。合适地,这种赋形剂是为了粘膜施用将允许omv结构保留或稳定的赋形剂。在另一个实施方案中,药物组合物可以进一步包含佐剂。
在本发明任何方面的一个实施方案中,可以提供含抗原的omv作为疫苗用于人类,或者其可以提供动物用途。例如,根据本发明的含抗原的omv可以用于疫苗接种农场动物例如猪和鸡,因此通过提供保护性免疫来提供控制肠道感染例如沙门氏菌和弯曲杆菌的途径。在另一个实施方案中,用于人类可以提供针对主要肠道感染例如诺如病毒(norovirus)的保护。
在本发明的任何方面的一个实施方案中,可以提供含有治疗性肽或蛋白质的omv作为用于人的治疗剂,或者其可以提供动物用途。根据本发明的含有治疗性肽或蛋白质(例如kgf-2)的omv可用作治疗人结肠炎或治疗动物结肠炎的治疗剂。
在本发明的另一方面,提供了诱导型基因表达系统。合适地,这种表达系统可以用于拟杆菌属的重组革兰氏阴性共生肠道细菌。在一个实施方案中,根据本发明的诱导型基因表达系统包含:
-拟杆菌属编码基因的诱导型启动子区域;
-至少一个核糖体结合位点;
-多克隆位点;和
-转录终止子。
在本发明的另一方面,提供了甘露聚糖控制的基因表达系统。这种表达系统也可以被描述为例如甘露聚糖诱导型基因表达系统、甘露聚糖诱导型表达系统或甘露聚糖诱导型系统。合适地,这种表达系统可以用于革兰氏阴性肠道共生细菌,例如拟杆菌属。在一个具体的实施方案中,表达系统可以用于多形拟杆菌。这种表达系统可能特别适用于产生含抗原的omv用作粘膜免疫的疫苗。同样,这种表达系统可能特别适用于产生含有治疗性多肽或蛋白质的omv。
在一个实施方案中,根据本发明的甘露聚糖控制的基因表达系统包含:
-α-1,2-甘露糖苷酶基因的甘露聚糖诱导型启动子区域;
-核糖体结合位点;
-多克隆位点;和
-转录终止子。
在一个实施方案中,甘露聚糖诱导型启动子区域衍生自针对基因bt_3784鉴定的启动子。特别地,甘露聚糖诱导型启动子区域可以衍生自p3784启动子区域序列:
5'-aatgttttttcatggcatagaatccttagatttgcaatatgacaaaggtaaacaaaaaaactttccagcacttttttggcgcagaatatatgtaagaatgcgtgccagtttggttaattatagcgccacagggcgatttagtgtttcgacttccggtagcggcattccttttctctctattttcgtcacagaaactaattttattcataaattcatttgttcatgaaaacacatttttcatttaaacacctgttatttattggaggtgcggt-3'。
合适地,甘露聚糖诱导型启动子区域包含核酸序列:
5'-acttttttggcgcagaatatatgtaagaatgcgtgccagtt-3'。
在另一个实施方案中,核糖体结合位点是设计用于调节表达的位点,而多克隆位点有助于克隆感兴趣的基因。这种系统的不同组分的实例在本文的实施例部分给出。
在其他实施方案中,根据本发明的任何方面的诱导型基因表达系统包含第二核糖体结合位点。一个、两个或更多个核糖体结合位点的选择允许改变异源肽或蛋白质的表达水平。
在另一个实施方案中,根据本发明的任何方面或实施方案,本发明提供了根据本发明的基因表达系统,其中所述基因表达系统用于重组细菌生产omv。
在其他实施方案中,根据本发明的甘露聚糖诱导型基因表达系统可以用于任何用于生产蛋白质或产品的拟杆菌属衍生的表达系统,或用于拟杆菌属生理学的研究。
在本发明的其他实施方案中,可选的拟杆菌属诱导型启动子如来自例如b.acidifaciens、粪拟杆菌(b.caccae)、b.coprocola、b.coprosuis、埃氏拟杆菌(b.eggerthii,)、b.finegoldii、脆弱拟杆菌(b.fragilis)、生溃疡拟杆菌(b.helcogenes,)、b.intestinalis、b.massiliensis、b.nordii、卵形拟杆菌(b.ovatus)、多形拟杆菌(b.thetaiotaomicron)、普通拟杆菌(b.vulgatus)、b.plebeius、单形拟杆菌(b.uniformis,)、b.salyersai、化脓拟杆菌(b.pyogenes)、b.goldsteinii、b.dorei或b.johnsonii的启动子可用于代替表达载体中来自b.taitaiotaomicron的甘露聚糖诱导型启动子。这是有利的,因为表达系统因此可以在其他拟杆菌属物种中起作用。
附图说明
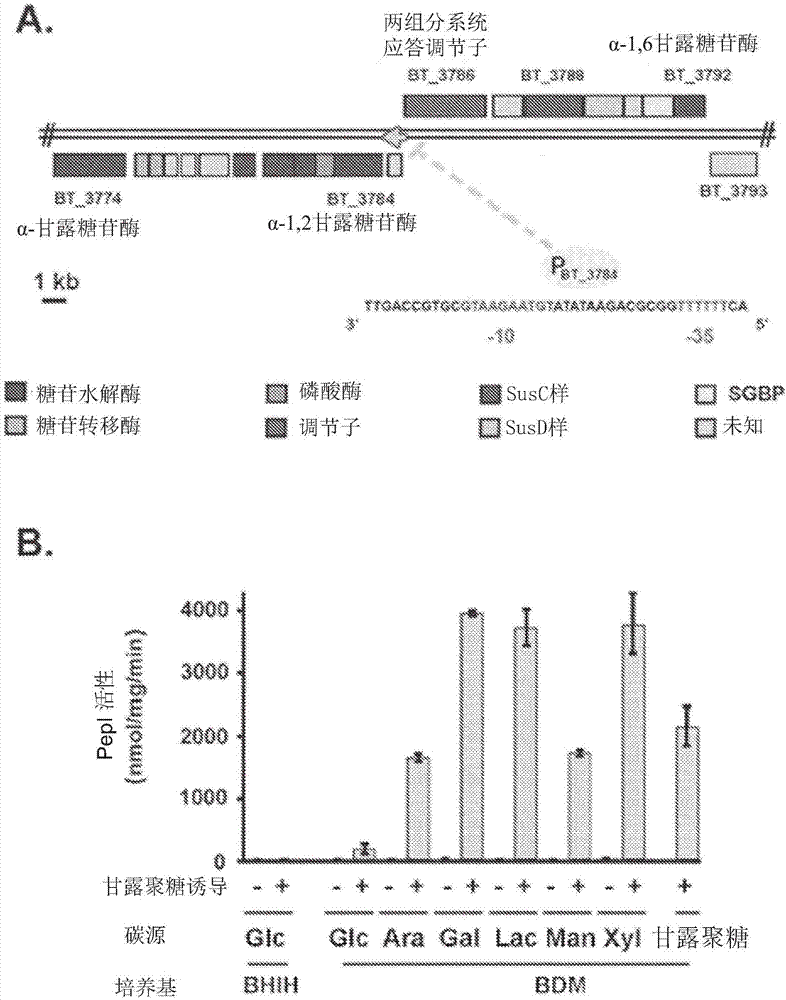
图1.man-pul2区域和使用p3784启动子用于甘露聚糖诱导的pepi报道基因的表达。a)多形拟杆菌组2pulbt3774-92的遗传图谱。具有已知或预测功能的基因(根据cuskinetal.,(2015)和xuetal.,(2003))以颜色标记,具有未知功能的基因以灰色表示。sgbp;表面聚糖结合蛋白。指出了p3784启动子的序列和方向。b)在不同碳源的存在下,在p3784的控制下pepi的表达。包含pepi基因的多形拟杆菌菌株gh193在依赖p3784启动子下生长于添加了氯高铁血红素(hemin)的bhi复合培养基(bhih)中。bhi是商业供应的,含有0.2%葡萄糖。gh193也在加入了50mg/l甘露聚糖(从酿酒酵母(s.cerevisiae)中提取)的不同碳源(0.5%)的基本培养基(bdma)中生长(已指出)。
图2.确定甘露聚糖诱导的基因表达的最佳条件。a)在浓度递增的甘露聚糖存在下,孵育在p3784启动子控制下表达中等水平pepi的多形拟杆菌菌株gh193(浅灰色),并测定pepi的比活性。gh287菌株(白色)含有设计用于pepl低表达水平的载体。b)gh193在甘露聚糖(100mg/l)的存在中生长,并且测量来自诱导后不同时间点收集的样品的蛋白提取物中pepi活性。
图3.ni-nta亲和层析之前和之后周质蛋白提取物的sds-page。l:蛋白梯;载体:含有空载体的gh359菌株提取物;btcepa:来自表达天然btcepa的gh364的提取物;btcepa-his6:来自表达c端his标记的464btcepa的gh402的提取物。在纯化的结合步骤中收集流出物。箭头指示对应于天然btcepa和更高分子量btcepa[his]6的条带。
图4.使用外源α-甘露聚糖在体内诱导头孢曲松耐药性。十字指示腹腔注射的时间。ga:a组小鼠在其饮用水中接受甘露聚糖。gb:b组小鼠给予正常饮用水。cro:头孢曲松。
图5.工程化bt表达疫苗抗原。a)通过omv裂解物的ib检测到的bt-omv中的沙门氏菌ompa(stompa)的表达(箭头)。插图:用兔抗stompa和抗兔ig-金颗粒染色的btstompa+omv的超薄切片并通过em成像。b)在用stompa+btomv(正方形)或野生型btomv(三角形)口服管饲后28天或在腹腔注射stompa+btomv(菱形)后,通过固相elisa测定的小鼠血清中抗stompaigg的水平(n=6ea)。比较口服和腹腔注射stompa+omv免疫前后igg的水平,*p<0.05。c)通过rt-pcr检测的重组bt中诺如病毒gii-4衣壳mrna的表达(norov)。gyra基因被用作对照。
图6.体内btomv与上皮的相互作用。将dil-标记的omv(红色)注射入小鼠回肠袢(ilealloop)中,30分钟后将组织快速冷冻,切片(4μl),用dapi(蓝色)复染并用uv显微镜(zeissaxiovert)成像。合并的低功率(顶部)和高功率(底部)图像显示沿着隐窝绒毛(cryptvillous)轴和绒毛顶部的omv(聚集体)的共定位(明亮区域)。箭头标识可能位于固有层内的omv。
图7.通过uv显微镜观察来自csflr-egf(macgreen)和-ecf(macblue)转基因小鼠的小肠全组织装片中的dc/巨噬细胞的图像。macgreen组织中的点状染色鉴定了绒毛中丰富的dc/mac,而macblue组织中的染色显示了分离的淋巴滤泡的上皮下穹隆(subepithelialdome)中的dc/mac和它们在绒毛中的实质缺失。插图:pp中dc/mac染色。右下图描绘了小鼠peyer’s结的fae中的m细胞(gp2+细胞;绿色)和杯状细胞(uea-1+细胞,红色)的全装片免疫荧光检测。请注意右下图中z形投影(箭头)中m细胞下面的基底外侧袋(basolateralpocket)的存在。
图8.omv-kgf-2处理dss诱导的小鼠实验性结肠炎的治疗效果。a)工程化bt在omv中表达和分泌重组人角质形成细胞生长因子-2(kgf-2)。与bt(bt_3852)的ompa的n端信号肽融合的kgf-2的表达。使用山羊抗kgf多克隆抗体通过omv裂解物的ib检测蛋白质(箭头)。b)疾病活动指数(dai)评分是基于在第7天呈现的体重减轻、结肠内容物一致性和结肠内容物血液以及盲肠和结肠组织的外观的累积评分。将dss通过饮用水施用给成年小鼠7天(2.5%dss)。在第1、3和5天,小鼠用pbs(dss-pbs)、对照omv(dss-omv)和含有kgf-2的omv(dss-omvkgf)管饲。对照组接受pbs(h20-pbs)、对照omv(h20omv)或含有kgf-2的omv(h20-omvkgf)。c)在尸体剖检时测量从回盲肠连接处到肛门边缘的结肠长度。d)体重减轻量计算为第7天占第0天的重量百分比。
*p<0.05为与接受相同处理的对照组(pbs、omv或omv-kgf)具有显著差异(onewayanova)。
图9.质粒pgh173的图谱。
发明详述
用于ag递送的无细胞膜囊泡可克服对于使用保留其侵入性的减毒、无毒病原体作为口服递送疫苗载体用于粘膜疫苗接种的先前策略已经报道的生物安全问题。
本发明描述了基于革兰氏阴性共生肠道细菌例如多形拟杆菌(bt)的omv技术,所述细菌经工程化以在其omv中表达候选疫苗抗原用于粘膜递送和产生针对主要动物病原体的保护性免疫。
基于omv的疫苗提供了与传统疫苗相比显著的优点,(1)它们是非复制的,(2)口服和鼻内递送克服了对针的需要并且它们靶向粘膜部位,(3)它们具有确定的安全记录,(4)可以引发先天性和ag特异性适应性免疫应答,(5)具有自我佐剂特性(即mamp,如lps),(6)相对便宜,快速和直接生产,并且(7)可以在正式的诊所环境外递送。当前(病原体衍生的)omv疫苗的局限性可能是由于非计划的毒性(由于相关的毒素)、保护性ag的低表达水平、取决于来源和制剂的可变效力、可能需要外源佐剂以及由于菌株变化提供不完全保护。原则上可以通过使用非致病性的产生omv的共生(肠道)细菌和遗传工程改善它们的疫苗应用来克服这些限制。
该技术原则上可用于向粘膜部位递送一系列疫苗抗原,以对于食物和伴侣动物和处于风险的人群(对其目前还没有有效粘膜疫苗)针对各种细菌、病毒和可能的寄生虫病提供保护。
bt-omv已被证明可以进入并影响肠道宿主细胞生理(stentzetal.,2014),并在体内激活粘膜免疫细胞(kaparakis-liaskosetal.,2015和hickeyetal.,2015)从而鉴定出肠道细菌影响肠内稳态的手段。
革兰氏阴性共生细菌
大量的共生细菌在人类和动物中都是已知的。在涉及粘膜递送的本发明的上下文中,沿着例如肠道、呼吸道粘膜内衬天然存在的细菌等可能是特别有用的。
在人类共生肠道细菌中,拟杆菌属是富有代表性的。本文所用的拟杆菌属指革兰氏阴性专性厌氧细菌的属。来自拟杆菌属的种类是非内生孢子形成杆菌,其可以是运动型的或非运动型的,这取决于拟杆菌属的膜在它们的肽聚糖层中含有鞘脂和内消旋二氨基庚二酸。
拟杆菌物种包括b.acidifaciens、粪拟杆菌(b.caccae)、b.coprocola、b.coprosuis、埃氏拟杆菌(b.eggerthii,)、b.finegoldii、脆弱拟杆菌(b.fragilis)、生溃疡拟杆菌(b.helcogenes,)、b.intestinalis、b.massiliensis、b.nordii、卵形拟杆菌(b.ovatus)、多形拟杆菌(b.thetaiotaomicron)、普通拟杆菌(b.vulgatus)、b.plebeius、单形拟杆菌(b.uniformis,)、b.salyersai、化脓拟杆菌(b.pyogenes)、b.goldsteinii、b.dorei或b.johnsonii。相关的parabacteroides属包括p.distasonis和p.merdae及其菌株。其它拟杆菌物种描述于例如clinicalmicrobiologyreviews,vol.20,no.4,oct2007,p.593-612和ncbi的approvedlistofbacterialnames、http://www.bacterio.net/-alintro.html#b和http://www.ncbi.nlm.gov/booksinbk819/。
合适地,根据本发明的甘露聚糖诱导型表达系统可以用于任何拟杆菌属中。
对于根据本发明的重组细菌表达系统和疫苗/药物组合物,特别优选例如多形拟杆菌(bt)(vpi-5482)及其菌株,包括例如gh193、gh359和gh364。
革兰氏阴性细菌例如拟杆菌属产生细胞外外膜囊泡(omv),其可能在体内的下消化道中与宿主细胞交流中发挥作用。成囊(vasiculation)和omv产生是与细菌裂解或膜不稳定性无关的革兰氏阴性细菌的基本特征,其满足原核分泌过程的关键要求(mcbroometal.,2007)。omv可以从多形拟杆菌(bt)、卵形拟杆菌、b.xylanisolvens、脆弱拟杆菌、粪便拟杆菌(b.stercoris)和b.dorei中分离(stentzetal.,2015)。由主要的共生肠道细菌多形拟杆菌(bt)产生的omv含有与哺乳动物minpp1结构相似的肌醇多磷酸磷酸酶(btminpp),并与培养的肠上皮细胞相互作用以促进细胞内ca2+信号传导。来自多形拟杆菌亲本细胞的omv也已经显示在体内胃肠道中正常产生并且与肠上皮相关并被其吸收。
有利地,在一个实施方案中,与衍生自其他细菌的omv相比,衍生自bt的omv可能与肠炎症的发展的较低发生有关。
抗原序列
用于本文所述的本发明的任何方面或实施方案的合适的抗原序列包括可用于治疗致病性感染例如细菌或病毒感染的候选抗原的任何抗原。在本发明的任何方面的一个实施方案中,抗原序列可以是任何先前验证的候选疫苗抗原。在另一个实施方案中,抗原序列可以是衍生自沙门氏菌的抗原序列,包括那些包括salmonellaenterica血清型(serovars)在内的人类致病性血清型。沙门氏菌抗原的实例包括sseb、ompd、iron和shda。其他合适的沙门氏菌抗原对本领域技术人员来说是已知的,并且包括本文描述和举例说明的那些。例如,其他实施方案包括衍生自诺如病毒的抗原序列,例如gii-4。其他诺如病毒抗原在本文中描述或将为本领域技术人员所知。
这种合适的抗原可以衍生自常见的人类病原体。在另一个实施方案中,合适的抗原可以衍生自常见的动物病原体,特别是引起农场动物感染和/或疾病的病原体。
治疗性肽、多肽或蛋白质
如本文所述,本发明还涉及含有由重组肠道共生细菌产生的治疗性肽、多肽或蛋白质的omv。合适的治疗性肽、多肽或蛋白质可以包括例如胰岛素、生长激素、催乳素、降钙素、促黄体激素、甲状旁腺激素、促生长素抑制素、促甲状腺激素、血管活性肠多肽、三叶因子、细胞和组织修复因子、转化生长因子β、角质形成细胞生长因子、采用反平行螺旋束结构的结构基团1细胞因子(如il-2、il-3、il-4、il-5、il-6、il-7、il-9、il-10、il-11、il-12、il-13、gm-csf、m-csf、scf、ifn-y、epo、g-csf、l1f、osm、cntf、gh、prl或ifnα/β)、通常与细胞表面相关的结构基团2细胞因子(其形成对称同源三聚体并且亚基占据对于某些病毒衣壳蛋白描述的β-果冻卷的构象,例如细胞因子tnf家族如tnfα、tnfβ、cd40、cd27或fas配体、细胞因子il-1家族、成纤维细胞生长因子家族、血小板衍生生长因子、转化生长因子β和神经生长因子)、包含短链α/β分子的结构基团3细胞因子(其作为大的跨膜前体分子产生,每个分子在胞外区域中含有至少一个egf结构域,例如细胞因子表皮生长因子家族、特征在于它们拥有围绕保守的半胱氨酸残基分组的氨基酸序列(c-c或c-x-c趋化因子亚基)的趋化因子、或胰岛素相关细胞因子)、展示镶嵌结构的结构基团4细胞因子(例如由不同的结构域组成的调蛋白或神经调节蛋白,例如egf、免疫球蛋白样和三环结构域)。或者,生物活性多肽可以是如上定义的生物活性多肽的受体或拮抗剂。
合适的治疗性肽、多肽或蛋白质可以是神经递质、神经活性或神经调质,例如速激肽如物质p(sp)或神经激肽a(nka)。其他合适的治疗性肽、多肽或蛋白质可包括那些参与食欲控制的,例如生长素释放肽、pyy、胰岛素或瘦素。
适合用于本发明的任何方面或实施方案的治疗性肽、多肽或蛋白质可以用于治疗炎症性肠道疾病,例如包括克罗恩氏病(crohn’sdisease)和溃疡性结肠炎病症的炎症性肠道疾病(ibd)。
适合用于本发明的任何方面或实施方案的治疗性肽、多肽或蛋白质可以以前体蛋白质的形式表达,其在翻译后进一步加工以产生活性形式的治疗性肽、多肽或蛋白质。
适合用于本发明的任何方面或实施方案的治疗性肽、多肽或蛋白质可以是具有直接治疗效果的肽段、多肽或蛋白质,例如蛋白质激素。
适合用于本发明的任何方面或实施方案的治疗性肽、多肽或蛋白质可以是具有间接治疗效果的肽段、多肽或蛋白质,例如催化产生具有治疗效果的生物活性产物的酶。例如,如果治疗性肽、多肽或蛋白质是酶并且酶的底物存在于或提供给所述重组革兰氏阴性共生肠道细菌,则可以在重组革兰氏阴性共生肠道细菌的细胞内发生产生具有治疗效果的生物活性产物。以这种方式,除了治疗性肽、多肽或蛋白质的产物之外,由革兰氏阴性共生肠道细菌产生的omv可以含有治疗性肽、多肽或蛋白质;或者具有治疗效果的生物活性产物的治疗性肽、多肽或蛋白质的产生可以在将omv递送至身体后发生。
其他方面或实施方案在以下编号的条款中提供:
1.一种重组革兰氏阴性肠道细菌,包含用于在外膜囊泡(omv)中表达抗原的表达系统。
2.根据条款1的重组革兰氏阴性共生肠道细菌,其中革兰氏阴性共生肠道细菌来自拟杆菌属。
3.根据条款1的重组革兰氏阴性共生肠道细菌,其中革兰氏阴性共生肠道细菌是多形拟杆菌(bt)。
4.制备用作疫苗的外膜囊泡(omv)的方法,包含产生在其omv中表达抗原的革兰氏阴性共生肠道细菌,在产生omv的条件下培养所述细菌,和分离含有抗原的omv。
5.根据条款4的方法,其中所述革兰氏阴性共生肠道细菌是多形拟杆菌(bt)。
6.根据条款4或5的方法,其中所述抗原表达是诱导型的。
7.一种用作药物的含抗原的omv。
8.一种用作疫苗的含抗原的omv。
9.根据条款7或8的含抗原的omv用于粘膜施用。
10.一种药物组合物,其包含从根据条款1至3中任一条的重组革兰氏阴性细菌分离的omv。
11.根据条款10的药物组合物,其进一步包含药学上可接受的赋形剂。
12.根据条款10或11的药物组合物,其进一步包含佐剂。
13.根据条款7至12中任一项的含抗原的omv或药物组合物,其中所述omv衍生自多形拟杆菌(bt)。
14.前述权利要求中任一项要求的重组革兰氏阴性共生肠道细菌、方法、含抗原的omv或药物组合物,其中所述抗原衍生自沙门氏菌、弯曲杆菌或诺如病毒,如gii-4。
15.一种甘露聚糖控制的基因表达系统,其包含:
-α-1,2-甘露糖苷酶基因的甘露聚糖诱导型启动子区域;
-核糖体结合位点;
-多克隆位点;和
-转录终止子。
16.根据条款15的基因表达系统,其中所述基因表达系统用于重组细菌中以产生含抗原的omv。
鉴于本公开,本发明的各种其他方面和实施方案对于本领域技术人员来说将是明显的。
本说明书中提及的所有文件均通过引用整体并入本文。
“和/或”在本文中使用时被认为是两个特定特征或组分的每个与另一个或不与另一个的特定公开。例如,“a和/或b”将被认为(i)a、(ii)b和(iii)a和b中的每一个的具体公开,正如每个在本文中单独列出一样。
除非上下文另有指示,否则上述特征的描述和定义不限于本发明的任何特定方面或实施方案,并且同样适用于所描述的所有方面和实施方案。
现在将通过实施例的方式并参考上述附图来说明本发明的某些方面和实施方案。
实施例
实施例a:甘露聚糖诱导型表达系统
研究驻留在人类胃肠(gi)道中的拟杆菌属物种的功能以及它们对宿主健康的贡献具有相当大的兴趣。反向遗传学和蛋白质表达技术,例如那些针对充分表征的大肠杆菌开发的不能应用于拟杆菌属物种,因为它们和拟杆菌门的其他成员具有独特的启动子结构。有用的拟杆菌属特异性遗传工具的可用性因此受到限制。在此,本发明人描述了开发一种有效的甘露聚糖控制的基因表达系统,用于含有α-1,2-甘露糖苷酶基因(bt_3784)的甘露聚糖诱导型启动子区域、设计用于调节表达的核糖体结合位点、便于克隆感兴趣的基因的多克隆位点和转录终止子的多形拟杆菌。使用乳芽孢杆菌属(lactobacillus)pepi作为报道基因,甘露聚糖诱导导致报道活性以时间和浓度依赖性方式增加,并具有大范围的活性。使用内源btcepa头孢菌素酶基因来证明这种新型表达系统的适用性,从而能够分离his标签版本的btcepa。本发明人还通过在小鼠中进行的实验显示该系统可以在外源来源的甘露聚糖的存在下在体内诱导。通过启用多形拟杆菌中内源和外源基因的控制的表达,这种新型的诱导物依赖性表达系统将有助于定义单个基因的生理学作用和其产物的功能性分析。这种诱导型表达系统也可用于生产感兴趣的蛋白质例如抗原的表达系统,特别是在产生根据本发明的含抗原的omv中。
诱导型表达系统是设计进行缺失突变表型检查的必要分子工具,以补充一个或几个感兴趣的基因,目的是定义表达的蛋白质的作用和功能。该过程通常需要使用调整的基因调节,这对于研究展示毒性效果的基因表达在正常生理水平之上时特别重要。
对使用人类肠道微生物群(microbiota)的优势成员如多形拟杆菌作为模式系统以了解和鉴定对胃肠道成功定殖和建立微生物-宿主共生重要的细菌因子具有相当大的兴趣。多形拟杆菌具有利用各种在其他方面不易消化的膳食植物多糖和宿主衍生的聚糖作为碳源和能量的能力(salyersetal.,1977)。但是,拟杆菌属基因和代谢途径的功能性分析受到缺乏遗传工具的限制。为模式微生物例如大肠杆菌开发的遗传工具对具有独特共有序列的启动子结构的拟杆菌属物种的使用非常有限(bayleyetal.,2000),所述独特共有序列由其核心rna聚合酶及其自身不平常的初级sigma因子识别(vingadassalometal.,2005)。parker和smith通过工程化脆弱拟杆菌启动子来避开这一障碍,其中添加了大肠杆菌启动子调节区以构建适用于脆弱拟杆菌的异丙基b-d-1-硫代半乳糖吡喃糖苷(iptg)-诱导型表达系统(parkerandjeffreysmith,2012)。然而,这种工程化的拟杆菌属表达载体的活性范围仅为7-10倍,当需要更大变化的蛋白质表达时,这是限制性因素。最近,mimee等人(mimeeetal.,2015)通过研究操纵位点对基因表达的位置效应进一步开发了这个系统。该策略产生iptg诱导型启动子,引发基因表达高达22倍的变化。作者使用组成型拟杆菌属衍生的启动子和核糖体结合位点的组合进一步扩展了基因表达范围(高达10,000倍范围)。
在此,本发明人描述了基于内源甘露聚糖诱导型启动子的多形拟杆菌的诱导型基因表达系统的开发。该系统已被证明对β-内酰胺酶btcepa的控制的表达有效,导致多形拟杆菌以剂量依赖性方式显现出宽范围的氨苄青霉素的最小抑制浓度(mic),其与甘露聚糖诱导的btcepa酶水平相关。
1.多形拟杆菌诱导型启动子的设计
为了开发在多形拟杆菌中使用的诱导型基因表达系统,为了在诱导剂存在时表现出低基础表达水平和高表达水平(增加超过100倍)的可诱导基因,检测了可公开获得的微阵列数据。使用ncbigeneexpressionomnibusweb工具(http://www.ncbi.nlm.nih.gov/geo/,系列gse1962)鉴定通过葡萄糖抑制的基因和在其他确定的碳源存在下诱导的基因并通过多形拟杆菌的转录谱获得的基因,其目的是建立宿主以聚糖觅食为基础的机制(martensetal.,2008)。在可能的候选中,编码作为后来命名为man-pul2(cuskinetal.,2015)的多糖利用基因座(pul)68(4)的一部分并且由酵母多糖α-甘露聚糖所诱导的α-1,2-甘露糖苷酶的bt_3784基因被选中。位于bt_3784基因上游273个碱基对的dna片段被克隆到表达载体中肽酶i报道基因(kleinetal.,1994)的前面,该表达载体被创建用于在拟杆菌属物种中表达中等水平的蛋白质(wegmannetal.,2013)(图1a)。所得的由多形拟杆菌创建的菌株gh193为宿主的构建体,其经测试其条件性地表达用作报道分子的pepi的能力。
2.质粒构建
大肠杆菌菌株jm109用于常规克隆和dna操作。培养物在37℃在luriabertani(lb)培养基中生长。适当时加入氨苄青霉素(200ug/ml)。当生长18小时时,向大肠杆菌菌株j53/r751补充200mg/ml甲氧苄氨嘧啶。使用j53/r751作为结合辅助菌株(shoemakeretal.,1986),通过三亲交配将大肠杆菌中构建的质粒移动到拟杆菌属菌株中。电感受态大肠杆菌细胞通过sambrook和russell(2001)的方法制备并转化。为了从pgh022中除去p1启动子,使用引物f-noppepi(参见表2的引物列表)(含有限制性位点sphi、ncoi、xhoi和eco47iii和掺入转录起始位点(tis)和用于中等水平蛋白表达(rbsmed;wegmannetal.,(2013)中的原始名称rbsxyl-20)的核糖体结合位点)和引物rppepi/noti(位于pepi起始密码子下游157bp)从pgh022(参见表1中的质粒列表)扩增228-bp片段。该片段用sphi和noti消化,并克隆到sphi-和noti-消化的pgh022中以产生pgh063。使用引物f-3784_3786和r-3784_3786_sp从多形拟杆菌vpi-5482基因组dna扩增位于基因bt_3784(推定的α-1,2-甘露糖苷酶)上游的282-bp区域。该片段用sphi消化并克隆到sphi-和eco47iii消化的pgh063中以产生pgh066,由此插入bt-3784启动子(p3784)。为了用p3784启动子和低水平蛋白表达核糖体结合位点等价物(rbslow;wegmannetal.,2013年的原始名称shinedelgarno8(sd8))将跨越p1启动子的区域置换为pgh022的rbsmed序列,使用了剪切重叠延伸pcr。最终,使用引物f-rbslow-pep1和引物r-3784_3786_sp从pgh066产生扩增子1。使用引物r-3784_rbslow和r-ppepi/noti从pgh001产生扩增子2。使用扩增子1和2的混合物作为模板,并使用引物r-3784_3786_sp和r-ppepi/noti进行剪切pcr。然后使用该pcr产物的452-bpsphi-和noti-消化的片段置换相应的pgh022的329-bp片段以产生pgh105。使用引物f-rbsmed_mcs或引物f-rbslow_mcs,与引物r-3784_3786_sp一起从pgh066扩增插入序列。使用每个pcr产物的297-bp(rbsmed)或292-bp(rbslow)sphi-和ncoi-消化的片段置换相应的pgh020的169-bp片段。这导致构建用于中等表达的质粒pgh106和用于低表达的pgh107。使用引物对ccr_amont2和ccr_aval2从质粒pfd516(smithetal.,1995)扩增携带ermf的1,500bp区域。将ermf片段用ndei消化并克隆到ndei消化的(平端)和nsii消化的pgh106或pgh107中以分别置换每个现存的1839-bp片段,以分别产生pgh117(rbsmed)和pgh122(rbslow)。将引物tev-his6_linker_5'和tev-his6_linker_3'退火以形成具有ncoi和smai相容末端的66-bpncoi-stui-smai接头,使得该片段直接克隆到ncoi和smai消化的pgh117中,从而产生pgh125med。该tev/6xhis-标签接头的存在提供了将感兴趣的基因克隆到pgh125med的ncoi和stui位点的选择,其结果是添加tev蛋白酶酶的表位识别位点,接着添加6xhis-标签到最终表达的蛋白质的c-末端。
3.碳源对bt_3784启动子活性的影响
所有的大肠杆菌和多形拟杆菌菌株都生长在补充有0.001%氯高铁血红素的脑心浸液(bhi)培养基(bhih)(oxoid/thermofisher,basingstoke,uk)中或生长在拟杆菌属adapteddefinedmedium(bdma,参见表3)中(改编自martensetal.(2008))。适当时加入抗生素作为选择试剂:庆大霉素(200μg/ml)、红霉素和四环素(5μg/ml)。培养物在37℃的无氧条件下孵育。在存在或不存在外源甘露聚糖的情况下,在丰富培养基(bhih)和补充有不同碳源的基本培养基(bdma)中生长之后,测试菌株gh193的报道分子活性(图1b)。在基本培养基中,菌株gh193的生长速率在所有与所存在的碳源无关(除甘露聚糖外)的情况下相似,对于与其他条件下90分钟的世代时间相比,gh193表现出较慢的生长,其世代时间为130分钟。在丰富培养基中,gh193的报道分子活性在甘露聚糖诱导后没有显著增加。由于bhi(添加了氯高铁血红素(h))含有0.2%的葡萄糖,这表明尽管存在甘露聚糖,葡萄糖抑制bt_3784的表达,如martensetal.(2008)报道的。然而,在补充有葡萄糖作为主要碳源的基本培养基中,甘露聚糖诱导导致pepi的活性增加大约15倍(图1b),表明bhi混合物中最可能存在额外的抑制来源。对于pepi测定,培养物(200ml)一式两份生长至诱导前在600nm处的光密度为0.5。为了测定最佳诱导物浓度,将甘露聚糖添加至20ml等分试样中,最终浓度为0、0.1、1.0、5.0、10、50或100mg/l。在2小时诱导期后,通过在4℃以6,000g离心15分钟来收集细胞。如前所述进行多形拟杆菌无细胞提取物的制备(wegmannetal.,2013)。为了测定最佳诱导时间,添加甘露聚糖至100mg/l的最终浓度并继续孵育。随后,随时间收集20ml样品,并如上所述收获细胞。根据wegmannetal.(2013)描述的方法测定蛋白质浓度和肽酶i活性。比活性表示为每毫克蛋白质每分钟从发色底物释放的对硝基苯酚的纳摩尔数。与缺少甘露聚糖的相应对照培养物相比,在半乳糖、乳糖和木糖上生长的细胞的甘露聚糖诱导的pepi活性增加110至120倍(图1b)。在甘露糖存在下在阿拉伯糖和甘露糖上生长的细胞的pepi活性虽然较低,但仍然分别比缺乏甘露聚糖的对照培养物高(图1b)87和109倍。毫不奇怪,尽管生长速度较慢,但在甘露聚糖上生长的细胞表现出高pepi活性。在本研究中测试的碳源中,只有葡萄糖负面影响甘露聚糖诱导的bt_3784启动子(p3784)。如之前在用于表达其他糖苷酶的其他拟杆菌属物种,例如b.ruminicola中的β-葡糖苷酶(strobel和russell,1987)或卵形拟杆菌中的木聚糖酶(hamadyetal.,2008)中观察到的,葡萄糖负面调节α1,2甘露糖苷酶的表达。值得注意的是,在不存在甘露聚糖的情况下可检测到低水平的pepi活性,这与之前的数据一致,该数据显示在缺乏相关底物的条件下,多形拟杆菌pul表达水平低(sonnenburgetal.,2006、martensetal.,2009和sonnenburgetal.,2006)。重要的是,单糖甘露糖是甘露聚糖酶水解的主要终产物之一(dusterhoftetal.,1993),尽管该底物已显示出在多形拟杆菌中具有对几种己糖(包括葡萄糖和戊糖)使用的抑制作用(degnan和macfarlane,1995),但不影响α1,2甘露糖苷酶基因的表达。
4.甘露聚糖浓度和诱导时间对启动子活性的影响
用德氏乳杆菌乳亚种乳乳杆菌(lactobacillusdelbrueckiisubsp.lactis)的pepi基因编码的肽酶i和btcepa基因编码的多形拟杆菌β-内酰胺酶作为报道分子来研究多形拟杆菌中应答甘露聚糖诱导试剂的启动子活性。研究中的多形拟杆菌菌株在bdma中生长。对于在含有木糖的基本培养基中生长的细胞,测试p3784对递增浓度的甘露聚糖的应答。测试的菌株是包含含有为中等表达设计的翻译起始信号的拟杆菌属表达载体的gh193(wegmannetal.,2013)和含有为低表达设计的载体的gh287(wegmannetal.,2013),以确保最广泛范围的表达水平覆盖了最低的基础活性。测量gh287的p3784的基础水平活性比菌株gh193的低5倍(图2a)。对于菌株gh193和gh287,pepl活性在甘露聚糖浓度低至50mg/l(其对应于0.005%的甘露聚糖)时达到峰值(图2a)。为了进一步优化诱导条件,测定了产生最高水平报道分子活性所需的最小诱导时间。在与50mg/l甘露聚糖孵育的菌株gh193中,在甘露聚糖诱导的时间过程中评估启动子的应答。pepi活性在30分钟后可检测到,并且此后继续增加,90分钟后达到最大活性(图2b)。对于gh287,该菌株含有low-rbs-p3784构建体,在90分钟后也达到最大活性。为了促进拟杆菌属的感兴趣的基因的控制的表达,构建了在pepi报道分子位置含有多克隆位点的质粒,导致构建如上所述的用于中等表达的质粒pgh106和用于低表达的pgh107。
5.甘露聚糖控制的氨苄青霉素抗性
由于该新型基因表达系统的优化是基于使用异源报道基因的,通过确定其是否可用于研究多形拟杆菌基因来验证该系统。为此目的,进行btcepa缺失突变体的互补(stentzetal.,2015),所述btcepa是一种头孢菌素酶基因,其参与细菌细胞对β-内酰胺类抗生素的耐药性。使用引物对lactamase_f和lactamase_ecori_r来扩增来自多形拟杆菌vpi-5482基因组dna编码btcepa的885-bp区域。用ecori消化btcepa片段并将其克隆到ncoi消化的(平端)和ecori消化的pgh122(rbslow)或pgh117(rbsmed)中,以分别产生质粒pgh141和pgh142,其分别用于转化多形拟杆菌δbtcepa菌株gh221。用递增浓度的甘露聚糖诱导2小时后测量β-内酰胺酶活性(表4)。对于β-内酰胺酶测定,在用不同水平的甘露聚糖(见表4)或5mg/l的头孢噻肟(cefotaxime)诱导20ml等分试样之前,将培养物(200ml)一式两份生长至600nm处的光密度为0.5。按照stentz等人所述制备周质蛋白质(stentzetal.,2015)。根据制造商的说明书(calbiochem),通过水解头孢硝噻(nitrocefin)以分光光度法评估β-内酰胺酶活性。所提供的平均值和标准偏差基于两个生物学重复,每个三次技术重复。使用递增浓度的甘露聚糖和低表达系统逐渐恢复至在野生型菌株产生的β-内酰胺酶活性的三分之二。随着中等表达系统渐变,产生增加的β-内酰胺酶活性水平,其最终超过了btcepa的天然表达水平。使用低和中等变体允许诱导范围从1到1155倍的活性值。低表达系统测量的基础水平可忽略不计,因为它仅代表野生型对照菌株测量的活性的2.7%。为了确定这些测量的活性如何转化为对β-内酰胺抗生素的耐药性,对于存在或不存在甘露聚糖时生长的每种变体菌株,测定β-内酰胺抗生素氨苄青霉素的最小抑制浓度(mic)。测得的mic值与在相应菌株(表5)中测量的β-内酰胺活性密切相关,其值范围为4mg/l至2048mg/l。
6.重组btcepa的生产和纯化
蛋白质融合标签是设计为提高重组蛋白表达产量、促进蛋白质纯化并加速确定蛋白质结构、功能和相互作用的基本工具。我们的系统用于表达重组his标签的btcepa蛋白。为此,btcepa编码区的c端与pgh125med上编码的六聚组氨酸亲和标签融合。含有该构建体的菌株gh402在甘露聚糖存在下诱导5小时并获得细胞周质级分。通过亲和层析纯化含有c端his标签的重组btcepa,并加样到sds-page上(图3)。btcepa[his]6来自多形拟杆菌,在用100mg/ml的甘露聚糖诱导2小时之前,培养物(100ml)生长至在600nm的光密度为0.5。通过3,500g离心10分钟在环境温度下收集两个50ml等分式样中的细胞。如stentzetal.(2015)所述处理每个50ml细胞沉淀以提取其周质蛋白,例外是使用最终体积为0.4ml的冰冷的mgso45mm溶液。向回收的渗透性休克液中加入63ml10×浓缩的裂解缓冲液(nah2po40.5m,nacl0.3m,咪唑0.1m,ph8),然后用5mmmgso4将终体积调节至600ml。在使用ni-ntaspinkit(qiagen,uk)继续纯化过程之前,通过在4℃12,000g离心15分钟除去污染的细胞碎片。根据制造商的说明在天然条件下进行纯化btcepa[his]6。作为对照,天然btcepa在相同条件下表达,sds-page分辨的条带对应于在周质提取物中检测到的蛋白质(图3)。检测到因蛋白质标签而分子量略高的btcepa-his6融合蛋白的条带。在纯化和浓缩洗脱的条带后,获得对应于btcepa-his6的单个物质,而对于空白载体对照没有检测到相当的条带,没有对应于流出物中检测到的btcepa-his6的蛋白(图3)。在sds-page和胰酶消化后,使用propickspotpicker(genomicsolutions)和progest蛋白质消化机器人(genomicsolutions),在使用离线版本的mascot(matrixusing)搜索多形拟杆菌序列并在ultraflex11maldi173tof-tof(bruker)上进行肽质量指纹分析之前在单一条带上挑选选定的斑点。使用肽质量指纹分析,该条带被鉴定为btcepa。开发了一种有效的系统允许纯化在其天然宿主中产生的多形拟杆菌重组蛋白质,并且在这种情况下,重组蛋白质更可能保留其天然特征。
7.小鼠肠道中甘露聚糖诱导的btcepa表达
“α-甘露聚糖是一种真菌细胞壁聚糖,其含有类似于那些存在于分泌的粘液和上皮表面上的n-连接聚糖的核心区域中发现的α-甘露糖苷键。”(martensetal.,2011)。然而,与其他显示体内高活性的pul相比,喂养缺乏外源α-甘露聚糖的饮食的小鼠中参与甘露聚糖利用的pul基因的表达水平仅为部分(martensetal.,2008)。在通过饮用水施用1mg/ml氨苄青霉素和1mg/ml新霉素处理3天后,在肠道内建立多形拟杆菌的7周龄雄性c57bl/6jwt小鼠体内测试甘露聚糖诱导系统的效力,所述小鼠在常规动物设施中饲养3天。为了达到此目的,通过口服管饲(1×108个集落形成单位(cfu)在100μl磷酸盐缓冲盐水中)施用含有由诱导型低表达系统(表1)控制的btcepa基因的菌株gh361至两组小鼠中,每组4只。其中一组(a组)给予含有2.5%(v/v)甘露聚糖-寡糖补充物(activemos,orffa,werkendam,thenetherlands)的饮用水,其用1%naoh在100℃处理粉末(10%w/v)1h,冷却并用稀盐酸溶液中和至ph7(huangetal.,2010)。2天后,通过计数粪便样品中的cfu(图4),两组小鼠都类似地定殖有gh361,表明暴露于甘露聚糖不影响多形拟杆菌定殖小鼠肠道的能力。两组小鼠均通过隔日腹腔注射一种第三代头孢菌素头孢曲松(ceftriaxone)(0.4mg/只)来攻击(challenged),其通过胆道途径排泄并影响结肠微生物群(arvidssonetal.,1982)。当细胞在不存在甘露聚糖时生长,gh361的头孢曲松的mic测定为8mg/l,当甘露聚糖添加到生长培养基中时,则为64mg/l。三次连续剂量的头孢曲松对给予甘露聚糖的a组gh361水平无影响;然而,没有给予甘露聚糖(b组)的gh361的水平大约降低了15倍(图4)。将头孢曲松进一步增加至0.8mg显示两组均受到同样的影响,并且群体水平显著下降。观察到的甘露糖对gh361对头孢曲松耐药性的中度影响很可能是由于内源甘露聚糖和/或衍生物对启动子活性的诱导。在有和没有添加甘露聚糖的组之间,gh361定殖中获得的差异(p≦0.01)表明该系统可用于体内研究。例如,可以考虑用pul启动子置换甘露聚糖启动子,通过植物衍生的诱导试剂如阿拉伯半乳聚糖(最近证实其有效性)来调节(mimee等,2015)。动物实验完全按照homeoffice批准的animalscienificproceduresact1986进行。
总结
已经产生了用于多形拟杆菌的新型甘露聚糖诱导型基因表达系统。我们已经表明基因bt_3784应答甘露聚糖而被调节,并且已经将位于基因bt_3784上游的区域与两个不同的核糖体结合位点结合在一起,使得基因表达量得到严格调节。这种甘露聚糖控制的基因表达系统可通过改变甘露聚糖浓度以及与核糖体结合位点rbsmed和rbslow(wegmannetal.,2013)的组合来调整,产生超过1000倍范围的启动子活性。该系统显著有效,因为它只需要浓度低至50mg/l的甘露聚糖即可完全诱导。本研究中描述的载体一起构成了表达拟杆菌属基因并纯化其产物以及研究拟杆菌属细胞生理学的有用工具。调整或调节表达水平的能力是有利的,因为它允许分泌不同量的异源肽或蛋白质,着在过量生产和/或高水平蛋白质可能具有不利生物学效应的情况下是有价值的。
实施例b:产生omv
工程化能够表达和包装候选细菌和病毒疫苗抗原到其omv中的bt菌株。btomv的大小多变(<50-300nm),这可能影响其装载(cargo)和疫苗抗原含量,以及它们如何与宿主免疫细胞相互作用。工程化的btomv疫苗抗原制剂使用蛋白质组学和大小分级的omv的质谱学进行表征。该信息对于鉴定肠道内摄取途径、靶向诱导的粘膜免疫部位、以及与粘膜免疫细胞尤其是抗原呈递细胞(apc)的相互作用和被其获取是重要的。
测定btomv疫苗与apc相互作用并产生局部和全身宿主免疫应答的能力。口服或鼻内施用后,使用体外和体内模式系统来研究omv-免疫细胞相互作用的机制和结果。已建立的转胞吞作用模式用于证明微褶细胞(m)细胞在omv的初始摄取中发挥重要作用,随后将其在其基底外侧袋中递送至树突状细胞和巨噬细胞。在它们的apc中表达荧光报道蛋白的两种独特的转基因小鼠系csflr-egfp(macgreen)和csflr-gal4vp16/uas-ecfp(macblue)与活体内2-光子和共聚焦显微镜结合使用,以证明omv暴露刺激了固有层中apc的直接取样,及omv随后向周围淋巴组织迁移和传播。
证明btomv疫苗可以诱导特异性免疫和保护。
用omv疫苗制剂疫苗接种小鼠用于证明omv疫苗引发抗原特异性粘膜和全身抗体(iga/igg)和cd4t细胞应答的能力。这些免疫参数是保护性免疫的代理或决定因素,如通过用活的毒性病原体攻击疫苗接种的动物并评估病原体遏制和从肠道到外周组织的传播来确定的。
开发了在omv中稳定表达先前验证的候选疫苗沙门氏菌(sseb、ompd和shda)和诺如病毒(gii-4衣壳蛋白)抗原的bt菌株,所述omv的物理和化学特征完全定义用于最佳口服或鼻内施用。通过在体内成像和追踪omv证明了在肠和鼻粘膜内omv摄取途径和其靶向微褶细胞(m)细胞和相关抗原呈递细胞(apc)的能力。成功的omv疫苗可是能够在局部和全身产生抗原特异性cd4t细胞和iga抗体的疫苗,其能够保护免受传染性攻击。
进行用于将疫苗抗原有效靶向omv的疫苗抗原分泌信号序列的合理设计和选择。表征了bt产生的omv疫苗制剂及其大小如何影响omv中疫苗抗原含量和分布。建立了体内omv摄取途径及其对进入m细胞和粘膜apc的要求。定义了omv疫苗的特异性免疫和对抗感染的产生。这提供了在动物和人中测试btomv疫苗的基本原理。合理的疾病和目标人群是农场动物(猪和鸡)中的沙门氏菌病以及易感人群和风险人群中的诺如病毒感染。
证明疫苗ag选择的可行性:沙门氏菌
salmonellaenterica包含不同的血清型,其感染宽范围的宿主,其中鼠伤寒沙门氏菌(typhimurium)和肠炎沙门氏菌(enteritidis)是牲畜和人的重要病原体,并且人独有的病原体伤寒沙门氏菌(typhi)引起伤寒症。世界范围的家畜和家禽的鼠伤寒沙门氏菌感染导致一系列结果,范围从严重疾病到无症状的携带,其中通过食物供应的污染是人感染的主要来源和途径。减少食源性感染的风险是开发更有效的疫苗用于养殖农场动物的重要驱动,特别是在考虑到禁止预防性使用抗生素(欧洲)和增加的多重耐药性时。目前可用的疫苗只提供中等水平和有限的持续以及临床相关血清型的不完全覆盖(bumann,2014)。保护性沙门氏菌ag已被鉴定为表面暴露的或分泌的(bumann,2014),编号超过200个。这些中约50个在感染期间在小鼠伤寒模型中表达,其中九个在小鼠中赋予一定程度的保护性免疫(flic、sseb、ompd、cira、iron、t0937、slyb、pagn和ssei)(bumann,2014、rollenhagenetal.,2004、gil-cruzetal.,2009、leeetal.,2012和reynoldsetal.,2014)。spi-2易位子亚基sseb是一种特别有前途的疫苗ag,能够在小鼠和人中产生(ab)和t细胞应答(leeetal.,2012)。鉴定沙门氏菌在肠道中的持续性和脱落所需的ag已经揭示了额外的候选疫苗ag,包括为持续在小鼠盲肠中所需的shda基因(kingsleyetal.,2002)。为了证明bt衍生的omv的能力是将候选疫苗ag递送到粘膜部位而不是鉴定候选疫苗ag在粘膜部位的具体目的,选择ag用于omv递送的合理性在于通过引发保护性宿主免疫应答(ompd和sseb)的那些具有潜在限制定殖(shda)和宿主感染的ag。我们的数据证明了衍生bt菌株在其omv中表达沙门氏菌ag(ompa)的可行性,该omv在口服施用后可在小鼠内引发特异性ab应答(图5)。bt被工程化为表达疫苗抗原。通过使用omv裂解物的免疫印迹(ib)检测在bt-omv中的沙门氏菌ompa(stompa)的表达(图5,a,箭头)。将btstompa+omv的超薄切片用兔抗stompa和抗兔ig-金颗粒染色,并通过em成像以证明stompa的表达(图5,a,插图)。在用stompa+btomv(正方形)或野生型btomv(三角形)口服管饲后28天,或腹腔注射stompa+btomv(菱形)之后,通过固相elisa测定小鼠血清中抗stompaigg的水平(n=6ea)。*p<0.05,比较口服前和口服后以及腹腔stompa+omv免疫的igg水平(图5,b)。通过rt-pcr检测诺如病毒gii-4衣壳mrna在重组bt中的表达(norov)。使用gyra基因作为对照(图5,c)。
证明疫苗ag选择的可行性:诺如病毒
人类诺如病毒是欧洲流行性肠胃炎和食源性疾病爆发的主要原因(verhoefetal.,2010)。估计每年有3亿例诺如病毒感染,导致全球大约26万人死亡,其中大部分是年轻人和老年人(trivedietal.,2013)。过去十年中,在美国、欧洲和大洋洲流传的主要基因型为genogroupii-genotype4(gii-4)诺如病毒,导致了高达所有诺如病毒爆发的80%(desaietal.,2012)。无法在细胞培养中维持人诺如病毒并且产生活的/杀死的减毒株导致使用掺入来自不同基因型(包括gii-4)的病毒样颗粒(vlp)的单价和多价疫苗,其还含有佐剂。当通过(肌内)注射递送时,这些疫苗可在人类志愿者中产生阻断ab应答(lindesmithetal.,2015和el-kamaryetal.,2010)。然而,他们保护免于病毒感染的能力还没有被试验,或者他们在早期阶段试验中已经错过了他们的主要终点(bemsteinetal.,2015)。迄今为止,不含佐剂的口服递送重组诺如病毒vlp具有免疫原性,并且能够在小鼠和健康人类志愿者中引发粘膜和全身ab应答(balletal.,1999和tacketetal.,2003)。vlp的粘膜施用是递送诺如病毒疫苗的有效途径。本发明人已经使工程化的bt菌株表达编码gii-4诺如病毒衣壳的基因(图5),其产物在omv中表达,在口服递送和免疫后测试其在体内引发粘膜和全身免疫应答的能力。全球占优势的gii-4株是一个快速发展的基因簇,并出现与流行性肠胃炎相关的抗原性新型gii-4株。由于此类出现的事件倾向于在一年内在全球范围内发生,因此任何候选疫苗都需要易于调整/重新工程化以适应流传病毒株的抗原性变化。本发明的拟杆菌属omv技术充分适应以满足这种需要。
工程化bt表达病原体ag
btompa的n-端信号肽与沙门氏菌ompa的融合促进其分泌到btomv中(图5),对沙门氏菌ompd和shda以及gii-4诺如病毒衣壳蛋白重复该策略。如果全长蛋白不能或不好地表达,则功能结构域优先表达。例如,纤连蛋白结合所需的shda的hep-2(kingsleyetal.,2004a)和a3(kingsleyetal.,2004b)区域。将重组基因克隆到含有提供不同表达水平的各种rbs构建体的bt载体中(wegmannetal.,2013)。疫苗ag分泌到btomv中是通过免疫印迹(1b)和/或elisa来评估的,并通过em可视化衣壳蛋白自组装成病毒样颗粒。可能增强病原体毒力的蛋白质/酶(如从基因组序列和/或omv蛋白质组中鉴定的抗生素耐药性基因)被“工程化成”bt,如已经实现的头孢菌素酶(cepa)(其表达与omv的外膜相关)的消除表达(stentzetal.,2015)。
ag表达的替代方法
产生重组bt菌株的技术由本发明人完善建立,并已成功用于在bt中表达沙门氏菌和诺如病毒ag及其omv(图5)。在btomv中表达疫苗ag的替代方法是可能的,例如,使用从omv蛋白质组和相应的bt基因组鉴定的不同(混合和匹配)分泌信号序列、或预测蛋白质n端信号序列的软件程序(例如signalp)、或通过关注那些可以表达符合选择标准的ag。
btomv制备
如发明人先前所证明(stentzetal.,2015和stentzetal.,2014),通过一系列对野生型bt(vpi-5482)和表达沙门氏菌和诺如病毒ag的工程化菌株的早期静止生长期培养物过滤和超速离心制备omvs。使用经二氧化硅微球校准的nanosightns500(malverninst.ltd),通过纳米颗粒追踪分析(nta)测定omv浓度和大小分布(gardineretal.,2013)。nta已成功用于表征人体细胞培养和体液中微泡(sooetal.,2012),并提供了一种快速、直接和可重复的方法来测定omv的浓度和大小分布。为了比较的目的,使用基于蛋白质含量与活细菌数量之比的常规omv测定。em用于评估omv的纯度和完整性。在蛋白酶保护测定中建立疫苗ag对胞外蛋白酶的内部/外部定位和抗性,在ib分析之前将omv制备物与蛋白酶(或小鼠盲肠内容物)一起孵育(stentzetal.,2015)。btomv的大小变化(~75-300nm;图5),可能影响其疫苗ag含量、和/或它们与宿主免疫细胞的相互作用和摄取。根据它们的大小和疫苗ag含量来最大化omv产生的最佳生长条件是凭经验确定的。疫苗ag表达通过omv裂解物的ib和/或elisa来证实。如果omv产生水平通过优化生长条件不足以来弥补,则通过例如突变与大肠杆菌和沙门氏菌deg丝氨酸蛋白酶(其在大肠杆菌中增加omv生产100倍(mcbroometal.,2006))同源的基因衍生超发泡(hypervesiculating)bt菌株(对于degs和degp,bt_1312e值分别为2e-63和4e-76)。大规模生物反应器(15-100升)用于扩大bt培养和omv生产。
omv成像
使用标准方案(hickeyetal.,2015),用荧光染料(例如fitc、dii、dio、pkh26)容易地标记分离的omv的包膜。使用荧光万古霉素标记omv的内容物以标记复杂的肽聚糖。数据显示dii标记适用于体内btomv与肠上皮细胞相互作用的成像(图6)。将dil标记的omv(红色)注射入小鼠回肠袢中,30分钟后将组织快速冷冻、切片(4μl),用dapi(蓝色)复染并通过uv显微镜(zeissaxiovert)成像。合并的低功率(顶部)和高功率(底部)图像显示沿着隐窝绒毛轴和绒毛顶部的omv的共定位(明亮区域)。鉴定了omv可能位于固有层内(箭头,图6)
btomv蛋白质组定义
定义btomv的蛋白质组建立最佳生长条件以最大化疫苗ag含量。它还建立了促进和增强宿主细胞相互作用(粘附素、粘液-硫酸酯酶)的mamp(例如tlr和nod配体)和lyco/脂蛋白的分布,解决了生物安全问题,排除了对宿主细胞功能有害的蛋白质的表达(例如毒素、溶素、ig蛋白酶)。高度纯化、密度梯度超速离心(optiprep)-分级(3-4级分)的omv的内容物除了疫苗ag含量外还通过蛋白质组学和质谱来表征(berlandascorzaetal.,2008和lee,2007)。
通过m细胞证明穿过肠上皮的omv的转胞吞作用
为了产生免疫应答,内腔ag必须首先通过粘膜(例如肠和鼻)上皮转运到galt/nalt中,其在胃肠道中主要包括阑尾、peyer’s结(pp)、结肠结(colonicpatch)和分离的淋巴滤泡。覆盖galt/nalt的是独特的上皮细胞,称为m细胞,专门发挥对内腔ag颗粒和病原体的转胞吞作用(mabbottetal.,2013)。穿过pp的滤泡相关上皮(fab)的m细胞介导的ag转胞吞作用对于诱导有效的粘膜免疫应答是必需的(haseetal.,2009和kanayaetal.,2012)。将疫苗ag靶向递送至m细胞是诱导ag特异性免疫应答的有效手段(ulmeretal.,2006)。m细胞与单核吞噬细胞(mnp)密切相关,所述单核吞噬细胞包含巨噬细胞和经典dc(bradfordetal.,2011),其在m细胞的基底外侧口袋内对经转胞的ag进行取样(wangetal.,2011)。肠上皮细胞和巨噬细胞可以在完整的小鼠结肠中获得bt产生的omv,尽管迄今为止仅在具有免疫调节缺陷和缺陷屏障功能的小鼠中发生(kangetal.,2013)。确定在胃肠道和鼻腔中发生btomv摄取的正常条件。
在体内建立的ag转胞吞作用试验(donaldsonetal.,2012)用于证明m细胞在来自肠腔和鼻腔中的omv穿过fae到下面的mnp的初始转胞吞作用中的重要性(knoopetal.,2009,raseetal.,2009,nakatoetal.,2012)。用荧光重组omv和荧光200nm乳胶珠(作为对照示踪剂)管饲c57bl/6小鼠组(n=4),随后以间隔(1-24小时)除去整个小肠和大肠,并通过高分辨率活体2-光子显微镜和全装片免疫荧光共聚焦显微镜定量摄入进galt的珠(图7)(donaldsonetal.,2015)。先前的研究指导了一系列omv剂量,其已经将病原体衍生的omv口服递送至小鼠以引发宿主免疫反应(collinsetal.,2011)。omv和珠也被鼻内施用以比较其在nalt中被m细胞的摄取(mutohetal.,2015)。通过使用整个肠,以及一系列剂量的omv和暴露间隔,证明了omv摄取的解剖部位,以及omv的最佳剂量,并且比较了它们摄取的动力学。已显示nf-κb配体(rankl)的tnf超家族成员受体激活剂是控制表达rank的肠上皮细胞分化成m细胞的关键因子(knoopetal.,2009)。此外,通过用抗rankl抗体处理使rank信号阻断后,m细胞被耗尽。为了证实m细胞参与穿过肠上皮的omv摄取,将omv(或珠)施用于villincre+rankfl/fl小鼠,其中rankl依赖性m细胞分化和ag颗粒的摄取在整个肠上皮中被阻断(powelletal.,2015)。用recrankl处理刺激m细胞的扩增,增强ag和肠道细菌的摄取(knoopetal.,2009,kanayaetal.,2012和kimuraetal.,2015)。确定增加m细胞密度是否增强从肠腔摄取omv。将c57bl/6小鼠组腹腔注射recrankl(或pbs作为对照)以刺激m细胞发育(knoopetal.,2009和kanayaetal.,2012),其中肠道内的m细胞数目以每日为间隔,通过用糖蛋白2(gp2)特异性ab染色整个肠道的全装片来确定(donaldsonetal.,2012和kobayashietal.,2013),并比较galt中和固有层内的gp2+m细胞的数量。为了证明m细胞密度对omv摄取的影响,在recrankl诱导的m细胞诱导的峰值处,小鼠用荧光omv(和荧光珠作为对照)管饲,并显微镜测定摄取到固有层中的omv的数目(donaldsonetal.,2015,donaldsonetal.,2012和kobayashietal.,2013)。
m细胞摄取的替代方法
在本发明中也可以实现通过掺入已知的m细胞结合配体如沙门氏菌的fimh蛋白、侵袭素或y.enterocolitica的omph以及选自选择用于m细胞结合(如co1)以增加局部和血清iga应答的(噬菌体展示)文库的肽,将m细胞靶向策略掺入omv疫苗设计(chionhetal.,2010,foxwelletal.,2007和shimaetal.,2014)。
证明omv进入和影响肠道apc
证明了m细胞相关mnp与omv的相互作用及其对mnp功能的影响。使用两种独特的转基因小鼠品系:csf1r-egfp+(macgreen)小鼠(sasmonoetal.,2007),其中全胃肠道的所有csf1r+mnp(巨噬细胞和dc;(bradfordetal.,2011)表达高水平的gfp,以及csf1r-gal4vp16uas-ecfp(macblue)小鼠,其中胃肠道中的ecfp表达限于在galt的fae下方的上皮下穹窿中的dc(sauteretal.,2014)(图7)。这两个小鼠品系允许通过免疫荧光显微镜研究在体内肠道中omv被不同mnp群的特异性摄取。(如上所述)通过口服管饲(donaldsonetal.,2015)或通过注射入从腹内取出的小鼠肠袢的内腔施用荧光重组omv(如上所述)(donaldsonetal.,2012和kobayashietal.,2013)。通过高分辨率活体2-光子和共聚焦显微镜进行组织成像,以证明omv暴露刺激固有层中的mnp直接取样。稳定状态下的肠道dc持续通过淋巴管迁移到肠系膜淋巴结(mln),在那里它们帮助引起免疫或耐受(cerovicetal.,2013)。macblue巨噬细胞报道分子小鼠被用于比较肠道中的固有和迁移dc亚群、mln和脾脏中的荧光omv的存在(sauteretal.,2014,cerovicetal.,2013和houstonetal.,2015)。本发明人还证明了btomv疫苗引发单核细胞募集至免疫诱导的主要部位如pp的能力。macblue小鼠非常适合这种情况,因为在正常的稳态条件下,他们鉴定了肠固有层中的单核细胞/巨噬细胞和dc的稀有群体(5-6%的cd45+细胞;图7)以及mln,并且pp中ecfp+细胞的数量大量增加以应答流动刺激物和细胞因子(sauteretal.,2014)。基于cd103和cd11b,肠dc可分为功能不同的组(cerovicetal.,2013)。尽管cd103+dc通常被认为是致耐受性的并诱导mln中treg的分化,但cd103-dc看起来更具免疫原性并诱导产生inf-γ和il-17的t细胞的分化。还使用多参数流式细胞术进行对从完整组织提取的细胞的体外分析以鉴定、表型分析和定量浸润的mnp。使用elisa来比较细胞因子应答。
实施例c-确定btomv疫苗是否可以诱导特异性免疫和保护
由淋巴细胞识别omv
沙门氏菌和诺如病毒感染诱导ag特异性b和t细胞应答,其具有需要体液和细胞介导的应答的保护性免疫(bumann,2014)。因此,重要的是所选择的在天然或实验感染期间产生ag特异性适应性免疫应答的沙门氏菌和诺如病毒疫苗ag,当通过omv递送时,可引发相当的ab和cd4t细胞应答。成年单性c57bl/6小鼠(n=10/组)用三种剂量的omv疫苗管饲,施用相隔4周。对照组动物接受腹腔递送野生型omv、仅载体(pbs)或omv。通过夹心elisa分析初始免疫接种之前和2周后以及第一次和第二次加强免疫接种后收集的血清样品的总ig(igm、igg和igg同种型、和iga),并通过固相elisa分析疫苗ag特异性ig。在终点(最终加强免疫后2周)收获粪便水和盲肠和小肠和大肠的内容物,同样检查疫苗ag特异性(iga)ab。产生ifn-γ的cd4+t细胞在控制小鼠毒性沙门氏菌感染(nauciel,2000)和禽沙门氏菌病免疫清除中发挥重要作用(withanageetal.,2005)。使用流式细胞术证明omv接种的小鼠中cd4t活化的证据,鉴定与活化相关的表面ag的表达(例如cd69、cd80/86、cd44、cd62l、foxp3;cd44hicd62llo)或现有的ag暴露(例如klrg1;voehringeretal.,2002)以及在体外重新暴露于含omv的疫苗ag后脾细胞和肠固有层细胞中细胞因子的产生(ifnγ、tnfα、il-6、il-12、il-17、il-10)的变化,使用来自野生型bt、lps或抗cd3抗体的omv作为对照刺激物(alanizetal.,2007)。
omv引发病原体特异性保护性免疫
在鼠科动物模型中复制的人沙门氏菌病的特征是天然(口服)途径进入、细菌的组织和细胞向性、以及先天和适应性免疫的活化(mastroenietal.,2004)。小鼠受到腹腔攻击以证明对全身感染的免疫性,并且通过口服攻击来证明粘膜免疫可以包含并防止肠道中鼠伤寒沙门氏菌的传播。c57bl/6易感小鼠(n=10/组)口服接种(5×108cfu)或腹腔接种(5×103cfu)鼠伤寒沙门氏菌的氯霉素抗药性变体sl1344,并且5天后,将小鼠处死,通过系列稀释在盲肠、肠系膜淋巴结、肝脏和脾脏匀浆组织中cfu计数。氯霉素耐药性的选择区分了盲肠内容物中来自共生细菌的攻击菌株。另外,首次接受试验的或免疫的c57bl/6小鼠用鼠伤寒沙门氏菌sl1344(5x103cfu)腹腔攻击,并定时至预定义的终点(体重减少>15%)至伦理上近似杀死曲线。对omv(疫苗ag+或ag-)或模拟(pbs)免疫的129svj抗性小鼠(n=10/组)接种1×109cfu的鼠伤寒沙门氏菌sl1344的氯霉素耐药性变体和测定接种后第1、7、14和21天粪便沉淀中的cfu以证明粘膜免疫对肠道持久性的影响。测定感染小鼠的免疫细胞参数,并与疫苗接种omv的小鼠获得的免疫细胞参数进行比较。
omv提供疫苗递送的替代方法
来自致病性和共生细菌的omv存活于完整的胃肠运输并且可以穿透肠上皮,进入粘膜apc并活化免疫细胞(collins,2011和vanderpoletal.,2015)。如果btomv疫苗介导的免疫细胞应答弱于由致病性和共生细菌的omv产生的免疫细胞应答,则通过使用替代分泌信号序列增加疫苗ag的表达水平、选择表达最高水平疫苗ag的omv的大小分级的omv群体、或通过在相同的omv制备物中共表达疫苗ag,来提高omv免疫原性。omv表面相关蛋白对蛋白酶处理具有显著的抗性(ohtaetal.,1993),但是如果特定蛋白质显示对肠蛋白酶易感,则选择鼻内途径递送,其可以使用病原体衍生的omv产生保护性免疫(vanderpoletal.,2015)。
证明btomv在其他物种中的疫苗接种
btomv疫苗接种的成功的小鼠模型提供了在动物和人中测试btomv疫苗的基本原理。合理的疾病和目标群体是农场动物(猪和鸡)中的沙门氏菌病以及易感人群和风险人群中的诺如病毒感染。例如,表达csf1r报道基因的转基因鸡(macred和macgreen鸡)(balicetal.,2014)用于优化禽omv疫苗接种方案。
实施例d-证明omv用于递送治疗性多肽的有效性
用含有表达的kgf-2的omv处理降低了化学诱导的结肠炎模型中小鼠中诱导的结肠炎的病理(图8)。
多形拟杆菌细胞被工程化以表达和分泌在omv中的与bt(bt_3852)的ompa的n端信号肽融合的重组人角质形成细胞生长因子-2(kgf-2;成纤维细胞生长因子-10;fgf-10;uniprotkbo15520)。将kgf-2序列的氨基酸残基38-208(全长蛋白质减去其信号肽)在其n端与ompa的多形拟杆菌信号肽(bt_3852;uniprotkbq8a119)融合,其氨基酸序列是mkkilmllafagvasvasa。将融合的产物克隆到表达载体pgh90中(wegmannetal.,2013),导致产生pghi73(见图9)。根据stentzetal.,2015和stentzetal.,2014的方法制备omv,如以上实施例b中所述。多克隆山羊生物素化抗人fgf-10(kgf-2)抗体(peprotech)用于免疫印迹以检测omv裂解物中重组蛋白的存在。结肠炎的小鼠模型通过饮用水对成年小鼠施用2.5%葡聚糖硫酸钠(dss)7天而产生。dss施用的小鼠用(i)含有2.5%dss的pbs(dss-pbs)、(ii)悬浮在2.5%dss中的对照omv(dss-omv)或(iii)悬浮在2.5%dss中的含有重组kgf-2的omv(dss-omvkgf)在第1、3和5天管饲。对照小鼠(无dss施用)类似地用(i)pbs(h2o-pbs)、(ii)对照omv(h2oomv)或(iii)含有重组kgf-2的omv(h2o-omvkgf)在第1、3和5天管饲。所有处理中n=5。基于在第7天呈现的体重减轻、结肠内容物一致性和结肠内容物血液以及盲肠和结肠组织的外观的累积评分,评估所有小鼠的疾病活动指数(dai)评分(hamadyetal.,2010)。在尸体剖检时测量从回盲肠连接处到肛门边缘的结肠长度。将体重减轻计算为第7天占第0天的体重百分比。
从图8可以看出,与对照小鼠相比,用含有表达重组kgf-2的omv处理显著改善了dai评分、dss施用的小鼠中观察到的结肠长度减少和体重减轻(p<0.05与接受相同处理(pbs、omv或omv-kgf)的对照组有显著差异,onewayanova)。与pbs或对照omv处理相比,用含有表达重组kgf-2的omv处理对于对照(无dss施用)小鼠没有显著的有害作用。
表1
表2
表3
表3:bdm适应的(bdma)组成
表4
表4:在甘露聚糖诱导后btcepaβ-内酰胺酶活性
a添加5mg/l头孢噻肟
b诱导因子=指示条件获得的平均值/非诱导的gh361菌株获得的平均值(11.4)
表5
参考文献:
alaniz,etal.,jimmunol,2007,179:7692-7701.
arvidssonetal.,j.antimicrob.chemother,1982,10:207-15.
balic,etal.,development,2014,141:3255-65.
ball,etal.,gastroenterology,1999,117:40-48.
bayley,etal.,femsmicrobiollett,2000,193:149-54.
berlandascorza,etal.,molcellproteom,2008,7:473-85.
bernstein,etal.,jinfectdis,2015,211:870-8.
bradford,etal.,immunobiol,2011,216:1228-1237.
bumann,frontimmunol,2014,5:381-9.
cerovic,etal.,mucosalimmunol,2013,6:104-113.
chionh,etal.,gutmicrobes,2010,1:42-44.
collins,discovmed,2011,62:7-15.
cuskinetal.,nature,2015,517:165-9.
degnanandmacfarlane,anaerobe,1995,1:25-33.
desai,etal.,clininfectdis,2012,55:189-193.
donaldson,etal.,immunol,2012,137:131-131.
donaldson,etal.,jvirol,2015,89:9532-9547.
elam-evans,etal.,mmwr,2104,63:741-748.
el-kamary,etal.,jinfectdis,2010,202:1649-1658.
foxwell,etal.,humvaccines,2007,3:220-223.
gardiner,etal.,jextracellvesicles,2013,2:19671.
gil-cruz,etal.,pnasusaa,2009,106:9803-9808.
hall,etal.,emerg.infect.dis.,2013,19:1305-1309.
hamadyetal.,microbiology,2008,154:3165-74.
hamady,etal.,gut,2010,59:461-9.
hamady,etal.,inflammatoryboweldiseases,2011,17:1925-35.
hase,etal.,nature,2009,462:226-232.
hickey,etal.,cellhostmicrobe,2015,17:672-80.
hoft,etal.,cellmicrobio,2011,13:934-942.
houston,etal.,mucosalimmunol,2015,inpress.
huangetal.,znaturforschc,2010,65:387-90.
kanaya,etal.,natimmunol,2012,13:729-734.
kang,etal.,plosone,2013,8:e76520.
kaparakis-liaskos,etal.,naturerevsimmunol,2015,15:375-87.
kesty,etal.,jbiolchem,2004,279:2069-2076.
kim,etal.,expmolmed,2014,46:e85.
kimura,etal.,mucosalimmunol,2015,8:650-660.
kingsley,etal.,molmicrobiol,2004a,52:345-355.
kingsley,etal.,molmicrobiol,2002,43:895-905.
kingsley,etal.,jbacteriol,2004b,186:4931-4939
kleinetal.,microbiology,1994,140:1133-9.
knoop,etal.,jimmunol,2009,183:5738-5747.
kobayashi,etal.,mucosalimmunol,2013,6:1027-1037.
lee,etal.,plospathog,2012,8:e1002499.
lee,proteomics,2007,7:3821-3821.
lewison,1997,gastroenterologyintheuk:theburdenofdisease(brit.soc.gastro.andbrit.digest.found.report).
lindesmith,etal.,openforuminfectdis,2015,2:1-8.
mabbott,etal.,mucosalimmunol,2013,6:666-677.
martensetal.,cellhostmicrobe,2008,4:447-57.
martensetal.,j.biol.chem.,2009,284:18445-57.
martensetal.,plosbiol,2011,9:e1001221.
mastroeni,etal.,microbesinfect,2004,6:398-405.
mcbroom,etal.,jbacteriol,2006,188:5385-5392.
mcbroom,etal.,molmicrobiol,2007,63:545-558.
mimeeetal.,cellsyst,2015,1:62-711.
mutoh,etal.,celltissueres.,2015,57:39-43.
nakato,etal.,jimmunol,2012,189:1540-1544.
nauciel,j.immunol.,2000,145:1265-1269.
noah.vaccinationoffarmanimals.2014:http://www.noah.co.uk/issues/vaccines.htm.
ohta,etal.,infectimmun,1993,61:4878-4884.
parkerandjeffreysmith,2012,plasmid,68:86-92.
powell,etal.,natnanotechnol,2015,10:361-369.
reynolds,etal.,immunol,2014,143:438-446.
rios,etal.,mucosalimmunol,2015,inpress:doi:10.1038/mi.2015.121.
rollenhagen,etal.,pnasusa,2004,101:8739-8744.salyers,etal.,appl.environ.microbiol,1977,33:319-22.
sambrook,molecularcloning:alaboratorymanual,2001,new-yorkusa.
sasmono,etal.,jleukocytebiol,2007,82:111-123.
sauter,etal.,plosone,2014,9:e105429.
shima,etal.,intimmunol,2014,26:619-625.
shoemakeretal.,bacteriol,1986,165:929-36.
smithetal.,plasmid,1995,34:211-22,
sonnenburgetal.,procnatlacadsciusa,2006,103:8834-9.
sonnenburget.,cell,2010,141,:1241-52.
soo,etal.,immunol,2012,136:192-7.
stentzetal.,j.antimicrob.chemother,2015,70:701-9.
stentz,etal.,cellreports,2014,6:646-56.
strobelandrussel,appl.environ.microbiol,1987,53:2505-10.
tacket,etal.,clinimmunol,2003,108:241-247.
tam,etal.,2011,theiid2study(fsareport).
trivedi,etal.,amjinfectcontrol,2013,41:654-657.
ulmer,etal.,natbiotechnol,2006,24:1377-1383.
vanderpol,etal.,biotech.j.,2015,10:1689-1706.
verhoef,etal.,emerginfectdis,2010,16:617-624.
vingadassalom,etal.,mol.microbiol,2005,56:888-902.voehringer,etal.,blood,2002,100:3698-3702.
wang,etal.,jimmunol,2011,187:5277-85.
wang,etal.,microbpathogenesis,2013,58:17-28.
wegmann,etal.,applenvironmicrob,2013,79:1980-1989.
withanage,etal.,infectimmun,2005,73:5173-5182.
xuetal.,science,2003,299:2074-6.
- 还没有人留言评论。精彩留言会获得点赞!