BCL-2L10/IP3受体相互作用的抑制剂的制作方法
本发明涉及制药领域,尤其涉及肿瘤学领域,尤其涉及癌症治疗领域,所述癌症细胞表达蛋白bcl-2l10。
背景技术:
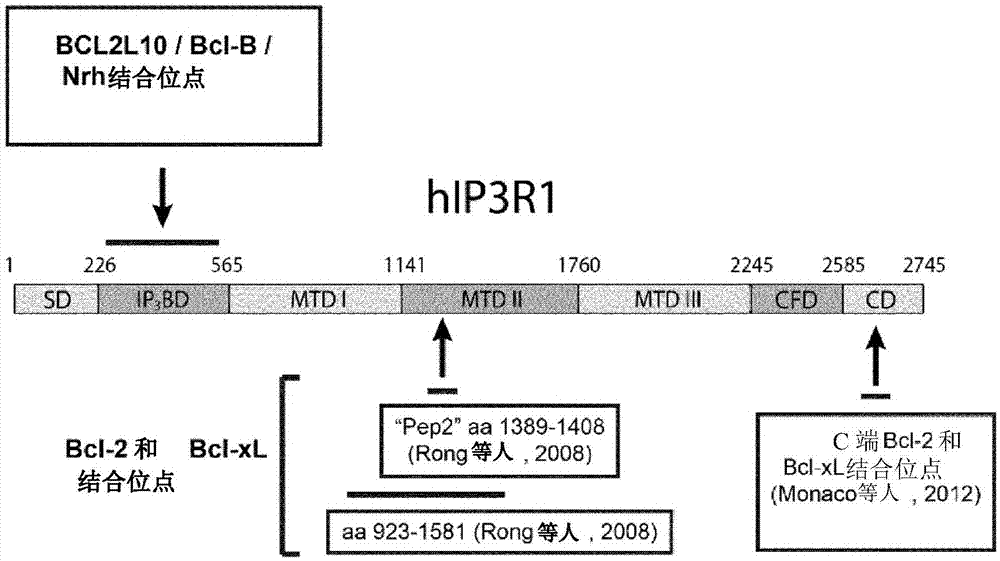
:癌症是人和动物的疾病,其通常是致命的,并且体现为内源性细胞的不受控生长。术语“癌症”用于表示恶性肿瘤和赘生物(肿瘤或癌)的形成。通常,癌症的生长包括两个阶段,即局部肿瘤生长然后癌症的扩散。局部肿瘤生长包括,在初始性和促进性致癌剂的作用下出现来自“转化”细胞的肿瘤克隆。细胞增殖导致肿瘤的形成。可以通过区域扩散和/或通过称为转移的继发性肿瘤发展,而发生癌症从初始肿瘤的扩散。为了治疗癌症,已经开发了各种技术,例如手术、放射疗法、化学疗法、激素疗法、免疫疗法和抗血管生成疗法。对最适合的治疗或疗法的选择基于各种因素,尤其取决于每种类型癌症通常遵循的治疗方案、诊断时的疾病阶段以及患者的一般状况。然而,似乎使用某些旨在通过诱导细胞凋亡来杀死癌细胞的化疗产品可能证明对某些患者有效,但在其它患者中无效。已经鉴定了某些生物标志物,已经在对药物具有耐受性的患者中观察到其存在或过表达,这些药物因为在所讨论的病理状况中有效而为人所知。因此,从业者一方面努力确定那些对某些治疗有响应的患者以及对这些治疗有耐受性的那些患者,另一方面努力制定策略,使得在那些对常规治疗响应不足的患者中有可能获得抗癌产品的增强效果。本发明的目的是满足这种增强现有治疗的需要,特别是在那些对这些治疗具有耐受性的患者中。bcl-2家族的分子“化学疗法”治疗基于施用化学分子来诱导患者中所存癌细胞的细胞凋亡。细胞凋亡,也称为“程序性细胞死亡”,在许多正常和病理生物过程中起关键作用。细胞凋亡的两个主要通路是不同的,内在的线粒体通路和由特异性细胞外信号激活的外在通路。bcl-2家族的蛋白是线粒体细胞凋亡的主要调节因子。bcl-2家族蛋白的成员和存在一个或多个肽序列结构域有关,所述肽序列和最初鉴定为bh结构域(bcl-2同源性结构域)的蛋白同源。bcl-2家族的蛋白可以通过促进(促细胞凋亡)或通过抑制(抗细胞凋亡)程序性细胞死亡来调节细胞凋亡。这个蛋白家族分为三个亚组:-促细胞凋亡效应蛋白,如bax和bak,其一旦被细胞信号激活,便插入线粒体外膜以引起细胞色素c的释放,从而诱导细胞凋亡。-抗细胞凋亡蛋白,如bcl-2、bcl-xl、mcl-1、bcl-2a1、bcl-w和bcl-b/bcl-2l10,它们通过与促细胞凋亡蛋白直接相互作用而将其中和来抑制细胞凋亡。由抗细胞凋亡蛋白的结构域bh3、bh1和bh2形成的疏水相互作用袋能够使bh3结构域与bax和bak蛋白结合,从而导致它们的中和。这些蛋白还具有参与钙流调节的第四结构域bh4。-仅含bh3的蛋白,其仅含有单一同源结构域bh3。这些仅含bh3的蛋白结合在抗细胞凋亡蛋白的疏水袋中,阻止它们中和bax和bak。一些疗法使用与仅含bh3的bh3类似的化学结构来抑制抗细胞凋亡bcl-2蛋白并诱导细胞死亡。这些分子被称为bh3模拟物(besbes等人2015)。bcl-2家族的蛋白调节细胞凋亡,特别是通过促进或抑制线粒体外膜对细胞色素c的渗透性。细胞色素c释放到胞质中后导致半胱天冬酶(半胱氨酸-天冬氨酸蛋白酶)的激活,所述蛋白酶负责许多细胞蛋白的酶促裂解,从而诱导细胞死亡。其它刺激也可能引发细胞色素c的释放,例如钙从内质网大量流入胞质,然后是线粒体。在肿瘤发生过程中,通常观察到抗细胞凋亡蛋白的过表达,这使肿瘤细胞逃避生物体的内源性控制以及旨在诱导其细胞死亡的药物。由bcl-2家族控制的生物过程的重要性使它们成为热门研究的蛋白家族。然而,在抗细胞凋亡组中,其中一些的功能仍然知之甚少;对于基因bcl2-l10/bcl-b/nrh的产物尤其如此。bcl-2l10基因bcl-2l10在进化上是保守的,特别是在脊椎动物中(arnaud等人,2006)。在人中,正常成人组织中bcl-2l10的表达局限于卵母细胞、卵巢和b淋巴细胞。在小鼠中,其敲除不会产生可观察到的表型。在斑马鱼中,在发育的早期阶段观察到其表达。在该动物模型中,其中基因bcl-2l10被称为nrz,该基因是胚胎发育必不可少的,其敲除导致致死表型。已经表明,蛋白nrz能够通过在内质网与ip3r1、肌醇1,4,5-三磷酸(ip3)-敏感型钙通道相互作用来调节细胞中的钙运输(popgeorgiev等人2011)。蛋白bcl-2l10/nrz能够通过其bh4结构域与负责结合受体ip3r1(ip3bd)的配体ip3的结构域相互作用。已证明重组蛋白nrz能够抑制ip3与受体ip3r1的结合。bh4结构域是与受体ip3r1相互作用所必需的,但不足以单独通过ip3r1抑制ca2+的释放(bonneau等人2014)。在人的疾病背景下,基因bcl-2l10的表达与乳腺、前列腺和肺肿瘤、急性髓性白血病和骨髓增生异常综合征的预后不良相关(krajewska等人2008;cluzeau等人2012)。因此,基因bcl-2l10被认为是这些基于肿瘤的病理状况预后不良的标志物。检测由该基因产生的蛋白作为造血系统肿瘤中阿扎胞苷耐受性的诊断试验是专利申请(wo2013/128089a1)的主题。ip3r受体bcl-2家族的不同蛋白能够阻止程序性细胞死亡过程,特别是通过钙流的负调节。钙(ca2+)是一种通用的细胞内信使,从细胞外和细胞内的ca2+来源,通过高度发达的信号传导网络可调节非常多样的细胞活动,如细胞死亡或分化。肌醇1,4,5-三磷酸酯受体(下文称为“ip3r”)是位于内质网膜上的四聚体钙通道,存在于所有细胞中。响应尤其由酪氨酸激酶受体和g-蛋白偶联质膜受体诱导的大量信号,这些通道控制钙从该区室释放到胞质,负责ip3(激活ip3r的配体)浓度的变化。已经鉴定了三种类型的ip3r受体,并且表示为ip3r1、ip3r2和ip3r3。这些大的受体,包含超过2500个氨基酸,被分成几个结构域(参见图1)。蛋白bcl-2通过其bh4结构域在mtdii结构域(rong等人2008)和c端部分(monaco等人2012)与受体ip3r1相互作用。仅bh4结构域的存在足以阻断ip3r受体释放钙(rong等人2009)。这尤其通过使用20个氨基酸的肽来证明,该肽模拟ip3r1中心部分的结合结构域(氨基酸1389-1408),其与bcl-2的bh4结构域相互作用从而阻断其生物活性。利用这种肽,已经证明有可能抑制bcl-2蛋白在调节钙流中的作用,从而促进和/或诱导不同类型肿瘤细胞的细胞凋亡(zong等人2011;lavik等人2015)。已经提出使用该肽作为药物,特别是用于治疗以bcl-2的细胞表达为特征的癌症的药物(wo2012/031103)。该策略具有不是非常特异的缺点,因为bcl-2家族的许多蛋白能够与这种模拟ip3r1中心结构域的肽相互作用,从而被中和。特别地,已经显示蛋白bcl-xl也使用该结合位点(monaco等人2012(1))。然而,这种蛋白的作用涉及由bcl-2介导的不同的生物学机制(monaco等人2012(2))。此外,使用这种能潜在地非特异性中和其它信号传导通路的衍生自ip3r1的肽,能够诱导显著的副作用。尽管bcl2-l10参与肿瘤发生及其作为诊断工具的作用,bcl2-l10编码的蛋白的功能仍然知之甚少,而且还没有找到特异性抑制和靶向这种促进肿瘤细胞的存活的蛋白活性的解决方案,包括当患者接受基于化疗化合物的治疗时。正在积极寻找当蛋白bcl-2l10与ip3r受体结合时,有可能阻断蛋白bcl-2l10的生物学功能、从而阻止由化疗治疗所引发的钙流入胞质的化合物,以加强化疗治疗的效果。有利地,这些化合物必须具有几个特征:防止bcl-2l10与ip3r受体结合,但不抑制配体ip3与其受体的结合;不抑制bcl-2l10的其它生物学功能;并且不抑制bcl-2家族的其它蛋白。本发明提供了满足这些要求的化合物。技术实现要素:本发明涉及一种蛋白bcl-2l10与至少一种ip3r受体的ip3配体结合结构域结合的竞争性抑制剂,其用于治疗癌症,所述癌症的细胞表达蛋白bcl-2l10。本发明最特别涉及一种抑制剂,其用于治疗所述癌症,所述抑制剂包含肽结构域,其序列与序列seqidno.1[rertelllady]具有至少80%的同一性,下划线的精氨酸和酪氨酸残基是保守的。根据本发明的一个具体方面,该抑制剂与至少一种第二活性剂和/或用于治疗癌症的任何常规方法组合施用,特别是与至少一种用于治疗癌症的化疗产品组合施用,所述癌症的细胞表达蛋白bcl-2l10。本发明还涉及一种蛋白bcl-2l10与至少一种ip3r受体的ip3配体结合结构域结合的竞争性抑制剂,其是根据以下结构而构建的:[adr]x-[esp]y-[dom]-[sadr]z,其中:·adr是靶向化合物,·esp是间隔序列,·dom是权利要求2或3中限定的肽结构域,·sadr表示特异性细胞内靶向肽结构域,其中x、y和z彼此独立地等于0或1,并且总和(x+y+z)等于或大于1。本发明还涉及药物组合物,其在药学上可接受的介质中包含至少一种上述蛋白bcl-2l10与至少一种ip3r受体的ip3配体结合结构域结合的竞争性抑制剂。附图说明图1:人ip3受体类型1(hip3r1)的一级结构图,分为七个功能结构域:sd(抑制结构域)、ip3bd(ip3配体结合结构域)、mtd(调节和转导结构域)、cfd(通道形成结构域)和cd(偶联结构域)。蛋白bcl-2和bcl-xl与结构域mtdii和偶联结构域相互作用。蛋白nrh与ip3结合结构域(ip3bd)相互作用。之前已经描述了与该受体结合的肽,但是其具有不同的结合位点,如图所示。图2:来自乳癌细胞mda-mb-231获得的总、线粒体(mito)或内质网(er)级分、或100000g离心后可溶级分(s100)的内源性蛋白nrh的免疫印迹。蛋白纽蛋白(vinculin)、钙联接蛋白(calnexin)和f0f1用作对照。图3:mda-mb-231细胞在36小时内响应10μm毒胡萝卜素(thg)的细胞凋亡动力学(半胱天冬酶3和7的活性),所述mda-mb-231细胞转染有针对nrh(si3-nrh和si6-nrh)的sirna或对照sirna(siscr)。用dmso孵育作为与毒胡萝卜素孵育的阴性对照。图4:(a)由基因nrh和靶向不同细胞区室产生的构建体的图:线粒体(nrh-acta,其具有线粒体靶向结构域,来源于单核细胞增生李斯特菌(l.monocytogene)的acta蛋白)、内质网(nrh-cb5,具有源自人细胞色素b5蛋白的网状靶向结构域)、膜(nrh-dtm及其c端膜靶向结构域)、或没有其n端bh4结构域的nrh(nrh-dbh4)。(b)hela细胞响应10μm毒胡萝卜素24小时的细胞凋亡测试(sr-flica),所述hela细胞转染有空载体pcs2+或编码nrh-wt(野生型)、nrh-acta、nrh-cb5、nrh-dtm或nrh-dbh4的构建体(n=3)。***,p<0.001;**,p<0.01;n.s.p>0.1(学生t-检验)。图5:(a)肽nrh1-23和点突变体的图,构建自nrh的bh4结构域,与靶向序列cb5融合。(b)通过免疫沉淀实验,在hela细胞中用抗ha抗体定量nrh-ip3r1相互作用(n=3),所述hela细胞以1:2比例转染有编码flag-nrh、ha-hbd和肽nrh1-23不同点突变体的质粒。(c)hela细胞中响应10μm毒胡萝卜素24小时的细胞凋亡测试(sr-flica),所述hela细胞转染有空载体pcs2+、或编码肽nrh1-23、nrh1-23y16f或nrh1-23c20a的构建体(n=3)。***,p<0.001;**,p<0.01;n.s.p>0.1(学生t-检验)。图6:(a)hela细胞中的链霉亲和素拉下实验(pull-down),所述hela细胞转染有空载体pcs2+、flag-nrh、ha-hbd或ha-becn1,其细胞提取物与或不与5μg生物素标记的nrh1-23肽一起孵育。nrh1-23能够与nrh相互作用,但不能与ha-hbd或ha-becn1相互作用。(b)hela细胞中的链霉亲和素拉下实验,所述hela细胞转染有空载体pcs2+、flag-nrh或flag-nrz,其细胞提取物与5μg生物素标记的nrh1-23肽或nrh1-23r6ay16f双突变体肽一起孵育。nrh1-23能够与nrh相互作用,但不能与nrz相互作用,从而表现出物种特异性。图7:用抗ha抗体通过共免疫沉淀,定量flag-nrh和ha-nrh之间的相互作用。结果显示nrh同二聚体形成。在本发明的nrh1-23肽存在下可以防止nrh二聚体,但不能在nrh1-23y16f存在下防止。图8:源自不同nrh蛋白直系同源物的bh4结构域的氨基酸序列的比对:来自nrz的bh4结构域(斑马鱼(daniorerio),seqidno.19)、来自nr-13的bh4结构域(鸡(gallusgallus),seqidno.20)、来自小鼠bcl-2l10的bh4结构域(小鼠(musmusculus),seqidno.21)、来自人bcl-2l10的bh4结构域(nrh,seqidno.22)、来自人bcl-2的bh4结构域(seqidno.23)、来自人bcl-xl的bh4结构域(seqidno.24)、来自人bcl-a1的bh4结构域(seqidno.25)、和来自人bcl-w的bh4结构域(seqidno.26)。nrh/ip3r1相互作用的关键氨基酸用箭头表示。图9:(a)合成肽nrh1-23和nrh1-23y16f的序列通过间隔序列(接头)与tat内化结构域融合并在n端与荧光团(fitc)偶联。(b)图9a中描述的肽tat-nrh1-23和tat-nrh1-23y16f的圆二色谱,以20%三氟乙醇中80μm浓度溶于[h2o-0.1%三氟乙酸],显示每种肽的α螺旋结构的特征性标志。图10:(a)邻近连接分析(pla)实验,其允许检测mda-mb-231细胞中内源性蛋白nrh和ip3r1之间的相互作用。(b)在肽tat-nrh1-23或tat-nrh1-23y16f孵育的mda-mb-231细胞中,旨在破坏含有不同肽的内体的闪光(λ488nm)或不闪光(对照)后,响应36小时10μm毒胡萝卜素的细胞凋亡(sr-flica)测试(n=3),***,p<0.001;**,p<0.01;n.s.p>0.1(学生t检验)。作为阴性对照,将细胞与dmso一起孵育。图11:(a)dtat-合成肽(nrh1-23c20a和nrh1-23c20ay16f)的表示,其序列由seqidno.27和no.28所示。两种dtat肽都具有tmr(四甲基罗丹明)荧光基团,其接枝到位置编号2的赖氨酸侧链上用于追踪目的。(b)在10μm对照肽(dtat1-23c20ay16f)或10μm肽(dtat1-23c20a)预孵育的、用编码flag-nrh或ha-hbdip3r1的质粒转染的hela细胞中,通过共免疫沉淀评估flag-nrh和ha-hbdip3r1之间的相互作用。在该实验中,dtat-nrh1-23c20a而非dtat1-23c20ay16f破坏nrh/ip3r1复合物。图12:(a)将mda-mb-231细胞注射到scid小鼠的乳腺脂肪垫中。当肿瘤达到约90mm3的平均体积时,用10mg/kg的dtat1-23c20a肽以肿瘤周围注射每三天一次、或以相同注射周期仅用载体(pbs)处理小鼠。使用卡尺每周两次测量肿瘤体积(平均值±sem;每个条件n=9只小鼠;**,p<0.01),显示dtat1-23c20a肽在肿瘤生长中的显著作用。(b)在(a)中显示的实验过程中测量小鼠的体重(平均值±sem;每种条件下n=9只小鼠)。图13:由bcl-2l10/nrh控制的钙流和细胞凋亡的图。nrh能够通过ip3受体阻止细胞毒性钙从er转移到线粒体,否则会在线粒体中引发细胞死亡。nrh1-23肽能够与nrh直接相互作用,并抑制其细胞保护活性,从而使表达nrh的肿瘤细胞对细胞死亡敏感。具体实施方式本发明涉及蛋白bcl-2l10与至少一种ip3r受体的ip3配体结合结构域(“bd结构域”)结合的竞争性抑制剂,其用于治疗癌症,其中癌症细胞表达蛋白bcl-2l10。图13示意性地显示了蛋白bcl-2l10/nrh在胞质钙流和细胞凋亡过程中的作用。在没有bcl-2l10/nrh的情况下,局部胞质钙量的增加导致通过vdac(电压依赖性阴离子通道)和mcu(线粒体钙单向转运体)通道将钙输入线粒体。在钙过量的情况下,线粒体外膜可能破裂,然后观察到细胞色素c的释放。细胞色素c触发apaf-1/caspase-9复合物的激活,其将通过细胞凋亡不可逆地导致细胞死亡。在进行旨在诱导所述细胞凋亡的处理的肿瘤细胞中,当蛋白bcl-2l10存在时,其bh4结构域与受体ip3r1相互作用以负调节钙信号传导。在竞争性抑制剂存在的情况下(该抑制剂使bcl-2l10和ip3r之间的相互作用不稳定),此后称为“肽nrh1-23”,蛋白bcl-2l10不再能够与ip3r1结合,并因此重新建立局部胞质的钙量,细胞也可以正常地响应治疗,从而起始细胞凋亡过程。ip3r受体脊椎动物中描述了三种类型的ip3r受体:每种类型ip3r1、ip3r2和ip3r3的蛋白序列与其同源物在全序列上具有60%至80%的同一性,但这个同一性百分比在特定区域高得多,该特定区域例如配体ip3的结合口袋和限定钙离子流通的通道的结构域。genbank数据库列出了人中鉴定的以下序列:-肌醇1,4,5-三磷酸酯1型受体/同种型1,登录号:np_001093422.2,2710个氨基酸;-肌醇1,4,5-三磷酸酯1型受体/同种型2,登录号:np_002213.5,2695个氨基酸;-肌醇1,4,5-三磷酸酯1型受体/同种型3,登录号:np_001161744.1,2743个氨基酸;-肌醇1,4,5-三磷酸酯2型受体,登录号:np_002214.2,2701个氨基酸;-肌醇1,4,5-三磷酸酯3型受体,登录号:np_002215.2,2671个氨基酸。虽然三种类型对配体ip3具有可变的亲和力,它们具有相同的生物学功能并且基本上通过不同的组织表达来区分(mikoshiba,2007)。在本发明中,通用术语“ip3r”用于表示类型ip3r1、ip3r2和ip3r3中的至少一种。因此,不加区分地使用表述“结合至少一种类型的ip3r受体”、“结合ip3r受体”和“结合ip3r受体之一”,并表示相同的相互作用。在本发明具体实施方案中,蛋白bcl-2l10与至少一种ip3r受体结合的竞争性抑制剂仅作用于ip3r1和/或ip3r3的ip3配体结合结构域。根据本发明的一个具体实施方案,抑制与bcl-2l10结合的ip3r受体类型是人蛋白,更具体地是蛋白hip3r1的同种型之一,其结构在图1中表示。ip3配体结合结构域已被广泛研究。“结合结构域”也被称为“bd结构域”,如图1所示。它位于n端区域,由人蛋白中残基226延伸至残基565的部分组成(yoshikawa等人1996)。在本发明的上下文中,术语“蛋白bcl-2l10与至少一种ip3r受体类型的ip3配体结合结构域结合的竞争性抑制剂”意指能够完全或部分抑制或使bcl-2l10与至少一种ip3r受体类型之间的这种结合不稳定的化合物。所述抑制剂可能能够结合bcl-2l10和/或至少一种ip3r的bd结构域。表述“蛋白bcl-2l10与ip3r受体结合的竞争性抑制剂”、“bcl-2l10/ip3r受体结合的竞争性抑制剂”和“本发明的抑制剂”在本申请中用于表示蛋白bcl-2l10与至少一种ip3r受体类型的ip3配体结合结构域结合的竞争性抑制剂。术语“竞争性抑制剂”说明的事实是指抑制剂:-能够结合ip3配体结合结构域,即ip3r的bd结构域(参见图1),从而与蛋白bcl-2l10竞争,该蛋白bcl-2l10的bh4结构域与ip3r受体的这个区域相互作用,从而抑制bcl-2l10/ip3r结合;或者-能够结合蛋白bcl-2l10,从而与ip3r的bd结构域竞争,或抑制蛋白bcl-2l10的二聚化。bcl-2l10/ip3r结合可根据本领域技术人员熟知的各种技术进行定量,尤其是根据实施例4中描述的技术,通过用特异性抗体进行免疫沉淀实验(图5b)。该bcl-2l10/ip3r结合也可通过称为“tr-fret”(时间分辨荧光共振能量转移)的实验、荧光偏振实验、spr(表面等离子体共振)或bli(生物层干涉测量法)来定量。本发明人还表明,这种bcl-2l10/ip3r结合可以通过pla技术在固定细胞或组织上原位定量(邻近连接分析,图10a)。抑制bcl-2l10/ip3r结合的特征在于所述bcl-2l10/ip3r结合的定量减少。根据本发明的具体方面,相对于通常在所讨论细胞中观察到的数值结合值,bcl-2l10与ip3r受体之一的结合减少为至少30%。特别是,bcl-2l10/ip3r结合的减少可能至少为40%、50%、60%、70%、80%、90%、95%、或甚至100%,也就是说完全没有观察到bcl-2l10和ip3r之间的相互作用。根据本发明的一个具体方面,蛋白bcl-2l10和至少一种ip3r受体的配体结合结构域结合的竞争性抑制剂特征在于对应于所述bcl-2l10/ip3r结合的定量抑制的其功能是至少60%、或甚至至少80%,例如根据实施例4描述方法所评估的。bcl-2l10蛋白在本发明的含义内,术语“bcl-2l10蛋白”表示被鉴定为人“bcl-2-样10”蛋白同种型或同源物的任何蛋白,“bcl-2-样10”蛋白在genbank中登录号为aag00503.1,具有204个氨基酸的序列。在本申请中该名称bcl-2l10和用于相同蛋白的其它名称bcl2-b或nrh不加区别地进行使用。蛋白bcl-2l10的序列在哺乳动物物种之间是非常保守的。为简化起见,氨基酸编号始于第二个甲硫氨酸残基,因此在genbank中登记的序列号aag00503(对应于bcl-2l10基因最常表达的同种型)上始于第10位。斑马鱼蛋白和人蛋白的bh4结构域的比对尤其使得可以确定第6位的精氨酸和第16位的酪氨酸是保守的(参见图8)。如上所述,该蛋白有许多作用,其中一些仍未知。因此,鉴于由于完全没有该蛋白表达而可能产生的潜在负面影响,旨在完全消除该蛋白表达的治疗策略可能是危险的。本发明特别涉及一种竞争性抑制剂,其阻止bcl-2l10蛋白与ip3r受体结合,并且仅阻断bcl-2l10对该受体的作用。包含肽结构域的竞争性抑制剂一种旨在使bcl-2l10/ip3r键不稳定的竞争性抑制剂,用于治疗其细胞表达蛋白bcl-2l10的癌症,所述竞争性抑制剂可以是多种形式。特别地,所述抑制剂是蛋白分子,尤其是嵌合肽的形式,或者是核酸形式,例如核酸适体,其特异性结合(i)至少一种类型ip3r的bd结构域或(ii)bcl-2l10。特别地,用于根据本发明用途的蛋白bcl-2l10与ip3r受体结合的这种竞争性抑制剂包含肽结构域。更特别地,用于根据本发明用途的蛋白bcl-2l10与ip3r受体结合的竞争性抑制剂包含肽结构域,其序列与序列seqidno.1[rertelllady]具有至少80%的同一性,下划线的精氨酸和酪氨酸残基是保守的。本发明人已经证明,这种抑制剂可以特异性地抑制bcl-2l10对ip3r钙通道开放的作用,从而消除钙释放至胞质的抑制。在本发明的含义中,表述“该序列与序列seqidno.1具有至少80%的同一性”表示肽结构域的序列与所述参考序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的氨基酸同一性。为了确定两个氨基酸序列的同一性百分比,将进行序列比对以实现最佳比较。可以将空缺(缺口)引入待比对序列中的一个或另一个中,以便实现最佳比对。可以如d.voet和j.g.voet的书biochimie[biochemistry]中所述(第2版,deboeck&larcier,2005第7.4节b段),获得待比较的两个氨基酸序列的同一性百分比。可以通过比较算法确定该同一性,例如needleman-wunsch或smith-waterman的全局比对算法。可以尤其通过clustalw或blastp软件,根据默认参数或本领域技术人员的调整进行比对。在一个具体实施方案中,用于根据本发明用途的竞争性抑制剂包含肽结构域,其序列与序列seqidno.2[madplrertellladylgycare]或序列seqidno.3[adplrertellladylgycare]具有至少80%的同一性,下划线的精氨酸和酪氨酸残基是保守的。在本发明的含义中,表述“该序列与序列seqidno.2或3具有至少80%的同一性”表示肽结构域序列与所述参考序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸同一性。在本申请的实施例中,由该序列seqidno.2组成的肽表示为术语“nrh1-23”并且对应于人bcl-2l10蛋白的bh4结构域。该术语“nrh1-23”也可以表示由序列seqidno.3(除了第一位置的甲硫氨酸外,与seqidno.2相同)组成的肽,其是任选的,如本领域技术人员所熟知。这是因为作为第一个氨基酸的甲硫氨酸存在或不存在不会改变肽的功能。产生各种肽构建体以确定该抑制剂与ip3r受体bd结构域的竞争性结合所必需的氨基酸。在本申请的实施例中研究的各种序列在下表1中列出:表1因此,用于根据本发明用途的竞争性抑制剂优选包含肽结构域,其序列与序列seqidno.1或序列seqidno.2或序列seqidno.3或序列seqidno.8具有至少80%的同一性,优选至少90%的同一性,下划线的精氨酸和酪氨酸残基是保守的。根据本发明的一个实施方案,竞争性抑制剂包含这样的肽结构域,其序列具有所需的同一性百分比,由10至50个氨基酸组成,优选11至40个氨基酸,更优选20至30个氨基酸,最优选长度为22至28个氨基酸,上述极限值包括在该范围内。根据本发明的一个实施方案,竞争性抑制剂包含含有50个氨基酸或更少氨基酸的肽结构域。可以考虑与seqidno.1所示序列具有至少80%同一性的这种肽结构域的几个序列。实际上,对于长度为11个氨基酸的两个肽结构域,在两个序列中只要9个氨基酸是相同的,这两个肽序列之间的同一性百分比则是81.81%同一性。可以提及下表2中的实例,该列表当然是非限制性的,肽结构域与序列seqidno.1具有至少80%的同一性,其中x代表选自20种已知氨基酸的任何氨基酸:表2seq号序列seqidno.9rertellxxdyseqidno.10rertxxlladyseqidno.11rextelllaxy根据本发明的一个具体方面,用于治疗其细胞表达bcl-2l10的癌症的所述竞争性抑制剂包含肽结构域,所述肽结构域的序列由选自以下之一的序列组成:序列seqidno.1、seqidno.2、seqidno.3、seqidno.7、seqidno.8、seqidno.9、seqidno.10或seqidno.11。根据本发明的另一个实施方案,用于治疗其细胞表达bcl-2l10的癌症的所述竞争性抑制剂包含肽结构域,所述肽结构域的序列由以下之一的序列组成:seqidno.1、seqidno.2、seqidno.3、seqidno.7、seqidno.8、seqidno.9、seqidno.10或seqidno.11。根据该实施方案,这种肽形式的竞争性抑制剂将能够通过化学合成直接产生,或者通过细胞机构从包含编码上述肽序列之一的核酸序列的质粒或载体在细胞内合成。通过常规转染、注射或病毒感染技术将所述质粒或载体预先引入细胞中。有利地,细胞内合成的肽将与特定的靶向序列融合,如下所示。bcl-2l10的同型二聚化本发明人观察到可以通过与nrh1-23肽(seqidno.2或3)孵育来防止bcl-2l10同型二聚化。该结果在实施例5和图7中给出。根据一个具体实施方案,用于根据本发明用途的抑制剂进一步抑制bcl-2l10的同型二聚化。根据另一个实施方案,本发明涉及bcl-2l10同型二聚化的抑制剂,其用于治疗细胞表达蛋白bcl-2l10的癌症。为了鉴定能够抑制bcl-2l10二聚化的化合物,本领域技术人员可以使用如实施例5中所述的实验。能够抑制bcl-2l10二聚化的所述化合物,优选地选自本申请中描述的化合物,特别是包含肽结构域的那些,优选包含序列与序列seqidno.1[rertelllady]具有至少80%同一性的肽结构域,下划线的精氨酸和酪氨酸残基是保守的。根据本发明的一个具体方面,用于治疗其细胞表达bcl-2l10的癌症的所述bcl-2l10同型二聚化抑制剂包含肽结构域,所述肽结构域的序列由选自以下之一的序列组成:序列seqidno.1、seqidno.2、seqidno.3、seqidno.7、seqidno.8、seqidno.9、seqidno.10或seqidno.11。根据本发明的另一个实施方案,用于治疗其细胞表达bcl-2l10的癌症的所述bcl-2l10同型二聚化抑制剂包含肽结构域,所述肽结构域的序列由以下之一的序列组成:seqidno.1、seqidno.2、seqidno.3、seqidno.7、seqidno.8、seqidno.9、seqidno.10或seqidno.11。抑制剂的结构以促进其通过细胞膜如上所述,ip3r受体位于内质网的膜中。因此,竞争性抑制剂必须能够到达所述膜以结合ip3r受体。因此,当施用至人时(例如通过血液),对于用于治疗细胞表达蛋白bcl-2l10的癌症的所述竞争性抑制剂而言,可以穿过细胞膜而存在于胞质中(在胞质中它可以附着在ip3r受体上)是重要的。细胞膜对于亲水性分子(如,肽)是不可穿透的。肽进入活细胞、以及它们进入各种细胞内区室,特别是胞质区室的问题,对于它们的治疗用途是非常重要的。为了促进肽通过生物膜的转运,主要使用三种技术:-使用与肽同时施用的化合物,其存在促进肽通过细胞膜转运;或者-使用用于包封肽的结构,例如脂质体或聚合物;或者-使用融合在肽n端或c端的靶向化合物,以促进其通过细胞膜和/或引导至特定的细胞结构。这三种技术可以相互独立使用,也可以同时使用。使用包封结构可以保护肽免受酶促降解以及亲水肽通过疏水屏障,是本领域技术人员公知的。脂质体是由脂质层组成的囊泡结构,使得可以将亲水性化合物包封在脂质中。脂质体越来越多地作为药物载体用于人的治疗。用于包封亲水性活性化合物(肽)的最常用聚合物是乳酸和乙醇酸(plga,pla)、乙基纤维素和聚(ε-己内酯)的衍生物,其是可以生物降解的。靶向化合物靶向化合物(下文称为[adr])可以是肽或非肽分子,其与具有竞争性抑制剂功能的肽结构域融合。融合至感兴趣肽的靶向化合物尤其可以是促进和/或介导所述肽从细胞外部向其内部转运的任何氨基酸序列。这些序列是本领域技术人员已知的。它们通常由2至20个氨基酸组成。可以根据所述细胞的细胞类型选择能够使所述肽穿透到细胞中的所述序列,以优化穿透效率。在这些靶向化合物中,尤其可以提及衍生自逆转录病毒hiv的tat蛋白的肽以及同源结构域型肽,其中所述衍生自逆转录病毒hiv的tat蛋白的肽具有如seqidno.12(rkkrrqrrr)所示的序列,由seqidno.13(rqikiwfqnrrmkwkk)所示的序列组成的穿透肽(penetratin),该序列称为“x7/11r序列”,表示含有7至11个精氨酸残基(7/11r)的7至20个氨基酸的任何肽序列,其中精氨酸残基随机置于所述序列中。也可以提及特异性靶向化合物,例如单核细胞增生李斯特菌(l.monocytogene)的线粒体靶向结构域acta,或者源自人细胞色素b5蛋白的内质网靶向结构域cb5。根据优选的实施方案,能够使所述竞争性抑制剂穿透到细胞中的靶向化合物是衍生自序列seqidno.12的hiv-tat的肽。根据本发明的一个具体实施方案,与肽融合的hiv-tat靶向结构域可以二聚化,以增加细胞内肽的生物利用度,如国际申请wo2015/038662中所述。根据本发明的另一个具体实施方案,hiv-tat靶向结构域之前可以有两个氨基酸“ck”(即半胱氨酸和赖氨酸),其存在增加hiv-tat结构域在氧化条件下的二聚化。二聚化的tat具有增强的内体逃逸特性,其允许肽有效进入细胞,而不利用外部物理剂(如光)。本发明的竞争性抑制剂的结构根据本发明,用于治疗其细胞表达bcl-2l10的癌症的竞争性抑制剂可以由彼此偶联的几个肽或非肽结构域组成。特别地,根据以下结构构建竞争性抑制剂:[adr]x-[esp]y-[dom]-[sadr]z,其中:·adr表示靶向化合物,·esp表示间隔序列,·dom是上述限定的肽结构域,·以及,sadr表示特异性细胞内靶向结构域,其中x、y和z彼此独立地等于0或1,并且总和(x+y+z)等于或大于1。靶向化合物特别是上述化合物之一。在一个实施方案中,靶向化合物是hiv-tat靶向结构域,其前面带有两个氨基酸“ck”。为了获得肽的有效二聚化,优选肽的序列不包含任何半胱氨酸残基。因此,根据本发明的一个优选实施方案,当hiv-tat靶向结构域之前有两个氨基酸“ck”时,肽结构域dom不包含半胱氨酸残基。在本发明更优选的实施方案中,当hiv-tat靶向结构域之前有两个氨基酸“ck”时,肽结构域dom包含序列seqidno.8。间隔序列,也称为分子间隔序列,表示确保两个分子部分之间结合的区段。在本发明的含义内,这是用于隔开活性肽结构域和靶向序列的结构域,由于其疏水性可能对活性肽结构域的功能产生不利影响。该间隔序列,也称为“接头”或“连接部分”,可以是肽或非肽分子。如果它是肽,则在大小方面其长度至少为3个氨基酸且至多50个氨基酸长。间隔序列肽的大小优选为5至30个氨基酸长,最优选为5至20个氨基酸长。间隔序列一般分为三类:柔性间隔序列、刚性间隔序列和体内可裂解的间隔序列。在(chen等人2013)的综述中列出的所有间隔序列都能够用于根据本发明的竞争性抑制剂的结构中。位于活性肽结构域和靶向序列之间的该间隔序列通过必须足够稳定的键得以维持,以在穿过胞质膜和被内体捕获的整个过程中以保持分子的整个结构[adr]x-[esp]y-[dom]-[sadr]z。随后,不再需要键,并且可以在间隔序列处裂解分子。根据本发明的一个实施方案,间隔序列属于体内可裂解的间隔序列,并且在细胞内裂解结构[adr]x-[esp]y-[dom]-[sadr]z。根据本发明的另一个实施方案,间隔序列是柔性类型并且由甘氨酸和丝氨酸残基组成。下面给出的实施例描述了结构[adr]x-[esp]y-[dom]-[sadr]z的竞争性抑制剂,其中y=1,其包含seqidno.14(ggsgg)所示的序列的柔性间隔序列。表3中列出了上述不同的序列:表3根据本发明的一个具体方面,间隔序列的氨基酸序列也是用于检测或纯化肽的标志物。例如,间隔序列肽可以由肽“hatag”组成。根据本发明的具体方面,竞争性抑制剂根据以下结构构建:[adr]x-[esp]y-[dom]-[sadr]z,其中:·adr表示靶向化合物,·esp表示间隔序列,·dom是肽结构域,其具有选自以下之一的序列:seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.7、seqidno.8、seqidno.9、seqidno.10和seqidno.11,·sadr表示特异性细胞内靶向肽结构域,·以及,其中x、y和z等于1。根据本发明的一个具体方面,根据以下结构构建竞争性抑制剂:[adr]x-[esp]y-[dom]-[sadr]z,其中:·adr表示靶向化合物,·esp表示间隔序列,·dom是肽结构域,其具有以下之一的序列:seqidno.2或no.3或no.8,·sadr表示特异性细胞内靶向肽结构域,·以及,其中x、y和z等于1。根据本发明的另一个具体方面,根据以下结构构建竞争性抑制剂:[adr]x-[esp]y-[dom]-[sadr]z,其中adr表示由源自tat-hiv的肽(序列seqidno.12)组成的靶向化合物,其中x等于1。根据本发明的另一个具体方面,根据以下结构构建竞争性抑制剂:[adr]x-[esp]y-[dom]-[sadr]z,其中esp表示序列seqidno.14所示的间隔序列,其中y等于1。根据本发明的另一个具体方面,根据以下结构构建竞争性抑制剂:[adr]x-[esp]y-[dom]-[sadr]z,其中esp表示序列seqidno.14所示的间隔序列,其中z等于1。用于根据本发明用途的竞争性抑制剂可以仅由肽结构域组成,并且尤其是特征在于结构域adr、esp和sadr是肽结构域。下表4表示用于根据本发明用途的肽的具体序列。表4用于根据本发明用途的竞争性抑制剂可包含至少一个肽,其具有seqidno.4、18或27任一个所示的肽序列。根据本发明的另一个优选方面,用于根据本发明用途的竞争性抑制剂由具有seqidno:4所示肽序列的肽组成。根据本发明的另一个优选方面,用于根据本发明用途的竞争性抑制剂由具有seqidno.18所示肽序列的肽组成。根据本发明的另一个优选方面,用于根据本发明用途的竞争性抑制剂由具有seqidno.27所示肽序列的肽组成。通常,本申请涉及蛋白bcl-2l10与至少一种ip3r受体的配体结合结构域结合的竞争性抑制剂,用作药物。实际上,发明人已经证明了这种竞争性抑制剂的治疗效果,其阻止bcl-2l10蛋白与ip3r受体结合,从而消除了bcl-2l10对ip3r受体的钙通道开放的抑制作用。通过使ip3r受体不依赖于bcl-2l10的存在,使得它对其它信号再次变得敏感,特别是对其配体ip3浓度的变化。因此,竞争性抑制剂可用作用于各种治疗应用的药物,尤其是直接或间接和ip3受体的功能和/或调节有关的病理情况。这种药物主要旨在用于人,但也可用于脊椎动物,特别是哺乳动物。在其作为药物的用途中,应理解施用的竞争性抑制剂的量可随所讨论的患者重量和所需效果、以及根据治疗频率调整的剂量而变化。这些剂量是本领域技术人员公知的,并且能够使用他们的一般知识容易地由他们确定。用于根据本发明用途的竞争性抑制剂可以通过任何合适的途径施用,例如口服、舌下、直肠、肠胃外、腹膜内、皮内、透皮、气管内、局部或眼部施用。可以通过注射进行施用,例如腹膜内、皮内、皮下、静脉内或肌肉内。也可以使用任何粘膜途径,例如泌尿生殖系统、肛门直肠系统、呼吸系统、颊鼻系统(bucconasal)、舌下途径或其组合。根据本发明的竞争性抑制剂用作治疗癌症的药物,所述癌症的细胞表达蛋白bcl-2l10。“治疗癌症”意指使所有癌细胞特别是原始肿瘤从患者身体中减少甚至完全消失。在本发明的意义中,表述“癌症,其细胞表达蛋白bcl-2l10”涵盖了许多癌症类型,尤其是乳癌、前列腺癌和肺癌以及造血系统肿瘤,如急性髓性白血病和骨髓增生异常综合征。根据本发明的一个具体方面,用于治疗癌症(其细胞表达蛋白bcl-2l10)的竞争性抑制剂与至少第二活性剂和/或任何治疗癌症的常规方法组合施用。特别地,所述第二活性剂是化疗产品或免疫疗法产品。在一个实施方案中,所述治疗癌症的常规方法是手术或放射疗法。在本发明的含义中,“化疗产品”旨在表示用于治疗癌症的治疗化合物,旨在诱导癌细胞的细胞凋亡。这些产品是本领域技术人员所熟知的。根据本发明的一个具体方面,所述化疗产品将选自以下列表,其包含称为以下的产品:顺铂、卡铂、奥沙利铂、苯达莫司汀、达卡巴嗪、替莫唑胺、雌莫司汀、氨甲喋呤、阿扎胞苷、卡培他滨、阿糖胞苷、氟尿嘧啶、吉西他滨、替加氟、培美曲塞、奈拉滨、羟基脲、雷替曲塞、阿霉素、表阿霉素、米托蒽醌、柔红霉素、伊达比星、博来霉素、丝裂霉素、更生霉素、伊立替康、拓扑替康、依托泊苷、多西他赛、紫杉醇、毒胡萝卜素及其衍生物。在本发明的含义中,表述“与至少一种化疗产品组合施用”表示两种治疗化合物,竞争性抑制剂和化疗产品,可以同时或顺序使用,特别是它们可以在患者治疗过程中在时间上分开施用。本发明还涉及一种化疗产品,其用于与如上所述的至少一种竞争性抑制剂组合用于治疗癌症,所述癌症的细胞表达蛋白bcl-2l10。本发明还涉及用作药物的竞争性抑制剂,与至少一种化疗产品组合,所述竞争性抑制剂是癌症对化疗治疗响应的调节剂,所述癌症的细胞表达蛋白bcl-2l10。术语“响应调节剂”表示根据本发明的竞争性抑制剂优化化疗产品(特别是用于治疗癌症的产品)治疗效果的能力,所述癌症的细胞表达蛋白bcl-2l10。因此,当竞争性抑制剂用作药物时,与至少一种化疗产品组合,在治疗细胞表达蛋白bcl-2l10的癌症的背景下,用化疗产品进行的所述治疗对所述癌症将更有效。表述“对所述癌症有效”尤其表示,当竞争性抑制剂与所述化疗产品组合用作药物时,用于治疗的化疗产品的量将少于通常使用的量。表述“对所述癌症有效”还可以表示,当竞争性抑制剂与所述化疗产品组合用作药物时,在患有癌症的患者中用所述化疗产品进行治疗将比通常进行的治疗更短,所述癌症的细胞表达蛋白bcl-2l10。本发明还涉及治疗癌症的方法,所述癌症的细胞表达蛋白bcl-2l10,所述方法包括向患有所述癌症的患者施用蛋白bcl-2l10与至少一种ip3r受体的配体结合结构域结合的竞争性抑制剂的步骤。本发明还涉及治疗癌症的方法,所述癌症的细胞表达蛋白bcl-2l10,所述方法包括向患有所述癌症的患者施用蛋白bcl-2l10与至少一种ip3r受体的配体结合结构域结合的竞争性抑制剂的步骤,以及施用至少一种化疗产品的另一步骤,所述两个施用步骤能够是同时的或依次的。竞争性抑制剂本发明还涉及蛋白bcl-2l10与至少一种ip3r受体的配体结合结构域结合的竞争性抑制剂,其是根据以下结构构建的:[adr]x-[esp]y-[dom]-[sadr]z,其中:·adr是靶向化合物,·esp是间隔序列,·dom是肽结构域,所述肽结构域的序列与序列seqidno.1[rertelllady]具有至少80%的同一性,下划线的精氨酸和酪氨酸残基是保守的,·sadr表示特异性细胞内靶向肽结构域,其中x、y和z彼此独立地等于0或1,并且总和(x+y+z)等于或大于1。本发明涉及根据上述结构构建的所有前述的抑制剂。在一个具体实施方案中,dom是肽结构域,其序列与序列seqidno.1或序列seqidno.2或序列seqidno.3或序列seqidno.8具有至少80%的同一性,优选至少90%的同一性,下划线的精氨酸和酪氨酸残基是保守的。在一个实施方案中,竞争性抑制剂的特征在于结构域adr、esp和sadr是肽结构域。在一个具体实施方案中,竞争性抑制剂包含选自以下的氨基酸序列所示的氨基酸序列:seqidno.4、seqidno.18和seqidno.27。在一个更具体的实施方案中,竞争性抑制剂由肽组成,所述肽具有选自以下的氨基酸序列:seqidno.4、seqidno.18和seqidno.27。药物组合物根据其另一方面,本发明涉及药物组合物,其在药学上可接受的介质中包含至少一种如上所述的竞争性抑制剂。根据优选的实施方案,本发明涉及药物组合物,其在药学上可接受的介质中包含至少一种蛋白bcl-2l10与至少一种ip3r受体的配体结合结构结合的竞争性抑制剂,所述抑制剂是根据以下结构而构建的:[adr]x-[esp]y-[dom]-[sadr]z,其中:·adr是靶向化合物,·esp是间隔序列,·dom是肽结构域,所述肽结构域的序列与序列seqidno.1[rertelllady]具有至少80%的同一性,下划线的精氨酸和酪氨酸残基是保守的,·sadr表示特异性细胞内靶向肽结构域,其中x、y和z彼此独立地等于0或1,并且总和(x+y+z)等于或大于1。这种竞争性抑制剂可尤其包含seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11所示序列的肽结构域(dom)。竞争性抑制剂还可以包含选自以下的氨基酸序列所示的氨基酸序列:seqidno.4、seqidno.18和seqidno.27。这种竞争性抑制剂也可以由序列seqidno.4、seqidno.18和seqidno.27之一中所示的序列的肽结构域组成。本发明的bcl-2l10/ip3r受体结合的竞争性抑制剂或药物组合物可与任何药学上可接受的介质或载体一起配制,并可配制成任何固体、半固体、液体或气体形式,例如片剂、胶囊、凝胶胶囊、粉末、颗粒、乳液、悬浮液、凝胶、微球或吸入形式。根据一个实施方案,根据本发明的bcl-2l10/ip3r受体结合的竞争性抑制剂或本发明的药物组合物可以以用于延长或控制释放的片剂、胶囊或凝胶胶囊、丸剂、粉末、溶液、悬浮液、糖浆或乳液的形式进行配制用于口服途径。根据另一个实施方案,可以以可注射形式制备根据本发明的bcl-2l10/ip3r受体结合的竞争性抑制剂或本发明的药物组合物。本发明的多肽或核酸可以与不同的载体(例如脂质体或转染聚合物)一起进行配制。本发明的药物组合物优选可以在药学上可接受的载体(例如水性载体)中在悬浮液中包含本说明书中限定的抑制剂。可以使用各种水性载体,例如水、盐水缓冲溶液、0.4%或0.3%甘氨酸溶液或透明质酸溶液。根据本发明的一个优选方面,药物组合物还包含能够促进肽转运通过生物膜的试剂,如,例如chariottm蛋白递送试剂。根据本发明的药物组合物可通过任何常规的已知方法灭菌,例如过滤。可以调节所得水性溶液以原样使用或者冻干。冻干制剂可以在使用前与无菌溶液组合。本发明的药物组合物可包含任何所需的药学上可接受的赋形剂,例如缓冲剂或用于调节ph或等渗性的试剂,和润湿剂。根据本发明的药物组合物还可包含一种或多种抗氧化剂、一种或多种防腐剂和任选的其它药物活性剂。根据一个具体的实施方案,本发明的药物组合物包含有效量的bcl-2l10/ip3r相互作用的竞争性抑制剂。根据本发明的有效量的抑制剂,是指这样的量,其单独或与随后的剂量组合而诱导所需的反应,即对bcl-2l10/ip3r受体结合的抑制作用,以及由此消除bcl-2l10对ip3r受体钙通道功能的抑制作用。这种抑制剂的有效量可取决于一个参数或多个参数,例如施用途径、单剂量或多剂量施用、或患者的特征(包括年龄、身体状况、身高、体重以及不适或疾病的存在)。这些参数及其影响是本领域技术人员公知的,并且可以通过任何已知方法确定。所述组合物将能够用于任何类型的治疗,特别是在预防和/或治疗所有类型治癌症的情况中,所述癌症的细胞表达蛋白bcl-2l10。实施例实施例1.蛋白bcl-2l10(nrh)的细胞定位培养,然后裂解内源性表达蛋白bcl-2l10/nrh的人乳癌细胞mda-mb-231。在凝胶上沉积几种提取物:总级分、线粒体级分(mito)、内质网级分(er)和在100000g离心后获得的可溶性级分(s100)。蛋白纽蛋白、钙联接蛋白和f0f1用作对照。蛋白bcl-2l10/nrh在内质网(er)中的定位在图2的第三列中清楚可见。实施例2.在存在或不存在毒胡萝卜素的情况下,干扰rna阻止蛋白nrh表达的作用用针对nrhmrna的sirna(si3-nrh或si6-nrh)或用对照sirna(siscr)转染mda-mb-231细胞。在这些细胞中,nrh的表达大大降低。转染后48小时,用dmso(对照)或10μm毒胡萝卜素(thg)将细胞孵育6小时、24小时和36小时。结果如图3所示。以百分比的形式测量半胱天冬酶3和7的活性。大于10%的活性表明细胞已进入细胞凋亡过程,这是在毒胡萝卜素(一种诱导细胞凋亡的化疗化合物)存在下预期的。另一方面,在dmso存在下,细胞不应表现出半胱天冬酶活性。然而,在阻断bcl-2l10/nrh表达的干扰rna存在情况下,即使不进行毒胡萝卜素处理,孵育36小时的细胞的半胱天冬酶活性也大于10%。此外,在毒胡萝卜素存在下,干扰rna所转染的细胞中半胱天冬酶活性比对照干扰rna所转染的细胞中观察到的活性更高。因此,缺失蛋白bcl-2l10/nrh的表达导致毒胡萝卜素作用的显著增强,这种效果在孵育动力学整个过程中越来越明显。实施例3.在存在或不存在毒胡萝卜素的情况下,衍生自bcl-2l10/nrh的突变体或融合蛋白的作用从基因nrh开始产生几种多肽构建体:-野生型、完整形式的人bcl-2l10/nrh蛋白:nrh-wt;-野生型、完整形式的蛋白bcl-2l10/nrh,带有源自人细胞色素b5蛋白的用于靶向内质网的化合物:nrh-cb5:nrh-cb5,-野生型、完整形式的蛋白bcl-2l10/nrh,带有用于靶向线粒体的单核细胞增生李斯特菌(l.monocytogene)的acta的化合物:nrh-acta,-蛋白bcl-2l10/nrh,其中膜锚定结构域已被删除:nrh-dtm,-蛋白bcl-2l10/nrh,其中n端bh4结构域已被删除:nrh-dbh4。这些各种融合蛋白/突变蛋白显示于图4a中。空载体pcs2+或编码nrh、nrh-acta、nrh-cb5、dtm或dbh4的构建体转染hela细胞后,观察到这些不同蛋白的作用。图4b中显示在用10μm毒胡萝卜素处理24小时的这些细胞中半胱天冬酶活性的测量。在毒胡萝卜素存在下,显示出极大地诱导了半胱天冬酶活性,这对应于预期的效果。当蛋白bcl-2l10/nrh-wt在细胞中过表达时,这种作用减少了一半;在靶向内质网的nrh蛋白存在或删除其膜锚定结构域的情况下,这种作用得以维持。然而,当蛋白bcl-2l10/nrh缺失其bh4结构域时,或当其靶向线粒体时,不再观察到细胞凋亡的阻断作用,半胱天冬酶活性维持在与缺失这种蛋白时相同的百分比水平。因此,可以得出结论,蛋白bcl-2l10/nrh在内质网中的定位及其bh4结构域的存在,对于取得阻断毒胡萝卜素所诱导的细胞凋亡的作用是必不可少的。实施例4.在存在或不存在毒胡萝卜素的情况下,构建可能用作阻止bcl-2l10/ip3r相互作用的竞争性抑制剂的各种肽从肽nrh1-23中产生几种肽构建体,其序列如下:madplrertellladylgycare(seqidno.2)。图5a显示进行的各种点突变,其中序列seqidno.2的肽nrh1-23进行突变以产生肽nrhr6a(seqidno.5)、nrhd15a(seqidno.7)、nrhy16f(seqidno.6)和nrhc20a(seqidno.8),其在c端与细胞色素b5胞内靶向结构域融合(seqidno.15)。图5b显示这些不同肽抑制bcl-2l10/nrh与受体ip3r1的bd结构域相互作用的能力。通过免疫沉淀技术定量这种相互作用,bd结构域用ha表位进行标记,蛋白bcl-2l10/nrh用flag表位进行标记。以1:2的比例,用编码flag-nrh、ha-hbd和flag标记的肽nrh1-23的不同点突变体的质粒转染hela细胞,并用抗ha抗体进行免疫沉淀。在不存在肽的情况下,观察到flag-nrh和ha-hbd之间的相互作用。然而,当添加编码肽nrh1-23(seqidno.2)、肽nrhd15a(seqidno.7)或nrhc20a(seqidno.8)的质粒时,可以在图5bwestern印迹上看到不存在对应于蛋白flag-nrh的条带,证明这些肽解离了nrh/ip3r1相互作用。另一方面,在肽nrhr6a(seqidno.5)和nrhy16f(seqidno.6)存在下,尽管微弱,对应于蛋白flag-nrh的条带仍然是可见。因此可以得出结论,第6位的精氨酸残基和第16位的酪氨酸残基对于肽nrh1-23在解离nrh和ip3r1之间相互作用的生物学功能方面是至关重要的。第15位的谷氨酰胺残基和第20位的半胱氨酸残基对于肽nrh1-23的功能不是必不可少的。图5c显示这些各种肽中的一些转染到hela细胞中的效果,用空载体pcs2+转染对照细胞。如图5c所示,测量用10μm毒胡萝卜素处理24小时的这些细胞中半胱天冬酶的活性。在对照细胞中,在毒胡萝卜素存在下显示出半胱天冬酶活性的诱导,这对应于预期的效果。当肽nrh1-23(seqidno.2)存在时,从而抑制bcl-2l10/ip3r1相互作用,毒胡萝卜素的这种作用得以增强,半胱天冬酶活性几乎加倍;在肽nrhc20a存在下维持这种作用,但在酪氨酸y16上进行点突变时则消失。实施例5.肽nrh和蛋白bcl-2l10的二聚化图6显示为了证明肽nrh1-23与nrh完整蛋白(bcl-2l10)相互作用的能力而实现的实验。(a)用空载体pcs2+、flag-nrh、ha-hbd或ha-beclin1(称为ha-becn1)(以其与nrh结合的能力而公知的蛋白)的任一种转染hela细胞,然后将细胞提取物与或不与5μg生物素标记的nrh1-23野生型肽一起孵育。链霉亲和素用于拉下包含生物素标记的nrh肽的复合物。图6a中,显示出nrh1-23肽仅能与nrh相互作用,但不与ha-hbd或ha-becn1相互作用。(b)用空载体pcs2+、flag-nrh或flag-nrz(来自斑马鱼的直系同源物)的任一种转染hela细胞,然后将细胞提取物与(i)5μg生物素标记的nrh1-23野生型肽或(ii)nrh1-23r6ay16f双突变体肽一起孵育。链霉亲和素用于拉下包含生物素标记的nrh肽的复合物。显示出nrh1-23仅能够与nrh相互作用,但不能与nrz相互作用,因此表现出物种特异性水平。此外,双突变体nrh1-23r6ay16f与nrh的相互作用减少。可以得出结论,这些残基r6和y16中的至少一个对于nrh/nrh1-23相互作用是至关重要的。图7显示为了证明完整蛋白nrh(bcl-2l10)二聚化能力而实现的实验。图7说明通过共免疫沉淀用抗ha抗体量化flag-nrh和ha-nrh之间的相互作用。观察到nrh同型二聚体的形成。通过与nrh1-23肽孵育能够防止nrh的同型二聚化,但在关键的y16残基中通过点突变而丧失功能的突变肽nrh1-23y16f则不能。实施例6.根据本发明的或在酪氨酸16处突变的竞争性抑制剂的肽构建体图9a显示序列seqidno.4所示的肽构建体“tatnrh1-23”;以及本发明之外的构建体,其中酪氨酸16不是保守的,“tat-nrh1-23y16f”包含tat序列(seqidno.12)、间隔序列(seqidno.14)和seqidno.6的组合,不含甲硫氨酸。图9b显示,以20%三氟乙醇中80μm浓度溶于缓冲液[h2o-0.1%三氟乙酸]中的肽tat-nrh1-23和tat-nrh1-23y16f的圆二色谱。两种肽构建体具有α螺旋结构的特征性标志。因此,表明即使点突变y16f不影响肽的三维结构,它确实影响其竞争性抑制剂的生物学功能。实施例7.根据本发明的肽构建体(tatnrh1-23)或本发明之外的肽构建体(tatnrh1-23y16f)存在下,在mda-mb-231细胞中内源蛋白bcl-2l10/nrh和ip3r1之间的相互作用图10a显示邻近连接分析(pla)实验的结果。将mda-mb-231细胞与肽tatnrh-1-23(seqidno.4)或对照肽tat-nrh1-23y16f(seqidno12、14和6)孵育4小时。在细胞洗涤3次后,使用488nm激光激发内体中存在的荧光团(fitc),破坏内体膜并使tat-fitc肽释放到胞质中。将细胞孵育12小时然后固定,并使用兔抗-nrh一抗和小鼠抗ip3r1一抗通过pla定量nrh和ip3r1之间的相互作用。该步骤之后与抗兔和抗小鼠二抗的混合物一起孵育,每个二抗与互补核苷酸探针偶联。在荧光核苷酸存在下进行连接然后扩增的步骤,使得在探针空间接近的情况下可以扩增特定信号。通过nikonnie荧光显微镜记录荧光信号,其中每个点对应于细胞中的相互作用。通过imagej软件量化图像,并且相互作用得分在图上表示为每个细胞的点数(n=3)。在图10a中,显示几个pla实验的定量,在没有488nm闪光的情况下与肽稀释缓冲液(载体)或肽tatnrh1-23孵育后,观察到得分为每个细胞80±5和87±6个点,因此没有肽释放到胞质中。相反,当使用488nm闪光时释放肽tatnrhy16f,得分降至65±5,然后用肽tatnrh1-23则降至每个细胞11±1个点。根据该定量技术,根据所讨论的阴性对照,本发明之外的肽存在时,nrh/ip3r1相互作用的抑制百分比在18.75%((80-65)/80)和25%((87-65)/87)之间。在肽tatnrh1-23存在下,nrh/ip3r1相互作用的抑制百分比等于86%或87%,作为所讨论的阴性对照的函数。因此,可以通过该定量实验得出结论,tatnrh1-23肽能够有效解离nrh和ip3r1之间的内源性相互作用,对应着nrh/ip3r1相互作用至少30%的抑制,并且tatnrhy16f肽仅以非常有限的方式影响相互作用,小于30%的极限值。实施例8.存在或不存在毒胡萝卜素的情况下,根据本发明的肽构建体(tatnrh1-23)或本发明之外的肽构建体(tatnrh1-23y16f)的生物活性内源性表达蛋白bcl-2l10的mda-mb-231细胞与肽tat-nrh1-23(seqidno.4)或肽tat-nrh1-23y16f(seqidno.12、14和6)一起孵育36小时,之后闪光或不闪光,以便破坏含有各种肽的内体。结果如图10b所示。当肽被释放到胞质中时,根据本发明的肽构建体与毒胡萝卜素组合作用于细胞,可以获得大于60%的半胱天冬酶活性。实施例9.根据本发明的其它肽构建体(dtat1-23c20a)或本发明之外的其它肽构建体(dtat1-23y16fc20a)已经合成了seqidno.27和28所示的两种合成肽。这些肽在tat内化结构域的n端存在半胱氨酸(c)和赖氨酸(k)残基,可在氧化条件下使tat序列二聚化。由于二聚体tat(dtat)具有增强的内体逃逸性质,在不使用如实施例7中所使用的外部物理试剂(例如光)的情况下肽实现有效的细胞进入。出于示踪的目的,两种dtat肽都具有接枝到位置编号2上的赖氨酸侧链的tmr(四甲基罗丹明)荧光基团。在编码flag-nrh或ha-hbdip3r1的质粒转染的hela细胞中,在无ca2+平衡盐溶液(121mmnacl、5.4mmkcl、0.8mmmgcl2、6mmnahco3、5.5mmd-葡萄糖、25mmhepes,ph7.3)中在37℃和载体(肽溶剂[h2o-tfa0.1%])以及以下:-10μm对照肽(dtat1-23y16fc20a)或-10μm野生型肽(dtat1-23c20a)预孵育1小时,通过共免疫沉淀来评估flag-nrh(bcl-2l10)和ha-hbdip3r1之间的相互作用。细胞洗涤两次并在收获前在37℃再孵育1小时。如图11b所示,在该实验中,dtat1-23c20a而非dtat1-23y16fc20a破坏nrh/ip3r1复合物,这意味着它们已被有效地引入细胞而没有任何外部试剂。对于肽的内化,该具体实施方案优于实施例7中先前使用的天然tat序列。实施例10.给小鼠施用肽dtat1-23c20a的体内作用scid小鼠已被用作肿瘤模型以测试根据本发明的肽的施用作用。将mda-mb-231癌细胞注射到scid小鼠的乳腺脂肪垫中。当肿瘤达到约90mm3的平均体积时,通过瘤周注射每三天一次施用10mg/kg的dtat1-23c20a肽(seqidno.27,与图11中所示相同的肽,但没有tmr荧光基团)、或按照相同的注射周期单独施用载体(pbs)来处理小鼠。使用卡尺每周测量肿瘤体积两次(平均值±sem;每个条件n=9只小鼠;**,p<0.01),显示dtat1-23c20a肽当用作抗肿瘤单一疗法时在肿瘤生长中的显著作用(图12a)。图12b显示在图12a所示实验过程中小鼠体重的测量(平均值±sem;每种条件n=9只小鼠)。处理的小鼠与对照小鼠没有差异,因此治疗没有表现出明显的毒性。参考文献专利wo2012/031103wo2013/128089wo2015/038662科技文献1.besbess,billardc.firstmcl-1-selectivebh3mimeticsaspotentialtherapeuticsfortargetedtreatmentofcancer.celldeathdis.2015jul9;62.arnaude,ferrikf,thibautj,haftek-terreauz,aouacheriaa,leguellecd,lorcat,gilletg.thezebrafishbcl-2homologuenrzcontrolsdevelopmentduringsomitogenesisandgastrulationviaapoptosis-dependentand-independentmechanisms.celldeathdiffer.2006jul;13(7):1128-37.3.popgeorgievn,bonneaub,ferrikf,prudentj,thibautj,gilletg.theapoptoticregulatornrzcontrolscytoskeletaldynamicsviatheregulationofca2+traffickinginthezebrafishblastula.devcell.2011may17;20(5):663-76.4.bonneaub,nougarèdea,prudentj,popgeorgievn,peyriérasn,rimokhr,gilletg.thebcl-2homolognrzinhibitsbindingofip3toitsreceptortocontrolcalciumsignalingduringzebrafishepiboly.scisignal.2014feb11;7(312)5.krajewskam,kitadas,winterjn,variakojisd,lichtensteina,zhaid,cuddym,huangx,lucianof,bakerch,kimh,shine,kennedys,olsonah,badzioa,jassemj,meinhold-heerleini,duffymj,schimmerad,tsaom,browne,sawyersa,andreeffm,mercolad,krajewskis,reedjc.bcl-bexpressioninhumanepithelialandnonepithelialmalignancies.clincancerres.2008may15;14(10):3011-21.6.cluzeaut,robertg,mouniern,karsentijm,dufiesm,puissanta,jacquela,rennevillea,preudhommec,cassutojp,raynauds,lucianof,aubergerp.bcl2l10isapredictivefactorforresistancetoazacitidineinmdsandamlpatients.oncotarget.2012apr;3(4):490-501.7.rongyp,aromolaranas,bultynckg,zhongf,lix,mccollk,matsuyamas,herlitzes,roderickhl,bootmanmd,migneryga,parysjb,desmedth,distelhorstcw.targetingbcl-2-ip3receptorinteractiontoreversebcl-2'sinhibitionofapoptoticcalciumsignals.molcell.2008jul25;31(2):255-65.8.monacog,beckersm,ivanovah,missiaenl,parysjb,desmedth,bultynckg.profilingofthebcl-2/bcl-x(l)-bindingsitesontype1ip(3)receptor.biochembiophysrescommun.2012nov9;428(1):31-59.rongyp,bultynckg,aromolaranas,zhongf,parysjb,desmedth,migneryga,roderickhl,bootmanmd,distelhorstcw.thebh4domainofbcl-2inhibitsercalciumreleaseandapoptosisbybindingtheregulatoryandcouplingdomainoftheip3receptor.procnatlacadsciusa.2009aug25;106(34):14397-402.10.zhongf,harrmw,bultynckg,monacog,parysjb,desmedth,rongyp,molitorisjk,lamm,ryderc,matsuyamas,distelhorstcw.inductionofca2+-drivenapoptosisinchroniclymphocyticleukemiacellsbypeptide-mediateddisruptionofbcl-2-ip3receptorinteraction.blood.2011mar10;117(10):2924-34.12.lavikar,zhongf,changmj,greenberge,choudharyy,smithmr,mccollks,pinkj,reufj,matsuyamas,distelhorstcw.asyntheticpeptidetargetingthebh4domainofbcl-2inducesapoptosisinmultiplemyelomaandfollicularlymphomacellsaloneorincombinationwithagentstargetingthebh3-bindingpocketofbcl-2.oncotarget.2015sep29;6(29):27388-402.13.monacog,decrocke,aklh,ponsaertsr,vervliett,luytent,demaeyerm,missiaenl,distelhorstcw,desmedth,parysjb,leybaertl,bultynckg.selectiveregulationofip3-receptor-mediatedca2+signalingandapoptosisbythebh4domainofbcl-2versusbcl-xl.celldeathdiffer.2012feb;19(2):295-30914.mikoshibak.ip3receptor/ca2+channel:fromdiscoverytonewsignalingconcepts.jneurochem.2007sep;102(5):1426-46.review.15.yoshikawaf,moritam,monkawat,michikawat,furuichit和mikoshibak(1996)mutationalanalysisoftheligandbindingsiteoftheinositol1,4,5-trisphosphatereceptor.rjbiolchem.271,18277–18284.16.xiaoyingchen,jennicazaro和wei-chiangshen.fusionproteinlinkers:property,designandfunctionality.advdrugdelivrev.2013oct15;65(10):1357–1369。序列表<110>ucblinsermcnrs贝哈里昂中心<120>bcl-2l10/ip3r相互作用的抑制剂<130>pr77236<150>fr1652040<151>2016-03-11<160>28<170>bissap1.3.2<210>1<211>11<212>prt<213>人<400>1arggluargthrgluleuleuleualaasptyr1510<210>2<211>23<212>prt<213>人<400>2metalaaspproleuarggluargthrgluleuleuleualaasptyr151015leuglytyrcysalaargglu20<210>3<211>22<212>prt<213>人<400>3alaaspproleuarggluargthrgluleuleuleualaasptyrleu151015glytyrcysalaargglu20<210>4<211>36<212>prt<213>人工序列<223>tat-esp-肽<220><223>tat-esp-肽<400>4arglyslysargargglnargargargglyglyserglyglyalaasp151015proleuarggluargthrgluleuleuleualaasptyrleuglytyr202530cysalaargglu35<210>5<211>23<212>prt<213>人工序列<223>肽r6a<220><223>肽r6a<400>5metalaaspproleualagluargthrgluleuleuleualaasptyr151015leuglytyrcysalaargglu20<210>6<211>23<212>prt<213>人工序列<223>肽y16f<220><223>肽y16f<400>6metalaaspproleuarggluargthrgluleuleuleualaaspphe151015leuglytyrcysalaargglu20<210>7<211>23<212>prt<213>人工序列<223>肽d15a<220><223>肽d15a<400>7metalaaspproleuarggluargthrgluleuleuleualaalatyr151015leuglytyrcysalaargglu20<210>8<211>23<212>prt<213>人工序列<223>肽c20a<220><223>肽c20a<400>8metalaaspproleuarggluargthrgluleuleuleualaasptyr151015leuglytyralaalaargglu20<210>9<211>11<212>prt<213>人工序列<223>xaa是任何氨基酸<220><223>xaa是任何氨基酸<400>9arggluargthrgluleuleuxaaxaaasptyr1510<210>10<211>11<212>prt<213>人工序列<223>xaa是任何氨基酸<220><223>xaa是任何氨基酸<400>10arggluargthrxaaxaaleuleualaasptyr1510<210>11<211>11<212>prt<213>人工序列<223>xaa是任何氨基酸<220><223>xaa是任何氨基酸<400>11arggluxaathrgluleuleuleualaxaatyr1510<210>12<211>9<212>prt<213>人免疫缺陷病毒<400>12arglyslysargargglnargargarg15<210>13<211>16<212>prt<213>人工序列<223>穿透肽(penetratine)<220><223>穿透肽<400>13argglnilelysiletrppheglnasnargargmetlystrplyslys151015<210>14<211>5<212>prt<213>人工序列<223>间隔序列(espaceur)<220><223>间隔序列<400>14glyglyserglygly15<210>15<211>26<212>prt<213>人<223>cb5<220><223>cb5<400>15trptrpthrasntrpvalileproalaileseralavalalavalala151015leumettyrargleutyrmetalagluasp2025<210>16<211>4<212>prt<213>人工序列<223>导向(adressage)re<220><223>导向re<400>16lysaspgluleu1<210>17<211>4<212>prt<213>人工序列<223>导向re<220><223>导向re<400>17lyslysmetpro1<210>18<211>62<212>prt<213>人工序列<223>tat-esp-肽-cb5<220><223>tat-esp-肽-cb5<400>18arglyslysargargglnargargargglyglyserglyglyalaasp151015proleuarggluargthrgluleuleuleualaasptyrleuglytyr202530cysalaargglutrptrpthrasntrpvalileproalaileserala354045valalavalalaleumettyrargleutyrmetalagluasp505560<210>19<211>27<212>prt<213>斑马鱼(daniorerio)<223>"nrz结构域bh4"<220><223>nrz结构域bh4<400>19metsercystrpleuarggluglnthrleuleuleualagluasptyr151015ileserphecysserglyileglnglnthrpro2025<210>20<211>27<212>prt<213>鸡(gallusgallus)<223>"nr-13结构域bh4"<220><223>nr-13结构域bh4<400>20metproglyserleulysglugluthralaleuleuleugluasptyr151015pheglnhisargalaglyglyalaalaleupro2025<210>21<211>30<212>prt<213>小鼠(musmusculus)<223>"小鼠bcl-2l10结构域bh4"<220><223>小鼠bcl-2l10结构域bh4<400>21metalaaspserglnaspproleuhisgluargthrargargleuleu151015serasptyrilephephecysalaarggluproaspthrpro202530<210>22<211>27<212>prt<213>人<223>"bcl2l10结构域bh4"<220><223>bcl2l10结构域bh4<400>22metalaaspproleuarggluargthrgluleuleuleualaasptyr151015leuglytyrcysalaarggluproglythrpro2025<210>23<211>29<212>prt<213>人<223>"bcl2结构域bh4"<220><223>bcl2结构域bh4<400>23metalahisalaglyargthrglytyraspasnarggluilevalmet151015lystyrilehistyrlysleuserglnargglytyrglu2025<210>24<211>23<212>prt<213>人<223>"bclxl结构域bh4"<220><223>bclxl结构域bh4<400>24metserglnserasnarggluleuvalvalasppheleusertyrlys151015leuserglnlysglytyrser20<210>25<211>27<212>prt<213>人<223>"bcla1结构域bh4"<220><223>bcla1结构域bh4<400>25metthraspcysglupheglytyriletyrargleualaglnasptyr151015leuglncysvalleuglnileproglnprogly2025<210>26<211>27<212>prt<213>人<223>"bclw结构域bh4"<220><223>bclw结构域bh4<400>26metalathrproalaseralaproaspthrargalaleuvalalaasp151015phevalglytyrlysleuargglnlysglytyr2025<210>27<211>38<212>prt<213>人工序列<223>"ck-tat-esp-肽c20a"<220><223>ck-tat-esp-肽c20a<400>27cyslysarglyslysargargglnargargargglyglyserglygly151015alaaspproleuarggluargthrgluleuleuleualaasptyrleu202530glytyralaalaargglu35<210>28<211>38<212>prt<213>人工序列<223>"ck-tat-esp-肽c20ay16f"<220><223>ck-tat-esp-肽c20ay16f<400>28cyslysarglyslysargargglnargargargglyglyserglygly151015alaaspproleuarggluargthrgluleuleuleualaasppheleu202530glytyralaalaargglu35当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1