炎症性肠病的生物标志物的制作方法
本申请要求2016年7月5日提交的英国专利申请gb1611738.4的优先权,其内容全部并入本申请。本发明涉及评估个体是否处于炎症性肠病(ibd)进展的高风险或低风险的方法,ibd进展包括克罗恩病(cd)和溃疡性结肠炎(uc)的进展。个体可选择性地进一步接受ibd治疗或被选择于ibd治疗,所述的治疗基于个体是否处于ibd进展的高风险或低风险来进行选择。
背景技术:
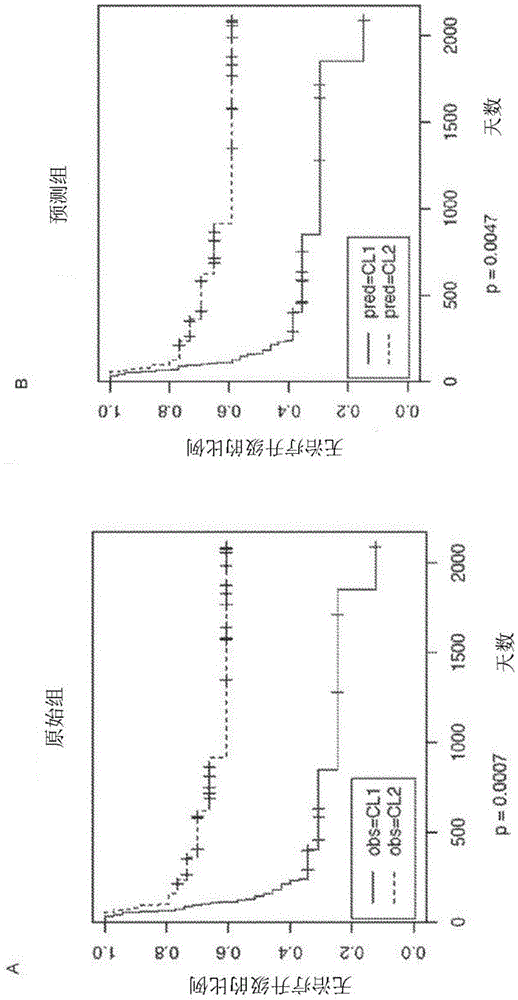
:与标准的递进式治疗(step-upapproach,d’haensetal.,2008;colombeletal.,2010)相比,早期在cd中引入侵袭性疗法已证实可以产生更好的结果。特别是,接受早期联合疗法(英夫利昔单抗联合硫唑嘌呤;d’haensetal.,2008)治疗的患者会经历更长时间的无类固醇缓解,更有可能实现粘膜愈合,并最终避免手术切除(d’haensetal.,2008;colombeletal.,2010)。然而,这种策略并不适合所有患者,因为即使使用常规治疗方法,较大比例的患者也会有延长的缓解期(jessetal.,2007),因此使用联合疗法治疗会使他们面临不必要的副作用和毒性。因此,通常地,预测预后的能力将是改善cd患者和ibd患者的护理的重要一步(ibdresearchpriority,2015;gerichetal.,2014)。许多不同的变量与cd的预后有关;这些变量为临床因素、血清学标志物和遗传变异(gerichetal.,2014;billietetal.,2014)。然而,迄今为止,已经证明单独或组合使用这些标记物的预测能力是有限的,并且没有一种适用于临床常规使用(lolyetal.,2008;markowitzetal.,2011;ananthakrishnanetal.,2014)。因此,开发一种包括cd和uc在内的ibd的可靠的预后检测方法,仍然是一个优先事项,且目前其被认为是胃肠病学中最重要的未满足需求之一(ibdresearchpriority,2015)。遗传变异是有希望实现这一目标的候选预后标记,因为它们是稳定的,可以很容易地测量,并且因为cd的遗传结构至少在易感性方面(jostinsetal.,2012)已经得到了广泛研究。然而,到目前为止发现的遗传因素可能只能解释在患者间cd结果中观察到的表型变异的5-6%。即使随着更好的研究发现其他与结果相关的变异导致这个数字增加,遗传因素也似乎不太可能单独准确预测cd和ibd的结果。这与包括吸烟在内的环境因素在ibd自然史中起重要作用的观点是一致的(kaseretal.,2010)。基因表达标志物可以是克服这些限制的更好的候选,特别是如果直接在涉及疾病发病机理的组织或细胞类型中测量的话(mckinneyetal.,2010;leeetal.,2011)。事实上,基因表达可以捕获涉及生物体与外部环境之间相互作用的更多信息(choietal.,2007),同时还反映了个体遗传背景的某些方面。另一方面,通常预期基因表达不会随时间而稳定,并且在不影响基因表达水平的情况下分离特定的细胞群在技术上具有挑战性(lyonsetal.,2007)。在受控的研究环境之外,所有这些因素都限制了基因表达标志物在临床环境中的使用。最近报道了可在cd8+t细胞中检测到的独特基因表达特征可用于预测ibd的预后(leeetal.,2011)。特别是,这种特征能够在诊断时和治疗前识别两组不同的患者(ibd1和ibd2),这两组患者在cd和uc中均与不同临床病程相关(leeetal.,2011)。更确切地说,当使用标准的递进式治疗(peyrin-birouletetal.,2008)进行管理时,归类为ibd1组的患者始终显示出明显高于ibd2组患者的治疗升级风险(leeetal,2011),从而为在较早阶段用更具侵袭性的疗法治疗这些患者提供了理论依据(leeetal,2011)。上述特征代表了预测ibd结果的重大进展(friedmanetal.,2011),主要原因有三个。首先,与先前报道的预后标志物不同(gerichetal.,2014),患者层之间的结果差异足以潜在地有助于指导治疗决策(leeetal.,2011;friedmanetal.,2011)。其次,先前报道了一个重叠的cd8+基因表达特征可以预测系统性红斑狼疮(sle)和anca相关性血管炎(aav)患者的疾病结果,从而提出了一个假设,即共同的生物过程可能是不同炎症性疾病预后的基础(mckinneyetal.,2010)。最后,最近对潜在生物过程提出了部分但引人注目的机理解释(mckinneyetal.,2015)。最后两点特别重要。事实上,调查预后必然需要纵向研究,其中数据收集既耗时又昂贵,因此限制了研究规模。因此,对于一小群患者是否能够从潜在人群中捕获足够的复杂性以及所提出的预后标志物是否确实可重现,通常仍然存在疑问。有鉴于此,观察不同疾病患者的不同群组的疾病结果的一致性,以及可靠的机理见解,极大增加了对上述cd8+t细胞基因表达特征的再现性的信心(mckinneyetal.,2010;leeetal.,2011)。然而,在cd8+t细胞基因表达特征可以常规用于在临床环境中对患者进行分层之前,一个重要的问题仍有待解决。目前,将患者分配到ibd1/ibd2组需要从纯化的cd8+t细胞中提取rna(mckinneyetal.,2010;leeetal.,2011)。已经反复观察到,该步骤为潜在的预后测试增加了相当大的复杂性,因此限制了其在受控研究环境中对少量样品的适用性(friedmanetal.,2011;billietetal.,2014)。相反,能够在易于获得的生物样品(例如全血)中检测ibd1/ibd2亚组将极大地促进其临床应用,并可能增加其作为预后标志物的适用性。此外,由于在一些临床试验期间已经常规收集全血样品而非纯化的cd8+t细胞,这将开启重新分析过去的ibd药物试验的可能性,以便在患者分层后重新评估药物功效。尽管可能有用,但应该注意的是,在不同于纯化的cd8+t细胞的样品中检测ibd1/ibd2特征已经证明是具有挑战性的(leeetal.,2011)。实际上,已经反复观察到来自cd4+t细胞的基因表达特征不能用于通过ibd(leeetal.,2011)、sle或aav(mckinneyetal.,2010)中的疾病结果对患者进行分层。与这些观察结果一致,使用最初用于发现cd8+t细胞表达特征的相同的无监督聚类方法(montietal.,2003),不可能在外周血单核细胞(pbmc)中鉴定等同的预后信号(mckinneyetal.,2010;leeetal.,2011)。这可能是由于cd8+t细胞在pbmc群体中所占比例非常小,且变化多端(lyonsetal.,2007)。此外,虽然可以使用高通量基因表达谱分析技术(例如微阵列)(schenaetal.,1995)发现预后特征,但可行的预后测试需要依赖于较小规模的基因表达平台,例如实时定量pcr(rt-qpcr)(freemanetal.,1999)。事实上,针对不同条件开发的大多数现代预后测试,例如allomap、oncotypedx和coruscad都是基于qpcr的测试(micheeletal.,2012),而只有少数旧的测试,如mammaprint,依赖于微阵列(micheeletal.,2012)。由于这个原因,如果可以在全血中发现一个概括ibd1/ibd2亚组的特征,那么通过qpcr检测它的可能性将对于其在临床环境中的应用是至关重要的。因此,本领域仍然需要一种ibd1/ibd2基因表达特征,其可以在全血中使用诸如qpcr的方法检测。发明阐述本发明人通过分析从个体获得的全血样品中的基因表达,意外地鉴定到可用于评估个体是否处于ibd(例如溃疡性结肠炎或克罗恩病)进展的高风险或低风险的基因表达特征。这些基因在全血中的表达可以通过例如rt-qpcr确定。具体地,本发明人发现,相对于这些基因在具有低风险(ibd2)表型的个体中的表达水平,高风险(ibd1)表型的特征在于arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达上调,以及全血中lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的表达下调。在一个方面,本发明因此提供了一种评估个体是否处于炎症性肠病(ibd)进展的高风险或低风险的方法,所述的方法包括通过测定从所述个体获得的全血样品中的两种或多种基因的表达水平来确定所述个体是否具有高风险(ibd1)或低风险(ibd2)表型,其中所述两种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、gzmh、trgc2、lgalsl、fcrl5、ifi44l、linc01136、ly96、gzmk和trgv3。在一个实施方案中,所述的方法可以包括使用例如rt-qpcr、数字pcr或全转录组鸟枪测序来确定所述两种或多种基因的表达水平。在这种情况下,所述方法可以包括:(i)提供从所述个体获得的全血样品;(ii)从所述全血样品中提取rna(例如mrna);(iii)将所述rna(例如mrna)转化为cdna;和(iv)进行rt-qpcr、数字pcr或全转录组鸟枪测序以确定所述两种或多种基因的表达水平。本发明还提供一种用于本发明方法的自身免疫疾病进展风险评估系统,其中,所述系统包括用于确定两种或更多种基因的表达的工具以及一计算机,所述两种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3,所述计算机被编程为根据受试者的基因表达数据计算ibd进展风险分数。用于确定所述基因表达的所述工具为或者包含用于使用本申请所述的任何技术,例如rt-qpcr、数字pcr、微阵列分析、全转录组鸟枪测序、或直接多重基因表达分析来确定所述基因的表达水平的试剂。例如,所述的工具为或者包含适于使用例如rt-qpcr、数字pcr、全转录组鸟枪测序或直接多重基因表达分析确定所讨论的所述基因的表达水平的引物。合适引物的设计是常规的并且完全在本领域技术人员的能力范围内。在所述方法包括多重基因表达分析的情况下,所述工具可以另外或替代地包括用于确定所讨论的所述基因的表达水平的荧光探针。所述工具还可以为或包含rna提取试剂和/或用于将rna逆转录成cdna的试剂。所述工具还可以为或包含用于实施所述方法的一种或多种制品和/或试剂,例如缓冲溶液,和/或用于获得测试样品本身的装置,例如,用于获得和/或分离样品的装置以及样品处理容器(这些部件通常是无菌的)。ibd进展风险评分的计算可以以多种方式实现,示例性方法在下面列出。本发明还提供治疗个体中ibd的方法。在一个实施方案中,所述的方法可以包括(i)使用本发明的方法将所述个体鉴定为具有ibd进展高风险或低风险,并且(ii)对所述个体进行ibd治疗。在另一个实施方案中,所述的方法可以包括:(i)要求提供分析结果的测试,以确定从所述个体获得的全血样品中两种或多种基因的表达水平,其中,所述两种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3,以及(ii)对确定具有ibd1或者ibd2表型的所述个体进行ibd治疗。还提供一种评估个体是否具有高风险ibd1或低风险ibd2表型的试剂盒,其中,所述试剂盒包含用于确定两种或多种基因的表达水平的试剂,所述两种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。本发明还涉及一种鉴定能够在ibd患者中诱导低风险(ibd2)表型的物质的体外方法。所述方法优选包括:提供(i)在使用目的物质治疗之前从ibd患者获得的全血样品,和(ii)在使用目的物质治疗后从ibd患者获得的全血样品,其中已经使用本发明的方法确定所述ibd患者具有高风险(ibd1)表型;并确定样品(i)和(ii)中选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3中的两种或多种基因的表达水平;其中相对于样品(i),在样品(ii)中arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的较低表达,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的较高表达表明所述物质能够在ibd患者中诱导低风险(ibd2)表型。本发明还提供涉及一种鉴定能够在个体中治疗ibd的物质的体外方法。所述方法优选包括:(i)使用本发明的方法鉴定具有ibd进展的高风险或低风险的个体;和(ii)比较使用目的物质治疗后和使用对照治疗后所述个体的ibd进展水平,其中与对照相比,个体中ibd进展的较低水平表明所述物质能够治疗ibd。附图简述图1显示了kaplan-meier图,比较了基于原始cd8t细胞的ibd1/ibd2组(左)和使用实施例1中描述的全血qpcr分类器预测的ibd1/ibd2组之间无治疗升级的存活率(右;分类器中包括的基因的细节参见表1)。obs:观察原始组;pred:使用全血qpcr数据预测的组;p:对数秩检验p值。cl1和cl2分别指ibd1(高风险)和ibd2(低风险)亚组。图2显示了根据qpcr分类器(表1)显示属于ibd1组的每个患者的预测概率的曲线图。空点:ibd1患者;填充点:ibd2患者。图3显示了kaplan-meier图,其显示了在85名新诊断的ibd患者的独立队列中,使用实施例2中描述的优化的全血qpcr分类器预测的ibd1/ibd2组中的无治疗升级存活率(分类器中包括的基因的细节参见表2)。如图3所示,qpcrpax1和qpcrpax2分别指亚组ibd1和ibd2。亚组ibd1相对于亚组ibd2的风险比为3.52。图4显示了kaplan-meier图,比较了使用wo2010/084312中描述的基因表达特征预测的ibd1/ibd2组之间的无治疗升级存活率。p:对数秩检验p值。cl1和cl2分别指代ibd1和ibd2亚组。发明详述如上所述,本发明人已经通过分析从个体获得的全血样品中的基因表达,例如通过实时定量pcr(rt-qpcr),鉴定了可用于评估个体是否处于ibd进展的高风险或低风险的基因表达特征。具体地,本发明人发现高风险(ibd1)表型的特征在于,相对于具有低风险(ibd2)表型的个体中这些基因的表达水平,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达上调,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的表达下调。这些基因的ncbi登录号(以及gi号)列于下表2中。如上所述,虽然先前已经描述了用于评估个体是否具有高风险(ibd1)或低风险(ibd2)表型的方法,但是这些方法不能被直接应用于全血样品,而是需要从血液样品中分离例如cd8t细胞,因此严重限制了它们的临床适用性。相反,本发明人鉴定的基因表达特征可以在全血样品中检测到,从而消除了从血液样品中分离特定细胞类型的需要,并且大大增加了采用该基因表达特征的诊断方法的临床应用。特别地,避免在基因表达分析之前分离特定细胞类型的需要降低了本发明方法的技术复杂性,并使所述方法执行起来耗时更少并且成本效益更高。本申请公开的方法,例如评估个体是否处于ibd进展的高风险或低风险的方法,因此可以包括确定选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3中的两种或多种基因的表达水平。如本发明人所鉴定的,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因代表从个体获得的全血样品中确定存在高风险(ibd1)或者低风险(ibd2)表型的前16个标记基因。确定两种或多种所述基因的表达水平预期比确定仅单一基因的表达水平更稳健。例如,确定两种或多种基因的表达水平可以允许精确确定高风险(ibd1)或低风险(ibd2)表型存在与否,即使例如一个基因的表达水平无法确定或不准确。例如,本申请公开的方法可以包括确定3种或多种、4种或多种、5种或多种、6种或多种、7种或多种、8种或多种、9种或多种、10种或多种、11种或多种、12种或多种、13种或多种、14种或多种、15种或多种、或全部16种基因的表达水平,所述基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。优选地,本申请公开的方法包括确定至少五种基因的表达水平,所述基因选自由以下基因构成的群组arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。在一个优选的实施方案中,本申请所公开的方法中可以包括确定il18rap和trgc2的表达水平。在该实施方案中,所述的方法可以任选地还包括确定1种或多种、2种或多种、3种或多种、4种或多种、5种或多种、6种或多种、7种或多种、8种或多种、9种或多种、10种或多种、11种或多种、12种或多种、13种或多种、或全部14种基因的表达水平,所述基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、hp、nudt7、gzmh、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。在另一个优选的实施方案中,本申请公开的方法可以包括确定il18rap、trgc2和trgv3的表达水平。在这个实施方案中,所述的方法可以任选地还包括确定1种或多种、2种或多种、3种或多种、4种或多种、5种或多种、6种或多种、7种或多种、8种或多种、9种或多种、10种或多种、11种或多种、12种或多种、或全部13种基因的表达水平的表达水平,所述基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、hp、nudt7、gzmh、gzmk、lgalsl、fcrl5、ifi44l、linc01136和ly96。在一个方面,本发明涉及评估个体是否处于炎症性肠病(ibd)进展的高风险或低风险的方法,所述方法包括通过确定从所述个体获得的全血样品中的两种或多种基因的表达水平来确定所述个体是否具有高风险(ibd1)或低风险(ibd2)表型,其中所述两种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。本发明的所述方法可以进一步包括通过,相对于具有ibd2表型的个体中这些基因的表达水平,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达上调,以及lgalsl、fcrl5ifi44l、linc01136、ly96和trgv3基因的表达下调来表征ibd1表型。本发明的所述方法可以进一步包括通过计算所述患者的风险评分来确定所述个体的ibd进展的风险,通过以下计算所述患者的风险分数:a)加权所选基因的测量表达水平;b)将逻辑回归模型应用于加权表达水平以确定风险分数,其中风险分数小于0.5表明ibd进展风险低,风险分数小于0.5表明ibd进展风险高,c)创建一份总结所述确定结果的报告。在本发明的某些方面,所述的方法可以包括选择被鉴定为ibd进展高风险或者低风险的个体以用于ibd治疗。本发明的所述方法可以进一步包括对被鉴定为ibd进展高风险或低风险的个体进行ibd治疗。在本发明的某些方面,使用实时定量pcr(rt-qpcr)、数字pcr、微阵列分析、全转录组鸟枪测序或直接多重基因表达分析来确定所述两种或多种基因的表达水平。在本发明的某些方面,所述方法包括:(i)提供从所述个体获得的全血样品;(ii)从所述全血样品中提取rna;(iii)将所述rna转化为cdna;和(iv)进行rt-qpcr、数字pcr或全转录组鸟枪测序,以确定所述两种或多种基因的表达水平。在某些方面,本发明涉及一种治疗个体中的ibd的方法,所述方法包括(i)鉴定所述个体为ibd进展高风险或低风险的个体,以及(ii)对个体进行ibd治疗。本发明的其他方面包括用于本发明方法的自身免疫疾病进展风险评估系统,所述系统包括用于确定两种或更多种基因的表达的工具以及一计算机,所述两种或更多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3,所述计算机被编程为根据受试者的基因表达数据计算ibd进展风险分数。所述系统可包括用于通过rt-qpcr、数字pcr、微阵列分析、全转录组鸟枪测序或直接多重基因表达分析来确定两种或多种基因的表达的工具。在某些方面,本发明涉及一种在被鉴定为ibd进展高风险或低风险的个体中治疗ibd的方法,所述的方法包括:(i)检查将所述个体分类为ibd1(ibd进展高风险)或ibd2(ibd进展低风险)的测试结果,其中所述测试确定从所述个体获得的全血样品中的两种或多种基因的表达水平,其中所述两种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3,其中,相对于在具有ibd2表型的个体中这些基因的表达水平,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达上调,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的表达下调,表明所述个体具有高风险(ibd1)表型;并且,其中,相对于在具有高风险(ibd1)表型的个体中这些基因的表达水平,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达下调,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的表达上调,表明所述个体具有低风险(ibd2)表型,以及(ii)对确定患有ibd1或ibd2表型的个体进行ibd治疗。所述方法可以进一步包括请求提供分析结果的测试,以通过rt-qpcr、数字pcr、微阵列分析、全转录组鸟枪测序或直接多重基因表达分析鉴定两种或多种基因的表达水平。在某些方面,本发明涉及一种用于评估个体是否具有高风险ibd1或低风险ibd2表型的试剂盒,所述试剂盒包含用于确定两种或多种基因的表达水平的试剂,所述两种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。其中,相对于具有ibd2表型的个体中这些基因的表达水平,ibd1表型的特征在于arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达上调,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的表达下调;并且相对于具有ibd1表型的个体中这些基因的表达水平,ibd2表型的特征在于arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达下调,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的表达上调。所述试剂盒包含通过rt-qpcr、微阵列分析、数字pcr、全转录组鸟枪测序或直接多重基因表达分析来确定所述两种或多种基因的表达水平的试剂。在本发明的某些方面,ibd为溃疡性结肠炎(uc)或克罗恩病。在某些方面,本发明涉及一种鉴定能够在ibd患者中诱导低风险(ibd2)表型的物质的体外方法,所述方法包括:提供(i)在使用目的物质治疗之前从ibd患者获得的全血样品,和(ii)在使用目的物质治疗后从ibd患者获得的全血样品,其中已经确定了所述ibd患者具有高风险(ibd1)表型;并且确定样品(i)和(ii)中选自由以下构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3中的两种或多种基因的表达水平;其中相对于样品(i),在样品(ii)中,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的较低表达,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的较高表达,表明所述物质能够在ibd患者中诱导低风险(ibd2)表型。所述的方法还包括将鉴定为能够在ibd患者中诱导低风险(ibd2)表型的物质配制成药物。在某些方面,本发明涉及一种鉴定能够在个体中治疗ibd的物质的体外方法,所述方法包括:(i)鉴定具有ibd进展的高风险或低风险的个体;以及(ii)比较使用目的物质治疗后和使用对照治疗后所述个体的ibd进展水平,其中与对照相比,个体中较低水平的ibd进展表明所述物质能够治疗ibd。所述的方法还包括将被鉴定为能够治疗ibd的物质配制成药物。在某些方面,本发明涉及一种从患者的全血样品中提供鉴定患者的选定基因表达产物阵列的方法,所述方法包括:a)从所述患者的全血样品中提供rna;b)将所述rna转化为cdna;c)将单个的cdna等分试样置于阵列上,使得所述cdna等分试样被鉴定为患者样品cdna等分试样;d)对选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组中的3种或多种基因的每个基因的单个cdna等分试样进行rt-qpcr、数字pcr或全转录组鸟枪测序,以便在所述阵列上提供rt-qpcr、数字pcr或全转录组鸟枪测序产物,从而提供一种基本上由所述3种或多种基因表达产物组成的鉴定患者的选定基因表达产物的阵列。所述方法还包括定量rt-qpcr、数字pcr或全转录组鸟枪测序产物的步骤。rt-qpcr产物可以通过使所述cdna与对所述3种或多种基因中的每一个特异的引物组接触来提供。所述的引物组包括一个正向引物、一个反向引物和一个探针引物。在一些实施方案中,4种、5种、13种、14种或者16种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。在某些方面,本发明涉及来自患者全血样品的鉴定患者的选定基因表达产物的阵列,所述阵列包括:鉴定为患者样品cdna的单个cdna等分试样,其中所述阵列的3种或多种cdna等分试样中的每一个包含rt-qpcr引物对,所述rt-qpcr引物对特异性地在所述cdna等分试样中扩增所选择的基因表达产物,其中所述阵列包含特异于3种或多种基因的引物对,所述3种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。所述的阵列可以进一步包含特异于所述3种或多种基因的rt-qpcr探针。在一些实施方案中,4种、5种、13种、14种、或者16种所述基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。在某些方面,本发明涉及一种从患者的全血样品中提供一个定量的鉴定患者的选定基因表达产物阵列的方法,所述方法包括:a)从所述患者的全血样品中提供rna;b)将所述rna转化为cdna;c)将所述cdna的等分试样置于阵列上,使得所述cdna等分试样被鉴定为患者样品cdna等分试样;d)对cdna等分试样进行rt-qpcr、数字pcr或全转录组鸟枪测序,以在所述阵列上提供rt-qpcr、数字pcr或全转录组鸟枪测序基因表达产物;以及e)并对3种或多种基因中的每一个选定基因进行基因表达产物定量,所述的3种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3;从而从患者的全血样品中提供一个定量的鉴定患者的选定基因表达产物阵列。在所述方法的某些方面,对于在所述阵列上的每一个选定基因表达产物,一个选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因构成的群组的基因的基因表达产物的量低于所述基因的对照;且一个选自由lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组的基因的基因表达产物的量高于所述基因的对照。在所述方法的另一个方面,对于在所述阵列上的每一个选定基因表达产物,一个选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因构成的群组的基因的基因产物的量高于所述基因的对照;且一个选自由lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组的基因的基因产物的量低于所述基因的对照。在一些实施方案中,4种、5种、13种、14种或者16种所述基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。在某些方面,本发明涉及一种定量的鉴定患者的选定基因表达产物的阵列,所述阵列包含患者全血样品的个体定量基因表达产物,所述定量基因表达产物由3种或多种基因的扩增cdna产物组成,所述3种或多种基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。在一些实施方案中,对于在所述阵列上的每一个选定基因表达产物,一个选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因构成的群组的基因的基因表达产物的量低于所述基因的对照;且一个选自由lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组的基因的基因表达产物的量高于所述基因的对照。在一些实施方案中,一个选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因构成的群组的基因的基因产物的量高于所述基因的对照;且一个选自由lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组的基因的基因产物的量低于所述基因的对照。在一些实施方案中,4、5、13、14或者16个所述基因选自由以下基因构成的群组:arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3。如本申请所用,术语“阵列”或“组”被定义为核酸分子库,其以允许在实验操作过程中鉴定或者定量单个核酸成员的方式被包含在或附着于一个或多个容器、基板或固体支撑物内。容器、基板或固体支撑物的非限制性实例包括一系列反应管、微阵列、多孔板(例如,16孔、32孔、48孔、96孔、384孔和1536孔板)、微流体装置和本领域熟知的其他容器、基板或固体支撑物。如本申请所用,“鉴定患者”被定义为表示标记的、贴标签的、编码的或以其他方式指示来自、源自或获自个体患者。非限制性示例包括患者姓名、患者的社会保障号、条形码、患者编号、代码、符号或其他合适的唯一标识符。如本申请所用,“基因表达产物”被定义为由特定基因的转录产生的核酸。基因表达产物的非限制性实例包括mrna转录物、由所述mrna产生或衍生的cdna和cdna片段、由所述mrna或所述cdna或cdna片段产生或衍生的dna或dna片段。基因表达产物的非限制性实例包括通过逆转录从所述mrna产生的mrna、cdna和cdna片段,以及通过使用聚合酶链式反应(pcr)、连接酶链式反应(lcr)和本领域熟知的其他核酸扩增技术扩增产生的所述mrna、cdna或其cdna片段产生或衍生的dna。如本申请所用,“基本上由......组成”被定义为任选地包含其他元素或产品,这些元素或产品不会实质上影响所要求保护的方法、测定或产品的结果、后果或读数。如本申请所用,“定量的”被定义为从患者获得的样品的基因表达产物的确定量。确定源自患者或从患者获得的样品中存在的基因表达产物的量的非限制性合适方法包括rt-qpcr、数字pcr、全转录组鸟枪测序、直接多重基因表达分析和其他本领域公知的方法。如本申请所用,“引物对”被定义为由正向和反向引物或寡核苷酸组成的两个引物或寡核苷酸,其能够通过聚合酶链式反应(pcr)扩增特定的cdna或dna序列或其片段。如本申请所用,“引物组”被定义为能够通过pcr扩增一种或多种特定cdna或dna序列或其片段的一个或多个引物对。如本申请所用,“严重疾病过程”被定义为ibd患者随时间的变化呈现出ibd发作周期变短和/或ibd疾病发作频率增加。ibd发作的特征是harveybradshaw(疾病活动)指数>5;以及(i)c反应蛋白(crp)水平>10mg/l,(ii)钙卫蛋白水平>200μg/g,或(iii)疾病活动的内窥镜证据。如本申请所用,“轻度疾病过程”被定义为ibd患者随时间的变化呈现出ibd发作周期变长和/或ibd疾病发作频率不增加。ibd发作的特征是harveybradshaw(疾病活动)指数>5;以及(i)c反应蛋白(crp)水平>10mg/l,(ii)钙卫蛋白水平>200μg/g,或(iii)疾病活动的内窥镜证据。具有高风险(ibd1)表型并因此具有ibd进展高风险的个体的特征在于,相对于具有低风险ibd2表型的个体中这些基因的表达水平,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达上调,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的表达下调。类似地,相对于具有高风险ibd1表型的个体中这些基因的表达水平,具有低风险(ibd2)表型并因此具有低ibd进展风险的个体的特征在于arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的表达下调,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的表达上调。基因的表达上调或下调可分别指所述基因的表达水平显著上调或显著下调。个体是否具有所讨论的基因的表达水平的上调或下调,可以通过任何方便的手段来确定,并且许多合适的技术是本领域已知并且在本发明中描述的。正如大多数生物标志物的情况一样,预测的准确性可能不是绝对的。因此,个体被归类为处于ibd进展的高风险或低风险。这种风险可能以多种方式表现出来。例如,一个体是否处于ibd进展的高风险或低风险,可以用术语危险率表示。此处的危险率描述了具有高风险(ibd1)或低风险(ibd2)表型的个体的ibd进展的瞬时概率。或者,ibd进展的风险可以用术语危险比(hr)表示,其中所述危险比描述了在具有高风险(ibd1)表型的个体中相对于在具有低风险(ibd2)表型的个体中发生ibd进展的概率。本发明人已经表明,相对于具有低风险(ibd2)表型的个体,具有高风险(ibd1)表型的个体就ibd进展的概率而言具有3.52的危险比(参见实施例3和图3)。在一个优选的实施方案中,具有ibd进展高风险的个体可能因此具有高于具有ibd进展低风险的个体的危险率至少2倍、至少2.5倍、至少3倍或者至少3.5倍的关于ibd进展的危险率。同样,具有ibd进展风险较低的个体可能具有低于具有ibd进展高风险个体的危险率至少2倍、至少2.5倍、至少3倍或至少3.5倍的关于ibd进展的危险率。因此,具有ibd进展高风险的个体相对于具有ibd进展低风险的个体,可能具有至少为2、至少为2.5、至少为3或至少为3.5的ibd进展的危险比。更优选地,具有ibd进展高风险的个体具有相对于具有ibd进展低风险的个体的危险率高至少3.5倍的关于ibd进展的危险率,即:具有相对于具有ibd进展低风险的个体具有至少为3.5的关于ibd进展的危险比,且具有ibd进展低风险的个体具有低于具有ibd进展高风险的个体的危险率3.5倍的关于ibd进展的危险率。可选择地,相比于具有ibd进展低风险的个体,具有ibd进展高风险的个体具有至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍、至少2.1倍、至少2.2倍、至少2.3倍、至少2.4倍、至少2.5倍、至少2.6倍、至少2.7倍、至少2.8倍、至少2.9倍、至少3倍、至少3.1倍、至少3.2倍、至少3.3倍、至少3.4倍、或至少3.5倍高的可能性经历ibd进展。同样,相比于具有ibd进展高风险的个体,具有ibd进展低风险的个体具有至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍、至少2.1倍、至少2.2倍、至少2.3倍、至少2.4倍、至少2.5倍、至少2.6倍、至少2.7倍、至少2.8倍、至少2.9倍、至少3倍、至少3.1倍、至少3.2倍、至少3.3倍、至少3.4倍、或至少3.5倍低的可能性经历ibd进展。ibd进展的可能性可以指在一年、两年、三年、四年或五年期间ibd进展的可能性。因此,具有ibd进展高风险的个体具有高于具有ibd进展低风险的个体至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、至少150%、至少160%、至少170%、至少180%、至少190%、至少200%、至少210%、至少220%、至少230%、至少240%、至少250%、至少260%、至少270%、至少280%、至少290%、至少300%、至少310%、至少320%、至少330%、至少340%、或至少350%的ibd进展可能性。同样地,具有ibd进展低风险的个体具有低于具有ibd进展高风险的个体至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、至少150%、至少160%、至少170%、至少180%、至少190%、至少200%、至少210%、至少220%、至少230%、至少240%、至少250%、至少260%、至少270%、至少280%、至少290%、至少300%、至少310%、至少320%、至少330%、至少340%、或至少350%的ibd进展可能性。ibd进展的可能性可以指在一年、两年、三年、四年或五年期间ibd进展的可能性。通过确定从个体获得的样品(即,测试样品)中的两种或多种基因的表达水平,有许多合适的方法可用于确定个体是否具有高风险(ibd1)或低风险(ibd2)表型(在本申请中也称为ibd进展风险分数),所述两种或多种基因选自由以下基因构成的群组:arrdc4,gbp5,p2ry14,vtrna1-1,il18rap,hp,nudt7,gzmh,trgc2,gzmk,lgalsl,fcrl5,ifi44l,linc01136,ly96和trgv3;其中所述样品优选为全血样品。例如,可以将从个体获得的一样品中的两种或多种基因的表达水平与一将高风险(ibd1)或低风险(ibd2)表型和所讨论的基因联系起来的数据集合进行比较,所述两种或多种基因选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组。在一个优选的实施方案中,将两种或多种基因的表达水平与从已知具有高风险(ibd1)或低风险(ibd2)表型的个体获得的所讨论的基因的表达数据相比较,所述两种或多种基因选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组,并且从所述比较中,评估是否个体处于ibd进展的高风险或低风险。所述比较可以使用线性回归模型。可选择地,通过使用基于从已知患有ibd的个体获得的所讨论的基因的基因表达数据的计算模型和合适的机器学习技术(如逻辑回归、支持向量机或基于决策树的方法),从个体中获得的样品的两种或多种基因可以用于确定个体是否具有高风险(ibd1)或低风险(ibd2)表型,所述两种或多种基因选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组。例如,所述计算模型可以基于从已知具有高风险(ibd1)或低风险(ibd2)表型的个体获得的所讨论的基因的基因表达数据。或者,所述计算模型可以基于从已知患有ibd并且已知已经历或未经历ibd进展的个体获得的所讨论的基因的基因表达数据。在另一个实施方案中,可以将样品中的两种或多种基因的表达水平与所讨论的每个基因的阈值水平进行比较,所述两种或多种基因的表达水平选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组中,所述样本优选获自个体(即测试样品)的全血样品。例如,可以使用qpcr表达数据和机器学习方法(例如逻辑回归、支持向量机或基于决策树的方法)来确定基因的合适阈值水平,以建立允许将患者最大程度地分离成离散的预后亚组ibd1和ibd2的最佳表达阈值。将选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组中的两种或多种基因的表达水平与所讨论的每个基因的阈值水平进行比较,可以指示个体是否具有高风险(ibd1)或低风险(ibd2)表型。可选择地,在从一组个体获得的样品中,每种所讨论的基因(即选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3构成的群组中的两种或多种基因)的中值表达水平可用作对照值,其中所述的组由个体组成,优选为至少100个、至少50个或至少10个没有ibd进展的个体。在这种情况下,在从个体获得的全血样品中,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2或gzmk基因的表达水平高于中值,或lgalsl、fcrl5、ifi44l、linc01136、ly96或trgv3基因的表达水平低于中值,可表明存在高风险(ibd1)表型,而在从个体获得的全血样品中,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7,gzmh,trgc2或gzmk基因的表达水平等于或低于中值,或lgalsl、fcrl5、ifi44l、linc01136、ly96或trgv3基因的表达水平等于或高于中值,可表明存在低风险(ibd2)表型。作为进一步的选择,从一组优选至少100、至少50或至少10个的个体获得的样本中的每一个所讨论的基因的中值表达水平可以用作对照,其中所述组由患有ibd进展的个体组成。在这种情况下,在从个体获得的全血样本中,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2或gzmk基因的表达水平等于或者高于中值,或lgalsl、fcrl5、ifi44l、linc01136、ly96或trgv3基因的表达水平等于或者低于中值水平,可指示存在高风险(ibd1)表型,而在从个体获得的全血样本中,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2或gzmk基因的表达水平小于中值,或lgalsl、fcrl5、ifi44l、linc01136、ly96或trgv3基因的表达水平高于中值,可表明存在低风险(ibd2)表型。作为进一步的选择,从一组优选至少100、至少50或至少10个的个体获得的样本中的每一个所讨论的基因的中值表达水平可以用作对照,其中所述组包括有ibd进展和没有ibd进展的个体。优选地,所述组包括相同数量或者基本相同数量的有ibd进展和没有ibd进展的个体。在这种情况下,在从个体获得的全血样本中,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2或gzmk基因的表达水平高于中值,或lgalsl、fcrl5、ifi44l、linc01136、ly96或trgv3基因的表达水平低于中值水平,可指示存在高风险(ibd1)表型,而在从个体获得的全血样本中,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2或gzmk基因的表达水平小于中值,或lgalsl、fcrl5、ifi44l、linc01136、ly96或trgv3基因的表达水平高于中值,可表明存在低风险(ibd2)表型。基因arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3的表达水平可以通过任何方便的方法确定,并且许多合适的技术在本领域中是已知的。例如,合适的技术包括:实时定量pcr(rt-qpcr)、数字pcr、微阵列分析、全转录组鸟枪测序(rna-seq)、直接多重基因表达分析、酶联免疫吸附测定(elisa)、蛋白质芯片、流式细胞术(例如rna的flow-fish,也称为flowrna)、质谱、western印迹和northern印迹。因此,本发明的方法可以包括将获自个体的全血样品与适于测定选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3构成的群组中的两种或更多种基因的表达水平的试剂接触,例如适用于使用rt-qpcr、数字pcr、微阵列分析、全转录组鸟枪测序、直接多重基因表达分析、elisa、蛋白质芯片、流式细胞术、质谱或western印迹确定两种或多种所述基因的表达水平的一种或多种试剂。例如,所述试剂可以是适于使用rt-qpcr、数字pcr或全转录组鸟枪测序确定一种或多种所述基因的表达水平的一对或多对核酸引物。可选择地,所述试剂可以为适于使用elisa或western印迹确定所述一种或多种基因的表达水平的抗体。优选地,通过使用rt-qpcr、数字pcr、微阵列分析、全转录组鸟枪测序或直接多重基因表达分析来确定所述基因的表达水平。最优选地,通过使用rt-qpcr确定所述基因的表达水平。rt-qpcr允许目标dna分子的扩增和同时定量。为了使用rt-qpcr分析基因表达水平,可以先分离全血样品的总mrna,并使用逆转录酶将其逆转录成cdna。例如,可以根据制造商的说明,在abiprism7900ht仪器上使用taqmangeneexpressionassays(appliedbiosystems)确定mrna水平。然后可以通过与标准曲线比较来计算转录物丰度。数字pcr是一种新的核酸检测和定量方法,为常规实时定量pcr提供了一种用于绝对定量和检测稀有等位基因的替代方法。数字pcr的工作原理是将dna或cdna样本分成许多单独的平行pcr反应;这些反应中的一些含有目标分子(阳性)而另一些则不含(阴性)。单个分子可以被扩增一百万倍或更多。在扩增过程中,使用染料标记探针的化学检测序列特异性靶标。当不存在目标序列时,没有信号累积。在pcr分析之后,使用阴性反应的比例来产生样品中目标分子数的绝对计数,而不需要标准品或内源对照。纳米流体芯片的使用提供了方便、直接的机制,以并行运行数千个pcr反应。每个孔装载样品、主混合物和assay试剂的混合物,并被单独分析以检测终点信号的存在(阳性)或不存在(阴性)。为了解释可能已接收到多于一个目标序列分子的孔,使用泊松模型应用校正因子。rna-seq使用新一代测序(ngs)在给定时刻检测和定量生物样品中的rna。制备、转录、片段化、测序、重新组装rna文库,并定量目标序列。nanostring技术使用可以直接与许多不同类型的目标核酸分子杂交的独特的颜色编码分子条形码,并提供了一种经济实惠的方法来同时分析多达800个基因的表达水平,其灵敏度与qpcr相当。rna流式荧光原位杂交采用流式细胞术,使用荧光标记的rna寡核苷酸来确定样品中目标mrna的丰度。该技术在例如porichisetal.,natcomm(2014)5:5641中有描述。该技术的优点在于它可以在不需要分离样品中存在的细胞的情况下使用。微阵列允许比较两个样品中的基因表达。首先从例如pbmc或全血中分离总rna,使用例如trizol或rneasyminikit(qiagen)。然后使用逆转录酶和polyt引物将分离的总rna逆转录成双链cdna,并使用例如cy3-或cy5-dctp标记。然后合并适当的cy3和cy5标记的样品,并与定制的点样寡核苷酸微阵列杂交,所述点样寡核苷酸微阵列包含代表合适基因和对照特征的探针,例如willcocksetal.,jexpmed205,1573-82,2008中描述的微阵列。可以使用染料交换策略将样品与来自合并的pbmc或全血样品的共同参照rna杂交,一式两份。杂交后,洗涤阵列并在例如agilentg2565b扫描仪上扫描。上述步骤的合适替代方案在本领域中是公知的,并且对于技术人员是显而易见的。如果适用的话,然后可以使用合适的方法分析获得的原始微阵列数据,以确定基因arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3的相对表达。酶联免疫吸附测定(elisa)允许检测样品中存在的蛋白质的相对量。首先将样品直接或通过对目的蛋白质特异的抗体固定在固体支持物例如聚苯乙烯微量滴定板上。固定后,使用对目标蛋白特异的抗体检测抗原。可以标记用于检测目标蛋白的第一抗体以允许检测,或者可以使用适当标记的第二抗体来检测第一抗体。例如,可以通过将抗体与报告酶偶联来标记抗体。在这种情况下,该制得的板通过添加合适的酶底物以产生可见信号。信号的强度取决于样品中存在的目标蛋白的量。蛋白质芯片,也称为蛋白质阵列或蛋白质微阵列,允许检测样品中存在的蛋白质的相对量。可以将不同的捕获分子固定到芯片上。实例包括抗体、抗原、酶底物、核苷酸和其他蛋白质。蛋白质芯片还可含有与一系列蛋白质结合的分子。蛋白质芯片在本领域中是公知的,并且许多不同的蛋白质芯片是可商购的。western印迹也允许测定样品中存在的蛋白质的相对量。首先使用凝胶电泳分离样品中存在的蛋白质。然后将蛋白质转移到膜例如,硝酸纤维素膜或pvdf膜上,并使用对目标蛋白特异的单克隆或多克隆抗体进行检测。许多不同的抗体是可商购的,并且在本领域中已经很好地建立了制备针对给定目标蛋白的抗体的方法。为了允许检测,对目的蛋白质或合适的第二抗体特异的抗体可以例如与报告酶连接,该报告酶引发比色反应,并且暴露于合适的底物时产生颜色。其他报告酶包括辣根过氧化物酶,当提供合适的底物时,其产生化学发光。抗体也可以用合适的放射性或荧光标记物标记。根据所用的标记,可以使用光密度测定法、分光光度法、照相胶片、x射线胶片或光传感器测定蛋白质水平。流式细胞术允许测定存在于例从待测患者中获得的pbmc或全血样品的蛋白质的相对量。流式细胞术也可用于检测或测量细胞表面上目的蛋白质的表达水平。使用流式细胞术检测蛋白质和细胞通常包括首先将荧光标记附着到目的蛋白质或细胞上。所述荧光标记可以是,例如对目的蛋白质或细胞特异的荧光标记的抗体。许多不同的抗体是可商购的,并且在本领域中已经很好地建立了制备对目的蛋白质特异的抗体的方法。质谱法,例如基质辅助激光解吸/电离(maldi)质谱法,允许例如使用肽质谱指纹从个体获得的样品中检测到蛋白质的存在。在质谱法之前,可以使用凝胶电泳例如,sds-page、尺寸排阻色谱或双向凝胶电泳分离样品中存在的蛋白质。还公开了用于评估个体是否具有高风险(ibd1)或低风险(ibd2)表型,或用于评估从个体获得的全血样品中是否存在高风险(ibd1)或低风险(ibd2)表型的试剂盒。所述试剂盒可包含用于确定选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组中的两种或多种基因的表达水平的试剂。这些基因的ncbi登录号(以及gi编号)列于表2中。所述试剂盒可包含用于确定选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组中的3种或多种、4种或多种、5种或多种、6种或多种、7种或多种、8种或多种、9种或多种、10种或多种、11种或多种、12种或多种、13种或多种、14种或多种、15种或多种、或全部16种基因的表达水平的试剂。优选地,所述试剂盒包含用于确定选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组的至少五种基因的表达水平的试剂。在一个优选的实施方案中,所述的试剂盒包括用于确定il18rap和trgc2表达水平的试剂,以及任选地用于确定选自由arrdc4、gbp5、p2ry14、vtrna1-1、hp、nudt7、gzmh、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组中的1种或多种、2种或多种、3种或多种、4种或多种、5种或多种、6种或多种、7种或多种、8种或多种、9种或多种、10种或多种、11种或多种、12种或多种、13种或多种、或全部14种基因的表达水平的试剂。在进一步优选的实施方案中,所述的试剂盒包含用于确定il18rap、trgc2和trgv3表达水平的试剂,以及任选地用于确定选自由arrdc4、gbp5、p2ry14、vtrna1-1、hp、nudt7、gzmh、gzmk、lgalsl、fcrl5、ifi44l、linc01136和ly96基因构成的群组中的1种或多种、2种或多种、3种或多种、4种或多种、5种或多种、6种或多种、7种或多种、8种或多种、9种或多种、10种或多种、11种或多种、12种或多种、或全部13种基因的表达水平的试剂。例如,所述的试剂可以为适于使用本申请所述的任何技术,例如rt-qpcr、数字pcr、微阵列分析、全转录组鸟枪测序或直接多重基因表达分析确定所讨论的基因的表达的试剂。例如,所述试剂盒可以包括适于使用,例如t-qpcr、数字pcr、微阵列分析、全转录组鸟枪测序或直接多重基因表达分析确定所讨论的基因的表达的引物。合适引物的设计是常规的,且在技术人员的能力范围之内。用于直接多重基因表达分析的试剂盒还可以或者选择性地包括用于确定所讨论的基因的表达的荧光探针。除检测试剂外,所述的试剂盒还可以包括rna提取试剂盒/或用于将rna逆转录为cdna的试剂。试剂盒还可以包括用于实现所述方法的一种或者多种制品和/或试剂,例如缓冲液、和/或获得测试样品本身的装置,例如用于获得和/或分离样品的装置,以及处理样品的容器(这些部件通常是无菌的)。所述试剂盒可以包括在评估个体是否具有高风险(ibd1)或低风险(ibd2)表型、或者全血样本中是否存在高风险(ibd1)或低风险(ibd2)表型的方法中使用该试剂盒的说明。本发明的主要优点是本发明人鉴定的基因的表达水平可以在从个体获得的全血样品中测定,以评估个体是否具有高风险(ibd1)或低风险(ibd2)表型。因此,在本发明的上下文中提到的样品优选是全血样品。术语全血样品、外周血样品和外周全血样品在本申请中可互换使用。全血样品是指血液样品,例如从个体中获得的外周血及其全部成分的。因此,本申请所用的术语“全血样品”不包括(a)从全血分离的特定血细胞类型的样品,例如现有技术的方法中所用的分离的外周血单核细胞(pbmc)或分离的t细胞,例如分离的cd8+或cd4+t细胞。可以在样品收集后对所述全血样品进行处理,例如细胞裂解和/或添加一种或多种酶抑制剂以抑制全血样品中的rna降解。尽管本发明涉及一种通过测定从个体获得的全血样本(而非pbmc样本)中的两种或者多种基因的表达水平来确定所述个体是否处于ibd进展高风险或者低风险的方法,然而可以预期确定从个体获得的pbmc样品中的由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3构成的群组中的两种或多种基因的表达水平,可以同样被用于评估所述个体是否处于高风险或低ibd进展风险中。但是,这并没有要求专利权保护。术语“个体”是指人类个体。个体也可以称为患者,即人类患者。在本发明的上下文中,除非上下文另有规定,所述个体患有ibd。优选地,所述个体已被诊断患有ibd。由于ibd的特征是严重症状期(突然发作)和缓解期,所述个体可能正在经历ibd的发作或ibd正在缓解。ibd是指以肠道炎症为特征的一组病症。ibd的症状可包括腹痛、反复或血性腹泻、食欲不振和体重减轻、疲倦和疲乏,以及贫血。ibd的两种主要类型是溃疡性结肠炎(uc)和克罗恩病(cd)。其他类型包括胶原性结肠炎和淋巴细胞性结肠炎。仅在英国,uc和克罗恩病就影响了超过300,000人。溃疡性结肠炎主要影响结肠和直肠,而克罗恩病影响小肠和大肠,也可影响口腔、食道、胃和肛门。uc和克罗恩病是慢性病,其特征在于严重症状(疾病发作)期和缓解期。两种疾病均无法治愈,但可以采取治疗方法,包括抗炎和免疫抑制治疗、以及手术治疗。“ibd进展”是指在个体中初始出现疾病后ibd的进展。ibd,包括uc和克罗恩病,其特征在于疾病的复发。这些复发也被称为突然发作。因此,ibd进展可以指在疾病的初始出现后ibd的复发或突然发作。特别地,ibd进展可以指在疾病的初始出现后ibd的高频率复发或突然发作。本发明人发现,在实施例3中鉴定为属于ibd1和ibd2亚组的个体,在疾病初始呈现后的12个月期间,分别具有平均0.66和0.34的ibd复发或突然发作。因此,高频率的复发或突然发作可以是指疾病初始出现后的12个月期间或在疾病初始出现的12个月内,平均0.5或更多、或0.6或更多,优选平均0.6或更多的复发或突然发作。复发或突发可以为需要增加治疗的事件,例如增加免疫抑制或抗炎治疗或手术。这种对于增加治疗的要求也可称为治疗升级。如果不治疗,或者治疗不当,复发或突然发作可能导致肠道损伤或破坏。因此,ibd进展的高风险可能是指个体在疾病初始出现后将经历疾病复发或突然发作的高风险,特别是在疾病初始出现后12个月内,个体平均经历0.6次或更多次复发或突然发作的高风险,而ibd进展的低风险可能是指个体在疾病初始出现后会经历复发或突然发作的低风险,特别是个体在初始出现该疾病后的12个月期间将经历平均0.6次或更多次的复发或突然发作的低风险。疾病复发或突然发作的诊断完全在本领域技术人员的能力范围内。例如,个体中ibd的复发或突然发作可以通过harveybradshaw(疾病活动)指数>5来表征;以及(i)c反应蛋白(crp)水平>10mg/l,(ii)钙卫蛋白水平>200μg/g,或(iii)疾病活动的内窥镜证据;并且所述个体在先前疾病突然发作之后已经达到缓解。crp是肝脏产生的炎症的血液标记物。炎症事件期间水平上升。crp水平通常在从个体获得的血液样品中测量,而钙卫蛋白水平通常在粪便样品中测量。所述harveybradshaw(疾病活动)指数通常测量以下参数:(i)总体幸福感(0=非常好,1=略低于平均水平,2=差,3=非常差,4=很糟)(ii)腹痛(0=无,1=轻度,2=中度,3=严重)(iii)每天的液体粪便次数(iv)腹部肿块(0=无,1=可疑,2=确定,3=触痛)(v)并发症的存在(每存在一个并发症记为一分):关节痛、葡萄膜炎、结节性红斑、口疮性溃疡、坏疽性脓皮病、肛裂、新型瘘管、脓肿。harveybradshaw指数得分>5表明存在轻度至重度疾病。已知的ibd治疗包括抗炎疗法、免疫抑制疗法和外科手术。抗炎疗法的实例包括用类固醇(例如皮质类固醇,如泼尼松龙或布地奈德)和/或美沙拉嗪治疗。免疫抑制疗法的实例包括用tnfα抑制剂(例如英夫利昔单抗)、硫唑嘌呤、甲氨蝶呤和/或6-巯嘌呤处理。治疗可指治疗进行中的疾病,旨在管理疾病(也称为维持治疗),以及治疗复发或突然发作的疾病。标准的“递进式”治疗涉及仅在响应于持续的疾病突然发作,或疾病未能对初始治疗作出反应时的逐步升级治疗。例如,疾病的初始突然发作(已进行诊断)将用抗炎类固醇(如泼尼松龙)或消炎药[如美沙拉嗪(例如在uc中)]治疗,但不会着手维持治疗。如果随后发生突然发作,则重复该治疗,然后还加入维持治疗(例如用硫唑嘌呤、甲氨蝶呤或6-巯基嘌呤治疗)。尽管进行了这种维持治疗,如果疾病继续发作,则可以加入更强的维持治疗,例如用tnfα抑制剂(英夫利昔单抗或阿达木单抗)治疗。这种治疗策略可以防止过度治疗——仅通过逐步升级的治疗来应对疾病控制的不充分——但当这些治疗最终无法有效控制疾病时,有可能将患有更多进展性疾病的患者暴露于严重的疾病相关并发症。如上所述,已经发现,与标准的递进式疗法相比,在ibd中早期引入侵袭性疗法带来更好的结果。具体而言,最初使用皮质类固醇治疗大多数患有活动性克罗恩病的患者。尽管这种方法通常控制症状,但许多患者对皮质类固醇具有抗性或依赖性,长期接触皮质类固醇会增加死亡风险。早期使用英夫利昔单抗和硫唑嘌呤联合免疫抑制疗法与常规疾病管理的比较表明,联合免疫抑制治疗比传统疾病管理更有效,可诱导缓解并减少最近被诊断患有克罗恩病的患者使用皮质类固醇。因此,在疾病早期开始更强化的治疗可以为ibd患者带来更好的结果(d’haensetal.,2008;colombeletal.,2010)。特别是,早期联合免疫抑制疗法(d’haensetal.,2008)治疗的克罗恩病患者经历更长时间的无类固醇缓解,更有可能实现粘膜愈合,并最终避免手术切除(d’haensetal.,2008;colombeletal.,2010)。然而,这种策略并不适合所有克罗恩病患者,因为即使使用常规皮质类固醇治疗,一部分患者也会实现长期缓解(jess等,2007),因此他们使用联合免疫抑制疗法的治疗会使他们暴露于不必要的副作用和毒性。由本发明人鉴定的全血基因分类手段预测ibd包括克罗恩病和溃疡性结肠炎的疾病过程。具体而言,ibd1亚组的患者复发或疾病突然发作的发生率显著较高,导致不仅需要早期治疗升级,而且每单位随访时间的升级治疗也需要更多(与ibd2组患者相比)。这种疾病的复发或突然发作的模式与相当高的发病率相关,因此ibd1亚组中的患者最有可能受益于早期侵袭性疗法,例如使用tnfα抑制剂。因此,被鉴定处于ibd进展高风险的患者可以采用比疾病进程早期通常给予的疗法更为侵袭性的疗法,例如“自上而下”的方法,其中,在诊断时使用tnfα抑制剂,例如英夫利昔单抗,与硫唑嘌呤、甲氨蝶呤或6-巯嘌呤联合治疗,随后复发或突然发作额外给予抗炎类固醇如泼尼松龙,增加tnfα抑制剂的给药,或者,例如,用抗整合素抗体治疗。在被鉴定为处于ibd进展高风险的个体的情况中,治疗因此可以包括用更频繁或更具侵袭性的疾病治疗方案,或在ibd的维持阶段不常用的疾病方案来治疗个体或者选择个体进行治疗。更频繁或更具侵袭性的疾病治疗方案可以指比ibd维持期期间通常施用的治疗更频繁或更强烈的疾病治疗方案。更具侵袭性的疾病治疗方案的实例是,例如在诊断时,用一种或多种免疫抑制剂治疗,例如用tnfα抑制剂,如英夫利昔单抗与硫唑嘌呤、6-巯嘌呤或甲氨蝶呤联合治疗。在被鉴定为ibd进展风险低的个体的情况中,治疗可包括用上述标准的递进式治疗方法治疗或选择个体进行治疗。所述标准的递进式治疗方法避免了对这些患者的不必要的过度治疗。因此,被鉴定处于ibd进展风险低的个体,可以在疾病初始出现时使用炎性类固醇例如泼尼松龙,或者抗炎药如美沙拉嗪治疗治疗或者选择其进行治疗。所述疾病随后的复发或突然发作时,可以使用炎性类固醇例如泼尼松龙,或抗炎药例如美沙拉秦,同时给予维持治疗,例如硫唑嘌呤、甲氨蝶呤或6-巯嘌呤治疗联合治疗。所述疾病的进一步复发或突然发作,可以用炎性类固醇例如泼尼松龙,或抗炎药例如美沙拉秦与tnfα抑制剂(例如英夫利昔单抗或阿达木单抗)联用作为维持治疗。本发明的所述方法涉及使用从一个或多个个体获得的全血样品,因此是体外方法。本发明提供了一种体外方法,包括确定从个体获得的全血样品中两种或多种基因的表达水平,所述两种或多种基因选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组。本发明的方法预期可应用于鉴定能够治疗个体ibd的物质的方法,例如临床试验。在这种方法中涉及的个体可能处于ibd进展的高风险或低风险,优选地,所述个体处于ibd进展的高风险中。处于ibd进展高风险的个体预期比ibd进展风险低的个体经历更频繁的疾病复发或突然发作,因此更容易评估推定治疗的效力,例如,减少这种突然发作或复发的频率和/或严重程度。鉴定能够治疗个体中ibd物质的方法,优选体外方法,可以包括:(i)使用本发明的方法鉴定处于ibd进展的高风险或低风险的个体,优选具有ibd进展的高风险的个体;和(ii)将所述个体中ibd进展的水平与对照比较,其中所述个体已经用目的物质进行治疗。与对照相比,所述个体中较低水平的ibd进展表明该物质能够治疗ibd。较低水平的ibd进展可以指与对照相比ibd突然发作或复发的频率和/或严重性降低。所述方法可以进一步包括在上述方法中的步骤(i)之后和步骤(ii)之前使用目的物质对所述个体进行治疗的步骤。所述对照可以是在未用目的物质处理的个体或个体组中观察到的ibd进展水平,该个体或个体组使用例如本发明的所述方法鉴定为处于ibd进展高风险或低风险,优选高风险。鉴定能够治疗个体中ibd物质的方法因此可以包括:(i)使用本发明的方法鉴定处于ibd进展高风险或者低风险,优选处于ibd进展的高风险的第一个个体;(ii)使用本发明的方法鉴定处于ibd进展高风险或者低风险,优选处于ibd进展的高风险的第二个个体;以及(iii)比较所述第一个个体的ibd进展水平与所述第二个个体的ibd进展水平,其中,所述第一个个体已经使用目的物质进行治疗,且相比于所述第二个个体,所述第一个个体中较低水平的ibd进展表明所述物质能够治疗ibd。所述方法可以任选地进一步包括在步骤(i)之后但在步骤(iii)之前用目的物质处理所述第一个体的步骤。本发明的所述方法还预期可用于鉴定能够在ibd患者中诱导低风险(ibd2)表型的物质的方法中。在这种方法涉及的患者处于ibd进展的高风险。具体地,本发明提供了一种鉴定能够在ibd患者中诱导低风险(ibd2)表型的物质的方法,优选体外方法,所述方法包括:提供(i)在使用目的物质治疗之前从ibd患者获得的全血样品,和(ii)在使用目的物质治疗后从ibd患者获得的全血样品,其中已经使用根据本发明的方法确定了所述ibd患者具有高风险(ibd1)表型;和确定样品(i)和(ii)中选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组中的两种或多种基因的表达水平;其中相对于样品(i),在样品(ii)中,arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2和gzmk基因的较低表达,以及lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因的较高表达,表明所述物质能够在ibd患者中诱导低风险(ibd2)表型。被鉴定为能够在ibd患者中治疗ibd或诱导低风险(ibd2)表型的物质可以进一步被配制成药物。除了所述物质之外,这种药物可以包括,例如药学上可接受的赋形剂。鉴于本公开包括以下实验例证,本发明的其它方面和实施方案对于本领域技术人员而言是显而易见的。本说明书中提及的所有文献均通过引用整体并入本文。在此使用的“和/或”,将被视为两个指定特征或组分中的每一个与另一个或者单独地具体公开。例如,“a和/或b”将被视为(i)a,(ii)b和(iii)a和b中的每一个的具体公开,就像每一个在本申请中单独列出一样。除非上下文另有指示,否则上述特征的描述和定义不限于本发明的任何特定方面或实施例,并且同样适用于所描述的所有方面和实施例。现在将通过示例并参考上述附图说明来说明本发明的某些方面和实施例。具体实施方式实施例1鉴定全血中的ibd1/ibd2基因标记材料和方法患者招募以构建基因表达谱在开始治疗之前招募了69名患有活动性克罗恩病(cd)(n=39)和溃疡性结肠炎(uc)(n=30)的患者,随后如(leeetal.,2011)中所述收集后续数据。这项工作获得了剑桥郡地区伦理委员会的伦理认可(rec08/h0306/21)。所有参与者均提供了书面知情同意。cd8+t细胞样品根据(lyonsetal.,2007)中描述的方法,从69名患者中获得的血液样品中阳性选择cd8+t细胞,并且如前所述(leeetal.,2011),根据制造商的说明使用rneasyminikits(qiagen)提取rna。全血样本从69名患者中收集2.5ml全血至rneasymini或paxgenebloodrnatubeivd(qiagen),以立即固定rna(rainenetal.,2002)。根据制造商的说明储存收集的样品,随后使用paxgenebloodrnakitivd(qiagen)提取rna。rna定量分别使用nanodrop1000分光光度计(thermoscientific)和agilent2100生物分析仪(agilenttechnologies)测定rna的数量和质量。全血基因表达谱处理200ng总rna并将其与affymetrixhumangenest1.0微阵列(cd8+rna样品)或affymetrixhumangenest2.0(全血rna样品)杂交,然后根据制造商的说明洗涤和扫描。微阵列数据处理使用bioconductor(huberetal.,2015)中的preprocesscore包(bolstad,2013)在r中处理微阵列原始数据。简而言之,使用清单4.1中报告的代码对原始数据进行背景校正、分位数归一化和汇总。使用arrayqualitymetrics包(kauffmannetal.,2009)评估潜在异常值的存在。使用combat(johnsonetal.,2007)进行批量校正。重要的是,关于个体样品的ibd1/ibd2成员的信息,没有纳入批量校正程序,以避免通过留一交叉验证在泛化误差估计中出现任何向下偏差。仅保留检测表达的转录物的探针组(定义为在至少75%的样品中显示log2表达信号>7.0的探针组)。从数据集中移除未表达的探针组和没有注释的探针组,留下12,874个探针组用于全血基因表达数据集。定量pcr根据制造商的说明书,在rochelightcycler480实时pcr仪器上使用taqmanexpressionassays(lifetechnologies)测定候选基因和3种参照基因的mrna水平。优化pcr条件以最小化板内和板间变化。使用δδct方法(livaketal.,2001)计算转录本丰度。将cdna样品加入到每个平板中,并用作校准物,所述cdna样品来源于从健康个体的全血中提取、合并的rna。每次测量重复三次,并且在最终分析中使用三次技术重复的中值。基于cd8+t细胞基因表达数据进行ibd1/ibd2患者分类为了将ibd1(不良预后)或ibd2(良好预后)状态分配给69名患者,将来自患者的cd8+t细胞样品的归一化表达数据与来自发明人现有ibd患者群组的数据合并。然后如leeetal.,2011中所描述的,使用合并数据集的一致聚类将该群组分层到两个先前鉴定的预后组中。ibd1亚组的患者具有显著较高的复发或疾病突发的发生率,其特征不仅在于早期需要治疗升级,而且每单位时间随访还需要更多治疗升级(与ibd2组中的患者相比)。基于全血基因表达数据的ibd1/ibd2患者分类同时,还产生了来自69名ibd患者的全血基因表达数据的数据集。通过将具有自适应弹性网络正则化的逻辑回归模型应用于全血基因表达数据集,以选择基于全血基因表达数据将患者分层为两个预后组(ibd1和ibd2)所需的许多基因。用实时pcr试验检测所选择的候选基因和几个密切相关的基因。对每个候选基因以及10个不变的参照基因进行taqman实时pcr测定。将弹性网络正则回归模型应用于实时pcr数据,以确定由一个由15种基因组成的最佳模型,该模型能够将69名ibd患者的队列分为两个原始预后组,ibd1和ibd2(ppv=0.87,npv=0.94,灵敏度0.94,特异性0.85;图1和2)。无论是无升级生存率(p=0.0074)还是随时间升级的数量[p=0.0003,平均治疗升级次数:1.62(ibd1),0.70)(ibd2)],ibd1和ibd2亚组也表现出与疾病过程的等效关联。表1列出了15种基因。表1序号基因符号基因名称1arrdc4抑制蛋白结构域蛋白42gbp5鸟苷酸结合蛋白53p2ry14g蛋白偶联嘌呤能受体p2y144vtrna1-1穹窿体rna1-15il18rap白细胞介素18受体辅助蛋白6hp结合珠蛋白7nudt7nudix(核苷二磷酸连接部分x)-型基序78gzmh颗粒酶h9trgc2/tarp/trgjit细胞受体γ恒定区2/t细胞受体γ连接110znf493锌指蛋白49311lgalsl半乳糖苷结合样凝集素12fcrl5fc受体样513ifi44l干扰素诱导蛋白44样蛋白14linc01136长基因间非蛋白编码rna113615ly96淋巴细胞抗原96实施例2用于rt-qpcr分析的全血分类器的优化使用实时qpcr测定开发实施例1中鉴定的基因,优化并最终确定全血分类器的最终含量(16个信息基因和2个参照基因)。形成该分类器一部分的信息基因列于下表2中。例如wo2010/084312中所述的,通过使用例如rt-qpcr等方法在全血中的可检测性,使用该全血基因分类器对患者分层将比在确定基因表达之前需要分离特定细胞类型的测试更简单且更具成本效益。此外,全血基因分类器预计将具有广泛的医疗保健福利,包括直接导致ibd管理的重大改进;使患有侵袭性疾病的患者能够从诊断中获得适当有效的治疗,同时确保患有无痛性疾病的患者不会暴露于不必要的免疫抑制的风险和副作用。这将有望通过降低治疗毒性和减少疾病并发症和医疗保健成本来改善临床结果。全血基因分类器也有望有助于基于疾病发作的可能性预先选择患者用于临床试验,从而将预防或治疗试验所需的患者数量减少2至3倍。表2实施例3基于qpcr的全血测定的独立验证然后使用来自英国四个地点(剑桥、诺丁汉、埃克塞特和伦敦)的85名新诊断的ibd患者的第二个独立的队列,对实施例2中鉴定的16基因分类器的预后性能进行独立验证。使用实施例2中开发的基于qpcr的测试分析全血基因表达,再现了具有ibd1/ibd2危险比为3.52(95%置信区间[ci]:1.84-6.76,p=0.0002,图3)的发现队列中观察到的预后分层。与基于体外诊断测试的现有基因表达相比,上述的性能更好。例如,预测乳腺癌复发的基因表达诊断oncotypedx的危险比为2.81(95%ci:1.704.64)(paiketal.,nejm,2004)。实施例4最小的基因分类器为了确定实施例2中开发的优化全血分类器将患者分层为两个预后组ibd1和ibd2所需的基因的最小数量,发明人对实施例2中鉴定的16种基因的所有可能组合进行了详尽的计算分析,以确定可用于将ibd患者准确分层为ibd1和ibd2亚组的最小基因数。对于n个基因的每种可能组合(1<=n<=16),将l2正则化逻辑回归模型拟合至相关qpcr基因表达数据,并如实施例1中所述,评估每种模型的相关预测性能。下表3中列出的结果显示,选自实施例2中鉴定的优化的16基因全血分类器的少至两个基因的全血基因表达数据可用于将ibd患者准确地分层为ibd1和ibd2亚组。具体而言,测量从ibd患者获得的全血样本中基因il18rap和trgc2的表达足以将患者分层为ibd1和ibd2亚组,精确度为0.71(敏感性:0.73;特异性:0.69;ppv:0.69;npv:0.74)。类似地,选自实施例2中开发的优化全血分类器的三种基因的全血基因表达数据被证实适合于将ibd患者准确分层为ibd1和ibd2亚组。例如,测量从ibd患者获得的全血样品中基因il18rap、trgc2和trgv3的表达足以将患者分为ibd1和ibd2亚组,精确度为0.74(敏感性:0.74;特异性:0.74;ppv:0.74;npv:0.74)。对表2中列出的基因的4、5、6、7、8、9、10、11、12、13、14和15个基因的组合进行了类似测试,发现其适合于将ibd患者分层为ibd1和ibd2亚组,精确度为0.7或以上,如表3所示。必须注意的是,对于每个测试的基因数量,表3仅报告了能够将ibd患者最佳分层为ibd1和ibd2亚组的基因组合。例如,表3中仅显示了允许ibd患者最佳分层为ibd1和ibd2亚组的四种基因的组合。然而,选自实施例2中鉴定的16种基因分类的四种基因的其他组合也适用于将ibd患者分为ibd1和ibd2亚组,精确度为0.7或以上。测量从ibd患者获得的全血样品中所有16个基因的表达将患者分层为ibd1和ibd2亚组,精确度为0.971(ppv=1.000;npv=0.941;灵敏度:0.946;特异性:1.000)。表3对比实施例5本发明人测试了先前在wo2010/084312中描述的基因表达特征的能力,以如实施例1中所述,基于全血基因表达数据,将患者正确分层为高风险ibd1和低风险ibd2亚组。如相关图下方报告的对数秩检验p值所示(见图4),在全血中测量wo2010/084312的表1或2中公开的基因,或wo2010/084312中描述的基因kat2b、ankrd32和znf26,或itga2、ptpn22和notch1的表达,不能将ibd患者准确分类为ibd1和ibd2亚组。这些结果表明,当在全血中测量基因表达时,wo2010/084312中公开的基因特征不适于评估个体是否处于ibd进展的高风险或低风险。实施例6使用3种、4种、5种、13种、14种和16种基因模型进行患者分类本发明的所述方法将患者分层为具有ibd进展风险高或低的患者,需要在收集管中收集仅2.5ml的全血以利于rna材料的稳定性并且可以在国际上发布(因为rna在室温下可保持稳定长达3天)。该测定在48小时内返回快速结果,并在开始治疗之前通过定量rt-pcr测量基因表达以用于患者诊断。每次rt-pcr测量的结果依赖于一种算法,该算法应用特定权重来返回结果预测(ibd进展的高/低风险),其中高风险结果组和低风险结果组之间的有效比值比为3.5。使用3种、4种、5种、13种、14种和16种基因模型进行患者分类为确定其可能的疾病病程,患者429和483在血液rna管中提供血液样本。在rna提取和cdna合成后,使用rochelightcycler480(ct,表4)通过定量pcr测定16个信息基因(arrdc4、fcrl5、gbp5、gzmh、gzmk、hp、ifi44l、il18rap、lgalsl、linc01136、ly96、nudt7、p2ry14、trgc2、trgv3和vtrna1-1)和2个参照基因(rna18s5和cdv3)的表达水平。原始数据通过从每个信息基因(dct,表4)中减去2个参照基因的平均值来标准化,然后通过均值中心化(dct',表4)来标准化。通过使用3基因模型[方程式(1)]、4种基因模型[方程式(2)]、5种基因模型[方程式(3)]、13基因模型[方程式(4)]、14基因模型[方程式(1)]和16基因模型[方程式(1)]将以下逻辑回归模型应用于标准化基因表达数据,可以确定经历轻度疾病(ibd进展低风险)的患者的风险分数,以概率(p)表示。logit(p严重)=β0+β1(il18rap)+β2(trgc2)+β3(trgv3)(1)logit(p严重)=β0+β1(il18rap)+β2(linc01136)+β3(trgc2)+β4(vtrna1-1)(2)logit(p严重)=β0+β1(il18rap)+β2(linc01136)+β3(trgc2)+β4(trgv3)+β5(vtrna1-1)(3)logit(p严重)=β0+β1(arrdc4)+β2(fcrl5)+β3(gbp5)+β4(gzmh)+β5(hp)+β6(ifi44l)+β7(il18rap)+β8(lgalsl)+β9(linc01136)+β10(ly96)+β11(p2ry14)+β12(trgv3)+β13(vtrna1-1)(4)logit(p严重)=β0+β1(fcrl5)+β3(gbp5)+β4(gzmk)+β5(hp)+β6(ifi44l)+β7(il18rap)+β8(lgalsl)+β9(linc01136)+β10(ly96)+β11(nudt7)+β12(p2ry14)+β13(trgc2)+β14(trgv3)(5)logit(p严重)=β0+β1(arrdc4)+β2(fcrl5)+β3(gbp5)+β4(gzmh)+β5(gzmk)+β6(hp)+β7(ifi44l)+β8(il18rap)+β9(lgalsl)+β10(linc01136)+β11(ly96)+β12(nudt7)+β13(p2ry14)+β14(trgc2)+β15(trgv3)+β16(vtrna1-1)(6)然后将-60~60、-30~30或-10~10的个体权重应用于模型中每个基因的标准化基因表达数据。用于每种测定的个体权重(β)如表5所示。3基因模型重新排列方程式(1)患者429遵循严重疾病过程的概率由下式给出:p严重=0.24,由于p严重<0.5,预计患者429将遵循轻度疾病过程。同样地,对于患者483,p严重=0.45,由于p严重<0.5,预计患者483将遵循轻度疾病过程。4基因模型重新排列方程式(2)患者429遵循严重疾病过程的概率由下式给出:p严重=0.13,由于p严重<0.5,预计患者429将遵循轻度疾病过程。同样地,对于患者483,p严重=0.73,由于p严重>0.5,预计患者483将遵循重度疾病过程。5基因模型重新排列方程式(3)患者429遵循严重疾病过程的概率由下式给出:p严重=0.35,由于p严重<0.5,预计患者429将遵循轻度疾病过程。同样地,对于患者483,p严重=0.55,由于p严重>0.5,预计患者483将遵循重度疾病过程(ibd进展高风险)。13基因模型重新排列方程式(4)患者429遵循严重疾病过程的概率由下式给出:p严重=0.058,由于p严重<0.5,预计患者429将遵循轻度疾病过程。同样地,对于患者483,p严重=1,由于p严重>0.5,预计患者483将遵循重度疾病过程(ibd进展高风险)。14基因模型重新排列方程式(5)患者429遵循严重疾病过程的概率由下式给出:p严重=0.201,由于p严重<0.5,预计患者429将遵循轻度疾病过程。同样地,对于患者483,p严重=0.98,由于p严重>0.5,预计患者483将遵循重度疾病过程(ibd进展高风险)。16基因模型重新排列方程式(6)患者429遵循严重疾病过程的概率由下式给出:p严重=0.008,由于p严重<0.5,预计患者429将遵循轻度疾病过程。同样地,对于患者483,p严重=1,由于p严重>0.5,预计患者483将遵循重度疾病过程。以上非限制性实例举例说明了本发明的一个实施方案,该实施方案应用于选自由arrdc4、gbp5、p2ry14、vtrna1-1、il18rap、hp、nudt7、gzmh、trgc2、gzmk、lgalsl、fcrl5、ifi44l、linc01136、ly96和trgv3基因构成的群组中的3种、4种、5种、13种、14种和16种基因。然而,本领域技术人员可以容易地将所述方法适用于选自由arrdc4,gbp5,p2ry14,vtrna1-1,il18rap,hp,nudt7,gzmh,trgc2,gzmk,lgalsl,fcrl5,ifi44l,linc01136,ly96和trgv3基因构成的群组中2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种或者16种基因。方法rna提取将获自受试者的血液样品在管(paxgenebloodrnakit,目录号762164,bdbiosciences,sanjose,ca)中于室温(15~25℃)下孵育3小时。然后将含有样品的试管以4,000×g离心10分钟,从管中倾出上清液并弃去。倾析上清液后,使用新的二级bdhemogardtm(paxgenebloodrnakit,bdbiosciences,sanjose,ca)封闭物将管封闭。然后将管涡旋直至颗粒明显溶解并以4,000×g离心10分钟。离心后,用移液管取出全部上清液并丢弃。然后加入350μl重悬浮缓冲液br1(paxgenebloodrnakit,bdbiosciences,sanjose,ca)并涡旋该管直至沉淀物明显溶解。然后将样品移液到1.5ml微量离心管中,向其中分别加入300μl结合缓冲液br2(paxgenebloodrnamdxkit,bdbiosciences,sanjose,ca)和40μl蛋白酶k。然后将管涡旋5秒并使用摇床培养箱在55℃下以1000rpm孵育10分钟。孵育后,将来自微量离心管的裂解物直接移液到置于2ml处理管中的shredder旋转柱(紫色)(paxgenebloodrnakit,bdbiosciences,sanjose,ca)中,并以15,000×g离心3分钟。然后将流穿部分的全部上清液小心地移液到新的1.5ml微量离心管中,而不搅乱处理管中的沉淀物。向上清液中加入350μl96~100%乙醇、涡旋2秒,500×g离心1秒后以除去管盖内部的液滴。将700μl样品移液到置于2ml处理管中的rna旋转柱(红色)(paxgenebloodrnakit,bdbiosciences,sanjose,ca)中,15,000×g离心1分钟。将旋转柱置于新的2ml处理管中,丢弃含有流过物的旧处理管。将剩余样品移液到paxgenerna旋转柱(paxgenebloodrnakit,bdbiosciences,sanjose,ca)中,15,000×g离心1分钟。将旋转柱置于新的2ml处理管中,丢弃含有流过物的旧处理管。将350μl洗涤缓冲液br3移液到rna旋转柱中,15,000×g离心1分钟。将旋转柱置于新的2ml处理管中,丢弃含有流过物的旧处理管。在单独的1.5ml微量离心管中,将10μldnasei溶液(paxgenebloodrnakit,bdbiosciences,sanjose,ca)与70μl缓冲液rdd(paxgenebloodrnakit,bdbiosciences,sanjose,ca)混合,制得dnasei孵育混合物。然后将80μldnasei孵育混合物直接加到rna离心柱膜上,并在室温(20~30℃)下孵育15分钟。将350μl缓冲液br3移液到rna离心柱中,15,000×g离心1分钟。将离心柱置于新的2ml处理管中,丢弃含有流过物的旧处理管。将500μl洗涤缓冲液br4(paxgenebloodrnakit,bdbiosciences,sanjose,ca)移液到离心柱中,15,000g离心1分钟。将离心柱置于新的2ml处理管中,丢弃含有流过物的旧处理管。将500μl缓冲液br4移液到rna离心柱中,15,000g离心3分钟。将离心柱置于新的2ml处理管中15,000×g离心1分钟。将rna离心柱置于1.5ml微量离心管中,将40μl洗脱缓冲液br5(paxgenebloodrnakit,bdbiosciences,sanjose,ca)直接移液到paxgenerna离心柱膜上,15,000×g离心1分钟以洗脱rna。使用40μl洗脱缓冲液br5和相同的微量离心管重复洗脱步骤。将洗脱的rna样品在65℃下孵育5分钟,并立即在冰上冷却rna样品。rna定量将准备好的等份的agilentrna6000凝胶-染料混合管(agilentrna6000nanokit,cat.no.5067-1511,agilent,santaclara,ca)13,000×g旋转10分钟,然后使凝胶-染料混合物在室温(15~25℃)下平衡30分钟。将新的rnanano芯片(agilentrna6000nanokit,cat.no.5067-1511,agilent,santaclara,ca)置于准备好的芯片涂底平台(chipprimingstation)(cat.no.5065-4401,agilent,santaclara,ca)。用移液器吸取9μl凝胶-染料混合物至标记为“g”的孔底部。在芯片涂底平台中,将柱塞定位在1ml,并关闭芯片涂底平台。等待30秒,然后用夹子释放机构释放柱塞,目视检查柱塞移回到至少0.3ml标记。等待5秒钟,然后慢慢将柱塞拉回到1ml位置。打开芯片涂底平台并在每个反应孔中用移液器吸取9μl凝胶-染料混合物。将准备好的等份的agilentrna6000ladder(cat.no.5067-1529,agilent,santaclara,ca)置于冰上15分钟以完全解冻,然后在70℃下孵育2分钟。用移液器吸取1μlagilentrna6000ladder至标有ladder符号的孔中。用移液器吸取5μlagilentrna6000nanomarker(agilentrna6000nanokit,cat.no.5067-1511,agilent,santaclara,ca)至带有ladder符号和每个反应孔的孔中。用移液器吸取1μlrna样品到rnanano芯片的左上部孔中。将rnanano芯片在2400rpm下水平涡旋60秒。将芯片小心地放入agilent2100生物分析仪(agilent,santaclara,ca)的容器中,盖上盖子并运行芯片。在完成运行后,检查rna的完整性,如果rin>7,则在进行cdna合成之前使用nanodrop分光光度计定量rna。cdna合成在置于冰上的贴有标签的0.2ml薄壁管中,将以下物质混合以形成混合物(表6):表6对于每个样品,将10μl制备的混合物加入10μl稀释至15ng/μl(150ngrna)的rna样品中。对于参照rna,将25μl(2.)中制备的cdna合成混合物加入25μl稀释至15ng/μl(375ng)的参照rna中。轻轻地混合并将管放置在热循环仪中(eppendorfmastercyclernexussx1,sku#8125-30-1030,eppendorfag,germany)。在25℃孵育10分钟。在42℃孵育60分钟。在85℃下进行终止反应5分钟。冷却至4℃。将管进行短暂离心、收集管底部的内容物并在qpcr之前将cdna样品储存在-20℃。qpcr将解冻的cdna样品通过轻轻涡旋来重悬,然后短暂离心以收集管底部的液体。对于每个样品,将内容物转移至标记的0.5ml管中,并通过添加380μl无核酸酶的水将样品稀释20倍。对于参照cdna,将内容物转移至标记的0.5ml管中,并通过添加200μl无核酸酶的水将参照cdna稀释5倍。根据待分析的cdna样品的数量,对于每个测定,在标记的无核酸酶的1.5ml管中合并以下组分(表7):表7可以使用以下示例性rt-qpcr引物(表8)。然而,技术人员有能力设计其他合适的引物,以进行本发明的示例性rt-qpcr测定。表8盖上管盖并反转几次以混合。短暂离心、收集管底部的反应混合物。下面的方案举例说明了对来自4名患者的cdna样品进行的测定,测量了16种基因以及2种参照对照的表达水平。然而,可以对1种或多种cdna样品进行测定,并且本领域技术人员可以容易地设计成使用1种或多种参照对照来测量16种基因中的2种或多种基因的表达水平。用移液器将4μl每种cdna模板吸取到如下标记的384孔板的孔中:a.参照cdna(cdv3和rna85s5)孔a1-c6b.cdna样品#1孔d1–f6c.cdna样品#2孔g1–i6d.cdna样品#3孔j1–l6e.cdna样品#4孔m1–o6用移液器将4μl无核酸酶的水吸取到每一个没有模板的对照孔中(孔p1-p18)。将16μl的taqmangeneexpressionassay添加到以下孔中:a.测定1:孔a1-a3、d1-d3、g1-g3、j1-j3、m1-m3以及p1b.测定2:孔a4-a6,d4-d6,g4-g6,j4-j6,m4-m6,p2c.测定3:孔a7-a9、d7-d9、g7-g9、j7-j9、m7-m9、p3d.测定4:孔a10-a12、d10-d12、g10-g12、j10-j12、m10-m12、p4e.测定5:孔a13-a15、d13-d15、g13-g15、j13-j15、m13-m15、p5f.测定6:孔a16-a18、d16-d18、g16-g18、j16-j18、m16-m18、p6g.测定7:孔a19-a21、d19-d21、g19-g21、j19-j21、m19-m21、p7h.测定8:孔a22-a24、d22-d24、g22-g24、j22-j24、m22-m24、p8i.测定9:孔b1-b3、e1-e3、h1-h3、k1-k3、n1-n3、p9j.测定10:孔b4-b6、e4-e6、h4-h6、k4-k6、n4-n6、p10k.测定11:孔b7-b9、e7-e9、h7-h9、k7-k9、n7-n9、p11l.测定12:孔b10-b12、e10-e12、h10-h12、k10-k12、n10-n12、p12m.测定13:孔b13-b15、e13-e15、h13-h15、k13-k15、n13-n15、p1n.测定14:孔b16-b18、e16-e18、h16-h18、k16-k18、n16-n18、p14o.测定15:孔b19-b21、e19-e21、h19-h21、k19-k21、n19-n21、p15p.测定16:孔b22-b24、e22-e24、h22-h24、k22-k24、n22-n24、p16q.测定17:孔c1-c3、f1-f3、i1-i3、l1-l3、o1-o3、p17r.测定18:孔c4-c6、f4-f6、i4-i6、l4-l6、o4-o6、p18用密封箔密封384孔板(cat.no.04729757001,rochediagnosticscorporation,indianapolis,in)。短暂离心板,以混合孔中的内容物并将板放置于热循环仪(rochelightcycler480ii,rochediagnosticscorporation,indianapolis,in)中。选择双色水解探针/upl探针的检测格式,按如下方式将qpcr程序设置为70个循环,并运行测定:a.95℃10分钟b.95℃10秒钟c.60℃1分钟d.40℃30秒钟。参考文献本说明书中提及的所有文献均通过引用整体并入本申请。ananthakrishnan,ashwinn.,etal."differentialeffectofgeneticburdenondiseasephenotypesincrohn’sdiseaseandulcerativecolitis:analysisofanorthamericancohort."theamericanjournalofgastroenterology109.3(2014):395.billiet,thomas,marcferrante,andgertvanassche."theuseofprognosticfactorsininflammatoryboweldiseases."currentgastroenterologyreports16.11(2014):1-14.bolstad,benjaminmilo."preprocesscore:acollectionofpre-processingfunctions."rpackageversion1.0(2013).choi,jungkyoon,andsangcheolkim."environmentaleffectsongeneexpressionphenotypehaveregionalbiasesinthehumangenome."genetics175.4(2007):1607-1613.colombel,jeanfrédéric,etal."infliximab,azathioprine,orcombinationtherapyforcrohn'sdisease."newenglandjournalofmedicine362.15(2010):1383-1395.d'haens,geert,etal."earlycombinedimmunosuppressionorconventionalmanagementinpatientswithnewlydiagnosedcrohn'sdisease:anopenrandomisedtrial."thelancet371.9613(2008):660-667.freeman,willardm.,stephenj.walker,andkente.vrana."quantitativert-pcr:pitfallsandpotential."biotechniques26(1999):112-125.friedman,davidj.,laurencea.turka,andsimonc.robson."there’sagoatbehinddoornumber3:frommontyhalltomedicine."thejournalofclinicalinvestigation121.10(2011):3819.gerich,marke.,anddermotpbmcgovern."towardspersonalizedcareinibd."naturereviewsgastroenterology&hepatology11.5(2014):287-299.huber,wolfgang,etal."orchestratinghigh-throughputgenomicanalysiswithbioconductor."naturemethods12.2(2015):115-121.ibdresearchpriority,settingpartnership(2015).inflammatoryboweldisease(ibd)researchpriorities.accessed:2015-04-20.url:http://www.bsg.org.uk/images/stories/docs/research/ibd_psp_top10_final.pdf.jess,tine,etal."changesinclinicalcharacteristics,course,andprognosisofinflammatoryboweldiseaseduringthelast5decades:apopulation-basedstudyfromcopenhagen,denmark."inflammatoryboweldiseases13.4(2007):481-489.jostins,luke,etal."host-microbeinteractionshaveshapedthegeneticarchitectureofinflammatoryboweldisease."nature491.7422(2012):119-124.kaser,a,szeissig,andrsblumberg(2010).“inflammatoryboweldisease”.in:annualreviewofimmunology28,pp.573–621.lee,jamesc.,etal."geneexpressionprofilingofcd8+tcellspredictsprognosisinpatientswithcrohndiseaseandulcerativecolitis."thejournalofclinicalinvestigation121.10(2011):4170-4179.livak,kennethj.,andthomasd.schmittgen."analysisofrelativegeneexpressiondatausingreal-timequantitativepcrandthe2-δδctmethod."methods25.4(2001):402-408.loly,catherine,jacquesbelaiche,andedouardlouis."predictorsofseverecrohn'sdisease."scandinavianjournalofgastroenterology43.8(2008):948-954.lyons,paula.,etal."novelexpressionsignaturesidentifiedbytranscriptionalanalysisofseparatedleucocytesubsetsinsystemiclupuserythematosusandvasculitis."annalsoftherheumaticdiseases69.6(2010):1208-1213.lyons,paula.,etal."microarrayanalysisofhumanleucocytesubsets:theadvantagesofpositiveselectionandrapidpurification."bmcgenomics8.1(2007):1.markowitz,james,etal."theprometheuscrohn'sprognostictestdoesnotreliablypredictcomplicatedcrohn'sdiseaseinchildren."gastroenterology140.5(2011):s-153.mckinney,eoinf.,etal."acd8+tcelltranscriptionsignaturepredictsprognosisinautoimmunedisease."naturemedicine16.5(2010):586-591.mckinney,eoinf.,etal."t-cellexhaustion,co-stimulationandclinicaloutcomeinautoimmunityandinfection."nature(2015).micheel,christinem.,sharlyj.nass,andgilberts.omenn,eds.evolutionoftranslationalomics:lessonslearnedandthepathforward.nationalacademiespress,2012.peyrin-biroulet,laurent,etal."surgeryinapopulation-basedcohortofcrohn'sdiseasefromolmstedcounty,minnesota(1970–2004)."theamericanjournalofgastroenterology107.11(2012):1693-1701.schena,mark,etal."quantitativemonitoringofgeneexpressionpatternswithacomplementarydnamicroarray."science270.5235(1995):467.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1