作为用于情绪障碍测试的生物标志物的RNA编辑的制作方法
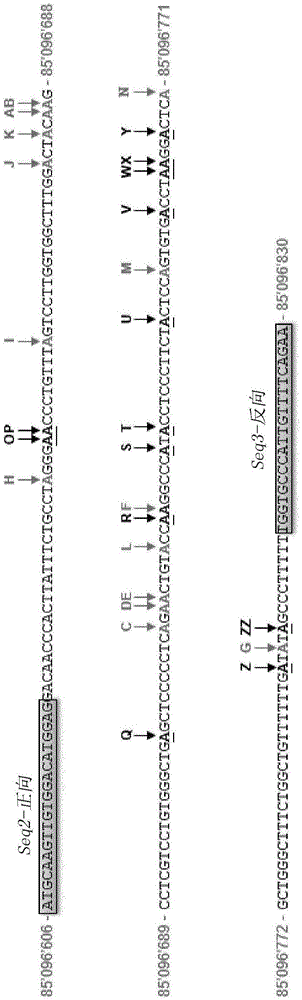
自杀和自杀行为是全球主要的公共卫生问题之一,在主要西方国家报告了100万例已遂自杀事件,预计到2020年这将上升至150万。今天,使用生物工具预防自杀风险尚未得到证实,并且临床评估不能很好地预测给定患者中的自杀行为的发生。此外,精神疾病的药物治疗已显示出它们对降低企图自杀和已遂自杀比率的效果有限。公共卫生迫切需要开发新的策略并促进针对最有风险自杀的人的预防行动。为实现这一目标,预防自杀策略需要鉴定有风险的个体。在决定自杀行为的众多因素中,分子遗传学和基因组研究的一些最新发展揭示了多种因素可能导致对自杀行为的易感性。该易感性很可能通过在整个生命周期中与环境和表观遗传因素相互作用的潜在遗传倾向性而介导来调节神经元回路的功能[1-3]。已显示在突触间隙中表达的受体和其他相关蛋白的rna编辑涉及不同精神病障碍的病因学并且与自杀行为有关[4-7]。simmons及其同事最近报道了在抑郁性自杀受害者大脑皮质中rna编辑酶1、作用于rna的腺苷脱氨酶(adar1)mrna表达的增加[8]。作为adar靶标的磷酸二酯酶8a(pde8a)在脑和血液组织中都表达,并在人类中由adar编辑[9-11]。pde8a前体mrna的编辑谱中的改变可以用于监测患者的状态,所述pde8a前体mrna可以从人组织的总rna提取物定量评估,所述人组织包括脑,但实际上在血液样品中也更方便。基于这些观察,目标是鉴定体液生物标志物以确定疾病特异性分子特征。这种体液测试的应用将为评估严重精神病副作用的主要或次要风险开辟新的可能性。迄今为止,美国食品药品管理局(fda)或其他药物管理机构尚未特别批准任何测试作为预测患者呈现或发展精神病症(例如抑郁症或自杀行为)风险的有效测试。在评估对可能证明确定患者的自杀行为或抑郁症的风险具有功效的任何测试方面人们具有极大兴趣。目前,没有经过批准的生物学测试来鉴定这些患者。因此,需要提供由例如待测患者的血液样品特别容易使用的体外测试,其可以高精度地并且高辨别力地确定患者呈现精神病障碍或发展精神病障碍(例如抑郁症或自杀行为)的风险。这正是本发明的目标。在第一方面,本发明涉及一种预测患者呈现病症的风险或鉴定患者是否有风险发展病症的体外方法,所述病症选自由与pde8a转录物上的a至i编辑的改变相关的精神病障碍或神经病学、免疫学和退行性综合征组成的组,所述方法包括以下步骤:-由含有表达编辑酶adar1a、adar1b和adar2中的至少一种和所述pde8a的细胞的所述患者的体液样品a)在自含有细胞的所述血液样品获得的同一细胞rna提取物中,确定:i)pde8amrna的表达水平,和ii)-能够在所述pde8a基因上被编辑并且优选与所述病症相关的位点中的至少一种或组合的所述pde8arna编辑的水平,和/或-能够被表达并且优选与所述病症相关的pde8a同种型或未编辑转录物(ne)中的至少一种或组合的表达水平;和b)根据步骤a)中获得的结果,确定所述rna编辑位点和/或所述pde8a同种型水平与所述pde8amrna的表达水平的相对比例;和c)通过以下方式鉴定所述患者是否呈现或有风险发展所述病症:i)比较步骤b)中获得的所述rna编辑位点和/或同种型的相对比例与由对照体液样品获得的所述rna编辑位点和/或同种型的比例,所述对照体液样品来自已知表现出或未表现所述病症、或者有风险发展或无风险发展所述病症的患者,和/或ii)应用利用在步骤b)中选择的所述编辑位点和/或同种型或其组合表现出辨别性能的算法或统计模型,和使用步骤c)i)或ii)中获得的结果或最终值来确定所述患者是否呈现所述病症或有风险发展所述病症。在步骤c)i)中为对照样品确定的阈值或在步骤c)ii)中使用的算法可以例如通过包括以下步骤的方法获得:a)-选择患者集合,其由一定比率的注释有或注释没有发展精神病障碍的风险或将患者鉴定为呈现精神病障碍的患者组成;-选择一个或数个pde8arna编辑位点和/或同种型,或其组合;b)对于所述集合的每一患者分析靶pde8arna编辑位点和/或同种型以获得所述靶位点的rna编辑水平或同种型的比例,c)-i)通过单变量分析统计方法,对于每个rna编辑的位点和/或同种型评估:其阈值、和/或其辨别发展所述病症(例如精神病症)的风险或者将患者鉴定为呈现所述病症的准确性和能力,和/或-ii)通过多变量分析统计方法,对于rna编辑的位点和/或同种型的每种组合评估:其辨别发展所述病症(特别是精神病症)的风险或者将患者鉴定为呈现所述病症的准确性和能力,和-iii)选择表现出可接受的辨别性能的编辑位点和/或同种型或其组合;和e)使用所选择的编辑位点和/或同种型的组合构建算法,并使用由此获得的所述算法来预测给定患者发展所述病症(特别是精神病症)的风险,或将所述患者鉴定为呈现所述病症。在优选实施方式中,在根据本发明的方法中使用的算法可以通过多变量方法来执行,所述多变量方法包括:-mroc程序,特别是用于鉴定线性组合的mroc程序,其使auc(曲线下面积)roc最大化,并且其中提供如下用于相应组合的方程并且其可以用作新的虚拟标志物z:z=a1.(生物标志物1)+a2.(生物标志物2)+...ai.(生物标志物i)+....an.(生物标志物n)其中ai是计算系数,(生物标志物i)是rna编辑位点或同种型靶标的个体水平的相对比例;和/或-应用于单变量和多变量分析的逻辑回归模型,以评估不同水平的rna编辑位点或同种型值的患者的相对风险;和/或-cart(分类和回归树)方法,其用于评估rna编辑位点和/或同种型组合;和/或-随机森林(rf)方法,其用于评估rna编辑位点和/或同种型组合,特别是用于对rna编辑位点和/或同种型的重要性进行排序,并将最佳rna编辑位点和/或同种型组合以对“相对风险”进行分类,和/或可选地-用于评估rna编辑位点和/同种型组合的“相对风险”的多变量分析,所述多变量分析例如选自由以下组成的组:-支持向量机(svm)方法;-人工神经网络(ann)方法;-贝叶斯网络方法;-wkn(加权k-最近邻)方法;-偏最小二乘-判别分析(pls-da);-线性和二次判别分析(lda/qda),和-任何其他结合生物标志物的数学方法。在优选实施方式中,体液样品选自血液、尿和唾液样品的组,最优选血液样品。在优选实施方式中,所述病症是精神病障碍。在另一优选实施方式中,所述病症选自由精神障碍(mentaldisorders)、双相情感障碍、抑郁症、精神分裂症、惊恐障碍、社交焦虑症、创伤后应激障碍(ptsd)、物质依赖性/滥用、异常摄食行为、优选厌食症或肥胖症、强迫症(ocd)、早期阿尔茨海默病或帕金森病组成的组。在更优选的实施方式中,所述病症是抑郁症,更优选是自杀行为。在本发明方法的一个更优选的实施方式中,所述方法用于预测患者企图自杀的风险,并且其中在步骤c)(i)中,对照体液样品获自患者的情感对照组。在本发明方法的另一个更优选的实施方式中,所述方法是鉴定患者是否表现出抑郁症的方法,并且其中在步骤c)(i)中,对照体液样品获自健康的患者组。在一个具体实施方式中,在根据本发明的方法中,所述患者选自已经鉴定出呈现精神病障碍的患者,所述精神病障碍可能与发展自杀行为的风险相关,特别是伴有或不伴有自杀企图史的抑郁症,并且其中在步骤c)中,鉴定所述患者是否呈现自杀行为或有风险发展自杀行为。在另一个实施方式中,本发明的方法允许在治疗的应答者和非应答者之间监测和/或分级(stratify)患者。已知诸如精神病症等许多疾病有时与自杀有关。在一些实施方式中,患者罹患精神障碍、双相情感障碍、精神分裂症、惊恐障碍、社交焦虑症、创伤后应激障碍(ptsd)、物质依赖性/滥用、进食障碍(异常进食行为(如厌食、肥胖)、强迫症(ocd)、早期阿尔茨海默病或帕金森病。在另一个实施方式中,所述患者可以是被鉴定为没有表现出精神病障碍并且治疗过非精神病障碍,特别是治疗过肝炎的患者。本发明的另一方面涉及本发明的方法,其进一步包括:-在步骤a)中确定编辑酶adar1a和/或adar1b和/或adar2在同一细胞提取物中的定量表达;和在步骤c)中,通过以下方式鉴定所述患者是否呈现或有风险发展所述疾病:i)进一步比较在步骤b)中获得的所述编辑酶adar1a和/或adar1b和/或adar2的定量表达与对于正常患者和可选地对于表现出与pde8a转录物上a至i编辑的改变相关的病症的患者获得的该定量表达,和/或ii)应用利用在步骤a)和b)中选择的所述编辑位点和/或同种型以及adar表达或其组合表现出辨别性能的算法或统计模型。在本发明方法的优选实施方式中,所述血液样品含有pbmc(外周血单个核细胞);优选地,在根据本发明的方法中,在步骤a)中,对于选自表iii中列出的编辑位点中的至少一个位点、更优选包括表iii的o至zz中的至少一个位点的数个位点确定一个位点的pde8arna编辑。优选地,在根据本发明的方法中,在步骤a)中,对选自由位点a、b、c、d、e、f、g、z和zz组成的组中的至少位点确定一个位点或数个位点的pde8arna编辑。更优选地,在根据本发明的方法中,在步骤a)中,对至少位点b进行一个位点或数个位点的pde8arna编辑的确定。更优选地,在根据本发明的方法中,在步骤a)中,确定仅包含经编辑的一个位点或经编辑的所述数个位点中的一些的组合的pde8arna同种型水平与pde8amrna表达水平的相对比例。优选地,在根据本发明的方法中,在步骤a)中,确定pde8arna同种型的相对比例,所述pde8arna同种型选自由同种型b、bc、d、e、ne(未编辑)、be、g、bg、bf、a、z、c、f、bz和bd组成的组。更优选地,在根据本发明的方法中,在步骤a)中,确定pde8arna同种型b的至少相对比例。在优选实施方式中,在根据本发明的方法中,步骤c)中的所述算法或统计方法包括:-mroc程序,特别是用于鉴定线性组合的mroc程序,其使auc(曲线下面积)roc最大化,并且其中如下提供用于相应组合的方程并且其可以用作新的虚拟标志物z:z=a1.(生物标志物1)+a2.(生物标志物2)+...ai.(生物标志物i)+....an.(生物标志物n)其中ai是计算系数,(生物标志物i)是一个位点或一个同种型靶标的个体pde8arna编辑水平或者adar1a、lb或adar2的表达水平的相对比例;和/或-应用于单变量和多变量分析的逻辑回归模型,以在不同编辑位点或同种型和/或adar值评估给定患者的相对风险。-或者任何其他将生物标志物组合的数学方法。优选地,在根据本发明的方法中,在步骤c)中,所述算法选自由表vi中列出的mroc组合组成的组。优选地,在根据本发明的方法中,在步骤a)和b)中,通过ngs(新一代测序)方法进行经由qpcr对pde8amrna的表达水平的确定,和/或对一个位点的rna编辑水平的确定。在优选实施方式中,使用正向引物和反向引物的组进行经由qpcr对pde8amrna的表达水平的确定,和/或对给定位点处的rna编辑水平的确定,所述正向引物和反向引物的组选自由下述组成的组:-用于正向引物的seql-正向(seqidno.2)或seq2-正向(seqidno.3),-用于反向引物的seql-反向(seqidno.4)、seq2-反向(seqidno.5)或seq3-反向(seqidno.6),和-满足以下选择标准的正向引物和反向引物的组:i)寡聚物的长度应该为18-27个核苷酸,ii)优选解链温度为约60℃(57-63℃),iii)最佳gc含量为约50%(±5%),iiii)最大允许长度为5个单核苷酸重复,和vi)特异性扩增图1中描述的感兴趣区域。在更优选的实施方式中,在本发明的方法中使用以下引物组seq2-正向和seq-3反向来确定一个位点上pde8a的rna编辑水平。在另一方面,本发明涉及用于确定患者是否有风险呈现病症或鉴定患者是否有风险发展病症的试剂盒,所述病症选自由与pde8a转录物上的a至i编辑的改变相关的精神病障碍或神经病学、免疫学和退行性综合征组成的组,所述试剂盒包括:1)应用本发明的方法的说明,以获得对其分析确定诱导病症的所述风险的最终值,所述说明可选地包括roc曲线;和2)所述正向引物和反向引物的组选自由下述组成的组:-用于正向引物的seql-正向(seqidno.2)或seq2-正向(seqidno.3),-用于反向引物的seql-反向(seqidno.4)、seq2-反向(seqidno.5)或seq3-反向(seqidno.6),和-满足以下选择标准的正向引物和反向引物的组:i)寡聚物的长度应该为18-27个核苷酸,ii)优选解链温度为约60℃(57-63℃),iii)最佳gc含量为约50%(±5%),iiii)最大允许长度为5个单核苷酸重复,和vi)特异性扩增图1中描述的感兴趣区域。在更优选的实施方式中,所述试剂盒包含以下引物组:seq2-正向(seqidno.3)和seq-3反向(seqidno.6)。为了能够实施和使用本发明,选择以下实例以及下文中的附图和图例以向本领域技术人员提供完整的描述。这些实例不旨在限制发明人认为是其发明的范围,也不旨在表明仅进行了下文的实验。本发明的其他特征和优点将在说明书的其余部分以及实施例和附图中出现,为其下面给出了图例。附图说明图1:位于人pde8a基因的内含子9内的目标序列。显示了内含子9的内部序列(225bp)(碱基位置85'096'606至85'096'830,seqidno.1)。使用引物组合seq2正向和seq3反向扩增该序列。由orlowski和合作者(a到h)[10]以及weissmann等人(专利wo2011/161253)之前所述的编辑位点在序列上方以灰色粗体大写字母表示。新的编辑位点o至zz在序列上方以黑色粗体加下划线的大写字母标示。图2:显示使用各种引物对扩增获得的非特异性副产物的典型电泳图。使用不产生可检测的非特异性产物的包含seq2-正向和seq3-反向的引物对,来扩增pde8a的靶区域并进行超深度测序。图3:通过超深度测序在人白细胞中鉴定的rna编辑位点。该图报告了在情感对照组的pde8a基因的数个位点(a至g、z和zz)上测量的rna编辑的相对比例(平均值±sem)。图4a-4d:在情感对照(ac)和自杀企图者(sa)群体的白细胞中通过qpcr分析测量的相关基因的表达水平。与自杀企图者(sa)相比,在情感对照(ac)中的adar1a(a)、adar1b(b)、adar2(c)和pde8a(d)mrna的表达水平。已经在38名患者(n=18名情感对照和n=20名自杀企图者)中定量了adar1a、adar1b、adar2和pde8amrna的表达水平。将不同转录物的表达相对于gapdh和β2m基因表达归一化。测量一式三份进行。adar1a、lb和pde8amrna表达在自杀企图者中显著更高。使用mann-whitney检验计算p值。图5a-5b:pde8a基因的b位点的rna编辑的相对比例。(a)在情感对照(ac)和自杀企图者(sa)中测量pde8ab位点mrna编辑的箱形图。(b)相对于相对转录水平调整过的pde8amrna编辑测量。数据代表五次独立实验的平均值。使用mann-whitney检验计算p值。图6:使用mroc方法的生物标志物组合的诊断性能。该图说明了将情感对照与自杀企图者进行比较的多变量roc曲线的实例。用adar1a+adar2+pde8a_位点a*+pde8a_位点b*mroc组合获得的roc曲线。图7:使用逻辑回归的生物标志物组合的诊断性能。该图说明了将情感对照与自杀企图者进行比较的多变量roc曲线的实例。用adar1a+pde8a_位点b*逻辑回归模型获得的roc曲线。图8:用ifn-α和利巴韦林治疗的丙型肝炎病毒(hcv)患者的纵向研究。在抗病毒治疗前4周(-4)和治疗开始后每两周(第0、2、4、6、8、10和12周)在paxgenebloodrna管上收集10名感染hcv的患者。该疗法包括每周聚乙二醇化ifn-α皮下注射(180μg)和每日利巴韦林片剂(1000-1200mg)。图9a-9d:相关基因(a-b)的表达水平的纵向分析以及在用ifn-α和利巴韦林治疗的2名感染丙型肝炎病毒(hcv)的患者上pde8a基因的b位点的rna编辑(c-d)的相对比例。显示的数据是在每个时间点对每个患者测量的五个独立实验(n=5)的平均值±sd(误差棒)。图10:ifn研究中包括的六名hcv感染患者的聚类分析。使用mev软件v4.9进行k-median聚类输出,选择用于距离的pearson相关、1000次迭代和2个聚类作为参数。这种方法产生了2个不同的患者聚类。通过治疗最初4周的曲线的陡峭斜率观察到包括显示对ifn的快速和强烈响应增加的4名患者的第一聚类。还可以观察到收集两名ifn响应迟钝的患者的第二聚类。图11a-11d:在6个月的随访研究中对非重复性自杀企图者(nrsa)组和重复性自杀企图者(rsa)的临床评估。对于两个组在初始摄入时0个月和6个月给予hamilton(hamd)、madrs(montgomery-asberg抑郁评定量表)和bdi(beck抑郁量表)评分(a-b)。在pde8a基因的所有位点上进行相应的rna编辑定量(c-d)。数据表示5次重复的平均值,误差棒表示平均值的标准误差。使用wilcoxon检验计算p值。图12a-12c:(a)16周的期间对所有hcv患者(n=10)的adar1a、adar1b、adar2和pde8a基因表达进行的纵向分析。(b)相对于相对pde8a转录物水平(n=10)的调整过的所有hcv患者的pde8a基因的b位点上的rna编辑的纵向分析。(c)相对于相对pde8a转录物水平(n=10)调整过的所有hcv患者的pde8a基因的其他鉴定位点上的rna编辑的纵向分析。显示平均值±sem(n=10)。图13a-13c:(a)在具有抑郁发作(n=3)和没有抑郁发作(n=7)的患者组中对由adar基因表达组成的生物标志物组合进行的纵向分析。(b)在抑郁发作(n=3)和没有抑郁发作(n=7)的患者组中对由rna编辑组成的生物标志物的组合进行的纵向分析。(c)生物标志物组合的roc曲线,其将抑郁发作与没有抑郁发作的人群分开。图14:将生物标志物的特定组合应用于在ifn治疗过程中获得的所有数据点。实施例1:材料和方法1)人类参与者提供了来自两个不同组的数据:一组包括有或无自杀企图史的抑郁症患者(称为自杀企图者研究和随访),和一个纵向研究分析感染丙型肝炎病毒并用干扰素α治疗的患者(称为干扰素研究)。在详细讨论研究目标和要求后,从所有受试者获得书面知情同意书。所有受试者都能够了解详细说明研究目的和程序的知情同意书。根据批准要求和良好的临床实践,该研究得到了当地机构审查委员会的批准。2)自杀企图者研究和自杀企图者的随访研究2.1自杀企图者研究该研究招募了38名抑郁症患者,他们在法国蒙彼利埃的chu的departmentofpsychiatricemergencyorpost-emergency咨询(17例)或西班牙奥维耶多的psychiatricresidentialtreatmentcenter咨询(n=21)。精神病诊断是通过结构化的临床访谈建立的。根据精神疾病iv的诊断和统计手册(dsm-iv)确定精神病学诊断。样品包括20名自杀企图者(sa)(52.63%)和18名非自杀企图者(情感对照,ac)(47.37%)(参见表1(a))。受试者在种族上是同质的;都是高加索人,来自欧洲西部。记录年龄和性别的人口统计数据,以及患者精神病诊断,酒精或物质消耗以及自杀企图数量。表1(a):研究中包括的患者的特征。包括两组以用于比较。第一组称为情感控制(ac),包括没有自杀企图史的抑郁症患者。第二组被称为自杀企图者(sa),其包括有自杀企图史的抑郁症患者。2.2自杀企图者随访研究该随访研究招募了28名抑郁症自杀企图患者,其在法国蒙彼利埃的chu的departmentofpsychiatricemergencyorpost-emergency咨询。在6个月对这些患者进行了随访(参见表1(b)。在随访期间,28名患者中有8名(28.6%)进行了一次或数次新的自杀企图(“重复性自杀企图者”,rsa),而20名患者(71.4%)未进行新的自杀企图(“非重复性自杀企图者”,nrsa)。对于患者实施如上文自杀企图者研究所述的精神病学评估。使用3个量表评价基线处的抑郁严重性和随访评估:hamilton抑郁量表(hamd)、montgomery和asberg抑郁量表(madrs)以及beck抑郁量表(bdi)。表1(b):自杀企图者的随访研究中包括的28名患者的特征。3)干扰素研究该研究招募了来自马赛、南希和斯特拉斯堡(法国)的chu(centerhospitalieruniversitaire)的3个不同科室的10名患者。感染丙型肝炎病毒(hcv)的患者(其不符合任何精神疾病标准)在抗病毒治疗开始之前招募,并且在抗病毒治疗开始后随访长达12周。在治疗前4周(-4)获得初始血液样品。在治疗开始时,每两周在paxgene管中收集血液长达12周(图8)。4)血液获取(bloodretrieval)和rna提取和资格鉴定在paxgenebloodrna管中获取来自每位患者的2.5ml体积的全血样品,并在-20℃下储存几个月,然后转移至-80℃。paxgenetm血液rna管(preanalytix)含有保护rna分子免受rna酶降解和基因表达的离体变化的试剂。样品在不同的提取组中是随机分布的。使用paxgenetmbloodrna试剂盒(ref28704,preanalytix)提取来自2.5ml全血的总rna。使用qiagenqiacube系统,按照制造商的paxgenebloodrna第1部分自动化方案的方案分离所提取的rna。在样品制备和rna提取期间,采取了标准预防措施以避免rna酶降解rna。用qubit荧光计(invitrogen)和quant-itrnabr测定(invitrogen)确定总rna浓度。5)ngs文库制备对于ngs文库制备,采用2步pcr法以对pde8a基因的内含子9内的目标区域选择性地测序。如图1所示,除了先前描述的编辑位点之外,还鉴定出感兴趣区域中的新编辑位点。使用经验证的pcr引物(seq2正向和seq3反向)通过pcr扩增目标区域(表ii和图1)。引物名称(seqidno.)引物序列长度seq1-正向(seqidno.2)acctgtctgctgaagccttc20seq2-正向(seqidno.3)atgcaagttgtggacatggag21seq1-反向(seqidno.4)ccttccagagtccctcagga20seq2-反向(seqidno.5)ttctgaaaacaatgggcacc20seq3-反向(seqidno.6)ttctgaaaacaatgggcacca21表ii:用于通过基于下一代测序(ngs)的方法测量pde8amrna编辑的引物的序列。使用2步pcr文库制备方案,产生含有多个样品的测序文库。该文库在诸如miseq平台(illumina)等下一代测序系统上测序。对于pcr扩增,根据制造商指南(ref#m0494s)使用q5热启动高保真酶(newenglandbiolabs)。使用优化的pcr方案在peqstar96x热循环仪上进行pcr反应。pcr后,通过labchipgx(perkinelmer)分析所有样品,并评估pcr产物的数量和品质。确定扩增子的纯度,并使用基于荧光的qubit方法进行定量。品质控制后,使用磁珠(来自mokascience的highpreppcrmagbio系统)纯化96个pcr反应(微量培养板)。使用qubit系统定量纯化后dna,并计算纯化产率。接下来,使用q5热启动高保真pcr酶(newenglandbiolabs)和illumina96indexes试剂盒(nexteraxtindexkit;illumina)通过pcr扩增分别对样品进行索引。pcr后,将样品合并到文库中,并使用magbiopcr纯化系统纯化。根据仅在miseq平台上测序fastq的illumina指南,将文库变性并加载到测序盒上。将来自人血液外周白细胞的商业总rna库(clontech,ref#636592)引入文库中以确定实验过程中不同测序流动细胞之间的变异性。将ngs文库以标准浓度测序并掺入以使用phixcontrolv3(illumina)引入文库多样性。实验独立进行五次。6)测序数据的生物信息学分析测序数据作为fastq文件从miseq测序仪(illumina)下载。为了评估测序品质,使用fastqc软件(版本0.11.3)执行每个原始fastq文件的初始品质。进行预处理步骤,其由除去衔接子序列并根据它们的大小和品质评分过滤序列(所有短读数(<50nt)和去除平均qc<30的读数)组成。接下来,为了促进和提高序列的对齐品质,使用了用于illuminangs数据的灵活读取修剪和过滤工具(fastxtoolkitvo.0.14和prinseqversion0.20.4)。在执行预处理步骤之后,在进一步的序列处理之前执行对每个纯fastq文件的附加品质控制。使用具有端对端敏感模式的bowtie2(版本2.2.5)进行所处理读数的比对。对人类基因组序列(grch38)的最新注释进行比对,并读取多个比对区域,具有差的比对品质(q<40)的读数或含有插入/缺失(indel)的读数从进一步分析中取出。使用samtools软件(版本1.3.1)进行文件比对的过滤,该软件提供用于操纵sam格式的比对的各种实用程序,包括以每位置格式排序、合并、索引和生成比对。接下来,使用samtoolsmpileup来同时堆积从多个样品获得的比对结果数据。运行内部脚本来对每个基因组位置中不同atgc核苷酸的数量计数(“碱基计数”)。因此,对于每个基因组位置,内部脚本计算具有'g'的读数的百分比['g'读数的数量/('g'读数的数量+'a'读数的数量)*100]。通过脚本自动检测'g'读数百分比>0.1的基因组位置'a'参考,并认为其是“a至i编辑位点”。最后阶段是计算pde8a转录物的所有可能同种型的百分比。根据定义,在给定的编辑“位点”处rna编辑的相对比例表示在此独特基因组坐标处测量的编辑修饰的总和。相反,mrna同种型是一种独特的分子,其在同一转录物上可能包含或不包含多个编辑修饰。给出的实例,pde8amrna同种型bc在同一转录物内含有对位点b和位点c的修饰。7)逆转录和定量实时pcr使用takara试剂盒(primescriptrt,takara,ref#rr037a)进行逆转录。将得到的cdna与taqman通用pcrmastermix(appliedbiosystems,ref#4369016)和以下特异性基因探针组合:adar1a(hso1020780)、adar1b(hs01017596)、adar2(hs00210562)、pde8a(hs00400174)、gapdh(hs02758991)、β2μ(hs00984230)、hprt1(hs02800695)、pgk(hs99999906)和tbp(hs00427620),终体积为20μl。在steponeplus实时pcr仪器(appliedbiosystems)上的96孔板中或在lightcycler480实时pcr仪器(roche)上的384孔板中进行定量pcr。对于用抑郁症患者和自杀企图者进行的研究,将所有患者中靶基因表达的定量相对于gapdh和β2m表达归一化,并且通过2-δδct计算每个样品中靶基因表达的变化。对于用慢性丙型肝炎病毒(hcv)患者进行的研究,使用二阶导数绝对定量进行分析,通过四个持家基因(gapdh、hprt1、pgk和tbp)的几何平均值进行归一化。8.数据的统计分析所有统计数据和数字均使用“r/bioconductor”统计开源软件和graphpadprism软件(7.0版)计算[12,13]。生物标志物(即rna编辑位点和pde8a的同种型以及adar的mrna表达)值通常表示为平均值±平均值的标准误差(sem)。使用mann-whitney检验进行差异分析,并且低于0.05的p值被认为是统计学上显著的。所有数据分布都显示为每个重要生物标志物的中位数和条形图或箱线图。通过相对于pde8a基因的相对转录物水平进行调整,从而分析rna编辑在位点和同种型上的相对比例。调整的rna编辑值如下计算:调整的rna编辑值*=(rna编辑值×相对转录水平)/100生物标志物的诊断性能可以通过以下来表征:表示其检测“自杀企图者”组的能力的灵敏度,和表示其检测“情感对照”组的能力的特异性。诊断测试的评估结果可以总结在比较这两个明确定义的组的2x2列联表中。通过固定截止,可以根据测试结果将两组分类,分类为阳性或阴性。对于特定的生物标志物,我们可以鉴定出在自杀企图者组中具有阳性测试结果的患者a(“真阳性”:tp)和在“情感对照”组中具有阴性测试结果的患者b(“真阴性”:tn)的数量。以同样的方式,观察到在“自杀企图者”组中具有阴性测试结果的患者c(“假阴性”:fn)和在“情感对照”组中具有阳性测试结果的患者d(“假阳性”:fp)。灵敏度定义为tp/(tp+fn);这里将其称为“真阳性率”。特异性定义为tn/(tn+fp);其在本文中称为“真阴性率”。使用受试工作特征(roc)分析评估每种生物标志物的准确性及其辨别力。roc曲线是对各种值进行的测试的灵敏度(se)和特异性(sp)之间的倒数关系的图形可视化。此外,所有生物标志物相互结合以使用多变量方法评估灵敏度和特异性的潜在增加,例如mroc程序或逻辑回归[14]。mroc是识别线性组合的专门程序[15,16],它使auc(曲线下面积)roc最大化[17]。提供了相应组合的等式,并且可以用作新的虚拟标志物z,如下:z=a×生物标志物l+b×生物标志物2+c×生物标志物3,其中a、b、c是计算系数,生物标志物1、2、3是生物标志物的水平。应用逻辑回归模型以使用患者的编辑位点和/或同种型的不同组合和/或adar基因表达值的不同组合来估计相对情绪障碍风险。使用k-medians或k-means方法[18]来鉴定来自干扰素研究中的患者聚类。举例而言,使用mevv4.9软件(http://www.tm4.org/mev/)和用于距离的pearson或euclidean相关性计算k-中值分析。因此,存在于同一聚类中的所有患者被认为与其他聚类的患者不同。实施例2:自杀企图者研究临床研究中包括的患者的特征显示在表i中。该前瞻性研究招募了38名被诊断患有精神病症的患者:一组18名从未企图自杀的患者(情感对照,ac),与之相比,一组20名都企图自杀至少一次的患者(sa)。患者年龄范围为20至77岁(平均值±标准差:50.16±13.5)。该组由9名男性(23.68%)和29名女性(76.32%)组成。所有患者均呈现抑郁症。自杀企图的次数范围为1至20次,平均值±sd为3.4±4.52。实施例3:使用下一代测序(ngs)方法分析pde8amrna编辑我们先前描述了使用毛细管电泳单链构象多态性(ce-sscp)技术(2011年6月24日提交的专利pct/ep2011/060444)确定pde8amrna的编辑谱的方法。这里,我们开发了基于新一代测序(ngs)定量pde8amrna编辑水平的新的实验系统,该系统提供足够的每碱基深度,以允许对所有研究的位点进行可靠的定量。由于该方法是基于pcr的,我们首先选择几个引物对来扩增pde8amrna的感兴趣区域(表ii)。测试了满足以下选择标准以特异性扩增该区域的不同引物组合:1)寡聚物的长度应该为18-27个核苷酸,2)优选解链温度为约60℃(57-63℃),3)最佳gc含量为约50%(±5%),4)最大允许长度为5个单核苷酸重复,5)特异性扩增图1中描述的感兴趣区域。由于一些引物对产生会干扰rna编辑的准确定量的非特异性扩增产物,给出优化的引物对,其包括seq2-正向和seq-3反向(参见表ii)。实施例4:通过超深度测序鉴定pde8a人基因的内含子9中的新编辑位点orlowski和合作者之前已经在pde8a人基因的内含子9中鉴定了8个编辑位点(a至h)(参见表iii)[10]。之后,我们在同一区域确定了六个额外的编辑站点(i至n)(2011年6月24日提交的专利pct/ep2011/060444)。几项研究指出,大多数adar活动发生在聚类中[19,20]。毫不奇怪,在sh-sy5y人成神经细胞瘤细胞系中使用基于ngs的测序,我们确认了先前鉴定的编辑位点并在pde8a人基因的内含子9中鉴定了新的a-至i-编辑位点。将这些新编辑位点称为o、p、q、r、s、t、u、v、w、x、y、z和zz(参见表iii、图1)。在来自用抑郁症患者和自杀企图者进行的研究的血液样品中也鉴定出大多数这些编辑位点(a至h、j至m、o、p、r至u和x至zz)的存在。表iii:pde8a基因的内含子9中先前鉴定和新鉴定的a至irna编辑位点的列表。出于实际原因,对从sh-sy5y成神经细胞瘤细胞系获得的人样品进行pde8a转录物内感兴趣的基因座的深度测序的标准条件的优化。这允许鉴定pde8a人基因的内含子9中尚未报道的新编辑位点(以粗体加下划线,编号15至27)。新的编辑站点命名为:o、p、q、r、s、t、u、v、w、x、y、z和zz。基因组坐标相对于人基因组(grch38:84,980,440)的染色体15上的pde8a。“sh-sy5y细胞系”列是指在该特定人成神经细胞瘤细胞系中鉴定的编辑位点。“血”列是指在paxgenebloodrna管上收集的白细胞。x表示当测量编辑部位时,至少一个患者的截止值>0.1%。实施例5:通过超深度测序在人白细胞中鉴定的rna编辑位点在表iv和图3中仅报道了使用来自情感对照组的截止值>0.1%测量的rna编辑位点(平均值±sem)(参见表iv和图3)。表iv:报告在情感对照组上pde8a基因的几个位点(a至g,z和zz)上测量的rna编辑的相对比例(平均值±sem)的表。根据定义,在给定编辑“位点”处rna编辑的相对比例表示在该独特基因组坐标处测量的编辑修饰的总和。相反,mrna同种型是一种独特的分子,其在同一转录物上可能包含或不包含多个编辑修饰。给出的实例,pde8amrna同种型bc在同一转录物中含有对位点b和位点c的修饰。实施例6:在自杀企图者的血液中adar1a、1b和2的mrna的表达增加使用实时pcr测定,我们通过所谓的δδct方法分析adar1a、adar1b和adar2mrna基因表达(分别为图4a、4b和4c)。adar1a、adar1b和adar2的表达水平从2.6到25变化(平均值±sd:10.2±6);ac中分别为2.04至14.09(平均值±sd:5.9±3.3)和1.25至50.5(平均值±sd:12.4±13.1)。在sa(n=20)中,adar1a、lb和adar2mrna表达水平分别在4.2和49.5(平均值±sd:17.8±11.7);3至33.8(平均值±sd:10.6±7)和3.8至62(平均值±sd:17.8±16.1之间)。sa中adar1a和adar1b基因的表达平均为17.8和10.6,显著高于分别为10.2和5.9(p=0.0435和0.0047)的ac。实施例7:pde8amrna表达在自杀企图者中较高类似地,与ac组相比,在sa组中观察到pde8a表达水平的改变(图4d)。实际上,在ac中,pde8a表达从4.7到19.9(平均值±sd:9.2±3.3)变化,而在sa中其水平在7.5和32.8之间(平均值±sd:15.7±7.1)。与adar一样,sa组中的pde8a表达显著高于情感障碍组(p=0.0013)(图4d)。这表明pde8a也可以为自杀行为提供额外的生物标志物。实施例8:在自杀企图者中pde8a位点b的mrna编辑增加,并且在自杀企图者中未编辑(ne)pde8a转录物减少a)pde8a位点bmrna编辑使用ngs测定,我们分析了ac与sa患者中的pde8amrna编辑谱。如图5a所示,我们发现与ac相比,sa中编辑的pde8amrnab位点的相对比例较高。在ac(n=18)中,pde8a编辑的转录物的范围为11.2-21.8%,平均值为17.4%(sd±2.8%)。在sa(n=20)中,编辑变体的水平在12.3-26.7%的范围内,平均值为20.2%(sd±3.7%)。ac与sa的值显著不同(p=0.01)。此外,我们调整了在pde8a基因的b位点上的rna编辑的相对比例和pde8amrna(位点b*)的相对表达水平。结果显示在图5b中。调整位点b上的rna编辑进一步增强了ac和sa组之间的差异,如p值所示(p<0.0001)。b)未编辑的pde8a转录物我们分析了未编辑pde8a转录物在情感对照(ac)和自杀企图者(sa)中的相对比例。与sa相比,ac中未编辑的pde8a转录物的相对比例较高。在ac中,pde8a未编辑的转录物的相对比例在77.1-87.9%的范围内,平均值为81.7%(sd±2.9%)。在sa中,未编辑的转录物的水平在71.5-87.2%的范围内,平均值为78.9%(sd±3.8%)。ac与sa的值显著不同(p=0.0094)。实施例9:调整的pde8amrna编辑以及adar1a和adar2mrna表达作为自杀的血液生物标志物我们使用受试者工作特征(roc)曲线,采用adars和pde8a的表达、在不同位点上(位点a*至g*、z*和zz*,表v(b))和在不同同种型上(表v(c))上的调整的pde8amrna编辑作为自杀的生物标志物,评估诊断性能(参见表v(a))。表v显示了每种单独生物标志物的结果。我们发现pde8a位点b*mrna编辑的曲线下面积(auc)最大,值为0.878(表vb)。使用pde8amrna同种型b获得相同的结果(表v(c))。表v(a)表v(b)表v(c)表v(a)-v(c):adar和pde8a个体编辑位点和同种型的相对表达的诊断性能。表v(a)表示adar1a、adar1b、adar2和pde8a的相对表达的诊断性能。表v(b)表示pde8a的各个编辑站点的诊断性能。表v(c)表示pde8a的个体编辑同种型或未编辑的转录物(ne)的诊断性能。仅呈现定义为p值<0.1的最相关的编辑同种型和编辑位点,使用mann-whitney检验计算p值。符号*表示将pde8a编辑位点或编辑同种型调整为其mrna相对表达。我们进一步检查了包括pde8amrna编辑以及其他生物标志物如其他pde8amrna编辑位点或同种型和adarmrna表达的组合方法是否可以增强我们预测未来自杀的能力。例如,我们发现通过添加pde8a位点a*mrna编辑以及adar1a和adar2mrna表达,mroc曲线从单独的pde8a位点b*编辑的auc为0.878提高至auc为0.956(参见表vi和vii,6行和图6)。然而,表vii中列出的其他组合给出了良好的诊断性能,auc在0.878(adar1bmrna表达和pde8a位点b*,泳道30)和0.964(adar1a和adar2mrna和pde8a同种型b、同种型bc和同种型dmrna编辑,泳道1)之间。表vi性能灵敏度%95.0特异性%88.9准确度%92.1aucroc0.956阈值(z)1.6259表vi:生物标志物组合的诊断性能。比较情感对照与自杀企图者的多变量roc曲线的相关诊断性能表,其用adar1a+adar2+pde8a位点a*+pde8a_位点b*组合获得。使用逻辑回归模型或mroc方法的统计分析产生了相似的结果(表viii,图7)。两种方法均显示adar1amrna表达+pde8a位点b*mrna编辑的相同准确度(表vii,29行和表viii,3行和/或图7)。表vii表vii:生物标志物组合的诊断性能的实例。通过mroc方法进行生物标志物的所有组合。组合可以是例如adarmrna表达和pde8arna位点编辑(经调整*或未经调整)联合、adarmrna表达和pde8arna同种型编辑(经调整*或未经调整)联合、pde8arna位点编辑(经调整*或未经调整)联合、pde8arna同种型编辑(经调整*或未经调整)的联合。举例而言,由mroc程序计算的adar1a+adar2+pde8a位点a*+pde8a_位点b*的生物标记组合的方程可以是:a)z=0,02327x[adar1a]-0,026474x[adar2]-16,6903xpde8a_位点a*+0,99311x[pde8a_位点b*]。使用这些方程,计算新的虚拟标志物(z)以执行患者的诊断。符号*表示将pde8a编辑位点或编辑同种型调整为其mrna相对表达。表viii表viii:使用对数回归(acv.s.sa)的生物标志物组合的诊断性能的实例。使用逻辑回归评估生物标志物组合的准确性及其辨别能力。组合可以是例如,adar表达和pde8arna位点编辑(经调整*或未经调整)的联合,adarmrna表达和pde8arna同种型编辑(经调整*或未经调整)的联合,pde8arna位点编辑(经调整*或未经调整)的联合,pde8arna同种型编辑(经调整*或未经调整)的联合。举例而言,通过逻辑回归计算的adar1a+pde8a_位点b*的生物标志物组合的方程式为:p=logit-1(0.0564x[adar1a]+1,9012x[pde8a_位点b*-4.68849]。使用这些方程,计算概率p以执行患者的诊断。p(logit)是患者属于“自杀企图者”类别的概率。符号*表示将pde8a编辑位点或编辑同种型调整为其mrna相对表达。实施例10:在ifn-α治疗期间,在感染丙型肝炎病毒(hcv)的患者中的pde8amrna编辑增加ifn-α治疗慢性丙型肝炎病毒(hcv)感染期间的严重抑郁症是常见的,发病率高达45%[21]。该模型代表了在短时间(数周)内评估个体抑郁症和/或药物引起的精神病学副作用的独特机会。纵向研究的主要优点是每个患者都可以作为自己的参考对照,这排除了遗传变异和环境影响。此外,adar1a可通过干扰素刺激诱导[22]。在该研究中,我们调查了在hcv患者的ifn-α治疗期间pde8amrna编辑是否被修饰。在12周ifn-α和利巴韦林治疗期间治疗前4周以及每2个周预期性地评估6名hcv患者(图8)。一般而言,我们观察到在ifn-α处理后所有患者中b位点上的pde8amrna编辑增加。举例而言,通过在两个代表性患者中进一步分析pde8a个体位点上的rna编辑和adar基因表达的相对比例,我们可以观察到个体之间对ifn-α治疗的响应的明显差异。在患者1中,未观察到adar基因表达的诱导,并且响应于ifn-α应答的pde8arna编辑的增加钝化(图9a,9c)。相反,在患者2中,可以观察到adar表达的快速和强烈增加(图9b)以及pde8arna编辑的强烈且快速增加(图9d)。一般而言,通过使用k-中值方法,所有六名患者的聚类证实了不同的ifn-α介导的响应,并且提出了两个不同的患者组(图10)。第一组患者(聚类1)在adar1a转录水平和b位上的pde8a编辑方面具有显著且快速的ifn-α介导的应答,如曲线的陡峭斜率所观察到的(图10)。如对患者1所观察到的,第二组患者(聚类2)与其他患者相比响应钝化(图9a-9c))。所有患者均使用madrs(montgomery和asberg抑郁症量表)、mini(简明国际神经精神病访谈(miniinternationalneuropsychiatricinterview))、mathys(胸腺状态多维评估量表)和ymrs(杨氏躁狂量表)测试进行临床评估。精神病学评估清楚地显示通过上述测试测量的情绪的改变,例如易怒和/或抑郁状态。实施例11:在非重复自杀企图者中pde8amrna编辑随时间的降低自杀企图是未来企图的最强风险因素之一[23,24]。在自杀后一年内,自杀的再次企图率为12-15%[25,26]。在包括28名患者的随访研究中(表i(b)),我们分析了这些患者在初次就诊和6个月后的临床评估。我们将整个组划分为2个不同的亚组:未再企图自杀(nrsa)的第一组(n=20)和在此期间至少一次企图自杀rsa)的第二组患者(n=8)。在6个月的随访期间,该组的平均自杀企图次数为1.875。使用三个独立的临床评估评分(hamilton、madrs和bdi)监测患者,并且在nrsa组随访期间bdi评分显示出显著改善(图11a)。另一方面,rsa组的临床评估未显示出改善,甚至显示madrs评分的显著恶化(图11b)。为了将临床评估与生物标志物(pde8a基因的rna编辑)进行比较,我们在随访评估时分析了这些患者的白细胞中的rna编辑(图11c和11d)。我们研究了在6个月内pde8amrna编辑是否在非重复性自杀企图者(nrsa)和重复性自杀企图者(rsa)之间进行调整。有趣的是,所有pde8amrna编辑位点在nrsa组中显示出显著变化,而在rsa组中仅b位被修饰,表明改善了患者的精神状态。实施例12:在ifn-α治疗期间在感染丙型肝炎病毒(hcv)的患者中修饰的pde8amrna编辑ifn-α治疗慢性丙型肝炎病毒(hcv)感染期间的严重抑郁症是常见的,发病率高达45%[21]。该模型代表了在短时间(数周)内评估个体抑郁和/或药物引起的精神病学副作用的独特机会。在该研究中,我们利用了在进行利用ifn和利巴韦林的抗病毒治疗的丙型肝炎感染患者中观察到的充分记录和充分表征的情绪变化的优势。在法国的不同医院招募了一小组10名具有丙型肝炎病毒而没有先前精神病症记录的个体。纳入时,患者接受了统一的精神病评估,并在治疗过程中反复进行。在这个特定的环境中,每个患者都作为自己的对照,并且可以随时监测患者随时间的进化。所有患者均使用madrs(montgomery和asberg抑郁症量表)、mini(简明国际神经精神访谈)、mathys(胸腺状态多维评估量表)和ymrs(杨氏躁狂量表)测试进行临床评估。精神病学评价清楚地显示通过上述测试测量的情绪的改变,例如易怒和/或抑郁状态。为了进一步详细研究在用ifn治疗的每个患者中发生的事件,我们在治疗的12周期间分析了madrs评分。我们认为与情绪反应相结合的每个madrs评分高的患者经历了情绪改变(抑郁)。在10名患者中,3名患者被归类为具有抑郁发作。纵向研究的主要优点是每个患者都可以作为自己的参考对照,这排除了遗传变异和环境影响。此外,adar1a可通过干扰素刺激诱导[22]。虽然adar2基因表达在治疗过程中没有变化,但是早在治疗开始后两周就观察到adar1和adar1b转录物水平的明显上调(图12a,表ix))。在adar1a、adar1b和pde8a之间观察到的相似表达谱表明这些基因通过抗病毒治疗特异性地改变。通过应用超深度测序方法,分析和计算调整至相对pde8a转录物水平的pde8a基因的rna编辑(图12b)。由于pde8a基因表达在治疗过程中显著增加,因此通过调整至相对pde8a转录物水平而进行pde8a基因分析的rna编辑。值得注意的是,pde8a转录物的rna编辑增加在整个研究群体中是高度同源的,并且pde8a转录物的b位点上的整体编辑在两周内加倍。这些位点上rna编辑的总体增加在治疗开始后2至4周达到平稳水平(图12c)。与先前在sh-sy5y中获得的数据一致,在感染丙型肝炎的患者中的ifn注射诱导了患者白细胞中rna编辑活性的快速且强烈的增加。通过将基因表达数据组合,观察到具有和不具有抑郁发作的组之间的显著差异(图13a)。令人感兴趣的是,通过特异性分析pde8a转录物的rna编辑与基因表达数据的组合也观察到类似的分离(图13b)。将rna编辑和特异性基因表达生物标志物组合在鉴定治疗过程中经历精神病事件风险的ifn治疗的患者中显示出高特异性和灵敏度(表x,图13d)。最后,通过将鉴定的算法应用于所有时间点的所有患者,我们测试了组合的生物标志物以鉴定风险患者(图14)。生物标志物的组合在整个试验研究过程中非常稳健,从而检测出三名发展抑郁症的患者,18次调用中的3次(16%)是假阴性。另一方面,在未显示出抑郁症临床症状的患者组中,42个结果中只有3个是假阳性(7%)。总体而言,鉴定的血液生物标志物允许准确且稳健地检测在诸如ifn等药理学治疗的背景下有风险发展抑郁症的患者。表ix:pwllcoxon倍数变化aucadar1a2,76e-071,570,897adar1b8,83e-081,330,914pde8a5,42e-041,120,767adarb10,821,010,518表ix:抗病毒治疗开始之前和之后的基因表达数据的统计。表ix概括了通过wilcoxon测试、倍数诱导和roc曲线下面积(auc)获得的p值。随着adar1a、adar1b和pde8a显著增加,adar2表达在研究过程中没有变化。表x:准确性89.8%特异性92.7%灵敏度83.3%ppv83.3%npv92.7%表x:诊断性能:鉴定在治疗过程中有经历精神病事件风险的ifn治疗患者时的特异性和灵敏度参考文献1.ernstc,delevav,dengx,sequeiraa,pomarenskia,etal.(2009)alternativesplicing,methylationstate,andexpressionprofileoftropomyosin-relatedkinasebinthefrontalcortexofsuicidecompleters.archgenpsychiatry66:22-32.2.bani-fatemia,howeas,delucav(2015)epigeneticstudiesofsuicidalbehavior.neurocase21:134-143.3.kaminskyz,wilcoxhc,eatonww,vaneckk,kilaruv,etal.(2015)epigeneticandgeneticvariationatska2predictsuicidalbehaviorandpost-traumaticstressdisorder.translpsychiatry5:e627.4.cavarecl,vincentl,leborgnec,plusquellecc,olliviern,etal.(2013)invitroscreeningfordrug-induceddepressionand/orsuicidaladverseeffects:anewtoxicogenomicassaybasedonce-sscpanalysisofhtr2cmrnaeditinginsh-sy5ycells.neurotoxres23:49-62.5.karanovicj,svikovics,pantovicm,duricas,brajuskovicg,etal.(2015)jointeffectofadarb1gene,htr2cgeneandstressfullifeeventsonsuicideattemptriskinpatientswithmajorpsychiatricdisorders.worldjbiolpsychiatry16:261-271.6.drachevas,pateln,wooda,marcussm,sieverlj,etal.(2008)increasedserotonin2creceptormrnaediting:apossibleriskfactorforsuicide.molpsychiatry13:1001-1010.7.drachevas,chinb,haroutunianv(2008)alteredserotonin2creceptorrnasplicinginsuicide:associationwithediting.neuroreport19:379-382.8.simmonsm,meador-woodruffjh,sodhims(2010)increasedcorticalexpressionofanrnaeditingenzymeoccursinmajordepressivesuicidevictims.neuroreport21:993-997.9.wangp,wup,eganrw,billahmm(2001)humanphosphodiesterase8asplicevariants:cloning,geneorganization,andtissuedistribution.gene280:183-194.10.orlowskirj,o'rourkeks,olorenshawi,hawkinsga,maass,etal.(2008)alterededitingincyclicnucleotidephosphodiesterase8a1genetranscriptsofsystemiclupuserythematosustlymphocytes.immunology125:408-419.11.morsedp,aruscavagepj,bassbl(2002)rnahairpinsinnoncodingregionsofhumanbrainandcaenorhabditiselegansmrnaareeditedbyadenosinedeaminasesthatactonrna.procnatlacadsciusa99:7906-7911.12.youngchaogesd,terencep.speed(2003)resampling-basedmultipletestingformicroarraydataanalysis.test12:1-77.13.gentlemanrc,careyvj,batesdm,bolstadb,dettlingm,etal.(2004)bioconductor:opensoftwaredevelopmentforcomputationalbiologyandbioinformatics.genomebiol5:r80.14.kramarafd,fortunea,reiserb(2001)mroc:acomputerprogramforcombiningtumourpredictingdiseasestates.computmethodsprogramsbiomed66:199-207.15.sujqlj(1993)linearcombinationsofmultiplediagnosticmarkers.journaloftheamericanstatisticalassociation.journaloftheamericanstatisticalassociation:1350-1355.16.wangh(2007)anoteoniterativemarginaloptimization:asimplealgorithmformaximumrankcorrelationestimation.computationalstatisticsanddataanalysis2803-2812.17.staacka,badendiecks,schnorrd,loeningsa,jungk(2006)combineddeterminationofplasmammp2,mmp9,andtimplimprovesthenon-invasivedetectionoftransitionalcellcarcinomaofthebladder.bmcurol6:19.18.soukasa,cohenp,soccind,friedmanjm(2000)leptin-specificpatternsofgeneexpressioninwhiteadiposetissue.genesdev14:963-980.19.levanoney,eisenberge,yelinr,nemzers,halleggerm,etal.(2004)systematicidentificationofabundanta-to-ieditingsitesinthehumantranscriptome.natbiotechnol22:1001-1005.20.porathht,carmis,levanoney(2014)agenome-widemapofhyper-editedrnarevealsnumerousnewsites.natcommun5:4726.21.asnisgm,delagarzar,2nd(2006)interferon-induceddepressioninchronichepatitisc:areviewofitsprevalence,riskfactors,biology,andtreatmentapproaches.jclingastroenterol40:322-335.21.asnisgm,delagarzar,2nd(2006)interferon-induceddepressioninchronichepatitisc:areviewofitsprevalence,riskfactors,biology,andtreatmentapproaches.jclingastroenterol40:322-335.22.georgecx,samuelce(1999)humanrna-specificadenosinedeaminaseadar1transcriptspossessalternativeexon1structuresthatinitiatefromdifferentpromoters,oneconstitutivelyactiveandtheotherinterferoninducible.procnatlacadsciusa96:4621-4626.23.borgesg,angstj,nockmk,ruscioam,waltersee,etal.(2006)ariskindexfor12-monthsuicideattemptsinthenationalcomorbiditysurveyreplication(ncs-r).psycholmed36:1747-1757.24.browngk,beckat,steerra,grishamjr(2000)riskfactorsforsuicideinpsychiatricoutpatients:a20-yearprospectivestudy.jconsultclinpsychol68:371-377.25.cederekem,ojehagena(2005)predictionofrepeatedparasuicideafterl-12months.eurpsychiatry20:101-109.26.heyerdahlf,bjornaasma,dahlr,hovdake,noreak,etal.(2009)repetitionofacutepoisoninginoslo:1-yearprospectivestudy.brjpsychiatry194:73-79.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1