使用栓系的核苷三磷酸的核酸合成和测序的制作方法
本申请要求2016年6月24日提交的申请号为62/354,635的美国专利申请的权益,该申请通过引用并入本文。
背景
现今进行的绝大多数下一代测序(ngs)是基于“合成测序”(sbs)的,其中引发的模板分子的序列通过由聚合酶逐步掺入互补核苷酸产生的信号确定(goodwin等,natrevgenet.2016may17;17(6):333-51)。目前,最流行的sbs方法采用荧光“可逆终止子”核苷酸(rtdntp)—经过化学修饰的核苷酸,一旦它们掺入引物中就可以阻断通过聚合酶的延伸。掺入后,除去游离的rtdntp,并通过来自掺入的核苷酸的荧光信号确定添加的碱基的同一性。接下来,从掺入的核苷酸除去荧光报告物和终止基团,使引物不发荧光并准备用于随后的通过聚合酶的延伸。通过重复该模板依赖性延伸、检测和脱保护的循环,由荧光信号的序列推断模板分子的序列。
现代dna合成始于使用亚磷酰胺方法化学合成数十至数百个的50-200nt寡核苷酸(oligo)(beaucage和caruthers,tetrahedronletters22.20(1981):1859-1862)。将这些寡核苷酸组装成千碱基大小的产物,然后对产物进行分离、序列验证并扩增,用于随后在必要时重组成全长靶序列(kosuri和church,naturemethods11.5(2014):499-507)。尽管进行了数十年的逐步改进,但寡核苷酸合成的每个化学步骤产生0.5-1.0%的未反应(或副反应)的产物,并且这些小的损失以指数方式复合,严重破坏全长寡核苷酸的产率。由于许多寡核苷酸被组装成每个千碱基大小的产物,因此在组装反应中甚至一小部分错误寡核苷酸的存在将导致大多数产物含有至少一个错误。现有技术水平的基因合成技术应用各种“纠错”策略来富集无错误的寡核苷酸或组装产物,但据报道错误的寡核苷酸是“现今dna合成方案中最关键的因素”(czar等,trendsinbiotechnology27.2(2009):63-72)。此外,许多生物相关序列,如具有重复或结构形成区域和/或高或低g/c含量的序列,如果不是不可能,则难以通过寡核苷酸的组装构建,阻碍了它们在研究和工程中的使用。
到目前为止,没有使用聚合酶以类似于sbs的循环方式延伸核酸的从头合成dna的实用方法。
可以说导致ngs革命的关键进展来自可逆终止子脱氧核苷三磷酸(rtdntp)的开发,可逆终止子脱氧核苷三磷酸可通过聚合酶掺入dna并可逆地终止dntp的进一步添加。改进的系统使得生长的核酸的单核苷酸延伸可以有利于sbs,并且实现实际的酶促的dna从头合成。
概述
除了其他方面,本发明提供了包含聚合酶和核苷三磷酸的结合物,其中所述聚合酶和核苷三磷酸通过包含可裂解的键的接头共价连接。还提供了一组这样的结合物,其中所述结合物对应于g、a、t(或u)和c。还提供了用于合成限定序列的核酸的方法。所述结合物还可以用于测序应用。
附图简述
技术人员将理解,下面描述的附图仅用于说明目的。附图不旨在以任何方式限制本发明的教导的范围。
图1a.使用聚合酶-核苷酸结合物的两步循环核酸合成的方案。在第一步中,结合物使用其连接的dntp部分延伸dna分子;在第二步中,聚合酶和延伸的dna分子之间的键被裂解,使dna分子脱保护以用于随后的延伸。
图1b.使用tdt-dntp结合物的两步循环核酸合成的方案,所述tdt-dntp结合物包含通过可裂解的接头使用dntp位点特异性标记的tdt分子。
图2.tdt(pdbid:4i27)与寡核苷酸和dntp的共晶结构,注释用以表明将dntp连接到聚合酶的可能的接头的位置。
图3a-3e.用于将dutp栓系到tdt的方案以及使用结合物延伸核酸的化学细节。
图3a.制备巯基反应性接头-核苷酸opss-peg4-氨基-烯丙基-dutp的起始材料。
图3b.巯基反应性接头-核苷酸opss-peg4-氨基-烯丙基-dutp的结构。
图3c.通过用opss-peg4-氨基-烯丙基-dutp标记tdt制备的聚合酶-核苷酸结合物。
图3d.通过聚合酶-核苷酸结合物延伸dna分子。
图3e.延伸的dna分子和tdt之间的键的裂解。
图4a-4e.基于光可裂解的接头将dctp栓系到tdt的方案以及使用结合物延伸核酸的化学细节。
图4a.制备巯基反应性接头-核苷酸bp-23354-炔丙基氨基-dctp的起始材料。
图4b.巯基反应性的光可裂解的接头-核苷酸bp-23354-炔丙基氨基-dctp的结构。
图4c.通过用bp-23354-炔丙基氨基-dctp标记tdt制备的聚合酶-核苷酸结合物。
图4d.通过聚合酶-核苷酸结合物延伸dna分子。
图4e.延伸的dna分子和tdt之间的键的裂解。
图5a-5e.使用荧光聚合酶-核苷酸结合物的实时纠错的dna合成的方案。
图5a.反应室负载有引物的单分子。
图5b.引物通过结合物延伸。
图5c.通过检测结合物的报告部分确认延伸反应。如果未检测到报告物,则重复延伸反应。
图5d.通过裂解接头对引物脱保护,释放聚合酶和报告物。
图5e.通过报告部分检测的缺失确认脱保护反应。如果未检测到报告物,则重复脱保护反应。
图6.集成微流体装置的示意图,其用于使用可通过tirf显微镜检测的荧光聚合酶-核苷酸结合物的dna合成。
图7a-7e.使用荧光聚合酶-核苷酸结合物的dna测序的方案。
图7a.反应室负载有引物-模板双链体。
图7b.将引物-模板双链体暴露于由不同荧光团标记的四种核苷酸的结合物的混合物,并通过与待测序的第一模板碱基互补的结合物延伸。
图7c.通过检测结合物的报告部分确定模板碱基。
图7d.通过裂解接头对引物进行脱保护,释放聚合酶和报告物。
图7e.通过报告部分检测的缺失任选地确认脱保护反应。
图8a-8b在sds-page上通过具有不同数量的栓系的核苷酸的聚合酶-核苷酸结合物证实引物的延伸。
图8a.通过野生型tdt(具有最多五个栓系的核苷酸)和仅具有一个栓系的核苷酸的tdt突变体延伸引物。
图8b.通过具有各种用于栓系的核苷酸的连接点的tdt突变体的结合物延伸引物。
图9a-9b.通过sds-page和毛细管电泳(ce)证明dna合成反应循环。
图9a.通过聚合酶-核苷酸结合物延伸引物和裂解接头时,蛋白质-dna复合物形成和解离的sds-page分析。
图9b.来自图9a的反应产物的毛细管电泳图。
图10.通过16μmtdt-datp、-dctp、-dgtp和-dttp结合物延伸25nmdna引物,接着是光解的反应时程的毛细管电泳图。
图11a-11b.4-聚体(5’-ctag-3’)的合成的证明。
图11a.延伸产物的合成和序列验证过程。步骤2:seqidno:15,步骤3:从上到下:seqidno:16、seqidno:23。
图11b.克隆之一(seqidno:17)的测序电泳图。
图12.通过ce分析证明游离核苷酸通过其掺入的栓系的核苷酸掺入栓系到聚合酶的引物中。
图13a-13c.证明瘢痕dna可以充当精确互补dna合成的模板的实验设置。
图13a.合成由具有3-乙酰氨基丙炔基修饰(“瘢痕”)的核苷酸组成的多核苷酸的方案。
图13b.合成的“瘢痕”多核苷酸的毛细管电泳分析。
图13c.“瘢痕”多核苷酸的qpcr扩增。
图14a-14b.10-聚体(5’-ctactgactg-3’)(seqidno:18)的合成的证明。
图14a.延伸产物的合成和序列验证的过程。步骤1:seqidno:19,步骤2:seqidno:20,步骤3:从上到下:seqidno:21,seqidno:24。
图14b.克隆之一(seqidno:22)的测序电泳图和合成步骤的分析。
详述
本发明提供了包含聚合酶和核苷三磷酸的结合物,其中所述聚合酶和核苷三磷酸通过包含可裂解的键的接头连接。这样的结合物的实例显示在图3c和图4c中。结合物的聚合酶部分可以使用其连接的核苷三磷酸延伸核酸(即聚合酶可以催化与其连接的核苷酸连接到核酸上)并通过接头保持连接到延伸的核酸,直到接头被裂解。
在一些实施方案中,一旦结合物的聚合酶已将其栓系的核苷酸掺入到核酸中,通过其他聚合酶-核苷酸结合物进一步延伸该核酸通过在本文中称为“屏蔽”的作用被阻碍,其中术语“屏蔽”是指以下现象,其中1)连接的聚合酶分子阻碍其他结合物分子接近延伸的dna分子的3’oh,和2)阻碍栓系到其他结合物分子的核苷三磷酸分子接近已经连接到延伸的核酸的末端的聚合酶的催化位点。在一些实施方案中,可以终止核酸的进一步延伸,而不需要在栓系的核苷三磷酸上的另外的阻断基团。由屏蔽效应引起的延伸的终止可以通过接头的裂解来逆转,其释放栓系的聚合酶并从而暴露延伸的核酸的3’端,以通过另一种结合物实现随后的延伸。
在任何实施方案中,结合物可以包含另外的部分,一旦栓系的核苷酸已掺入,所述部分有助于终止核酸的延伸。例如,熟知的且在众多出版物中综述的3’o-修饰的或碱基修饰的可逆终止子脱氧核苷三磷酸(rtdntp)可以栓系到聚合酶,所述出版物包括chen,fei等(genomics,proteomics&bioinformatics11.1(2013):34-40.)。可逆终止子核苷酸是指化学修饰的核苷三磷酸类似物,其可以在具有聚合酶和核酸的溶液中孵育,并且一旦掺入核酸分子中就阻碍反应中的进一步延伸。当包含聚合酶和rtdntp的结合物用于延伸核酸时,除了接头的裂解以外,还可能需要rtdntp的脱保护以使得延伸的核酸能够经历另外的核苷酸添加。
在一些实施方案中,结合物可以是荧光的,其在测序应用中可能是有用的。在一些实施方案中,核苷三磷酸可以连接到聚合酶中的半胱氨酸残基。然而,其他化学物质可以用于连接蛋白和核苷三磷酸,因此在一些情况下,核苷三磷酸可以连接到聚合酶中的非半胱氨酸残基。
可裂解的接头应该能够使用刺激物(例如,光、其环境的改变或暴露于化学物质或酶)选择性地裂解,而不破坏核酸中的其他键。在一些实施方案中,可裂解的键可以是二硫键,其可以使用还原剂(例如,β-巯基乙醇等)容易地破坏。可能适合的可裂解的键可以包括但不限于以下:碱可裂解的位点,如酯,特别是琥珀酸酯(可被例如氨或三甲胺裂解的),季铵盐(可被例如二异丙胺裂解的)和氨基甲酸酯(可被氢氧化钠水溶液裂解的);酸可裂解的位点,如苄醇衍生物(可使用三氟乙酸裂解的),替考拉宁苷元(可被三氟乙酸,接着被碱裂解的),缩醛和硫缩醛(还可被三氟乙酸裂解的),硫醚(可被例如hf或甲酚裂解的)和磺酰基(可被三氟甲磺酸、三氟乙酸、硫代苯甲醚等裂解的);亲核试剂可裂解的位点,如邻苯二甲酰胺(可被取代的肼裂解的),酯(可被例如三氯化铝裂解的);和weinreb酰胺(可被氢化锂铝裂解的);和其他类型的化学可裂解的位点,包括硫代磷酸酯(可被银或汞离子裂解的),二异丙基二烷氧基甲硅烷基(可被氟离子裂解的),二醇(可被高碘酸钠裂解的)和偶氮苯(可被连二亚硫酸钠裂解的)。其他可裂解的键对于本领域技术人员将是显而易见的,或者在相关文献和课本中有描述(例如,brown(1997)contemporaryorganicsynthesis4(3);216-237)。
在特定的实施方案中,可以采用光可裂解的(“pc”)接头(例如,紫外可裂解的接头)。供使用的适合的光可裂解的接头可以包括基于邻硝基苄基的接头、苯甲酰甲基接头、烷氧基苯偶姻接头、铬芳烃络合物接头、npssmpact接头和新戊酰二醇接头,如guillier等(chemrev.2000jun14;100(6):2091-158)描述的。可以在主题方法中使用的示例性连接基团可以在guillier等,同上和olejnik等(methodsinenzymology1998291:135-154)中描述,并进一步描述于u.s.p.n.6,027,890;olejnik等(proc.natl.acadsci,92:7590-94);ogata等(anal.chem.200274:4702-4708);bai等(nucl.acidsres.200432:535-541);zhao等(anal.chem.200274:4259-4268);和sanford等(chemmater.199810:1510-20),并且可购自ambergen(boston,ma;nhs-pc-lc-biotin)、linktechnologies(bellshill,scotland)、fisherscientific(pittsburgh,pa)和calbiochem-novabiochemcorp.(lajolla,ca)。
在其他实施方案中,键可以被酶裂解。例如,酰胺键可以被蛋白酶裂解,酯键可以被酯酶裂解,并且糖苷键可以被糖苷酶裂解。在一些实施方案中,裂解试剂还可以破坏连接的聚合酶中的键,例如,蛋白酶还可以消化聚合酶。
在结合物中,接头被认为至少是将核苷酸的碱基、糖或α-磷酸连接到聚合酶的主链中的cα原子的原子。在一些实施方案中,聚合酶和核苷酸共价连接,并且核苷酸的连接原子和其连接的聚合酶的主链中的cα原子之间的距离可以在
在所有实施方案中,使用的接头应足够长以允许核苷三磷酸接近其栓系的聚合酶的活性位点。如下文将更详细描述的,结合物的聚合酶能够催化将其连接的核苷酸添加到核酸的3’端上。
核酸的长度可以是至少3个核苷酸、至少10个核苷酸、至少50个核苷酸、至少100个核苷酸、至少500个核苷酸、至少1,000个核苷酸或至少5,000个核苷酸,并且可以是完全单链的或至少部分双链的,例如,与另一个分子(即双链体的部分)或与其自身(例如,以发夹的形式)杂交。在任何实施方案中,核酸可以是寡核苷酸,其长度可以为至少3个核苷酸,例如长度为至少10个核苷酸,至少50个核苷酸,至少100个核苷酸,长度为至少500个核苷酸至最多1,000个核苷酸或更多,并且可以是完全单链的或至少部分双链的,例如,与另一个分子(即双链体的部分)或与其自身(例如,以发夹的形式)杂交。在一些实施方案中,寡核苷酸可以与模板核酸杂交。在这些实施方案中,模板核酸的长度可以是至少20个核苷酸,例如长度为至少80个核苷酸,长度为至少150个核苷酸,长度为至少300个核苷酸,长度为至少500个核苷酸,长度为至少2000个核苷酸,长度为至少4000个核苷酸或至少10,000个核苷酸。在一些情况下,核酸可以是天然dna底物的部分,例如,它可以是质粒的链。如果核酸是双链的,则它可以具有3’突出端。
本发明还提供了一组上文总结的结合物,其中结合物对应于(即具有与其相同的碱基配对能力)g、a、t(或u)和c(即脱氧腺苷三磷酸(datp)、脱氧鸟苷三磷酸(dgtp)、脱氧胞苷三磷酸(dctp)、脱氧胸苷三磷酸(dttp))。
在一些实施方案中,这些结合物在不同的容器中。在其他实施方案中,结合物可以在相同的容器中,特别是如果其将用于测序。本文使用的核苷酸可以包含腺嘌呤、胞嘧啶、鸟嘌呤和胸腺嘧啶碱基,和/或与互补核苷酸碱基配对并且能够通过dna或rna聚合酶用作模板的碱基,例如7-脱氮-7-炔丙基氨基-腺嘌呤、5-炔丙基氨基-胞嘧啶、7-脱氮-7-炔丙基氨基-鸟苷、5-炔丙基氨基-尿苷、7-脱氮-7-羟甲基-腺嘌呤、5-羟甲基-胞嘧啶、7-脱氮-7-羟甲基-鸟苷、5-羟甲基-尿苷、7-脱氮-腺嘌呤、7-脱氮-鸟嘌呤、腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶、尿嘧啶、2-脱氮-2-硫代-鸟苷、2-硫代-7-脱氮-鸟苷、2-硫代-腺嘌呤、2-硫代-7-脱氮-腺嘌呤、异鸟嘌呤、7-脱氮-鸟嘌呤、5,6-二氢尿苷、5,6-二氢胸腺嘧啶、黄嘌呤、7-脱氮-黄嘌呤、次黄嘌呤、7-脱氮-黄嘌呤、2,6-二氨基-7-脱氮嘌呤、5-甲基-胞嘧啶、5-丙炔基-尿苷、5-丙炔基-胞苷、2-硫代-胸腺嘧啶或2-硫代-尿苷是这样的碱基的实例,但也已知其他的。用于合成和/或测序dna分子的示例性的一组结合物可以包括连接到选自以下的脱氧核糖核苷酸三磷酸的dna聚合酶:脱氧核糖腺苷三磷酸(datp)、脱氧核糖鸟苷三磷酸(dgtp)、脱氧核糖胞苷三磷酸(dctp)、脱氧核糖胸苷三磷酸(dttp)和/或与那些脱氧核糖核苷酸以相同方式碱基配对的其他脱氧核糖核苷酸。用于合成rna分子的示例性的一组结合物可以包括连接到选自以下的核糖核苷酸三磷酸的rna聚合酶:腺苷三磷酸(atp)、鸟苷三磷酸(gtp)、胞苷三磷酸(dctp)和尿苷三磷酸(utp)和/或与那些核糖核苷酸三磷酸以相同方式碱基配对的其他核糖核苷酸。
上述结合物可以用于核酸合成方法。在一些实施方案中,该方法可包括:在其中聚合酶催化第一结合物的核苷酸共价添加到核酸的3’羟基上的条件下,使用第一结合物孵育核酸,以制备延伸产物。该反应可以使用连接到固体载体或在溶液中,即未栓系到固体载体的核酸进行。在通过第一期望的核苷酸延伸核酸后,所述方法可以包括脱保护步骤,其中接头的可裂解的键被裂解,从而从延伸产物释放聚合酶。如果可裂解的键是二硫键,这可以通过将反应产物暴露于还原条件完成。然而,该步骤可使用其他化学物质和试剂。在一些实施方案中,核苷三磷酸可以是rtdntp,并且该方法的脱保护步骤还包括从添加的核苷酸去除阻断基团(即去除终止子基团)以制备脱保护的延伸产物。脱保护实现核酸的随后延伸,从而允许这些步骤循环重复以制备限定序列的延伸产物。具体地,在一些实施方案中,该方法还可以在脱保护后包括:在其中聚合酶催化第二结合物的核苷酸共价添加到延伸产物的3’端上的条件下,用第二结合物孵育脱保护的延伸产物。
在一些实施方案中,该方法可以包括(a)在其中聚合酶催化第一结合物的核苷酸(即单个核苷酸)共价添加到核酸的3’羟基上的条件下,用第一结合物孵育核酸,以制备延伸产物;(b)裂解接头的可裂解的键,从而从延伸产物释放所述聚合酶,并使延伸产物脱保护;(c)在其中聚合酶催化第二结合物的核苷酸共价添加到延伸产物的3’端上的条件下,用权利要求1的第二结合物孵育脱保护的延伸产物,以制备第二延伸产物;(d)对第二延伸产物重复步骤(b)-(c)多次(例如,2至100或更多次),以制备限定序列的延伸的寡核苷酸。步骤(b)-(c)可以根据需要重复多次,直到合成限定序列和长度的延伸产物。最终产物的长度可以是2-100个碱基,但理论上,该方法可用于制备任何长度的产物,包括大于200个碱基或大于500个碱基的产物。
在某些实施方案中,接头的裂解可以在每个或一些添加的核苷酸上留下“瘢痕”(即接头的部分)。在其他实施方案中,接头的裂解不产生瘢痕。
在一些实施方案中,在每个脱保护步骤之后,瘢痕可以进一步衍生化(例如,通过使用碘乙酰胺对含硫醇的瘢痕的烷基化)。在其他实施方案中,最终产物中的所有瘢痕可以同时衍生化(例如通过使用nhs乙酸酯乙酰化炔丙基氨基瘢痕)。
在一些实施方案中,可以例如通过pcr或一些其他方法扩增产物,以产生没有瘢痕的产物(如实施例4中所示)。
还提供了一种测序的方法。这些方法可以包括用包含一组结合物的组合物孵育包含引物和模板的双链体,其中所述结合物对应于g、a、t和c,并且被可区分地标记,例如荧光标记;通过检测栓系到已将核苷酸添加到引物的聚合酶的标记,检测哪个核苷酸已经添加到引物;通过裂解所述接头使所述延伸产物脱保护;和重复孵育、检测和脱保护步骤,以获得模板的至少部分的序列。
还提供了可以用于制备上述结合物的试剂组。在一些实施方案中,该试剂组可以包括:聚合酶,其经修饰以在其表面上包含单个半胱氨酸;和一组核苷三磷酸,其中核苷三磷酸中的每个连接到巯基反应基团。在一些实施方案中,核苷三磷酸对应于g、a、t和c。如上所述,核苷三磷酸可以是可逆终止子。在该试剂组中,核苷三磷酸可以包含长度在
在任何实施方案中,聚合酶可以是非模板依赖性聚合酶,即末端脱氧核苷酸转移酶或dna核苷酸外转移酶,这些术语可互换使用,是指使用iubmb命名法的具有活性2.7.7.31的酶。这些酶的描述可以见于bollum,f.j.deoxynucleotide-polymerizingenzymesofcalfthymusgland.v.homogeneousterminaldeoxynucleotidyltransferase.j.biol.chem.246(1971)909-916;gottesman,m.e.和canellakis,e.s.theterminalnucleotidyltransferasesofcalfthymusnuclei.j.biol.chem.241(1966)4339-4352;和krakow,j.s.,coutsogeorgopoulos,c.和canellakis,e.s.studiesontheincorporationofdeoxyribonucleicacid.biochim.biophys.acta55(1962)639-650。
末端转移酶实施方案可以用于dna合成。
在任何实施方案中,聚合酶可以是模板依赖性聚合酶,即dna指导的dna聚合酶(这些术语可互换使用,是指使用iubmb命名法的具有活性2.7.7.7的酶),或dna指导的rna聚合酶。这些酶的描述可以见于richardson,a.enzymaticsynthesisofdeoxyribonucleicacid.xiv.furtherpurificationandpropertiesofdeoxyribonucleicacidpolymeraseofescherichiacoli.j.biol.chem.239(1964)222-232;schachman,a.enzymaticsynthesisofdeoxyribonucleicacid.vii.synthesisofapolymerofdeoxyadenylateanddeoxythymidylate.j.biol.chem.235(1960)3242-3249;和zimmerman,b.k.purificationandpropertiesofdeoxyribonucleicacidpolymerasefrommicrococcuslysodeikticus.j.biol.chem.241(1966)2035-2041。
在任何上述实施方案中,核苷三磷酸可以是脱氧核糖核苷三磷酸或核糖核苷三磷酸。在一些实施方案中,结合物可以包含连接到核糖核苷三磷酸的rna聚合酶。在这些实施方案中,添加到核酸的核苷酸可以是核糖核苷酸。在其他实施方案中,结合物包含连接到脱氧核糖核苷三磷酸的dna聚合酶。在这些实施方案中,添加到核酸的核苷酸可以是脱氧核糖核苷酸。
在任何实施方案中,使用的聚合酶可以具有与野生型聚合酶至少80%相同,例如至少90%或至少95%相同的氨基酸序列。
在一些实施方案中,每步核苷酸添加步骤的产率可以是至少70%、至少80%、至少90%、至少95%、至少97%、至少98%或至少99%,例如91%或99.5%。可以通过优化条件来提高该方法的任何实施方式的每步产率。如将认识到的,通过所提出的方法制备的核酸可以在使用前例如通过液相色谱法纯化。
在任何实施方案中,结合物可以另外包含与聚合酶融合的另外的多肽结构域。例如,麦芽糖结合蛋白可以与末端脱氧核苷酸转移酶的n-末端融合,以增强其溶解度和/或实现直链淀粉亲和纯化。在任何实施方案中,核苷三磷酸可以是可逆终止子。
本文提及的所有专利和出版物,包括在这些专利和出版物中公开的所有序列,都明确地通过引用并入本文。
以上描述的试剂和方法的另外的细节可以在下文找到。该描述中的一些涉及tdt。该描述的原理也可以应用于其他模板非依赖性聚合酶和模板依赖性聚合酶。
栓系的核苷酸可以具有高有效浓度,实现快速掺入动力学。
根据接头的长度和几何形状及其在蛋白质上的连接位点,栓系的核苷酸将具有聚合酶的活性位点的特定的占据速率。该速率可以表示为有效浓度(将给出相当的占据速率的游离核苷酸的浓度)。通过改变接头性质和连接位点,能够控制核苷酸的有效浓度,实现高有效浓度并因此实现快速掺入。例如,非常粗略的计算表明,由
接头在聚合酶上的连接位置
在一些实施方案中,接头特异性连接到聚合酶的氨基酸(参见图2的示意图)。在这些情况下,优选将接头连接到可以突变而不损失聚合酶活性的位置处的氨基酸,例如,鼠tdt的180、188、253或302位(如在晶体结构pdbid:4i27中的编号)。优选不将接头连接到参与聚合酶的催化活性的氨基酸,以避免干扰催化。已知参与催化的残基和确定残基是否参与催化的方法(例如通过位点特异性诱变)对于本领域技术人员而言是显而易见的,并且在文献中进行了综述(例如,joyce等(journalofbacteriology177.22(1995):6321.)和jara和martinez(thejournalofphysicalchemistryb120.27(2016):6504-6514.))。
接头的长度
在任何实施方案中,接头的长度可以长于聚合酶上接头的连接位置与核苷三磷酸结合到催化位点时其上的连接位置之间的距离。在一些情况下,空间限制,例如,由于聚合酶或由于接头可以限制栓系的核苷三磷酸的移动性,需要增加的接头长度以使栓系的核苷三磷酸能够接近生产构象的聚合酶的催化位点。例如,接头长度可以超过其两个连接点之间的距离
接头与聚合酶的位点特异性连接策略。
在一些实施方案中,使用巯基特异性连接化学物质,可以将栓系的核苷三磷酸特异性连接到聚合酶的半胱氨酸残基。可能的巯基特异性连接化学物质包括但不限于可以有利地与特定氨基酸序列包围的巯基反应的邻吡啶基二硫化物(opss)(如图3中例举并在实施例1中说明的)、马来酰亚胺官能团(如图4中例举并在实施例2中说明的)、3-芳基丙炔腈官能团、连烯胺官能团、卤代乙酰基官能团如碘乙酰基或溴乙酰基、烷基卤化物或全氟芳基基团(zhang,chi,等naturechemistry8,(2015)120–128)。用于特定标记半胱氨酸残基的其他连接化学物质对于本领域技术人员将是显而易见的,或者在相关文献和课本中描述(例如,kim,younggyu等bioconjugatechemistry19.3(2008):786-791)。
在其他实施方案中,接头可以通过胺反应性官能团(例如nhs酯、磺基-nhs酯、四氟或五氟苯酯、异硫氰酸酯、磺酰氯等)连接到赖氨酸残基。
在其他实施方案中,接头可以通过连接到以基因的形式插入的非天然氨基酸连接到聚合酶,所述以基因的形式插入的非天然氨基酸例如可以进行叠氮-炔烃huisgen环加成的对炔丙氧基苯丙氨酸或对叠氮基苯丙氨酸,但是存在许多适合位点特异性标记的适合的非天然氨基酸,并且可以在文献中找到(例如,如lang和chin.,chemicalreviews114.9(2014):4764-4806中所述)。
在其他实施方案中,接头可以特异性连接到聚合酶n-末端。在一些实施方案中,聚合酶突变成具有n-末端丝氨酸或苏氨酸残基,其可被特异性氧化以产生n-末端醛,用于随后偶联至例如酰肼。在其他实施方案中,聚合酶突变成具有n-末端半胱氨酸残基,其可以用醛特异性标记以形成噻唑烷。在其他实施方案中,可以通过天然化学连接用肽接头标记n-末端半胱氨酸残基。
在其他实施方案中,可以将肽标签序列插入聚合酶中,所述肽标签序列可以通过酶用合成基团特异性标记,例如如文献中所证明的,使用生物素连接酶、转谷氨酰胺酶、硫辛酸连接酶、细菌分选酶和磷酸泛酰巯基乙胺基转移酶(例如,如stephanopoulos&francisnat.chem.biol.7,(2011)876-884的参考文献74-78中所述)。
在其他实施方案中,接头连接到融合到聚合酶的标记结构域。例如,具有相应反应性部分的接头可用于共价标记snap标签、clip标签、halotag和酰基载体蛋白结构域(例如,如stephanopoulos&francisnat.chem.biol.7,(2011)876–884的参考文献79-82中所述)。
在其他实施方案中,接头连接到在聚合酶内特异性产生的醛,如carrico等所述(nat.chem.biol.3,(2007)321–322)。例如,在将酶甲酰甘氨酸生成酶(fge)识别的氨基酸序列插入聚合酶后,可将其暴露于fge,其将特异性地将识别序列中的半胱氨酸残基转化为甲酰甘氨酸(即产生醛)。然后可以用例如接头的酰肼或氨氧基部分特异性标记该醛。
在一些实施方案中,接头可以通过接头部分与融合到聚合酶的部分的非共价结合而连接到聚合酶。这样的连接策略的实例包括将聚合酶与可以结合接头的生物素部分的链霉亲和素融合,或将聚合酶与可以结合接头的洋地黄毒苷部分的抗洋地黄毒苷融合。
在一些实施方案中,位点特异性标记可以导致容易被逆转的接头与聚合酶的连接(例如,与半胱氨酸形成二硫键的邻吡啶基二硫化物(opss)基团,其可以使用还原剂,例如使用tcep裂解),其他连接化学物质将产生永久性连接。
在任何实施方案中,聚合酶可以突变以确保栓系的核苷酸特异性连接到聚合酶的特定位置,这对于本领域技术人员将是显而易见的。例如,对于巯基特异性连接化学物质如马来酰亚胺或邻吡啶基二硫化物,野生型聚合酶中可接近的半胱氨酸残基可以突变为非半胱氨酸残基以防止在那些位置标记。在这种“无反应性半胱氨酸”的背景下,可以通过在期望的连接位置的突变引入半胱氨酸残基。这些突变优先不干扰聚合酶的活性。
将合成基团位点特异性连接到蛋白的其他策略对于本领域技术人员是显而易见的,并且在文献中进行了综述(例如,stephanopoulos&francisnat.chem.biol.7,(2011)876–884)。
将接头连接到核苷三磷酸的策略。
在一些实施方案中,接头连接在嘧啶的5位或7-脱氮嘌呤的7位。在其他实施方案中,接头可以连接到核碱基的环外胺,例如,通过用如下讨论的硝基苄基部分使胞嘧啶的环外胺n-烷基化。在其他实施方案中,接头可以连接到核碱基、糖或α-磷酸中的任何其他原子,这对于本领域技术人员将是显而易见的。
某些聚合酶对核苷酸的某些部分的修饰具有高耐受性,例如,一些聚合酶对嘧啶的5位和嘌呤的7位的修饰是良好耐受的(he和seela.nucleicacidsresearch30.24(2002):5485-5496.;或hottin等,chemistry.2017feb10;23(9):2109-2118)。在一些实施方案中,接头连接到这些位置。
在一些实例中,通过首先合成包含接头和核苷三磷酸的中间化合物(在本文中称为“接头-核苷酸”)来制备聚合酶-核苷酸结合物,然后将该中间化合物连接到聚合酶。在一些实例中,与天然核苷相比具有取代的核苷,例如,具有5-羟甲基或5-炔丙基氨基取代基的嘧啶,或具有7-羟甲基或7-炔丙基氨基取代基的7-脱氮嘌呤可以是用于制备接头-核苷酸的有用的起始材料。可用于制备接头-核苷酸的具有5-和7-羟甲基取代基的示例性的一组核苷如下所示:
可用于制备接头-核苷酸的具有5-和7-脱氮-7-炔丙基氨基取代基的示例性的一组核苷如下所示:
这些核苷也可作为脱氧核糖核苷三磷酸商购获得。
在实施例2中,通过使包含5-和7-炔丙基氨基取代基的核苷三磷酸与包含硝基苄基nhs碳酸酯的前体分子反应制备包含连接到嘧啶的5位和7-脱氮嘌呤的7位的3-(((2-硝基苄基)氧基)羰基)氨基丙炔基的接头-核苷酸(如图4所示)。
接头裂解策略
如上所述,接头可以连接到核苷酸上的各个位置,并且可以使用多种裂解策略。这些策略可以包括但不限于以下实例:
在一些实施方案中,可以通过暴露于还原剂例如二硫苏糖醇(dtt)来裂解接头。例如,包含连接到嘧啶的5位或7-脱氮嘌呤的7位的4-(二硫烷基)丁酰氧基-甲基的接头可以通过还原剂(例如dtt)裂解以在核碱基上产生4-巯基丁酰氧基甲基瘢痕。该瘢痕可以经历分子内硫代内酯化以消除2-氧硫戊环,在核碱基上留下较小的羟甲基瘢痕。连接到胞嘧啶的5位的这种接头的实例如下所示,但该策略适用于任何合适的核碱基:
在其他实施方案中,可以通过暴露于光来裂解接头。例如,包含(2-硝基苄基)氧基甲基的接头可以用365nm光裂解,留下羟甲基瘢痕,例如如以下针对胞嘧啶所示,但适用于任何合适的核碱基:
(其中,例如,r”=h或r”=ch3或r”=t-bu。)
在其他实施方案中,接头可以包含3-(((2-硝基苄基)氧基)羰基)氨基丙炔基,其可以用365nm光裂解以释放具有炔丙基氨基瘢痕的核碱基。该策略用于实施例2,并且在以下针对胞嘧啶所示,但适用于任何合适的核碱基:
在其他实施方案中,接头可以包含酰基氧基甲基,其可以用合适的酯酶裂解以释放具有羟甲基瘢痕的核碱基,例如,如以下针对胞嘧啶所示,但适用于任何合适的核碱基:
在这样的实施方案中,接头可以包含与酯相邻的另外的原子(包括在上述的r’中),其增加酯酶对酯键的活性。
在其他实施方案中,接头可以包含n-酰基-氨基丙炔基,其可以用肽酶裂解以释放具有炔丙基氨基瘢痕的核碱基,例如,如以下针对5-炔丙基氨基胞嘧啶所述,但适用于任何合适的核碱基:
在这样的实施方案中,接头可以包含与酰胺相邻的另外的原子(包括在上述的r’中),其增加肽酶对酰胺键的活性。在一些实施方案中,r’是肽或多肽。
裂解肽键以分离栓系的核苷酸
在一些实施方案中,将一个或多个氨基酸插入聚合酶中,所述氨基酸可以充当可裂解的接头的部分,以用于核苷酸的特异性连接。在这种情况下,接头包含插入的氨基酸,并且可裂解的键被认为是插入的氨基酸(多个插入的氨基酸)的一个或多个键。例如,肽键可以使用肽酶(这些术语可互换使用,指使用iubmb命名法的具有活性3.4的酶),例如蛋白酶k(ec3.4.21.64,使用iubmb命名法)裂解。
在一些实施方案中,蛋白本身可以被裂解以从聚合酶分离栓系的核苷三磷酸。例如,可以使用肽酶裂解接头连接位置之前和/或之后的肽键。
在一些实施方案中,接近接头的连接点的氨基酸位置可以突变,以确保连接点附近的肽序列是蛋白酶的良好底物,这对于本领域技术人员是显而易见的。例如,可以将突变引入脂族氨基酸如亮氨酸或苯丙氨酸,以实现用蛋白酶k的快速裂解。
rtdntp-聚合酶结合物
在某些实施方案中,栓系核苷酸类似物,使得当在溶液中可游离获得时,掺入时不终止dna合成。然而,在其他实施方案中,栓系含有可逆终止子基团的核苷酸类似物,所述基团如糖的3’位上的o-叠氮甲基或o-nh2基团或嘧啶的5位或7-脱氮嘌呤的7位上的(α-叔丁基-2-硝基苄基)氧基甲基(概述参见例如chen等,genomics,proteomics&bioinformatics201311:34–40)。在这些实施方案中,核苷酸类似物一旦掺入核酸中就防止或阻碍进一步延伸,因此可能除了结合物的其他有助于终止(例如屏蔽)性质之外,有助于结合物实现终止的能力。在rtdntp-聚合酶结合物不依赖于屏蔽作用来实现终止的情况下,例如,当3’修饰的rtdntp栓系到聚合酶时,使用的接头长度可以超过
聚合酶-核苷酸结合物的屏蔽作用
当用核酸孵育包含聚合酶和核苷三磷酸的结合物与核酸时,它优选使用其栓系的核苷酸延伸核酸(与使用另一种结合物分子的核苷酸相反)。如上所述,然后聚合酶通过其与添加的核苷酸的栓系保持与核酸连接(例如图3d和图4d),直到暴露于一些刺激,所述刺激导致连接添加的核苷酸的键被裂解。在这种情况下,当:1)连接的聚合酶分子阻碍其他结合物接近延伸的dna分子的3’oh,和2)阻碍系统中的其他核苷三磷酸接近保持连接到延伸的核酸的3’端的聚合酶的催化位点时,聚合酶-核苷酸结合物的进一步延伸由于“屏蔽”而受到阻碍。(屏蔽程度可以描述为这两种相互作用被阻碍的程度。)为了实现后续延伸,可以裂解将掺入的核苷酸栓系到聚合酶的接头,从核酸释放聚合酶,并因此重新暴露其3’oh基团用于随后的延伸(例如,如图3e和图4e所示)。
本文提供的利用屏蔽作用实现终止的核酸合成和测序方法包括延伸步骤,其中核酸在不存在游离(即未栓系的)核苷三磷酸的情况下优先暴露于结合物,因为屏蔽的终止机制可能不会阻止它们掺入核酸中。如实施例3中所示,将已经通过tdt-dctp结合物延伸的引物暴露于游离dctp导致几个另外的延伸。
在一些实施方案中,进一步延伸的终止可以是“完全的”,意味着在核酸分子被结合物延伸后,在反应过程中不能发生进一步的延伸。在其他实施方案中,进一步延伸的终止可以是“不完全的”,意味着在反应过程中可以发生进一步的延伸,但是与初始延伸相比,可以以显著降低的速率,例如以慢100倍,或慢1000倍,或慢10,000倍或更慢的速率发生进一步的延伸。当在适当的时间后停止反应时,实现不完全终止的结合物仍然可以用于主要通过单个核苷酸延伸核酸(例如在核酸合成和测序的方法中)。
在一些实施方案中,含有结合物的试剂可以另外含有没有栓系的核苷三磷酸的聚合酶,但那些聚合酶不应显著影响反应,因为混合物中没有游离的dntp。
基于使用屏蔽作用实现终止的结合物的试剂优选仅含有聚合酶-核苷酸结合物,其中所有聚合酶以活性构象保持折叠。在一些情况下,如果结合物的聚合酶部分是未折叠的,则其栓系的核苷三磷酸可以变得更容易被其他结合物分子的聚合酶部分接近。在这些情况下,未屏蔽的核苷酸可以更容易地被其他结合物分子掺入,避开终止机制。
使用屏蔽作用实现终止的聚合酶-核苷酸结合物优选仅用单个核苷三磷酸部分标记。在一些情况下,可以接近催化位点的用多个核苷三磷酸标记的聚合酶-核苷酸结合物可以将多个核苷三磷酸掺入到相同的核酸中(例如,用在实施例1中用最多达5个核苷三磷酸标记的wttdt的结合物所显示的)。因此,在反应过程中,另外的栓系的核苷酸可能导致另外的不希望的核苷酸掺入到核酸中。此外,只有一个栓系的核苷三磷酸可以一次占据其聚合酶的(掩埋的)催化位点,因此其他栓系的核苷三磷酸(多个栓系的核苷三磷酸)可以具有增加的对其他结合物分子的聚合酶部分的可接近性,如下所述。上文描述了将至多一个核苷三磷酸位点特异性地栓系到聚合酶的策略。
使用屏蔽作用实现终止的聚合酶-核苷酸结合物优选包含尽可能短的接头,其仍使得核苷三磷酸经常以生产构象接近其连接的聚合酶分子的催化位点,以实现核苷酸快速掺入核酸中。这样的结合物还可优选使用尽可能接近催化位点的接头与聚合酶的连接位置,实现使用更短的接头。接头的长度将决定从栓系的核苷三磷酸或栓系的核酸可以到达的连接点起的最大距离。较小的距离可导致栓系部分到其他聚合酶-核苷酸分子的可接近性降低,如下所述。实施例1和2中使用的接头长约24和
屏蔽作用可能受到因素的组合的影响,所述因素包括但不限于聚合酶的结构、接头的长度、接头的结构、接头与聚合酶的连接位置、核苷三磷酸与聚合酶的催化位点的结合亲和力、核酸与聚合酶的结合亲和力、聚合酶的优选构象和接头的优选构象。
屏蔽的一个促成因素可以是空间效应,其阻断已经被结合物延伸的核酸的3’oh到达另一个结合物的聚合酶部分的催化位点中。由于在这种方法期间将发生的结合物之间的碰撞,空间效应还可以阻碍栓系的核苷三磷酸到达另一个聚合酶-核苷酸结合物分子的催化位点中。如果这些空间效应完全阻断一个结合物分子的栓系的核苷三磷酸(或延伸的核酸)与另一个结合物分子之间的生产性相互作用,则其可以导致完全终止,或者如果这些空间效应仅阻碍这种分子间相互作用,则可以导致不完全终止。
屏蔽的另一个促成因素源自栓系的核苷三磷酸与聚合酶的催化位点的结合亲和力。对于其栓系的聚合酶的催化位点,结合物的栓系的核苷三磷酸具有高有效浓度,因此它可以在大部分时间保持与该位点结合。当核苷三磷酸结合到其栓系的聚合酶分子的催化位点时,其不能被其他聚合酶分子用于掺入。因此,栓系降低了可用于分子间掺入的核苷三磷酸的有效浓度(即由未栓系核苷酸的聚合酶分子催化的掺入)。这种屏蔽作用可以通过降低延伸核酸的速率增强终止,其通过另一种结合物分子的聚合酶部分使用一个结合物分子的核苷三磷酸部分。
屏蔽的另一个促成因素源自核酸分子的3’区域与聚合酶分子的催化位点的结合亲和力。在通过结合物延伸后,核酸通过其3’末端核苷酸栓系到结合物,并且对于其栓系的聚合酶的催化位点具有高有效浓度,因此它可以在大部分时间保持与该位点结合。当核酸与其栓系的聚合酶分子的催化位点结合时,其不能用于通过其他结合物分子延伸。通过降低已被第一结合物延伸的核酸被其他结合物分子进一步延伸的速率,该作用可以增强终止。
添加具有空间限制的元素以增加屏蔽作用
在一些实施方案中,聚合酶-核苷酸结合物包含另外的部分,其在空间上阻碍栓系的核苷三磷酸(或延伸后的连接的核酸)接近另一个结合物分子的催化位点。这样的部分包括可以插入聚合酶环中的多肽或蛋白结构域,以及那些和其它大分子,如可以位点特异性地连接到例如插入的非天然氨基酸或特定多肽标签的聚合物。
rtdntp终止机制与屏蔽作用的组合。
如上所述,在一些实施方案中,结合物可以包含聚合酶和栓系的可逆终止子核苷三磷酸。一些rtdntp(特别是3’o-未阻断的rtdntp)在溶液中游离使用时实现不完全终止。也采用屏蔽作用的这样的rtdntp的聚合酶-核苷酸结合物可以实现比其自身使用的rtdntp更完全的终止。在一些实施方案中,可以采用具有连接到核苷三磷酸中的嘧啶的5位或7-脱氮嘌呤的7位的(α-叔丁基-2-硝基苄基)氧基甲基的rtdntp,例如,在gardner等(nucleicacidsres.2012aug;40(15):7404-1)或stupi等(angewandtechemieinternationaledition51.7(2012):1724-1727)中所描述的。在一些实施方案中,接头与rtdntp的终止部分中的原子连接。在其他实施方案中,接头与不在终止部分中的rtdntp的原子连接。
栓系到其他聚合酶-核苷酸结合物的核苷三磷酸的有效浓度
如前所述,对于其连接的聚合酶部分的催化位点,栓系的核苷三磷酸具有高有效浓度,实现快速掺入。对于其他聚合酶部分的催化位点,相同的核苷三磷酸具有低得多的浓度,如果分子间掺入是可能的,则导致较慢的分子间核苷酸掺入速率。与其他结合物栓系的核苷三磷酸的有效浓度至多是结合物的绝对浓度,因为每个结合物分子包含单个核苷酸。由于阻碍这些核苷三磷酸的可接近性的屏蔽作用,有效浓度进一步降低。
防止延伸的核酸在聚合酶催化位点移位
聚合酶-核苷酸结合物的另外的终止作用可以通过选择接头和连接位置来实现,所述接头和连接位置防止延伸的(并因此栓系的)核酸将其栓系的3’端移动到其3’oh可以被激活以攻击进入的核苷三磷酸的位置。如果栓系的核苷三磷酸可以接近聚合酶的核苷三磷酸结合位点,但是不能达到对应于进入的核酸的3’oh的其3’oh的位置,则可以实现这种作用。
聚合酶-核苷酸结合物在从头合成核酸中的应用
本文描述了使用包含聚合酶和核苷三磷酸的结合物从头合成核酸的方法。在该方法的一些实施方案中,结合物包含聚合酶末端脱氧核苷酸转移酶(tdt)。在其他实施方案中,该方法可以使用包含另一种非模板依赖性聚合酶或模板依赖性聚合酶的结合物。
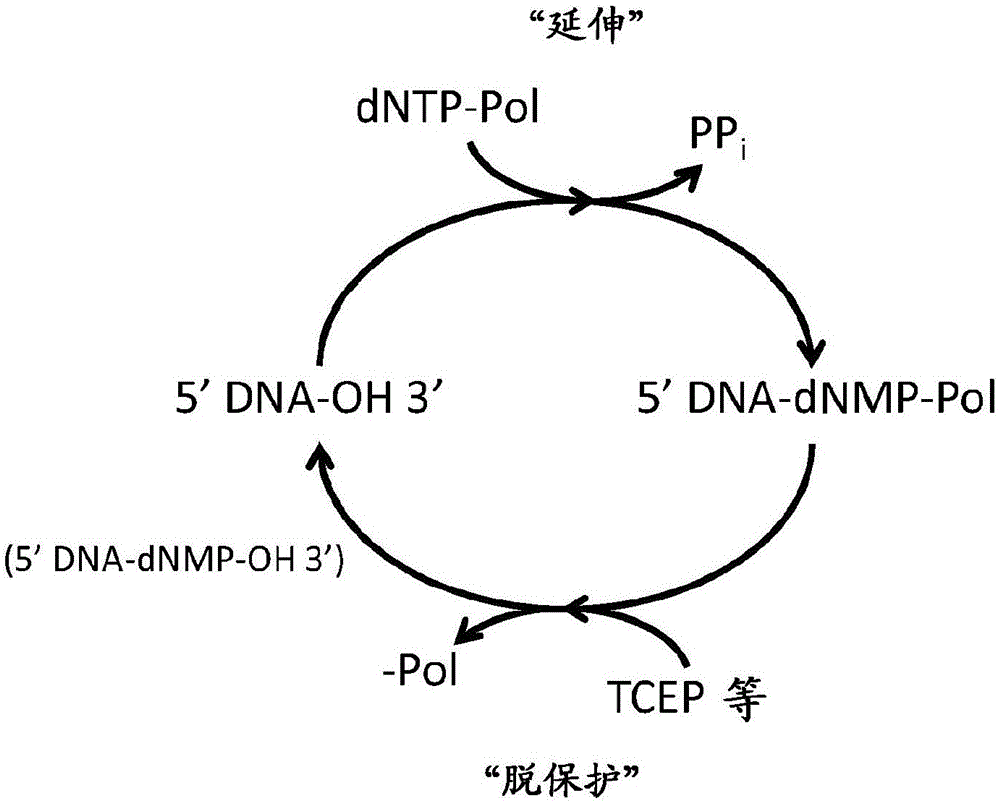
图1a说明使用非模板依赖性聚合酶逐步合成限定序列的典型方法。将充当用于延伸的初始底物的核酸(即“起始分子”)用第一聚合酶-核苷酸结合物孵育。一旦核酸被结合物的栓系的核苷酸延伸,就不会发生进一步的延伸,因为结合物例如基于屏蔽作用实现终止机制。在该方法的第二步中,裂解接头以释放聚合酶并逆转终止机制,从而实现随后的延伸。然后将延伸产物暴露于第二结合物,并重复这两个步骤以通过限定序列延伸核酸。图1b说明如实施例2中所实践的使用包含tdt和光可裂解的接头的结合物的合成过程。如上所述,其他策略可用于接头的连接和裂解。
对于dna合成应用,可以使用特别是非模板依赖性聚合酶,即末端脱氧核苷酸转移酶或dna核苷酸外转移酶,这些术语可互换使用,是指具有活性2.7.7.31的酶。具有延伸单链核酸能力的聚合酶包括但不限于聚合酶θ(kent等,elife5(2016):e13740)、聚合酶μ(juarez等,nucleicacidsresearch34.16(2006):4572-4582.;或mcelhinny等,molecularcell19.3(2005):357-366)或其中例如通过插入非模板依赖性聚合酶的元件诱导非模板依赖性活性的聚合酶(juarez等,nucleicacidsresearch34.16(2006):4572-4582)。在其他dna合成应用中,聚合酶可以是模板依赖性聚合酶,即dna指导的dna聚合酶(这些术语可互换使用,是指使用iubmb命名法的具有活性2.7.7.7的酶)。
对于rna合成应用,可以使用栓系的核糖核苷三磷酸。在这些实施方案中,尤其可以使用rna特异性核苷酸转移酶,例如大肠杆菌聚(a)聚合酶(iubmbec2.7.7.19)或聚(u)聚合酶等。rna核苷酸转移酶可以包含修饰,例如单点突变,其影响对特定rntp的底物特异性(lunde等,nucleicacidsresearch40.19(2012):9815-9824.)。在一些实施方案中,rna核苷酸转移酶和核糖核苷三磷酸之间的非常短的栓系可用于诱导高有效浓度的核苷三磷酸,从而迫使可能不是核苷酸转移酶的天然底物的rntp掺入。
用于从头合成核酸的初始底物。
使用聚合酶栓系的核苷三磷酸的核酸合成方案可能需要至少3-5个碱基的核酸底物(或具有相似性质的分子)来引发合成。然后可以将该初始底物核苷酸接核苷酸地延伸到期望的产物中。在一些实施方案中,初始底物可以是使用亚磷酰胺方法合成的寡核苷酸引物(如实施例1中所示)。在一些情况下,引发引物的特定序列可用于合成核酸的下游应用。在一些实施方案中,可以在合成完成后从合成的核酸除去初始底物的序列,特别是如果初始底物在其3’末端附近包含可裂解的键。例如,如果初始底物是具有3’末端脱氧尿苷碱基的引物,则将延伸的引物暴露于user酶(即尿嘧啶dna糖苷酶和核酸内切酶viii的混合物)将从初始底物裂解合成的序列。然而,可以使用其他可裂解的键,例如,可用银离子或汞离子裂解的引物中的桥接硫代磷酸酯。
在一些实施方案中,可以使用双链dna分子来引发合成,特别是如果它具有3’突出端(如实施例2中所示)。如果初始底物是线性化质粒骨架,则可以使用dna合成方法通过一种或多种合成基因序列延伸dna分子,然后可以将延伸的dna(任选地扩增和)环化成质粒。通常,本文描述的用于核酸合成的方法能够由天然核酸分子开始从头合成dna;相反,使用亚磷酰胺方法不可能通过限定序列直接延伸天然核酸分子。
将接头连接到可用于核酸合成的核苷三磷酸的策略。
在一些实施方案中,连接到核苷酸的接头的裂解可以导致裂解时产生天然核苷酸。例如,包含烷基化核碱基的胺的硝基苄基部分的接头可以用光裂解,例如,如以下针对胞嘧啶和腺嘌呤的环外胺所描述的,但适用于任何核碱基上的任何合适的氮原子:
在其他实施方案中,通过酰胺键与核碱基的胺连接的接头可以被合适的肽酶裂解,例如,如以下针对胞嘧啶和腺嘌呤的环外胺所描述的,但适用于任何核碱基上的任何合适的氨基:
在这样的实施方案中,接头可以包含与酰胺相邻的另外的原子(包括在上述的r’中),其增加肽酶对酰胺键的活性。在一些实施方案中,r’是肽或多肽。
在一些实施方案中,在脱保护步骤中裂解接头可以留下瘢痕,其在整个逐步合成过程中持续存在,但是一旦逐步合成完成就将其去除或进一步减少。该连接策略可以实现在接头的可裂解部分和核苷酸之间引入另外的距离,这可以与某些(例如庞大的)可裂解的基团一起使用。瘢痕可用于防止掺入的核苷酸的碱基配对,从而防止在合成过程中形成二级结构,例如,如下所讨论的,通过防止环外氨基团参与碱基配对。一旦完成这种分子的合成,可以使用单个“瘢痕去除”步骤来防止瘢痕对下游应用的干扰并恢复核酸的碱基配对能力。
例如,裂解后留在腺嘌呤、胞嘧啶和鸟嘌呤的环外氨基上的酰基瘢痕可能在合成期间阻碍某些类型的二级结构的形成。在合成完成后,可以使用温和的氨处理(schulhof等,nucleicacidsresearch.1987;15(2):397-416)定量除去这样的瘢痕,如下所示:
使用这些基团的接头的实例是将包含2-((4-(二硫烷基)丁酰基)氧基)乙酰基的接头连接到核碱基的环外氨基(形成酰胺),如以下针对胞嘧啶和腺嘌呤所述:
二硫化物的裂解(例如通过dtt)可以通过分子内硫代内酯化导致2-氧硫戊环的消除,留下羟乙酰基瘢痕。该策略的另一个实例是将包含光可裂解的基团(例如nppoc)的接头连接到核碱基的环外氨基的羟乙酰基,如以下针对胞嘧啶和腺嘌呤所述:
在接头的光裂解后,碱基仍然包含羟乙酰基(酰基)瘢痕,其不可以通过其他核苷酸-聚合酶结合物终止进一步延伸,但最终可通过用氨处理除去,如下所示:
可以使用遵循上述原理将核苷三磷酸连接到聚合酶的其他策略,并且这对于本领域技术人员是显而易见的。
非模板依赖性聚合酶可以对碱基修饰具有高耐受性(例如,对于tdt,参见figeys等(analchem.1994dec1;66(23):4382-3)和li等(cytometry.1995jun1;20(2):172-80.)),使得在随后的核酸延伸步骤中可以很好地耐受特定瘢痕。
在一些实施方案中,与具有单个可裂解的基团的接头相比,具有串联插入的多个可裂解的基团的接头可用于增加裂解速率。
减轻3’末端二级结构的抑制作用
在某些实施方案中,可以使用具有连接的化学部分的修饰的核苷三磷酸,其在合成期间防止碱基配对或形成不期望的二级结构。这样的修饰可以包括但不限于胞嘧啶的n3-甲基化、腺嘌呤的n1-甲基化、鸟嘌呤的o6-甲基化和鸟嘌呤的环外胺的乙酰化。显示了类似的修饰显著增强使用tdt的dgtp均聚物合成的速率(lefler和bollum,journalofbiologicalchemistry244.3(1969):594-601.)。在合成完成后,可以同时去除这种碱基修饰以恢复用于下游应用的碱基配对。例如,如上所述,可以通过氨处理除去鸟嘌呤的n-乙酰化。可以通过酶alkb除去胞嘧啶的n3-甲基化和腺嘌呤的n1-甲基化,并且可以通过酶mgmt除去鸟嘌呤的o6-甲基化,如下所示:
在一些实施方案中,可以在中间步骤暂停从头合成核酸,并且可以例如通过合适的引物(例如随机六聚体)的杂交进行互补dna的合成,所述引物可以使用核苷三磷酸通过模板依赖性聚合酶延伸。在互补dna合成后,可以恢复从头合成dna,并且可以阻止核酸的双链部分形成二级结构。在一些情况下,互补dna合成步骤可以包括在从头合成的核酸上留下3’突出端,实现通过聚合酶-核苷酸结合物的有效的随后延伸。
在一些实施方案中,在延伸反应中可以包含单链结合蛋白(例如大肠杆菌ssb)以阻碍合成的核酸中二级结构的形成。
非天然或修饰的dntp的掺入。
可用于从头合成核酸的结合物可以包含核苷三磷酸类似物,包括不具有碱基配对能力的核苷酸(例如无碱基核苷酸类似物)或具有不同于天然核苷酸的碱基配对能力的核苷三磷酸,例如,脱氧肌苷或硝基吲哚核苷三磷酸。
使用聚合酶-核苷酸结合物从头合成核酸的自动化
在一些实施方案中,在合成期间将核酸分子固定在固体载体上,所述固体载体可通过自动液体处理设备洗涤并暴露于反应循环酶和缓冲液。固体载体的实例包括但不限于:微量滴定板,可以通过液体处理机器人向其中分配和除去试剂;磁珠,其可以与悬浮液磁性分离,然后以微量滴定形式重新悬浮在新试剂中;或微流体装置的内表面,其可以以自动方式将反应循环试剂分配到该位置。
使用包含聚合酶和核苷三磷酸的结合物的核酸合成自动化系统的应用是用于分子生物学应用例如pcr的10-100nt寡核苷酸的合成。另一种应用是使用基于喷墨的液体处理技术的50-500nt或更长的寡核苷酸的皮摩尔级或飞摩尔级合成,以产生例如充当常规dna组装方法的输入的dna分子(kosuri和church,naturemethods11.5(2014):499-507)。
使用荧光聚合酶-核苷酸结合物的单分子核酸合成
在一些实施方案中,dna合成方法可以以单分子形式实施。在该方法中,自动微流体装置的反应室装载有单个dna引物分子,其使用上述反应循环的改良形式反复地延伸成期望的序列(图5a)。在该系统中,包含聚合酶和核苷三磷酸的结合物用一种或多种报告分子(例如荧光团)标记,使得一旦标记的结合物分子已经通过其栓系的核苷酸延伸引物,并且由此通过引物连接到固体载体(图5b),则生长的dna分子变得有荧光。在洗去游离的结合物分子后,连接到引物的聚合酶可以例如使用荧光显微镜技术,例如全内反射荧光(tirf)显微镜检测(图5c)。在每次尝试延伸后,洗涤反应室并成像,如果确定延伸已经失败,则用相同类型的结合物重新尝试。在确认成功延伸后,将脱保护试剂引入反应室,裂解栓系的标记的聚合酶,从而使生长的dna分子的3’末端脱保护以用于随后的延伸,同时使其无荧光(图5d)。如果脱保护失败,则荧光信号将保留,并且重新尝试脱保护步骤(图5e)。这些延伸和脱保护检查防止引入删除错误,这些错误在大规模反应期间不可避免地累积,大规模反应未达到100%完成。执行该方案的自动合成仪最终将合成一种具有期望序列的dna分子,该序列随后可被扩增。图6中描绘了这种合成仪的实例。合成仪包括具有用于试剂的输入端口的pdms装置,包括用于每种聚合酶-核苷酸结合物的端口,用于洗涤缓冲液的端口,用于脱保护缓冲液的端口,和用于原位扩增缓冲液的端口。输入端口通过微通道(以及任选地,计算机驱动的微阀)连接到发生合成的反应室。该装置还包括通过微通道连接到反应室的废弃物端口和输出端口(用于收集合成的产物)。该装置可以安装在适合单分子成像的显微镜上,例如,图6中所示的物镜式tirf显微镜。可以通过合适的波长,例如532nm的激光激发连接到结合物的荧光团;发射的光可以通过物镜收集并在合适的检测器上成像,所述检测器例如,连接到计算机的电子倍增电荷耦合器件(emccd)相机。计算机可以通过以下执行上述合成方案:(a)使用算法解释来自检测器的信号,和(b)通过驱动微流体装置内部或外部的微阀或泵将适宜的试剂分配到反应室。
使用聚合酶-核苷酸结合物进行dna测序的方法。
本文提供了使用模板依赖性聚合酶和核苷三磷酸的结合物进行核酸测序的方法。该方法类似于合成测序(sbs)。
在一些实施方案中,该方法使用“acgt延伸试剂”,其包含具有等同于a、c、g和t的碱基配对能力的四种结合物,其中所述结合物用可区分的标记,例如不同的荧光团标记。在其他实施方案中,该方法在不同的容器中使用“四种不同的延伸试剂”,每个容器包含具有分别等同于a、c、g和t的碱基配对能力的结合物。在一些实施方案中,可以例如用荧光团标记这四种延伸试剂用于检测。
在一些实施方案中,该方法包括:(a)将包含引物和模板核酸的双链体固定在载体上;(b)将双链体暴露于“acgt延伸试剂”以通过与模板互补的核苷酸延伸引物;(c)检测连接的结合物的标记以推断模板的互补碱基;(d)将双链体暴露于脱保护试剂,该脱保护试剂裂解聚合酶和添加的核苷酸之间的键,使双链体未标记;和(e)重复步骤(b-d)10次或更多次以确定模板分子的至少部分的序列。采用具有四种可区分的荧光团的聚合酶-结合物的该方法的一个实例描绘于图7a-7e中。
在其他实施方案中,该方法包括:(a)将包含引物和模板核酸的双链体固定在载体上;(b)将双链体暴露于第一延伸试剂,如果结合物的核苷酸是互补的,通过与模板互补的核苷酸延伸引物;(c)检测连接的结合物的标记,以推断是否已经发生了延伸;(d)将核酸暴露于脱保护试剂,该脱保护试剂裂解聚合酶和添加的核苷酸之间的键,使双链体未标记;(e)再用剩余的三种延伸试剂重复步骤(b-d)三次;和(f)重复步骤(b-e)10次或更多次以确定模板分子的至少部分的序列。
在一些实施方案中,可检测的标记可以是与聚合酶融合的荧光蛋白。在其他实施方案中,可检测的标记可以是特异性连接到聚合酶的量子点。
特别是在使用四种不同的延伸试剂的实施方案中,结合物可以是非荧光的或没有可检测的标记。在这样的实施方案中,延伸可以通过延伸反应的其他信号例如h+或焦磷酸的释放检测。在其他实施方案中,聚合酶可以与报告酶如荧光素酶或过氧化物酶融合,当它们通过催化反应产生光时可以被检测到。在其他实施方案中,聚合酶可以通过散射光与可检测的纳米颗粒融合。在其他实施方案中,可以通过表面等离子体共振的变化来检测已经延伸核酸的结合物的另外未标记的聚合酶。
特别是在使用具有可检测的标记的结合物的实施方案中,该方法可用于确定单个分子的序列,即“单分子测序”。
在一些实施方案中,该方法可另外地包括制备模板分子的10、100、1000个或更多个拷贝的初始步骤,然后同时将上述方法应用于所有拷贝。
在核酸测序方法的任何实施方案中,可以选择结合物的核苷三磷酸和聚合酶之间的接头长度,以使通过结合物的核苷酸掺入的保真度最大化,即使相对模板的错配碱基的掺入最小化。同样地,在任何实施方案中,可以调节延伸反应中的(多种)二价阳离子(例如mg2+)的浓度以使通过结合物的核苷酸掺入的保真度最大化。
在一些实施方案中,结合物的聚合酶可以是具有“随机结合顺序”的聚合酶,即引物-模板双链体可以结合到核苷三磷酸之前或之后的催化位点。
在其他实施方案中,结合物的聚合酶可以是具有确定的结合顺序的聚合酶,即引物-模板双链体必须结合到核苷三磷酸之前的催化位点。在这样的实施方案中,可以选择结合物的核苷三磷酸和聚合酶之间的接头长度,以使引物-模板双链体与结合物的结合的抑制最小化,即通过使用长于
在任何实施方案中,结合物可以包含可逆终止子核苷三磷酸。
实施方案
实施方案1.一种结合物,其包含聚合酶和核苷三磷酸,其中所述聚合酶和核苷三磷酸通过包含可裂解的键的接头共价连接。
实施方案2.实施方案1所述的结合物,其中所述聚合酶能够催化连接到聚合酶的核苷酸添加到核酸的3’端。
实施方案3.任一前述实施方案所述的结合物,其中所述聚合酶通过长度在
实施方案4.任一前述实施方案所述的结合物,其中所述核苷三磷酸连接到聚合酶中的半胱氨酸残基。
实施方案5.任一前述实施方案所述的结合物,其中所述可裂解的键是光可裂解的键或酶可裂解的键。
实施方案6.任一前述实施方案所述的结合物,其中所述聚合酶是dna聚合酶。
实施方案7.实施方案1-5中任一项所述的结合物,其中所述聚合酶是rna聚合酶。
实施方案8.任一前述实施方案所述的结合物,其中所述聚合酶是非模板依赖性聚合酶。
实施方案9.实施方案1-7中任一项所述的结合物,其中所述聚合酶是模板依赖性聚合酶。
实施方案10.任一前述实施方案所述的结合物,其中所述核苷三磷酸或聚合酶包含荧光标记。
实施方案11.任一前述实施方案所述的结合物,其中所述核苷三磷酸是脱氧核糖核苷三磷酸。
实施方案12.任一前述实施方案所述的结合物,其中所述核苷三磷酸是核糖核苷三磷酸。
实施方案13.一组任一前述实施方案所述的结合物,其中所述结合物对应于g、a、t和c,并在不同的容器中。
实施方案14.一种核酸合成方法,包括:
用第一结合物孵育核酸,其中所述第一结合物是任一前述实施方案所述的结合物,并且所述孵育在其中聚合酶催化第一结合物的核苷酸共价添加到核酸的3’羟基上的条件下完成,以制备延伸产物。
实施方案15.实施方案14所述的方法,其中核酸栓系到载体。
实施方案16.实施方案14或15所述的方法,其中所述方法包括在将核苷酸添加到核酸上之后,裂解接头的可裂解的键,从而从延伸产物释放聚合酶。
实施方案17.实施方案16所述的方法,其中所述可裂解的键是酶可裂解的键或光可裂解的键,并且所述裂解包括将延伸产物暴露于酶或暴露于光。
实施方案18.实施方案16或17所述的方法,其中所述可裂解的键的裂解使添加的核苷酸脱保护以产生脱保护的延伸产物。
实施方案19.实施方案18所述的方法,还包括在添加的核苷酸脱保护之后:
用第二结合物孵育脱保护的延伸产物,其中所述第二结合物是实施方案1-12中任一项所述的结合物,并且所述孵育在其中聚合酶催化第二结合物的核苷酸共价添加到脱保护的延伸产物的3’端上的条件下完成。
实施方案20.实施方案14-19中任一项所述的方法,其中所述方法包括:
(a)在其中聚合酶催化第一结合物的核苷酸共价添加到核酸的3’羟基上的条件下,用实施方案1-12中任一项所述的第一结合物孵育核酸,以制备延伸产物;
(b)裂解所述接头的可裂解的键,从而从延伸产物释放聚合酶并使延伸产物脱保护;
(c)在其中聚合酶催化第二结合物的核苷酸共价添加到延伸产物的3’端的条件下,用实施方案1-12中任一项所述的第二结合物孵育脱保护的延伸产物,以制备第二延伸产物;
(d)对第二延伸产物重复步骤(b)-(c)多次,以产生限定序列的延伸的核酸。
实施方案21.实施方案20所述的方法,其中所述核苷酸是可逆终止子,并且其中延伸产物的脱保护包括去除可逆终止子的阻断基团。
实施方案22.实施方案14-21中任一项所述的方法,其中所述核酸是寡核苷酸。
实施方案23.一种测序的方法,包括:
用包含实施方案13所述的一组结合物的组合物孵育包含引物和模板的双链体,其中所述结合物对应于g、a、t(或u)和c,并且被可区分地标记;
通过检测栓系到已将核苷酸添加到引物的聚合酶的标记,检测哪个核苷酸已经添加到引物;
通过裂解所述接头使延伸产物脱保护;和
重复孵育、检测和脱保护步骤,以获得模板的至少部分的序列。
实施方案24.实施方案23所述的方法,其中所述测序的方法是dna测序的方法。
实施方案25.实施方案23所述的方法,其中所述测序的方法是rna测序的方法。
实施方案26.实施方案23-25中任一项所述的方法,其中所述核苷酸是可逆终止子,并且其中所述延伸产物的脱保护包括去除阻断基团。
实施方案27.一种试剂组,包含:
聚合酶,其经修饰以在其表面上包含单个半胱氨酸;和
一组核苷三磷酸,其中核苷三磷酸中的每个连接到巯基反应性基团。
实施方案28.实施方案27所述的试剂组,其中所述核苷三磷酸对应于g、a、t(或u)和c。
实施方案29.实施方案27-28中任一项所述的试剂组,其中所述核苷三磷酸是可逆终止子。
实施方案30.实施方案27-29中任一项所述的试剂组,其中所述核苷三磷酸包含长度在
实施例
根据以下实施例可以进一步理解本发明教导的各方面,这些实施例不应被解释为以任何方式限制本发明教导的范围。
实施例1
使用可通过还原剂裂解的接头通过聚合酶-核苷酸结合物掺入栓系的核苷酸
1.具有用于接头的不同的连接位置的聚合酶(tdt)突变体的产生。
编码boulé等使用的小家鼠tdt氨基酸序列的gblock(molecularbiotechnology10.3(1998):199-208)订购自idt(coralville,ia)。将该序列克隆到pet19b载体中,使用等温组装将载体的n-末端his-标签融合到蛋白。quickchangepcr用于产生缺乏所有表面半胱氨酸的tdt突变体,其可以实现栓系的dntp(tdt5cysx)的掺入。188、302和378位的半胱氨酸突变成丙氨酸,216和438位的半胱氨酸突变成丝氨酸(位置是指在pdb结构4i27中的编号)。通过quickchangepcr在tdt5cysx上产生包含一个靠近催化位点的表面半胱氨酸的tdt突变体。半胱氨酸分别在188、302、180或253位插入。
下面列出的是在半胱氨酸残基突变之前在本实施例中使用的“野生型”tdt蛋白的氨基酸序列(tdtwt):
mghhhhhhhhhhssghiddddkhmsqyacqrrttlnnhnqiftdafdilaendefrenegpsltfmraasvlkslpftiismkdiegipnlgdrvksiieeiiedgessavkavlnderyksfklftsvfgvglktsekwfrmgfrtlsnirsdksltftrmqragflyyedlvsrvtraeaeavgvlvkeavwaslpdafvtmtggfrrgkktghdvdflitspgateeeeqqllhkvislwehkglllyydlvestfeklklpsrkvdaldhfqkcflilklhhqrvdsdqsswqegktwkairvdlvvcpyerrafallgwtgsrqferdlrryatherkmiidnhalydktkrifleaeseeeifahlgldyiepwerna
(seqidno:1)。
如上所述,产生了编码具有不同半胱氨酸残基(因此具有不同的用于接头的连接位置)的6个tdt突变体的质粒:
(a)编码具有7个半胱氨酸的“野生型”tdt的质粒(tdtwt)
(b)编码没有表面半胱氨酸且只有2个均被掩埋的半胱氨酸的tdt突变体的质粒(tdt5cysx)
(c)编码具有2个掩埋的半胱氨酸加上在不同的位置(188、180、253和302)具有一个暴露的表面半胱氨酸的tdt突变体的四个质粒,在本文中称为tdtcys188、tdtcys180、tdtcys253和tdtcys302。
2.突变体的蛋白质表达和纯化。
在含有针对细胞的所有四种抗性标志物(kan、cmp、tet和carb,其通过pet19载体引入)的抗生素的lb培养基中使用rosetta-gamib(de3)plyss细胞(novagen)进行tdt表达。使用50ml的过夜培养物接种具有1/20体积的400ml表达培养物。细胞在37℃和200rpm振荡下生长直至它们的od达到0.6。加入iptg至终浓度为0.5mm,并且在30℃下进行表达12小时。通过在8000g下离心10分钟收获细胞,并重悬于20ml缓冲液a(20mmtris-hcl,0.5mnaci,ph8.3)+5mm咪唑中。使用超声处理进行细胞裂解,然后在15000g下离心20分钟。将上清液施加到含有1mlni-nta琼脂糖(qiagen)的重力柱。用20体积的缓冲液a+40mm咪唑洗涤柱,用4ml缓冲液a+500mm咪唑洗脱结合的蛋白。用vivaspin20柱(mwco10kda,sartorius)将蛋白浓缩至~0.15ml,然后使用pur-a-lyzertm透析试剂盒mini12000管(sigma)用200mltdt储备缓冲液(100mmnacl,200mmk2hpo4,ph7.5)透析过夜。
表达并纯化具有不同半胱氨酸残基的所有6个tdt突变体。
3.栓系的核苷三磷酸与聚合酶的连接
为了制备tdt-dutp结合物,首先合成接头-核苷酸opss-peg4-aa-dutp,然后与tdt反应。通过使氨基-烯丙基dutp(aa-dutp)与异双功能交联剂peg4-spdp反应来合成opss-peg4-aa-dutp(图3a)。该反应含有12.5mmaa-dutp、3mmpeg4-spdp交联剂和125mm碳酸氢钠(ph8.3),体积为8μl,并在室温下进行1小时。通过加入1μl含100mm甘氨酸的pbs淬灭反应10分钟。通过添加1μl10xtdt储备缓冲液将缓冲液调节至opss-标记条件,然后添加含70-100μg纯化的蛋白的40μl1xtdt储备缓冲液。将接头-核苷酸连接到tdt的反应在室温下进行13小时。使用capturemhis-标记的纯化miniprep试剂盒(clonetech)进行游离(即未连接的)接头-核苷酸的去除。纯化导致蛋白浓度在0.2和0.4μg/μl之间。在pur-a-lyzertm透析试剂盒mini12000管中用100ml1xtdt反应缓冲液(neb)进行透析4小时。
用于制备聚合酶-核苷酸结合物的方案示于图3中。首先,氨基烯丙基dutp(aa-dutp)与异双功能胺-硫醇交联剂peg4-spdp(图a)反应,以形成巯基反应性接头-核苷酸opss-peg4-aa-dutp(图b)。然后opss-peg4-aa-dutp可以用于通过二硫键形成在表面半胱氨酸残基(图c)处位点特异性标记tdt。
将具有不同半胱氨酸残基的所有6个tdt突变体分别暴露于opss-peg4-aa-dutp栓系反应。
(a)tdtwt含有五个表面半胱氨酸残基,其导致用最多达五个opss-peg4-aa-dutp部分标记。
(b)tdt5cysx仅含有两个被掩埋的半胱氨酸残基但没有表面半胱氨酸残基,可能不实现由opss-peg4-aa-dutp实质性标记。
(c)tdtcys188、tdtcys180、tdtcys253和tdtcys302具有单个表面半胱氨酸,其可以用单个opss-peg4-aa-dutp部分标记(分别在残基188、180、253和302位)。这些tdt突变体还含有两个被掩埋的半胱氨酸,存在于tdt5cysx中,其可能未被标记。
4.延伸产物标准品的梯形条带的产生。
通过使用tdt掺入游离opss-peg4-aa-dutp产生连接的掺入产物标准品的梯形条带。通过混合6μl50mmaa-dutp、5μl180mmpeg4-spdp、5μl1mnahco3和4μlddh2o来进行合成opss-peg4-aa-dutp的反应。将反应在室温下孵育1小时,并添加另外5μl的180mmpeg4-spdp。1小时后,使用5μl含100mm甘氨酸的pbs淬灭反应。为了实现不同数量的掺入,使用游离opss-peg4-aa-dutp作为底物进行6次tdt掺入反应。反应包含1.5μl10xnebtdt反应缓冲液、1.5μlnebtdtcocl2、1.5μl10μm5'-fam标记的35-聚体dt-寡核苷酸(5’-fam-dt(35))、1μl10mmopss-peg4-aa-dutp、4.5μlddh2o,并且其tdt浓度不同(在5μl1xneb反应缓冲液中100、50、25、12.5、6.3、3.13单位的nebtdt)。反应在37℃下进行5分钟,并通过添加0.3mmedta终止。在聚丙烯酰胺凝胶上跑出梯形条带之前,将反应产物与等体积的2xnovextris-甘氨酸缓冲液+1%v/vβ-巯基乙醇混合,并加热至95℃5分钟。
通过0至5个或更多个opss-peg4-aa-dump核苷酸延伸5'-fam-dt(60)寡核苷酸。在负载染料中还原梯形条带后,在聚丙烯酰胺凝胶(图8a和b,标记为“l”的泳道)上分离hs-peg4-aa-dutp延伸产物标准品(一种hs-peg4-aa-dutp延伸产物的结构绘制在图3e中)。通过比较延伸产物条带向梯形条带的迁移,使用梯形条带确定具有聚合酶-核苷酸结合物的引物延伸反应的裂解产物。
5.将栓系的核苷三磷酸掺入核酸中。
使tdtwt、tdt5cysx、tdtcys188、tdtcys180、tdtcys253和tdtcys302的opss-peg4-aa-dutp结合物与5’-fam-dt(35)反应。图8a中显示的反应包含1μl5μm5’-fam-dt(35)、17μl含纯化的结合的tdt变体的1xtdt反应缓冲液(neb)和2μl2.5mmcocl2。反应在37℃下进行20秒,然后通过添加33mmedta淬灭反应。图8b中所示的反应包含1.5μl的5μm5’-fam-dt(35)、1μl10xneb反应缓冲液、1.5μl的2.5mmcocl2、5μl的含各种的tdt结合物的1xtdt缓冲液和6μlddh2o。反应在37℃下进行40秒,通过添加33mmedta进行淬灭。为了准备用于凝胶的反应,将样品分别与等体积的2xnovextris-甘氨酸sds样品缓冲液(thermoscientific)或2xnovextris-甘氨酸缓冲液+1%v/v2-巯基乙醇(bme)混合。将所有样品加热至95℃保持5分钟并在sds上跑胶。
如图3中的化学细节所示,opss-peg4-aa-dutp的tdt结合物(图c)可以将栓系的核苷酸掺入引物中,这导致tdt部分与延伸的引物共价连接(图d)。出于检测目的,引物可以在其5’端用荧光染料如6-羧基荧光素(fam)标记。引物-聚合酶复合物可以通过暴露于βme而解离,所述βme裂解掺入的核苷酸和tdt之间的二硫键,释放游离的tdt和通过含有hs-peg4-aa瘢痕的dump延伸的引物(图e)。
为了证明聚合酶-核苷酸结合物将其栓系的核苷酸添加至寡核苷酸,将opss-peg4-aa-dutp的tdt结合物用5’fam标记的dt(35)引物孵育。用具有多个栓系的核苷酸的tdtwt的结合物,不具有栓系的核苷酸的tdt5cysx的结合物,和具有栓系到在302位的半胱氨酸的单个核苷酸的tdtcys302的结合物进行反应。如上所述,停止反应,并且通过sds-page分离产物(图8a)。tdtwt和tdtcys302结合物将其栓系的核苷酸(多个核苷酸)添加到引物的3’端并变得共价连接,形成聚合酶-引物复合物,如sds-page上的条带(分别为泳道3和11)的迁移与引物相比(标记为“p”:2、6和10的泳道)慢得多所示。相反,用tdt5cysx(泳道7)观察到迁移没有改变,其不包含栓系的核苷酸。在添加二硫化物裂解试剂2-巯基乙醇后,引物-tdt复合物解离,如通过条带的恢复的迁移所示(对于tdtwt、tdt5cysx和tdtcys302,分别标记为“b”:4、8和12的泳道)。引物的延伸可以参考产物标准品的梯形条带(标记为“l”:1、5、9和13的泳道)。tdtwt的结合物掺入多个栓系的核苷酸,产生通过最多达5个瘢痕dump核苷酸延伸的引物(泳道4)。tdtcys302的结合物主要通过单个瘢痕dump核苷酸延伸引物(泳道12),并且tdt5cysx的结合物不延伸引物(泳道8)。
这些数据显示聚合酶-核苷酸结合物的聚合酶部分可以将一个或多个栓系的核苷三磷酸掺入引物中。它们还显示用单个核苷酸三磷酸标记的结合物可以进行引物的单个延伸,并且显示可以阻碍通过其他聚合酶-核苷酸结合物进一步延伸引物,使得核酸能够通过单个核苷酸延伸。
为了证明可以使用聚合酶上的多个连接位置产生功能性聚合酶-核苷酸结合物,在188、302、180和253位具有单个表面半胱氨酸的tdt突变体的opss-peg4-aa-dutp结合物(分别为tdtcys188、tdtcys302、tdtcys180和tdtcys253)用于通过单个核苷酸延伸引物。将结合物分别暴露于5’荧光标记的多-dt引物。在sds-page上分离产物(图8b)显示所有四种结合物都能够将栓系的核苷酸掺入引物的3’端,如与引物条带(标记为“l”:1、8和15的泳道的最快的迁移条带)相比,形成对应于聚合酶-引物复合物(分别为泳道4-7)的慢得多的迁移条带所表明的。通过2-巯基乙醇(bme)裂解接头后,聚合酶-引物复合物解离,留下主要通过1个瘢痕dump核苷酸延伸的引物(分别为泳道11-14),如通过与产物标准品的梯形条带(标有“l”的泳道)比较所确定的。
这些数据表明,通过聚合酶上的连接点可概括出将单个核苷酸栓系到聚合酶以实现核酸的单个核苷酸延伸的原理。
实施例2
使用采用光可裂解的接头的聚合酶-核苷酸结合物合成限定的dna序列
1.仅具有一个表面暴露的半胱氨酸(tdtcys)的mbp-tdt融合蛋白的产生。
从pmal-c5x(neb)扩增编码麦芽糖结合蛋白(mbp)的序列,并使用等温组装将其在n-末端融合到实施例1中使用的tdtcys302构建体。在整个实施例2中使用得到的mbp-tdt融合蛋白(本文中称为tdtcys)。
tdtcys的蛋白序列:
mghhhhhhhhhhssghiddddkhmmkieegklviwingdkgynglaevgkkfekdtgikvtvehpdkleekfpqvaatgdgpdiifwahdrfggyaqsgllaeitpdkafqdklypftwdavryngkliaypiavealsliynkdllpnppktweeipaldkelkakgksalmfnlqepyftwpliaadggyafkyengkydikdvgvdnagakagltflvdliknkhmnadtdysiaeaafnkgetamtingpwawsnidtskvnygvtvlptfkgqpskpfvgvlsaginaaspnkelakeflenylltdegleavnkdkplgavalksyeeelvkdpriaatmenaqkgeimpnipqmsafwyavrtavinaasgrqtvdealkdaqtnsssnnnnnnnnnnlgiegrishmsmggrdivdgsefspspvpgsqnvpapavkkisqyacqrrttlnnynqlftdaldilaendelrenegsalafmrassvlkslpfpitsmkdtegipslgdkvksiiegiiedgesseakavlnderyksfklftsvfgvglktaekwfrmgfrtlskiqsdkslrftqmqkagflyyedlvscvnrpeaeavsmlvkeavvtflpdalvtmtggfrrgkmtghdvdflitspeatedeeqqllhkvtdfwkqqglllyadilestfekfkqpsrkvdaldhfqkcflilkldhgrvhseksgqqegkgwkairvdlvmspydrrafallgwtgsrqferdlrryatherkmmldnhalydrtkrvfleaeseeeifahlgldyiepwerna
(seqidno:2)。
2.基于镍亲和色谱继而阴离子交换色谱的蛋白表达和纯化。
除非另有提及,否则携带pet19-tdtcys的大肠杆菌bl21(de3)在含有100μg/ml羧苄青霉素的lb(miller)中生长,同时以200rpm振摇。在没有挡板的2l烧瓶中,将过夜培养物1/60稀释到400mllb中,并在37℃下生长直至od600达到0.40-0.45。然后将烧瓶冷却至室温45分钟而不振摇,然后在15℃下振摇45分钟。用iptg(最终浓度1mm)诱导蛋白表达,并使细胞在15℃下生长过夜并通过离心收获。所有蛋白纯化步骤均在4℃下进行。将细胞在缓冲液a(20mmtris-hcl,ph8.3,0.5mnacl)+5mm咪唑中裂解,并使用咪唑梯度(缓冲液a+5mm咪唑到缓冲液a+500mm咪唑)对裂解物进行镍亲和色谱(histrapff5ml,gehealthcare)。合并具有足够纯度的级分,以1:40稀释到20mmtris-hcl,ph8.3中,并使用0至1mnacl的梯度在20mmtris-hcl中进行阴离子交换色谱(hitrapqhp5ml,gehealthcare)。蛋白在200mmnacl下洗脱。在添加50%甘油后,将蛋白储存在-20℃下。
3.tdt-dntp结合物的制备。
采用温和涡旋在室温下将炔丙基氨基-dntp(pa-dntp)与光可裂解的nhs碳酸酯-马来酰亚胺交联剂bp-23354(图4a)在35μl反应物中偶联1小时,所述反应物含有3.3mm各种pa-dntp、6.6mm接头、66mmph7.5的kh2po4和33mmnacl。将反应物分成7.5μl等分试样,用乙酸乙酯(~2ml)研磨,并以15,000g离心以使接头-核苷酸成团。除去上清液,将团粒在speedvac中在室温下干燥8分钟。将团粒重悬于2.5μl水中,并将接头-核苷酸添加到20μl如上所述制备的tdtcys蛋白,加上2.5μlph6.5缓冲液(2mkh2po4,1mnacl),并在室温下孵育1小时。然后使用直链淀粉树脂(neb)在0.8ml旋转柱(pierce)中纯化tdtcys-接头-dntp结合物(也称为tdt-dntp结合物)。将所有试剂和缓冲液在冰上预冷却。将25μltdtcys接头-核苷酸结合反应物稀释到400μl缓冲液b(200mmkh2po4ph7.5,100mmnacl)中,并分成两个纯化柱,每个柱含有含250μl直链淀粉树脂的缓冲液b。采用温和涡旋结合蛋白10分钟后,用缓冲液b洗涤柱两次,然后用1xnebtdt反应缓冲液(50mm乙酸钾,20mmtris-乙酸盐,10mm乙酸镁,ph7.9)洗涤两次。通过向柱加入500μl缓冲液进行洗涤,在振荡器区块上孵育1分钟以混合树脂和缓冲液(800rpm),接着以50g离心1分钟。通过振荡5分钟将树脂在150μltdt反应缓冲液+10mm麦芽糖中重悬浮两次进行洗脱,然后离心。合并洗脱液并在30kdamwco柱中浓缩,用tdt反应缓冲液1:10稀释,然后浓缩至~2.5μg/μl。
将四种核苷酸datp、dctp、dgtp和dttp的类似物分别偶联到光可裂解的交联剂并栓系到tdt。使用直链淀粉亲和色谱纯化不同的聚合酶-核苷酸结合物。
4.毛细管电泳分析和梯形条带产生。
在abi3730xldna分析仪上进行整个实施例2中的毛细管电泳(ce)分析。将genescanliz600v1.0(thermo)添加到所有样品中用作内部尺寸标准。通过用tdt掺入游离pa-dntp产生5'-fam标记的60-聚体dt-寡核苷酸(5’-fam-dt(60))延伸产物的梯形条带(尺寸标准)。反应含有100nm5’-fam-dt(60)、100μm一种类型的pa-dntp、1xrbc和0.05u/μl或0.03u/μlnebtdt。反应在37℃下进行。在2、5和10分钟后取等分试样并用edta淬灭至终浓度为33.3mm。然后使用nhs-乙酸酯、纯化的oligoclean&concentrator试剂盒(“occ”,zymoresearch)将淬灭的样品乙酰化,并通过毛细管电泳分析。选择具有5’-fam-dt(60)的可检测峰的样品以及+1和+2pa-dntp延伸产物作为尺寸标准(梯形条带)。
5.在page和毛细管电泳上证明两个反应循环。
在整个实验中,引物延伸反应在37℃下进行2分钟,并通过添加等体积的200mmedta淬灭。所有反应均含有50nm5’-fam-dt(60)、0.25mg/ml的tdtcys(-接头)/tdt-dctp和1xrbc(1xnebtdt反应缓冲液,0.25mm钴)。使用台式2uv透射仪(uvp,llc)在365nm设置下在冰上进行1小时的光诱导的接头裂解。测量的辐照度约为5mw/cm2。双循环实验:进行含有tdt-dctp结合物和5’-fam-dt(60)的反应,并用365nm光裂解产物。然后纯化寡核苷酸(zymoocc),并与tdt-dctp进行另一反应,然后再进行光裂解步骤。在两次延伸反应(对于page)和两次光裂解反应(对于page和ce)之后取等分试样。对于对照实验(“未连接的对照”),通过在冰上用365nm光照射1小时来裂解tdt-dctp结合物,以产生未连接的tdtcys(-接头)+pa-dctp的等摩尔混合物。然后将产物与5’-fam-dt(60)反应。在用edta淬灭反应后取用于page和ce的等分试样。样品制备:在分析之前,使用含20mmnhs-乙酸酯的碳酸氢盐缓冲液将所有ce样品乙酰化。将样品与sds负载染料组合并通过page分析,对凝胶的绿色荧光(5’fam标记的引物的)成像,并且在用lumiteinuv(biotium)染色后,对红色荧光(总蛋白)成像。
将5’fam标记的寡核苷酸引物暴露于tdt-dctp结合物形成在sds-page上可见的含有dna引物和蛋白的共价复合物(图9a)。用365nmuv光照射复合物裂解接头,从而解离复合物,释放出主要通过单个瘢痕dcmp核苷酸延伸的引物(图9b)。将该产物暴露于新鲜的tdt-dctp,并再次形成引物-tdt复合物,其再次通过uv照射解离,释放现在已经通过两个核苷酸延伸的引物。相反,在添加dna引物之前,在tdt-dctp的对照反应中未观察到引物-tdt复合物形成(图9a);相反,对照反应产生多种引物延伸产物(图9b),其与tdt催化的游离核苷酸的掺入一致。
这些数据表明,可以重复使用聚合酶-核苷酸结合物通过一个核苷酸延伸引物的过程,以通过限定序列延伸引物。
6.通过tdt-dctp、tdt-dgtp、tdt-dttp和tdt-datp的快速单个核苷酸掺入。
在8、15和120秒时测量1.5mg/mltdt-dntp结合物的寡核苷酸延伸产率。在37℃下,通过将4.5μltdt-dntp结合物(2mg/ml)添加到1.5μl5’-fam-dt(60)(100nm,最终25nm)(二者均在1xrbc中)进行反应。快速混合后,在8或15秒后,在18μlqs(94%hidi甲酰胺,10mmedta)中淬灭4.5μl反应物。2分钟后,用6μlqs淬灭剩余的反应体积。所有样品在台式2uv透射仪(uvp,llc)上以365nm照射30分钟以裂解接头。用洗涤缓冲液(0.67mnah2po4,0.67mnacl,0.17medta,ph8)稀释裂解产物,并捕获到用5’生物素基da(60)寡核苷酸饱和的dynabeadsm-280链霉亲和素(thermo)上,洗涤,使用含100mmnhs-乙酸酯的碳酸氢盐缓冲液乙酰化,并用75%去离子甲酰胺洗脱用于ce。
图10中的ce数据显示在用tdt-dctp、tdt-dgtp、tdt-dttp和tdt-datp孵育不到20秒的时间内,引物转化成单个延伸的复合物。这些结果证明,聚合酶-核苷酸结合物可以快速地通过一个核苷酸延伸引物并且具有优异的产率。
7.限定的dna序列的循环合成。
使用0.25mg/ml的tdt-dntp结合物重复进行四次核酸延伸和脱保护。在37℃下,在1xrbc中以孵育2分钟进行延伸反应,并通过添加等体积的淬灭缓冲液(250mmedta,500mmnacl)淬灭。通过在365nm下照射进行接头的裂解。第一次延伸反应包含tdt-dctp和50nm寡聚c1(/5phos/utgaagagcgagagtgagtga/ifluort/cattaaagacgtgggcctggattt(seqidno:3),其中/5phos/是指5’磷酸化,/ifluort/是指用荧光素修饰的dt核苷酸碱基)。光解后,纯化延伸产物(zymoocc),用tdt-dttp对回收的dna进行下一个延伸步骤。用tdt-datp,然后再用tdt-dgtp进行另外两个循环,并使用tdt和游离dttp+ddttp以100:1的比例使最终产物以t加尾(t-tailed)。然后使用hotstarttaq(neb)用引物c2(gtgccgtgagacctggctcctgacgatatggataagctttgaagagcgagagtgagtga;seqidno:4)和c3(aaaagaattcaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa;seqidno:5)对所述加尾产物进行pcr扩增(pcr程序:98℃初始循环2分钟,49℃持续20秒,68℃持续5分钟,然后是30个循环的三步骤方案:98℃持续30秒,49℃持续20秒,68℃持续30秒)。使用通过pcr引物引入的ecori和hindiii位点将pcr产物插入puc19质粒中。将质粒转化到dh10b细胞中,在lb中过夜生长后提取单集落的质粒并测序。
如以上详细描述的,对起始dna分子重复进行四次反应循环,对加尾产物进行pcr扩增,并且克隆扩增子用于测序,如图11a所示。在测序的35个克隆中,31个(89%)含有完整的5’-ctag-3’序列(图11b),意味着平均逐步产率为97%。
这些数据表明,聚合酶-核苷酸结合物可用于循环过程,以极好的逐步产率编写dna的限定的序列。
实施例3
将游离dntp掺入已经栓系到聚合酶的引物中
使用如实施例2中制备的tdt-dctp结合物进行实验。也如实施例2中所述进行毛细管电泳分析,并使用相同的寡核苷酸梯形条带作为尺寸参考。在37℃下在1xrbc中用tdt-dctp(0.25mg/ml)孵育5’-fam-dt60(50nm)120秒以产生引物-聚合酶复合物,并将反应物分成等分试样。通过添加edta至终浓度为100mm淬灭一份等分试样。将另一份等分试样用1xrbc稀释10倍。将另一份等分试样用含有游离pa-dctp的1xrbc稀释10倍至终浓度为500μmpa-dctp。在37℃下再孵育60秒后,通过添加edta至终浓度为100mm淬灭两个反应。使用台式2uv透射仪(uvp,llc)在365nm设置下在冰上对所有样品进行光诱导的接头裂解1小时。使用含20mmnhs-乙酸酯的碳酸氢盐缓冲液将样品乙酰化,纯化并通过ce分析。
在用tdt-dctp初始孵育引物期间,形成引物-聚合酶复合物,如通过ce分析观察到的通过单个核苷酸延伸引物所示(图12)。在允许再进行60秒的反应中,没有检测到引物的进一步延伸。然而,在允许用添加的游离核苷三磷酸(pa-dctp)再进行60秒的反应中,观察到栓系的引物的进一步延伸。
这些结果表明,通过聚合酶-核苷酸结合物核苷三磷酸的栓系掺入时形成的核酸-聚合酶复合物仍然能够掺入游离的核苷三磷酸。
实施例4
将“瘢痕”多核苷酸转化为天然dna
通过用含4.5mm荧光团nhs酯的碳酸氢钠缓冲液,接着用occ标记含胺寡核苷酸来制备荧光引物。按照制造商的说明(两步方案:98℃变性10秒,72℃退火/延伸1分钟),使用引物pa1(/5phos/cattaaagacgtgggcgtgga;seqidno:6)和pa2(t*t*t/iuniamm/tgtgaaatccttccctcgatcc;seqidno:7),使用phusionu(thermo),通过35个循环的pcr由质粒模板pmal-c5x(neb)获得含有脱氧尿苷碱基的639ntdna产物。引物pa1是5’磷酸化的;引物pa2含有用cy3nhs(gehealtcare)标记的内部氨基(/iuniamm/),并以两个硫代磷酸酯键(*)开始,使其具有外切核酸酶抗性。由1%tae-琼脂糖凝胶纯化pcr产物,并用5uλ外切核酸酶(neb)在100μl反应中在37℃下消化~6.7μg产物20分钟以分离cy3标记的链。通过occ纯化消化产物,然后以~1μm与等摩尔5’fam标记的引物pa3(/5ammc6/caacacaccacccacccaaccgcagatgtccgctttctgg(seqidno:14);/5ammc6/是指5’磷酸的氨基己基修饰)在1xcutsmart缓冲液(neb)中通过以1℃/min加热到85℃和冷却到25℃杂交。通过在100mm碳酸氢钠缓冲液中用25mmnhs乙酸盐乙酰化13mm炔丙基氨基dntp制备n-乙酰基炔丙基氨基dntp,并用甘氨酸淬灭至25mm终浓度。然后使用7.5u的klenow(外-)(neb)在37℃下,在30μl反应中用200μm(每种)n-乙酰基炔丙基氨基dntp(反应ii)或不使用任何dntp(反应i)延伸引物。1小时后,向两个反应添加3μl的2.5mm(每种)ddntp(affymetrix)再孵育15分钟,然后通过加热至75℃20分钟使聚合酶失活。然后使用5u的user酶(neb)在37℃下,立即在50μl反应中消化产物1小时以除去含有du的ssdna模板。通过occ纯化消化产物,并通过ce确认5’fam标记的引物的炔丙基氨基dntp依赖性延伸和cy3标记的模板的user消化。然后将两种产物用作互补dna合成(“读取”)的模板,所述互补dna合成(“读取”)以5utaq(thermo),在20μl反应中使用200μm(每种)天然dntp和200nm5’cy3标记的引物pa4(/5ammc6/cgactcacctcacgtcctcatgtgaaatccttccctcgatcc;seqidno:8),以加热至95℃2分钟,然后在45℃下孵育来进行。30分钟后,将1μl的2.5mm(各)ddntp添加到两个反应再孵育15分钟,并纯化dna产物。然后分析等体积的两种读取产物,所述分析通过qpcr在cfx96仪器(bio-rad)上,使用phusionhsii(thermo)和1xevagreen(biotium)和引物pa5(ttttgaattccaacacaccacccacccaac;seqidno:9)和pa6(ttttaagcttcgactcacctcacgtcctca;seqidno:10)进行,98℃持续5秒,67℃持续15秒,和72℃持续30秒进行30个循环。使用由pcr引物引入的ecori和hindiii位点,将来自反应ii的qpcr产物插入到puc19质粒中,并如上所述对81个克隆进行测序。
在该实施例中使用的dntp类似物含有从核碱基(嘧啶的5位,7-脱氮嘌呤的7位)延伸的炔丙基氨基,其是来自实施例2的聚合酶-核苷酸结合物作为瘢痕留下的相同的部分。炔丙基氨基部分通过n-乙酰化进一步衍生化。为了证明包含如实施例2中制备的瘢痕碱基的dna可以充当模板用于通过模板依赖性聚合酶使用天然dntp精确合成互补dna,在该实施例中制备了含有141个连续3-乙酰胺丙炔基(即n-乙酰化炔丙基氨基)核苷酸的dna分子。分离该dna产物并用作pcr的模板(图13a-13c)。将pcr产物插入质粒中,克隆到大肠杆菌中,并对81个集落进行测序。发现5个错误,意味着由3-乙酰氨基丙炔基修饰的模板合成天然dna的错误率约为6x10-4/nt。
该数据显示,可以以高保真度pcr扩增瘢痕核酸(在这种情况下多核苷酸具有可源自实施例2的炔丙基氨基瘢痕的部分),从而产生可用于生物学应用的天然dna。
实施例5.10聚体的合成
使用如实施例2中制备的tdt-dntp结合物进行双链dna分子的3’突出端的10次延伸。按照制造商的说明(两步方案:98℃持续10秒,72℃持续45秒),使用引物t1(/5phos/gcagccaactcagcttctgcaggggctttgttagcagccggatcctc;seqidno:11)和t2(aaacaagcgctcatgagccagaaatctggagcccgatcttccccatcgg;seqidno:12),使用phusion聚合酶(thermo),由源自pet19b质粒的~350bp的pcr产物制备用作初始底物的双链dna。用psti消化pcr产物以在一侧产生3’突出端,然后使用tdt用ddttp加尾以防止产生的3’突出端延伸。加尾后,用bstxi消化dna以在扩增子的另一端产生3’突出端,以通过聚合酶-核苷酸结合物实现延伸。通过2%琼脂糖凝胶电泳分离消化产物并纯化,得到用于通过聚合酶-核苷酸结合物延伸的初始底物。
在37℃下在1xrbc中用1mg/ml的各种聚合酶-核苷酸结合物进行延伸反应90秒,并通过添加等体积的淬灭缓冲液(250mmedta,500mmnacl)淬灭。通过在365nm下照射进行接头的裂解。第一延伸反应含有~40nm的初始底物。在每个裂解步骤后,纯化dna产物(zymoocc),并对回收的dna进行下一个延伸步骤。以下结合物用于延伸步骤:1)tdt-dctp,2)tdt-dttp,3)tdt-datp,4)tdt-dctp,5)tdt-dttp,6)tdt-dgtp,7)tdt-datp,8)tdt-dctp,9)tdt-dttp,10)tdt-dgtp。使用tdt和游离dttp+ddttp以100:1的比例对十循环产物进行t加尾,并使用含20mmnhs-乙酸盐的碳酸氢盐缓冲液乙酰化。然后使用hotstarttaq(neb)用引物c3和c4(gtgccgtgagacctggctcctgacgaggataagcttctatagtgagtcgtattaatttcg;seqidno:13)pcr扩增加尾产物(pcr程序:98℃初始循环2分钟,49℃持续20秒,68℃持续12分钟,然后是30个循环的三步方案:98℃持续30秒,49℃持续20秒,68℃持续30秒)。使用通过pcr引物引入的ecori和hindiii位点将pcr产物插入puc19中。将质粒转化到dh10b细胞中,在lb中过夜生长后提取单集落的质粒并测序。
如上文更详细描述的,使用聚合酶-核苷酸结合物通过10个循环延伸双链dna模板,扩增合成产物并克隆用于测序(图14a)。在测序的32个克隆中,13个(41%)含有完整的5’-ctactgactg-3’序列(图14b),意味着平均逐步产率为91%。
该结果表明dna延伸的循环过程可以重复多次以编写具有期望序列和长度的核酸分子。
序列表
<110>d·阿洛(arlow,daniel)
s·帕鲁克(palluk,sebastian)
<120>使用栓系的核苷三磷酸的核酸合成和测序
<130>berk-339wo
<150>62354635
<151>2016-06-24
<160>24
<170>siposequencelisting1.0
<210>1
<211>384
<212>prt
<213>眼镜猴(tarsiussyrichta)
<400>1
metglyhishishishishishishishishishisserserglyhis
151015
ileaspaspaspasplyshismetserglntyralacysglnargarg
202530
thrthrleuasnasnhisasnglnilephethraspalapheaspile
354045
leualagluasnaspgluphearggluasngluglyproserleuthr
505560
phemetargalaalaservalleulysserleuprophethrileile
65707580
sermetlysaspilegluglyileproasnleuglyaspargvallys
859095
serileileglugluileilegluaspglygluserseralavallys
100105110
alavalleuasnaspgluargtyrlysserphelysleuphethrser
115120125
valpheglyvalglyleulysthrserglulystrppheargmetgly
130135140
pheargthrleuserasnileargserasplysserleuthrphethr
145150155160
argmetglnargalaglypheleutyrtyrgluaspleuvalserarg
165170175
valthrargalaglualaglualavalglyvalleuvallysgluala
180185190
valtrpalaserleuproaspalaphevalthrmetthrglyglyphe
195200205
argargglylyslysthrglyhisaspvalasppheleuilethrser
210215220
proglyalathrglugluglugluglnglnleuleuhislysvalile
225230235240
serleutrpgluhislysglyleuleuleutyrtyraspleuvalglu
245250255
serthrpheglulysleulysleuproserarglysvalaspalaleu
260265270
asphispheglnlyscyspheleuileleulysleuhishisglnarg
275280285
valaspseraspglnsersertrpglngluglylysthrtrplysala
290295300
ileargvalaspleuvalvalcysprotyrgluargargalapheala
305310315320
leuleuglytrpthrglyserargglnphegluargaspleuargarg
325330335
tyralathrhisgluarglysmetileileaspasnhisalaleutyr
340345350
asplysthrlysargilepheleuglualaglusergluglugluile
355360365
phealahisleuglyleuasptyrilegluprotrpgluargasnala
370375380
<210>2
<211>807
<212>prt
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(807)
<223>合成序列
<400>2
metglyhishishishishishishishishishisserserglyhis
151015
ileaspaspaspasplyshismetmetlysileglugluglylysleu
202530
valiletrpileasnglyasplysglytyrasnglyleualagluval
354045
glylyslyspheglulysaspthrglyilelysvalthrvalgluhis
505560
proasplysleugluglulyspheproglnvalalaalathrglyasp
65707580
glyproaspileilephetrpalahisaspargpheglyglytyrala
859095
glnserglyleuleualagluilethrproasplysalapheglnasp
100105110
lysleutyrprophethrtrpaspalavalargtyrasnglylysleu
115120125
ilealatyrproilealavalglualaleuserleuiletyrasnlys
130135140
aspleuleuproasnproprolysthrtrpglugluileproalaleu
145150155160
asplysgluleulysalalysglylysseralaleumetpheasnleu
165170175
glngluprotyrphethrtrpproleuilealaalaaspglyglytyr
180185190
alaphelystyrgluasnglylystyraspilelysaspvalglyval
195200205
aspasnalaglyalalysalaglyleuthrpheleuvalaspleuile
210215220
lysasnlyshismetasnalaaspthrasptyrserilealagluala
225230235240
alapheasnlysglygluthralametthrileasnglyprotrpala
245250255
trpserasnileaspthrserlysvalasntyrglyvalthrvalleu
260265270
prothrphelysglyglnproserlysprophevalglyvalleuser
275280285
alaglyileasnalaalaserproasnlysgluleualalysgluphe
290295300
leugluasntyrleuleuthraspgluglyleuglualavalasnlys
305310315320
asplysproleuglyalavalalaleulyssertyrgluglugluleu
325330335
vallysaspproargilealaalathrmetgluasnalaglnlysgly
340345350
gluilemetproasnileproglnmetseralaphetrptyralaval
355360365
argthralavalileasnalaalaserglyargglnthrvalaspglu
370375380
alaleulysaspalaglnthrasnserserserasnasnasnasnasn
385390395400
asnasnasnasnasnleuglyilegluglyargileserhismetser
405410415
metglyglyargaspilevalaspglyserglupheserproserpro
420425430
valproglyserglnasnvalproalaproalavallyslysileser
435440445
glntyralacysglnargargthrthrleuasnasntyrasnglnleu
450455460
phethraspalaleuaspileleualagluasnaspgluleuargglu
465470475480
asngluglyseralaleualaphemetargalaserservalleulys
485490495
serleupropheproilethrsermetlysaspthrgluglyilepro
500505510
serleuglyasplysvallysserileilegluglyileilegluasp
515520525
glygluserserglualalysalavalleuasnaspgluargtyrlys
530535540
serphelysleuphethrservalpheglyvalglyleulysthrala
545550555560
glulystrppheargmetglypheargthrleuserlysileglnser
565570575
asplysserleuargphethrglnmetglnlysalaglypheleutyr
580585590
tyrgluaspleuvalsercysvalasnargproglualaglualaval
595600605
sermetleuvallysglualavalvalthrpheleuproaspalaleu
610615620
valthrmetthrglyglypheargargglylysmetthrglyhisasp
625630635640
valasppheleuilethrserproglualathrgluaspgluglugln
645650655
glnleuleuhislysvalthraspphetrplysglnglnglyleuleu
660665670
leutyralaaspileleugluserthrpheglulysphelysglnpro
675680685
serarglysvalaspalaleuasphispheglnlyscyspheleuile
690695700
leulysleuasphisglyargvalhisserglulysserglyglngln
705710715720
gluglylysglytrplysalaileargvalaspleuvalmetserpro
725730735
tyraspargargalaphealaleuleuglytrpthrglyserarggln
740745750
phegluargaspleuargargtyralathrhisgluarglysmetmet
755760765
leuaspasnhisalaleutyraspargthrlysargvalpheleuglu
770775780
alaglusergluglugluilephealahisleuglyleuasptyrile
785790795800
gluprotrpgluargasnala
805
<210>3
<211>46
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(46)
<223>合成序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>5'端的5'磷酸化
<220>
<221>misc_feature
<222>(1)..(1)
<223>n为尿嘧啶
<220>
<221>misc_feature
<222>(22)..(22)
<223>n是用荧光素修饰的脱氧胸苷核苷酸碱基
<400>3
ntgaagagcgagagtgagtgancattaaagacgtgggcctggattt46
<210>4
<211>59
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(59)
<223>合成序列
<400>4
gtgccgtgagacctggctcctgacgatatggataagctttgaagagcgagagtgagtga59
<210>5
<211>56
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(56)
<223>合成序列
<400>5
aaaagaattcaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa56
<210>6
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(21)
<223>合成序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>在5'端磷酸化
<400>6
cattaaagacgtgggcgtgga21
<210>7
<211>26
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(26)
<223>合成序列
<220>
<221>misc_feature
<222>(4)..(4)
<223>n是用cy3nhs标记的内部氨基
<400>7
tttntgtgaaatccttccctcgatcc26
<210>8
<211>42
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(42)
<223>合成序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>5'端的5'磷酸的氨基己基修饰
<400>8
cgactcacctcacgtcctcatgtgaaatccttccctcgatcc42
<210>9
<211>30
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(30)
<223>合成序列
<400>9
ttttgaattccaacacaccacccacccaac30
<210>10
<211>30
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(30)
<223>合成序列
<400>10
ttttaagcttcgactcacctcacgtcctca30
<210>11
<211>47
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(47)
<223>合成序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>5'端的5'磷酸化
<400>11
gcagccaactcagcttctgcaggggctttgttagcagccggatcctc47
<210>12
<211>49
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(49)
<223>合成序列
<400>12
aaacaagcgctcatgagccagaaatctggagcccgatcttccccatcgg49
<210>13
<211>60
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(60)
<223>合成序列
<400>13
gtgccgtgagacctggctcctgacgaggataagcttctatagtgagtcgtattaatttcg60
<210>14
<211>40
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(40)
<223>合成序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>5'端的5'磷酸的氨基己基修饰
<400>14
caacacaccacccacccaaccgcagatgtccgctttctgg40
<210>15
<211>11
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(11)
<223>合成序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(2)..(2)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(3)..(3)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(4)..(4)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(11)..(11)
<223>3'端的oh基
<400>15
ctagttttttt11
<210>16
<211>11
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(11)
<223>合成序列
<220>
<221>misc_feature
<222>(11)..(11)
<223>3'端的oh基
<400>16
ctagttttttt11
<210>17
<211>11
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(11)
<223>合成序列
<400>17
tttctagtttt11
<210>18
<211>10
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(10)
<223>合成序列
<400>18
ctactgactg10
<210>19
<211>10
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(10)
<223>合成序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(1)..(1)
<223>无其他信息
<220>
<221>misc_feature
<222>(2)..(2)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(3)..(3)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(4)..(4)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(5)..(5)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(6)..(6)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(7)..(7)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(8)..(8)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(9)..(9)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(10)..(10)
<223>3'端的oh基
<220>
<221>misc_feature
<222>(10)..(10)
<223>连接到-c三键cch2nh2
<400>19
ctactgactg10
<210>20
<211>17
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(17)
<223>合成序列
<220>
<221>misc_feature
<222>(1)..(1)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(2)..(2)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(3)..(3)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(4)..(4)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(5)..(5)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(6)..(6)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(7)..(7)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(8)..(8)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(9)..(9)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(10)..(10)
<223>连接到-c三键cch2nh2
<220>
<221>misc_feature
<222>(17)..(17)
<223>3'端的oh基
<400>20
ctactgactgttttttt17
<210>21
<211>17
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(17)
<223>合成序列
<400>21
ctactgactgttttttt17
<210>22
<211>17
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(17)
<223>合成序列
<400>22
tttctactgactgtttt17
<210>23
<211>11
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(17)
<223>合成序列
<400>23
aaaaaaactag11
<210>24
<211>17
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>conflict
<222>(1)..(17)
<223>合成序列
<400>24
aaaaaaacagtcagtag17
- 还没有人留言评论。精彩留言会获得点赞!