用于PDGF-CC抑制的方法和组合物与流程
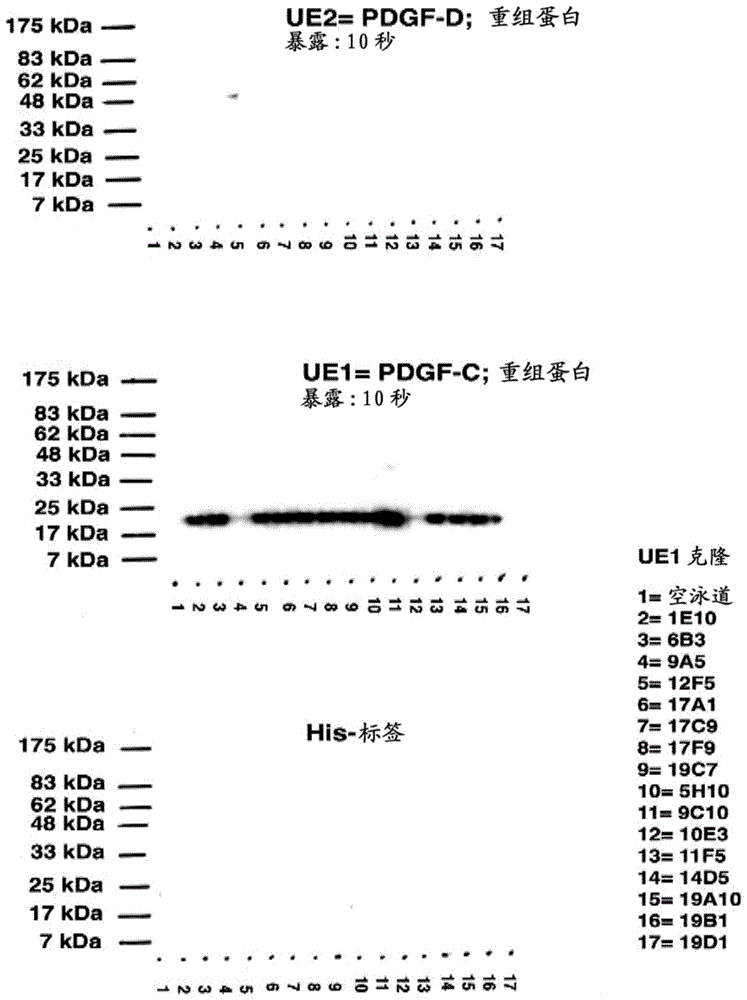
本申请要求2016年7月1日提交的美国临时申请no.62/357,536的优先权。该申请的内容通过引用整体并入本文。发明领域本发明部分涉及分离的抗体,其与血小板衍生的生长因子c(pdgf-c)及其二聚体形式的pdgf-cc的表位特异性相互作用并显示出可测量的结合亲和力。此类抗体可以用于调节细胞中或从细胞分泌的pdgf-cc活性,以研究pdgf-cc对细胞功能的影响,并且在某些实施方案中,用于治疗和/或预防与pdgf-c表达相关的疾病或状况。发明背景血小板衍生的生长因子(pdgf)对于正常组织生长和维持是重要的,并且还涉及多种病理状况,例如恶性肿瘤、动脉粥样硬化和纤维化。pdgf信号传导通过两种结构相关的酪氨酸激酶受体pdgfr-α和pdgfr-β介导。pdgf家族由涉及四条多肽链的二硫键键合的二聚体组成:经典的pdgf-a和pdgf-b链以及最近发现的pdgf-c和pdgf-d链。这些链中每种的标志是它们都含有vegf/pdgf同源性域(vhd)。pdgf-c和-d链的进一步区别在于它们各自也具有vhd上游的cub域,其形成双域结构。pdgf-c以潜伏的二聚体pdgf-cc从细胞分泌,并且已知在pdgf-cc能结合并激活其关联受体(pdgfr)前需要受调节的cub域的蛋白水解除去。认为活化的pdgf-cc,如pdgf-aa通过pdgfr-α同二聚体发出信号,尽管有人认为pdgf-cc和还有pdgf-dd两者也能够激活pdgfrα/β异二聚体复合物。pdgf-cc参与血管生成-许多恶性癌的形态学标志-已在许多模型中得到证实,包括小鼠胚胎、小鼠角膜和缺血性心脏组织。虽然其作用的具体细节仍在研究中,但认为pdgf-cc通过vegf上调、pdgf受体的激活和/或通过对基质的直接作用诱导血管发生。因此,认为自分泌和旁分泌pdgf介导的信号传导经由肿瘤及其周围组织的血管化而导致或有助于加速的肿瘤细胞生长和侵入。最近的研究显示了此类效果可以通过抑制pdgf-cc的活性来抵消。具体地,已经显示抑制pdgf-cc活性导致血管生成减少,这减缓某些恶性的进展。在某些情况下,它进一步导致肿瘤细胞生长的减少(crawfordy.,etal.cancercell15:21-34,2009)。因此,pdgf-cc为研究pdgf诱导的血管生成提供了有吸引力的靶标。pdgf-cc还为用于治疗恶性癌(特别是那些表达pdgf-c,或者在其它情况下使用pdgf-cc依赖性途径进行血管化和肿瘤生长的恶性癌)的潜在治疗剂和/或潜在化学治疗剂提供了有吸引力的靶标。最近的研究还显示了pdgf-cc信号传导控制血脑屏障(在脑血管和脊髓血管以及眼视网膜中发现的特化血管壁)的完整性。血脑屏障的独特性质使其在正常条件下对大多数血液成分不可渗透,包括离子和大多数其他小分子。这点的原因是密封中枢神经系统(cns)免于血液中的毒性和/或感染作用物,并且正常的神经元活动与血液的特性不相容。在脑和cns的其他部分的几种类型的病理状况,包括但不限于中风,创伤,炎症,如多发性硬化症(ms),感染,原发性和继发性癌症,手术,心脏停搏或出生并发症之后对脑的正常氧和营养物供应的缺乏,cns的神经变性性疾病,包括阿尔茨海默氏病,血脑屏障完整性变得受损,导致流体和其他血液成分外渗到cns的实质中。这导致组织的肿胀和炎症,导致正常灌注的丧失和对脑、脊髓和视网膜的损害增加。因此,如上所述,pdgf-cc作为用于治疗具有受损的血脑屏障的状况的潜在治疗剂的有吸引力的靶标呈现。先前suetal.“activationofpdgf-ccbyplasminogenactivatorimpairsbloodbrainbarrierintegrityduringischemicstroke.naturemedicine,14;731-737,2008和erikssonetal.“methodsandcompositionsformodulationofblood-neuralbarrier”,国际申请pct/us2007/066804(两者在此并入作为参考)已经认识到pdgf-cc在控制血脑屏障完整性中的潜在作用。发明概述在某些方面,本发明涉及与血小板衍生的生长因子c(pdgf-c)(包括其二聚体形式pdgf-cc)的表位特异性相互作用和/或显示可测量的亲和力(affinity)的分离的抗体或其片段。在其他方面,此类抗体或其片段与蛋白质pdgf-c的活性部分内(seqidno:2)的多肽或与其基本上同源的多肽特异性相互作用和/或显示可测量的亲和力。在更进一步的方面,抗体或其片段与seqid.no:3的表位或者与seqid.no:3内的序列或与其基本上同源的多肽特异性相互作用和/或显示出可测量的亲和力。本发明的抗体(统称为抗pdgf-c抗体,或抗pdgf-cc抗体)与pdgf-c和pdgf-cc特异性相互作用和/或显示出可测量的亲和力,并且可以包含单克隆抗体(mab)6b3、11f5、19c7和12f5、嵌合抗体ch6b3或人源化抗体hu6b3的整个抗体、片段或基本上同源的片段。片段可以包括6b3、ch6b3、hu6b3、11f5、12f5和19c7的可变轻链和重链序列之一或部分或cdr区,或者可以与此类序列基本上同源。6b3、ch6b3、hu6b3、11f5、12f5和19c7各自的轻链和重链cdr如下:6b3肽–轻链–seqidno:16(cdr1),seqidno:17(cdr2),和seqidno:18(cdr3);重链–seqidno:34(cdr1),seqidno:35(cdr2),和seqidno:36(cdr3);核酸–轻链-seqidno:64(cdr1),seqidno:65(cdr2),和seqidno:66(cdr3);重链–seqidno:82(cdr1),seqidno:83(cdr2),和seqidno:84(cdr3);ch6b3肽-轻链–seqidno:28(cdr1),seqidno:29(cdr2),和seqidno:30(cdr3);重链–seqidno:46(cdr1),seqidno:47(cdr2),和seqidno:48(cdr3);核酸–轻链-seqidno:76(cdr1),seqidno:77(cdr2),和seqidno:78(cdr3);重链–seqidno:94(cdr1),seqidno:95(cdr2),和seqidno:96(cdr3);11f5肽–轻链–seqidno:19(cdr1),seqidno:20(cdr2),和seqidno:21(cdr3);重链–seqidno:37(cdr1),seqidno:38(cdr2),和seqidno:39(cdr3);核酸–轻链-seqidno:67(cdr1),seqidno:68(cdr2),和seqidno:99(cdr3);重链–seqidno:85(cdr1),seqidno:86(cdr2),和seqidno:87(cdr3);12f5肽–轻链–seqidno:22(cdr1),seqidno:23(cdr2),和seqidno:24(cdr3);重链–seqidno:40(cdr1),seqidno:41(cdr2),和seqidno:42(cdr3);核酸–轻链-seqidno:70(cdr1),seqidno:71(cdr2),和seqidno:72(cdr3);重链–seqidno:88(cdr1),seqidno:89(cdr2),和seqidno:90(cdr3).19c7肽–轻链–seqidno:25(cdr1),seqidno:26(cdr2),和seqidno:27(cdr3);重链–seqidno:43(cdr1),seqidno:44(cdr2),和seqidno:45(cdr3);核酸–轻链-seqidno:73(cdr1),seqidno:74(cdr2),和seqidno:75(cdr3);重链–seqidno:91(cdr1),seqidno:92(cdr2),和seqidno:93(cdr3).hu6b3肽-轻链–seqidno:31(cdr1),seqidno:32(cdr2),和seqidno:33(cdr3);重链–seqidno:49(cdr1),seqidno:50(cdr2),和seqidno:51(cdr3);核酸–轻链-seqidno:79(cdr1),seqidno:80(cdr2),和seqidno:81(cdr3);重链–seqidno:97(cdr1),seqidno:98(cdr2),和seqidno:99(cdr3);为此,并且在某些方面,本发明的抗pdgf-c抗体的抗体或部分在分离的核酸分子中编码,所述分离的核酸分子包含前述序列、其片段或同源物中的一种或多种。核酸分子可以编码单克隆抗体6b3、11f5、19c7和12f5、嵌合抗体ch6b3或人源化抗体hu6b3的可变重链和/或轻链和/或cdr,包括其片段。可以将此类核酸序列克隆到表达载体中并插入重组宿主细胞中。为此,本发明包括分离的核酸、编码此类分离的核酸的重组表达载体和表达此类载体的宿主细胞中的每种。掺入一种或多种前述序列(包括其基本上同源的变体)的本发明的抗pdgf-c抗体可以作为单克隆抗体、嵌合抗体、人源化抗体、人单克隆抗体或本文定义的其他变体提供。本发明还涉及单独或在药物组合物中使用本发明的抗pdgf-c抗体中的一种或组合的治疗方法。治疗方法的一个实施方案包括通过对哺乳动物施用有效量的至少一种本发明的抗pdgf-c抗体来调节细胞(例如表达pdgf-cc的癌)中血小板衍生的生长因子cc(pdgf-cc)的活性。在进一步的实施方案中,本发明的治疗方法包括调节pdgf-cc介导的来自细胞的自分泌或旁分泌信号传导。对于某些表达pdgf-cc的癌,例如,pdgf-cc自分泌或旁分泌信号传导与细胞内或细胞周围的血管化、基质支持或其他肿瘤效应(其导致细胞存活力和/或肿瘤生长)相关。施用本发明的一种或多种抗pdgf-c抗体可以用于抑制或预防此类信号传导,从而导致此类效应的降低。为此,本发明的治疗方法还包括通过对哺乳动物施用有效量的至少一种本发明的抗pdgf-c抗体来减少血管生成、基质支持、细胞存活力、肿瘤大小等的方法。在另一个实施方案中,治疗方法包括通过对哺乳动物施用有效量的至少一种本发明的抗pdgf-c抗体来调节血脑屏障中血小板衍生的生长因子cc(pdgf-cc)的活性。在进一步的实施方案中,本发明的治疗方法包括在cns的几种病理状况下调节pdgf-cc介导的血脑屏障的开放。施用本发明的一种或多种抗pdgf-c抗体可以用于抑制或预防此类信号传导,从而导致此类效应的降低。为此,本发明的治疗方法还包括通过对哺乳动物施用有效量的至少一种本发明的抗pdgf-c抗体来减少cns病理学等的血脑屏障开放的方法。另外,本发明包括诊断测定法,药物筛选测定法等,用于在患者或受试者体液中诊断表达pdgf-cc的细胞的存在或以其他方式鉴定表现出对pdgf-cc活性的靶向抑制的替代治疗剂。本发明的抗pdgf-c抗体也可以用作研究pdgf-cc表达细胞中pdgf-cc活性的分子工具。结合此类实施方案,本发明还包括试剂盒,用于检测血小板衍生的生长因子c(pdgf-c)肽,而显示对除pdgf-c之外的血小板衍生的生长因子的最小亲和力,所述试剂盒包含(1)抗体或其片段,其能够在体外特异性结合血小板衍生的生长因子c(pdgf-c)肽的表位,而对除pdgf-c之外的血小板衍生的生长因子显示最小的亲和力;(2)直接或间接结合所述抗体或其片段的试剂。本发明还提供了调节有此需要的高等脊椎动物中的血脑屏障通透性的方法。方法包括对动物施用有效量的上文所述抗体或其抗原结合部分。还提供了治疗脑血管疾病或状况的方法。此方法包括对有此需要的受试者施用有效量的上文所述抗体或其抗原结合部分。疾病或状况的实例包括水肿腹水(edemaascites)、胸水(hydrothorax)、心包积液(hydropericardium)、大脑/脑水肿、脑积水(hydrocephalus)、青光眼、急性肺水肿、视网膜病变、黄斑病变(maculopathy)、中风,缺血性视网膜病变、阿尔茨海默氏病,多发性硬化、创伤、炎症和cns肿瘤。在一个实例中,视网膜病变是糖尿病性视网膜病变。另一方面,黄斑病变是湿性年龄相关性黄斑变性(wetage-relatedmaculardegeneration)(amd)。另一方面,本发明提供了非人转基因动物,其基因组包含编码异源pdgf-c蛋白的异源血小板衍生的生长因子c(pdgf-c)基因。异源pdgf-c蛋白可以与人pdgf-c蛋白(seqidno:1)至少75%(例如,80%,85%,90%,95%,96%,97%,98%,99%和100%)相同。转基因动物可以是小鼠、大鼠或兔。在一个实例中,动物是小鼠。在那种情况下,异源pdgf-c蛋白可以是人源化小鼠pdgf-c蛋白。人源化小鼠pdgf-c蛋白可以是蛋白质,可以与小鼠pdgf-c蛋白(seqidno:104)至少75%(例如,80%,85%,90%,95%,96%,97%,98%,99%和100%)相同。它可以包含对小鼠pdgf-c蛋白的一种或多种以下突变:k242t,k246r,r299s,k318r,n342s和a343t。例如,人源化小鼠pdgf-c蛋白可以包含seqidno:103的序列。本领域技术人员将容易理解,前述内容不必然限制本发明,并且基于本文提供的公开内容可容易地获得本发明的另外的实施方案和优点。为了帮助理解本发明,提供了以下非限制性定义:如本文所用,术语“同源性”可以指两种组成之间共有结构的存在。在蛋白质的背景中,术语“同源性”可以指两个或更多个氨基酸和/或肽序列之间重叠的量(例如以百分比表示)。在核酸的背景中,该术语可以指两个或更多个核酸序列之间重叠的量(例如以百分比表示)。如本文所用,两个序列之间的百分比(%)同源性等同于两个序列之间的百分比同一性。两个序列之间的百分比同一性是序列共有的相同位置的数目的函数(即,%同源性=相同位置的数目/位置总数x100),考虑到缺口的数目和每个缺口的长度,其需要引入以得到两个序列的最佳比对。可以使用数学算法完成序列的比较和两个序列之间的同一性百分比的确定。此类同源性经由局部比对工具和/或算法在本领域中充分呈现,并且可以包括成对比对、多序列比对方法、结构比对方法和/或系统发育分析方法。例如,可以使用karlinandaltschulproc.natl.acad.sci.usa87:2264-68,1990(如karlinandaltschulproc.natl.acad.sci.usa90:5873-77,1993中修改)的算法确定两个氨基酸序列或两个核酸的百分比同一性。此类算法并入altschul,etal.j.mol.biol.215:403-10,1990的nblast和xblast程序(2.0版)中。可以用nblast程序,得分=100,字长-12进行blast核苷酸搜索,以获得与本发明的核酸分子同源的核苷酸序列。可以用xblast程序,得分=50,字长=3进行blast蛋白质搜索,以获得与本发明的蛋白质分子同源的氨基酸序列。当两个序列之间存在缺口的情况下,可以如altschuletal.,nucleicacidsres.25(17):3389-3402,1997中所述使用gappedblast。当使用blast和gappedblast程序时,可以使用相应程序(例如,xblast和nblast)的默认参数。如本文所用,“基本上同源”指在很大程度上但是非完全同源,并且与其同源的序列保留大部分或全部活性的序列。具体地,“基本上同源”指在与参考序列至少70%相同,优选至少75%,80%,90%,95%,96%,97%,98%,99%同源性的序列。如本文所用,异源多肽、核酸或基因是源自外来物种的,或者若来自相同物种,则基本上从其原始形式修饰的。若两个融合域或序列在天然存在的蛋白质或核酸中彼此不相邻,则它们彼此是异源的。转基因指核酸序列(编码例如一种或多种主题多肽),其对于接受其导入的受试者或细胞是部分或完全异源的,或者与接受其导入,但是意图以改变基因组(例如,它在天然基因的位置不同的位置处插入或其插入导致敲除)的方式插入受试者的基因组中的受试者或细胞的内源基因同源。转基因可以包括一个或多个可操作连接的转录调节序列(例如,增强子序列)和任何其他核酸,例如内含子,其可以是感兴趣核酸的最佳表达所必需的。转基因细胞是含有转基因的细胞。转基因动物是其中动物的一种或多种或所有细胞包含转基因的任何动物。可以通过依靠本领域已知的有意遗传操作来导入前体细胞中而将转基因引入细胞中。转基因可以整合在染色体内,或者它可以是染色体外复制的dna。如本文所用,术语“表位”指b和/或t细胞响应的抗原上的位点或分子上产生的抗体针对的和/或与抗体结合的位点。例如,表位可以被限定表位的抗体识别。表位可以是“线性表位”(在一级氨基酸的情况下,一级序列包含表位;通常独特序列中的至少3个连续氨基酸残基,更通常至少5个,最多约8至约10个氨基酸)或“构象表位”(如下的表位,其中连续的一级氨基酸序列不是表位的唯一限定组分)。构象表位相对于线性表位可以包含增加数目的氨基酸,因为此构象表位识别肽或蛋白质的三维结构。例如,当蛋白质分子折叠形成三维结构时,形成构象表位的某些氨基酸和/或多肽主链变得并置,使得抗体能够识别表位。确定表位构象的方法包括但不限于例如x射线晶体学、二维核磁共振光谱术和定点自旋标记和电子顺磁共振光谱术。参见例如epitopemappingprotocolsinmethodsinmolecularbiology,第66卷,glenne.morris编(1996),其公开内容通过引用整体并入本文。如本文所用,术语“分离的”如其在本领域内使用,即其中发现抗体/特异性结合成员,核酸分子等的状态。抗体/特异性结合成员和核酸分子将不含或基本上不含与它们天然相关的物质,例如在其天然环境或当通过重组dna技术(体外实施)或体内进行制备时它们制备的环境(例如细胞培养物)中与它们一起发现的其他多肽或核酸。“分离的”涵盖从该初始环境中取出后含有本发明的鉴定和表征的组分的任何形式。实例但明确非限制性包括药物配制剂、具有稀释剂的配制剂、抗体/特异性结合成员、核酸分子及其部分,其已经在体外或体内修饰(例如,抗体糖基化)并从该环境中取出。术语“受试者”或“患者”意在包括脊索动物(chordata)门的任何成员,包括但不限于人和其他灵长类,包括非人类灵长类,例如黑猩猩和其他猿和猴物种;农场动物,如牛、棉羊、猪、山羊和马;家养的哺乳动物,如狗和猫;实验动物包括啮齿类如小鼠、大鼠和豚鼠;禽类,包括家禽、野生禽类和游戏禽类,如鸡、火鸡和其他鹑鸡类禽类、鸭、鹅等。术语疾病“治疗”或“处理”指执行方案,其可以包括对受试者(人或其他)施用一种或多种药物,以努力减轻疾病的体征或症状。缓解可以在疾病的体征或症状出现之前以及在其出现之后发生。因此,“治疗”或“处理”包括“预防”疾病。另外,“治疗”或“处理”不需要完全缓解体征或症状,不需要治愈,并且特别包括对受试者仅具有边际积极效应的方案。如本文所用,如本文中提供的术语抗体“有效量”或“药学有效量”指无毒但足够量的活性成分,以提供期望的生物学结果。在任何个别情况下,适当的“有效”量可以由本领域普通技术人员使用常规实验确定。如本文所用,术语“药学可接受”或“药理学可接受”指材料可以与配制的生物剂一起在药物递送装置中对个体施用,而不引起任何不期望的生物学效应或以有害的方式与任何包含它的组合物(例如,“药学可接受组合物”)的组分相互作用。如本文所用,可互换使用的短语“生理学可接受的载体”和“药学可接受载体”是指不对生物体造成重大刺激并且不消除施用的化合物的生物活性和性质的载体、稀释剂和赋形剂。这些短语下包括佐剂。如本文所用,术语“赋形剂”指添加到药物组合物以进一步促进活性成分施用的惰性物质。附图简述图1显示了对重组人pdgf-dd蛋白(上图)、pdgf-cc蛋白(中图)和组氨酸多肽(下图)的结合活性的pdgf-cc单克隆抗体的杂交瘤上清液。图2显示了鉴定的四种单抗6b3、11f5、12f5和19c7的结合特异性,其中图2a显示了抗体仅与人pdgf-cc反应,并且图2b显示12f5但非6b3识别小鼠pdgf-c核心蛋白,这两种抗体都识别rhpcc。图3提供了抗体6b3、11f5、12f5和19c7的完整可变轻链氨基酸序列(seqidno:4-7)的比对,其中cdr加下划线。图4提供了完整的可变重链氨基酸序列(seqidno:10-13)6b3、11f5、12f5和19c7的比对,其中cdr加下划线。图5提供了与鼠抗体(mu6b3)相比ch6b3的完整可变重链和轻链氨基酸序列的比对。图6显示了对在存在不同浓度(44.6-267.6μm)的a)肽1(dvalehheecdc,seqidno:100);b)肽2(llteevr,seqidno:101);c)肽3(svsireelkrtdtifwpgc,seqidno:3)和d)肽4(vtkkyhevl,seqidno:102)的情况下6b3抗体(333nm)对固定化重组pdgf-cc核心蛋白的结合观察到的最大biacore响应的生物传感器分析。仅在仅存在肽3的情况下观察到6b3与pdgf-cc的结合减少,提示特异性抑制。图7a显示了来自抗体6b3(浓度范围20.8nm-667nm)与固定化的pdgfc肽(svsireelkc,rtdtifwpgc和eelkrtdtifc,seqidno:105-107)的结合(图7a)和抗体6b3(1.334μm)与固定化pdgf-c肽表位svsireelkc(seqidno:105)和与pdgf-c肽相差一个氨基酸的相应的pdgf-d肽svnireelkc(seqidno:108)结合(图7b)的生物传感器分析的传感图。合成了肽,具有c末端半胱氨酸以使用硫醇固定化在传感器芯片上实现限定的取向。图8显示了pdgf-c氨基酸序列(seqidno:2)的残基231至345,突出显示了6b3表位序列,并指出了与pdgf-d的同源性。图9提供了抗体6b3、11f5、12f5和19c7与pdgf-cc而非pdgf-dd结合的特异性的生物传感器分析的图示。图10显示了鼠6b3(10a)和嵌合6b3(10b)的代表性结合曲线,其拟合到1:1langmuir结合模型。图11显示了对pdgf-cc活性的抑制,其中图11a提供了sds-page凝胶和免疫印迹分析,显示了对pae-pdgfrα磷酸化的抑制作用,并且图11b提供了sds-page凝胶和免疫印迹分析,显示了对pdgf-cc诱导的pae-pdgfrα磷酸化的抑制。pb:pdgfrα的pdgf-bb活化的阳性对照;对照:全长pdgf-c的阴性对照。rhpc:重组人pdgf-cc核心域。图12a和b证明6b3以剂量依赖性方式抑制pdgf-cc诱导的paeα细胞增殖。图13显示了正常人组织中的免疫组织化学6b3染色模式,以200倍放大。图14显示了人肿瘤组织中的免疫组织化学6b3染色模式,以200倍放大。图15显示了用300μg抗pdgf-c12f5或6b3一周处理三次达3周(15a)和以300μg和1mg剂量每周三次用6b3疗法处理4周的更长时段(15b)的小鼠中的结肠癌异种移植物的结果。图16显示了在colo205异种移植物切片的足糖萼蛋白(podocalyxin)染色的情况下对血管的免疫组织化学分析,其中图a显示血管数目的变化,图b显示每单位面积的血管数目的变化,图c显示血管周长的变化,并且图d显示细胞增殖的变化。图17a-b显示了抗pdgf-cc处理通过减少的血管生成减少原位肿瘤生长。图18a和18b显示了证明通过抗pdgf-c抗体调节pdgf-cc介导的血脑屏障开放的结果。图18a是一组照片,显示了在鞘内注射pdgf-cc和腹膜内注射抗pdgf-c抗体6b3或对照抗体bm4后小鼠脑中伊文思蓝(evansblue)的外渗。图18b是显示相同结果的图。图19提供了小鼠和人pdgf-cc的生长因子域的氨基酸序列(seqidno:108和109)的比较。红色箭头指示那些被改变以产生部分人源化pdgf-cc小鼠品系的氨基酸。图20显示了部分人源化的小鼠pdgf-c蛋白的氨基酸序列(残基1-345,seqidno:103)。生长因子域中的六个氨基酸替换(氨基酸残基229-345)标有下划线。氨基酸替换是242k至242t、246k至246r、299r至299s、318k至318r、342n至342s、和343a至343t。图21显示了用于产生中风的人源化小鼠模型的靶向载体。图22显示了pdgf-cc小鼠基因组基因座,用于产生中风的人源化小鼠模型的靶向载体,同源重组后的靶向的pdgf-cc等位基因,以及flp重组后的人源化pgcf-cc等位基因。图23显示了在mcao(预防性处理)前的6b3处理对每搏输出量(图23a)和出血评分(图23b)的影响。图24显示了mcao(治疗性处理)后的6b3处理对每搏输出量(图24a)和出血评分(图24b)的影响。图25提供了与鼠抗体(mu6b3)相比hu6b3的完整可变轻链蛋白序列的比对,其中cdr加下划线。图26a提供了与鼠抗体(mu6b3,seqidno:15)相比hu6b3hcr的完整可变重链蛋白序列(seqidno:14)的比对,其中cdr加下划线。hu6b3“r”形式表明对pdgf-cc的优异结合特性,并被选择作为人源化抗体的最终序列。图26b提供了与鼠抗体(mu6b3,seqidno:15)相比较的hu6b3hcg(seqidno:110)的完整可变重链蛋白序列的比对,其中cdr加下划线。图27通过elisa分析(图27a)和western印迹法(图27b)显示了,在嵌合化和人源化后保留鼠6b3抗pdgf-cc抗体的特异性和功能。图27a:嵌合6b3(ch6b3)和人源化抗体hu6b3g和hu6b3r形式保留亲本鼠抗pdgf-cc单克隆抗体6b3对pdgf-cc的特异性。仅对照抗pdgf-dd抗体12c2结合密切相关的pdgf家族成员pdgf-dd。图27b:在有或没有事先用纯化的抗体(5μg/ml)温育细胞的情况下,用50ng/mlpdgf-cc核心蛋白刺激pae细胞。用抗磷酸酪氨酸抗体py99检测活化的受体。结果证明人源化6b3g和r变体与亲本鼠mab6b3一样有效地中和pdgf-c。抗pdgf-cc单克隆抗体12f5而非对照12c2也是中和性的。图28显示了来自对固定化的pdgf-cc与增加浓度的hu6b3抗体变体a)重链g30r和b)重链r30之间的相互作用的生物传感器分析的传感图。发明详述在本文中证明pdgf-c是许多现有癌的分子标志,并且已经与血管生成和肿瘤生长的诱导途径相关联,并且作为控制cns的血脑屏障的生理特性的因素。pdgf-c表达还与其他疾病状态如动脉粥样硬化和纤维化相关。因此,它提供了用于研究表达pdgf-c的细胞的可行靶标,或者替代地,用于治疗诊断患有相关细胞类型表现出pdgf-c表达/分泌的疾病或状况的患者的方法的可行靶标。在某些方面,本发明涉及与血小板衍生的生长因子c(pdgf-c)的一个或多个表位特异性相互作用并显示可测量的亲和力的分离的抗体,本文为“抗-pdgf-c抗体”。此类抗体可以用于调节细胞中或从细胞分泌的pdgf-cc活性以研究其对细胞功能的影响,并且在某些实施方案中,用于治疗与pdgf-c表达增加或pdgf-cc活性增加相关的疾病或状况。在某些实施方案中,抗pdgf-c抗体可以施用于受试者以治疗或预防肿瘤细胞生长和转移和/或用于预防血管生成和肿瘤生长,以及施用于受试者以治疗cns损伤或cns疾病。在某些方面,它指蛋白质的人形式,其具有以下氨基酸序列:mslfglllvtsalagqrrgtqaesnlsskfqfssnkeqngvqdpqheriitvstngsihsprfphtyprntvlvwrlvaveenvwiqltfderfgledpeddickydfveveepsdgtilgrwcgsgtvpgkqiskgnqirirfvsdeyfpsepgfcihynivmpqfteavspsvlppsalpldllnnaitafstledliryleperwqldledlyrptwqllgkafvfgrksrvvdlnllteevrlysctprnfsvsireelkrtdtifwpgcllvkrcggncacclhncnecqcvpskvtkkyhevlqlrpktgvrglhksltdvalehheecdcvcrgstggseqidno:1.然而,本发明不限于这种形式,并且可包括任何天然或合成的变体,其在靶定的细胞中表现出pdgf-c和pdgf-cc的特性,这些特性在本文中讨论或本领域已知。抗pdgf-c抗体的靶向表位包括pdgf-c的任何一种或多种肽序列,本发明的一种或多种抗体将以可测量的亲和力与之结合。此类序列可以包括蛋白质的活性或非活性区域,并包括如本文所定义的线性表位和/或构象表位。在某些方面,它们包括一个或多个区域,其中抗体的结合导致宿主细胞中pdgf-cc活性的可测量的降低。为此,在某些方面,表位位于蛋白质的位置,其中抗体的结合改变蛋白质活性,例如活性位点阻断、空间位阻、变构抑制等。此类结合位点可以包括但不限于pdgf-cc核心活性域内的一个或多个表位,其在以seqidno.:2提供的全长序列的残基231-345(下面加下划线)处提供。在另一个实施方案中,表位包括氨基酸序列svsireelkrtdtifwpgc(seqidno:3)或(或其内的氨基酸序列)。本发明的表位不限于seqidno:1-3内的确切序列,并且可以包括具有至少70%同源性,80%同源性,90%同源性或99%同源性的任何序列。本发明的抗pdgf-c抗体包括两条相同的重链和两条轻链,其含有一个或多个本文中鉴定的抗原结合域。轻链包括一个可变域(vl)和一个恒定域(cl)。重链还包括一个可变域(vh),并且根据抗体的类别或同种型,三个或四个恒定域(ch1、ch2、ch3和ch4)。同种型包括但不限于iga、igd、ige、igg、和igm,iga和igg进一步细分为亚类或亚型。在某些非限制性发明中,本发明的同种型是igg,其包括其亚型中的一种或组合(例如igg1、igg2、igg3和igg4)。根据应用,某些同种型或同种型衍生物可以优先用于本发明所考虑的抗体。在本发明的一些实施方案中,抗体具有同种型,其导致显著的补体依赖性细胞毒性(cdc)和/或效应器介导的抗体依赖性细胞毒性(adcc)的杀伤。此类效应器功能包括但不限于补体的第一组分(c1)、fcγ受体i(fcγri,也称为cd64))、fcγrii(也称为cd32)或fcγriiia/b(也称为cd16)的活化。对于igg同种型,效应器功能水平按igg3≥igg1≥igg2≥igg4的顺序降低。因此,具有显著效应器功能和/或激活补体的能力的同种型如igg3和igg1特别适用于所考虑的抗体的肿瘤学应用,例如治疗或预防肿瘤细胞生长、存活力或转移,以及预防血管生成。在本发明的另一个实施方案中,抗体具有被认为相对无活性的同种型,例如,其表现出降低的效应器功能或没有效应器功能。此类同种型的非限制性实例包括igg2、igg4或已经突变以降低其效应器功能的其他同种型。例如,已经证明人igg1和igg2残基233-236和位置327、330和331处igg4残基的取代显著降低cdc和adcc(参见armourkl,clarkmr,hadleyag,williamsonlm.recombinanthumaniggmoleculeslackingfcgammareceptoribindingandmonocytetriggeringactivities.eurjimmunol.1999aug;29(8):2613-24和shieldsrl,namenukak,hongk,mengyg,raej,briggsj,xied,laij,stadlena,lib,foxja,prestalg.highresolutionmappingofthebindingsiteonhumanigg1forfcgammari,fcgammarii,fcgammariii,andfcrnanddesignofigg1variantswithimprovedbindingtothefcgammar.jbiolchem.2001mar2;276(9):6591-604))。具有降低的效应器功能的同种型对于为了治疗与cns的受损bbb相关的病症或状况而施用的抗体特别有用。通常将配对的重链恒定域理解为限定抗体的fc区。基于其序列,它为抗体提供上文讨论的一种或多种同种型。fc区与fc受体结合、补体介导的细胞毒性的激活和抗体依赖性细胞性细胞毒性相关。为此,它至少部分负责引发免疫反应性。抗体的vl和vh域通常定义为“fv”区并构成抗原结合位点。单链fv(scfv)包括在一条多肽链上含有vl域和vh域的蛋白质,其中一个域的n端和另一个域的c端通过柔性接头连接。“fab”区指抗体中包括vl-cl(即轻链)和vh-ch的部分(也称为“fd”)。存在于抗体fv区的每个vl和vh域内的是8个框架区(fr)和6个总共互补决定区(cdr)。在每个vl链和vh链中发现4个fr和3个cdr。4个fr区(fr1、fr2、fr3和fr4)是相对保守的,而cdr区(cdr1、cdr2和cdr3)代表抗体中主要负责识别和结合靶向表位序列的高变部分。通常,fr和cdr区如下从抗体的nh2末端排列到cooh末端:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在某些方面,本发明的抗pdgf-c抗体包括如本文所定义的分离的单克隆抗体6b3、11f5、12f5和19c7,以及产生此类抗体的杂交瘤。本发明的抗体还包括单克隆抗体6b3、11f5、12f5和19c7的变体,即具有来自抗体6b3、11f5、12f5和19c7的肽序列中的一种或组合的抗体。此类变体的两个非限制性实例是嵌合抗体ch6b3和人源化抗体hu6b3,其具有与6b3mab基本上同源的cdr序列。下表1和2分别提供了抗体6b3、11f5、12f5、19c7、ch6b3和hu6b3的可变轻链和可变重链的氨基酸序列:表1表2下表3和4分别提供了抗体6b3、11f5、12f5、19c7、ch6b3和hu6b3的可变轻链cdr和可变重链cdr的氨基酸序列:表3表4本发明的抗pdgf-c抗体可以完全包括前述可变轻链、可变重链和/或cdr肽序列或者可以与前述序列之一充分同源或基本相同,以便表现出对pdgf-c蛋白的可测量的结合亲和力,包括对本文鉴定的一个或多个表位的结合亲和力。基本上相同的氨基酸序列或充分同源的在本文中定义为与比较的氨基酸序列具有至少70%,至少约80%,至少约90%,至少约95%或至少约99%同源性或同一性的序列,如通过根据pearsonandlipman,proc.natl.acad.sci.usa85:2444-2448(1988)(其内容通过引用并入本文)的fasta检索方法确定。本发明的抗pdgf-c抗体可以作为以可测量的亲和力与靶向的抗原或表位结合的天然存在的抗体、二价片段如(fab’)2、单价片段如fab、单链抗体、单链fv(scfv)、单域抗体、多价单链抗体、双抗体、三抗体等提供。也包括在本发明内的是编码上述氨基酸序列(或其片段)的分离的核酸分子,所述氨基酸序列可以包含6b3、11f5、12f5、19c7或ch6b3或hu6b3抗体的vh和/或vl区和/或cdr。6b3、11f5、12f5、19c7、ch6b3和hu6b3的可变轻链和重链dna序列如下在表5和6中,每个的cdr区域加下划线。表5表66b3、11f5、12f5、19c7、ch6b3和hu6b3的可变轻链和重链cdr序列的dna序列如下在表7和8中:表7表8分离的核酸分子(多核苷酸)编码6b3、11f5、12f5、19c7、ch6b3、hu6b3或6b3、11f5、12f5、19c7、ch6b3、hu6b3的亲和力成熟形式或其它方面突变形式,或本文中讨论的其他抗pdgf-c抗体的生物学相关部分。为此,分离的核酸分子可以包括一种或多种前述dna序列、一种或多种前述序列的片段、或与一种或多种前述物质至少70%同源、80%同源、90%同源或99%同源的核酸序列。变体抗体也包括在本发明的范围内。因此,本申请中列举的序列的变体也包括在本发明的范围内。可以使用本领域已知的方法获得具有改善的亲和力的抗体序列的其他变体,并且包括在本发明的范围内。例如,氨基酸取代可以用于获得具有进一步改善的亲和力的抗体。或者,核苷酸序列的密码子优化可以用于改善产生抗体的表达系统中的翻译效率。在某些实施方案中,本发明的抗体含有包含cdr1、cdr2和cdr3序列重链可变区和包含cdr1、cdr2和cdr3序列的轻链可变区,其中这些cdr序列中的一个或多个包含基于本文中所述的优选抗体的规定氨基酸序列或其保守修饰,并且其中抗体保留与pdgf-c和/或pdgf-cc结合的期望功能特性。本发明中公开的肽、多肽或蛋白质的保守修饰或功能等同物指肽、多肽或蛋白质的多肽衍生物,例如具有一个或多个点突变、插入、缺失、截短的蛋白质、融合蛋白或其组合。它基本上保留亲本肽、多肽或蛋白质(例如本发明中公开的那些)的活性。通常,保守修饰或功能等同物与亲本(例如,本文中公开的序列之一)是至少70%(例如,在70%和100%之间的任何数字,包括端点,例如70%,80%,85%,90%,95%和99%)相同的。如本文所用,术语“保守修饰”指不显著影响或改变含有氨基酸序列的抗体的结合特征的氨基酸修饰。此类保守修饰包括氨基酸取代、添加和缺失。可以通过本领域已知的标准技术,例如定点诱变和pcr介导的诱变将修饰引入本发明的抗体中。保守氨基酸取代是其中氨基酸残基用具有相似侧链的氨基酸残基取代的氨基酸取代。本领域已经定义了具有相似侧链的氨基酸残基家族。这些家庭包括:具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸),酸性侧链(例如天冬氨酸、谷氨酸),不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸),非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸),β-支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,本发明抗体的cdr区内的一个或多个氨基酸残基可以用来自相同侧链家族的其他氨基酸残基替换,并且可以使用本文所述的功能测定法测试改变的抗体的保留功能。本文考虑了抗体的其他修饰。例如,抗体可以与多种非蛋白质性聚合物之一连接,例如聚乙二醇、聚丙二醇、聚氧化烯(polyoxyalkylene)、或聚乙二醇和聚丙二醇的共聚物。抗体也可以包埋在例如通过凝聚技术或通过界面聚合制备的微胶囊(例如,分别为羟甲基纤维素或明胶-微胶囊和聚(甲基丙烯酸甲酯)微胶囊)中,在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊),或粗乳液中。此类技术公开在例如remington'spharmaceuticalsciences,第16版,oslo,a.编,(1980)中。本发明的核酸可以基本上不含其他核酸。对于大多数克隆目的,dna是优选但非限制性的核酸。可以将上述dna分子中的一种或组合亚克隆到表达载体中,随后转染到选择的宿主细胞中,其中重组宿主细胞提供相当高水平的本发明的6b3,11f5,12f5,19c7,ch6b3,hu6b3或抗pdgf-c抗体,或其亲和力成熟形式的相关部分的来源。此类方法可以用于多种效用,例如产生scfv或在编码例如igg抗体的人ch和cl区的哺乳动物表达载体系统中共表达那些vh和vl链。遗传密码的简并性使得对于除了两个氨基酸以外的所有氨基酸,超过单一密码子编码特定的氨基酸。这允许构建编码本发明抗体的合成dna,其中合成dna的核苷酸序列与本文公开的核苷酸序列显著不同,但仍然编码此类抗体。此类合成dna意图在本发明的范围内。若期望在特定的宿主细胞或生物体中表达此类合成dna,则可以调整此类合成dna的密码子选择以反映该特定宿主的密码子选择,从而导致本发明抗体的更高的表达水平。换言之,编码特定氨基酸的各种密码子中的此种冗余性在本发明的范围内。因此,本发明还涉及编码包含备选密码子的rna的那些dna序列,所述密码子编码相同氨基酸的最终翻译,如下所示:a=ala=丙氨酸:密码子gca,gcc,gcg,gcu;c=cys=半胱氨酸:密码子ugc,ugu;d=asp=天冬氨酸:密码子gac,gaue=glu=谷氨酸:密码子gaa,gag;f=phe=苯丙氨酸:密码子uuc,uuu;g=gly=甘氨酸:密码子gga,ggc,ggg,ggu;h=his=组氨酸:密码子cac,cau;i=ile=异亮氨酸:密码子aua,auc;auu;k=lys-赖氨酸:密码子aaa,aag;l=leu=亮氨酸:密码子uua,uug,cua,cuc,cug,cuu;m=met=甲硫氨酸:密码子aug;n=asp=天冬酰胺:密码子gau,gac;p=pro=脯氨酸:密码子cca,ccc,ccg,ccu;q=gln=谷氨酰胺:密码子caa,cag;r=arg=精氨酸:密码子aga,agg,cga,cgc,cgg,cgu;s=ser=丝氨酸:密码子agc,agu,uca,ucc,ucg,ucu;t=thr=苏氨酸:密码子aca,acc,acg,acu;v=val=缬氨酸:密码子gua,guc,gug,guu;w=trp=色氨酸:密码子ugg;y=tyr=酪氨酸:密码子uac,uau。然后,可以将此类重组表达载体稳定或瞬时转染到合适的细胞系中,以产生替代抗体形式。本发明注意到密码子冗余性的存在,所述密码子冗余性可以导致表达相同抗体或其部分的不同dna分子(例如,编码相同scfv或igg的vh和/或vl部分的替代核酸分子)。出于本说明书的目的,带有一个或多个被取代的密码子的序列将定义为简并变异。序列变异的另一个来源可以通过rna编辑发生。此类rna编辑可以导致另一种形式的密码子冗余性,其中可读框的变化不导致表达蛋白质中改变的氨基酸残基。还包括在本发明范围内的是dna序列或翻译抗体中的突变,其改善表达抗体的最终物理性质。为此,本发明涉及(i)抗pdgf-c抗体的亲和力成熟形式,包括但不限于6b3、11f5、12f5、19c7、ch6b3或hu6b3,和/或(ii)抗pdgf-c抗体的突变形式,包括但不限于6b3、11f5、12f5、19c7、ch6b3或hu6b3,包括但不限于cdr1、cdr2和/或cdr3区域中的一个或多个突变,如通过已知的亲和力成熟方法和已知用于引入位点特异性突变的重组dna技术产生。此类分离的或纯化的核酸分子将代表抗pdgf-c抗体的vh和/或vl部分。这些核酸基本上不含其他核酸,并且可以根据前述内容进行克隆。本发明还涉及重组载体和重组宿主(原核和真核两者),其含有编码抗pdgf-c抗体的相应重链和/或轻链区(或其片段)的核酸分子。这些核酸分子全部或部分可以与非天然连接的其他dna分子(即涵盖用于产生重组人抗体的免疫球蛋白基因的dna分子)连接,以形成“重组dna分子”,其编码相应的人重组抗体。这些载体可以由dna或rna构成。对于大多数克隆目的,dna载体是优选的。典型的载体包括质粒、经修饰的病毒、噬菌体、粘粒、酵母人工染色体和附加型或整合型dna的其他形式。确定用于特定基因转移、重组人抗体的产生或其他用途的合适载体在熟练技术人员的能力范围内。公知的是将感兴趣的核酸分子亚克隆到表达载体中,转化或转染含有载体的宿主细胞的方法,以及制备基本上纯的蛋白质的方法,包括如下的步骤:将相应的表达载体导入宿主细胞中,以及在适当条件下培养宿主细胞。如此产生的抗体(例如igg重组人抗体)可以以常规方式从宿主细胞中收获。可以利用任何已知的表达载体来实施本发明的这一部分,包括含有合适启动子和其他合适的转录调节元件的任何载体。将得到的表达构建体转移到原核或真核宿主细胞中以产生重组蛋白。表达载体在本文中定义为克隆dna的转录和它们的rnrna在合适宿主中的翻译所需要的dna序列。此类载体可以用于在多种宿主,例如细菌、蓝绿藻(bluegreenalgae)、植物细胞、昆虫细胞和动物细胞中表达真核dna。专门设计的载体允许在诸如细菌-酵母或细菌-动物细胞的宿主之间穿梭dna。适当构建的表达载体应当包含:用于宿主细胞中自主复制的复制起点、选择标志物、有限数目的有用限制酶位点、高拷贝数的潜力和活性启动子。启动子定义为指导rna聚合酶与dna结合并启动rna合成的dna序列。强启动子是导致rnrna以高频率启动的启动子。可以找到此类操作的技术,记载于sambrook,etal.(1989,molecularcloning.alaboratorymanual;coldspringharborlaboratory,coldspringharbor,newyork),是本领域普通技术人员公知且可用的。表达载体可以包括但不限于克隆载体、经修饰的克隆载体,特别设计的质粒或病毒。可能合适的商品化哺乳动物表达载体包括但不限于pcdna3.neo(invitrogen),pcdna3.1(invitrogen),pci-neo(promega),plitmus28,plitmus29,plitmus38和plitmus39(newenglandbioloabs),pcdnai,pcdnaianp(invitrogen),pcdna3(invitrogen),pmclneo(stratagene),pxt1(stratagene),psg5(stratagene),ebopsv2-neo(atcc37593)pbpv-1(8-2)(atcc37110),pdbpv-mmtneo(342-12)(atcc37224),prsvgpt(atcc37199),prsvneo(atcc37198),psv2-dhfr(atcc37146),puctag(atcc37460)和lzd35(atcc37565)。还有,可获得多种细菌表达载体,包括但不限于pcr2.1(invitrogen),pet1la(novagen),lambdagtl1(invitrogen)和pkk223-3(pharmacia)。另外,可以使用多种真菌细胞表达载体,包括但不限于pyes2(invitrogen)和pichie表达载体(invitrogen)。此外,可以使用多种昆虫细胞表达载体,包括但不限于pbluebaciii和pbluebachis2(invitrogen)和pacg2t(pharmingen)。重组宿主细胞可以是原核或真核的,包括但不限于细菌如大肠杆菌,真菌细胞如酵母,哺乳动物细胞包括但不限于牛、猪、猴和啮齿类来源的细胞系;和昆虫细胞。可能合适的哺乳动物物种包括但不限于l细胞l-m(tk-)(atccccl1.3),l细胞l-m(atccccl1.2),saos-2(atcchtb-85),293(atcccrl1573),raji(atccccl86),cv-1(atccccl70),cos-l(atcccrl1650),cos-7(atcccrl1651),cho-k1(atccccl61),3t3(atccccl92),nih/3t3(atcccrl1658),hela(atccccl2),c127i(atcccrl1616),bs-c-l(atccccl26),mrc-5(atccccl171)和cpae(atccccl209)。还可以调整或特别工程化改造本发明的抗体以形成前述抗体的变体,包括但不限于多克隆、替代单克隆、嵌合和/或人源化抗体。本发明的分离的或变体的抗体可以包括单可变域(svd)和包含svd的抗原结合蛋白。svd结合位点可以从抗原特异性fv区(其包含vh和vl域)获得。通常,可以显示fv区的结合亲和力和特异性主要由可变域之一贡献。或者,可以直接获得scfv。svd的直接来源包括天然表达仅含有vh域的抗体的哺乳动物(例如骆驼科(camelids))。此外,可以构建噬菌体展示文库以仅表达单可变域。例如,人域抗体噬菌体展示文库可购自domantis(cambridge,uk)。嵌合抗体如ch6b3通常可以包含一种抗体的可变域和不同抗体的恒定域。通常,为了最小化针对抗体的宿主免疫应答并通过保留抗体效应器功能来增强针对抗体靶标的宿主应答,嵌合抗体的恒定域取自将要施用嵌合抗体的相同物种。人源化抗体如hu6b3是嵌合蛋白的一种形式,其构建为使得可变域包含一个或多个移植到人框架区的非人起源的互补决定区(cdr)。为此,在某些实施方案中,可以通过本领域公知的重组dna技术和非人转基因学的各种手段产生。此类方法用于从一种或以下来源产生抗体:(i)从组合人抗体文库中分离的scfv或备选抗体;(ii)从稳定或瞬时转染到宿主细胞,优选哺乳动物宿主细胞中的相应表达载体产生的部分或完全抗体(例如,将编码vh和vl链的核苷酸序列与相应的ch和cl核苷酸序列一起亚克隆到表达载体中,以促进显示对pdgf-cc的特异性的抗体的预定形式的表达);和/或(iii)从含有人免疫球蛋白基因的非人转基因动物中,或通过任何其他已知的方法分离的抗体,所述方法依赖于人免疫球蛋白基因序列与其他dna序列的重组“混合和匹配”,以便产生感兴趣的人重组抗体。人源化构建体对于消除不利的免疫原性特征是有价值的,例如,其中来自非人来源的抗原结合域期望用于人的治疗。可变域具有高度的结构同源性,允许容易地鉴定可变域内对应于cdr和fr的氨基酸残基。已经开发了保持或增强对此类变体抗体的亲和力的方法,特别是但不限于嵌合和/或人源化形式。一种方式是在接受可变域中包括影响cdr区构象的外源框架残基。第二种方式是将外源cdr移植到与外来可变区具有最接近的同源性的人可变域上。通过如下将cdr最容易地移植到不同的框架区上:首先使用包括期望cdr序列的重叠引物扩增个别的fr序列,并在随后的扩增反应中连接所得的基因区段。将cdr移植到不同的可变域上可以进一步涉及氨基酸残基的取代,所述氨基酸残基在氨基酸序列中与cdr相邻或者在折叠的可变域结构中相对于cdr包装,它们影响cdr的构象。因此,本发明的人源化可变域包括人域,其包含一个或多个非人cdr以及其中已经进行另外的取代或替换以保持或增强结合特征的此类域。本发明的抗体还可以使用通过替换表面暴露的残基而变为较低免疫原性的可变域,从而使抗体看起来对免疫系统是自身的。通过此过程修饰抗体而不丧失亲和力。因为抗原结合位点附近的氨基酸残基的内部堆积保持不变,所以保持亲和力。为了降低的免疫原性,根据本发明的表面暴露的残基的取代并不意味着取代影响结合特征的cdr残基或相邻残基。在任何前述实施方案中,可以对掺入抗体中的可变区、cdr和恒定区进行体外或体内突变和筛选程序,以便修饰亲和力和/或特异性。因此,本发明的结合域包括通过直接突变、亲和力成熟方法或链改组使cdr和/或fr区突变而改善结合特征的结合域。应当理解,作为单域抗体结合的主要决定因素的氨基酸残基可以在kabat定义的cdr内,但也可以包括其他残基。对于svd,对抗原结合重要的残基也潜在包括在其它情况下将位于vh-vl异二聚体的界面处的氨基酸。通常,噬菌体展示用于筛选此类突变体以鉴定具有期望结合特征的突变体(参见例如yangetal.,j.mol.biol.,254:392-403(1995))。突变可以以多种方式进行。一种方法是使个别残基或残基组合随机化,使得在其他方面相同序列的群体中,在特定位置处发现所有20种氨基酸或其子集。或者,可以通过易错pcr方法在一批cdr残基上诱导突变(参见例如hawkinsetal.,j.mol.biol.,226:889-896(1992))。例如,含有重链和轻链可变区基因的噬菌体展示载体可以在大肠杆菌的增变菌株中繁殖(参见例如lowetal.,j.mol.biol.,250:359-368(1996))。这些诱变方法例示了本领域技术人员已知的许多方法。尽管已经参考某些实施方案描述了本发明,但是本领域技术人员将理解,在不脱离本发明的范围的情况下,可以进行各种改变并且可以用等同方案替换其元件。另外,在不脱离本发明的实质范围的情况下,可以进行许多修改以适应本发明的教导的特定情况或材料。因此,意图是本发明不限于所公开的具体实施方案,而是本发明将包括落入所附权利要求书或后面添加的任何权利要求的范围内的所有实施方案。除了上述内容之外,本发明的抗pdgf-c抗体可以单独使用或在组合物中使用以用于广泛的用途。在某些方面,本发明的抗体和含有抗体的组合物可以用于治疗诊断患有表达pdgf-c的细胞类型的患者,诊断表达pdgf-c的细胞或癌,检测细胞中pdgf-c的表达,筛选和选择替代的pdgf-c结合化合物等。以下详叙了此类用途,但不应认为是对本发明的抗pdgf-c抗体的用途的限制。为此,本领域技术人员将容易理解,本发明的抗体可以提供有本领域中其它方面已知的任何用途。治疗方法和药物配制剂在某些方面,本发明的抗pdgf-c抗体可以施用于受试者以预防受试者的血管发生或减小受试者中的实体瘤的大小,其通过结合并抑制pdgf-cc的活性来进行。例如,可以施用本发明的抗pdgf-c抗体以减少细胞内pdgf-cc介导的活性或减少细胞/肿瘤的自分泌和/或旁分泌信号传导或减少血脑屏障中的pdgf-cc信号传导。例如,许多肿瘤细胞使用pdgf-cc自分泌和/或旁分泌信号传导来实现血管形成、基质支持或其他肿瘤效应,其最终有助于肿瘤细胞存活力和/或肿瘤生长。本发明的抗pdgf-c抗体可以施用于患有pdgf-c表达癌的患者,以减少、抑制或预防pdgf-cc介导的信号传导,最终导致血管化、基质支持等的减少和肿瘤大小和/或细胞存活力的降低。表达pdgf-c的细胞类型的非限制性实例包括头、颈、眼、口腔、咽喉、食道、支气管、喉、咽、胸、骨、肺、结肠、直肠、胃、前列腺、膀胱、子宫、宫颈、乳房、卵巢、睾丸或其他生殖器官、皮肤、甲状腺、血液、淋巴结、肾、肝、胰腺和脑或中枢神经系统癌症。在某些非限制性方面,此类细胞类型包括膀胱移行细胞癌(tcc)、乳腺侵入性导管癌(idc)、乳腺侵入性小叶癌(ilc)、结肠直肠腺癌、多形性成胶质细胞瘤(glioblastomamultiforme)、神经胶质肉瘤(gliosarcoma,)、肝细胞癌、肺腺癌、肺鳞状细胞癌(sqcc)、转移性黑素瘤、间皮瘤(mesothelioma)、卵巢腺癌、胰腺癌、前列腺癌、肾细胞癌和子宫腺癌等。然而,本发明的抗体的用途不一定限于癌细胞类型的治疗,并且还可以施用此类抗体以通过抑制细胞中或从细胞分泌的pdgf-cc活性来治疗任何pdgf-cc相关的疾病状态和/或状况。此类状况的非限制性实例包括调节中枢神经系统(cns)(脑、脊髓和视网膜)的血脑屏障(bbb)的完整性、动脉粥样硬化和纤维化。在其他方面,本发明的抗pdgf-c抗体可以施用于受试者,用于治疗与受损的bbb相关的病症或状况。因此,本发明的方法和组合物可以用于治疗cns疾病,例如脑水肿、中风、缺血性视网膜病变、糖尿病性视网膜病变、阿尔茨海默氏病、多发性硬化和cns肿瘤。本发明的方法特别适用于治疗脑水肿、肺栓塞、心血管疾病、头部创伤、感染、神经疾病或其他疾病,其中水肿是重要的临床问题。在特别优选的实施方案中,本发明用于治疗脑水肿。本发明的方法还可以用于治疗局部或受限的水肿,例如水肿腹水、胸腔积液,心包积液、脑水肿、脑积水、青光眼或急性肺水肿,以及泛发性或全身性,如全身性水肿或积液。可以受益于本发明的抗pdgf-cc治疗的大脑或脑水肿另外可以包括但不限于由于脑疟疾感染引起的缺血性脑水肿,其在发展中国家中杀死许多儿童(参见penetetal.,imagingexperimentalcerebralmalariainvivo:significantroleofischemicbrainedema.j.neurosci.2005;25:7352-8);急性肝衰竭中的脑水肿(参见vaqueroetal.,brainedemainacuteliverfailure.awindowtothepathogenesisofhepaticencephalopathy.ann.hepatol.20032:12-22);源自脑手术的水肿,其在许多方面类似于脑创伤;由颅内肿瘤引起的水肿(参见papadopoulosetal.,molecularmechanismsofbraintumoredema.neuroscience.2004;129:1011-20;和高原脑水肿(参见hackettandroach.highaltitudecerebraledema.high.alt.med.biol.20045:136-46)。优选地,将抗pdgf-c抗体或包含该抗体的药物组合物递送至水肿部位,例如通过在脑水肿的情况下直接注射到脑脊液(csf)中,或通过血管内施用或甚至鼻内递送,已经证明它们可以成功到达bbb。在优选的实施方案中,静脉内、鞘内或通过鼻内施用(鼻内)进行施用。特别地,对于脑水肿的治疗或在缺血性中风的联合疗法中,用于递送至血脑屏障区域中的血管床的优选施用方式是鞘内或鼻内施用。如本文所用,术语“鞘内施用”包括将药物配制剂中的pdgf-c抗体直接递送到受试者的脑脊髓液中,通过包括经由钻孔或脑池对小脑延髓池的侧脑室注射或对腰区的腰椎穿刺术等的技术进行,例如,如lazorthesetal.,advancesindrugdeliverysystemsandapplicationsinneurosurgery,143-192,andomayaetal.,cancerdrugdelivery,1:169-179)中所述。术语“腰区”旨在包括第三和第四腰椎(下背部)椎骨之间的区域。术语“小脑延髓池”旨在包括头骨末端和脊髓开始于头后部的区域。术语“脑室”是指脑中与脊髓中央管连续的腔。可以通过直接注射抗体或通过使用输注泵来实现对任何上述位点施用pdgf-c抗体。参见例如美国专利no.8765671和8147828,其内容通过引用并入本文。对于治疗与受损的bbb相关的病症或状况,本文中公开的pdgf-c抗体可以以美国专利no.8765671和8147828(其内容通过引用并入本文)中描述的方式与其他治疗剂(例如tpa)组合使用。术语“治疗/处理”是指治疗和预防措施。需要治疗的那些包括已经患有疾病或病症的那些以及要预防疾病或病症的那些。待治疗的受试者可能已经被诊断为患有疾病或病症或者可以有疾病的素因或易患疾病。抗pdgf-c抗体的施用可以是单独的或与现有治疗方案组合。例如,对于癌,另外的治疗方案可以包括本领域中其它方面已知的一种或多种化学治疗剂。本领域技术人员能够容易地确定这些方案中的每一种的标准剂量和时间表。结合一种或多种前述治疗方案,可以施用包含有效量的一种或多种本发明的抗pdgf-c抗体或其亲和力成熟形式的药物组合物,以通过抑制pdgf-cc活性提供预防或治疗性处理。本发明的基于抗体的药物组合物可以通过本领域已知的任何数目的策略配制(例如参见mcgoffandscher,2000,solutionformulationofproteins/peptides:于mcnally,e.j.编proteinformulationanddelivery.newyork,ny:marceldekker;第139-158页;akersanddefilippis,2000,peptidesandproteinsasparenteralsolutions.于:pharmaceuticalformulationdevelopmentofpeptidesandproteins.philadelphia,pa:talyorandfrancis;第145-177页;akers,etal.,2002,pharm.biotechnol.14:47-127)。适合于患者施用的药学可接受组合物将含有配制剂中有效量的抗体,其既保留生物活性又在可接受的温度范围内促进贮存期间的最大稳定性。根据期望的配制剂,药物组合物还可以包含药学可接受稀释剂、药学可接受载体和/或药学可接受赋形剂,或通常用于配制用于动物或人类施用的药物组合物的任何此类媒介物。选择稀释剂以便不影响组合的生物活性。此类稀释剂的实例是蒸馏水、生理磷酸盐缓冲盐水、林格氏溶液、右旋糖溶液和汉克(hank)氏溶液等。可用于本发明的药物组合物或配制剂中的赋形剂的量是用来使抗体在整个组合物中均匀分布,以使其在将其递送至有此需要的受试者时可以均匀分散的量。它可以用来将抗体稀释至某个浓度,所述浓度提供期望的有益的姑息或治愈结果,同时最小化可以由于浓度过高而发生的任何不利副作用。它也可以具有防腐作用。因此,对于具有高生理活性的抗体,将使用更多的赋形剂。另一方面,对于任何表现出较低生理活性的活性成分,将使用较少量的赋形剂。通常,组合物中赋形剂的量为总组合物的约50%重量(w)至99.9%wt。若抗体表现出特别低的生理活性,则赋形剂的量可以低至1%wt。另一方面,对于具有特别高的生理活性的抗体,赋形剂的量可以为约98.0%至约99.9%wt。另外,一种或多种抗体可以以“化学衍生物”(含有通常不是基础分子的一部分的其他化学部分的分子)的形式施用。此类部分可以改善生物剂的溶解度、半衰期、吸收等。或者,这些部分可以减弱抗体的不想要的副作用。药物组合物还可以包含大的缓慢代谢的大分子,例如蛋白质、多糖、聚乳酸、聚乙醇酸和共聚物(例如胶乳官能化的sepharose、琼脂糖、纤维素等)、聚合氨基酸、氨基酸共聚物和脂质聚集体(如油滴或脂质体)。另外,这些载体可以起免疫刺激剂(即佐剂)的功能。对于胃肠外施用,本发明的试剂可以与药物载体一起在生理学可接受的稀释剂中以可注射剂量的物质溶液或悬浮液施用,所述药物载体可以是无菌液体,例如水油、盐水、甘油或乙醇。另外,组合物中可以存在辅助物质,例如润湿剂或乳化剂、表面活性剂、ph缓冲物质等。药物组合物的其他组分是石油、动物、植物或合成来源的组分,例如花生油、大豆油和矿物油。通常,二醇如丙二醇或聚乙二醇是优选的液体载体,特别是对于可注射溶液。抗体配制剂可以是液体形式或固体形式。通常将固体配制剂冻干,并在施用前制成溶液以进行单次或多次给药。配制剂不应暴露于极端温度或ph,以避免热变性。因此,必需在生物学相关的ph范围内配制本发明的抗体组合物。指示经缓冲以在贮存期间维持适当ph范围的溶液,特别是对于在配制和施用之间贮存较长时间段的液体配制剂。迄今为止,液体和固体配制剂两者都需要在较低温度(通常为2-8℃)下贮存,以保持较长时段的稳定性。配制的抗体组合物,尤其是液体配制剂,可以含有抑菌剂以防止或最小化贮存期间的蛋白水解,包括但不限于有效浓度(通常<1%w/v)的苄醇、酚、间甲酚、氯丁醇、对羟基苯甲酸甲酯和/或对羟基苯甲酸丙酯。对于一些患者,抑菌剂可能是禁忌的。因此,冻干配制剂可以在含有或不含有此类成分的溶液中重建。可以将额外的组分添加到缓冲液体或固体抗体配制剂,包括但不限于作为冷冻保护剂的糖(包括但不必限于多羟基烃,例如山梨糖醇、甘露醇、甘油和卫矛醇和/或二糖,例如蔗糖、乳糖、麦芽糖或海藻糖),并且在某些情况下,相关的盐(包括但不限于nacl、kcl或licl)。此类抗体配制剂,特别是长期贮存的液体配制剂,将依赖于有用的总渗量范围,以促进2-8℃或更高温度的长期稳定性,还使配制剂可用于胃肠外注射。总渗量的有效范围(溶液中的分子总数)为约200mos/l至约800mos/l。明显的是,诸如蔗糖或山梨糖醇的细胞保护剂的量将取决于配制剂中盐的量,以使溶液的总渗量保持在合适的范围内。因此,无盐配制剂可以含有约5%至约25%的蔗糖,优选的蔗糖范围为约7%至约15%,无盐配制剂中特别优选的蔗糖浓度为10%至12%。或者,不含盐的基于山梨糖醇的配制剂可以含有约3%至约12%范围内的山梨糖醇,优选的范围为约4%至7%,特别优选的范围为无盐配制剂中的约5%至约6%。当然,无盐配制剂将保证相应冷冻保护剂的范围增加,以保持有效的渗量水平。这些配制剂还可以含有二价阳离子(包括但不必限于mgcl2,cacl2和mncl2);非-32离子表面活性剂(包括但不必限于polysorbate-80(tween),polysorbate-60(tween),polysorbate-40(tween)和polysorbate-20(tween),聚氧乙烯烷基醚(polyoxyethylenealkylether),包括但不限于brijbrij以及其他如tritonx-tritonxspan85和pluronic系列非离子表面活性剂(如,pluronic121))。此类组分的任何组合(包括抑菌剂的可能纳入)可以用于填充本发明的含有抗体的配制剂。各种其它载体、稀释剂、赋形剂等的许多实例是本领域已知的,并且在本文引用的参考文献以及remington'spharmaceuticalsciences(第18版;mackpublishingcompany,easton,pa.,1990)(其内容通过引用并入本文)中公开。简言之,应当理解,可以掺入合适的载体、赋形剂和其他试剂以配制药物组合物,以提供改善的转移、递送,耐受性等。将生物剂和/或另外的活性成分掺入载体中的方法是本领域普通技术人员已知的,并且取决于生物剂的性质和由实施本发明的人选择的载体的性质。离子结合、凝胶包囊或载体内的物理捕获、电离子透入疗法(iontophoresis)以及将载体浸泡在生物剂的溶液中是配制要用于实施所公开的处理方法的药物组合物中考虑的合适实例。或者,载体可以仅仅是生物剂的稀释剂。这些配制剂可以包括例如粉末、糊剂、软膏剂、胶冻剂、蜡、油、脂质、无水吸收基质、水包油或油包水乳液、乳液碳蜡(carbowax)(多种分子量的聚乙二醇)、半固体凝胶和含有碳蜡的半固体混合物。利用本发明化合物的剂量方案根据多种因素选择,包括患者的类型、物种、年龄、体重、性别和医疗状况;待治疗状况的严重性;施用路径;患者的肾、肝和心血管功能;及使用的其特定生物剂。具有普通技能的内科医生或兽医可以容易地确定和开出预防、对抗或阻止状况进展所需要的药物的有效量。在无毒性的情况下产生功效的范围内达到药物浓度的最佳精确度需要基于药物对靶位点的可用性的动力学的方案。这涉及考虑药物的分布、平衡和消除。任何前述配制剂可以适用于根据本发明的治疗和疗法,条件是配制剂中的活性成分不被配制剂灭活并且配制剂是生理学相容的。本发明的药物组合物可以以足以通过抑制pdgf-cc活性来提供治疗性处理,即肿瘤大小减少、血管生成减少等的量以本领域中可用的任何方式、策略和/或组合对宿主施用。这些组合物可以通过本领域已知的多种途径提供给个体,尤其是胃肠外途径,包括但不限于胃肠外途径,例如静脉内(iv)、肌肉内(im);或者皮下(sc)施用,iv施用是治疗性抗体施用领域内的标准。这些组合物可以以分开剂量或多剂量施用(即,通过经由治疗方案维持配制剂的无菌条件,在交错时间施用抗体)。利用本发明化合物的剂量方案根据多种因素选择,包括患者(例如人患者)的类型、物种、年龄、体重、性别和医疗状况;待治疗病况的严重程度;施用途径;患者的肾、肝和心血管功能;及采用的其特定抗体。具有普通技能的内科医生或兽医可以容易地确定和开出有效治疗量的抗体。在产生功效而无毒性的范围内实现抗体浓度的最佳精确度需要基于药物对靶位点的可用性的动力学的方案。这涉及考虑药物的分布、平衡和消除。本文描述的抗体可以以合适的剂量单独使用。或者,可以期望共施用或顺序施用其他试剂。有可能与替代预防或治疗方案的施用结合提供本发明抗体的治疗给药方案。有效剂量方案将根据许多不同因素而变化,包括施用手段、靶位点、患者的生理状态、患者是人还是动物、施用的其他药物、以及治疗是预防性还是治疗性。对于抗pdgf-c抗体的施用,剂量范围为约0.0001至100mg/kg,更通常为0.01至5mg/kg宿主体重。关于本发明的抗pdgf-c抗体组合物的递送和剂量方案的另一方面涉及通过胃肠外途径递送药物,其可以包括非注射和可注射装置。通常,可注射组合物制备成液体溶液或悬浮液;也可以制备适于在注射前溶解或悬浮在液体媒介物中的固体形式。如上所讨论,制剂还可以乳化或包囊在脂质体或微粒如聚乳酸、聚乙醇酸交酯或共聚物中以增强佐剂效应(参见langer,1990,science249:1527-1523;andhanes,1997,advanceddrugdeliveryreviews28:97-119)。本发明的试剂可以以积蓄注射(depotinjection)或植入制剂的形式使用,其可以以允许活性成分持续或脉冲释放的方式配制。pdgf-c/pdgf-cc检测/诊断测定法本文所述的抗pdgf-c抗体可以用作许多不同免疫测定法中的基础试剂以确定组织样品中pdgf-c和pdgf-cc形式的存在和/或诊断pdgf-c表达细胞类型,诸如表达pdgf-c的癌、cns组织、血液、血清、血浆和脑髓液的存在。一般而言,抗体可以用于任何类型的免疫测定法,无论是定性的还是定量的。这包括双位点夹心测定法和非竞争性类型的单位点免疫测定法两者,以及传统的竞争性结合测定法。感兴趣的一个实施方案(为了便于检测)及其定量性质是夹心或双重抗体测定法,其中存在许多变化,所有这些变化都意图由本发明的此部分涵盖。例如,在典型的正向夹心测定法中,将未标记的抗体(例如抗pdgf-c一抗)固定化在固体基质,例如微量滴定板孔上,并且使待测样品与结合的分子接触。在适当的温育期后,持续足以允许形成抗体-抗原双重复合物的一段时间,然后添加用能够诱导可检测信号的报告分子标记的二抗(例如与一抗具有不同的靶表位的pdgf-c二抗),继续培养,留出足够的时间以在不同位点处与抗原结合,并且形成抗体-抗原-标记抗体的三重复合物。洗掉任何未反应的物质,并通过观察信号确定抗原的存在,所述信号可以通过与含有已知量抗原的对照样品比较来定量。正向夹心测定法的变化包括同时测定法,其中样品和抗体两者同时添加到结合的抗体,或反向夹心测定法,其中首先将经标记的抗体和待测试的样品组合,温育并加入未标记的表面结合抗体。这些技术对于本领域技术人员来说是公知的,并且很小的变化的可能性将是显而易见的。如本文所用,“夹心测定法”旨在涵盖基本双位点技术的所有变化。对于本发明的夹心测定法,鉴于pdgf-cc蛋白的二聚体性质,可以使用对该蛋白具有不同或相同结合特异性的两种抗体进行测定法。因此,许多可能的组合是可能的。作为更具体的实例,在典型的前向夹心测定法中,一抗与固体支持物共价或被动结合。固体表面通常是玻璃或聚合物,最常用的聚合物是纤维素、聚丙烯酰胺、尼龙、聚苯乙烯、聚氯乙烯或聚丙烯。固体支持物可以是管、珠、盘或微板的形式,或适于进行免疫测定法的任何其他表面。结合过程在本领域中是公知的。结合后,清洗固相-抗体复合物以准备测试样品。然后将待测试的体液的等分试样添加到固相复合物,并在25℃温育一段时间,该时间段足以使存在的任何pdgf-cc蛋白与抗体结合。然后将二抗添加到固相复合物并在25℃再温育一段时间,该时间段足以使二抗与一抗-抗原固相复合物结合。二抗与报告分子连接,其可见信号用于指示二抗与样品中任何抗原的结合。如本说明书中使用,“报告分子”是指通过其化学性质提供分析可检测信号的分子,所述分析可检测信号允许检测抗原结合的抗体。检测必须至少是相对可量化的,以允许确定样品中的抗原量,这可以以绝对值计算,或者可以与含有已知正常抗原水平的标准品(或一系列标准品)进行比较。在此类型的测定法中最常用的报告分子是酶或荧光团。在酶免疫测定法的情况下,酶通常通过戊二醛或高碘酸盐与二抗缀合。然而,如将容易认识到,存在极其多种不同的缀合技术,这些技术是本领域技术人员公知的。常用的酶包括辣根过氧化物酶、葡萄糖氧化酶、β-半乳糖苷酶和碱性磷酸酶等。通常选择与特定酶一起使用的底物用于在通过相应的酶水解时产生可检测的颜色变化。例如,对硝基苯磷酸盐适合于与碱性磷酸酶缀合物一起使用;对于过氧化物酶缀合物,通常使用1,2-苯二胺或甲苯胺。还可以使用荧光底物,其产生荧光产物而不是上述的生色底物。在所有情况下,将经酶标记的抗体添加到一抗-pdgf-cc蛋白复合物中并允许与复合物结合,然后洗去过量的试剂。然后,将含有适当底物的溶液添加到抗体-抗原-标记抗体的三重复合物。底物与连接到二抗的酶反应,产生定性的视觉信号,其可以通常以分光光度法进一步定量,以评估血清样品中存在的抗原的量。另外,荧光化合物如荧光素或罗丹明可以与抗体化学偶联而不改变它们的结合能力。当通过用特定波长的光照射激活时,经荧光染料标记的抗体吸收光能,诱导分子的可激发性状态,然后以特征性的更长波长发射光。发射表现为用光学显微镜或其他合适的检测装置可视觉检测的特征性颜色。如在酶免疫测定法(eia)中,使荧光标记的抗体与一抗-pdgf-c蛋白复合物结合。清洗未结合的试剂后,将剩余的三重复合物暴露于适当波长的光,并且观察到的荧光指示抗原的存在。免疫荧光和eia技术在本领域中都完善建立的,并且对于本方法是特别优选的。然而,也可以使用其他报告分子,例如放射性同位素、化学发光或生物发光分子。熟练技术人员将容易明白如何改变程序以适应所需要的用途。在另一个实施方案中,待测试的样品可以用于单位点免疫测定法,其中它以共价或非共价的方式附着到固体基底。使本发明的未标记的抗pdgf-c抗体与结合在固体基底上的样品接触。在适当的温育期后,持续足以允许形成抗体-抗原双重复合物的一段时间,添加用能够诱导可检测信号的报告分子标记的第二抗体,并继续温育,留出足够的时间用于形成抗原-抗体-标记抗体的三重复合物。对于单位点免疫测定法,二抗可以是通用抗体(即针对免疫球蛋白的异种(zenogeneic)抗体,特别是与报告分子连接的抗-(igm和igg)),其能够结合对pdgf-c/pdgf-cc特异的抗体。试剂盒本发明涵盖用于进行上述测定法的试剂盒和诊断系统。为此,本文中公开的方法的一种或多种反应组分可以以试剂盒的形式提供,所述试剂盒用于富集和检测靶分子。在此类试剂盒中,适当量的一种或多种反应组分在一个或多个容器中提供或保持在基底上(例如,通过静电相互作用,共价键键合或非共价键键合)。在一个实施方案中,试剂盒可以包含靶标特异性抗体(例如,抗pdgf-c/pdgf-cc抗体),和一种或多种用于检测靶标特异性抗体与靶标结合的试剂。试剂可以包括例如荧光标签、酶标签或其他可检测标签。试剂还可以包括用于酶促反应的二级或三级抗体或试剂,其中酶促反应产生可以显现的产物。在一个实施方案中,本发明提供了诊断试剂盒,其包含在合适容器中的标记或未标记形式的一种或多种本发明的靶标特异性抗体、用于间接测定法的温育的试剂、以及用于此类测定法中检测的底物或衍生剂,取决于标记物的性质。还可以包括对照试剂和使用说明书。试剂盒还可以包含一种或多种以下组分:支持物、终止、修饰或消化试剂、渗透物、用于检测检测标签的装置和缓冲液(1x或浓缩形式)。还可以提供诊断试剂盒以与靶标特异性抗体(例如经标记的靶标特异性抗体)一起使用,用于检测组织样品或宿主中靶标的存在。在此类诊断试剂盒中,以及在本文中别处描述的治疗用途的试剂盒中,靶标特异性抗体通常可以在容器中以冻干形式提供,单独或与对靶细胞或肽特异的其他抗体一起提供。通常,也包括药学可接受载体(例如,惰性稀释剂)和/或其组分,例如tris、磷酸盐或碳酸盐缓冲剂、稳定剂、防腐剂、杀生物剂、惰性蛋白质,例如血清白蛋白等(通常在用于混合的单独容器中)和另外的试剂(通常也在单独的容器中)。在某些试剂盒中,还包括能够结合靶标特异性抗体的二抗,其通常存在于单独的容器中。二抗通常与标记物缀合,并以与本发明的靶标特异性抗体相似的方式配制。使用上文和本文别处描述的方法,靶标特异性抗体可以用于限定需要治疗的患者亚组并表征此类细胞和相关组织。试剂盒或系统可以以足以进行至少一种测定法的量包含本文所述组分的任何组合,并且可以进一步包括以有形形式记录的使用所述组分的说明书。在一些应用中,可以在个别的,通常一次性的管或等同容器中以预先测量的单次使用量提供一种或多种反应组分。凭借此类配置,可以将要测试靶抗原存在的样品添加到个别管并直接进行扩增。试剂盒中提供的组分的量可以是任何适当的量,并且可以取决于产品所针对的目标市场。确定适当量的一般指导原则可参见例如josephsambrookanddavidw.russell,molecularcloning:alaboratorymanual,第3版,coldspringharborlaboratorypress,2001;和frederickm.ausubel,currentprotocolsinmolecularbiology,johnwiley&sons,2003。供应组分的容器可以是能够容纳所提供的形式的任何常规容器,例如微量离心管、安瓿、瓶或整体测试装置,例如流体装置、筒、侧向流动,或其他类似的装置。在一些实施方案中,试剂盒可以进一步包括在本文描述的任何方法中使用组分的说明书。用于此类试剂盒和系统的典型包装材料包括固体基质(例如,玻璃、塑料、纸、箔、微颗粒等),其在多种构造中的任一种中(例如,在小瓶、微量滴定板孔、微阵列等中)保持反应组分或检测探针。在含有试剂盒组分之外,系统还可以包含用于进行测定法的仪器,例如,用于检测来自标记分子的信号的发光计。详细说明使用本发明的试剂盒或系统的说明书,例如书面说明或录像演示任选随试剂盒或系统提供。可选地,本发明的试剂盒或系统还可以包括用于加速数据的生成、分析和/或存储以及便于访问数据库的软件。该软件包括可用于数据的收集、存储和/或分析的逻辑指令、指令集或合适的计算机程序。使用提供的软件可以对数据进行比较和关系分析。药物筛选测定法在进一步的实施方案中,本发明的抗pdgf抗体可以用于筛选和选择可以充当细胞中pdgf-cc活性抑制剂的化合物的方法。此类方法包括在各种抗体/肽/测试化合物相互作用测定法中利用具有抗pdgf-c亲和力的抗体,以选择调节pdgf-cc活性的化合物。化合物可以是非蛋白质性有机或无机分子、肽(例如,作为潜在的预防性或治疗性肽疫苗)、蛋白质、dna(单链或双链)或rna(例如sirna或shrna)。在阅读本说明书的公开内容和教导后,显而易见的是,与本发明的抗pdgf-c抗体有效竞争结合pdgf-c表位的任何此类肽或小分子代表可能的先导化合物,其与以pdgf-c表达或过表达为特征的疾病状态,特别是表达pdgf-c的癌症的疾病状态的预防性或治疗性处理相关。为此,可以利用相互作用测定法进行高通量筛选,以鉴定占据pdgf-c表位或与pdgf-c表位相互作用并置换抗体的化合物。可以根据前述内容使用本领域已知的各种基于抗体/抗原的测定法,包括但不限于elisa测定法、放射免疫测定法、western印迹分析、不需要分离或清洗步骤的依赖于可检测的生物相互作用的任何同质测定法(例如参见来自perkinelmer的alphascreen)和/或基于spr的技术(例如,参见biacore))。通过使用抗pdgf-c抗体鉴定的化合物和/或肽疫苗候选物可以通过多种测定法检测。测定法可以是简单的“是/否”测定法,以确定形成已知抗体/抗原复合物的能力是否发生变化,或者可以通过利用测定法诸如基于elisa的测定法、同质测定法或基于spr的测定法变为本质上定量的。为此,本发明涉及任何此类测定发,不管所使用的已知方法如何,所述已知方法测量测试化合物与本发明的抗pdgf-c抗体竞争的能力。以下是支持前述发明的实施例。它们不应解释为限制本发明。实施例实施例1-产生针对人pdgf-cc的单克隆抗体产生针对人pdgf-cc活性核心域蛋白的单克隆抗体。用于免疫方案的纯化的pdgf-cc核心域片段(rhpc)由具有末端组氨酸标签的pdgf-cc蛋白(seqidno:1)的残基230-345(seqidno:2)组成。如前所述(lix,etal.natcellbiol.2000may2(5):302-309,其内容通过引用并入本文),它从杆状病毒感染的昆虫sf9细胞产生和纯化。pdgf-c的核心域与pdgf-d(与pdgf-c共享最高同源性的人蛋白质)中的同源区具有53%的同一性。存在足够的非同一性区域以产生对pdgf-cc特异的抗体。购买商品化重组纯化的人pdgf-aa、pdgf-bb和pdgf-dd。针对活性pdgf-cc的对照多克隆阻断抗体是如前所述(lix,etal.natcellbiol.2000may2(5):302-309)从兔615分离的亲和纯化的兔igg。最初将cos-1细胞维持在dmem培养基中。这两种培养基补充有10%fcs、2mm谷氨酰胺、100u/ml青霉素和100mg/ml链霉素。将细胞在37℃,湿润的5%co2气氛中培养。用三氯乙酸收集条件化的无血清培养基和沉淀的蛋白质。将生长因子pdgf-dd或pdgf-cc和his-五肽进行三氯乙酸(tca)沉淀,并且通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分离蛋白质。为了产生小鼠pdgf-cc蛋白,用在表达载体pcdna3.1(invitrogen)中构建的小鼠pdgf-c核心质粒转染cos-1细胞。使用lipofectamineplus试剂(invitrogen)根据制造商的说明书进行转染。将转染的细胞在无血清培养基中培养。在转染后24小时,收集培养物上清液(cosmpccoremedia)并将30μl样品与人pdgf-c核心蛋白(0.1μgrhpcc)一起加载到sds-page上,并通过sds-page分离蛋白质。然后使用标准手段分离蛋白质。通过标准程序免疫小鼠和脾脏融合后,最初通过elisa和western分析评估16个杂交瘤的上清液的pdgf-cc结合特异性。使用灵敏的elisa测定法,使用商品化pdgf-aa、pdgf-bb、pdgf-dd和重组pdgf-cc探索这点。具体地,以浓度1μg/ml在100mmnahco3中稀释的纯化的重组人pdgf配体,pdgf-aa、bb、cc和dd的抗原固定化在+4℃进行过夜。此后,所有温育均在室温进行1.5-2小时,并用pbs进行清洗。一式三份,将杂交瘤上清液以1:2的稀释应用于pbs/1%牛血清白蛋白(bsa)中,或添加纯化的单克隆抗体(mab)(1.5μg/ml,在3%bsa中)。兔多克隆igg-纯化的抗体用作阳性对照(4μg/ml)。用抗小鼠(或对照中的抗兔)碱性磷酸酶缀合的二抗检测结合,并通过与用于elisa的碱性磷酸酶黄(pnpp)液体底物系统(sigma-aldrich)一起温育来显现。在405nm处读取吸光度。选择新产生的单克隆抗体,其显示预期的反应性模式和预防pdgfr-α磷酸化。显示杂交瘤上清液特异性结合pdgf-cc的免疫印迹分析结果在图1中显示。pdgf-c的核心域与pdgf-d(与pdgf-c共享最高同源性的人蛋白质)中的同源区之间有53%的氨基酸同一性。克隆无一显示对pdgf-dd或聚组氨酸(his6)的强阳性免疫反应性。用抗体6b3、11f5、12f5和19c7的纯化样品进行的代表性elisa分析在图2a中显示。抗体6b3、11f5、12f5和19c7特异性结合人pdgf-cc但不结合pdgf-dd或pdgf-aa。进一步的免疫印迹分析观察到纯化的抗体12f5而非6b3,证实了与小鼠pdgf-cc以及人pdgf-cc的结合(图2b)。抗体6b3表明仅与人pdgf-cc结合。实施例2-抗体的氨基酸序列通过标准程序测定6b3、19c7、11f5和12f5的可变重链和轻链的氨基酸序列。完整的可变轻链和可变重链序列分别在图3和4中呈现。令人感兴趣的是,19c7和6b3序列是相同的。确定抗体均为具有κ轻链的同种型igg2a。6b3、11f5和12f5抗体的互补决定区(cdr)和同种型在上表3和4中呈现,并且cdr是图3和4中的加下划线的序列。实施例3-嵌合抗pdgf-cc抗体6b3(ch6b3)的产生使用标准实验室技术测定鼠单克隆抗体11f5、12f5、19c7和6b3的cdna序列。基于下文的体外和体内特征,选择6b3作为产生小鼠-人嵌合抗体和用于人源化的候选物。由geneart合成重链(hc)和轻链(lc)克隆6b3pdgfcc抗体的鼠可变区,并分别克隆到pee6.4和pee14.4谷氨酰胺合成酶(gs)表达载体(lonzabiologics)中人igg1重链和轻链κ链恒定区的上游。在dna序列验证后,用noti/sali限制酶消化pee6.4ch6b3hc和pee14.4ch6b3lc载体,并将来自pee6.4ch6b3hc的hc盒克隆到pee14.4ch6b3lc质粒中以制备双重基因载体pdgvch6b3最终构建体。在瞬时(freestyle293)和稳定(cho)细胞两者中使用gs系统进行表达,并使用elisa和biacore评估ch6b3抗体产物的pdgf-cc结合,并且在体外评估pdgf-cc中和活性,如下文对鼠单克隆抗体描述。嵌合(ch)和鼠(mu)6b3抗体的序列比对在图5中呈现。ch6b3的互补决定区(cdr)和同种型在上表3和4中呈现,并且cdr是图5中的加下划线的序列。实施例4-鉴定pdgf-c上的6b3结合表位使用先前描述(zhangw.,et.al.jcomputaidedmoldes.27(6):539-50,2013)的方法从抗体fv域的3d结构和pdgf-cc核心域二聚体模型以计算方式预测位于pdgf-cc核心抗原上的6b3抗体可变域结合表位。鉴定出形成pdgf-cc核心蛋白上的6b3抗体结合表位的部分的四种推定的肽,然后合成用于以精制6b3结合表位为目的的生物传感器分析(表9)。表9肽1:dvalehheecdcseqidno:100肽2:llteevrseqidno:101肽3:svsireelkrtdtifwpgcseqidno:3肽4:vtkkyhevlseqidno:1026b3抗体对固定化的pdgf-cc核心域及在不存在和存在潜在肽表位的情况下的结合:使用羧甲基葡聚糖包被的传感器芯片(xanteccmd)在biacore2000生物传感器上进行生物传感器分析。使用标准胺偶联化学(0.05mnhs/0.2medc),用pdgf-cc核心抗原(60μg/ml)在通道2上将芯片衍生化。通道1用乙醇胺衍生化并用作空白对照通道以校正折射率效应。在不存在或存在个别pdgf-c肽的情况下,在固定化的pdgfc核心抗原上,在hbs缓冲液(10mmhepes,ph7.4;150mmnacl,3.4mmedta,0.005%tween-20)中(30μl,10μl/min)注射6b3抗体样品(333nm):肽1(142μm)、肽2116μm、肽3(89μm)和肽4(179μm)。在注射阶段之后,通过在芯片表面上流动hbs缓冲液360s来监测解离。洗脱结合的抗体,并通过注射30μl的10mm甘氨酸ph2.0在样品之间再生芯片表面。在存在肽3(svsireelkrtdtifwpgc,seqidno:3)的情况下观察到6b3结合动力学的变化。进一步的生物传感器分析确定对6b3与pdgf-cc结合的此种抑制是肽3浓度依赖性的,指示特异性抑制。在过量浓度(高达267μm)的肽1、2或4的情况下未观察到6b3(333nm)结合抑制(图6)。6b3抗体对固定化的pdgfc肽3(svsireelkrtdtifwpgc,seqidno:3)的结合:使用硫醇化学将肽3在羧甲基葡聚糖包被的传感器芯片的通道4上固定化。简言之,使用标准胺偶联化学(0.05mnhs/0.2medc),然后在1m硼酸盐ph8.2中使用80mm(2-(2-吡啶基二硫代)乙烷胺(pdea)在通道4上活化芯片。肽3(10mm乙酸钠ph4.5中的100nm)通过其c末端半胱氨酸与pdea缀合。然后使用10mm乙酸钠ph4.0和1m乙醇胺ph8.2中的40mml-半胱氨酸封闭芯片。空白衍生化的通道用作对照通道。将抗体6b3(20.8nm-667nm)的样品在固定化肽3上在hbs缓冲液中注射(30μl,10μl/min)。与空白通道相比观察到特异性结合,然后用较小的重叠肽序列进一步研究(数据未显示)。确定由抗体6b3结合的特定pdgfc肽序列:合成三个重叠的10个氨基酸的肽,涵盖pdgfc核心域内svsireelkrtdtifwpgc(seqidno:3)的推定表位区域,以进一步精制6b3表位。这些肽是:svsireelkc、rtdtifwpgc和eelkrtdtifc(seqidnos:105-107)。合成具有c末端半胱氨酸的肽以使用硫醇固定化在传感器芯片上实现限定的定向。将6b3抗体样品(1.334μm)在固定化的肽上在hbs缓冲液中注射(30μl,10μl/min)。结果在图7a中显示,并且指示6b3结合svsireelkc(seqidno:105)肽,并且svsir序列对于6b3结合是必需的,因为没有观察到对重叠肽eelkrtdtifc(seqidno:107)的结合,或者对备选肽svnireelkc(seqidno:108)的结合,如图7b中所示。因此,通过同源性建模预测推测的6b3表位和随后通过生物传感器分析测定确定pdgfc核心域序列内的特异性6b3表位是序列svsireelkrtdtifwpgc(seqidno:3)的256svsir260。pdgfc抗体6b3表位的特异性:由于我们先前的western印迹和基于细胞的分析已经确定6b3不结合pdgf-d多肽,因此进一步的生物传感器结合分析检查了6b3对pdgf-c肽表位svsireelkc(seqidno:105)和相差一个氨基酸的pdgf-d肽svnireelkc(seqidno:108)的结合。合成具有c末端半胱氨酸的肽以使用硫醇固定化在传感器芯片上实现限定的定向。在固定化的svsireelkc(seqidno:105)和svnireelkc(seqidno:108)肽上,在hbs缓冲液中(30μl,10μl/min)注射抗体6b3样品(667nm)。与svnireelkc(相应的pdgfd表位肽,seqidno:108)和空白对照通道相比,观察到与svsireelkc(pdgfc表位肽,seqidno:105)的特异性结合(图7b)。pdgf-c序列svsir与相应的pdgf-d序列仅相差一个氨基酸(丝氨酸)(图8)。实施例5-人pdgf-cc特异性的生物传感器确认a.亲和力评估使用nta传感器芯片在biacore2000生物传感器上进行生物传感器分析。简言之,nta传感器芯片装载有ni2+并用于固定化经组氨酸标记的pdgf-cc配体。将pdgf-cc抗体以不同浓度通过芯片以确定表观亲和力(kd)。用egta再生芯片。在进一步分析之前,通过用hbs(不含edta)清洗来再平衡芯片。使用biaevaluation软件,使用1:1langmuir结合分析模型来估计每组抗体实验的表观结合(ka)和解离(kd)速率常数。将浓度330nm的抗pdgf-ccmab(6b3、12f5、19c7和11f5)在固定化的pdgf-cc和pdgf-dd(r&d)上注射。图9中显示的结果证明了与pdgf-dd的密切相关序列相比较,对pdgf-cc结合的特异性,并且这些观察结果与elisa分析一致(图2a)。与6b3鼠抗体相比,嵌合6b3构建体还表明低纳摩尔表观结合亲和力并且没有表观结合亲和力的损失。鼠和嵌合6b3的代表性结合曲线在图10中显示。将这些曲线拟合到1:1langmuir结合模型。观察到检查的每种抗体的剂量依赖性结合。表10中报告了表观结合速率(ka)、解离速率(kd)和解离常数。计算的每种抗体的解离常数均在低纳摩尔范围内,指示所有5种抗体对pdgf-cc配体具有高亲和力。如预期,6b3和19c7表明高度相当的表观结合亲和力。表10.生物传感器分析。使用1/1langmuir分析测定的表观结合参数抗pdgf-cc抗体b.结合特异性使用固定化的pdgf-cc对4种抗pdgf-cc候选单抗的组类似进行竞争性结合分析。使用标准条件,通过伯胺基团(nhs/edc化学)将pdgf-cc抗原共价偶联至cm5传感器芯片。将抗pdgf-ccmab(6b3、12f5、19c7和11f5)和对照抗pdgf-ddmab在固定化的抗原上注射。针对分开的表位的单克隆抗体将彼此独立结合,而针对密切相关的表位的抗体将干扰彼此的结合。通过注射第一抗体(50μl,100μl/ml)进行成对结合研究,直到表面饱和,其中所有可用的结合位点都被占据。然后,在注射(50μl,100μl/ml)后评估第二抗体对pdgf-cc的结合。通过使用10mm甘氨酸ph2.1从传感器芯片表面除去结合的材料来终止每个分析循环。通过以相反的顺序分析相同抗体的相互重复来进行定位。为了进一步检查对pdgf-cc结合的性质和pdgf-cc内二硫键参与的可能性,使用非还原和还原/烷基化抗原进行单克隆抗体结合。通过连续注射二硫苏糖醇(200μl,50mm)和碘乙酰胺(30mm,200μl),在固定化的pdgf-cc上进行还原和烷基化。mab交叉竞争对固定化的pdgf-cc配体的结合的有效性列于下表(表11)。颜色代码包括:白色,结合抗体(不同的表位);黑色:竞争抗体(相似表位);灰色,干扰结合的抗体。表11.生物传感器分析-结合固定化的pdgf-cc的抗体交叉竞争如预期,每种抗体与其自身竞争,并且相同的可变域mab6b3和19c7也竞争结合。mab12f5和11f5与6b3和19c7以及mab12f5和11f5彼此具有不同的表位。在6b3和19c7的情况下对11f5观察到一些结合干扰,提示表位或空间位阻的重叠。如从biacore数据确定的4种抗体的表位组如下图示呈现。从biacore数据确定的表位组。当pdgf-cc抗原减少和烷基化时,未观察到结合反应性的明显变化,提示所有表位看起来都是不依赖二硫化物的。实施例6-pdgf-配体诱导的受体活化和细胞增殖过表达pdgf受体α(pdgfr-α)的猪主动脉内皮细胞(pae)用于对单抗表征pdgf-cc诱导的pdgfr-α活化的中和活性。在冰上仅用60ng/ml活化的重组人pdgf配体,或用纯化的mab(5μg/ml)预温育的pdgf配体刺激细胞1小时。在测定法中包括pdgfr-α的pdgf-bb活化的阳性对照和全长pdgf-cc的阴性对照(对照)或未刺激的细胞。然后,将细胞在冷pbs中清洗,温和离心,并在裂解缓冲液(20mmtris-hclph7.5,150mmnacl,5mmedta,0.5%脱氧胆酸,200μm正钒酸盐和完全蛋白酶抑制剂)中裂解。然后,使用识别磷酸酪氨酸py99的小鼠单克隆抗体和检测c端pdgfr的兔多克隆抗体(用作上样对照的ced)通过免疫印迹法分析释放的蛋白质。人pdgf-cc的核心域有效诱导pdgfr-α的酪氨酸磷酸化,pdgf-bb也如此(图11a)。来自未刺激细胞或来自用全长pdgf-cc刺激的细胞的pdgfr-α仅显示背景活化水平。随后,使用针对pdgfr-α的抗体探测滤器证实在所有泳道中存在等量的pdgfr-α(数据未显示)。观察到抗体6b3、11f5、19c7和12f5阻断pdgf-cc诱导的而非pdgf-bb诱导的pae细胞中的pdgfr-α磷酸化。因此,这些抗体是针对人pdgf-cc的中和性单克隆抗体。体外分析还证明小鼠-人嵌合抗体6b3是在抑制pdgf-cc诱导的pdgfr-α活化上与亲本鼠mab6b3一样有效的中和抗体(图11b)。抗pdgf-ccmab12f5而非12c2或9a5也是中和性的。过表达pdgfr-α的pae(猪主动脉内皮细胞)类似地用于评估6b3作为这些抗体抑制通过pdgf-cc诱导的pdgfr-α活化进行的增殖的能力的实例。将pae-α细胞接种在6孔板(2×105个细胞/孔)中,并在无血清培养基中饥饿过夜。然后,用人pdgf-cc核心域蛋白(rhpcc)(图12a)或用6b3(0-6μg/ml)和50ng/mlrhpcc(图12b)处理细胞24小时。用细胞计数器在24小时后测定细胞数。图12证明6b3以剂量依赖性方式抑制pdgf-cc诱导的paeα细胞增殖。在存在3μg/ml6b3的情况下,观察到50ng/mlpdgf-cc核心域诱导的paeα细胞增殖的最大抑制(图12b)。实施例7-免疫组织化学-组织筛选a.材料和方法最初在乳腺癌组织上探索6b3、11f5、12f5和19c7以及其他克隆反应性的免疫组织化学分析。在一组经福尔马林固定的石蜡包埋的人正常组织和肿瘤上进行作为这些抗体实例的克隆6b3的进一步免疫组织化学表征。人组织由victoriancancerbiobankandaustinhospitaltissuebank(melbourne,australia)提供。将经石蜡包埋的切片脱石蜡,然后用3%过氧化氢在室温淬灭内源过氧化物酶活性10分钟。通过在10mmol/l柠檬酸ph6.0中煮沸30分钟来进行抗原修复。使用的抗体和稀释液是或者6b3(1.5μg/ml)、同种型对照migg1(southernbiotechnologies;1.5μg/ml)、cd34(0.5μg/ml;dako)。使用dako-envision+抗小鼠-hrp缀合的二抗,然后使用dab色原体检测抗体结合。阳性对照样品由人肺癌细胞系a549(atcc)和已知的阳性鳞状细胞肺癌组织组成。测定对照包括用同种型对照替换一抗,或省略一抗。若在用抗体温育的组织中存在信号,并且在与同种型对照温育的切片和/或在不存在一抗的情况下温育的切片中缺乏信号,则报告测试组织呈阳性。用阳性对照组织染色的特异性的进一步分析涉及与pdgf-cc配体或相关生长因子vegf-b的竞争。将鼠6b3抗体(1.5μg/ml)与6.7倍过量的pdgf-cchis6抗原(10μg/ml)或过量的vegf-b抗原(10μg/ml)一起温育,之后1小时将混合物应用到a549细胞或人胎盘组织的切片。根据标准6b3免疫组织化学方案进行染色检测。使用aperioscanscopextinstrument(aperiotechnologies,inc,vista,ca)将载玻片数字化,并使用imagescopesoftware(aperiotechnologies,inc,vista,ca)观察。若在用抗体温育的组织中存在信号并且在与同种型对照温育的切片或在没有一抗的情况下温育的切片中没有信号或具有最小信号,则报告测试组织呈阳性。将抗体cd34应用于相邻切片以帮助血管的鉴定和染色频率。通过三个参数报告6b3染色:1)阳性染色强度:-或neg或-ve阴性;+,弱染色;++,中度染色;+++,强烈染色;+ve,阳性染色,其中未记录强度2)阳性细胞染色的百分比,其作为范围提供:neg,<5%6-25%26-50%51-75%>75%3)阳性组织的频率,即阳性组织(分子)与评估的组织总数(分母)的比较。基于染色的强度和阳性染色细胞的百分比,确定每个个别组织样品的修改的h评分。此评分通过将阳性细胞的分数(范围0-5[neg=0;<5%=1;6-25%=2;26-50%=3;51-75%=4;>75%=5])乘以染色强度(neg=0;+=1;++=2;+++=3)来确定。对每种组织类型使用修改的h-评分t-检验,以确定正常和肿瘤标本中6b3反应性之间的统计学显著性。p值<0.05是显著的。b.结果正常组织和肿瘤组织的免疫组织化学染色结果分别在表12和13中显示。同种型和阴性对照没有染色,指示用6b3抗体染色是特异性的。正常组织和肿瘤组织染色模式的代表性图像分别在图13和14中呈现。i.正常组织northern印迹分析先前已揭示pdgf-c转录物在人心、肝、肾、胰腺和卵巢中的大量表达,在大多数其他组织中较低水平的mrna转录物。与此先前的mrna分析一致,在人心、肝、肾、胰腺、子宫、卵巢和前列腺中观察到pdgf-cc蛋白的广泛表达。在正常组织中,主要在上皮细胞的细胞质以及在记录时在基质细胞的细胞质中观察到6b3的染色模式,除卵巢(在那里也见到膜状模式)以外。还观察到内皮细胞的染色(图13)。血管和基质的染色频率倾向于小于正常组织的上皮组分的染色频率,除肠、卵巢、子宫和胎盘(其中基质和血管染色显示相似的阳性染色频率)以外。肾上腺皮质细胞表现出弱到中等的胞质染色。由于在组织核心中没有采样髓质,仅能够报告肾上腺的皮质免疫组织化学染色。在脑中观察到广泛的弱至中度神经元和神经胶质细胞染色。乳腺组织中主要的染色模式是肌上皮细胞,然而,导管细胞也是阳性染色的。脂肪显示较弱的阳性(数据未显示)。在肾中,存在有小管的上皮细胞的广泛染色和肾小球中的壁细胞(parietalcell)的染色。先前还使用多克隆抗体描述了高的肾pdgf-ccmrna水平和肾小囊(bowman’scapsule)的壁上皮细胞、肾小管上皮细胞(亨利(henle)袢、远端小管、集合管)和动脉内皮细胞中的染色。在大肠中,腺体和上皮通常显示弱至中等的染色强度,然而,固有层表现出增加的染色强度。观察到心脏心肌的弱染色和阳性染色血管的低频率,提示虽然先前报告了人心脏的潜在生长因子的高水平mrna,但通常不存在活性pdgf-cc。与先前的mrna分析一致,观察到肝的肝细胞的中等至强染色强度,然而,胆管虽然通常为阳性,但强度较弱。在正常胰腺中观察到类似的模式,其中腺泡表现出具有中等至强烈强度的广泛染色模式,然而导管染色较弱且不太频繁。ii.肿瘤组织在肿瘤细胞的细胞质和膜中观察到pdgf-cc蛋白的免疫染色,通常显示出强的核周染色模式。在血管的内皮细胞中也看到6b3的表达,并且在可评估的任何地方,检查了肿瘤的基质组分的细胞质。肿瘤细胞染色对于所研究的所有肿瘤组织是广泛的,其中通常大于75%的肿瘤细胞表达中等至强烈的染色强度,除胶质母细胞瘤,浸润性小叶癌和前列腺腺癌(其中看到较为异质性的染色模式)外(图14)。此外,不同等级的肿瘤分化间的染色频率和强度之间没有差异。iii.肿瘤与正常组织间的比较通常,与相应的肿瘤细胞染色强度相比,正常组织薄壁组织显示出显著降低的染色强度。例外是肝组织,其中正常肝细胞和原发性肝肿瘤细胞之间的强度差异不明显,以及子宫组织,其中正常腺上皮和子宫肿瘤细胞间染色强度差异不明显。此外,与肿瘤组织相比时,正常组织中阳性染色细胞的频率更低。例外是还是肝脏和子宫组织以及另外是肾、卵巢和脑,其中没有明显的差异。结果共同指示与其各自的肿瘤组织相比,正常组织中的pdgf-cc表达更低,但有一些例外。为了探索正常和肿瘤6b3染色模式之间的明显差异,使用修改的h-评分系统来实现结果的统计分析,其中阳性细胞染色的百分比报告为范围而不是离散数目。基于对修改的h-评分的分析,肿瘤细胞中pdgf-cc的6b3染色与膀胱(p=0.039)、脑神经胶质肉瘤(p<0.001)、乳房浸润性导管癌(p=0.006)、肠(p<0.001)、肾(p=0.008)、胰腺(p<0.001)和前列腺(p=0.001)的其相应的正常商品组织相比显著增加。然而,肿瘤细胞染色和脑胶质母细胞瘤(p=0.26)和乳腺浸润性小叶癌(p=0.87)(两者均表现出非常异质的染色模式),以及肝细胞癌(p=0.26)和子宫腺癌(p=0.59)(其中pdgf-c染色在它们各自的正常上皮组织中也呈强阳性)的其相应正常上皮之间没有显著差异。浸润性小叶癌倾向于生长缓慢且攻击性低于idc,并且ilc患者倾向于比idc患者具有更好的预后。在攻击性较小的肿瘤中pdgf-c表达可以降低的推论对于脑和胶质母细胞瘤(一种非常具有攻击性的脑肿瘤)并不明显。需要进一步分析较大的肿瘤数目以及相关临床信息,以探索此种假设。先前证明pdgf-c的过表达导致pdgf-c转基因小鼠模型中的肝纤维化、皮脂腺病和肝细胞癌。目前免疫组织化学研究中使用的大多数正常肝表现出纤维化或皮脂腺病。这些条件可以解释在“正常”肝中观察到的pdgf-cc的高表达以及它们与肝细胞癌中的pdgf-cc表达水平缺乏任何统计学差异。由于缺乏基质,在许多检查的组织类型中无法评估基质染色比较(表12和13)。与正常乳腺组织中的基质染色相比,浸润性导管(p=0.039)和小叶癌肿瘤(p=0.006)两者中的基质染色显著更高。在正常和肿瘤前列腺组织的基质组分之间看到的染色没有统计学显著差异(p=0.08)。与正常子宫中的基质细胞染色相比,观察到子宫肿瘤基质细胞染色显著减少(p=0.011)。对于膀胱、脑、乳腺、肠、肾、胰腺和前列腺,观察到正常和各自肿瘤组织的血管染色之间的高度显著差异(p<0.0001)。pdgf-c涉及在肿瘤血管生成中起作用,并且与正常血管相比在肿瘤血管中观察到更高的染色将支持这点。在正常和肿瘤肝脏(p=0.39)或子宫(p=0.20)中的血管染色之间观察到的染色模式没有统计学显著差异。总之,如由6b3抗体检测的pdgf-cc在一系列人正常和肿瘤组织中广泛表达。在肿瘤细胞的细胞质和膜、血管内皮细胞和在可评估的情况下基质细胞的细胞质中观察到肿瘤组织中6b3染色的模式。总之,与正常肿瘤组织相比,观察到肿瘤组织中6b3染色水平显著增加。表12-正常人组织组中抗体6b3的pdgf-cc免疫反应性表13-人肿瘤组织组上抗体6b3的pdgf-cc免疫反应性实施例8-体内疗法研究a.结肠癌异种移植物为了研究结肠肿瘤中pdgf-cc表达的体内效应,通过细胞表面和细胞内荧光激活细胞分选(facs)分析筛选几种细胞系。人类结肠癌细胞系colo205使用6b3和12f5抗体证明pdgf-cc的细胞内表达,并且证明细胞表面pdgfrα表达,并且选择用于体内肿瘤异种移植物治疗研究。体内研究在6-7周龄雌性无胸腺balb/c裸鼠(nu/nu等位基因纯合)中进行,所述裸鼠由animalresearchcentre,wa,australia培育。将小鼠维持在高压灭菌的微隔离笼中,并使用单独通气的笼养系统(techniplastivcsystem,italy)将其置于正压容器架中。为了建立异种移植物,将小鼠皮下以2×106ht-29或colo205结肠癌细胞接种到左体侧中。通过facs分析评估这些细胞系,并确认pdgf-rα细胞表面表达和细胞内pdgf-cc表达呈阳性(数据未显示)。一旦肿瘤达到50~100mm3的平均体积,在第0天开始用12f5、6b3或pbs处理作为对照。10只小鼠的组接受100μg、300μg或1.0mg剂量的pbs载体对照或抗体的腹膜内(i.p.)注射,总共9剂,每周3次,持续3或4周。使用公式(长度×宽度2)/2确定肿瘤体积,其中长度是最长轴,并且宽度是与长度成直角的测量。当肿瘤体积达到1000mm3时,出于伦理原因对小鼠实施安乐死。数据表示为每次处理的平均肿瘤体积±se。在第0天和治疗开始后1、2、3或4周从每组处死动物(n=1或2)。通过外科手术从小鼠取出肿瘤异种移植物,切成两分,快速冷冻或在10%(v/v)福尔马林中固定过夜,用于增殖、细胞结构、血管结构和数目的形态学和药效学评估。在图15a中显示了每周三次用300μg抗pdgf-c12f5或6b3处理3周的小鼠中结肠癌异种移植物的结果。在第21天和第24天时治疗2周后,这两种抗体均显著抑制肿瘤生长(p=0.04;配对t检验)。在第25天对pbs对照组进行剔除,以考虑伦理肿瘤负担,防止进一步的功效评估。在使用相同colo205结肠癌异种移植模型的第二个实验中,每周三次施用300μg和1mg剂量的6b3治疗,持续4周的更长时间段。结果显示在图15b中。剂量响应不明显,然而在抗pdgf-cc治疗2周和3周后,在pbs对照和1mg6b3之间再次观察到显著差异(p<0.02,第17天,第24天)。b.colo205异种移植物药效学评估-组织制备、组织学和免疫染色石蜡包埋后,切割并封固4μmcolo205异种移植物切片。将切片在60℃炉中脱石蜡,然后在二甲苯和乙醇中清洗。通过在室温在蒸馏水中的3%(v/v)过氧化氢中温育20分钟来淬灭组织过氧化物酶活性。使用10%柠檬酸盐缓冲液,ph6.0(labvision),使用100℃沸水浴处理切片30分钟以“恢复”抗原。冷却后,使用maxitage蛋白质封闭剂(thermofisher)在室温封闭非特异性结合30分钟。随后,将载玻片转移到载玻片架(thermoshandon)中并使用如下适当的一抗进行显色:通过ki-67染色的细胞增殖将切片与1/100兔抗人ki-67(thermoscientific,rm-9106)在室温温育2小时,用pbs清洗并与抗兔igg-hrp(dako,k4003)温育30分钟。用aec显色20分钟和mayer苏木精染色后显现染色。通过足糖萼蛋白染色评估血管将切片与1μg山羊抗人足糖萼蛋白(r&d,af1556)抗体在室温温育2小时。用pbs清洗后,将切片与生物素化的抗山羊二抗一起温育,并使用vectastainabc试剂盒(vectorlaboratories)根据制造商的说明书显现。使用aperioimagescope载玻片扫描和分析系统捕获所有图像。进行图像分析以确定肿瘤样品内的血管数目和密度和血管周长。结果用colo205异种移植物切片的足糖萼蛋白染色进行血管免疫组织化学鉴定,并且血管数目、周长和血管面积的分析结果在图16(a)-(c)中呈现。分析证明在6b3抗pdgf-cc处理3周和4周后,异种移植物内血管的数目和大小显著减少,并且与pbs对照异种移植物相比,处理组中血管模式也发生变化。这些结果再次提示抗pdgf-cc疗法的抗血管生成活性。使用ki-67标志物评估细胞增殖。使用aperioimagescope核染色算法计数阳性细胞。如通过ki67染色评估的细胞增殖速率的显著差异在pbs对照和6b3处理的异种移植物之间是明显的(图16d),在3周1mg6b3抗pdgf-cc处理后观察到增殖的显著降低。此种观察结果与观察到的延迟的肿瘤生长一致(图15),并且与细胞增殖抑制的体外观察结果一致(图12)。c.mda-mb-231乳腺癌异种移植物人乳腺癌细胞系mda-mb-231、mda-mb-435和mcf-7在正常条件下在补充有10%fbs、100单位/ml青霉素、100μg/ml链霉素和2mm谷氨酰胺的dmem中培养。根据制造商的说明书(superscriptvilocdnasynthesiskit,invitrogen)逆转录rna(1.25μg)。使用kapasybrfastqpcrkitmastermix(2x)universal(kapabiosystems)和rotor-geneq(qiagen)实时pcr热循环仪根据制造商的说明书进行实时定量pcr,总共40个循环。pdgf-c(cat:qt00088935quantitectprimerassay,qiagen),b2m(cat:qt00026551quantitectprimerassay,qiagen,参考基因)。为了进一步分析,选择mda-mb-231细胞,其是公认的乳腺癌模型并且还表现出高pdgf-cmrna水平。为了产生原位肿瘤模型,将2×106个mda-mb-231细胞原位注射到雌性6-8周龄cb17/icr-prkdcscid/crl小鼠(charlesriver)的第4乳腺中。在肿瘤明显可触知(定义为测量超过3mm的最长直径)后,每周两次(300μg/小鼠/剂量)腹膜内施用6b3ig和同种型匹配的对照ig。处理持续7次。每周测量肿瘤大小两次,并且肿瘤体积计算为宽度2x长度xπ/6。在实验结束时,用2.5%阿费丁(avertin)(sigma-aldrich)对小鼠实施安乐死,并用10mlpbs灌注心脏,然后用10ml2%pfa灌注,之后取出肿瘤并如前所述进行切片处理。使用山羊抗小鼠足糖萼蛋白(1:100)(r&dsystems)进行血管染色。在10个均匀分布的视野中,将血管的密度手动计数为血管结构数/40x视野。在第六次处理后,与对照ig处理的动物相比,在6b3处理的小鼠中观察到原位注射mda-mb-231细胞后肿瘤体积的显著减少。总之,用6b3ig处理在第六次处理或三周后导致肿瘤大小显著减少约30%(图17a),这与结肠癌异种移植物模型的观察结果一致。值得注意的是,6b3仅中和人pdgf-cc,证明了肿瘤细胞和邻近基质之间旁分泌信号传导的功能重要性。来自肿瘤的切片的染色揭示了pdgfrα仅在肿瘤基质细胞上发现,可能是侵入小鼠成纤维细胞(数据未显示)。在来自用6b3ig处理的肿瘤的切片中,表达pdgfrα的基质细胞较小,并且未拉伸,而在对照ig处理的肿瘤中,这些细胞更加细长并且显现成纤维细胞的典型模式(现在显示数据)。在6b3和对照ig处理的肿瘤中使用足糖萼蛋白测量微血管密度揭示肿瘤中pdgf-cc信号传导的抑制使微血管密度降低约30%(p<0.05)(图17b)。这些结果揭示,在这种乳腺癌小鼠模型中,pdgf-cc信号传导的限制以显著的方式减少肿瘤的生长,可能是通过减少肿瘤血管的数目。实施例9-通过抗pdgf-c抗体6b3调节pdgf-cc介导的血脑屏障的开放为了证明抗pdgf-c单克隆抗体6b3靶向pdgf-cc介导的脑中血脑屏障开放的能力,在c57bl/6小鼠中腹膜内注射400μg抗pdgf-c单克隆抗体6b3或对照抗体bm4,两者都分开在pbs中稀释至总体积500μl。3-4小时后,随后用异氟烷麻醉注射的小鼠,并且安装在立体定向框中。在进行皮肤手术以暴露头骨之后,在离前卤的中间外侧(ml)0和前后位(ap)-2处在头骨中钻2mm的孔。使用显微注射机器人(neurostar)以1μl/min的速率将在3μlpbs中稀释的1.5μg高度纯化的pdgf-cc核心域蛋白注射到ml0的第3脑室中;离前卤的ap-2和后前位(dv)-2。注射3μlpbs充当对照(pbsicv)。创伤用创伤夹闭合。按照这些程序,将100μl过滤的伊文思蓝溶液注射到每只小鼠的尾静脉中,并使其循环2小时,然后用pbs充分灌注。图中给出的时间点指pdgf-ccicv注射后的时间(3小时、3.5小时和4小时)。拍摄解剖的脑并且外渗伊文思蓝视为脑中剩余的蓝色染料(图18a)。为了定量外渗的伊文思蓝,将脑分别均质化并在每个半球的500μln,n-二甲基甲酰胺中提取。存在于样品的有机n,n-二甲基甲酰胺相中的伊文思蓝染料使用光度计定量,如yepesm,sandkvistm,mooreeg,buggeth,stricklanddk,lawrencedatissue-typeplasminogenactivatorinducesopeningoftheblood-brainbarrierviatheldlreceptor-relatedprotein.jclininvest.112:1533-40,2003中所述,在此引入作为参考(图18b)。简言之,伊文思蓝水平提供下式测定:(a620nm–((a500nm+a740nm)/2))/mg湿重。结果显示与对照抗体bm4(pdgf-ccicv+bm4)相比,当用抗pdgf-c抗体(pdgf-ccicv+6b3)处理小鼠时,pdgf-cc介导的血脑屏障开放和伊文思蓝的外渗显著减少。结果显示了抗pdgf-c抗体6b3的系统性施用有效关闭pdgf-cc诱导其开放后的血脑屏障开放。结果还显示抗体优选必须静脉内施用,因为需要在pdgf-cc介导的信号传导前至少4小时注射以开放血脑屏障,以便使用抗pdgf-c抗体6b3实现对闭合血脑屏障的最大效果并防止伊文思蓝的外渗。来自分离的脑的外渗伊文思蓝的定量证明通过抗pdgf-c抗体6b3闭合pdgf-cc诱导的血脑屏障开放,导致抗体施用后伊文思蓝外渗的显著减少。在pdgf-ccicv前抗pdgf-c抗体6b3和对照抗体bm4的3-4,5小时注射后,使用注射的脑测量伊文思蓝外渗的定量。实施例10.在实验性中风期间治疗性使用6b3(抗pdgfc)a.材料和方法动物,hfd和抗体处理。雄性或雌性c57bl/6ntac-pdgfctm3633(k242t,k246r,r299s,k318r,n342s,a343t)arte小鼠(称为pdgf-cchum)从断奶(出生后3周)起饲喂60%高脂饮食(hfd,researchdiets),持续16周(出生后19周)。用抗pdgfc(6b3)预防性或治疗性处理pdgfchum小鼠。给小鼠腹膜内注射400μg的6b3或同种型匹配的对照抗体(bm4)。缺血性中风的小鼠模型用3%异氟烷麻醉pdgfchum小鼠并且在面罩上维持。然后将小鼠牢固地放置在解剖显微镜(nikonsmz-2t)下。如前所述(参见nagaietal.,j.thromb.haemost.3,1379-1384(2005))暴露左中脑动脉(mca),并且将激光多普勒流动探针(n型(18号),transonicsystems)放置在距离mca分叉处1.5mm背中位的脑皮层表面上。将探针连接到流量计(transonicblf21型),并用连续数据采集程序(windaq,dataqinstruments)记录相关组织灌注单元(tpu)数据。将玫瑰红(fisherscientific)在pbs中稀释至10mg/ml,然后注入尾静脉,最终剂量为50mg/kg。在注射开始时,将3.5mw绿光激光(540nm,mellesgriot)从6cm的距离导向mca,并且记录大脑皮层的tpu。当tpu降至低于闭塞前水平的30%时,实现完全闭塞。评估每搏输出量和出血评分通过ttc评估每搏输出量基本上如所述进行(参见lietal.,neurology54,689-696(2000))。简言之,用3%异氟烷麻醉动物并通过断头术使其安乐死。然后,取出脑并在基质(harvardapparatus)中切成2mm厚的冠状切片,并用pbs中的4%2,3,5-三苯基四唑氯化物(2,3,5-triphenyltetrazoliumchloride,ttc)在室温染色30分钟。梗塞组织显示对ttc没有反应,而健康组织变成砖红色。使用连接到zeisslumar立体显微镜的axiocammrc5(zeiss)彩色相机记录每个脑的四个中央切片的图像,并且使用图像分析系统(nihimagej)分析捕获的图像以采用以下公式计算半球损伤体积百分比:v%stroke=∑(损失面积)/∑(同侧半球面积)*100。为了评估出血评分,然后通过使用血红素评分系统量化四个中央切片的图像:0=无出血,1=1-3个瘀点,2=4-6个瘀点,3=大于6个瘀点,4=大面积出血。总计来自每个脑的8个图像的得分,并计算平均得分/组。b.结果由于脑室内注射活性pdgf-cc蛋白足以诱导bbb开放(参见suetal.,natmed14(7),731–737(2008)),并且已经显示其抑制使急性和进行性实验神经病理学模型中的bbb功能障碍最小化(参见suetal.,natmed14(7),731–737(2008),abramsetal.,plosone7(6),e38760(2012),adzemovicetal.,plosone8(2),e56586(2013),fredrikssonetal.,annclintranslneurol2(7),722–738(2015),lewandowskietal.,actaneuropathol131(3),453–464(2016),suetal.,frontcellneurosci9,385(2015)),我们旨在在实验性中风期间干扰血小板衍生的生长因子(pdgf)-cc信号传导途径。为了分析阻断pdgf-cc是否可以改善脑中动脉闭塞(mcao),产生了中风的动物模型,即人源化小鼠模型。人源化小鼠品系部分含有编码人pdgf-cc氨基酸序列而不是小鼠pdgf-cc氨基酸序列的基因组dna(图19),允许用抗人pdgfc单克隆抗体在体内中和pdgf-cc信号传导(6b3)。用人pdgf-cc替换小鼠pdfg-cc的靶向策略基于ncbi转录物nm_019971_2(图20)。外显子1含有翻译起始密码子。将k242t、k246r和r299s突变引入外显子5。将k318r、n342s和a343t突变引入外显子6。这些突变对应于人氨基酸序列。小鼠基因组片段(获自c57bl/6jrpcib-731bac文库)和选择的特征(如重组位点和选择标志物,如载体图谱上所示,图21)组装成靶向载体。如有必要,通过qpcr扩增另外的片段并亚克隆。最终靶向载体的确认序列在图21中显示。阳性选择标志物的侧翼为frt(新霉素抗性-neor)和f3(嘌呤霉素抗性-puror)位点,并分别插入内含子4和内含子5中。使用来自c57bl/6jrpcib-731bac文库的bac克隆产生靶向载体,并将其转染到taconicartemisc57bl/6ntaces细胞系中。使用双重阳性(neor和puror)和阴性(胸苷激酶-tk)选择分离同源重组克隆。在体外flp介导的选择标志物除去后获得组成性人源化等位基因。此等位基因表达突变的pdgfck242t,k246r,r299s,k318r,n342s,a343t蛋白。剩余的重组位点位于基因组的非保守区域中(图22)。下面显示的是野生型小鼠pdgf-c蛋白质序列和突变形式,其中242k至242t,246k至246r,299r至299s,318k至318r,342n至342s和343a至343t突变标有下划线。初始野生型小鼠pdgf-c蛋白序列(seqidno:104)人源化pdgf-c蛋白序列(seqidno:103)mcao前的6b3处理(预防性处理)为了测试在诱导mcao之前用6b3阻断pdgf-cc是否将显著降低每搏输出量和出血评分,将pdgf-cchum用hfd喂养16周并随后诱导mcao。在mcao诱导前24小时,用6b3(n=12)或bm4(n=14)处理小鼠。在mcao后72小时处死mcao小鼠并使用ttc方法测量每搏输出量。6b3处理的小鼠的中风体积为18.35%+/-2.2%,并且bm4处理的小鼠为29.21+/-1.72%(平均值+/-sem)。使用非配对t检验的p值为0.0006。橙色和红色点指示由于其一般健康状况的恶化,这些小鼠必须分别在mcao后24小时或48小时处死(图23a)。6b3处理的pdgf-cchum的出血得分为5.17+/-0.73,并且bm4处理的小鼠的出血得分为7.93+/-1.04(平均值+/-sem)。使用非配对t检验的p值为0.045。橙色和红色点指示由于其一般健康状况的恶化,这些小鼠必须分别在mcao后24小时或48小时处死(图23b)。总之,在诱导mcao之前用6b3阻断pdgf-cc显著降低每搏输出量和出血评分。mcao后的6b3处理(治疗性处理)为了测试mcao后用6b3阻断pdgf-cc(治疗性处理)是否会显著降低每搏输出量和出血评分,用hfd喂养pdgf-cchum达16周并诱导mcao。mcao诱导后1小时,用6b3(n=13)或bm4(n=13)处理小鼠。在mcao后72小时处死mcao小鼠并使用ttc方法测量每搏输出量。6b3处理的小鼠的中风体积为16.05%+/-1.55%,并且bm4处理的小鼠为27.32+/-2.78%(平均值+/-sem)。使用非配对t检验的p值为0.0017。品红色点指示这些小鼠由于其一般健康状况的恶化而必须在mcao后24小时处死(图24a)。6b3处理的小鼠的出血得分为12+/-0.83,并且bm4处理的小鼠的出血得分为9.69+/-0.84(平均值+/-sem)。使用非配对t检验的p值为0.062。品红色点指示这些小鼠由于其一般健康状况的恶化而必须在mcao后24小时处死(图24b)。总之,在诱导mcao后用6b3阻断pdgf-cc显著降低了每搏输出量,但没有显著改变出血评分。实施例11.人源化抗pdgf-cc抗体6b3(hu6b3)的产生为了使6b3抗体可变域的免疫原性最小化,而保持配体结合特性,进行人源化过程。第一代构建体包含6b3的人可变轻链域的2个变体和6b3的人源化可变重链域的3个变体。这些基于用可用的晶体结构的同源性建模分析产生,所述晶体结构最接近所选择的种系序列。基于以下标准评估可变区氨基酸:·不在cdr中·不改变埋藏的残基·若人共有和人种系两者都具有相同的残基,则进行更改·vl/vh界面外部·如由chothia、tomlinson,padlan鉴定的外部保守残基表达系统基于lonzags表达系统,其使用如由lonzabiologics提供的pee14.4和pee6.4重链和轻链表达载体。将合成的经序列验证的人源化可变轻链和重链域克隆到先前制备的pee14.4ch6b3lc和pee6.4ch6b3hc嵌合igg1k构建体中,替换鼠可变域。构建双重基因载体,然后瞬时转染与人源化重链候选物组合的嵌合轻链以及与嵌合重链组合的人源化轻链候选物。除了杂合构建体之外,还将完全人源化的形式组合并进行分析。通过elisa和生物传感器分析评估6种变体hu-ch6b3产物和hu6b3lc+hc产物对pdgf-cc的结合,并且在所有产物中观察到与亲本鼠6b3抗体相比更低的结合活性。然后,根据以下附加标准评估可变区氨基酸后产生第二代人源化构建体:·将埋藏的残基变为人类种系氨基酸·从小鼠到常见的人种系共有序列的保守变化·根据基于氨基酸结构、侧链相互作用和电荷的对抗原结合的贡献,考虑非保守变化和鼠氨基酸的回复突变。根据通过简并引物从杂交瘤扩增的通常存在的初始mu6b3可变序列,将重链残基甘氨酸g30修饰为精氨酸(r30)。使用密码子优化的序列将hu6b3vl和hu6b3vh工程化改造为全长人igg1k和igg4k背景,以在cho细胞中实现稳定的基因表达。6b3抗pdgf-c抗体的人源化涉及vl中的11个氨基酸的突变(图25)和vh链中的18个氨基酸的突变(图26a和26b)。最终的hu6b3抗体通过elisa表明对重组pdgf-cc的强结合,并且通过生物传感器分析表明高表观亲和力。在体外证实针对pdgf-cc的特异性和中和活性(图27)。通过生物传感器分析分析在2.6nm-333nm的浓度范围内对固定化的pdgf-cc的hu6b3r30和r30g变体表观结合特征。虽然这两种构建体表现出纳摩尔表观结合亲和力,但hu6b3“r”形式表明对pdgf-cc的优异结合特征(图28),并被选为igg1k人源化抗体hu6b3的最终序列。前述示例和优选实施方案的描述应当视为例示,而不是限制由权利要求书限定的本发明。如将容易理解,在不脱离如权利要求书中所阐述的本发明的情况下,可以利用上述特征的许多变化和组合。这些变化不视为脱离本发明的范围,并且所有这些变化旨在包括在所附权利要求书的范围内。本文引用的所有参考文献都通过引用整体并入。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1