基因工程化细胞及其制备方法与流程
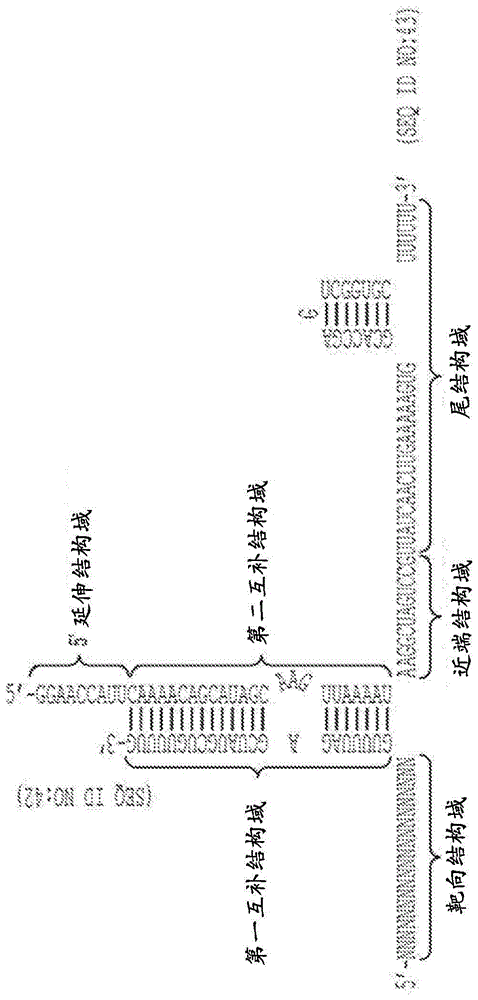
本申请要求2016年5月6日提交的题为“geneticallyengineeredcellsandmethodsofmakingthesame[基因工程化细胞及其制备方法]”的美国临时申请号62/333,144和2016年5月6日提交的题为“crispr-cas-relatedmethods,compositionsandcomponentsforcancerimmunotherapy[用于癌症免疫疗法的crispr-cas相关方法、组合物和组分]”的美国临时申请号62/332,657的优先权,将其各自的内容通过引用以其整体并入。通过引用并入序列表本申请是连同电子格式的序列表一起提交的。序列表被提供为题为735042006440seqlist.txt的文件,创建于2017年5月4日,大小是12,031,926个字节。序列表的电子格式的信息通过引用以其整体并入。本披露涉及用于编辑靶核酸序列或调节靶核酸序列表达的crispr/cas相关方法、组合物和组分,及其与包括工程化t细胞或t细胞前体的过继转移的癌症免疫疗法结合的应用。
背景技术:
:有多种策略可用于产生和给予工程化细胞用于过继疗法。例如,策略可用于工程化表达基因工程化抗原受体(例如car)的免疫细胞,以及用于在细胞中阻抑或阻遏基因表达。需要改善的策略来改善细胞的功效,例如通过在给予受试者时避免效应物功能的阻抑以及改善细胞的活性和/或存活。提供了满足此类需求的方法、细胞、组合物、试剂盒和系统。技术实现要素:提供了组合物,这些组合物包括含有重组受体的工程化免疫细胞和能够诱导pdcd1基因的遗传破坏或编码pd-1多肽的pdcd1基因的遗传破坏的剂(agent),例如用于过继细胞疗法例如以治疗受试者的疾病和/或病症。还提供了用于产生或生成此类组合物或细胞的方法,细胞、细胞群体、组合物,以及使用此类组合物或细胞的方法。这些组合物和细胞通常包括能够诱导pdcd1基因的遗传破坏或者预防或减少其表达或者pdcd1基因的遗传破坏的剂。还提供了用于向受试者给予(例如通过这些方法产生的)所提供的组合物、表达基因工程化(重组)细胞表面受体且含有pdcd1基因的遗传破坏的细胞群体或细胞的方法,例如用于过继细胞疗法以治疗受试者的疾病和/或病症。在一些实施例中,提供了组合物,这些组合物含有(a)含有特异性结合抗原的重组受体的工程化免疫细胞;和(b)能够诱导编码pd-1多肽的pdcd1基因的遗传破坏的剂,其中所述剂能够在该组合物中至少70%、至少75%、至少80%、或至少或大于90%的细胞中,和/或在该组合物中至少70%、至少75%、至少80%、或至少或大于90%的表达该重组受体的细胞中诱导所述遗传破坏,和/或预防或减少pd-1表达。在一些实施例中,提供了组合物,这些组合物含有(a)含有编码特异性结合抗原的重组受体的核酸的工程化免疫细胞;和(b)能够诱导编码pd-1多肽的pdcd1基因的遗传破坏的剂,其中所述剂能够在该组合物中至少70%、至少75%、至少80%、或至少或大于90%的细胞中,和/或在该组合物中至少70%、至少75%、至少80%、或至少或大于90%的表达该重组受体的细胞中诱导所述遗传破坏,和/或预防或减少pd-1表达。在本文提供的一些实施例中,该组合物包括在其表面上表达该重组受体的工程化免疫细胞。在一些实施例中,提供了含有细胞群体的组合物,该细胞群体含有工程化免疫细胞,该工程化免疫细胞含有(a)特异性结合抗原的重组受体;和(b)编码pd-1多肽的pdcd1基因的遗传破坏,所述遗传破坏预防或减少所述pd-1多肽的表达,其中在该组合物中至少约70%、至少约75%、或至少约80%或至少或大于约90%的细胞含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因,不含pdcd1基因,和/或不含功能性pdcd1基因;和/或不表达pd-1多肽;和/或在该组合物中至少约70%、至少约75%、或至少约80%或至少或大于约90%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,和/或不表达pd-1多肽。在一些实施例中,提供了含有细胞群体的组合物,该细胞群体含有工程化免疫细胞,该工程化免疫细胞含有(a)特异性结合抗原的重组受体,其中在该重组受体与所述抗原结合时,该工程化免疫细胞能够诱导细胞毒性、增殖和/或分泌细胞因子;和(b)编码pd-1多肽的pdcd1基因的遗传破坏,所述遗传破坏能够预防或减少所述pd-1多肽的表达,任选地其中所述预防或减少是在该组合物中至少或至少约或大于或大于约70%、75%、80%、85%或90%的细胞中和/或在该组合物中至少或至少约或大于或大于约70%、75%、80%、85%或90%的表达该重组受体的细胞中。在一些实施例中,提供了含有细胞群体的组合物,该细胞群体含有工程化免疫细胞群体,每个工程化免疫细胞含有(a)特异性结合抗原的重组受体;和(b)编码pd-1多肽的pdcd1基因的遗传破坏,其中所述遗传破坏能够预防或减少所述pd-1多肽的表达,其中:平均而言,分别与该组合物中含有该重组受体且不含该遗传破坏的其他细胞中所述重组受体的平均表达和/或表面表达水平相比,这些工程化免疫细胞以相同、大致相同或基本相同的水平表现出该受体的表达和/或表面表达,或这些工程化免疫细胞不表达该pd-1多肽,并且平均而言,分别与该组合物中含有该重组受体且表达该pd-1多肽的细胞中的平均表达和/或表面水平相比,这些工程化免疫细胞以相同、大致相同或基本相同的水平表现出该受体的表达和/或表面表达。在一些实施例中,任选地如在体外测定中所测量的,任选地在任选地包括任选地在一种或多种细胞因子的存在下孵育12、24、36、48或60小时的体外测定中,在与该抗原、表达该抗原的细胞和/或抗原受体活化物质一起孵育时,该重组受体能够特异性结合该抗原,能够活化或刺激工程化t细胞,能够诱导细胞毒性,或能够诱导该免疫细胞的增殖、存活和/或细胞因子分泌。在一些实施例中,任选地如在体外测定中所测量的,该体外测定任选地包括任选地在一种或多种细胞因子的存在下孵育12、24、36、48或60小时且任选地包括或不包括将该免疫细胞暴露于表达pd-l1的细胞,在与该抗原、表达该抗原的细胞和/或抗原受体活化物质一起孵育时,该工程化免疫细胞能够特异性结合该抗原,能够诱导细胞毒性、增殖、存活和/或分泌细胞因子。在一些实施例中,当在相同条件下评估时,该结合、细胞毒性、增殖、存活或细胞因子分泌的水平或程度或范围或持续时间与针对含有该重组受体但不含pdcd1基因的该遗传破坏的免疫细胞检测到或观察到的相比相同、大致相同或基本相同。在一些实施例中,该结合、细胞毒性、增殖、存活和/或细胞因子分泌是在抽出并再次暴露于该抗原、抗原表达细胞和/或物质后如任选地在体外测定中所测量的。在一些实施例中,该免疫细胞是来自受试者的原代细胞。在一些实施例中,该免疫细胞是人细胞。在一些实施例中,该免疫细胞是白细胞,例如nk细胞或t细胞。在一些实施例中,该免疫细胞包含含有未分级的t细胞的多种t细胞,包含分离的cd8+细胞或针对cd8+t细胞进行富集,或包含分离的cd4+t细胞或针对cd4+细胞进行富集,和/或针对其子集进行富集,该子集选自下组,该组由以下组成:原初细胞、效应记忆细胞、中枢记忆细胞、干中枢记忆细胞、效应记忆细胞和长寿效应记忆细胞。在一些实施例中,表现出非活化的长寿记忆或中枢记忆表型的t细胞、或表达该受体且含有该遗传破坏的t细胞在该组合物中的百分比与如下细胞群体相同或基本相同,该细胞群体与该组合物相同或基本相同但不含该遗传破坏或但不表达该pd-1多肽。在一些实施例中,当在相同条件下评估时,任选地在不存在或存在使该免疫细胞接触或暴露于pd-l1的情况下进行比较,表现出非活化的长寿记忆或中枢记忆表型的t细胞在该组合物中的百分比与表现出该表型的t细胞在包含含有该重组受体但不含编码pd-1多肽的pdcd1基因的该遗传破坏的t细胞的组合物中的百分比相比相同、大致相同或基本相同。在一些实施例中,该表型是如将该组合物在或在约37℃±2℃下孵育至少12小时、24小时、48小时、96小时、6天、12天、24天、36天、48天或60天后所评估的。在一些实施例中,该孵育是体外的。在一些实施例中,该孵育的至少一部分是在刺激剂的存在下进行的,该孵育的至少一部分是任选地长达1小时、6小时、24小时或48小时的孵育。在一些实施例中,该刺激剂是能够诱导t细胞、cd4+t细胞和/或cd8+t细胞增殖的剂。在一些实施例中,该刺激剂是或含有对cd3具有特异性的抗体、对cd28具有特异性的抗体和/或细胞因子。在一些实施例中,含有该重组受体的t细胞含有一种或多种选自以下的表型标记:ccr7+、4-1bb+(cd137+)、tim3+、cd27+、cd62l+、cd127+、cd45ra+、cd45ro-、t-bet低、il-7ra+、cd95+、il-2rβ+、cxcr3+或lfa-1+。在一些实施例中,该重组受体是功能性非tcr抗原受体或转基因tcr。在一些实施例中,该重组受体是嵌合抗原受体(car),例如含有抗原结合结构域的car,该抗原结合结构域是抗体或抗体片段。在一些实施例中,该重组受体中含有的抗体片段是单链片段。在一些实施例中,该抗体片段含有通过柔性免疫球蛋白接头连接的抗体可变区。在一些实施例中,该片段含有scfv。在一些实施例中,该抗原与疾病或障碍(例如感染性疾病或病症、自身免疫性疾病、炎性疾病或肿瘤或癌症)相关联。在一些实施例中,该重组受体特异性结合肿瘤抗原。在一些实施例中,该重组受体所结合的抗原选自rorl、her2、ll-cam、cd19、cd20、cd22、间皮素、cea、乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、egfr、egp-2、egp-4、epha2、erbb2、erbb3、erbb4、fbp、胎儿型乙酰胆碱受体、gd2、gd3、hmw-maa、il-22r-α、il-13r-α2、kdr、κ轻链、lewisy、l1-细胞黏附分子(cd171)、mage-a1、间皮素、muc1、muc16、psca、nkg2d配体、ny-eso-1、mart-1、gp100、瘤胚抗原(oncofetalantigen)、tag72、vegf-r2、癌胚抗原(carcinoembryonicantigen,cea)、前列腺特异性抗原、psma、雌激素受体、孕酮受体、肝配蛋白b2、cd123、cs-1、c-met、gd-2、magea3、ce7、肾母细胞瘤1(wt-1)、周期蛋白a1(ccna1)或白细胞介素12。在一些实施例中,该重组受体包含含有itam的细胞内信号传导结构域。在一些实施例中,该细胞内信号传导结构域含有cd3-ζ(cd3ζ)链的细胞内结构域。在一些实施例中,该重组受体进一步含有共刺激信号传导区,例如含有cd28或4-1bb的信号传导结构域的共刺激信号传导区。在一些实施例中,其中能够诱导pdcd1基因的遗传破坏的该剂含有以下中的至少一种:(a)具有与pdcd1基因的靶结构域互补的靶向结构域的至少一种指导rna(grna),或(b)编码该至少一种grna的至少一种核酸。在一些实施例中,该剂含有至少一种cas9分子和grna的复合物,该grna具有与pdcd1基因的靶结构域互补的靶向结构域。在一些实施例中,该指导rna进一步含有第一互补结构域、与该第一互补结构域互补的第二互补结构域、近端结构域和任选地尾结构域。在一些实施例中,该第一互补结构域和第二互补结构域通过连接结构域连接。在一些实施例中,该指导rna含有3'聚-a尾和5'抗反向帽类似物(arca)帽。在一些实施例中,该cas9分子是酶促活性cas9。在一些实施例中,该至少一种grna包括靶向结构域,该靶向结构域含有选自下组的序列,该组由以下组成:gucugggcggugcuacaacu(seqidno:508)、gcccuggccagucgucu(seqidno:514)、cgucugggcggugcuacaac(seqidno:1533)、uguagcaccgcccagacgac(seqidno:579)、cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)。在一些实施例中,该至少一种grna包括靶向结构域,该靶向结构域含有序列cgacuggccagggcgccugu(seqidno:582)。在一些实施例中,该cas9分子是金黄色葡萄球菌(s.aureus)cas9分子。在一些实施例中,该cas9分子是化脓性链球菌(s.pyogenes)cas9。在一些组合物中,该cas9分子缺乏活性ruvc结构域或活性hnh结构域。在一些实施例中,该cas9分子是含有d10a突变的化脓性链球菌cas9分子。在一些实施例中,该cas9分子是含有n863a突变的化脓性链球菌cas9分子。在本文提供的实施例的一些中,该遗传破坏包括双链断裂的产生,该双链断裂通过非同源末端连接(nhej)修复以实现该pdcd1基因中的插入和缺失(indel)。在一些实施例中,在该组合物中至少约70%、至少约75%、或至少约80%的细胞含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;和/或在该组合物中至少约70%、至少约75%、或至少约80%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,或不表达pd-1多肽。在一些实施例中,在该组合物中大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的细胞含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;和/或在该组合物中大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,和/或不表达pd-1多肽。在一些实施例中,基因组中该基因的两个等位基因都被破坏。在一些实施例中,在该组合物中的细胞和/或在该组合物中的表达该重组受体的细胞没有针对含有该遗传破坏的细胞进行富集或选择;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽。在一些实施例中,平均而言,在该组合物中的每个细胞中或在该组合物中的表达该重组受体的每个细胞中不超过2个、不超过5个或不超过10个其他基因被破坏或被该剂破坏,例如在该组合物中的每个细胞中或在该组合物中的表达该重组受体的每个细胞中没有其他基因在该细胞中被破坏或被该剂破坏。在一些实施例中,本文提供的任何组合物进一步含有药学上可接受的缓冲剂。本文还提供了产生基因工程化免疫细胞的方法,该方法包括:(a)向免疫细胞中引入编码特异性结合抗原的重组受体的核酸分子;以及(b)向该免疫细胞中引入能够诱导编码pd-1多肽的pdcd1基因的遗传破坏的剂,该剂包括以下中的一种:(i)具有与该pdcd1基因的靶结构域互补的靶向结构域的至少一种grna或(ii)编码该至少一种grna的至少一种核酸。本文还提供了产生基因工程化免疫细胞的方法,该方法包括向表达特异性结合抗原的重组受体的免疫细胞中引入能够诱导编码pd-1多肽的pdcd1基因的遗传破坏的剂,该剂包括以下中的一种:(i)具有与该pdcd1基因的靶结构域互补的靶向结构域的至少一种grna或(ii)编码该至少一种grna的至少一种核酸。在一些实施例中,该剂包括至少一种cas9分子和grna的复合物,该grna具有与pdcd1基因的靶结构域互补的靶向结构域。在一些实施例中,该指导rna进一步包括第一互补结构域、与该第一互补结构域互补的第二互补结构域、近端结构域和任选地尾结构域。在一些实施例中,该第一互补结构域和第二互补结构域通过连接结构域连接。在一些实施例中,该指导rna包括3'聚-a尾和5'抗反向帽类似物(arca)帽。在一些实施例中,引入包括在体外使这些细胞与该剂或其一部分接触。在一些实施例中,该剂的引入包括电穿孔。在一些实施例中,该引入进一步包括在这些细胞与该剂接触之前、期间或之后,或在该电穿孔之前、期间或之后,在体外孵育这些细胞。在一些实施例中,(a)中的该引入包括转导,并且该引入进一步包括在该转导之前、期间或之后,在体外孵育这些细胞。在一些实施例中,该孵育的至少一部分是在如下的存在下:(i)选自由il-2、il-7和il-15组成的组的细胞因子,和/或(ii)任选地包括抗cd3和/或抗cd28抗体的一种或多种刺激剂或活化剂。在一些实施例中,(a)中的该引入包括:在转导之前,将这些细胞与浓度为20u/ml至200u/ml、任选地约100u/ml的il-2一起孵育;与浓度为1ng/ml至50ng/ml、任选地约10ng/ml的il-7一起孵育,和/或与浓度为0.5ng/ml至20ng/ml、任选地约5ng/ml的il-15一起孵育;以及在转导之后,将这些细胞与浓度为10u/ml至200u/ml、任选地约50u/ml的il-2一起孵育;与浓度为0.5ng/ml至20ng/ml、任选地约5ng/ml的il-7一起孵育,和/或与浓度为0.1ng/ml至10ng/ml、任选地约0.5ng/ml的il-15一起孵育。在一些实施例中,该孵育独立地进行长达或大约24小时、36小时、48小时、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天或21天,例如24-48小时或36-48小时。在一些实施例中,使这些细胞与该剂以大约1微克/100,000、200,000、300,000、400,000、或500,000个细胞的比率接触。在一些实施例中,该孵育处于30℃±2℃至39℃±2℃的温度;或该孵育处于至少或约至少30℃±2℃、32℃±2℃、34℃±2℃或37℃±2℃的温度。在一些实施例中,该孵育的至少一部分处于30℃±2℃,并且该孵育的至少一部分处于37℃±2℃。在一些实施例中,该方法进一步包括在(a)中的该引入和(b)中的该引入之间使这些细胞静置。在本文提供的任何此类实施例的一些中,该cas9分子是酶促活性cas9。在一些实施例中,该至少一种grna包括靶向结构域,该靶向结构域包括选自下组的序列,该组由以下组成:gucugggcggugcuacaacu(seqidno:508)、gcccuggccagucgucu(seqidno:514)、cgucugggcggugcuacaac(seqidno:1533)、uguagcaccgcccagacgac(seqidno:579)、cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)。在一些实施例中,59-78,该至少一种grna包括靶向结构域,该靶向结构域包括序列cgacuggccagggcgccugu(seqidno:582)。在一些实施例中,该cas9分子是金黄色葡萄球菌cas9分子。在一些实施例中,该cas9分子是化脓性链球菌cas9。在一些实施例中,该cas9分子缺乏活性ruvc结构域或活性hnh结构域。在一些实施例中,该cas9分子是包括d10a突变的化脓性链球菌cas9分子。在一些实施例中,该cas9分子是包括n863a突变的化脓性链球菌cas9分子。在一些实施例中,该遗传破坏包括双链断裂的产生,该双链断裂通过非同源末端连接(nhej)修复以实现该pdcd1基因中的插入和缺失(indel)。在一些实施例中,该重组受体是功能性非tcr抗原受体或转基因tcr。在一些实施例中,该重组受体是嵌合抗原受体(car)。在一些实施例中,该car包括抗原结合结构域,该抗原结合结构域是抗体或抗体片段。在一些实施例中,该抗体片段是单链片段。在一些实施例中,该抗体片段包括通过柔性免疫球蛋白接头连接的抗体可变区。在一些实施例中,该片段包括scfv。在一些实施例中,该抗原与疾病或障碍(例如感染性疾病或病症、自身免疫性疾病、炎性疾病或肿瘤或癌症)相关联。在一些实施例中,该重组受体特异性结合肿瘤抗原。在一些实施例中,该重组受体所结合的抗原选自rorl、her2、ll-cam、cd19、cd20、cd22、间皮素、cea、乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、egfr、egp-2、egp-4、epha2、erbb2、erbb3、erbb4、fbp、胎儿型乙酰胆碱受体、gd2、gd3、hmw-maa、il-22r-α、il-13r-α2、kdr、κ轻链、lewisy、l1-细胞黏附分子(cd171)、mage-a1、间皮素、muc1、muc16、psca、nkg2d配体、ny-eso-1、mart-1、gp100、瘤胚抗原、tag72、vegf-r2、癌胚抗原(cea)、前列腺特异性抗原、psma、雌激素受体、孕酮受体、肝配蛋白b2、cd123、cs-1、c-met、gd-2、magea3、ce7、肾母细胞瘤1(wt-1)、周期蛋白a1(ccna1)或白细胞介素12。在一些实施例中,该重组受体包括包含itam的细胞内信号传导结构域。在一些实施例中,该细胞内信号传导结构域包括cd3-ζ(cd3ζ)链的细胞内结构域。在一些实施例中,该重组受体进一步包括共刺激信号传导区,例如包括cd28或4-1bb的信号传导结构域的共刺激信号传导区。在一些实施例中,编码该重组受体的核酸是病毒载体,例如逆转录病毒载体。在一些实施例中,该病毒载体是慢病毒载体或γ逆转录病毒载体。在一些实施例中,编码该重组载体的核酸的引入是通过转导,该转导任选地是逆转录病毒转导。在一些实施例中,该免疫细胞是来自受试者的原代细胞。在一些实施例中,该免疫细胞是人细胞。在一些实施例中,该免疫细胞是白细胞,例如nk细胞或t细胞。在一些实施例中,该免疫细胞是t细胞,该t细胞是未分级的t细胞、分离的cd8+t细胞或分离的cd4+t细胞。在一些实施例中,本文提供的任何方法在多种免疫细胞上进行。在一些实施例中,在引入该剂和引入该重组受体之后,细胞没有针对以下进行富集或选择:(a)包括该遗传破坏或不表达该内源性pd-1多肽的细胞,(b)表达该重组受体的细胞,或(a)和(b)两者。在一些实施例中,任何方法进一步包括针对以下进行富集或选择:(a)包括该遗传破坏或不表达该内源性pd-1多肽的细胞,(b)表达该重组受体的细胞,或(a)和(b)两者。在一些实施例中,任何方法进一步包括在或约在37℃±2℃下孵育这些细胞。在一些实施例中,该孵育进行以下时间:在1小时或约1小时与96小时或约96小时之间、在4小时或约4小时与72小时或约72小时之间、在8小时或约8小时与48小时或约48小时之间、在12小时或约12小时与36小时或约36小时之间、在6小时或约6小时与24小时或约24小时之间、在36小时或约36小时与96小时或约96小时之间,包括端值。在一些实施例中,该孵育或该孵育的一部分在刺激剂的存在下进行。在一些实施例中,刺激剂是能够诱导t细胞、cd4+t细胞和/或cd8+t细胞增殖的剂。在一些实施例中,该刺激剂是或包括对cd3具有特异性的抗体、对cd28具有特异性的抗体和/或细胞因子。在一些实施例中,本文提供的任何方法进一步包括将由该方法产生的细胞在药学上可接受的缓冲剂中配制。在一些实施例中,本文提供的任何方法产生细胞群体,其中:至少约70%、至少约75%、或至少约80%的细胞既1)包括该遗传破坏;不表达该内源性pd-1多肽;不包括连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;又2)表达该重组受体;或至少约70%、至少约75%、或至少约80%的表达该重组受体的细胞包括该遗传破坏,不表达该内源性pd-1多肽,或不表达pd-1多肽。在一些实施例中,本文提供的任何方法产生细胞群体,其中:大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的细胞既1)包括该遗传破坏;不表达该内源性pd-1多肽;不包括连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;又2)表达该重组受体;和/或大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的表达该重组受体的细胞包括该遗传破坏,不表达该内源性pd-1多肽,和/或不表达pd-1多肽。在本文提供的任何方法的一些实施例中,基因组中该基因的两个等位基因都被破坏。在一些实施例中,还提供了通过本文提供的任何方法产生的基因工程化免疫细胞。在一些实施例中,还提供了通过本文提供的任何方法产生的多种基因工程化免疫细胞。在一些实施例中,提供了此类基因工程化免疫细胞,其中:至少约70%、至少约75%、或至少约80%的细胞既1)包括该遗传破坏;不表达该内源性pd-1多肽;不包括连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;又2)表达该重组受体;或至少约70%、至少约75%、或至少约80%的表达该重组受体的细胞包括该遗传破坏,不表达该内源性pd-1多肽,或不表达pd-1多肽。在一些实施例中,提供了多种基因工程化免疫细胞,其中:大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的细胞既1)包括该遗传破坏;不表达该内源性pd-1多肽;不包括连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;又2)表达该重组受体;和/或大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的表达该重组受体的细胞包括该遗传破坏,不表达该内源性pd-1多肽,和/或不表达pd-1多肽。在一些实施例中,还提供了组合物,这些组合物包括本文提供的任何基因工程化免疫细胞或本文提供的任何多种基因工程化免疫细胞和任选地药学上可接受的缓冲剂。在一些实施例中,还提供了治疗方法,这些治疗方法包括向患有疾病或病症的受试者给予本文提供的任何组合物。在一些实施例中,该重组受体特异性结合与该疾病或病症(例如癌症、肿瘤、自身免疫性疾病或障碍、或感染性疾病)相关联的抗原。在一些实施例中,还提供了本文提供的任何药物组合物,用于治疗受试者的疾病或病症。在一些实施例中,在任何使用的药物组合物中,该重组受体特异性结合与该疾病或病症(例如癌症、肿瘤、自身免疫性疾病或障碍、或感染性疾病)相关联的抗原。本文提供了改变t细胞的方法,该方法包括使该t细胞与一种或多种cas9分子/grna分子复合物接触,其中在该一种或多种cas9分子/grna分子复合物中的一种或多种grna分子含有与来自该pdcd1基因的靶结构域互补的靶向结构域。在一些实施例中,该t细胞来自患有癌症的受试者。在一些实例中,该癌症选自下组,该组由以下组成:淋巴瘤、慢性淋巴细胞白血病(cll)、b细胞急性淋巴细胞白血病(b-all)、急性成淋巴细胞性白血病、急性髓性白血病、非霍奇金淋巴瘤(nhl)、弥漫性大细胞淋巴瘤(dlcl)、多发性骨髓瘤、肾细胞癌(rcc)、神经母细胞瘤、结肠直肠癌、乳腺癌、卵巢癌、黑色素瘤、肉瘤、前列腺癌、肺癌、食管癌、肝细胞癌、胰腺癌、星形细胞瘤、间皮瘤、头颈癌、和髓母细胞瘤。在任何此类实施例的一些中,该t细胞来自患有癌症或者否则可以受益于该pdcd1基因的t细胞靶位置处的突变的受试者。在任何此类实施例的一些中,该接触是离体进行的。在任何此类实施例的一些中,在该接触步骤之后将该改变的t细胞返回到该受试者的身体。在任何此类实施例的一些中,该t细胞来自患有癌症的受试者,该接触是离体进行的,并且在该接触步骤后将该改变的t细胞返回到该受试者的身体。在任何此类实施例的一些中,该一种或多种cas9分子/grna分子复合物在该接触之前形成。在任何此类实施例的一些中,该一种或多种grna分子含有与来自seqidno:481-555、563-1516、1517-3748、14657-16670、和16671-21037中的任一个的靶向结构域相同或相差不超过3个核苷酸的靶向结构域。在一些实施例中,该一种或多种grna分子含有选自seqidno:563-1516的靶向结构域。在一些情况下,该一种或多种grna分子含有选自seqidno:1517-3748的靶向结构域。在一些例子中,该一种或多种grna分子含有选自seqidno:14657-16670的靶向结构域。在一些方面中,该一种或多种grna分子含有选自seqidno:16671-21037的靶向结构域。在一些实施例中,该一种或多种grna分子含有选自seqidno:481-500和508-547的靶向结构域。在一些情况下,该一种或多种grna分子含有选自seqidno:501-507和548-555的靶向结构域。在一些实施例中,该一种或多种grna分子含有选自seqidno:508、514、576、579、582、和723的靶向结构域。在一些情况下,该一种或多种grna分子含有选自seqidno:508、510、511、512、514、576、579、581、582、766、和723的靶向结构域。在任何此类实施例的一些中,该一种或多种grna分子在其5'末端被修饰或含有3’聚a尾。在任何此类实施例的一些中,该一种或多种grna分子在其5'末端被修饰且含有3’聚a尾。在一些例子中,该一种或多种grna分子缺乏5'三磷酸酯基团。在一些方面中,该一种或多种grna分子包括5'帽。在一些情况下,该5'帽含有修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。在一些例子中,该5'帽含有两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。在任何此类实施例的一些中,该3'聚a尾包括约10至约30个腺嘌呤核苷酸。在任何此类实施例的一些中,该3'聚a尾包括约20个腺嘌呤核苷酸。在一些实施例中,包括该3'聚a尾的一种或多种grna分子通过体外转录从dna模板制备。在一些实施例中,该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板包括紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。在一些情况下,该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包括紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。在任何此类实施例的一些中,该一种或多种cas9分子/grna分子复合物经由电穿孔被递送至该t细胞中。在任何此类实施例的一些中,该一种或多种grna分子含有与来自该pdcd1基因的靶结构域互补的靶向结构域,并且其中该一种或多种grna分子指导该cas9分子以至少40%的切割效率来切割该靶结构域。在一些例子中,使用标记的抗pdcd1抗体和流式细胞术来确定该切割效率。在一些实施例中,该cas9分子由单种grna分子指导并以单个双链断裂来切割该靶结构域。在一些实例中,该cas9分子是化脓性链球菌cas9分子。在一些实施例中,该单种grna分子包括选自以下靶向结构域的靶向结构域:gucugggcggugcuacaacu(seqidno:508);gcccuggccagucgucu(seqidno:514);cgucugggcggugcuacaac(seqidno:576);uguagcaccgcccagacgac(seqidno:579);cgacuggccagggcgccugu(seqidno:582);或caccuaccuaagaaccaucc(seqidno:723)。在一些实施例中,该cas9分子是切口酶,并且两种cas9分子/grna分子复合物由两种不同的grna分子指导,以在该靶结构域的相对链上以两个单链断裂来切割该靶结构域。在一些情况下,该cas9分子是化脓性链球菌cas9分子。在一些例子中,该化脓性链球菌cas9分子具有d10a突变。在一些实施例中,该两种grna分子包括选自以下靶向结构域对的靶向结构域:cgacuggccagggcgccugu(seqidno:582)和gucugggcggugcuacaacu(seqidno:508);cgacuggccagggcgccugu(seqidno:582)和gggcggugcuacaacugggc(seqidno:510);cgacuggccagggcgccugu(seqidno:582)和ggccaggaugguucuuaggu(seqidno:511);cgacuggccagggcgccugu(seqidno:582)和ggaugguucuuagguaggug(seqidno:512);cgacuggccagggcgccugu(seqidno:582)和cgucugggcggugcuacaac(seqidno:576);cgacuggccagggcgccugu(seqidno:582)和cuacaacugggcuggcggcc(seqidno:766);uguagcaccgcccagacgac(seqidno:579)和ggccaggaugguucuuaggu(seqidno:511);uguagcaccgcccagacgac(seqidno:579)和ggaugguucuuagguaggug(seqidno:512);或accgcccagacgacuggcca(seqidno:581)和ggccaggaugguucuuaggu(seqidno:511)。在一些情况下,该化脓性链球菌cas9分子具有n863a突变。在一些实施例中,该两种grna分子包括选自以下靶向结构域对的靶向结构域:cgacuggccagggcgccugu(seqidno:582)和gucugggcggugcuacaacu(seqidno:508);cgacuggccagggcgccugu(seqidno:582)和gggcggugcuacaacugggc(seqidno:510);或cgacuggccagggcgccugu(seqidno:582)和ggccaggaugguucuuaggu(seqidno:511)。在任何此类实施例的一些中,该一种或多种grna分子是一种或多种模块化grna分子。在任何此类实施例的一些中,该一种或多种grna分子是一种或多种嵌合grna分子。在一些实施例中,该一种或多种grna分子从5'至3'包括:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。在一些情况下,该一种或多种grna分子含有长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。在任何此类实施例的一些中,该一种或多种grna分子指导该cas9分子以至少60%的切割效率来切割该靶结构域。在任何此类实施例的一些中,该一种或多种grna分子指导该cas9分子以至少80%的切割效率来切割该靶结构域。在任何此类实施例的一些中,该一种或多种grna分子指导该cas9分子以至少90%的切割效率来切割该靶结构域。在任何此类实施例的一些中,该一种或多种cas9分子/grna分子复合物产生少于5个脱靶。在任何此类实施例的一些中,该一种或多种cas9分子/grna分子复合物产生少于2个外显子脱靶。在一些方面中,脱靶通过guide-seq鉴定。在一些例子中,脱靶通过amp-seq鉴定。本文提供了cas9分子/grna分子复合物,其中该grna分子含有与来自该pdcd1基因的靶结构域互补的靶向结构域,并且该grna分子在其5'末端被修饰和/或含有3'聚a尾。在一些实施例中,该grna分子含有与来自seqidno:481-555、563-1516、1517-3748、14657-16670、和16671-21037的靶向结构域相同或相差不超过3个核苷酸的靶向结构域。在一些方面中,该grna分子含有选自seqidno:563-1516的靶向结构域。在一些例子中,该grna分子含有选自seqidno:1517-3748的靶向结构域。在一些情况下,该grna分子含有选自seqidno:14657-16670的靶向结构域。在一些情况下,该grna分子含有选自seqidno:16671-21037的靶向结构域。在一些实施例中,该grna分子含有选自seqidno:481-500和508-547的靶向结构域。在一些例子中,该grna分子含有选自seqidno:501-507和548-555的靶向结构域。在一些方面中,该grna分子含有选自seqidno:508、514、576、579、582、和723的靶向结构域。在一些情况下,该grna分子含有选自seqidno:508、510、511、512、514、576、579、581、582、766、和723的靶向结构域。在任何此类实施例的一些中,该grna分子在其5'末端被修饰。在一些情况下,该grna分子缺乏5'三磷酸酯基团。在一些例子中,该grna分子包括5'帽。在一些实施例中,该5'帽含有修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。在一些情况下,该5'帽含有两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。在任何此类实施例的一些中,该3'聚a尾包括约10至约30个腺嘌呤核苷酸。在任何此类实施例的一些中,该3'聚a尾包括约20个腺嘌呤核苷酸。在一些方面中,包括该3'聚a尾的grna分子通过体外转录从dna模板制备。在一些实施例中,该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板含有紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。在一些例子中,该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包括紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。在任何此类实施例的一些中,该cas9分子以双链断裂来切割靶结构域。在一些实例中,该cas9分子是化脓性链球菌cas9分子。在一些情况下,该靶向结构域选自以下靶向结构域的组:gucugggcggugcuacaacu(seqidno:508);gcccuggccagucgucu(seqidno:514);cgucugggcggugcuacaac(seqidno:576);uguagcaccgcccagacgac(seqidno:579);cgacuggccagggcgccugu(seqidno:582);或caccuaccuaagaaccaucc(seqidno:723)。在任何此类实施例的一些中,该cas9分子以单链断裂来切割靶结构域。在一些情况下,该cas9分子是化脓性链球菌cas9分子。在一些实例中,该化脓性链球菌cas9分子具有d10a突变。在一些情况下,该靶向结构域选自以下靶向结构域的组:cgacuggccagggcgccugu(seqidno:582)和gucugggcggugcuacaacu(seqidno:508);cgacuggccagggcgccugu(seqidno:582)和gggcggugcuacaacugggc(seqidno:510);cgacuggccagggcgccugu(seqidno:582)和ggccaggaugguucuuaggu(seqidno:511);cgacuggccagggcgccugu(seqidno:582)和ggaugguucuuagguaggug(seqidno:512);cgacuggccagggcgccugu(seqidno:582)和cgucugggcggugcuacaac(seqidno:576);cgacuggccagggcgccugu(seqidno:582)和cuacaacugggcuggcggcc(seqidno:766);uguagcaccgcccagacgac(seqidno:579)和ggccaggaugguucuuaggu(seqidno:511);uguagcaccgcccagacgac(seqidno:579)和ggaugguucuuagguaggug(seqidno:512);或accgcccagacgacuggcca(seqidno:581)和ggccaggaugguucuuaggu(seqidno:511)。在一些例子中,该化脓性链球菌cas9分子具有n863a突变。在一些实施例中,该靶向结构域选自以下靶向结构域的组:cgacuggccagggcgccugu(seqidno:582)和gucugggcggugcuacaacu(seqidno:508);cgacuggccagggcgccugu(seqidno:582)和gggcggugcuacaacugggc(seqidno:510);或cgacuggccagggcgccugu(seqidno:582)和ggccaggaugguucuuaggu(seqidno:511)。在任何此类实施例的一些中,该grna分子是模块化grna分子。在任何此类实施例的一些中,该grna分子是嵌合grna分子。在一些实施例中,该grna分子从5'至3'包括:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。在一些方面中,该grna分子含有长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。本文提供了grna分子,该grna分子含有与来自该pdcd1基因的靶结构域互补的靶向结构域,其中该grna分子在其5'末端被修饰和/或含有3'聚a尾。在一些实施例中,该grna分子含有与来自seqidno:481-555、563-1516、1517-3748、14657-16670、和16671-21037中的任一个的靶向结构域相同或相差不超过3个核苷酸的靶向结构域。在一些情况下,该grna分子含有选自seqidno:563-1516的靶向结构域。在一些情况下,该grna分子含有选自seqidno:1517-3748的靶向结构域。在一些实例中,该grna分子含有选自seqidno:14657-16670的靶向结构域。在一些方面中,该grna分子含有选自seqidno:16671-21037的靶向结构域。在一些实施例中,该grna分子含有选自seqidno:481-500和508-547的靶向结构域。在一些情况下,该grna分子含有选自seqidno:501-507和548-555的靶向结构域。在一些例子中,该grna分子含有选自seqidno:508、514、576、579、582、和723的靶向结构域。在一些实施例中,该grna分子含有选自seqidno:508、510、511、512、514、576、579、581、582、766、和723的靶向结构域。在任何此类实施例的一些中,该grna分子在其5'末端被修饰。在一些情况下,该grna分子缺乏5'三磷酸酯基团。在一些方面中,该grna分子包括5'帽。在一些实例中,该5'帽含有修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。在一些实施例中,该5'帽含有两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。在任何此类实施例的一些中,该grna分子包括含有约10至约30个腺嘌呤核苷酸的3'聚a尾。在任何此类实施例的一些中,该grna分子包含含有约20个腺嘌呤核苷酸的3'聚a尾。在一些实施例中,包括该3'聚a尾的grna分子通过体外转录从dna模板制备。在一些例子中,该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板含有紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。在一些情况下,该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包括紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。在任何此类实施例的一些中,该grna分子是化脓性链球菌grna分子。在一些实施例中,该靶向结构域选自以下靶向结构域的组:gucugggcggugcuacaacu(seqidno:508);gcccuggccagucgucu(seqidno:514);cgucugggcggugcuacaac(seqidno:576);uguagcaccgcccagacgac(seqidno:579);cgacuggccagggcgccugu(seqidno:582);或caccuaccuaagaaccaucc(seqidno:723)。在一些情况下,该靶向结构域选自以下靶向结构域的组:gcccuggccagucgucu(seqidno:514);或caccuaccuaagaaccaucc(seqidno:723)。在一些例子中,该靶向结构域选自以下靶向结构域的组:gggcggugcuacaacugggc(seqidno:510);ggccaggaugguucuuaggu(seqidno:511);ggaugguucuuagguaggug(seqidno:512);accgcccagacgacuggcca(seqidno:581)和cuacaacugggcuggcggcc(seqidno:766)。在一些例子中,该靶向结构域选自以下靶向结构域的组:ggccaggaugguucuuaggu(seqidno:511);ggaugguucuuagguaggug(seqidno:512);cuacaacugggcuggcggcc(seqidno:766)。在任何此类实施例的一些中,该grna分子是模块化grna分子。在任何此类实施例的一些中,该grna分子是嵌合grna分子。在一些实施例中,该grna分子从5'至3'含有:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。在一些实施例中,该grna分子含有长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。本文提供了制备用于植入的细胞的方法,该方法包括使该细胞与一种或多种cas9分子/grna分子复合物接触,其中在该一种或多种cas9分子/grna分子复合物中的一种或多种grna分子含有与来自该pdcd1基因的靶结构域互补的靶向结构域。在一些情况下,该一种或多种grna分子含有与来自该pdcd1基因的靶结构域互补的靶向结构域,并且其中该一种或多种grna分子指导该cas9分子以至少40%的切割效率来切割该靶结构域。在一些方面中,使用标记的抗pdcd1抗体和流式细胞术来确定该切割效率。在任何此类实施例的一些中,该一种或多种grna分子在其5'末端被修饰或包括3’聚a尾。在任何此类实施例的一些中,该一种或多种grna分子在其5'末端被修饰且包括3’聚a尾。在一些实施例中,该一种或多种grna分子缺乏5'三磷酸酯基团。在一些实例中,该一种或多种grna分子包括5'帽。在一些情况下,该5'帽含有修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。在一些实施例中,该5'帽含有两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。在任何此类实施例的一些中,该3'聚a尾含有约10至约30个腺嘌呤核苷酸。在任何此类实施例的一些中,该3'聚a尾含有约20个腺嘌呤核苷酸。在一些情况下,包括该3'聚a尾的一种或多种grna分子通过体外转录从dna模板制备。在一些实施例中,该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板包括紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。在一些情况下,该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包括紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。在任何此类实施例的一些中,该一种或多种cas9分子/grna分子复合物经由电穿孔被递送至该细胞中。在任何此类实施例的一些中,该cas9分子由单种grna分子指导并以单个双链断裂来切割该靶结构域。在一些实施例中,该cas9分子是化脓性链球菌cas9分子。在一些实施例中,该单种grna分子含有选自以下靶向结构域的靶向结构域:gucugggcggugcuacaacu(seqidno:508);gcccuggccagucgucu(seqidno:514);cgucugggcggugcuacaac(seqidno:576);uguagcaccgcccagacgac(seqidno:579);cgacuggccagggcgccugu(seqidno:582);或caccuaccuaagaaccaucc(seqidno:723)。在任何此类实施例的一些中,该cas9分子是切口酶,并且两种cas9分子/grna分子复合物由两种不同的grna分子指导,以在该靶结构域的相对链上以两个单链断裂来切割该靶结构域。在一些实施例中,该cas9分子是具有d10a突变的化脓性链球菌cas9分子。在一些实例中,该两种grna分子包括选自以下靶向结构域对的靶向结构域:cgacuggccagggcgccugu(seqidno:582)和gucugggcggugcuacaacu(seqidno:508);cgacuggccagggcgccugu(seqidno:582)和gggcggugcuacaacugggc(seqidno:510);cgacuggccagggcgccugu(seqidno:582)和ggccaggaugguucuuaggu(seqidno:511);cgacuggccagggcgccugu(seqidno:582)和ggaugguucuuagguaggug(seqidno:512);cgacuggccagggcgccugu(seqidno:582)和cgucugggcggugcuacaac(seqidno:576);cgacuggccagggcgccugu(seqidno:582)和cuacaacugggcuggcggcc(seqidno:766);uguagcaccgcccagacgac(seqidno:579)和ggccaggaugguucuuaggu(seqidno:511);uguagcaccgcccagacgac(seqidno:579)和ggaugguucuuagguaggug(seqidno:512);或accgcccagacgacuggcca(seqidno:581)和ggccaggaugguucuuaggu(seqidno:511)。在一些例子中,该化脓性链球菌cas9分子具有n863a突变。在一些实施例中,该两种grna分子包括选自以下靶向结构域对的靶向结构域:cgacuggccagggcgccugu(seqidno:582)和gucugggcggugcuacaacu(seqidno:508);cgacuggccagggcgccugu(seqidno:582)和gggcggugcuacaacugggc(seqidno:510);或cgacuggccagggcgccugu(seqidno:582)和ggccaggaugguucuuaggu(seqidno:511)。在任何此类实施例的一些中,该一种或多种grna分子是一种或多种模块化grna分子。在任何此类实施例的一些中,该一种或多种grna分子是一种或多种嵌合grna分子。在一些实例中,该一种或多种grna分子从5'至3'含有:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。在一些例子中,该一种或多种grna分子含有长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。在任何此类实施例的一些中,该一种或多种grna分子指导该cas9分子以至少60%的切割效率来切割该靶结构域。在任何此类实施例的一些中,该一种或多种grna分子指导该cas9分子以至少80%的切割效率来切割该靶结构域。在任何此类实施例的一些中,该一种或多种grna分子指导该cas9分子以至少90%的切割效率来切割该靶结构域。在任何此类实施例的一些中,该一种或多种cas9分子/grna分子复合物产生少于5个脱靶。在任何此类实施例的一些中,该一种或多种cas9分子/grna分子复合物产生少于2个外显子脱靶。在一些方面中,脱靶通过guide-seq鉴定。在一些实例中,脱靶通过amp-seq鉴定。附图说明首先简要描述附图。图1a-1g是若干种示例性grna的图示。图1a描绘了部分地来源于(或部分地在序列上建模)化脓性链球菌(streptococcuspyogenes,s.pyogenes)的呈双链体结构(按出现的顺序分别为seqidno:42和43)的模块化grna分子;图1b描绘了部分地来源于化脓性链球菌的呈双链体结构(seqidno:44)的单分子(或嵌合)grna分子;图1c描绘了部分地来源于化脓性链球菌的呈双链体结构(seqidno:45)的单分子grna分子;图1d描绘了部分地来源于化脓性链球菌的呈双链体结构(seqidno:46)的单分子grna分子;图1e描绘了部分地来源于化脓性链球菌的呈双链体结构(seqidno:47)的单分子grna分子;图1f描绘了部分地来源于嗜热链球菌(streptococcusthermophilus,s.thermophilus)的呈双链体结构(按出现的顺序分别为seqidno:48和49)的模块化grna分子;图1g描绘了化脓性链球菌和嗜热链球菌的模块化grna分子(按出现的顺序分别为seqidno:50-53)的比对。图2a-2g描绘了来自chylinski等人(rnabiol.[rna生物学]2013;10(5):726–737)的cas9序列的比对。将n-末端ruvc样结构域加框并用“y”指示。将另外两个ruvc样结构域加框并用“b”指示。将hnh样结构域加框并用“g”指示。sm:变异链球菌(s.mutans)(seqidno:1);sp:化脓性链球菌(seqidno:2);st:嗜热链球菌(seqidno:3);li:无害李斯特菌(l.innocua)(seqidno:4)。基序:这是基于四个序列的基序:将所有四个序列中保守的残基用单字母氨基酸缩写指示;“*”指示在四个序列中任一个的对应位置发现的任何氨基酸;并且“-”指示任何氨基酸,例如20种天然存在的氨基酸中的任一种。图3a-3b显示了来自chylinski等人中披露的cas9分子的n-末端ruvc样结构域(按出现的顺序分别为seqidno:54-103)的比对。图3b的最后一行鉴定了4个高度保守的残基。图4a-4b显示了来自chylinski等人中披露的cas9分子的n-末端ruvc样结构域(其中除去了序列异常值)(按出现的顺序分别为seqidno:104-177)的比对。图4b的最后一行鉴定了3个高度保守的残基。图5a-5c显示了来自chylinski等人中披露的cas9分子的hnh样结构域(按出现的顺序分别为seqidno:178-252)的比对。图5c的最后一行鉴定了保守的残基。图6a-6b显示了来自chylinski等人中披露的cas9分子的hnh样结构域(其中除去了序列异常值)(按出现的顺序分别为seqidno:253-302)的比对。图6b的最后一行鉴定了3个高度保守的残基。图7a-7b描绘了来自化脓性链球菌和脑膜炎奈瑟菌(neisseriameningitidis,n.meningitidis)的cas9序列的比对。将n-末端ruvc样结构域加框并用“y”指示。将另外两个ruvc样结构域加框并用“b”指示。将hnh样结构域加框并用“g”指示。sp:化脓性链球菌;nm:脑膜炎奈瑟菌。基序:这是基于两个序列的基序:将两个序列中保守的残基用单个氨基酸名称指示;“*”指示在两个序列中任一个的对应位置发现的任何氨基酸;“-”指示任何氨基酸,例如20种天然存在的氨基酸中的任一种,并且“-”指示任何氨基酸,例如20种天然存在的氨基酸中的任一种,或不存在。图8显示了编码脑膜炎奈瑟菌cas9的核酸序列(seqidno:303)。由“r”指示的序列是sv40nls;指示为“g”的序列是ha标签;并且由“o”指示的序列是合成nls序列;剩余的(未标记的)序列是开放阅读框(orf)。图9a显示了化脓性链球菌cas9的结构域组织的示意图和cas9结构域的组织,包括氨基酸位置,参考cas9的两种叶(识别(rec)和核酸酶(nuc)叶)。图9b显示了化脓性链球菌cas9的结构域组织的示意图和跨越83种cas9直向同源物的每个结构域的同源性百分比。图10a显示了部分地来源于化脓性链球菌的呈双链体结构(seqidno:40)的单分子grna分子的示例性结构。图10b显示了部分地来源于金黄色葡萄球菌的呈双链体结构(seqidno:41)的单分子grna分子的示例性结构。图11显示了使用金黄色葡萄球菌cas9评估293细胞中针对trbc基因的grna活性的实验的结果。用两种质粒(一种编码金黄色葡萄球菌cas9,另一种编码所列出的grna)转染293。该图总结了针对每种grna在trbc2基因座处观察到的平均%nhej,其是从对来自一式两份样品中分离的基因组dna进行的t7e1测定计算而来的。图12显示了使用化脓性链球菌cas9评估293细胞中针对trbc基因的grna活性的实验的结果。用两种质粒(一种编码化脓性链球菌cas9,另一种编码所列出的grna)转染293细胞。该图显示了针对每种grna在trbc1和trbc2两个基因座处观察到的平均%nhej,其是从对来自一式两份样品中分离的基因组dna进行的t7e1测定计算而来的。图13显示了使用金黄色葡萄球菌cas9评估293细胞中针对trac基因的grna活性的实验的结果。用两种质粒(一种编码金黄色葡萄球菌cas9,另一种编码所列出的grna)转染293细胞。该图显示了针对每种grna在trac基因座处观察到的平均%nhej,其是从对来自一式两份样品中分离的基因组dna进行的t7e1测定计算而来的。图14显示了使用化脓性链球菌cas9评估293细胞中针对trac基因的grna活性的实验的结果。用两种质粒(一种编码化脓性链球菌cas9,另一种编码所列出的grna)转染293细胞。该图显示了针对每种grna在trac基因座处观察到的平均%nhej,其是从对来自一式两份样品中分离的基因组dna进行的t7e1测定计算而来的。图15显示了使用金黄色葡萄球菌cas9评估293细胞中针对pdcd1基因的grna活性的实验的结果。用两种质粒(一种编码金黄色葡萄球菌cas9,另一种编码所列出的grna)转染293细胞。该图显示了针对每种grna在pdcd1基因座处观察到的平均%nhej,其是从对来自一式两份样品中分离的基因组dna进行的t7e1测定计算而来的。图16显示了使用化脓性链球菌cas9评估293细胞中针对pdcd1基因的grna活性的实验的结果。用两种质粒(一种编码化脓性链球菌cas9,另一种编码所列出的grna)转染293细胞。该图显示了针对每种grna在pdcd1基因座处观察到的平均%nhej,其是从对来自一式两份样品中分离的基因组dna进行的t7e1测定计算而来的。图17a-17c描绘了显示由于化脓性链球菌cas9mrna以及trbc和trac基因特异性grna的递送导致cd4+t细胞中cd3表达丧失的结果。图17a显示了用化脓性链球菌cas9mrna和指示的grna(trbc-210(gcgcugacgaucugggugac)(seqidno:413)、trac-4(gcugguacacggcaggguca)(seqidno:453)或aavs1(guccccuccaccccacagug)(seqidno:51201))电穿孔并用apc-cd3抗体染色和通过facs分析的cd4+t细胞。在电穿孔后第2天和第3天分析细胞。图17b显示了来自(a)中图的cd3阴性群体的定量。图17c显示了对trbc2和trac基因座进行的t7e1测定的%nhej结果。图18a-18c描绘了显示由于靶向trac基因的金黄色葡萄球菌cas9/grnarnp的递送导致jurkatt细胞中cd3表达丧失的结果。图18a显示了用靶向trac基因的金黄色葡萄球菌cas9/grnatrac-233(gugaauaggcagacagacuuguca)(seqidno:474)rnp电穿孔并用apc-cd3抗体染色和通过facs分析的jurkatt细胞。在电穿孔后第1天、第2天和第3天分析细胞。图18b显示了来自(a)中图的cd3阴性群体的定量。图18c显示了对trac基因座进行的t7e1测定的%nhej结果。图19显示了5’arca帽的结构。图20描绘了用cas9mrna和aavs1grna电穿孔后,活jurkatt细胞的定量结果。用化脓性链球菌cas9mrna和相应修饰的grna电穿孔jurkatt细胞。电穿孔后24小时,将1x105个细胞在室温下用fitc缀合的膜联蛋白-v特异性抗体染色15分钟,然后在通过流式细胞术分析之前立即用碘化丙啶染色。在条形图中示出了未针对膜联蛋白-v或pi染色的细胞百分比。图21a-21c描绘了由于靶向trac的金黄色葡萄球菌cas9/grnarnp的递送导致原初cd3+t细胞中cd3表达丧失。图21a描绘了用靶向trac的金黄色葡萄球菌cas9/grna(具有靶向结构域gugaauaggcagacagacuuguca(seqidno:474))rnp电穿孔并用apc-cd3抗体染色和通过facs分析的原初cd3+t细胞。在电穿孔后第4天分析细胞。阴性对照是具有含靶向结构域gugaauaggcagacagacuuguca(seqidno:474)的grna而没有功能性cas9的细胞。图21b描绘了来自图21a中图的cd3阴性群体的定量。图21c描绘了对trac基因座进行的t7e1测定的%nhej结果。图22描绘了在靶向pdcd1的化脓性链球菌cas9mrna和pdcd1grna(具有靶向结构域gucugggcggugcuacaacu(seqidno:508))或化脓性链球菌cas9/grna(具有靶向结构域gucugggcggugcuacaacu(seqidno:508)rnp的递送后,在jurkatt细胞中pdcd1基因座处的基因组编辑。在24小时、48小时和72小时对pdcd1基因座进行的t7e1测定的%nhej结果的定量。使用所要求保护的示例性靶grna(seqidno:508),用rnp与mrna递送来检测更高水平的%nhej。图23描绘了用包含靶向pdcd1基因座的不同标记的grna的cas9/grnarnp电穿孔原代t细胞后,pd-1表面表达阴性的细胞百分比。图24a描绘了在递送靶向pdcd1的化脓性链球菌cas9/grnarnp后,在活化的原代t细胞中pdcd1基因座处的基因组编辑。将从多个健康供体分离的原代cd4t细胞用相同rnp处理,并且在再活化后通过流式细胞术评估pdcd1表达。绘制来自多个实验的pdcd1阴性细胞的百分比的平均值,并且通过误差条描绘标准差。图24b描绘了用包含靶向pdcd1基因座或对照aavs1基因座的不同标记的grna的cas9/grnarnp电穿孔后,原代cd4+t细胞中cd4和pd-1的表面表达。图25描绘了用包含靶向pdcd1基因座或对照aavs1基因座的不同标记的grna的cas9/grnarnp电穿孔后,原代cd8+t细胞中cd45ra和cd62l的表面表达。图126描绘了用靶向pdcd1基因座的cas9/grnarnp(pd-1ko)、靶向aavs1对照的cas9/grnarnp(aavs1-ko)或未处理对照电穿孔后,用抗cd19car或模拟转导对照(模拟)转导的cd8+或cd4+t细胞上,针对抗cd19嵌合抗原受体(car)表达的pd-1和替代标记(egfrt)的表面表达。图27a和27b显示了用靶向pdcd1基因座的cas9/grnarnp(pd-1ko)或靶向aavs1对照的cas9/grnarnp(aavs1-ko)电穿孔后,用抗cd19car(car)或模拟转导对照(模拟)转导的cd8+(图27a)或cd4+(图27b)t细胞的t细胞表面标记表达的平均荧光强度(mfi)。描绘了表面标记cd45ra、cd69、41bb、ccr7、cd27、cd25、cd62l、tim3和cd45ro的mfi。图28a描绘了用靶向pdcd1基因座的cas9/grnarnp(pd-1ko)或靶向aavs1对照的cas9/grnarnp(aavs1-ko)电穿孔后,用抗cd19car(car+)或模拟转导对照(模拟)转导的t细胞中,在pdcd1基因座处含有indel的细胞的百分比。图28b描绘了来自miseq测序分析的相对于所用的pdcd1grna在每个位置处含有缺失或插入的读数的相对数量。指导rna的位置被描绘为在x轴上的位置60附近的粗垂直线。图29显示了用抗cd19car(car+)或模拟转导对照(模拟)转导并用靶向pdcd1基因座的cas9/grnarnp或靶向aavs1对照的cas9/grnarnp电穿孔的原代cd8+和cd4+t细胞的t细胞增殖。如使用celltracetmviolet所测量的,在与表达cd19的细胞或表达ror-1的对照细胞共培养后评估t细胞增殖。图30a-30c描绘了与表达cd19的细胞或表达ror-1的对照细胞共培养后,用抗cd19car(car+)或模拟转导对照(模拟)转导并用靶向pdcd1基因座的cas9/grnarnp或靶向aavs1对照的cas9/grnarnp电穿孔的原代t细胞的细胞上清液中的细胞因子分泌。图30a描绘了细胞上清液中的ifn-γ。图30b描绘了细胞上清液中的白细胞介素-2(il-2)分泌。图30c描绘了细胞上清液中的肿瘤坏死因子α(tnf-α)分泌。图31描绘了用化脓性链球菌d10a或n863a切口酶rnp对处理的活化的cd4t细胞。在用pma/io再刺激后,使用pe缀合的抗pdcd1抗体通过流式细胞术评估pdcd1的表达。将pdcd1阴性细胞的百分比用误差条绘制,参考一式两份样品的标准差。样品25和26是用作阴性对照的d10a和n863a与单种grna,而样品27是用作阳性对照的野生型cas9与单种grna。具体实施方式i.在表达重组受体的细胞中靶向pd-1敲除提供了表达重组受体(例如转基因或工程化t细胞受体(tcr)和/或嵌合抗原受体(car))的细胞和细胞组合物(包括免疫细胞,例如t细胞和nk细胞)。通常通过引入编码此类重组受体或其产物的一种或多种核酸分子来工程化细胞。在此类重组受体中有基因工程化抗原受体,包括工程化tcr和功能性非tcr抗原受体,例如嵌合抗原受体(car),包括活化、刺激和共刺激car及其组合。所提供的细胞还具有编码程序性死亡-1(pd-1)多肽的pdcd1基因的遗传破坏。还提供了产生此类基因工程化细胞的方法。在一些实施例中,细胞和组合物可用于过继细胞疗法,例如过继免疫疗法。在一些实施例中,所提供的细胞、组合物和方法改变或降低涉及程序性死亡-1(pd-1)与其配体pd-l1之间的抑制性相互作用的t细胞抑制性途径或信号的作用。在一些实施例中,共刺激抑制性受体或其配体中的一种或两种的上调和/或表达可负向控制t细胞活化和t细胞功能。pd-1(seqidno:51207和51208分别所示的示例性氨基酸和编码核酸序列)是免疫抑制性受体,其属于b7:cd28共刺激分子家族并与其配体pd-l1和pd-l2反应以抑制t细胞功能。主要报道pd-l1(seqidno:51209和51210分别所示的示例性氨基酸和编码核酸序列;还参见genbank登录号af233516)在抗原呈递细胞或癌细胞上表达,在此处其与t细胞表达的pd-1相互作用以抑制t细胞的活化。在一些情况下,报道pd-l1也在t细胞上表达。在一些情况下,pd-1和pd-l1的相互作用阻抑细胞毒性t细胞的活性,并且在一些方面中,可以抑制肿瘤免疫以为肿瘤细胞提供免疫逃逸。在一些实施例中,pd-1和pd-l1在t细胞上和/或在肿瘤微环境中的表达可降低过继t细胞疗法的效力和功效。因此,在一些实施例中,此类抑制性途径可能以其他方式在过继细胞疗法的背景下损害某些所希望的效应物功能。肿瘤微环境中的肿瘤细胞和/或细胞通常上调pd-1的配体(例如pd-l1和pd-l2),这反过来导致pd-1与表达pd-1的肿瘤特异性t细胞连接,从而递送抑制性信号。pd-1通常也在肿瘤微环境中的t细胞上(例如在肿瘤浸润性t细胞上)被上调,这可以在通过抗原受体或某些其他活化信号的信号传导之后发生。在一些情况下,此类事件可能有助于基因工程化(例如,car+)t细胞获得耗尽的表型,例如当存在于表达pd-l1的其他细胞附近时,这反过来可导致功能性降低。t细胞的耗尽可能导致t细胞功能的逐渐丧失和/或细胞耗竭(yi等人(2010)immunology[免疫学],129:474-481)。t细胞耗尽和/或t细胞持续性的缺乏是过继细胞疗法的功效和治疗结果的障碍;临床试验揭示了更大和/或更长程度的暴露于表达抗原受体(例如car)的细胞和治疗结果之间的相关性。某些方法旨在于t细胞中(包括在癌症疗法的背景下)阻断pd-1信号传导或破坏pd-1表达。此类阻断或破坏可以通过阻断抗体、小分子或抑制性肽的给予,或通过在t细胞中(例如在过继转移的t细胞中)敲除或减少pd-1的表达。然而,转移的t细胞中pd-1的破坏可能不完全令人满意。在一些情况下,编码pd-1的基因的破坏可能不是永久性的,使得消除细胞表面上的pd-1表达可能只是暂时性的。在其他方面中,细胞中遗传破坏的效率不够高,使得相对大量的被靶向用于破坏的细胞保留靶向基因的表达。在一些情况下,某些破坏方法(例如使用crispr/cas9)可能由于有限的切割特异性而导致脱靶效应,这种有限的切割特异性可能导致一种或多种非靶基因的非特异性破坏。在一些情况下,此类问题可能限制工程化细胞(其中破坏基因(例如pd-1)是希望的)的功效。在一些实施例中,所提供的细胞、组合物和方法导致免疫细胞(例如t细胞)中pdcd1表达的减少、缺失、消除、敲除或破坏。在一些方面中,通过基因编辑(例如使用对将被破坏的pd-1基因(pdcd1)具有特异性的rna指导的核酸酶,如成簇规律间隔短回文核酸(crispr)-cas系统,如crispr-cas9系统)进行破坏。在一些实施例中,将含有cas9和含靶向pdcd1基因座的区域的靶向结构域的指导rna(grna)的引入细胞中剂。在一些实施例中,该剂是或包含cas9和含有pdcd1靶向性靶向结构域的grna的核糖核蛋白(rnp)复合物(cas9/grnarnp)。在一些实施例中,引入包括在体外使剂或其部分与细胞接触,其可以包括培育或孵育细胞和剂长达24小时、36小时或48小时或3天、4天、5天、6天、7天或8天。在一些实施例中,引入还可以包括实现剂向细胞中的递送。在各种实施例中,根据本披露的方法、组合物和细胞使用cas9和grna的核糖核蛋白(rnp)复合物例如通过电穿孔直接递送至细胞。在一些实施例中,rnp复合物包括已被修饰以包括3'聚-a尾和5'抗反向帽类似物(arca)帽的grna。在一些情况下,待修饰细胞的电穿孔包括在细胞电穿孔后且铺板之前例如在32℃下冷休克细胞。在一些实施例中,在使剂与细胞接触之前、期间或之后,和/或在实现递送(例如电穿孔)之前、期间或之后,所提供的方法包括在细胞因子、刺激剂和/或能够诱导免疫细胞(例如t细胞)增殖的剂的存在下孵育细胞。在一些实施例中,孵育的至少一部分是在刺激剂的存在下,该刺激剂是或包含对cd3具有特异性的抗体、对cd28具有特异性的抗体和/或细胞因子。在一些实施例中,孵育的至少一部分是在细胞因子(例如il-2、il-7和il-15中的一种或多种)的存在下。在一些实施例中,在电穿孔之前或之后孵育长达8天,例如长达24小时、36小时或48小时或3天、4天、5天、6天、7天或8天。在一些实施例中,在电穿孔前,在刺激剂(例如抗cd3/抗cd28)和/或细胞因子(例如il-2、il-7和/或il-15)的存在下孵育长达24小时、25小时或48小时。在一些方面中,所提供的组合物和方法包括如下那些:其中引入用于pdcd1基因的敲除或遗传破坏的剂(例如grna/cas9)的细胞的组合物中至少或大于约50%、60%、65%、70%、75%、80%、85%、90%或95%的细胞含有遗传破坏;不表达内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因。在一些实施例中,根据本披露的方法、组合物和细胞包括如下那些:其中引入用于pdcd1基因的敲除或遗传破坏的剂(例如grna/cas9)的细胞的组合物中至少或大于约50%、60%、65%、70%、75%、80%、85%、90%或95%的细胞不表达pd-1多肽(例如在细胞表面上)。在一些实施例中,其中引入用于pdcd1基因的敲除或遗传破坏的剂(例如grna/cas9)的细胞的组合物中至少或大于约50%、60%、65%、70%、75%、80%、85%、90%或95%的细胞的两个等位基因被敲除,即在此类百分比的细胞中包含双等位基因缺失。在一些实施例中,提供了组合物和方法,其中cas9介导的pdcd1基因中或附近(例如,在切割位点上游或下游的100个碱基对内或约在100个碱基对内、在50个碱基对内或约在50个碱基对内、或在25个碱基对内或约在25个碱基对内或在10个碱基对内或约在10个碱基对内)的切割效率(%indel)在其中已经引入用于pdcd1基因的敲除或遗传破坏的剂(例如grna/cas9)的细胞的组合物的细胞中为至少或大于约50%、60%、65%、70%、75%、80%、85%、90%或95%。在一些实施例中,所提供的细胞、组合物和方法导致在其中引入用于pdcd1基因的敲除或遗传破坏的剂(例如grna/cas9)的细胞的组合物中,至少或大于约50%、60%、65%、70%、75%、80%、85%、90%或95%的细胞中经由免疫检查点分子pd-1递送的信号减少或破坏。在一些实施例中,当在相同条件下评估时,与在对应或参考组合物的工程化细胞(其中此类细胞用重组受体工程化但不包含pdcd1基因的遗传破坏或表达pd-1多肽)中表达的重组受体相比,根据所提供的披露的组合物(包含用重组受体工程化的细胞并包含pd-1表达的减少、缺失、消除、敲除或破坏(例如pdcd1基因的遗传破坏))保留重组受体(例如car)的功能特性或活性。在一些实施例中,重组受体(例如car)保留与抗原的特异性结合。在一些实施例中,重组受体(例如car)在抗原结合时保留活化或刺激活性,以在细胞中诱导细胞毒性、增殖、存活或细胞因子分泌。在一些实施例中,当在相同条件下评估时,与包含工程化细胞(其中此类细胞用重组受体工程化但不包含pdcd1基因的遗传破坏或表达pd-1多肽)的对应或参考组合物相比,所提供的组合物的工程化细胞保留功能特性或活性。在一些实施例中,与这种对应或参考组合物相比,细胞保留细胞毒性、增殖、存活或细胞因子分泌。在一些实施例中,当在相同条件下评估时,与对应或参考组合物中的细胞的表型相比,组合物中的细胞保留一种或多种免疫细胞的表型。在一些实施例中,组合物中的细胞包括原初细胞、效应记忆细胞、中枢记忆细胞、干中枢记忆细胞、效应记忆细胞和长寿效应记忆细胞。在一些实施例中,t细胞、或表达重组受体(例如car)且包含pdcd1基因的遗传破坏的t细胞的百分比表现出与用重组受体工程化但不含遗传破坏或表达pd-1多肽的细胞的对应或参考群体或组合物相同或基本相同的非活化的长寿记忆或中枢记忆表型。在一些实施例中,所提供的组合物包含含有重组受体(例如car)和选自ccr7+、4-1bb+(cd137+)、tim3+、cd27+、cd62l+、cd127+、cd45ra+、cd45ro-、t-bet低、il-7ra+、cd95+、il-2rβ+、cxcr3+或lfa-1+的一种或多种表型标记的t细胞。在一些实施例中,这种特性、活性或表型可以在体外测定中测量,例如通过在抗原、表达抗原的细胞和/或抗原受体活化物质的存在下孵育细胞。在一些实施例中,孵育在或约在37℃±2℃下。在一些实施例中,孵育可以长达或长达约12、24、36、48或60小时,并且任选地可以在一种或多种细胞因子(例如il-2、il-15和/或il-17)的存在下。在一些实施例中,可以在电穿孔或剂的其他引入后(例如在3、4、5、6、7天后或长达3、4、5、6、7天)的不同天数评估任何评估的活性、特性或表型。在一些实施例中,当在相同条件下评估时,与含有用重组受体工程化但不包含pdcd1基因的遗传破坏的细胞的对应组合物的活性相比,组合物中至少80%、85%、90%、95%或100%的细胞的这种活性、特性或表型被保留。如本文所用的,提及“对应组合物”或“对应细胞群体”(也称为“参考组合物”或“参考细胞群体”)是指在相同或基本相同的条件下(除了t细胞或t细胞群体没有引入该剂之外)获得、分离、生成、产生和/或孵育的t细胞或细胞。在一些方面中,除了不包括剂的引入之外,此类细胞或t细胞与引入了剂的t细胞或细胞相同或基本相同地处理,使得可影响细胞的活性或特性(包括抑制性分子的上调或表达)的任何一种或多种条件在细胞之间不变化或基本不变,除了引入剂之外。例如,出于评估一种或多种抑制性分子(例如pd-1)表达减少和/或上调抑制的目的,包括引入剂的t细胞和不包括引入剂的t细胞在已知在t细胞中导致一种或多种抑制性分子表达和/或上调的相同条件下孵育。用于评估t细胞标记(包括抑制性分子,例如pd-1)的表达和/或水平的方法和技术是本领域已知的。用于检测此类标记的抗体和试剂是本领域熟知的,并且容易获得。用于检测此类标记的测定和方法包括但不限于流式细胞术(包括细胞内流式细胞术)、elisa、elispot、流式微珠阵列(cytometricbeadarray)或其他多重方法、蛋白质印迹法和其他基于免疫亲和力的方法。在一些实施例中,可以通过流式细胞术或其他基于免疫亲和力的方法针对此类细胞特有的标记的表达检测表达抗原受体(例如car)的细胞,然后可以将此类细胞针对另外一种或多种t细胞表面标记(例如抑制性分子(例如pd-1))共染色。在一些实施例中,可以生成表达抗原受体(例如car)的t细胞以含有截短的egfr(egfrt)作为非免疫原性选择表位,然后其可以用作检测此类细胞的标记(参见例如,美国专利号8,802,374)。在一些实施例中,细胞、组合物和方法提供在待过继转移的免疫细胞(例如t细胞)(例如工程化以表达car或转基因tcr的细胞)中pd-1表达的缺失、敲除、破坏或减少。在一些实施例中,这些方法在原代细胞(例如来自受试者的原代免疫细胞(例如t细胞))上离体进行。在一些方面中,产生或生成此类基因工程化t细胞的方法包括向含有免疫细胞(例如t细胞)的细胞群体中引入编码重组受体(例如car)的一种或多种核酸和能够破坏编码免疫抑制性分子pd-1的基因的一种或多种剂。如本文所用的,术语“引入”涵盖在体外或在体内将dna引入细胞中的各种方法,此类方法包括转化、转导、转染(例如电穿孔)和感染。载体可用于将编码分子的dna引入细胞中。可能的载体包括质粒载体和病毒载体。病毒载体包括逆转录病毒载体、慢病毒载体或其他载体,例如腺病毒载体或腺相关载体。含有t细胞的细胞群体可以是从受试者获得的细胞,例如从外周血单核细胞(pbmc)样品、未分级的t细胞样品、淋巴细胞样品、白细胞样品、单采术(apheresis)产物或白细胞分离术(leukapheresis)产物获得的细胞。在一些实施例中,可以使用阳性或阴性选择和富集方法来分开或选择t细胞以富集群体中的t细胞。在一些实施例中,群体含有cd4+、cd8+、或cd4+和cd8+t细胞。在一些实施例中,引入编码基因工程化抗原受体的核酸的步骤和引入剂(例如cas9/grnarnp)的步骤可以同时或以任何顺序循序地发生。在一些实施例中,在引入基因工程化抗原受体(例如car)和一种或多种剂(例如cas9/grnarnp)之后,在刺激细胞扩增和/或增殖的条件下培养或孵育细胞。因此,提供了在过继细胞疗法中增强免疫细胞(例如t细胞)功能的细胞、组合物和方法,包括提供改善的功效的那些,例如通过增加给予的基因工程化(例如car+)细胞的活性和效力,同时维持随着时间的推移的持续性或暴露于转移的细胞。在一些实施例中,与某些可用方法相比,当在体内向受试者给予时,基因工程化细胞(例如表达car的t细胞)表现出增加的扩增和/或持续性。在一些实施例中,所提供的含有表达重组受体的细胞(例如表达car的细胞)的组合物在体内向受试者给予时表现出增加的持续性。在一些实施例中,在给予时在受试者中基因工程化细胞(例如表达car的t细胞)的持续性与通过替代方法(例如涉及给予通过方法(其中t细胞没有引入减少编码pd-1的基因的表达或对其进行破坏的剂)基因工程化细胞的那些)实现的相比更大。在一些实施例中,持续性增加至少或约至少1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、50倍、60倍、70倍、80倍、90倍、100倍或更多。在一些实施例中,所给予的细胞的持续性的程度或范围可在向受试者给予后检测或定量。例如,在一些方面中,定量pcr(qpcr)用于评估在受试者的血液或血清或器官或组织(例如,疾病部位)中表达重组受体的细胞(例如,表达car的细胞)的量。在一些方面中,持续性被定量为每微克dna的编码受体(例如car)的dna或质粒的拷贝,或定量为每微升样品(例如,血液或血清的样品)表达受体(例如表达car)的细胞的数量或每微升样品的外周血单核细胞(pbmc)或白细胞或t细胞的总数量。在一些实施例中,还可以进行通常使用对受体具有特异性的抗体来检测表达受体的细胞的流式细胞术测定。基于细胞的测定也可用于检测功能性细胞(例如能够结合和/或中和疾病或病症的细胞或表达受体识别的抗原的细胞和/或诱导针对疾病或病症的细胞或表达受体识别的抗原的细胞的反应(例如,细胞毒性反应)的细胞)的数量或百分比。在任何此类实施例中,与重组受体(例如表达car的细胞)相关联的另一种标记的表达范围或水平可用于区分在受试者中给予的细胞与内源性细胞。还提供了细胞的方法和用途,例如用于癌症治疗的过继疗法中。还提供了用于工程化、制备和产生细胞的方法,含有细胞的组合物,以及含有和用于使用、产生和给予细胞的试剂盒和装置。还提供了用于产生工程化细胞的方法、化合物和组合物。提供了用于细胞分离、基因工程化和基因破坏的方法。提供了编码基因工程化抗原受体和/或编码用于实现破坏的剂的核酸(例如构建体,例如病毒载体),以及用于将此类核酸例如通过转导引入细胞中的方法。还提供了含有工程化细胞的组合物,以及用于将细胞和组合物给予受试者(例如用于过继细胞疗法)的方法、试剂盒和装置。在一些方面中,将细胞从受试者中分离,工程化并给予同一受试者。在其他方面中,将它们从一名受试者中分离,工程化并给予另一名受试者。ii.基因工程化细胞和产生表达重组受体的细胞的方法提供了用于过继细胞疗法(例如过继免疫疗法)的细胞和用于产生或生成细胞的方法。细胞包括免疫细胞,例如t细胞。通常通过引入一种或多种基因工程化核酸或其产物来工程化细胞。在此类产物中有基因工程化抗原受体,包括工程化t细胞受体(tcr)和功能性非tcr抗原受体(例如嵌合抗原受体(car),包括活化、刺激和共刺激car)及其组合。在一些实施例中,还将能够破坏编码免疫抑制性分子pd-1的基因的剂(例如cas9/grnarnp)与编码基因工程化抗原受体的核酸同时或循序地引入细胞。在一些实施例中,可以在引入编码重组受体的核酸分子和/或剂(例如cas9/grnarnp)之前、期间和/或之后孵育或培育细胞(例如t细胞)。在一些实施例中,可以在引入编码重组受体的核酸分子之前、期间或之后(例如在用编码重组受体的病毒载体(例如慢病毒载体)转导细胞之前、期间或之后)孵育或培育细胞(例如t细胞)。在一些实施例中,可以在引入剂(例如cas9/grnarnp)之前、期间或之后(例如在使细胞与剂接触之前、期间或之后,或将剂(例如经由电穿孔)递送至细胞中之前、期间或之后)孵育或培育细胞(例如t细胞)。在一些实施例中,孵育可以在引入编码重组受体的核酸分子和引入剂(例如cas9/grnarnp)两者的背景下。在一些实施例中,孵育可以在细胞因子(例如il-2、il-7或il-15)的存在下,或在诱导细胞增殖或活化的刺激剂或活化剂(例如抗cd3/抗cd28抗体)的存在下。在一些实施例中,该方法包括在引入编码重组受体的核酸分子和剂(例如cas9/grnarnp)之前用刺激剂或活化剂(例如抗cd3/抗cd28抗体)活化或刺激细胞。在一些实施例中,孵育也可以在细胞因子(例如il-2(例如1u/ml至500u/ml,如10u/ml至200u/ml,例如至少或至少约50u/ml或100u/ml)、il-7(例如0.5ng/ml至50ng/ml,如1ng/ml至20ng/ml,例如至少或至少约5ng/ml或10ng/ml)或il-15(例如0.1ng/ml至50ng/ml,如0.5ng/ml至25ng/ml,例如至少或至少约1ng/ml或5ng/ml))的存在下进行。在一些实施例中,在(例如经由转导)引入编码重组受体的核酸分子之前,将细胞孵育6小时至96小时,例如24-48小时或24-36小时。在一些实施例中,在引入编码重组受体的核酸分子后,引入剂(例如cas9/grnarnp)。在一些实施例中,在引入剂之前,例如通过除去任何刺激剂或活化剂来静置细胞。在一些实施例中,在引入剂之前,不除去刺激剂或活化剂和/或细胞因子。在一些实施例中,在引入核酸分子和/或引入剂(例如cas9/grna)之后,将细胞在细胞因子(例如il-2(例如1u/ml至500u/ml,如1u/ml至100u/ml,例如至少或至少约25u/ml或50u/ml)、il-7(例如0.5ng/ml至50ng/ml,如1ng/ml至20ng/ml,例如至少或至少约1ng/ml或5ng/ml)或il-15(例如0.1ng/ml至50ng/ml,如0.1ng/ml至10ng/ml,例如至少或至少约0.1ng/ml、0.5ng/ml或1ng/ml))的存在下孵育、培育或培养细胞。在一些实施例中,在该过程的任何部分或全部过程期间的孵育可以处于30℃±2℃至39℃±2℃,例如至少或约至少30℃±2℃、32℃±2℃、34℃±2℃或37℃±2℃的温度。在一些实施例中,孵育的至少一部分处于30℃±2℃,并且孵育的至少一部分处于37℃±2℃。a.细胞和细胞的制备用于基因工程化可以将结合特异性抗原的重组受体和用于编码pd-1多肽的pdcd1基因的基因编辑的剂(例如cas9/grnarnp)引入多种细胞中。在一些实施例中,将重组受体工程化和/或将pdcd1靶基因离体操纵,并将所得基因工程化细胞给予受试者。用于离体操纵的靶细胞的来源可以包括例如受试者的血液、受试者的脐带血或受试者的骨髓。用于离体操纵的靶细胞的来源还可以包括例如异源供体血液、脐带血或骨髓。在一些实施例中,细胞(例如工程化细胞)是真核细胞,例如哺乳动物细胞,例如人细胞。在一些实施例中,细胞衍生自血液、骨髓、淋巴或淋巴器官,是免疫系统的细胞,例如先天或适应性免疫的细胞,例如骨髓或淋巴细胞,包括淋巴细胞,典型地为t细胞和/或nk细胞。其他示例性细胞包括干细胞,例如多潜能干细胞和多能干细胞,包括诱导多能干细胞(ipsc)。在一些方面中,细胞是人细胞。就待治疗的受试者而论,细胞可以是同种异体的和/或自体的。细胞典型地是原代细胞,例如直接从受试者分离和/或从受试者分离并冷冻的那些。在一些实施例中,靶细胞是t细胞(例如cd8+t细胞(例如,cd8+原初t细胞、中枢记忆t细胞或效应记忆t细胞)、cd4+t细胞、自然杀伤t细胞(nkt细胞)、调节性t细胞(treg)、干细胞记忆t细胞)、淋巴祖细胞、造血干细胞、自然杀伤细胞(nk细胞)或树突细胞。在一些实施例中,细胞是单核细胞或粒细胞,例如骨髓细胞、巨噬细胞、嗜中性粒细胞、树突细胞、肥大细胞、嗜酸性粒细胞和/或嗜碱性粒细胞。在一个实施例中,靶细胞是诱导多能干(ips)细胞或衍生自ips细胞的细胞(例如,生成自受试者的ips细胞),该细胞被操纵以改变一种或多种靶基因(例如在其中诱导突变)或操纵一种或多种靶基因的表达,并分化成例如t细胞(例如cd8+t细胞(例如cd8+原初t细胞、中枢记忆t细胞或效应记忆t细胞)、cd4+t细胞、干细胞记忆t细胞)、淋巴祖细胞或造血干细胞)。在一些实施例中,细胞包括t细胞或其他细胞类型的一个或多个子集,例如整个t细胞群体、cd4+细胞、cd8+细胞及其亚群,例如由功能、活化状态、成熟度、分化、扩增、再循环、定位和/或持续能力的潜力、抗原特异性、抗原受体类型、在特定器官或区室中的存在、标记或细胞因子分泌谱、和/或分化程度定义的那些。在t细胞和/或cd4+和/或cd8+t细胞的亚型和亚群中有原初t(tn)细胞、效应t细胞(teff)、记忆t细胞及其亚型(例如干细胞记忆t(tscm)、中枢记忆t(tcm)、效应记忆t(tem)、或终末分化的效应记忆t细胞)、肿瘤浸润淋巴细胞(til)、未成熟t细胞、成熟t细胞、辅助t细胞、细胞毒性t细胞、黏膜相关恒定t(mait)细胞、天然存在和适应性调节性t(treg)细胞、辅助t细胞(例如th1细胞、th2细胞、th3细胞、th17细胞、th9细胞、th22细胞、滤泡性辅助t细胞)、α/βt细胞、和δ/γt细胞。在一些实施例中,这些方法包括从受试者中分离细胞,制备、加工、培养和/或工程化这些细胞。在一些实施例中,工程化细胞的制备包括一个或多个培养和/或制备步骤。如上所述的用于工程化的细胞可以从样品(例如生物样品,例如从受试者获得或来源于受试者的样品)中分离。在一些实施例中,细胞从其分离的受试者是患有疾病或病症或需要细胞疗法或将被给予细胞疗法的受试者。在一些实施例中,受试者是需要特定治疗性干预(例如过继细胞疗法,其中细胞被分离、加工和/或工程化)的人。因此,在一些实施例中,细胞是原代细胞,例如原代人细胞。样品包括直接取自受试者的组织、流体和其他样品,以及来自一个或多个加工步骤(例如分开、离心、基因工程化(例如用病毒载体转导)、洗涤和/或孵育)的样品。生物样品可以是直接从生物来源获得的样品或经过加工的样品。生物样品包括但不限于体液(例如血液、血浆、血清、脑脊髓液、滑液、尿液和汗液)、组织和器官样品,包括由其衍生的加工样品。在一些方面中,细胞从其衍生或分离的样品是血液或血液衍生的样品,或者是或衍生自单采术或白细胞分离术产物。示例性样品包括全血、外周血单核细胞(pbmc)、白细胞、骨髓、胸腺、组织活检、肿瘤、白血病、淋巴瘤、淋巴结、肠相关淋巴组织、黏膜相关淋巴组织、脾、其他淋巴组织、肝脏、肺、胃、肠、结肠、肾、胰腺、乳房、骨、前列腺、子宫颈、睾丸、卵巢、扁桃体或其他器官、和/或由其衍生的细胞。在细胞疗法(例如过继细胞疗法)的背景下,样品包括来自自体和同种异体来源的样品。在一些实施例中,细胞衍生自细胞系,例如t细胞系。在一些实施例中,细胞获自异种来源,例如获自小鼠、大鼠、非人灵长类动物和猪。在一些实施例中,细胞的分离包括一个或多个制备和/或基于非亲和力的细胞分开步骤。在一些实例中,细胞在一种或多种试剂的存在下洗涤、离心和/或孵育,例如以除去不需要的组分、针对所希望的组分进行富集、裂解或除去对特定试剂敏感的细胞。在一些实例中,基于一种或多种特性(例如密度、黏附特性、尺寸、对特定组分的敏感性和/或抗性)而分开细胞。在一些实例中,来自受试者的循环血液的细胞例如通过单采术或白细胞分离术获得。在一些方面中,样品含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞和/或血小板,并且在一些方面中含有除红细胞和血小板之外的细胞。在一些实施例中,洗涤从受试者收集的血细胞,例如以除去血浆级分并将细胞置于适当的缓冲液或介质中用于随后的加工步骤。在一些实施例中,用磷酸盐缓冲盐水(pbs)洗涤细胞。在一些实施例中,洗涤溶液缺乏钙和/或镁和/或许多或所有二价阳离子。在一些方面中,根据制造商的说明书,通过半自动“流通”离心机(例如,cobe2991细胞加工器,巴克斯特公司(baxter))完成洗涤步骤。在一些方面中,根据制造商的说明书,通过切向流过滤(tff)完成洗涤步骤。在一些实施例中,洗涤后将细胞重悬于多种生物相容性缓冲液(例如像不含ca++/mg++的pbs)中。在某些实施例中,去除血细胞样品的组分并将细胞直接重悬于培养基中。在一些实施例中,这些方法包括基于密度的细胞分开方法,例如通过裂解红细胞并通过percoll或ficoll梯度离心而从外周血制备白细胞。在一些实施例中,分离方法包括基于细胞中一种或多种特异性分子(例如表面标记,例如表面蛋白、细胞内标记或核酸)的表达或存在来分开不同细胞类型。在一些实施例中,可以使用任何已知的基于此类标记的用于分开的方法。在一些实施例中,分开是基于亲和力或免疫亲和力的分开。例如,在一些方面中,分离包括基于细胞的一种或多种标记(典型地细胞表面标记)的表达或表达水平来分开细胞和细胞群体,例如通过与特异性结合此类标记的抗体或结合配偶体一起孵育,然后通常是洗涤步骤和从那些未与抗体或结合配偶体结合的细胞分开已结合抗体或结合配偶体的细胞。此类分开步骤可以基于阳性选择(其中保留已经结合试剂的细胞以供进一步使用)和/或阴性选择(其中保留未与抗体或结合配偶体结合的细胞)。在一些实例中,保留两种级分以供进一步使用。在一些方面中,当没有可用于特异性鉴定异质群体中的细胞类型的抗体时,阴性选择可能特别有用,使得最好基于由除所希望的群体之外的细胞表达的标记进行分开。分开不需要导致100%富集或去除特定细胞群体或表达特定标记的细胞。例如,针对特定类型细胞(例如表达标记的那些)的阳性选择或富集是指增加此类细胞的数量或百分比,但不需要导致不表达标记的细胞的完全不存在。同样地,特定类型细胞(例如表达标记的那些)的阴性选择、去除或耗竭是指减少此类细胞的数量或百分比,但不需要导致所有此类细胞的完全去除。在一些实例中,进行多轮分开步骤,其中来自一个步骤的阳性或阴性选择的级分经受另一个分开步骤,例如随后的阳性或阴性选择。在一些实例中,单个分开步骤可以同时耗竭表达多种标记的细胞,例如通过将细胞与多种抗体或结合配偶体(每种抗体或结合配偶体对被靶向用于阴性选择的标记具有特异性)一起孵育。同样地,通过将细胞与在各种细胞类型上表达的多种抗体或结合配偶体一起孵育,可以同时阳性选择多种细胞类型。在一些实施例中,一种或多种t细胞群体针对对一种或多种特定标记(例如表面标记)呈阳性(标记+)或高水平表达(标记高)或对一种或多种标记呈阴性(标记-)或相对低水平表达(标记低)的细胞进行富集或耗竭。例如,在一些方面中,t细胞的特定亚群,例如对一种或多种表面标记呈阳性或高水平表达的细胞(例如cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+、和/或cd45ro+t细胞)通过阳性或阴性选择技术来分离。在一些情况下,此类标记是在某些t细胞群体(例如非记忆细胞)上不存在或相对较低水平表达,但在某些其他t细胞群体(例如记忆细胞)上存在或相对较高水平表达的那些。在一个实施例中,细胞(例如cd8+细胞或t细胞,例如cd3+细胞)针对对cd45ro、ccr7、cd28、cd27、cd44、cd127、和/或cd62l呈阳性或高表面水平表达的细胞进行富集(即,阳性选择),和/或针对对cd45ra呈阳性或高表面水平表达的细胞进行耗竭(例如,阴性选择)。在一些实施例中,细胞针对对cd122、cd95、cd25、cd27和/或il7-rα(cd127)呈阳性或高表面水平表达的细胞进行富集或耗竭。在一些实例中,cd8+t细胞针对对cd45ro呈阳性(或对cd45ra呈阴性)且对cd62l呈阳性的细胞进行富集。例如,可以使用cd3/cd28缀合的磁珠(例如,m-450cd3/cd28tcellexpander)阳性选择cd3+,cd28+t细胞。在一些实施例中,通过阴性选择在非t细胞(例如b细胞、单核细胞或其他白细胞,例如cd14)上表达的标记,来将t细胞与pbmc样品分开。在一些方面中,cd4+或cd8+选择步骤用于分开cd4+辅助细胞和cd8+细胞毒性t细胞。通过对一种或多种原初、记忆和/或效应t细胞亚群表达或以相对较高程度表达的标记的阳性或阴性选择,可以将此类cd4+和cd8+群体进一步分类成亚群。在一些实施例中,cd8+细胞针对原初细胞、中枢记忆细胞、效应记忆细胞和/或中枢记忆干细胞进行进一步富集或耗竭,例如通过基于与相应亚群相关联的表面抗原的阳性或阴性选择。在一些实施例中,针对中枢记忆t(tcm)细胞进行富集以增加功效,例如以改善给予后的长期存活、扩增和/或移植,这在一些方面中在此类亚群中特别稳健。参见terakura等人(2012)blood.[血液]1:72–82;wang等人(2012)jimmunother.[免疫疗法杂志]35(9):689-701。在一些实施例中,组合针对tcm富集的cd8+t细胞和cd4+t细胞进一步增强功效。在实施例中,记忆t细胞存在于cd8+外周血淋巴细胞的cd62l+和cd62l两个子集中。pbmc可以针对cd62l-cd8+和/或cd62l+cd8+级分进行富集或耗竭,例如使用抗cd8和抗cd62l抗体。在一些实施例中,cd4+t细胞群体和cd8+t细胞亚群,例如针对中枢记忆(tcm)细胞富集的亚群。在一些实施例中,针对中枢记忆t(tcm)细胞的富集基于对cd45ro、cd62l、ccr7、cd28、cd3、和/或cd127呈阳性或高表面表达;在一些方面中,它基于对表达或高度表达cd45ra和/或颗粒酶b的细胞的阴性选择。在一些方面中,通过表达cd4、cd14、cd45ra的细胞的耗竭,和针对表达cd62l的细胞的阳性选择或富集,来分离针对tcm细胞富集的cd8+群体。在一个方面中,针对中枢记忆t(tcm)细胞的富集从基于cd4表达选择的细胞的阴性级分开始进行,其经受基于cd14和cd45ra的表达的阴性选择和基于cd62l的阳性选择。此类选择在一些方面中是同时进行的,并且在其他方面中以任何顺序循序地进行。在一些方面中,用于制备cd8+细胞群体或亚群的相同的基于cd4表达的选择步骤也用于生成cd4+细胞群体或亚群,使得来自基于cd4的分开的阳性和阴性两种级分被保留并用于方法的随后的步骤中,任选地在一个或多个另外的阳性或阴性选择步骤之后。在一个特定实例中,pbmc样品或其他白细胞样品经受cd4+细胞的选择,其中保留了阴性和阳性两种级分。然后将阴性级分经受基于cd14和cd45ra或cd19的表达的阴性选择和基于中枢记忆t细胞特有的标记(例如cd62l或ccr7)的阳性选择,其中阳性和阴性选择以任一顺序进行。通过鉴定具有细胞表面抗原的细胞群体,将cd4+t辅助细胞分类为原初细胞、中枢记忆细和效应细胞。cd4+淋巴细胞可通过标准方法获得。在一些实施例中,原初cd4+t淋巴细胞是cd45ro-,cd45ra+,cd62l+,cd4+t细胞。在一些实施例中,中枢记忆cd4+细胞是cd62l+且cd45ro+。在一些实施例中,效应cd4+细胞是cd62l-且cd45ro。在一个实例中,为了通过阴性选择来富集cd4+细胞,单克隆抗体混合物典型地包括针对cd14、cd20、cd11b、cd16、hla-dr、和cd8的抗体。在一些实施例中,将抗体或结合配偶体与固体支持物或基质(例如磁珠或顺磁珠)结合,以允许细胞分开用于阳性和/或阴性选择。例如,在一些实施例中,使用免疫磁性(或亲和磁性)分开技术来分开或分离细胞和细胞群体(综述于methodsinmolecularmedicine[分子医学方法],第58卷:metastasisresearchprotocols[转移研究协议],第2卷:cellbehaviorinvitroandinvivo[体外和体内细胞行为],第17-25页s.a.brooks和u.schumacher编辑humanapressinc.[胡玛纳出版社公司],totowa[托托瓦],nj[新泽西州])。在一些实施例中,在基因工程化之前或与基因工程化相连地孵育和/或培养细胞。孵育步骤可以包括培养、培育、刺激、活化和/或繁殖。在一些实施例中,组合物或细胞在刺激条件或刺激剂的存在下孵育。此类条件包括设计用于在群体中诱导细胞的增殖、扩增、活化和/或存活以模拟抗原暴露和/或引发细胞用于基因工程化(例如用于引入重组抗原受体)的那些。条件可以包括以下中的一种或多种:特定介质、温度、氧含量、二氧化碳含量、时间、剂(例如营养素、氨基酸、抗生素、离子和/或刺激因子(例如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶性受体和任何其他旨在活化细胞的剂))。在一些实施例中,刺激条件或刺激剂包括能够活化tcr复合物的细胞内信号传导结构域的一种或多种剂(例如配体)。在一些方面中,剂在t细胞中开启或启动tcr/cd3细胞内信号传导级联。此类剂可以包括例如与固体支持物(例如珠)结合的抗体(例如对tcr组分和/或共刺激受体具有特异性的那些,例如抗cd3、抗cd28)和/或一种或多种细胞因子。任选地,扩增方法可以进一步包括向培养基中(例如,以至少约0.5ng/ml的浓度)添加抗cd3和/或抗cd28抗体的步骤。在一些实施例中,刺激剂包括il-2和/或il-15,例如,il-2浓度为至少约10单位/ml。在一些方面中,孵育根据例如描述于riddell等人的美国专利号6,040,177,klebanoff等人(2012)jimmunother.[免疫疗法杂志]35(9):651–660,terakura等人(2012)blood.[血液]1:72–82和/或wang等人(2012)jimmunother.[免疫疗法杂志]35(9):689-701中的那些等技术进行。在一些实施例中,通过以下方式来扩增t细胞:向培养起始组合物中添加饲养细胞(例如非分裂外周血单核细胞(pbmc))(例如,使得针对待扩增的初始群体中每个t淋巴细胞,所得细胞群体含有至少约5、10、20或40或更多个pbmc饲养细胞);和孵育培养物(例如,持续足以扩增t细胞数量的时间)。在一些方面中,非分裂饲养细胞可以包含γ照射的pbmc饲养细胞。在一些实施例中,用在约3000至3600拉德范围内的γ射线来照射pbmc以防止细胞分裂。在一些方面中,在添加t细胞群体之前将饲养细胞添加至培养基中。在一些实施例中,刺激条件包括适合人t淋巴细胞生长的温度,例如至少约25摄氏度,通常至少约30摄氏度,并且通常在或约在37摄氏度。任选地,孵育可以进一步包括添加非分裂ebv转化的类淋巴母细胞(lcl)作为饲养细胞。lcl可以用在约6000至10,000拉德范围内的γ射线照射。在一些方面中,lcl饲养细胞以任何合适的量(例如lcl饲养细胞与初始t淋巴细胞的比率为至少约10:1)提供。在一些实施例中,制备方法包括在分离、孵育和/或工程化之前或之后冷冻(例如冷冻保存)细胞的步骤。在一些实施例中,冷冻和随后的解冻步骤去除细胞群体中的粒细胞,并且在一定程度上去除单核细胞。在一些实施例中,例如在洗涤步骤之后将细胞悬浮在冷冻溶液中以除去血浆和血小板。在一些方面中,可以使用各种已知的冷冻溶液和参数中的任一种。一个实例涉及使用含有20%dmso和8%人血清白蛋白(hsa)的pbs,或其他合适的细胞冷冻培养基。然后将其用培养基1:1稀释,使得dmso和hsa的最终浓度分别为10%和4%。然后通常将细胞以1°/分钟的速率冷冻至-80℃并储存在液氮储罐的气相中。在一些实施例中,这些方法包括在冷冻保存之前或之后将工程化细胞重新引入同一患者。b.重组受体在一些实施例中,细胞包含编码经由基因工程化引入的重组受体的一种或多种核酸、以及此类核酸的基因工程化产物。在一些实施例中,可以通过将编码重组受体的核酸分子引入细胞中(例如经由转导病毒载体,例如逆转录病毒或慢病毒载体)来产生或生成细胞。在一些实施例中,核酸是异源的,即通常不存在于细胞或从该细胞获得的样品中,例如从另一种生物体或细胞获得的核酸,该核酸例如一般不会在被工程化的细胞和/或从其衍生出这种细胞的生物体中发现。在一些实施例中,核酸不是天然存在的,例如在自然界中没有发现的核酸,包括包含编码来自多种不同细胞类型的各种结构域的核酸的嵌合组合的核酸。在一些实施例中,靶细胞已经改变以结合一种或多种靶抗原,例如一种或多种肿瘤抗原。在一些实施例中,靶抗原选自ror1、b细胞成熟抗原(bcma)、碳酸酐酶9(caix)、tegfr、her2/neu(受体酪氨酸激酶erbb2)、l1-cam、cd19、cd20、cd22、间皮素、cea、和乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、egfr、上皮糖蛋白2(epg-2)、上皮糖蛋白40(epg-40)、epha2、erb-b2、erb-b3、erb-b4、erbb二聚体、egfrviii、叶酸结合蛋白(fbp)、fcrl5、fcrh5、胎儿型乙酰胆碱受体、gd2、gd3、hmw-maa、il-22r-α、il-13r-α2、激酶插入结构域受体(kdr)、κ轻链、lewisy、l1-细胞黏附分子(l1-cam)、黑色素瘤相关抗原(mage)-a1、mage-a3、mage-a6、黑色素瘤优先表达抗原(prame)、存活蛋白、tag72、b7-h6、il-13受体α2(il-13ra2)、ca9、gd3、hmw-maa、cd171、g250/caix、hla-aimageal、hla-a2ny-eso-1、psca、叶酸受体-a、cd44v6、cd44v7/8、avb6整联蛋白、8h9、ncam、vegf受体、5t4、胎儿型achr、nkg2d配体、cd44v6、双抗原、癌-睾丸抗原、间皮素、鼠cmv、黏蛋白1(muc1)、muc16、psca、nkg2d、ny-eso-1、mart-1、gp100、瘤胚抗原、ror1、tag72、vegf-r2、癌胚抗原(cea)、her2/neu、雌激素受体、孕酮受体、肝配蛋白b2、cd123、c-met、gd-2、o-乙酰化gd2(ogd2)、ce7、肾母细胞瘤1(wt-1)、周期蛋白、周期蛋白a2、ccl-1、cd138、病原体特异性抗原和与通用标签相关的抗原。在一些实施例中,靶细胞已经改变以(例如通过tcr或car)结合以下肿瘤抗原中的一种或多种。肿瘤抗原可以包括但不限于ad034、akt1、brap、cage、cdx2、clp、ct-7、ct8/hom-tes-85、ctage-1、腓骨蛋白-1、hage、hca587/mage-c2、hcap-g、hce661、her2/neu、hla-cw、hom-hd-21/半乳凝素9、hom-meel-40/ssx2、hom-rcc-3.1.3/caxii、hoxa7、hoxb6、hu、hub1、km-hn-3、km-kn-1、koc1、koc2、koc3、koc3、lage-1、mage-1、mage-4a、mpp11、msln、nnp-1、ny-br-1、ny-br-62、ny-br-85、ny-co-37、ny-co-38、ny-eso-1、ny-eso-5、ny-lu-12、ny-ren-10、ny-ren-19/lkb/stk11、ny-ren-21、ny-ren-26/bcr、ny-ren-3/ny-co-38、ny-ren-33/snc6、ny-ren-43、ny-ren-65、ny-ren-9、ny-sar-35、ogfr、plu-1、rab38、rbpjκ、rhamm、scp1、scp-1、ssx3、ssx4、ssx5、top2a、top2b、或酪氨酸酶。1.抗原受体a)嵌合抗原受体(car)细胞通常表达重组受体,例如抗原受体,包括功能性非tcr抗原受体(例如嵌合抗原受体(car))和其他抗原结合受体(例如转基因t细胞受体(tcr))。在受体中还有其他嵌合受体。示例性抗原受体(包括car)以及用于将此类受体工程化并引入细胞中的方法包括例如国际专利申请公开号wo200014257、wo2013126726、wo2012/129514、wo2014031687、wo2013/166321、wo2013/071154、wo2013/123061,美国专利申请公开号us2002131960、us2013287748、us20130149337,美国专利号6,451,995、7,446,190、8,252,592、8,339,645、8,398,282、7,446,179、6,410,319、7,070,995、7,265,209、7,354,762、7,446,191、8,324,353和8,479,118,以及欧洲专利申请号ep2537416所述的那些,和/或由sadelain等人,cancerdiscov.[癌症发现]2013年4月;3(4):388–398;davila等人(2013)plosone[公共科学图书馆·综合]8(4):e61338;turtle等人,curr.opin.immunol.[免疫学新见],2012年10月;24(5):633-39;wu等人,cancer[癌症],2012年3月18(2):160-75所述的那些。在一些方面中,抗原受体包括car,如美国专利号7,446,190所述的,以及国际专利申请公开号wo/2014055668a1所述的那些。car的实例包括如任何上述出版物中披露的car,例如wo2014031687,us8,339,645,us7,446,179,us2013/0149337,美国专利号7,446,190,美国专利号8,389,282,kochenderfer等人,2013,naturereviewsclinicaloncology[自然评论临床肿瘤学],10,267-276(2013);wang等人(2012)j.immunother.[免疫疗法杂志]35(9):689-701;以及brentjens等人,scitranslmed.[科学转化医学]20135(177)。还参见wo2014031687、us8,339,645、us7,446,179、us2013/0149337、美国专利号7,446,190和美国专利号8,389,282。嵌合受体(例如car)通常包括细胞外抗原结合结构域,例如抗体分子的一部分,通常是抗体的可变重(vh)链区和/或可变轻(vl)链区,例如scfv抗体片段。在一些实施例中,受体靶向的抗原是多肽。在一些实施例中,它是碳水化合物或其他分子。在一些实施例中,与正常或非靶向性细胞或组织相比,抗原在疾病或病症的细胞(例如肿瘤或致病细胞)上选择性表达或过表达。在其他实施例中,抗原在正常细胞上表达和/或在工程化细胞上表达。可以被受体靶向的抗原包括但不限于αvβ6整联蛋白(avb6整联蛋白)、b细胞成熟抗原(bcma)、b7-h6、碳酸酐酶9(ca9,也称为caix或g250)、癌-睾丸抗原、癌/睾丸抗原1b(ctag,也称为ny-eso-1和lage-2)、癌胚抗原(cea)、周期蛋白、周期蛋白a2、c-c基序趋化因子配体1(ccl-1)、cd19、cd20、cd22、cd23、cd24、cd30、cd33、cd38、cd44、cd44v6、cd44v7/8、cd123、cd138、cd171、表皮生长因子蛋白(egfr)、截短的表皮生长因子蛋白(tegfr)、iii型表皮生长因子受体突变体(egfrviii)、上皮糖蛋白2(epg-2)、上皮糖蛋白40(epg-40)、肝配蛋白b2、肝配蛋白受体a2(epha2)、雌激素受体、fc受体样5(fcrl5;也称为fc受体同源物5或fcrh5)、胎儿型乙酰胆碱受体(胎儿型achr)、叶酸结合蛋白(fbp)、叶酸受体α、胎儿型乙酰胆碱受体、神经节苷脂gd2、o-乙酰化gd2(ogd2)、神经节苷脂gd3、糖蛋白100(gp100)、her2/neu(受体酪氨酸激酶erbb2)、her3(erb-b3)、her4(erb-b4)、erbb二聚体、人高分子量黑色素瘤相关抗原(hmw-maa)、乙型肝炎表面抗原、人白细胞抗原a1(hla-ai)、人白细胞抗原a2(hla-a2)、il-22受体α(il-22ra)、il-13受体α2(il-13ra2)、激酶插入结构域受体(kdr)、κ轻链、l1细胞黏附分子(l1cam)、l1-cam的ce7表位、含有8家族成员a的富亮氨酸重复序列(lrrc8a)、lewisy、黑色素瘤相关抗原(mage)-a1、mage-a3、mage-a6、间皮素、c-met、鼠巨细胞病毒(cmv)、黏蛋白1(muc1)、muc16、自然杀伤组2成员d(nkg2d)配体、melana(mart-1)、神经细胞黏附分子(ncam)、瘤胚抗原、黑色素瘤优先表达抗原(prame)、孕酮受体、前列腺特异性抗原、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(psma)、受体酪氨酸激酶样孤儿受体1(rorl)、存活蛋白、滋养层细胞糖蛋白(tpbg,还称为5t4)、肿瘤相关糖蛋白72(tag72)、血管内皮生长因子受体(vegfr)、血管内皮生长因子受体2(vegfr2)、肾母细胞瘤1(wt-1)、和病原体特异性抗原。在一些实施例中,受体靶向的抗原在一些实施例中包括孤儿酪氨酸激酶受体rorl,tegfr,her2,ll-cam,cd19,cd20,cd22,间皮素,cea,和乙型肝炎表面抗原,抗叶酸受体,cd23,cd24,cd30,cd33,cd38,cd44,egfr,egp-2,egp-4,0epha2,erbb2、3、或4,fbp,胎儿型乙酰胆碱受体,gd2,gd3,hmw-maa,il-22r-α,il-13r-α2,kdr,κ轻链,lewisy,l1-细胞黏附分子,mage-a1,间皮素,muc1,muc16,psca,nkg2d配体,ny-eso-1,mart-1,gp100,瘤胚抗原,ror1,tag72,vegf-r2,癌胚抗原(cea),前列腺特异性抗原,psma,her2/neu,雌激素受体,孕酮受体,肝配蛋白b2,cd123,c-met,gd-2,和magea3,ce7,肾母细胞瘤1(wt-1),周期蛋白例如周期蛋白a1(ccna1),和/或生物素化分子,和/或由hiv、hcv、hbv或其他病原体表达的分子。在一些实施例中,car对肿瘤相关抗原(例如cd19、cd20、碳酸酐酶ix(caix)、cd171、cea、erbb2、gd2、α-叶酸受体、lewisy抗原、前列腺特异性膜抗原(psma)或肿瘤相关糖蛋白72(tag72))具有结合特异性。在一些实施例中,car结合病原体特异性抗原。在一些实施例中,car对病毒抗原(例如hiv、hcv、hbv等)、细菌抗原和/或寄生虫抗原具有特异性。在嵌合受体中有嵌合抗原受体(car)。嵌合受体(例如car)通常包括细胞外抗原结合结构域,例如抗体分子的一部分,通常是抗体的可变重(vh)链区和/或可变轻(vl)链区,例如scfv抗体片段。在一些实施例中,重组受体(例如car)的抗体部分进一步包括免疫球蛋白恒定区的至少一部分,例如铰链区(例如igg4铰链区)和/或ch1/cl和/或fc区。在一些实施例中,恒定区或部分属于人igg,例如igg4或igg1。在一些方面中,恒定区的部分用作抗原识别组分(例如scfv)和跨膜结构域之间的间隔子区。与不存在间隔子相比,间隔子的长度可以提供抗原结合后细胞的增强的反应性。示例性间隔子(例如铰链区)包括国际专利申请公开号wo2014031687所述的那些。在一些实例中,间隔子的长度为或约为12个氨基酸或长度不超过12个氨基酸。示例性间隔子包括具有至少约10至229个氨基酸、约10至200个氨基酸、约10至175个氨基酸、约10至150个氨基酸、约10至125个氨基酸、约10至100个氨基酸、约10至75个氨基酸、约10至50个氨基酸,约10至40个氨基酸、约10至30个氨基酸、约10至20个氨基酸或约10至15个氨基酸(并且包括任何列出的范围的端点之间的任何整数)的那些。在一些实施例中,间隔子区具有约12个或更少的氨基酸、约119个或更少的氨基酸、或约229个或更少的氨基酸。示例性间隔子包括单独的igg4铰链、与ch2和ch3结构域连接的igg4铰链、或与ch3结构域连接的igg4铰链。示例性间隔子包括但不限于hudecek等人(2013)clin.cancerres.[临床癌症研究],19:3153或国际专利申请公开号wo2014031687所述的那些。在一些实施例中,间隔子具有seqidno:51213所示的序列,并且由seqidno:51212所示的序列编码。在一些实施例中,间隔子具有seqidno:51214所示的序列。在一些实施例中,间隔子具有seqidno:51215所示的序列。在一些实施例中,恒定区或部分属于igd。在一些实施例中,间隔子具有seqidno:51216所示的序列。在一些实施例中,间隔子具有与seqidno:51213、51214、51215或51216中的任一个表现出至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性的氨基酸序列。此抗原识别结构域通常与一种或多种细胞内信号传导组分(例如通过抗原受体复合物(例如tcr复合物)(在car的情况下)模拟活化和/或经由另一种细胞表面受体来模拟信号的信号传导组分)连接。因此,在一些实施例中,抗原结合组分(例如,抗体)与一个或多个跨膜和细胞内信号传导结构域连接。在一些实施例中,跨膜结构域与细胞外结构域融合。在一个实施例中,使用天然与受体(例如car)中的一个结构域缔合的跨膜结构域。在一些例子中,通过氨基酸取代选择或修饰跨膜结构域以避免此类结构域与相同或不同表面膜蛋白的跨膜结构域结合,以最小化与受体复合物的其他成员的相互作用。在一些实施例中,跨膜结构域从自然来源或合成来源衍生。当来源是天然的时,在一些方面中,结构域可以衍生自任何膜结合蛋白或跨膜蛋白。跨膜区包括衍生自以下的那些(即至少包含以下中的一个或多个跨膜区):t细胞受体的α、β或ζ链,cd28,cd3ε,cd45,cd4,cd5,cd8,cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137,cd154。可替代地,在一些实施例中,跨膜结构域是合成的。在一些方面中,合成跨膜结构域主要包含疏水残基,例如亮氨酸和缬氨酸。在一些方面中,将在合成跨膜结构域的每个末端发现苯丙氨酸、色氨酸和缬氨酸的三联体。在一些实施例中,连接是通过接头、间隔子和/或一个或多个跨膜结构域。在细胞内信号传导结构域有通过自然抗原受体模拟或接近信号、通过这种受体与共刺激受体结合模拟或接近信号、和/或仅通过共刺激受体模拟或接近信号的那些。在一些实施例中,短的寡肽或多肽接头(例如长度在2与10个之间的氨基酸的接头,例如含有甘氨酸和丝氨酸的接头,例如甘氨酸-丝氨酸双联体)存在并形成car的跨膜结构域和胞质信号传导结构域之间的连接。受体(例如car)通常包括至少一种或多种细胞内信号传导组分。在一些实施例中,受体包括tcr复合物的细胞内组分,例如介导t细胞活化和细胞毒性的tcrcd3链,例如cd3ζ链。因此,在一些方面中,抗原结合部分与一个或多个细胞信号传导模块连接。在一些实施例中,细胞信号传导模块包括cd3跨膜结构域、cd3细胞内信号传导结构域和/或其他cd跨膜结构域。在一些实施例中,受体(例如car)进一步包括一种或多种另外的分子(例如fc受体γ、cd8、cd4、cd25或cd16)的一部分。例如,在一些方面中,car或其他嵌合受体包括cd3-ζ(cd3-ζ)或fc受体γ和cd8、cd4、cd25或cd16之间的嵌合分子。在一些实施例中,在连接car或其他嵌合受体时,受体的胞质结构域或细胞内信号传导结构域活化免疫细胞(例如,工程化以表达car的t细胞)的正常效应物功能或反应中的至少一种。例如,在一些背景下,car诱导t细胞的功能,例如细胞溶解活性或t辅助活性,例如细胞因子或其他因子的分泌。在一些实施例中,使用抗原受体组分或共刺激分子的细胞内信号传导结构域的截短部分代替完整的免疫刺激链(例如,如果其转导效应物功能信号的话)。在一些实施例中,一个或多个细胞内信号传导结构域包括t细胞受体(tcr)的胞质序列,并且在一些方面中还包括共受体(其在自然背景下与此类受体并行起作用以在抗原受体接合后启动信号转导)和/或此类分子的任何衍生物或变体的那些,和/或具有相同功能能力的任何合成序列。在自然tcr的背景下,完全活化通常不仅需要通过tcr进行信号传导,还需要共刺激信号。因此,在一些实施例中,为了促进完全活化,用于生成次级或共刺激信号的组分也包括在car中。在其他实施例中,car不包括用于生成共刺激信号的组分。在一些方面中,另外的car在同一细胞中表达,并且提供用于生成次级或共刺激信号的组分。在一些方面中,t细胞活化被描述为由两类胞质信号传导序列介导:通过tcr启动抗原依赖性初级活化的那些(初级胞质信号传导序列),以及以抗原非依赖性方式起作用以提供次级或共刺激信号的那些(次级胞质信号传导序列)。在一些方面中,car包括这些信号传导组分中的一种或两种。在一些方面中,car包括调控tcr复合物的初级活化的初级胞质信号传导序列。以刺激方式起作用的初级胞质信号传导序列可以含有信号传导基序(其被称为基于免疫受体酪氨酸的活化基序或itam)。含有初级胞质信号传导序列的itam的实例包括衍生自cd3ζ链、fcrγ、cd3γ、cd3δ和cd3ε的那些。在一些实施例中,car中的一种或多种胞质信号传导分子含有胞质信号传导结构域、其部分或衍生自cd3ζ的序列。在一些实施例中,car包括共刺激受体(例如cd28、4-1bb、ox40、dap10和icos)的信号传导结构域和/或跨膜部分。在一些方面中,同一car包括活化和共刺激两种组分。在一些实施例中,活化结构域包括在一种car内,而共刺激组分由识别另一种抗原的另一种car提供。在一些实施例中,car包括在同一细胞上表达的活化或刺激car、共刺激car(参见wo2014/055668)。在一些方面中,细胞包括一种或多种刺激或活化car和/或共刺激car。在一些实施例中,细胞进一步包括抑制性car(icar,参见fedorov等人,sci.transl.medicine[科学转化医学],5(215)(2013年12月)),例如如下car:该car识别除了与疾病或病症相关联和/或对其具有特异性的抗原之外的抗原,凭此通过靶向疾病的car递送的活化信号被抑制性car与其配体的结合减少或抑制,例如以减少脱靶效应。在某些实施例中,细胞内信号传导结构域包含与cd3(例如,cd3-ζ)细胞内结构域连接的cd28跨膜和信号传导结构域。在一些实施例中,细胞内信号传导结构域包含与cd3ζ细胞内结构域连接的嵌合cd28和cd137(4-1bb,tnfrsf9)共刺激结构域。在一些实施例中,car涵盖胞质部分中的一个或多个(例如两个或更多个)共刺激结构域和活化结构域(例如初级活化结构域)。示例性car包括cd3-ζ、cd28和4-1bb的细胞内组分。在一些实施例中,car或其他抗原受体进一步包括标记,例如细胞表面标记,其可用于确认细胞的转导或工程化以表达受体,例如细胞表面受体的截短形式,例如截短的egfr(tegfr)。在一些方面中,标记包括cd34、ngfr或表皮生长因子受体(例如,tegfr)的全部或部分(例如,截短形式)。在一些实施例中,编码标记的核酸与编码接头序列(例如可切割的接头序列,例如t2a)的多核苷酸可操作地连接。参见wo2014031687。在一些实施例中,编码通过t2a核糖体开关分开的car和egfrt的构建体的引入可以表达来自相同构建体的两种蛋白质,使得egfrt可以用作检测表达这种构建体的细胞的标记。在一些实施例中,标记和任选地接头序列可以是如公开的申请号wo2014031687中披露的任何标记和任选地接头序列。例如,标记可以是截短的egfr(tegfr),其任选地与接头序列(例如t2a可切割的接头序列)连接。用于截短的egfr(例如tegfr)的示例性多肽包含seqidno:51218所示的氨基酸序列或与seqidno:51218表现出至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性的氨基酸序列。示例性t2a接头序列包含seqidno:51217所示的氨基酸序列或与seqidno:51217表现出至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性的氨基酸序列。在一些实施例中,标记是非天然发现于t细胞上或非天然发现于t细胞表面上的分子(例如细胞表面蛋白)或其部分。在一些实施例中,分子是非自身分子,例如非自身蛋白质,即没有被细胞过继转移到其中的宿主的免疫系统识别为“自身”的分子。在一些实施例中,标记不起任何治疗功能和/或除了用作基因工程化标记(例如,用于选择成功工程化的细胞)之外不产生任何作用。在其他实施例中,标记可以是治疗性分子或另外发挥一些所希望的作用的分子,例如在体内细胞将遇到的配体,例如共刺激或免疫检查点分子,以在过继转移和遇到配体时增强和/或减弱细胞的反应。在一些情况下,car被称为第一代、第二代和/或第三代car。在一些方面中,第一代car是在抗原结合时单独提供cd3链诱导的信号的car;在一些方面中,第二代car是提供这种信号和共刺激信号的car,例如包括来自共刺激受体(例如cd28或cd137)的细胞内信号传导结构域的car;在一些方面中,第三代car是包括不同共刺激受体的多个共刺激结构域的car。在一些实施例中,嵌合抗原受体包括含有抗体或抗体片段的细胞外部分。在一些方面中,嵌合抗原受体包括含有抗体或片段的细胞外部分和细胞内信号传导结构域。在一些实施例中,抗体或片段包括scfv,并且细胞内结构域含有itam。在一些方面中,细胞内信号传导结构域包括cd3-ζ(cd3ζ)链的ζ链的信号传导结构域。在一些实施例中,嵌合抗原受体包括连接细胞外结构域和细胞内信号传导结构域的跨膜结构域。在一些方面中,跨膜结构域含有cd28的跨膜部分。细胞外结构域和跨膜可以直接或间接连接。在一些实施例中,细胞外结构域和跨膜通过间隔子(例如本文所述的任何间隔子)连接。在一些实施例中,嵌合抗原受体含有t细胞共刺激分子的细胞内结构域,例如在跨膜结构域和细胞内信号传导结构域之间。在一些方面中,t细胞共刺激分子是cd28或41bb。在一些实施例中,car含有抗体(例如抗体片段)、作为或含有cd28或其功能变体的跨膜部分的跨膜结构域、和含有cd28或其功能变体的信号传导部分和cd3ζ或其功能变体的信号传导部分的细胞内信号传导结构域。在一些实施例中,car含有抗体(例如抗体片段)、作为或含有cd28或其功能变体的跨膜部分的跨膜结构域、和含有4-1bb或其功能变体的信号传导部分和cd3ζ或其功能变体的信号传导部分的细胞内信号传导结构域。在一些此类实施例中,受体进一步包括含有ig分子(例如人ig分子)的一部分的间隔子,例如ig铰链,例如igg4铰链,例如仅铰链间隔子。在一些实施例中,受体(例如car)的跨膜结构域是人cd28或其变体的跨膜结构域,例如人cd28(登录号:p10747.1)的27个氨基酸的跨膜结构域,或是包含seqidno:51219所示的氨基酸序列或与seqidno:51219表现出至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性的氨基酸序列的跨膜结构域;在一些实施例中,含有重组受体的部分的跨膜结构域包含seqidno:51220所示的氨基酸序列或与其具有至少或至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性的氨基酸序列。在一些实施例中,嵌合抗原受体含有t细胞共刺激分子的细胞内结构域。在一些方面中,t细胞共刺激分子是cd28或41bb。在一些实施例中,细胞内信号传导结构域包含人cd28或其功能变体或部分的细胞内共刺激信号传导结构域,例如其41个氨基酸的结构域和/或在天然cd28蛋白的位置186-187处具有ll至gg取代的这种结构域。在一些实施例中,细胞内信号传导结构域可以包含seqidno:51221或51222所示的氨基酸序列或与seqidno:51221或51222表现出至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性的氨基酸序列。在一些实施例中,细胞内结构域包含41bb或其功能变体或部分的细胞内共刺激信号传导结构域,例如人4-1bb(登录号q07011.1)或其功能变体或部分的42个氨基酸的胞质结构域,例如seqidno:51223所示的氨基酸序列或与seqidno:51223表现出至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性的氨基酸序列。在一些实施例中,细胞内信号传导结构域包含人cd3ζ刺激信号传导结构域或其功能变体,例如人cd3ζ(登录号:p20963.2)的同种型3的112aa胞质结构域或如美国专利号7,446,190或美国专利号8,911,993所述的cd3ζ信号传导结构域。在一些实施例中,细胞内信号传导结构域包含seqidno:51224、51225或51226所示的氨基酸序列或与seqidno:51224、51225或51226表现出至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性的氨基酸序列。在一些方面中,间隔子仅含有igg的铰链区,例如仅igg4或igg1的铰链,例如seqidno:51213所示的仅铰链间隔子。在其他实施例中,间隔子是与ch2和/或ch3结构域连接的ig铰链,例如和igg4铰链。在一些实施例中,间隔子是与ch2和ch3结构域连接的ig铰链,例如igg4铰链,如seqidno:396所示。在一些实施例中,间隔子是仅与ch3结构域连接的ig铰链,例如igg4铰链,如seqidno:51214所示。在一些实施例中,间隔子是或包含富甘氨酸-丝氨酸序列或其他柔性接头,例如已知的柔性接头。例如,在一些实施例中,car包括特异性结合抗原的抗体或片段、间隔子(例如任何含ig铰链的间隔子)、cd28跨膜结构域、cd28细胞内信号传导结构域和cd3ζ信号传导结构域。在一些实施例中,car包括特异性结合抗原的抗体或片段、间隔子(例如任何含ig铰链的间隔子)、cd28跨膜结构域、cd28细胞内信号传导结构域和cd3ζ信号传导结构域。在一些实施例中,此类car构建体进一步包括t2a核糖体跳跃元件和/或tegfr序列,例如car的下游。术语“多肽”和“蛋白质”可互换地使用以指代氨基酸残基的聚合物,并且不限于最小长度。多肽(包括所提供的受体和其他多肽,例如接头或肽)可以包括氨基酸残基(包括天然和/或非天然氨基酸残基)。这些术语还包括多肽的表达后修饰,例如糖基化、唾液酸化、乙酰化和磷酸化。在一些方面中,多肽可以含有关于天然或自然序列的修饰,只要蛋白质维持所希望的活性即可。这些修饰可以是有意的(如通过定点诱变)或可能是偶然的(例如通过产生蛋白质的宿主突变或由于pcr扩增引起的错误)。b)t细胞受体在一些实施例中,基因工程化抗原受体包括重组t细胞受体(tcr)和/或从天然存在的t细胞克隆的tcr。因此,在一些实施例中,靶细胞已经改变以含有特定t细胞受体(tcr)基因(例如,trac和trbc基因)。tcr或其抗原结合部分包括识别靶多肽(例如肿瘤、病毒或自身免疫蛋白的抗原)的肽表位或t细胞表位的那些。在一些实施例中,tcr对肿瘤相关抗原(例如癌胚抗原(cea)、gp100、由t细胞1识别的黑色素瘤抗原(mart1)、黑色素瘤抗原a3(magea3)、nyeso1或p53)具有结合特异性。在一些实施例中,“t细胞受体”或“tcr”是如下分子,该分子含有可变α和β链(也分别称为tcrα和tcrβ)或可变γ和δ链(也分别称为tcrγ和tcrδ)或其抗原结合部分,并且能够特异性结合与mhc分子结合的肽。在一些实施例中,tcr呈αβ形式。典型地,以αβ和γδ形式存在的tcr通常在结构上相似,但表达它们的t细胞可以具有不同的解剖位置或功能。通常,tcr在或可以在t细胞(或t淋巴细胞)的表面上表达,此时tcr通常负责识别与主要组织相容性复合物(mhc)分子结合的抗原。在一些实施例中,tcr是完整的tcr或其抗原结合部分或其抗原结合片段。在一些实施例中,tcr是完整或全长tcr,包括呈αβ形式或γδ形式的tcr。在一些实施例中,tcr是抗原结合部分,其少于全长tcr但结合在mhc分子中结合的特异性肽,例如结合mhc-肽复合物。在一些情况下,tcr的抗原结合部分或片段可以仅含有全长或完整tcr的结构性结构域的一部分,但是仍能够结合与完整tcr结合的肽表位,例如mhc-肽复合物。在一些情况下,抗原结合部分含有tcr的可变结构域,例如tcr的可变α链和可变β链,足以形成结合特异性mhc-肽复合物的结合位点。通常,tcr的可变链含有参与肽、mhc和/或mhc-肽复合物的识别的互补决定区(cdr)。在一些实施例中,tcr的可变结构域含有高变环或cdr,其通常是抗原识别和结合能力和特异性的主要贡献者。在一些实施例中,tcr的cdr或其组合形成给定tcr分子的全部或基本上全部的抗原结合位点。tcr链的可变区内的各种cdr通常由框架区(fr)(其与cdr相比通常在tcr分子中显示出较小的可变性)分开(参见例如,jores等人,proc.nat'lacad.sci.u.s.a.[美国国家科学院院刊]87:9138,1990;chothia等人,emboj.[欧洲分子生物学学会杂志]7:3745,1988;还参见lefranc等人,dev.comp.immunol.[发育与比较免疫学]27:55,2003)。在一些实施例中,cdr3是负责抗原结合或特异性的主要cdr,或者是在给定tcr可变区的用于肽-mhc复合物的加工肽部分的抗原识别和/或相互作用的三个cdr中最重要的cdr。在一些背景下,α链的cdr1可以与某些抗原肽的n-末端部分相互作用。在一些背景下,β链的cdr1可以与肽的c-末端部分相互作用。在一些背景下,cdr2对mhc-肽复合物的mhc部分的相互作用或识别具有最强的作用或者是主要的负责cdr。在一些实施例中,β-链的可变区可以含有另外的高变区(cdr4或hvr4),其通常参与超抗原结合而非抗原识别(kotb(1995)clinicalmicrobiologyreviews[临床微生物学评论],8:411-426)。在一些实施例中,tcr含有可变α结构域(vα)和/或可变β结构域(vβ)或其抗原结合片段。在一些实施例中,tcr的α-链和/或β-链还可以含有恒定结构域、跨膜结构域和/或短胞质尾(参见例如,janeway等人,immunobiology:theimmunesysteminhealthanddisease[免疫生物学:健康与疾病的免疫系统],第3版,currentbiologypublications[当代生物学出版物],第4页:33,1997)。在一些实施例中,α链恒定结构域由trac基因(imgt命名法)编码或是其变体。在一些实施例中,β链恒定区由trbc1或trbc2基因(imgt命名法)编码或是其变体。在一些实施例中,恒定结构域与细胞膜相邻。例如,在一些情况下,由两条链形成的tcr的细胞外部分含有两个膜近端恒定结构域和两个膜远端可变结构域,其中可变结构域各自含有cdr。确定或鉴定tcr的各种结构域或区域在技术人员的水平内。在一些方面中,tcr的残基是已知的或可以根据国际免疫遗传学信息系统(imgt)编号系统鉴定(参见例如www.imgt.org;还参见lefranc等人(2003)developmentalandcomparativeimmunology[发育和比较免疫学],2&;55-77;和thetcellfactsbook[t细胞丛书]第2版,lefranc和lefrancacademicpress[学术出版社]2001)。使用此系统,tcrvα链和/或vβ链内的cdr1序列对应于残基编号27-38(包括端值)之间存在的氨基酸,tcrvα链和/或vβ链内的cdr2序列对应于残基编号56-65(包括端值)之间存在的氨基酸,并且tcrvα链和/或vβ链内的cdr3序列对应于残基编号105-117(包括端值)之间存在的氨基酸。在一些实施例中,tcr可以是例如通过一个或多个二硫键连接的两条链α和β(或任选地γ和δ)的异二聚体。在一些实施例中,tcr的恒定结构域可以含有短连接序列,其中半胱氨酸残基形成二硫键,从而连接tcr的两条链。在一些实施例中,tcr可以在α链和β链的每一个中具有另外的半胱氨酸残基,使得tcr在恒定结构域中含有两个二硫键。在一些实施例中,恒定和可变结构域中的每一个含有由半胱氨酸残基形成的二硫键。在一些实施例中,如所述的用于工程化细胞的tcr是从已知的一个或多个tcr序列(例如vα,β链的序列)生成的tcr,其中基本上全长的编码序列是容易获得的。用于从细胞来源获得全长tcr序列(包括v链序列)的方法是熟知的。在一些实施例中,编码tcr的核酸可以从多种来源获得,例如通过在给定的一个或多个细胞内或分离自其的tcr编码核酸的聚合酶链式反应(pcr)扩增或公开可获得的tcrdna序列的合成。在一些实施例中,tcr获得自生物来源,例如来自细胞,例如来自t细胞(例如细胞毒性t细胞)、t细胞杂交瘤或其他公开可获得的来源。在一些实施例中,t细胞可以从体内分离的细胞获得。在一些实施例中,t细胞可以是培养的t细胞杂交瘤或克隆。在一些实施例中,tcr或其抗原结合部分可以从tcr序列的知识合成地生成。在一些实施例中,鉴定用于靶抗原(例如,癌抗原)的高亲和力t细胞克隆,从患者分离,并引入细胞中。在一些实施例中,已经在用人免疫系统基因(例如,人白细胞抗原系统或hla)工程化的转基因小鼠中生成了针对靶抗原的tcr克隆。参见例如,肿瘤抗原(参见例如,parkhurst等人(2009)clincancerres.[临床癌症研究]15:169–180和cohen等人(2005)jimmunol.[免疫学杂志]175:5799–5808)。在一些实施例中,噬菌体展示用于分离针对靶抗原的tcr(参见例如,varela-rohena等人(2008)natmed.[自然医学]14:1390–1395和li(2005)natbiotechnol.[自然生物技术]23:349–354)。在一些实施例中,tcr或其抗原结合部分是经过修饰或工程化的tcr或其抗原结合部分。在一些实施例中,定向进化方法用于生成具有改变的特性的tcr,例如对特异性mhc-肽复合物具有更高的亲和力。在一些实施例中,通过展示方法实现定向进化,这些展示方法包括但不限于酵母展示(holler等人(2003)natimmunol[自然免疫学],4,55-62;holler等人(2000)procnatlacadsciusa[美国国家科学院院刊],97,5387-92)、噬菌体展示(li等人(2005)natbiotechnol[自然生物技术],23,349-54)、或t细胞展示(chervin等人(2008)jimmunolmethods[免疫学方法杂志],339,175-84)。在一些实施例中,展示方式涉及工程化或修饰已知的亲本或参考tcr。例如,在一些情况下,野生型tcr可用作用于产生诱变的tcr(其中cdr的一个或多个残基被突变,并且选择具有所希望的改变的特性(例如对所希望的靶抗原具有更高亲和力)的突变体)的模板。在如所述的一些实施例中,tcr可以含有引入的一个或多个二硫键。在一些实施例中,不存在天然二硫键。在一些实施例中,形成天然链间二硫键的一个或多个天然半胱氨酸(例如在α链和β链的恒定结构域中)被另一种残基(例如丝氨酸或丙氨酸)取代。在一些实施例中,可以通过将α链和β链上(例如在α链和β链的恒定结构域中)的非半胱氨酸残基突变为半胱氨酸来形成引入的二硫键。tcr的示例性非天然二硫键描述于公开的国际pct号wo2006/000830和wo2006037960中。在一些实施例中,半胱氨酸可以在α链的残基thr48和β链的残基ser57、α链的残基thr45和β链的残基ser77、α链的残基tyr10和β链的残基ser17、α链的残基thr45和β链的残基asp59和/或α链的残基ser15和β链的残基glu15处引入。在一些实施例中,重组tcr中非天然半胱氨酸残基的存在(例如,导致一个或多个非天然二硫键)可以有利于在引入它的细胞中产生所希望的重组tcr,而不是表达含有天然tcr链的错配tcr对。在一些实施例中,tcr链含有跨膜结构域。在一些实施例中,跨膜结构域带正电荷。在一些情况下,tcr链含有胞质尾。在一些方面中,tcr的每条链(例如α或β)可以具有一个n-末端免疫球蛋白可变结构域、一个免疫球蛋白恒定结构域、跨膜区和c-末端处的短胞质尾。在一些实施例中,tcr(例如经由胞质尾)与参与介导信号转导的cd3复合物的恒定蛋白质缔合。在一些情况下,该结构允许tcr与其他分子如cd3及其亚基缔合。例如,含有恒定结构域与跨膜区的tcr可以将蛋白质锚定在细胞膜中并与cd3信号传导装置或复合物的恒定亚基缔合。cd3信号传导亚基(例如cd3γ、cd3δ、cd3ε和cd3ζ链)的细胞内尾含有参与tcr复合物信号传导能力的一种或多种基于免疫受体酪氨酸的活化基序或itam。在一些实施例中,tcr是全长tcr。在一些实施例中,tcr是抗原结合部分。在一些实施例中,tcr是二聚体tcr(dtcr)。在一些实施例中,tcr是单链tcr(sc-tcr)。tcr可以是细胞结合的或呈可溶形式。在一些实施例中,出于所提供的方法的目的,tcr呈在细胞表面上表达的细胞结合形式。在一些实施例中,dtcr含有第一多肽(其中对应于tcrα链可变区序列的序列与对应于tcrα链恒定区细胞外序列的序列的n末端融合)和第二多肽(其中对应于tcrβ链可变区序列的序列与对应于tcrβ链恒定区细胞外序列的序列的n末端融合),第一和第二多肽通过二硫键连接。在一些实施例中,键可以对应于天然二聚体αβtcr中存在的天然链间二硫键。在一些实施例中,链间二硫键不存在于天然tcr中。例如,在一些实施例中,可以将一个或多个半胱氨酸掺入dtcr多肽对的恒定区细胞外序列中。在一些情况下,天然和非天然两种二硫键可能是希望的。在一些实施例中,tcr含有跨膜序列以锚定至膜。在一些实施例中,dtcr含有tcrα链(其含有可变α结构域、恒定α结构域和附接至恒定α结构域的c-末端的第一二聚化基序)和tcrβ链(其包含可变β结构域、恒定β结构域和附接至恒定β结构域的c-末端的第一二聚化基序),其中第一和第二二聚化基序容易相互作用以在第一二聚化基序中的氨基酸和第二二聚化基序中的氨基酸之间形成共价键,从而将tcrα链和tcrβ链连接在一起。在一些实施例中,tcr是sctcr,其是含有能够结合mhc-肽复合物的α链和β链的单氨基酸链。典型地,sctcr可以使用本领域技术人员已知的方法生成,参见例如,国际公开的pct号wo96/13593、wo96/18105、wo99/18129、wo04/033685、wo2006/037960、wo2011/044186;美国专利号7,569,664;和schlueter,c.j.等人j.mol.biol.[分子生物学杂志]256,859(1996)。在一些实施例中,sctcr含有第一区段(其由对应于tcrα链可变区的氨基酸序列构成)、第二区段(其由对应于tcrβ链可变区序列(该序列与对应于tcrβ链恒定结构域细胞外序列的氨基酸序列的n末端融合)的氨基酸序列构成)、和接头序列(其将第一区段的c末端连接至第二区段的n末端)。在一些实施例中,sctcr含有第一区段(其由对应于tcrβ链可变区的氨基酸序列构成)、第二区段(其由对应于tcrα链可变区序列(该序列与对应于tcrα链恒定结构域细胞外序列的氨基酸序列的n末端融合)的氨基酸序列构成)、和接头序列(其将第一区段的c末端连接至第二区段的n末端)。在一些实施例中,sctcr含有第一区段(其由与α链细胞外恒定结构域序列的n末端融合的α链可变区序列构成)、和第二区段(其由与序列β链细胞外恒定和跨膜序列的n末端融合的β链可变区序列构成),以及任选地接头序列(其将第一区段的c末端连接至第二区段的n末端)。在一些实施例中,sctcr含有第一区段(其由与β链细胞外恒定结构域序列的n末端融合的tcrβ链可变区序列构成)、和第二区段(其由与序列α链细胞外恒定和跨膜序列的n末端融合的α链可变区序列构成),以及任选地接头序列(其将第一区段的c末端连接至第二区段的n末端)。在一些实施例中,对于待结合mhc-肽复合物的sctcr,α和β链必须配对,使得其可变区序列定向用于这种结合。促进sctcr中α和β配对的各种方法是本领域熟知的。在一些实施例中,包括连接序列,其连接α和β链以形成单多肽链。在一些实施例中,接头应该具有足够的长度以跨越α链的c末端和β链的n末端之间的距离,或反之亦然,同时还确保接头长度不那么长以使其阻断或减少sctcr与靶肽-mhc复合物的结合。在一些实施例中,sctcr的连接第一和第二tcr区段的接头可以是能够形成单多肽链同时保留tcr结合特异性的任何接头。在一些实施例中,接头序列可以例如具有式-p-aa-p-,其中p是脯氨酸,并且aa代表氨基酸序列,其中氨基酸是甘氨酸和丝氨酸。在一些实施例中,第一和第二区段配对,使得其可变区序列定向用于这种结合。因此,在一些情况下,接头具有足够的长度以跨越第一区段的c末端和第二区段的n末端之间的距离,或反之亦然,但是不能太长以阻断或减少sctcr与靶配体的结合。在一些实施例中,接头可以含有从或从约10至45个氨基酸,例如10至30个氨基酸或26至41个氨基酸残基,例如29、30、31或32个氨基酸。在一些实施例中,接头具有式-pggg-(sgggg)5-p-或-pggg-(sgggg)6-p-,其中p是脯氨酸,g是甘氨酸,并且s是丝氨酸(seqidno:51227或51228)。在一些实施例中,接头具有序列gsaddakkdaakkdgks(seqidno:51229)。在一些实施例中,sctcr在单氨基酸链的残基之间含有二硫键,其在一些情况下可以促进单链分子的α和β区之间配对的稳定性(参见例如美国专利号7,569,664)。在一些实施例中,sctcr含有共价二硫键,其将α链恒定结构域的免疫球蛋白区的残基连接至单链分子的β链恒定结构域的免疫球蛋白区的残基。在一些实施例中,二硫键对应于天然dtcr中存在的天然二硫键。在一些实施例中,天然tcr中不存在二硫键。在一些实施例中,二硫键是引入的非天然二硫键,例如通过将一个或多个半胱氨酸掺入sctcr多肽的第一和第二链区的恒定区细胞外序列中。示例性半胱氨酸突变包括如上所述的任何突变。在一些情况下,可存在天然和非天然二硫键。在一些实施例中,sctcr是非二硫键连接的截短的tcr,其中与其c-末端融合的异源亮氨酸拉链促进链缔合(参见例如国际公开的pct号wo99/60120)。在一些实施例中,sctcr含有经由肽接头与tcrβ可变结构域共价连接的tcrα可变结构域(参见例如国际公开的pct号wo99/18129)。在一些实施例中,任何tcr(包括dtcr或sctcr)可以与在t细胞表面上产生活性tcr的信号传导结构域连接。在一些实施例中,tcr在细胞表面上表达。在一些实施例中,tcr确实含有对应于跨膜序列的序列。在一些实施例中,跨膜结构域可以是cα或cβ跨膜结构域。在一些实施例中,跨膜结构域可以来自非tcr来源,例如来自cd3z、cd28或b7.1的跨膜区。在一些实施例中,tcr确实含有对应于胞质序列的序列。在一些实施例中,tcr含有cd3z信号传导结构域。在一些实施例中,tcr能够与cd3形成tcr复合物。在一些实施例中,tcr或其抗原结合片段对靶抗原以在或约在10-5和10-12m之间以及其中的所有单个值和范围的平衡结合常数表现出亲和力。在一些实施例中,靶抗原是mhc-肽复合物或配体。在一些实施例中,tcr或其抗原结合部分可以是重组产生的天然蛋白质或其突变形式(其中一种或多种特性(例如结合特征)已经改变)。在一些实施例中,tcr可以来源于各种动物物种之一,例如人、小鼠、大鼠或其他哺乳动物。在一些实施例中,为了生成编码tcr的载体,α和β链可以从总cdna(其分离自表达目的tcr的t细胞克隆)进行pcr扩增并克隆到表达载体中。在一些实施例中,α和β链可以合成地生成。在一些实施例中,将tcrα和β链分离并克隆到基因表达载体中。在一些实施例中,转录单元可以被工程化为含有ires(内部核糖体进入位点)的双顺反子单元,其允许通过来自单个启动子的信息来共表达基因产物(例如编码α和β链)。可替代地,在一些情况下,单个启动子可以指导rna(其在单个开放阅读框(orf)中含有通过编码自切割肽(例如,t2a)或蛋白酶识别位点(例如,弗林蛋白酶)的序列彼此分开的多种基因(例如编码α和β链))的表达。因此,orf编码单个多蛋白,其在翻译期间(在t2a的情况下)或翻译后被切割成单个蛋白质。在一些情况下,肽(例如t2a)可导致核糖体跳过(核糖体跳跃)2a元件c-末端处的肽键的合成,这导致2a序列末端与下一个肽下游之间的分开。2a切割肽(包括可诱导核糖体跳跃的那些)的实例是t2a、p2a、e2a和f2a。在一些实施例中,将α和β链克隆到不同的载体中。在一些实施例中,将生成的α和β链掺入逆转录病毒(例如慢病毒)载体中。在一些实施例中,tcrα和β基因经由小核糖核酸病毒2a核糖体跳跃肽连接,使得两条链共表达。在一些实施例中,tcr的遗传转移经由逆转录病毒或慢病毒载体或经由转座子完成(参见例如,baum等人(2006)moleculartherapy:thejournaloftheamericansocietyofgenetherapy.[分子疗法:美国基因疗法学会杂志]13:1050–1063;frecha等人(2010)moleculartherapy:thejournaloftheamericansocietyofgenetherapy.[分子疗法:美国基因疗法学会杂志]18:1748–1757;以及hackett等人(2010)moleculartherapy:thejournaloftheamericansocietyofgenetherapy.[分子疗法:美国基因疗法学会杂志]18:674–683)。2.载体和工程化方法所提供的方法包括表达重组受体(包括car或tcr)用于产生表达此类结合分子的基因工程化细胞。基因工程化通常涉及将编码重组或工程化组分的核酸引入细胞中,例如通过逆转录病毒转导、转染或转化。在一些实施例中,通过以下方式完成基因转移:首先刺激细胞,例如通过将其与诱导反应(例如增殖、存活和/或活化)的刺激进行组合,例如如通过细胞因子或活化标记的表达所测量的,然后转导活化细胞,并在培养物中扩增至足以用于临床应用的数量。用于引入基因工程化组分(例如抗原受体,例如car)的各种方法是熟知的,并且可以与所提供的方法和组合物一起使用。示例性方法包括用于转移编码受体的核酸的那些,包括经由病毒(例如逆转录病毒或慢病毒)转导、转座子和电穿孔。在一些实施例中,可以将编码重组受体的核酸克隆到合适的一种或多种表达载体中。表达载体可以是任何合适的重组表达载体,并且可以用于转化或转染任何合适的宿主。合适的载体包括设计用于繁殖和扩增或用于表达或用于两者的那些,例如质粒和病毒。在一些实施例中,载体可以是以下系列的载体:puc系列(富酶泰斯生命科学公司(fermentaslifesciences))、pbluescript系列(加利福尼亚州拉霍亚的stratagene公司(stratagene,lajolla,calif))、pet系列(威斯康星州麦迪逊的novagen公司(novagen,madison,wis.))、pgex系列(瑞典乌普萨拉的法玛西亚生物技术公司(pharmaciabiotech,uppsala,sweden))或pex系列(加利福尼亚州帕罗奥图的克隆科技公司(clontech,paloalto,calif.))。在一些情况下,也可以使用噬菌体载体,例如λg10、λgt11、λzapii(stratagene公司)、λembl4和λnm1149。在一些实施例中,可以使用植物表达载体,包括pbi01、pbi101.2、pbi101.3、pbi121和pbin19(克隆科技公司)。在一些实施例中,动物表达载体包括peuk-cl、pmam和pmamneo(克隆科技公司)。在一些实施例中,使用病毒载体,例如逆转录病毒载体。在一些实施例中,可以使用标准重组dna技术来制备重组表达载体。在一些实施例中,载体可以含有调节序列,例如转录和翻译起始和终止密码子,其对引入载体的宿主(例如,细菌、真菌,植物或动物)的类型具有特异性,酌情并考虑载体是基于dna还是基于rna。在一些实施例中,载体可以含有与编码重组受体的核苷酸序列可操作地连接的非天然启动子。在一些实施例中,启动子可以是非病毒启动子或病毒启动子,例如巨细胞病毒(cmv)启动子、sv40启动子、rsv启动子和在鼠干细胞病毒的长末端重复中发现的启动子。还考虑了本领域技术人员已知的其他启动子。在一些实施例中,使用重组感染性病毒颗粒(像例如,衍生自猿猴病毒40(sv40)、腺病毒、腺相关病毒(aav)的载体)将重组核酸转移到细胞中。在一些实施例中,使用重组慢病毒载体或逆转录病毒载体(例如γ-逆转录病毒载体)将重组核酸转移至t细胞中(参见例如,koste等人(2014)genetherapy[基因疗法]2014年4月3日.doi:10.1038/gt.2014.25;carlens等人(2000)exphematol[实验血液学]28(10):1137-46;alonso-camino等人(2013)molthernuclacids[分子疗法-核酸]2,e93;park等人,trendsbiotechnol.[生物技术趋势]2011年11月29日(11):550–557)。在一些实施例中,逆转录病毒载体具有长末端重复序列(ltr),例如衍生自莫洛尼鼠白血病病毒(momlv)、骨髓增生性肉瘤病毒(mpsv)、鼠胚胎干细胞病毒(mesv)、鼠干细胞病毒(mscv)、脾脏病灶形成病毒(sffv)或腺相关病毒(aav)的逆转录病毒载体。大多数逆转录病毒载体衍生自鼠逆转录病毒。在一些实施例中,逆转录病毒包括来源于任何禽类或哺乳动物细胞来源的那些。逆转录病毒典型地是双嗜性的,这意味着它们能够感染包括人在内的若干种物种的宿主细胞。在一个实施例中,待表达的基因替代逆转录病毒gag、pol和/或env序列。已经描述了许多说明性逆转录病毒系统(例如,美国专利号5,219,740;6,207,453;5,219,740;miller和rosman(1989)biotechniques[生物技术]7:980-990;miller,a.d.(1990)humangenetherapy[人类基因疗法]1:5-14;scarpa等人(1991)virology[病毒学]180:849-852;burns等人(1993)proc.natl.acad.sci.usa[美国国家科学院院刊]90:8033-8037;以及boris-lawrie和temin(1993)cur.opin.genet.develop.[遗传学与发育新见]3:102-109)。慢病毒转导的方法是已知的。示例性方法描述于例如wang等人(2012)j.immunother.[免疫疗法杂志]35(9):689-701;cooper等人(2003)blood.[血液]101:1637–1644;verhoeyen等人(2009)methodsmolbiol.[分子生物学方法]506:97-114;以及cavalieri等人(2003)blood.[血液]102(2):497-505中。在一些实施例中,经由电穿孔将重组核酸转移到t细胞中(参见例如,chicaybam等人,(2013)plosone[公共科学图书馆·综合]8(3):e60298和vantedeloo等人(2000)genetherapy[基因疗法]7(16):1431-1437)。在一些实施例中,经由转座将重组核酸转移到t细胞中(参见例如,manuri等人(2010)humgenether[人类基因疗法]21(4):427-437;sharma等人(2013)molecthernuclacids[分子疗法-核酸]2,e74;以及huang等人(2009)methodsmolbiol[分子生物学方法]506:115-126)。在免疫细胞中引入和表达遗传物质的其他方法包括磷酸钙转染(例如,如currentprotocolsinmolecularbiology[分子生物学现代方法],johnwiley&sons[约翰威利父子出版公司],newyork.n.y.[纽约,纽约州]所述)、原生质体融合、阳离子脂质体介导的转染、钨颗粒促进的微粒轰击(johnston,nature[自然],346:776-777(1990))、和磷酸锶dna共沉淀(brash等人,mol.cellbiol.[分子细胞生物学],7:2031-2034(1987))。用于转移编码重组产物的核酸的其他方式和载体是例如国际专利申请公开号wo2014055668和美国专利号7,446,190所述的那些。在一些背景下,刺激因子(例如,淋巴因子或细胞因子)的过表达可能对受试者有毒。因此,在一些背景下,工程化细胞包括导致细胞在体内(例如在过继免疫疗法中给予时)对阴性选择易感的基因区段。例如,在一些方面中,工程化细胞,使得它们可以由于给予它们的患者的体内状况的改变而被消除。阴性选择表型可以由赋予对所给予的剂(例如化合物)敏感性的基因的插入而产生。阴性选择基因包括单纯疱疹病毒i型胸苷激酶(hsv-itk)基因(wigler等人,cell[细胞]ii:223,1977),其赋予更昔洛韦敏感性;细胞次黄嘌呤磷酸核糖基转移酶(hprt)基因;细胞腺嘌呤磷酸核糖基转移酶(aprt)基因;细菌胞嘧啶脱氨酶(mullen等人,proc.natl.acad.sci.usa.[美国国家科学院院刊]89:33(1992))。在一些方面中,进一步工程化细胞以促进细胞因子或其他因子的表达。在另外的核酸中(例如,用于引入的基因)是例如通过促进转移细胞的活力和/或功能来改善疗法功效的那些;提供用于选择和/或评估细胞的遗传标记(例如以评估体内存活或定位)的基因;例如通过使细胞在体内易感阴性选择来提高安全性的基因,如luptons.d.等人,mol.andcellbiol.[分子与细胞生物学],11:6(1991);和riddell等人,humangenetherapy[人类基因疗法]3:319-338(1992)所述的;还参见lupton等人的pct/us91/08442和pct/us94/05601的出版物,其描述了衍生自将显性阳性选择标记与阴性选择标记融合的双功能选择融合基因的用途。参见例如,riddell等人,美国专利号6,040,177,第14-17栏。c.pdcd1的基因编辑在本文提供的任何实施例中,可以将工程化免疫细胞经受基因改变或基因编辑,其靶向编码参与免疫调节的基因的基因座。在一些实施例中,用于基因编辑的靶基因座是程序性细胞死亡1(pdcd1)基因座,其编码程序性细胞死亡(pd-1)蛋白。在一些实施例中,基因编辑导致靶基因座处的插入或缺失,或靶基因座的“敲除”和编码蛋白的表达的消除。在一些实施例中,使用crispr/cas9系统通过非同源末端连接(nhej)实现基因编辑。在一些实施例中,一种或多种指导rna(grna)分子可与一种或多种cas9核酸酶、cas9切口酶、酶促失活的cas9或其变体一起使用。一种或多种grna分子和一种或多种cas9分子的示例性特征描述如下。1.指导rna(grna)分子在一些实施例中,剂包含靶向pdcd1基因座的区域的grna。“grna分子”是指促进grna分子/cas9分子复合物特异性靶向或归巢至靶核酸(例如细胞基因组dna上的基因座)的核酸。grna分子可以是单分子的(具有单rna分子)(有时在本文中称为“嵌合”grna)、或模块化的(包含多于一种并且典型地两种分开的rna分子)。图1中提供了若干种示例性grna结构,在其上指示了结构域。虽然不希望受理论束缚,但关于grna的活性形式的三维形式或链内或链间相互作用,高互补性区域有时在图1中显示为双链体以及本文提供的其他描绘。在一些情况下,grna是单分子或嵌合grna,其从5'至3'包含:与靶核酸(例如来自pdcd1基因的序列(seqidno:51208所示的编码序列))互补的靶向结构域;第一互补结构域;连接结构域;第二互补结构域(其与第一互补结构域互补);近端结构域;以及任选地尾结构域。在其他情况下,grna是包含第一和第二链的模块化grna。在这些情况下,第一链优选从5'至3'包括:靶向结构域(其与靶核酸(例如来自pdcd1基因的序列(seqidno:51208所示的编码序列))互补)和第一互补结构域。第二链通常从5'至3'包括:任选地5'延伸结构域;第二互补结构域;近端结构域;以及任选地尾结构域。下面简要讨论这些结构域:a)靶向结构域图1提供了靶向结构域的放置的实例。靶向结构域包含与靶核酸上的靶序列例如至少80%、85%、90%、95%、98%或99%互补(例如完全互补)的核苷酸序列。含靶序列的靶核酸链在本文中称为靶核酸的“互补链”。关于靶向结构域选择的指导可见于例如fuy等人,natbiotechnol[自然生物技术]2014(doi:10.1038/nbt.2808)和sternbergsh等人,nature[自然]2014(doi:10.1038/nature13011)。靶向结构域是rna分子的一部分,并且因此将包含碱基尿嘧啶(u),而编码grna分子的任何dna将包含碱基胸腺嘧啶(t)。尽管不希望受理论束缚,但在一个实施例中,据信靶向结构域与靶序列的互补性有助于grna分子/cas9分子复合物与靶核酸相互作用的特异性。应理解的是,在靶向结构域和靶序列对中,靶向结构域中的尿嘧啶碱基将与靶序列中的腺嘌呤碱基配对。在一个实施例中,靶结构域本身在5'至3'方向上包含任选的次级结构域和核心结构域。在一个实施例中,核心结构域与靶序列完全互补。在一个实施例中,靶向结构域的长度为5至50个核苷酸。与靶向结构域互补的靶核酸链在本文中称为互补链。结构域的一些或所有核苷酸可以具有修饰,例如以使其不对降解易感、改善生物相容性等。作为非限制性实例,可以用硫代磷酸酯或一种或多种其他修饰来修饰靶结构域的主链。在一些情况下,靶向结构域的核苷酸可以包含2'修饰,例如2-乙酰化,例如2'甲基化,或一种或多种其他修饰。在各种实施例中,靶向结构域的长度为16-26个核苷酸(即其长度为16个核苷酸,或长度为17个核苷酸,或长度为18、19、20、21、22、23、24、25或26个核苷酸。示例性靶向结构域在一些实施例中,靶序列(靶结构域)在pdcd1基因座(例如seqidno:51208所示的pdcd1编码序列的任何部分)处或其附近。在一些实施例中,与靶向结构域互补的靶核酸位于目的基因(例如pdcd1)的早期编码区处。对早期编码区的靶向可用于敲除目的基因(即,消除其表达)。在一些实施例中,目的基因的早期编码区包括紧接在起始密码子(例如,atg)之后的序列,或在起始密码子的500bp内(例如少于500bp、450bp、400bp、350bp、300bp、250bp、200bp、150bp、100bp、50bp、40bp、30bp、20bp或10bp)的序列。在特定实例中,靶核酸在起始密码子的200bp、150bp、100bp、50bp、40bp、30bp、20bp或10bp内。在一些实例中,grna的靶向结构域与靶核酸(例如pdcd1基因座中的靶核酸)上的靶序列是互补的,例如至少80%、85%、90%、95%、98%或99%互补,例如完全互补。在一些实施例中,用于敲除或敲低pdcd1的靶向结构域是或包含选自seqidno:481-3748或14657-21037中任一个的序列。在一些实施例中,靶向结构域是或包含序列gucugggcggugcuacaacu(seqidno:508)、gcccuggccagucgucu(seqidno:514)、cgucugggcggugcuacaac(seqidno:1533)、uguagcaccgcccagacgac(seqidno:579)、cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)。在一些实施例中,靶向结构域包含序列gucugggcggugcuacaacu(seqidno:508)。在一些实施例中,靶向结构域包含序列gcccuggccagucgucu(seqidno:514)。在一些实施例中,靶向结构域包含序列cgucugggcggugcuacaac(seqidno:1533)。在一些实施例中,靶向结构域包含序列uguagcaccgcccagacgac(seqidno:579)。在一些实施例中,靶向结构域包含序列cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)。在一些实施例中,靶向结构域包括使用化脓性链球菌cas9或使用脑膜炎奈瑟菌cas9来敲除pdcd1基因的那些。在一些实施例中,靶向结构域包括使用化脓性链球菌cas9来敲除pdcd1基因的那些。任何靶向结构域可与化脓性链球菌cas9分子(其生成双链断裂(cas9核酸酶)或单链断裂(cas9切口酶))一起使用。在一个实施例中,将双重靶向用于通过使用化脓性链球菌cas9切口酶在相对的dna链上产生两个切口,这些切口酶具有与相对的dna链互补的两个靶向结构域,例如包含任何负链靶向结构域的grna可以与包含正链靶向结构域的任何grna配对。在一些实施例中,两种grna在dna上定向,使得pam面向外,并且grna的5'末端之间的距离为0-50bp。在一个实施例中,使用两种grna以靶向两种cas9核酸酶或两种cas9切口酶,例如使用由两种不同grna分子指导的一对cas9分子/grna分子复合物以在靶结构域的相对链上用两个单链断裂来切割靶结构域。在一些实施例中,两种cas9切口酶可以包括具有hnh活性的分子,例如ruvc活性失活的cas9分子,例如在d10处具有突变(例如d10a突变)的cas9分子;具有ruvc活性的分子,例如hnh活性失活的cas9分子,例如在h840处具有突变(例如h840a)的cas9分子;或具有ruvc活性的分子,例如hnh活性失活的cas9分子,例如在n863处具有突变(例如n863a)的cas9分子。在一些实施例中,两种grna中的每一种与d10acas9切口酶复合。在一些实施例中,两个靶向结构域可以包括具有是或包含a组中任何序列的靶向结构域的grna,其可以与具有来自b组的任何靶向结构域的grna配对(表1a)。在一些实施例中,具有来自c组的靶向结构域的grna可以与具有来自d组的任何靶向结构域的grna配对(表1a)。表1a在一些实施例中,两个靶向结构域可以包括具有是或包含e组中任何序列的靶向结构域的grna,其可以与具有来自f组的任何靶向结构域的grna配对(表1b)。表1b在一些实施例中,两个靶向结构域可以包括来自表1c中以下对的grna对。在一些实施例中,cas9分子/grna分子复合物对包括来自表1c的grna对,每种grna与d10acas9切口酶复合。在一些实施例中,cas9分子/grna分子复合物对包括来自表1c的grna对,每种grna与n863acas9切口酶复合。表1c:在一些实施例中,通过另外地或替代地靶向来自fas、bid、ctla4、cblb、ptpn6、trac和/或trbc中的一种或多种的基因座,可以将工程化免疫细胞经受基因改变或基因编辑。在一些实施例中,fas、bid、ctla4、pdcd1、cblb、ptpn6、trac和trbc基因中的一种或多种被靶向作为靶向性敲除或敲低,例如以影响t细胞增殖、存活和/或功能。在一个实施例中,所述方式包括敲除或敲低一种t细胞表达的基因(例如,fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因)。在另一个实施例中,该方式包括敲除或敲低两种t细胞表达的基因,例如fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因中的两种。在另一个实施例中,该方式包括敲除或敲低三种t细胞表达的基因,例如fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因中的三种。在另一个实施例中,该方式包括敲除或敲低四种t细胞表达的基因,例如fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因中的四种。在另一个实施例中,该方式包括敲除或敲低五种t细胞表达的基因,例如fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因中的五种。在另一个实施例中,该方式包括敲除或敲低六种t细胞表达的基因,例如fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因中的六种。在另一个实施例中,该方式包括敲除或敲低七种t细胞表达的基因,例如fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因中的七种。在另一个实施例中,该方式包括敲除或敲低八种t细胞表达的基因,例如fas、bid、ctla4、pdcd1、cblb、ptpn6、trac和trbc基因中的每一种。在一些实施例中,用于敲除或敲低fas的靶向结构域是或包含选自seqidno:8460-10759或27729-32635中任一个的序列。在一些实施例中,用于敲除或敲低bid的靶向结构域是或包含选自seqidno:10760-13285或40252-45980中任一个的序列。在一些实施例中,用于敲除或敲低ctla4的靶向结构域是或包含选自seqidno:13286-14656或45981-49273中任一个的序列。在一些实施例中,用于敲除或敲低cblb的靶向结构域是或包含选自seqidno:6119-8639或32636-40251中任一个的序列。在一些实施例中,用于敲除或敲低ptpn6的靶向结构域是或包含选自seqidno:3749-6118或21038-27728中任一个的序列。在一些实施例中,用于敲除或敲低trac的靶向结构域是或包含选自seqidno:49274-49950中任一个的序列。在一些实施例中,用于敲除或敲低trbc的靶向结构域是或包含选自seqidno:49951-51200中任一个的序列。b)第一互补结构域图1a-1g提供了第一互补结构域的实例。第一互补结构域与下文所述的第二互补结构域互补,并且通常与第二互补结构域具有足够的互补性,以在至少一些生理条件下形成双链体区。第一互补结构域的长度典型地为5至30个核苷酸,并且长度可为5至25个核苷酸,长度可为7至25个核苷酸,长度可为7至22个核苷酸,长度可为7至18个核苷酸,或者长度可为7至15个核苷酸。在各种实施例中,第一互补结构域的长度为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。典型地,第一互补结构域与第二互补结构域靶标不具有精确的互补性。在一些实施例中,第一互补结构域可以具有1、2、3、4或5个不与第二互补结构域的对应核苷酸互补的核苷酸。例如,第一互补结构域的1、2、3、4、5或6(例如3)个核苷酸的区段可以不在双链体中配对,并且可以形成非双链体或环凸(looped-out)区。在一些例子中,未配对或环凸区(例如3个核苷酸的环凸)存在于第二互补结构域上。此未配对区任选地从第二互补结构域的5'末端开始1、2、3、4、5或6(例如4)个核苷酸。第一互补结构域可以包括3个亚结构域,其在5'至3'方向上是:5'亚结构域、中央亚结构域和3'亚结构域。在一个实施例中,5'亚结构域的长度为4-9(例如,4、5、6、7、8或9)个核苷酸。在一个实施例中,中央亚结构域的长度为1、2或3(例如1)个核苷酸。在一个实施例中,3'亚结构域的长度为3至25(例如,4-22、4-18或4至10,或3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25)个核苷酸。在一些实施例中,当双链体化时,第一和第二互补结构域包含11个成对的核苷酸,例如在grna序列中(一条成对链加下划线,一条加粗):nnnnnnnnnnnnnnnnnnnnguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seqidno:5)。在一些实施例中,当双链体化时,第一和第二互补结构域包含15个成对的核苷酸,例如在grna序列中(一条成对链加下划线,一条加粗):nnnnnnnnnnnnnnnnnnnnguuuuagagcuaugcugaaaagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seqidno:27)。在一些实施例中,当双链体化时,第一和第二互补结构域包含16个成对的核苷酸,例如在grna序列中(一条成对链加下划线,一条加粗):nnnnnnnnnnnnnnnnnnnnguuuuagagcuaugcuggaaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seqidno:28)。在一些实施例中,当双链体化时,第一和第二互补结构域包含21个成对的核苷酸,例如在grna序列中(一条成对链加下划线,一条加粗):nnnnnnnnnnnnnnnnnnnnguuuuagagcuaugcuguuuuggaaacaaaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seqidno:29)。在一些实施例中,核苷酸进行交换以除去聚-u束,例如在grna序列中(交换的核苷酸加下划线):nnnnnnnnnnnnnnnnnnnnguauuagagcuagaaauagcaaguuaauauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seqidno:30);nnnnnnnnnnnnnnnnnnnnguuuaagagcuagaaauagcaaguuuaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seqidno:31);和nnnnnnnnnnnnnnnnnnnnguauuagagcuaugcuguauuggaaacaauacagcauagcaaguuaauauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seqidno:32)。第一互补结构域可以与天然存在的第一互补结构域共享同源性或从其衍生。在一个实施例中,其与本文披露的第一互补结构域(例如化脓性链球菌、金黄色葡萄球菌、脑膜炎奈瑟菌或嗜热链球菌第一互补结构域)具有至少50%同源性。应注意的是,第一互补结构域的一个或多个或甚至所有核苷酸可沿着上文针对靶向结构域所讨论的思路进行修饰。c)连接结构域图1a-1g提供了连接结构域的实例。在单分子或嵌合grna中,连接结构域用于将单分子grna的第一互补结构域与第二互补结构域连接。连接结构域可以共价地或非共价地连接第一和第二互补结构域。在一个实施例中,连接是共价的。在一个实施例中,连接结构域共价地偶联第一和第二互补结构域,参见例如图1b-1e。在一个实施例中,连接结构域是或包含插入在第一互补结构域和第二互补结构域之间的共价键。典型地,连接结构域包含一个或多个(例如2、3、4、5、6、7、8、9或10个)核苷酸,但在各种实施例中,接头的长度可以是20、30、40、50或甚至100个核苷酸。在模块化grna分子中,两种分子凭借互补结构域的杂交而缔合,并且可能不存在连接结构域。参见例如图1a。多种连接结构域适用于单分子grna分子。连接结构域可以由共价键组成,或者长度短至一个或几个核苷酸,例如1、2、3、4或5个核苷酸。在一个实施例中,连接结构域的长度为2、3、4、5、6、7、8、9、10、15、20或25个或更多个核苷酸。在一个实施例中,连接结构域的长度为2至50、2至40、2至30、2至20、2至10或2至5个核苷酸。在一个实施例中,连接结构域与天然存在的序列(例如,第二互补结构域5'处的tracrrna的序列)共享同源性或从其衍生。在一个实施例中,连接结构域与本文披露的连接结构域具有至少50%同源性。如上文结合第一互补结构域所讨论的,连接结构域的一些或所有核苷酸可以包括修饰。d)5'延伸结构域在一些情况下,模块化grna可以在第二互补结构域5'处包含另外的序列,在本文中称为5'延伸结构域,参见例如图1a。在一个实施例中,5'延伸结构域的长度为2-10、2-9、2-8、2-7、2-6、2-5或2-4个核苷酸。在一个实施例中,5'延伸结构域的长度为2、3、4、5、6、7、8、9或10个或更多个核苷酸。e)第二互补结构域图1a-1g提供了第二互补结构域的实例。第二互补结构域与第一互补结构域互补,并且通常与第二互补结构域具有足够的互补性,以在至少一些生理条件下形成双链体区。在一些情况下,例如如图1a-1b所示,第二互补结构域可以包括缺乏与第一互补结构域的互补性的序列,例如从双链体区环凸的序列。第二互补结构域的长度可以是5至27个核苷酸,并且在一些情况下可以比第一互补区长。例如,第二互补结构域的长度可以是7至27个核苷酸,长度可以是7至25个核苷酸,长度可以是7至20个核苷酸,或长度可以是7至17个核苷酸。更一般地,互补结构域的长度可以是5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25或26个核苷酸。在一个实施例中,第二互补结构域包括3个亚结构域,其在5'至3'方向上是:5'亚结构域、中央亚结构域和3'亚结构域。在一个实施例中,5'亚结构域的长度为3至25(例如,4至22、4至18或4至10,或3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25)个核苷酸。在一个实施例中,中央亚结构域的长度为1、2、3、4或5(例如3)个核苷酸。在一个实施例中,3'亚结构域的长度为4至9(例如,4、5、6、7、8或9)个核苷酸。在一个实施例中,第一互补结构域的5'亚结构域和3'亚结构域分别与第二互补结构域的3'亚结构域和5'亚结构域互补,例如完全互补。第二互补结构域可以与天然存在的第二互补结构域共享同源性或从其衍生。在一个实施例中,其与本文披露的第二互补结构域(例如化脓性链球菌、金黄色葡萄球菌、脑膜炎奈瑟菌或嗜热链球菌第一互补结构域)具有至少50%同源性。第二互补结构域的一些或所有核苷酸可以具有修饰,例如本文第viii章节中发现的修饰。f)近端结构域图1a-1g提供了近端结构域的实例。在一个实施例中,近端结构域的长度为5至20个核苷酸。在一个实施例中,近端结构域可以与天然存在的近端结构域共享同源性或从其衍生。在一个实施例中,其与本文披露的近端结构域(例如化脓性链球菌、金黄色葡萄球菌、脑膜炎奈瑟菌或嗜热链球菌近端结构域)具有至少50%同源性。近端结构域的一些或所有核苷酸可以沿着上述思路进行修饰。g)尾结构域图1a-1g提供了尾结构域的实例。如通过检查图1a和图1b-1f中的尾结构域可以看出,广谱的尾结构域适用于grna分子。在各种实施例中,尾结构域的长度为0(不存在)、1、2、3、4、5、6、7、8、9或10个核苷酸。在某些实施例中,尾结构域核苷酸来自天然存在的尾结构域的5'末端的序列或与其共享同源性,参见例如图1d或1e。尾结构域还任选地包括彼此互补并且在至少一些生理条件下形成双链体区的序列。尾结构域可以与天然存在的近端尾结构域共享同源性或从其衍生。作为非限制性实例,根据本披露的各种实施例的给定尾结构域可以与本文披露的天然存在的尾结构域(例如化脓性链球菌、金黄色葡萄球菌、脑膜炎奈瑟菌、或嗜热链球菌尾结构域)共享至少50%同源性。在某些情况下,尾结构域在3'末端包括核苷酸,其与体外或体内转录方法有关。当t7启动子用于grna的体外转录时,这些核苷酸可以是在dna模板的3'末端之前存在的任何核苷酸。当u6启动子用于体内转录时,这些核苷酸可以是序列uuuuuu。当使用替代pol-iii启动子时,这些核苷酸可以是各种数量的尿嘧啶碱基,或者可以包括替代碱基。作为非限制性实例,在各种实施例中,近端和尾结构域连在一起包含以下序列:aaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcu(seqidno:33),aaggcuaguccguuaucaacuugaaaaaguggcaccgagucgguggugc(seqidno:34),aaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcggauc(seqidno:35),aaggcuaguccguuaucaacuugaaaaagug(seqidno:36),aaggcuaguccguuauca(seqidno:37),或aaggcuaguccg(seqidno:38)。在一个实施例中,尾结构域包含3'序列uuuuuu,例如如果u6启动子用于转录的话。在一个实施例中,尾结构域包含3'序列uuuu,例如,如果h1启动子用于转录的话。在一个实施例中,尾结构域包含可变数量的3'u,这取决于例如所用的pol-iii启动子的终止信号。在一个实施例中,如果使用t7启动子,则尾结构域包含衍生自dna模板的可变3'序列。在一个实施例中,尾结构域包含衍生自dna模板的可变3'序列,例如如果体外转录用于生成rna分子的话。在一个实施例中,尾结构域包含衍生自dna模板的可变3'序列,例如如果pol-ii启动子用于驱动转录的话。在一个实施例中,grna具有以下结构:5'[靶向结构域]-[第一互补结构域]-[连接结构域]-[第二互补结构域]-[近端域]-[尾结构域]-3'其中,靶向结构域包含核心结构域和任选地次级结构域,并且长度为10至50个核苷酸;第一互补结构域的长度为5至25个核苷酸,并且在一个实施例中,与本文披露的参考第一互补结构域具有至少50%、60%、70%、80%、85%、90%、95%、98%或99%同源性;连接结构域的长度为1至5个核苷酸;近端结构域的长度为5至20个核苷酸,并且在一个实施例中,与本文披露的参考近端结构域具有至少50%、60%、70%、80%、85%、90%、95%、98%或99%同源性;并且尾结构域不存在或核苷酸序列的长度为1至50个核苷酸,并且在一个实施例中,与本文披露的参考尾结构域具有至少50%、60%、70%、80%、85%、90%、95%、98%或99%同源性。h)示例性嵌合grna在一个实施例中,单分子或嵌合grna从5'至3’优选包含:,例如包含15、16、17、18、19、20、21、22、23、24、25或26个核苷酸的靶向结构域(其与靶核酸互补);第一互补结构域;连接结构域;第二互补结构域(其与第一互补结构域互补);近端结构域;和尾结构域,其中,(a)近端和尾结构域(当连在一起时)包含至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸;(b)第二互补结构域的最后一个核苷酸的3'处至少有15、18、20、25、30、31、35、40、45、49、50或53个核苷酸;或(c)第二互补结构域(其与第一互补结构域的其对应核苷酸互补)的最后一个核苷酸的3'处至少有16、19、21、26、31、32、36、41、46、50、51或54个核苷酸。在一个实施例中,来自(a)、(b)或(c)的序列与天然存在的grna的对应序列或与本文所述的grna具有至少60%、75%、80%、85%、90%、95%或99%同源性。在一个实施例中,近端和尾结构域(当连在一起时)包含至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸。在一个实施例中,第二互补结构域的最后一个核苷酸的3'处至少有15、18、20、25、30、31、35、40、45、49、50或53个核苷酸。在一个实施例中,第二互补结构域(其与第一互补结构域的其对应核苷酸互补)的最后一个核苷酸的3'处至少有16、19、21、26、31、32、36、41、46、50、51或54个核苷酸。在一个实施例中,靶向结构域包含、具有或由与靶向结构域具有互补性的16、17、18、19、20、21、22、23、24、25或26个核苷酸(例如,16、17、18、19、20、21、22、23、24、25或26个连续核苷酸)组成,例如靶向结构域的长度为16、17、18、19、20、21、22、23、24、25或26个核苷酸。在一个实施例中,单分子或嵌合grna分子(包含靶向结构域、第一互补结构域、连接结构域、第二互补结构域、近端结构域和任选地尾结构域)包含以下序列,在该序列中靶向结构域被描绘为20个n,但可以是长度范围从16至26个核苷酸的任何序列,并且在该序列中grna序列后面是6个u(其作为u6启动子的终止信号,但可以不存在或数量更少):nnnnnnnnnnnnnnnnnnnnguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuuu(seqidno:40)。在一个实施例中,单分子或嵌合grna分子是化脓性链球菌grna分子。在一些实施例中,单分子或嵌合grna分子(包含靶向结构域、第一互补结构域、连接结构域、第二互补结构域、近端结构域和任选地尾结构域)包含以下序列,在该序列中靶向结构域被描绘为20个n,但可以是长度范围从16至26个核苷酸的任何序列,并且在该序列中grna序列后面是6个u(其作为u6启动子的终止信号,但可以不存在或数量更少):nnnnnnnnnnnnnnnnnnnnguuuuaguacucuggaaacagaaucuacuaaaacaaggcaaaaugccguguuuaucucgucaacuuguuggcgagauuuuuu(seqidno:41)。在一个实施例中,单分子或嵌合grna分子是金黄色葡萄球菌grna分子。在一些实施例中,示例性嵌合grna中的靶向结构域是或包含选自seqidno:481-3748中任一个的序列。在一些实施例中,示例性嵌合grna中的靶向结构域是或包含选自gucugggcggugcuacaacu(seqidno:508)、gcccuggccagucgucu(seqidno:514)、cgucugggcggugcuacaac(seqidno:1533)、uguagcaccgcccagacgac(seqidno:579)、cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)中任一个的序列。在一些实施例中,靶向结构域是或包含序列gucugggcggugcuacaacu(seqidno:508)。在一些实施例中,靶向结构域是或包含序列gcccuggccagucgucu(seqidno:514)。在一些实施例中,靶向结构域是或包含序列cgucugggcggugcuacaac(seqidno:1533)。在一些实施例中,靶向结构域是或包含序列uguagcaccgcccagacgac(seqidno:579)。在一些实施例中,靶向结构域是或包含序列cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)。示例性嵌合grna的序列和结构也示于图10a-10b中。i)示例性模块化grna在一个实施例中,模块化grna包含第一和第二链。第一链从5'至3’优选包含:例如包含15、16、17、18、19、20、21、22、23、24、25或26个核苷酸的靶向结构域;第一互补结构域。第二链从5'至3’优选包含:任选地5'延伸结构域;第二互补结构域;近端结构域;和尾结构域,其中:(a)近端和尾结构域(当连在一起时)包含至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸;(b)第二互补结构域的最后一个核苷酸的3'处至少有15、18、20、25、30、31、35、40、45、49、50或53个核苷酸;或(c)第二互补结构域(其与第一互补结构域的其对应核苷酸互补)的最后一个核苷酸的3'处至少有16、19、21、26、31、32、36、41、46、50、51或54个核苷酸。在一个实施例中,来自(a)、(b)或(c)的序列与天然存在的grna的对应序列或与本文所述的grna具有至少60%、75%、80%、85%、90%、95%或99%同源性。在一个实施例中,近端和尾结构域(当连在一起时)包含至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸。在一个实施例中,第二互补结构域的最后一个核苷酸的3'处至少有15、18、20、25、30、31、35、40、45、49、50或53个核苷酸。在一个实施例中,第二互补结构域(其与第一互补结构域的其对应核苷酸互补)的最后一个核苷酸的3'处至少有16、19、21、26、31、32、36、41、46、50、51或54个核苷酸。在一个实施例中,靶向结构域具有或由与靶向结构域具有互补性的16、17、18、19、20、21、22、23、24、25或26个核苷酸(例如,16、17、18、19、20、21、22、23、24、25或26个连续核苷酸)组成,例如靶向结构域的长度为16、17、18、19、20、21、22、23、24、25或26个核苷酸。在一些实施例中,示例性模块化grna中的靶向结构域是或包含选自seqidno:481-3748中任一个的序列。在一些实施例中,示例性模块化grna中的靶向结构域是或包含选自gucugggcggugcuacaacu(seqidno:508)、gcccuggccagucgucu(seqidno:514)、cgucugggcggugcuacaac(seqidno:1533)、uguagcaccgcccagacgac(seqidno:579)、cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)中任一个的序列。在一些实施例中,靶向结构域是或包含序列gucugggcggugcuacaacu(seqidno:508)。在一些实施例中,靶向结构域是或包含序列gcccuggccagucgucu(seqidno:514)。在一些实施例中,靶向结构域是或包含序列cgucugggcggugcuacaac(seqidno:1533)。在一些实施例中,靶向结构域是或包含序列uguagcaccgcccagacgac(seqidno:579)。在一些实施例中,靶向结构域是或包含序列cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)。2.用于设计grna的方法本文描述了用于设计grna的方法,包括用于选择、设计和验证靶向结构域的方法。本文还提供了示例性靶向结构域。本文讨论的靶向结构域可以掺入本文所述的grna中。用于选择和验证靶序列以及脱靶分析的方法描述于例如mali等人,2013science[科学]339(6121):823-826;hsu等人natbiotechnol[自然生物技术],31(9):827-32;fu等人,2014natbiotechnol[自然生物技术],doi:10.1038/nbt.2808.pubmedpmid:24463574;heigwer等人,2014natmethods[自然方法]11(2):122-3.doi:10.1038/nmeth.2812.pubmedpmid:24481216;bae等人,2014bioinformatics[生物信息学]pubmedpmid:24463181;xiaoa等人,2014bioinformatics[生物信息学]pubmedpmid:24389662中。在一些实施例中,软件工具可用于优化用户靶序列内grna的选择,例如以使基因组中的总脱靶活性最小化。脱靶活性可能不是切割。例如,对于使用化脓性链球菌cas9的每种可能的grna选择,软件工具可以鉴定含有多达一定数量(例如,1、2、3、4、5、6、7、8、9或10)的错配碱基对的基因组中所有潜在的脱靶序列(在nag或nggpam之前)。可以例如使用实验得出的加权方案来预测每个脱靶序列处的切割效率。然后可以根据其总预测的脱靶切割对每种可能的grna进行排名;排名靠前的grna代表可能具有最大中靶切割和最少脱靶切割的那些。其他功能(例如,用于grna载体构建的自动化试剂设计、用于中靶surveyor测定的引物设计、以及用于经由下一代测序进行脱靶切割的高通量检测和定量的引物设计)也可以包括于工具中。候选grna分子可通过本领域已知的方法或如本文所述进行评估。在一些实施例中,使用dna序列搜索算法,例如使用基于公共工具cas-offinder的定制grna设计软件(bae等人bioinformatics[生物信息学].2014;30(10):1473-1475),鉴定与化脓性链球菌、金黄色葡萄球菌和脑膜炎奈瑟菌cas9一起使用的grna。定制grna设计软件在计算其全基因组脱靶倾向后为指导物评分。对于长度范围从17到24的指导物,典型地考虑范围从完美匹配到7个错配的匹配。在一些方面中,一旦计算确定了脱靶位点,就针对每种指导物计算总分并使用网页界面在表格输出中进行总结。除了鉴定与pam序列相邻的潜在grna位点之外,该软件还可以鉴定与所选grna位点相差1、2、3个或更多个核苷酸的所有pam相邻序列。在一些实施例中,针对每种基因的基因组dna序列获得自ucsc基因组浏览器,并且可以使用公开可获得的repeatmasker程序来筛选序列的重复元件。repeatmasker搜索输入dna序列中重复元件和低复杂性区域。输出是给定查询序列中存在的重复的详细注释。在鉴定之后,grna可以基于以下中的一个或多个排成等级:其与靶位点的距离,其正交性和5'g的存在(基于在含有相关pam的人类基因组中的紧密匹配的鉴定,例如在化脓性链球菌的情况下是nggpam,在金黄色葡萄球菌的情况下是nngrr(例如,nngrrt或nngrrv)pam,并且在脑膜炎奈瑟菌的情况下是nnnngatt或nnnngcttpam)。正交性是指人类基因组中含有与靶序列最小数量错配的序列数量。例如,“高水平正交性”或“良好正交性”可以指20聚体靶向结构域,这些靶向结构域除了预期的靶标之外不具有人类基因组中相同的序列,也不具有靶标中含有一个或两个错配的任何序列。选择具有良好正交性的靶向结构域以使脱靶dna切割最小化。应理解的是,这是非限制性实例,并且可使用多种策略来鉴定与化脓性链球菌、金黄色葡萄球菌和脑膜炎奈瑟菌或其他cas9酶一起使用的grna。在一些实施例中,可以使用公开可获得的基于网络的zifit服务器来鉴定与化脓性链球菌cas9一起使用的grna(fu等人,improvingcrispr-casnucleasespecificityusingtruncatedguidernas[使用截短的指导rna改善crispr-cas核酸酶特异性].natbiotechnol[自然生物技术].2014年1月26日.doi:10.1038/nbt.2808.pubmedpmid:24463574,关于原始参考文献参见sander等人,2007,nar35:w599-605;sander等人,2010,nar38:w462-8)。除了鉴定与pam序列相邻的潜在grna位点之外,该软件还鉴定与所选grna位点相差1、2、3个或更多个核苷酸的所有pam相邻序列。在一些方面中,针对每种基因的基因组dna序列可以获得自ucsc基因组浏览器,并且可以使用公开可获得的repeat-masker程序来筛选序列的重复元件。repeatmasker搜索输入dna序列中重复元件和低复杂性区域。输出是给定查询序列中存在的重复的详细注释。鉴定后,与化脓性链球菌cas9一起使用的grna可以排成等级,例如排成5个等级。在一些实施例中,第一等级grna分子的靶向结构域是基于其与靶位点的距离、其正交性和5'g的存在(基于含有nggpam的人类基因组中的紧密匹配的zifit鉴定)来选择。在一些实施例中,针对靶标设计17聚体和20聚体两种grna。在一些方面中,还选择grna用于单grna核酸酶切割和双grna切口酶两种策略。用于选择grna的标准和确定哪些grna可以用于哪种策略可以基于若干考虑因素。在一些实施例中,鉴定了用于单grna核酸酶切割和用于双grna配对的“切口酶”两种策略的grna。在用于选择grna(包括确定哪些grna可以用于双grna配对的“切口酶”策略)的一些实施例中,grna对应该在dna上定向,使得pam面向外并且用d10acas9切口酶切割将导致5'突出端。在一些方面中,可以假设用双切口酶对切割将导致以合理的频率缺失整个间插序列。然而,用双切口酶对切割也可能经常导致仅一种grna的位点处的indel突变。可以针对它们如何有效地去除整个序列而不是仅在一种grna的位点造成indel突变来测试候选对成员。在一些实施例中,可以基于以下来选择第一等级grna分子的靶向结构域:(1)与靶位置的合理距离(例如在起始密码子下游的编码序列的前500bp内)、(2)高水平正交性、以及(3)5'g的存在。在一些实施例中,为了选择第二等级grna,可以去除对5'g的要求,但是需要距离限制并且需要高水平正交性。在一些实施例中,第三等级选择使用相同的距离限制和对5'g的要求,但是去除了良好正交性的要求。在一些实施例中,第四等级选择使用相同的距离限制但是去除了良好正交性和以5'g起始的要求。在一些实施例中,第五等级选择去除了良好正交性和5'g的要求,并且扫描了更长的序列(例如,其余的编码序列,例如转录靶标位点的上游或下游的另外500bp)。在一些情况下,基于特定等级的标准没有鉴定到grna。在一些实施例中,鉴定了用于单grna核酸酶切割以及双grna配对的“切口酶”策略的grna。在一些方面中,可以通过扫描基因组dna序列手动地鉴定与脑膜炎奈瑟菌和金黄色葡萄球菌cas9一起使用的grna中pam序列的存在。这些grna可以分成两个等级。在一些实施例中,对于第一等级grna,在起始密码子下游的编码序列的前500bp内选择靶向结构域。在一些实施例中,对于第二等级grna,在剩余的编码序列(前500bp的下游)内选择靶向结构域。在一些情况下,基于特定等级的标准没有鉴定到grna。在一些实施例中,用于鉴定与化脓性链球菌、金黄色葡萄球菌和脑膜炎奈瑟菌cas9一起使用的指导rna(grna)的另一种策略可以使用dna序列搜索算法。在一些方面中,使用基于公共工具cas-offinder的定制指导rna设计软件进行指导rna设计(参考:cas-offinder:afastandversatilealgorithmthatsearchesforpotentialoff-targetsitesofcas9rna-guidedendonucleases.[cas-offinder:一种快速且通用的算法,用于搜索cas9rna指导的内切核酸酶的潜在脱靶位点],bioinformatics[生物信息学].2014年2月17日.baes,parkj,kimjs.pmid:24463181)。所述定制指导rna设计软件在计算其全基因组脱靶倾向后为指导物评分。对于长度范围从17到24的指导物,典型地考虑范围从完美匹配到7个错配的匹配。一旦计算确定了脱靶位点,就针对每种指导物计算总分并使用网页界面在表格输出中进行总结。除了鉴定与pam序列相邻的潜在grna位点之外,该软件还鉴定与所选grna位点相差1、2、3个或更多个核苷酸的所有pam相邻序列。在一些实施例中,针对每种基因的基因组dna序列获得自ucsc基因组浏览器,并且使用公开可获得的repeatmasker程序来筛选序列的重复元件。repeatmasker搜索输入dna序列中重复元件和低复杂性区域。输出是给定查询序列中存在的重复的详细注释。在一些实施例中,在鉴定之后,grna可以基于以下排成等级:其与靶位点的距离或其正交性(基于在含有相关pam的人类基因组中的紧密匹配的鉴定,例如在化脓性链球菌的情况下是nggpam,在金黄色葡萄球菌的情况下是nngrr(例如,nngrrt或nngrrv)pam,并且在脑膜炎奈瑟菌的情况下是nnnngatt或nnnngcttpam)。在一些方面中,选择具有良好正交性的靶向结构域以使脱靶dna切割最小化。作为一个实例,对于化脓性链球菌和脑膜炎奈瑟菌靶标,可以设计17聚体或20聚体grna。作为另一个实例,对于金黄色葡萄球菌靶标,可以设计18聚体、19聚体、20聚体、21聚体、22聚体、23聚体和24聚体grna。在一些实施例中,鉴定了用于单grna核酸酶切割和用于双grna配对的“切口酶”两种策略的grna。在用于选择grna(包括确定哪些grna可以用于双grna配对的“切口酶”策略)的一些实施例中,grna对应该在dna上定向,使得pam面向外并且用d10acas9切口酶切割将导致5'突出端。在一些方面中,可以假设用双切口酶对切割将导致以合理的频率缺失整个间插序列。然而,用双切口酶对切割也可能经常导致仅一种grna的位点处的indel突变。可以针对它们如何有效地去除整个序列而不是仅在一种grna的位点造成indel突变来测试候选对成员。为了设计敲除策略,在一些实施例中,基于以下选择化脓性链球菌的等级1grna分子的靶向结构域:其与靶位点的距离及其正交性(pam是ngg)。在一些情况下,基于以下来选择等级1grna分子的靶向结构域:(1)与靶位置的合理距离(例如在起始密码子下游的编码序列的前500bp内)和(2)高水平正交性。在一些方面中,为了选择等级2grna,不需要高水平正交性。在一些情况下,等级3grna去除了良好正交性的要求,并且可以扫描更长的序列(例如,其余的编码序列)。在一些情况下,基于特定等级的标准没有鉴定到grna。为了设计敲除策略,在一些实施例中,脑膜炎奈瑟菌的等级1grna分子的靶向结构域在编码序列的前500bp内进行选择并具有高水平正交性。脑膜炎奈瑟菌的等级2grna分子的靶向结构域在编码序列的前500bp内进行选择并且不需要高正交性。在500bp下游的编码序列的剩余部分内选择脑膜炎奈瑟菌的等级3grna分子的靶向结构域。请注意,等级是非包含性的(每种grna仅列出一次)。在一些情况下,基于特定等级的标准没有鉴定到grna。为了设计敲除策略,在一些实施例中,金黄色葡萄球菌的等级1grna分子的靶向结构域在编码序列的前500bp内进行选择,具有高水平正交性,并含有nngrrtpam。在一些实施例中,金黄色葡萄球菌的等级2grna分子的靶向结构域在编码序列的前500bp内进行选择,不需要水平正交性,并含有nngrrtpam。在一些实施例中,金黄色葡萄球菌的等级3grna分子的靶向结构域在编码序列下游的剩余部分内进行选择并含有nngrrtpam。在一些实施例中,金黄色葡萄球菌的等级4grna分子的靶向结构域在编码序列的前500bp内进行选择并含有nngrrvpam。在一些实施例中,金黄色葡萄球菌的等级5grna分子的靶向结构域在编码序列下游的剩余部分内进行选择并含有nngrrvpam。在一些情况下,基于特定等级的标准没有鉴定到grna。为了设计用于敲低策略的grna分子,在一些实施例中,化脓性链球菌的等级1grna分子的靶向结构域在转录起始位点的上游和下游的前500bp内进行选择并具有高水平正交性。在一些实施例中,化脓性链球菌的等级2grna分子的靶向结构域在转录起始位点的上游和下游的前500bp内进行选择,并且不需要高正交性。在一些实施例中,化脓性链球菌的等级3grna分子的靶向结构域在转录起始位点的上游和下游的另外500bp内(例如,延伸至转录起始位点的上游和下游1kb)进行选择。在一些情况下,基于特定等级的标准没有鉴定到grna。为了设计用于敲低策略的grna分子,在一些实施例中,脑膜炎奈瑟菌的等级1grna分子的靶向结构域在转录起始位点的上游和下游的前500bp内进行选择并具有高水平正交性。在一些实施例中,脑膜炎奈瑟菌的等级2grna分子的靶向结构域在转录起始位点的上游和下游的前500bp内进行选择,并且不需要高正交性。在一些实施例中,脑膜炎奈瑟菌的等级3grna分子的靶向结构域在转录起始位点的上游和下游的另外500bp内(例如,延伸至转录起始位点的上游和下游1kb)进行选择。在一些情况下,基于特定等级的标准没有鉴定到grna。为了设计用于敲低策略的grna分子,在一些实施例中,金黄色葡萄球菌的等级1grna分子的靶向结构域在转录起始位点的上游和下游500bp内进行选择,高水平正交性,并且pam是nngrrt。在一些实施例中,金黄色葡萄球菌的等级2grna分子的靶向结构域在转录起始位点的上游和下游500bp内进行选择,没有正交性要求,并且pam是nngrrt。在一些实施例中,金黄色葡萄球菌的等级3grna分子的靶向结构域在转录起始位点的上游和下游的另外500bp内(例如,延伸至转录起始位点的上游和下游1kb)进行选择,并且pam是nngrrt。在一些实施例中,金黄色葡萄球菌的等级4grna分子的靶向结构域在转录起始位点的上游和下游500bp内进行选择,并且pam是nngrrv。在一些实施例中,金黄色葡萄球菌的等级5grna分子的靶向结构域在转录起始位点的上游和下游的另外500bp内(例如,延伸至转录起始位点的上游和下游1kb)进行选择,并且pam是nngrrv。在一些情况下,基于特定等级的标准没有鉴定到grna。3.cas9多种物种的cas9分子可用于本文所述的方法和组合物中。虽然化脓性链球菌、金黄色葡萄球菌、脑膜炎奈瑟菌和嗜热链球菌cas9分子是本文披露的大部分的主题,但是本文列出的其他物种的cas9蛋白的、衍生自其的或基于其的cas9分子也可以使用。换句话说,虽然本文的大部分描述使用了化脓性链球菌、金黄色葡萄球菌、脑膜炎奈瑟菌和嗜热链球菌cas9分子,但来自其他物种的cas9分子可以替代它们。此类物种包括:燕麦食酸菌(acidovoraxavenae)、胸膜肺炎放线杆菌(actinobacilluspleuropneumoniae)、产琥珀酸放线杆菌(actinobacillussuccinogenes)、猪放线杆菌(actinobacillussuis)、放线菌属物种(actinomycessp.)、cycliphilusdenitrificans、少食氨基单胞菌(aminomonaspaucivorans)、蜡样芽孢杆菌(bacilluscereus)、史氏芽孢杆菌(bacillussmithii)、苏云金芽孢杆菌(bacillusthuringiensis)、拟杆菌属物种(bacteroidessp.)、blastopirellulamarina、慢生根瘤菌属物种(bradyrhizobiumsp.)、侧孢短芽孢杆菌(brevibacilluslaterosporus)、结肠弯曲杆菌(campylobactercoli)、空肠弯曲杆菌(campylobacterjejuni)、红嘴鸥弯曲杆菌(campylobacterlari)、candidatuspuniceispirillum、解纤维梭菌(clostridiumcellulolyticum)、产气荚膜梭菌(clostridiumperfringens)、拥挤棒状杆菌(corynebacteriumaccolens)、白喉棒状杆菌(corynebacteriumdiphtheria)、马氏棒状杆菌(corynebacteriummatruchotii)、dinoroseobactershibae、细长真杆菌(eubacteriumdolichum)、γ-变形菌(gammaproteobacterium)、重氮营养葡糖酸醋杆菌(gluconacetobacterdiazotrophicus)、副流感嗜血杆菌(haemophilusparainfluenzae)、生痰嗜血杆菌(haemophilussputorum)、加拿大螺杆菌(helicobactercanadensis)、同性恋螺杆菌(helicobactercinaedi)、鼬鼠螺杆菌(helicobactermustelae)、多营养泥杆菌(ilyobacterpolytropus)、金氏金氏菌(kingellakingae)、卷曲乳酸杆菌(lactobacilluscrispatus)、伊氏李斯特菌(listeriaivanovii)、产单核细胞李斯特菌(listeriamonocytogenes)、李斯特氏菌科菌(listeriaceaebacterium)、甲基孢囊菌属物种(methylocystissp.)、甲基弯菌(methylosinustrichosporium)、羞怯动弯杆菌(mobiluncusmulieris)、杆状奈瑟菌(neisseriabacilliformis)、灰色奈瑟菌(neisseriacinerea)、浅黄色奈瑟菌(neisseriaflavescens)、乳糖奈瑟菌(neisserialactamica)、脑膜炎奈瑟菌(neisseriameningitidis)、奈瑟菌属物种(neisseriasp.)、沃兹沃思奈瑟菌(neisseriawadsworthii)、亚硝化单胞菌属物种(nitrosomonassp.)、食清洁剂细小棒菌(parvibaculumlavamentivorans)、多杀巴氏杆菌(pasteurellamultocida)、phascolarctobacteriumsuccinatutens、ralstoniasyzygii、沼泽红假单胞菌(rhodopseudomonaspalustris)、小红卵菌属物种(rhodovulumsp.)、米氏西蒙斯氏菌(simonsiellamuelleri)、鞘氨醇单胞菌属物种(sphingomonassp.)、sporolactobacillusvineae、金黄色葡萄球菌(staphylococcusaureus)、路邓葡萄球菌(staphylococcuslugdunensis)、链球菌属物种(streptococcussp.)、罕见小球菌属物种(subdoligranulumsp.)、运动替斯崔纳菌(tistrellamobilis)、密螺旋体属物种(treponemasp.)或verminephrobactereiseniae。当该术语在本文使用时,cas9分子或cas9多肽是指可以与grna分子相互作用并且与该grna分子并行归巢或定位至包含靶结构域和pam序列的位点的分子或多肽。当那些术语在本文使用时,cas9分子和cas9多肽是指天然存在的cas9分子和经工程化、改变或修饰的cas9分子或cas9多肽,其与参考序列(例如,最相似的天然存在的cas9分子或表2a的序列)相差例如至少一个氨基酸残基。a)cas9结构域已经确定了两种不同的天然存在的细菌cas9分子(jinek等人,science[科学],343(6176):1247997,2014)和具有指导rna的化脓性链球菌cas9(例如,crrna和tracrrna的合成融合物)(nishimasu等人,cell[细胞],156:935-949,2014;和anders等人,nature[自然],2014,doi:10.1038/nature13579)的晶体结构。天然存在的cas9分子包含两种叶:识别(rec)叶和核酸酶(nuc)叶;其中每一种进一步包含本文所述的结构域。图8a-8b以一级结构提供了重要cas9结构域的组织的示意图。本披露中使用的每个结构域所涵盖的结构域命名法和氨基酸残基的编号如nishimasu等人所述。氨基酸残基的编号参考来自化脓性链球菌的cas9。rec叶包含富精氨酸桥螺旋(bh)、rec1结构域和rec2结构域。rec叶与其他已知蛋白质不共享结构相似性,指示它是cas9特异性功能结构域。bh结构域是长α-螺旋和富精氨酸区,并且包含化脓性链球菌cas9序列的氨基酸60-93。rec1结构域对于识别重复:抗重复双链体(例如grna或tracrrna)是重要的,并且因此通过识别靶序列对cas9活性是关键的。rec1结构域在化脓性链球菌cas9序列的氨基酸94至179和308至717处包含两个rec1基序。这两个rec1结构域虽然在线性一级结构中被rec2结构域分开,但是以三级结构进行组装以形成rec1结构域。rec2结构域或其部分也可在识别重复:抗重复双链体中起作用。rec2结构域包含化脓性链球菌cas9序列的氨基酸180-307。nuc叶包含ruvc结构域(本文中也称为ruvc样结构域)、hnh结构域(本文中也称为hnh样结构域)和pam相互作用(pi)结构域。ruvc结构域与逆转录病毒整合酶超家族成员共享结构相似性并切割单链,例如靶核酸分子的非互补链。ruvc结构域由分别在化脓性链球菌cas9序列的氨基酸1-59、718-769和909-1098处的三个分裂的ruvc基序(ruvci、ruvcii和ruvciii,其在本领域中通常称为ruvci结构域、或n-末端ruvc结构域、ruvcii结构域和ruvciii结构域)组装而成。与rec1结构域类似,三个ruvc基序在一级结构中由其他结构域线性分开,然而在三级结构中,三个ruvc基序组装并形成ruvc结构域。hnh结构域与hnh内切核酸酶共享结构相似性并切割单链,例如靶核酸分子的互补链。hnh结构域位于ruvcii-iii基序之间,并包含化脓性链球菌cas9序列的氨基酸775-908。pi结构域与靶核酸分子的pam相互作用,并包含化脓性链球菌cas9序列的氨基酸1099-1368。(1)ruvc样结构域和hnh样结构域在一个实施例中,cas9分子或cas9多肽包含hnh样结构域和ruvc样结构域。在一个实施例中,切割活性取决于ruvc样结构域和hnh样结构域。cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)可以包含以下结构域中的一种或多种:ruvc样结构域和hnh样结构域。在一个实施例中,cas9分子或cas9多肽是eacas9分子或eacas9多肽,并且eacas9分子或eacas9多肽包含ruvc样结构域(例如下文所述的ruvc样结构域)、和/或hnh样结构域(例如下文所述的hnh样结构域)。(2)ruvc样结构域在一个实施例中,ruvc样结构域切割单链,例如靶核酸分子的非互补链。cas9分子或cas9多肽可以包括多于一个ruvc样结构域(例如,一个、两个、三个或更多个ruvc样结构域)。在一个实施例中,ruvc样结构域的长度为至少5、6、7、8个氨基酸但不超过20、19、18、17、16或15个氨基酸。在一个实施例中,cas9分子或cas9多肽包含长度为约10至20个氨基酸(例如约15个氨基酸)的n-末端ruvc样结构域。(3)n-末端ruvc样结构域一些天然存在的cas9分子包含多于一个ruvc样结构域,其中切割依赖于n-末端ruvc样结构域。因此,cas9分子或cas9多肽可以包含n-末端ruvc样结构域。示例性n-末端ruvc样结构域描述如下。在一个实施例中,eacas9分子或eacas9多肽包含含有具有式i的氨基酸序列的n-末端ruvc样结构域:d-x1-g-x2-x3-x4-x5-g-x6-x7-x8-x9(seqidno:8),其中,x1选自i、v、m、l和t(例如,选自i、v、和l);x2选自t、i、v、s、n、y、e和l(例如,选自t、v、和i);x3选自n、s、g、a、d、t、r、m和f(例如,a或n);x4选自s、y、n和f(例如,s);x5选自v、i、l、c、t和f(例如,选自v、i和l);x6选自w、f、v、y、s和l(例如,w);x7选自a、s、c、v和g(例如,选自a和s);x8选自v、i、l、a、m和h(例如,选自v、i、m和l);并且x9选自任何氨基酸或不存在(由δ指定)(例如选自t、v、i、l、δ、f、s、a、y、m和r,或例如选自t、v、i、l和δ)。在一个实施例中,n-末端ruvc样结构域与seqidno:8的序列相差多达1个但不超过2、3、4或5个残基。在实施例中,n-末端ruvc样结构域是有切割能力的。在实施例中,n-末端ruvc样结构域是无切割能力的。在一个实施例中,eacas9分子或eacas9多肽包含含有具有式ii的氨基酸序列的n-末端ruvc样结构域:d-x1-g-x2-x3-s-x5-g-x6-x7-x8-x9(seqidno:9),其中x1选自i、v、m、l和t(例如,选自i、v、和l);x2选自t、i、v、s、n、y、e和l(例如,选自t、v、和i);x3选自n、s、g、a、d、t、r、m和f(例如,a或n);x5选自v、i、l、c、t和f(例如,选自v、i和l);x6选自w、f、v、y、s和l(例如,w);x7选自a、s、c、v和g(例如,选自a和s);x8选自v、i、l、a、m和h(例如,选自v、i、m和l);并且x9选自任何氨基酸或不存在(例如选自t、v、i、l、δ、f、s、a、y、m和r,或选自例如t、v、i、l和δ)。在一个实施例中,n-末端ruvc样结构域与seqidno:9的序列相差多达1个但不超过2、3、4或5个残基。在一个实施例中,n-末端ruvc样结构域包含具有式iii的氨基酸序列:d-i-g-x2-x3-s-v-g-w-a-x8-x9(seqidno:10),其中x2选自t、i、v、s、n、y、e和l(例如,选自t、v、和i);x3选自n、s、g、a、d、t、r、m和f(例如,a或n);x8选自v、i、l、a、m和h(例如,选自v、i、m和l);并且x9选自任何氨基酸或不存在(例如选自t、v、i、l、δ、f、s、a、y、m和r,或选自例如t、v、i、l和δ)。在一个实施例中,n-末端ruvc样结构域与seqidno:10的序列相差多达1个但不超过2、3、4或5个残基。在一个实施例中,n-末端ruvc样结构域包含具有式iii的氨基酸序列:d-i-g-t-n-s-v-g-w-a-v-x(seqidno:11),其中x是非极性烷基氨基酸或羟基氨基酸,例如x选自v、i、l和t(例如,eacas9分子可以包含图2a-2g中所示的n-末端ruvc样结构域(描绘为y))。在一个实施例中,n-末端ruvc样结构域与seqidno:11的序列相差多达1个但不超过2、3、4或5个残基。在一个实施例中,n-末端ruvc样结构域与本文(例如,图3a-3b或图7a-7b中)披露的n-末端ruvc样结构域的序列相差多达1个但不超过2、3、4或5个残基。在一个实施例中,存在图3a-3b或图7a-7b中鉴定的1、2、或所有3个高度保守的残基。在一个实施例中,n-末端ruvc样结构域与本文(例如,图4a-4b或图7a-7b中)披露的n-末端ruvc样结构域的序列相差多达1个但不超过2、3、4或5个残基。在一个实施例中,存在图4a-4b或图7a-7b中鉴定的1、2、3或所有4个高度保守的残基。(4)另外的ruvc样结构域除了n-末端ruvc样结构域之外,cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)可以包含一个或多个另外的ruvc样结构域。在一个实施例中,cas9分子或cas9多肽可以包含两个另外的ruvc样结构域。优选地,另外的ruvc样结构域的长度为至少5个氨基酸,并且例如长度为少于15个氨基酸,例如长度为5至10个氨基酸,例如长度为8个氨基酸。另外的ruvc样结构域可以包含如下氨基酸序列:i-x1-x2-e-x3-a-r-e(seqidno:12),其中x1是v或h,x2是i、l或v(例如,i或v);并且x3是m或t。在一个实施例中,另外的ruvc样结构域包含如下氨基酸序列:i-v-x2-e-m-a-r-e(seqidno:13),其中x2是i、l或v(例如,i或v)(例如,eacas9分子或eacas9多肽可以包含图2a-2g或图7a-7b中所示的另外的ruvc样结构域(描绘为b))。另外的ruvc样结构域可以包含如下氨基酸序列:h-h-a-x1-d-a-x2-x3(seqidno:14),其中x1是h或l;x2是r或v;并且x3是e或v。在一个实施例中,另外的ruvc样结构域包含如下氨基酸序列:h-h-a-h-d-a-y-l(seqidno:15)。在一个实施例中,另外的ruvc样结构域与seqidno:12、13、14或15的序列相差多达1个但不超过2、3、4或5个残基。在一些实施例中,侧接n-末端ruvc样结构域的序列是具有式v的序列:k-x1’-y-x2’-x3’-x4’-z-t-d-x9’-y(seqidno:16),其中x1’选自k和p,x2’选自v、l、i、和f(例如,v、i和l);x3’选自g、a和s(例如,g);x4’选自l、i、v和f(例如,l);x9’选自d、e、n和q;并且z是n-末端ruvc样结构域,例如如上所述。(5)hnh样结构域在一个实施例中,hnh样结构域切割单链互补结构域,例如双链核酸分子的互补链。在一个实施例中,hnh样结构域的长度为至少15、20、25个氨基酸但长度不超过40、35或30个氨基酸,例如长度为20至35个氨基酸,例如长度为25至30个氨基酸。示例性hnh样结构域描述如下。在一个实施例中,eacas9分子或eacas9多肽包含具有如下氨基酸序列的hnh样结构域,该氨基酸序列具有式vi:x1-x2-x3-h-x4-x5-p-x6-x7-x8-x9-x10-x11-x12-x13-x14-x15-n-x16-x17-x18-x19-x20-x21-x22-x23-n(seqidno:17),其中x1选自d、e、q和n(例如,d和e);x2选自l、i、r、q、v、m和k;x3选自d和e;x4选自i、v、t、a和l(例如,a、i和v);x5选自v、y、i、l、f和w(例如,v、i和l);x6选自q、h、r、k、y、i、l、f和w;x7选自s、a、d、t和k(例如,s和a);x8选自f、l、v、k、y、m、i、r、a、e、d和q(例如,f);x9选自l、r、t、i、v、s、c、y、k、f和g;x10选自k、q、y、t、f、l、w、m、a、e、g、和s;x11选自d、s、n、r、l和t(例如,d);x12选自d、n和s;x13选自s、a、t、g和r(例如,s);x14选自i、l、f、s、r、y、q、w、d、k和h(例如,i、l和f);x15选自d、s、i、n、e、a、h、f、l、q、m、g、y和v;x16选自k、l、r、m、t和f(例如,l、r和k);x17选自v、l、i、a和t;x18选自l、i、v和a(例如,l和i);x19选自t、v、c、e、s和a(例如,t和v);x20选自r、f、t、w、e、l、n、c、k、v、s、q、i、y、h和a;x21选自s、p、r、k、n、a、h、q、g和l;x22选自d、g、t、n、s、k、a、i、e、l、q、r和y;并且x23选自k、v、a、e、y、i、c、l、s、t、g、k、m、d和f。在一个实施例中,hnh样结构域与seqidno:17的序列相差至少一个但不超过2、3、4或5个残基。在一个实施例中,hnh样结构域是有切割能力的。在一个实施例中,hnh样结构域是无切割能力的。在一个实施例中,eacas9分子或eacas9多肽包含含有具有式vii的氨基酸序列的hnh样结构域:x1-x2-x3-h-x4-x5-p-x6-s-x8-x9-x10-d-d-s-x14-x15-n-k-v-l-x19-x20-x21-x22-x23-n(seqidno:18),其中x1选自d和e;x2选自l、i、r、q、v、m和k;x3选自d和e;x4选自i、v、t、a和l(例如,a、i和v);x5选自v、y、i、l、f和w(例如,v、i和l);x6选自q、h、r、k、y、i、l、f和w;x8选自f、l、v、k、y、m、i、r、a、e、d和q(例如,f);x9选自l、r、t、i、v、s、c、y、k、f和g;x10选自k、q、y、t、f、l、w、m、a、e、g、和s;x14选自i、l、f、s、r、y、q、w、d、k和h(例如,i、l和f);x15选自d、s、i、n、e、a、h、f、l、q、m、g、y和v;x19选自t、v、c、e、s和a(例如,t和v);x20选自r、f、t、w、e、l、n、c、k、v、s、q、i、y、h和a;x21选自s、p、r、k、n、a、h、q、g和l;x22选自d、g、t、n、s、k、a、i、e、l、q、r和y;并且x23选自k、v、a、e、y、i、c、l、s、t、g、k、m、d和f。在一个实施例中,hnh样结构域与seqidno:18的序列相差1、2、3、4或5个残基。在一个实施例中,eacas9分子或eacas9多肽包含含有具有式vii的氨基酸序列的hnh样结构域:x1-v-x3-h-i-v-p-x6-s-x8-x9-x10-d-d-s-x14-x15-n-k-v-l-t-x20-x21-x22-x23-n(seqidno:19),其中x1选自d和e;x3选自d和e;x6选自q、h、r、k、y、i、l和w;x8选自f、l、v、k、y、m、i、r、a、e、d和q(例如,f);x9选自l、r、t、i、v、s、c、y、k、f和g;x10选自k、q、y、t、f、l、w、m、a、e、g、和s;x14选自i、l、f、s、r、y、q、w、d、k和h(例如,i、l和f);x15选自d、s、i、n、e、a、h、f、l、q、m、g、y和v;x20选自r、f、t、w、e、l、n、c、k、v、s、q、i、y、h和a;x21选自s、p、r、k、n、a、h、q、g和l;x22选自d、g、t、n、s、k、a、i、e、l、q、r和y;并且x23选自k、v、a、e、y、i、c、l、s、t、g、k、m、d和f。在一个实施例中,hnh样结构域与seqidno:19的序列相差1、2、3、4或5个残基。在一个实施例中,eacas9分子或eacas9多肽包含具有如下氨基酸序列的hnh样结构域,该氨基酸序列具有式viii:d-x2-d-h-i-x5-p-q-x7-f-x9-x10-d-x12-s-i-d-n-x16-v-l-x19-x20-s-x22-x23-n(seqidno:20),其中x2选自i和v;x5选自i和v;x7选自a和s;x9选自i和l;x10选自k和t;x12选自d和n;x16选自r、k和l;x19选自t和v;x20选自s和r;x22选自k、d和a;并且x23选自e、k、g和n(例如,eacas9分子或eacas9多肽可以包含如本文所述的hnh样结构域)。在一个实施例中,hnh样结构域与seqidno:20的序列相差多达1个但不超过2、3、4或5个残基。在一个实施例中,eacas9分子或eacas9多肽包含具有式ix的氨基酸序列:l-y-y-l-q-n-g-x1’-d-m-y-x2’-x3’-x4’-x5’-l-d-i—x6’-x7’-l-s-x8’-y-z-n-r-x9’-k-x10’-d-x11’-v-p(seqidno:21),其中x1’选自k和r;x2’选自v和t;x3’选自g和d;x4’选自e、q和d;x5’选自e和d;x6’选自d、n和h;x7’选自y、r和n;x8’选自q、d和n;x9’选自g和e;x10’选自s和g;x11’选自d和n;并且z是hnh样结构域,例如如上所述。在一个实施例中,eacas9分子或eacas9多肽包含与seqidno:21的序列相差多达1个但不超过2、3、4或5个残基的氨基酸序列。在一个实施例中,hnh样结构域与本文(例如,图5a-5c或图7a-7b中)披露的hnh样结构域的序列相差多达1个但不超过2、3、4或5个残基。在一个实施例中,存在图5a-5c或图7a-7b中鉴定的1个或两个高度保守的残基。在一个实施例中,hnh样结构域与本文(例如,图6a-6b或图7a-7b中)披露的hnh样结构域的序列相差多达1个但不超过2、3、4或5个残基。在一个实施例中,存在图6a-6b或图7a-7b中鉴定的1、2、所有3个高度保守的残基。b)cas9活性(1)核酸酶和解旋酶活性在一个实施例中,cas9分子或cas9多肽能够切割靶核酸分子。典型地,野生型cas9分子切割靶核酸分子的两条链。可以工程化cas9分子和cas9多肽以改变核酸酶切割(或其他特性),例如以提供作为切口酶或缺乏切割靶核酸的能力的cas9分子或cas9多肽。能够切割靶核酸分子的cas9分子或cas9多肽在本文中称为eacas9分子或eacas9多肽。在一个实施例中,eacas9分子或eacas9多肽包含以下活性中的一种或多种:切口酶活性,即切割核酸分子的单链(例如非互补链或互补链)的能力;双链核酸酶活性,即切割双链核酸的两条链并产生双链断裂的能力,其在一个实施例中是在两种切口酶活性的存在下;内切核酸酶活性;外切核酸酶活性;以及解旋酶活性,即解开双链核酸的螺旋结构的能力。在一个实施例中,酶促活性或eacas9分子或eacas9多肽切割两条链并导致双链断裂。在一个实施例中,eacas9分子仅切割一条链,例如与grna杂交的链、或与和grna杂交的链互补的链。在一个实施例中,eacas9分子或eacas9多肽包含与hnh样结构域相关联的切割活性。在一个实施例中,eacas9分子或eacas9多肽包含与n-末端ruvc样结构域相关联的切割活性。在一个实施例中,eacas9分子或eacas9多肽包含与hnh样结构域相关联的切割活性和与n-末端ruvc样结构域相关联的切割活性。在一个实施例中,eacas9分子或eacas9多肽包含活性或有切割能力的hnh样结构域以及无活性或无切割能力的n-末端ruvc样结构域。在一个实施例中,eacas9分子或eacas9多肽包含无活性或无切割能力的hnh样结构域以及活性或有切割能力的n-末端ruvc样结构域。一些cas9分子或cas9多肽具有与grna分子相互作用并且连同grna分子一起定位至核心靶结构域的能力,但不能切割或不能以有效速率切割靶核酸。不具有或基本上不具有切割活性的cas9分子在本文中称为eicas9分子或eicas9多肽。例如,如通过本文所述的测定所测量的,eicas9分子或eicas9多肽可缺乏切割活性或具有基本上少于例如少于参考cas9分子或eicas9多肽的切割活性的20%、10%、5%、1%或0.1%。(2)靶向和pamcas9分子或cas9多肽是可以与指导rna(grna)分子相互作用并且与该grna分子并行定位至包含靶结构域和pam序列的位点的多肽。在一个实施例中,eacas9分子或eacas9多肽与靶核酸相互作用和切割靶核酸的能力是pam序列依赖性的。pam序列是靶核酸中的序列。在一个实施例中,靶核酸的切割发生在pam序列的上游。来自不同细菌物种的eacas9分子可以识别不同的序列基序(例如,pam序列)。在一个实施例中,化脓性链球菌的eacas9分子识别序列基序ngg、nag、nga并指导切割靶核酸序列的该序列上游的1至10(例如3至5)个碱基对。参见例如,mali等人,science[科学]2013;339(6121):823-826。在一个实施例中,嗜热链球菌的eacas9分子识别序列基序nggng和/或nnagaaw(w=a或t)并指导切割靶核酸序列的这些序列上游的1至10(例如,3至5)个碱基对。参见例如,horvath等人,science[科学]2010;327(5962):167-170,和deveau等人,jbacteriol[细菌学杂志]2008;190(4):1390-1400。在一个实施例中,变异链球菌的eacas9分子识别序列基序ngg和/或naar(r=a或g)并指导切割核心靶核酸序列的该序列上游的1至10(例如,3至5)个碱基对。参见例如,deveau等人,jbacteriol[细菌学杂志]2008;190(4):1390-1400。在一个实施例中,金黄色葡萄球菌的eacas9分子识别序列基序nngrr(r=a或g)并指导切割靶核酸序列的该序列上游的1至10(例如,3至5)个碱基对。在一个实施例中,金黄色葡萄球菌的eacas9分子识别序列基序nngrrt(r=a或g)并指导切割靶核酸序列的该序列上游的1至10(例如,3至5)个碱基对。在一个实施例中,金黄色葡萄球菌的eacas9分子识别序列基序nngrrv(r=a或g)并指导切割靶核酸序列的该序列上游的1至10(例,3至5)个碱基对。在一个实施例中,脑膜炎奈瑟菌的eacas9分子识别序列基序nnnngatt或nnngctt(r=a或g,v=a、g或c)并指导切割靶核酸序列的该序列上游的1至10(例如,3至5)个碱基对。参见例如,hou等人,pnas[美国科学院院报]早期版本2013,1-6。可以例如使用jinek等人,science[科学]2012337:816所述的转化测定来确定cas9分子识别pam序列的能力。在前述实施例中,n可以是任何核苷酸残基,例如a、g、c或t中的任一个。如本文所讨论的,可以工程化cas9分子以改变cas9分子的pam特异性。示例性天然存在的cas9分子描述于chylinski等人,rnabiology[rna生物学]201310:5,727-737中。此类cas9分子包括簇1-78细菌家族的cas9分子。示例性天然存在的cas9分子包括簇1细菌家族的cas9分子。实例包括以下的cas9分子:化脓性链球菌(例如菌株sf370、mgas10270、mgas10750、mgas2096、mgas315、mgas5005、mgas6180、mgas9429、nz131和ssi-1)、嗜热链球菌(例如菌株lmd-9)、伪猪链球菌(s.pseudoporcinus)(例如菌株spin20026)、变异链球菌(例如菌株ua159、nn2025)、猕猴链球菌(s.macacae)(例如菌株nctc11558)、解没食子酸链球菌(s.gallolyticus)(例如菌株ucn34、atccbaa-2069)、马肠链球菌(s.equines)(例如菌株atcc9812、mgcs124)、停乳链球菌(s.dysdalactiae)(例如菌株ggs124)、牛链球菌(s.bovis)(例如菌株atcc700338)、咽峡炎链球菌(s.anginosus)(例如菌株f0211)、无乳链球菌(s.agalactiae)(例如菌株nem316、a909)、产单核细胞李斯特菌(例如菌株f6854)、无害李斯特菌(listeriainnocua,l.innocua,例如菌株clip11262)、意大利肠球菌(enterococcusitalicus)(例如菌株dsm15952)、或屎肠球菌(enterococcusfaecium)(例如菌株1,231,408)。另一种示例性cas9分子是脑膜炎奈瑟菌的cas9分子(hou等人,pnas[美国科学院院报]早期版本2013,1-6)。在一个实施例中,cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)包含如下氨基酸序列:该氨基酸序列与本文所述的任何cas9分子序列或天然存在的cas9分子序列(例如来自本文列出的或描述于chylinski等人,rnabiology[rna生物学]201310:5,727-737;hou等人,pnas[美国科学院院报]早期版本2013,1-6中的物种的cas9分子;seqidno:1-4)具有60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性;该氨基酸序列与其比较时相差不超过2%、5%、10%、15%、20%、30%或40%的氨基酸残基;该氨基酸序列与其相差至少1、2、5、10或20个氨基酸但不超过100、80、70、60、50、40或30个氨基酸;或与其是相同的。在一个实施例中,cas9分子或cas9多肽包含以下活性中的一种或多种:切口酶活性;双链切割活性(例如,内切核酸酶和/或外切核酸酶活性);解旋酶活性;或与grna分子一起归巢至靶核酸的能力。在一个实施例中,cas9分子或cas9多肽包含图2a-2g的共有序列的氨基酸序列,其中“*”指示在化脓性链球菌、嗜热链球菌、变异链球菌和无害李斯特菌的cas9分子的氨基酸序列中对应位置中发现的任何氨基酸,并且“-”指示任何氨基酸。在一个实施例中,cas9分子或cas9多肽与图2a-2g中披露的共有序列的序列相差至少1个但不超过2、3、4、5、6、7、8、9或10个氨基酸残基。在一个实施例中,cas9分子或cas9多肽包含图7a-7b的seqidno:7的氨基酸序列,其中“*”指示在化脓性链球菌或脑膜炎奈瑟菌的cas9分子的氨基酸序列中对应位置中发现的任何氨基酸,“-”指示任何氨基酸,并且“-”指示任何氨基酸或不存在。在一个实施例中,cas9分子或cas9多肽与图7a-7b中披露的seqidno:6或7的序列相差至少1个但不超过2、3、4、5、6、7、8、9或10个氨基酸残基。比较许多cas9分子的序列指示某些区域是保守的。这些区域在下文鉴定为:区域1(残基1至180,或在区域1'的情况下,残基120至180)区域2(残基360至480);区域3(残基660至720);区域4(残基817至900);以及区域5(残基900至960);在一个实施例中,cas9分子或cas9多肽包含区域1-5以及足够的另外的cas9分子序列以提供生物活性分子,例如具有本文所述的至少一种活性的cas9分子。在一个实施例中,区域1-6中的每一个独立地与本文所述的cas9分子或cas9多肽(例如,来自图2a-2g或来自图7a-7b的序列)的对应残基具有50%、60%、70%或80%同源性。在一个实施例中,cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)包含称为区域1的氨基酸序列:该氨基酸序列与化脓性链球菌的cas9的氨基酸序列的氨基酸1-180(根据图2a-2g中基序序列进行编号;图2a-2g中四个cas9序列中52%的残基是保守的)具有50%、60%、70%、80%、85%、90%、95%、96%、97%、98%或99%同源性;该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸1-180相差至少1、2、5、10或20个氨基酸但不超过90、80、70、60、50、40或30个氨基酸;或该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的1-180是相同的。在一个实施例中,cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)包含称为区域1’的氨基酸序列:该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸120-180(图2a-2g中四个cas9序列中55%的残基是保守的)具有55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性;该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸120-180相差至少1、2或5个氨基酸但不超过35、30、25、20或10个氨基酸;或该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的120-180是相同的。在一个实施例中,cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)包含称为区域2的氨基酸序列:该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸360-480(图2a-2g中四个cas9序列中52%的残基是保守的)具有50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性;该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸360-480相差至少1、2或5个氨基酸但不超过35、30、25、20或10个氨基酸;或该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的360-480是相同的。在一个实施例中,cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)包含称为区域3的氨基酸序列:该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸660-720(图2a-2g中四个cas9序列中56%的残基是保守的)具有55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性;该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸660-720相差至少1、2或5个氨基酸但不超过35、30、25、20或10个氨基酸;或该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的660-720是相同的。在一个实施例中,cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)包含称为区域4的氨基酸序列:该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸817-900(图2a-2g中四个cas9序列中55%的残基是保守的)具有50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性;该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸817-900相差至少1、2或5个氨基酸但不超过35、30、25、20或10个氨基酸;或该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的817-900是相同的。在一个实施例中,cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)包含称为区域5的氨基酸序列:该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸900-960(图2a-2g中四个cas9序列中60%的残基是保守的)具有50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性;该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的氨基酸900-960相差至少1、2或5个氨基酸但不超过35、30、25、20或10个氨基酸;或该氨基酸序列与化脓性链球菌、嗜热链球菌、变异链球菌或无害李斯特菌的cas9的氨基酸序列的900-960是相同的。c)工程化或改变的cas9分子和cas9多肽本文所述的cas9分子和cas9多肽(例如天然存在的cas9分子)可以具有许多特性中的任一种,包括:切口酶活性;核酸酶活性(例如,内切核酸酶和/或外切核酸酶活性);解旋酶活性;与grna分子功能性缔合的能力;以及在核酸上靶向(或定位至)位点的能力(例如,pam识别和特异性)。在一个实施例中,cas9分子或cas9多肽可以包括这些特性的全部或子集。在典型的实施例中,cas9分子或cas9多肽具有与grna分子相互作用并且与该grna分子并行定位至核酸中的位点的能力。其他活性(例如pam特异性、切割活性或解旋酶活性)可在cas9分子和cas9多肽中更广泛地变化。cas9分子包括工程化cas9分子和工程化cas9多肽(如在此背景下使用的“工程化”仅指cas9分子或cas9多肽与参考序列不同,并且暗示没有加工或起源限制)。工程化cas9分子或cas9多肽可以包含改变的酶特性,例如改变的核酸酶活性(与天然存在的或其他参考cas9分子相比)或改变的解旋酶活性。如本文所讨论的,工程化cas9分子或cas9多肽可以具有切口酶活性(与双链核酸酶活性相反)。在一个实施例中,工程化cas9分子或cas9多肽可以具有改变其尺寸的改变,例如减少其尺寸的氨基酸序列的缺失,例如对一种或多种或任何cas9活性没有显著影响。在一个实施例中,工程化cas9分子或cas9多肽可以包含影响pam识别的改变。例如,可以改变工程化cas9分子以识别除内源野生型pi结构域识别的pam序列之外的pam序列。在一个实施例中,cas9分子或cas9多肽可以在序列上与天然存在的cas9分子不同,但在一种或多种cas9活性方面不具有显著改变。具有所希望的特性的cas9分子或cas9多肽能以多种方式制备,例如通过改变亲本(例如天然存在的)cas9分子或cas9多肽,以提供具有所希望的特性的改变的cas9分子或cas9多肽。例如,可以引入相对于亲本cas9分子(例如天然存在的或工程化cas9分子)的一个或多个突变或差异。此类突变和差异包括:取代(例如,保守取代或非必需氨基酸的取代);插入;或缺失。在一个实施例中,cas9分子或cas9多肽相对于参考(例如亲本)cas9分子可以包含一个或多个突变或差异,例如至少1、2、3、4、5、10、15、20、30、40或50个突变但少于200、100或80个突变。在一个实施例中,一个或多个突变对cas9活性(例如本文所述的cas9活性)没有实质性影响。在一个实施例中,一个或多个突变对cas9活性(例如本文所述的cas9活性)有实质性影响。(1)非切割和修饰的切割cas9分子和cas9多肽在一个实施例中,cas9分子或cas9多肽包含不同于天然存在的cas9分子(例如,不同于具有最接近同源性的天然存在的cas9分子)的切割特性。例如,cas9分子或cas9多肽可以与天然存在的cas9分子(例如化脓性链球菌的cas9分子)不同,如下:例如与天然存在的cas9分子(例如,化脓性链球菌的cas9分子)相比,其调节(例如,减少或增加)双链核酸的切割的能力(内切核酸酶和/或外切核酸酶活性);例如与天然存在的cas9分子(例如,化脓性链球菌的cas9分子)相比,其调节(例如,减少或增加)核酸的单链(例如核酸分子的非互补链或核酸分子的互补链)的切割的能力(切口酶活性);或切割核酸分子(例如双链或单链核酸分子)的能力,可以被消除。(2)修饰的切割eacas9分子和eacas9多肽在一个实施例中,eacas9分子或eacas9多肽包含以下活性中的一种或多种:与n-末端ruvc样结构域相关联的切割活性;与hnh样结构域相关联的切割活性;与hnh样结构域相关联的切割活性和与n-末端ruvc样结构域相关联的切割活性。在一个实施例中,eacas9分子或eacas9多肽包含活性或有切割能力的hnh样结构域(例如,本文所述的hnh样结构域,例如seqidno:17、seqidno:18、seqidno:19、seqidno:20、或seqidno:21)和无活性或无切割能力的n-末端ruvc样结构域。示例性无活性或无切割能力的n-末端ruvc样结构域可以在n-末端ruvc样结构域中具有天冬氨酸的突变(例如图2a-2g中披露的共有序列的位置9处的天冬氨酸或seqidno:7的位置10处的天冬氨酸例如可以被丙氨酸取代)。在一个实施例中,eacas9分子或eacas9多肽与野生型的不同在于n-末端ruvc样结构域,并且不切割靶核酸,或以显著更低的效率(例如,如通过本文所述的测定所测量的,少于参考cas9分子的切割活性的20%、10%、5%、1%或.1%)切割。参考cas9分子可以是天然存在的未修饰的cas9分子,例如天然存在的cas9分子,例如化脓性链球菌或嗜热链球菌的cas9分子。在一个实施例中,参考cas9分子是具有最接近的序列同一性或同源性的天然存在的cas9分子。在一个实施例中,eacas9分子或eacas9多肽包含无活性或无切割能力的hnh结构域以及活性或有切割能力的n-末端ruvc样结构域(例如,本文所述的n-末端ruvc样结构域,例如,seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、或seqidno:16)。示例性无活性或无切割能力的hnh样结构域可以在以下中的一个或多个处具有突变:在hnh样结构域中的组氨酸(例如图2a-2g的位置856处显示的组氨酸)例如可以被丙氨酸取代;在hnh样结构域中的一个或多个天冬酰胺(例如图2a-2g的位置870处和/或图2a-2g的位置879处所示的天冬酰胺)例如可以被丙氨酸取代。在一个实施例中,eacas9与野生型的不同在于hnh样结构域,并且不切割靶核酸,或以显著更低的效率(例如,如通过本文所述的测定所测量的,少于参考cas9分子的切割活性的20%、10%、5%、1%或0.1%)切割。参考cas9分子可以是天然存在的未修饰的cas9分子,例如天然存在的cas9分子,例如化脓性链球菌或嗜热链球菌的cas9分子。在一个实施例中,参考cas9分子是具有最接近的序列同一性或同源性的天然存在的cas9分子。在一个实施例中,eacas9分子或eacas9多肽包含无活性或无切割能力的hnh结构域以及活性或有切割能力的n-末端ruvc样结构域(例如,本文所述的n-末端ruvc样结构域,例如,seqidno:8、seqidno:9、seqidno:10、seqidno:11、seqidno:12、seqidno:13、seqidno:14、seqidno:15、或seqidno:16)。示例性无活性或无切割能力的hnh样结构域可以在以下中的一个或多个处具有突变:在hnh样结构域中的组氨酸(例如图2a-2g的位置856处显示的组氨酸)例如可以被丙氨酸取代;在hnh样结构域中的一个或多个天冬酰胺(例如图2a-2g的位置870处和/或图2a-2g的位置879处所示的天冬酰胺)例如可以被丙氨酸取代。在一个实施例中,eacas9与野生型的不同在于hnh样结构域,并且不切割靶核酸,或以显著更低的效率(例如,如通过本文所述的测定所测量的,少于参考cas9分子的切割活性的20%、10%、5%、1%或0.1%)切割。参考cas9分子可以是天然存在的未修饰的cas9分子,例如天然存在的cas9分子,例如化脓性链球菌或嗜热链球菌的cas9分子。在一个实施例中,参考cas9分子是具有最接近的序列同一性或同源性的天然存在的cas9分子。d)切割靶核酸的一条或两条链的能力的改变在一个实施例中,示例性cas9活性包括pam特异性、切割活性和解旋酶活性中的一种或多种。可以存在一个或多个突变,例如在以下中:一个或多个ruvc样结构域,例如n-末端ruvc样结构域;hnh样结构域;ruvc样结构域和hnh样结构域外的区域。在一些实施例中,一个或多个突变存在于ruvc样结构域(例如,n-末端ruvc样结构域)中。在一些实施例中,一个或多个突变存在于hnh样结构域中。在一些实施例中,突变存在于ruvc样结构域(例如n-末端ruvc样结构域)和hnh样结构域两者中。可参考化脓性链球菌序列在ruvc结构域或hnh结构域上进行的示例性突变包括:d10a、e762a、h840a、n854a、n863a和/或d986a。在一个实施例中,cas9分子或cas9多肽是eicas9分子或eicas9多肽,其与参考cas9分子相比在ruvc结构域和/或hnh结构域中包含一个或多个差异,并且该eicas9分子或eicas9多肽不切割核酸,或以比野生型显著更低的效率切割(例如,如通过本文所述的测定所测量的,当在例如如本文所述的切割测定中与野生型比较时,以少于参考cas9分子的50%、25%、10%或1%切割)。例如通过评估突变是否是保守的或通过第iv章节所述的方法,可以评估或预测特定序列(例如取代)是否可以影响一种或多种活性(例如靶向活性、切割活性等)。在一个实施例中,如在cas9分子的背景下使用的“非必需”氨基酸残基是可以从cas9分子(例如天然存在的cas9分子(例如,eacas9分子))的野生型序列改变而没有消除或更优选地基本上不改变cas9活性(例如,切割活性)的残基,而改变“必需”氨基酸残基导致活性(例如,切割活性)的显著丧失。在一个实施例中,cas9分子或cas9多肽包含不同于天然存在的cas9分子(例如,不同于具有最接近同源性的天然存在的cas9分子)的切割特性。例如,cas9分子或cas9多肽可以与天然存在的cas9分子(例如,金黄色葡萄球菌、化脓性链球菌或空肠弯曲杆菌的cas9分子)不同,如下:例如与天然存在的cas9分子(例如,金黄色葡萄球菌、化脓性链球菌或空肠弯曲杆菌的cas9分子)相比,其调节(例如,减少或增加)双链断裂的切割的能力(内切核酸酶和/或外切核酸酶活性);例如与天然存在的cas9分子(例如,金黄色葡萄球菌、化脓性链球菌或空肠弯曲杆菌的cas9分子)相比,其调节(例如,减少或增加)核酸的单链(例如核酸分子的非互补链或核酸分子的互补链)的切割的能力(切口酶活性);或切割核酸分子(例如双链或单链核酸分子)的能力,可以被消除。在一个实施例中,改变的cas9分子或cas9多肽是包含以下活性中的一种或多种的eacas9分子或eacas9多肽:与ruvc结构域相关联的切割活性;与hnh结构域相关联的切割活性;与hnh结构域相关联的切割活性和与ruvc结构域相关联的切割活性。在一个实施例中,改变的cas9分子或cas9多肽是eicas9分子或eacas9多肽,其不切割核酸分子(双链或单链核酸分子),或以显著更低的效率(例如,如通过本文所述的测定所测量的,少于参考cas9分子的切割活性的20%、10%、5%、1%或0.1%)切割核酸分子。参考cas9分子可以是天然存在的未修饰的cas9分子,例如天然存在的cas9分子,例如化脓性链球菌、嗜热链球菌、金黄色葡萄球菌、空肠弯曲杆菌或脑膜炎奈瑟菌的cas9分子。在一个实施例中,参考cas9分子是具有最接近的序列同一性或同源性的天然存在的cas9分子。在一个实施例中,eicas9分子或eicas9多肽缺乏与ruvc结构域相关联的实质切割活性和与hnh结构域相关联的切割活性。在一个实施例中,改变的cas9分子或cas9多肽是包含图2a-2g中披露的共有序列中所示的化脓性链球菌的固定氨基酸残基的eacas9分子或eacas9多肽,并且具有与化脓性链球菌的氨基酸序列在一个或多个残基(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)(在图2a-2g中披露的共有序列或seqidno:7中用“-”表示)处不同(例如,具有取代)的一个或多个氨基酸。在一个实施例中,改变的cas9分子或cas9多肽包含以下序列,其中:对应于图2a-2g中披露的共有序列的固定序列的序列与图2a-2g中披露的共有序列相差不超过1%、2%、3%、4%、5%、10%、15%或20%的固定残基;对应于图2a-2g中披露的共有序列中由“*”标识的残基的序列与天然存在的cas9分子(例如,化脓性链球菌cas9分子)的对应序列相差不超过1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、或40%的“*”残基;并且,对应于图2a-2g中披露的共有序列中由“-”标识的残基的序列与天然存在的cas9分子(例如,化脓性链球菌cas9分子)的对应序列相差不超过5%、10%、15%、20%、25%、30%、35%、40%、45%、55%、或60%的“-”残基。在一个实施例中,改变的cas9分子或cas9多肽是包含图2a-2g中披露的共有序列中所示的嗜热链球菌的固定氨基酸残基的eacas9分子或eacas9多肽,并且具有与嗜热链球菌的氨基酸序列在一个或多个残基(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)(在图2a-2g中披露的共有序列中用“-”表示)处不同(例如,具有取代)的一个或多个氨基酸。在一个实施例中,改变的cas9分子或cas9多肽包含以下序列,其中:对应于图2a-2g中披露的共有序列的固定序列的序列与图2a-2g中披露的共有序列相差不超过1%、2%、3%、4%、5%、10%、15%或20%的固定残基;对应于图2a-2g中披露的共有序列中由“*”标识的残基的序列与天然存在的cas9分子(例如,嗜热链球菌cas9分子)的对应序列相差不超过1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、或40%的“*”残基;并且,对应于图2a-2g中披露的共有序列中由“-”标识的残基的序列与天然存在的cas9分子(例如,嗜热链球菌cas9分子)的对应序列相差不超过5%、10%、15%、20%、25%、30%、35%、40%、45%、55%、或60%的“-”残基。在一个实施例中,改变的cas9分子或cas9多肽是包含图2a-2g中披露的共有序列中所示的变异链球菌的固定氨基酸残基的eacas9分子或eacas9多肽,并且具有与变异链球菌的氨基酸序列在一个或多个残基(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)(在图2a-2g中披露的共有序列中用“-”表示)处不同(例如,具有取代)的一个或多个氨基酸。在一个实施例中,改变的cas9分子或cas9多肽包含以下序列,其中:对应于图2a-2g中披露的共有序列的固定序列的序列与图2a-2g中披露的共有序列相差不超过1%、2%、3%、4%、5%、10%、15%或20%的固定残基;对应于图2a-2g中披露的共有序列中由“*”标识的残基的序列与天然存在的cas9分子(例如,变异链球菌cas9分子)的对应序列相差不超过1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、或40%的“*”残基;并且,对应于图2a-2g中披露的共有序列中由“-”标识的残基的序列与天然存在的cas9分子(例如,变异链球菌cas9分子)的对应序列相差不超过5%、10%、15%、20%、25%、30%、35%、40%、45%、55%、或60%的“-”残基。在一个实施例中,改变的cas9分子或cas9多肽是包含图2a-2g中披露的共有序列中所示的无害李斯特菌的固定氨基酸残基的eacas9分子或eacas9多肽,并且具有与无害李斯特菌的氨基酸序列在一个或多个残基(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)(在图2a-2g中披露的共有序列中用“-”表示)处不同(例如,具有取代)的一个或多个氨基酸。在一个实施例中,改变的cas9分子或cas9多肽包含以下序列,其中:对应于图2a-2g中披露的共有序列的固定序列的序列与图2a-2g中披露的共有序列相差不超过1%、2%、3%、4%、5%、10%、15%或20%的固定残基;对应于图2a-2g中披露的共有序列中由“*”标识的残基的序列与天然存在的cas9分子(例如,无害李斯特菌cas9分子)的对应序列相差不超过1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、或40%的“*”残基;并且,对应于图2a-2g中披露的共有序列中由“-”标识的残基的序列与天然存在的cas9分子(例如,无害李斯特菌cas9分子)的对应序列相差不超过5%、10%、15%、20%、25%、30%、35%、40%、45%、55%、或60%的“-”残基。在一个实施例中,改变的cas9分子或cas9多肽(例如eacas9分子)可以是例如两种或更多种不同的cas9分子或cas9多肽(例如不同物种的两种或更多种天然存在的cas9分子)的融合物。例如,一种物种的天然存在的cas9分子的片段可以与第二物种的cas9分子的片段融合。作为一个实例,包含n-末端ruvc样结构域的化脓性链球菌cas9分子的片段可以与包含hnh样结构域的化脓性链球菌以外的物种(例如嗜热链球菌)的cas9分子的片段融合。(1)具有改变的pam识别或没有pam识别的cas9分子天然存在的cas9分子可以识别特定pam序列,例如上文针对例如化脓性链球菌、嗜热链球菌、变异链球菌、金黄色葡萄球菌和脑膜炎奈瑟菌所述的pam识别序列。在一个实施例中,cas9分子或cas9多肽具有与天然存在的cas9分子相同的pam特异性。在其他实施例中,cas9分子或cas9多肽具有与天然存在的cas9分子无关联的pam特异性、或与和其具有最接近的序列同源性的天然存在的cas9分子无关联的pam特异性。例如,可以改变天然存在的cas9分子,例如以改变pam识别,例如以改变cas9分子或cas9多肽识别的pam序列来减少脱靶位点和/或改善特异性;或消除pam识别要求。在一个实施例中,可以改变cas9分子,例如以增加pam识别序列的长度和/或将cas9特异性改善至高水平的同一性,例如以减少脱靶位点并增加特异性。在一个实施例中,pam识别序列的长度为至少4、5、6、7、8、9、10或15个氨基酸。可以使用定向进化来生成识别不同pam序列和/或具有降低的脱靶活性的cas9分子或cas9多肽。可用于cas9分子的定向进化的示例性方法和系统描述于例如esvelt等人nature[自然]2011,472(7344):499-503中。候选cas9分子可以例如通过第iv章节中所述的方法进行评估。下面讨论介导pam识别的pi结构域的改变。e)具有改变的pi结构域的合成cas9分子和cas9多肽目前的基因组编辑方法受限于靶序列的多样性,这些靶序列可被所使用的cas9分子识别的pam序列靶向。当该术语在本文使用时,合成cas9分子(或syn-cas9分子)或合成cas9多肽(或syn-cas9多肽)是指包含来自一种细菌物种的cas9核心结构域和例如来自不同的细菌物种的功能性改变的pi结构域(即除了与cas9核心结构域天然相关联的pi结构域之外的pi结构域)的cas9分子或cas9多肽。在一个实施例中,改变的pi结构域识别如下pam序列,该序列不同于衍生出cas9核心结构域的天然存在的cas9所识别的pam序列。在一个实施例中,改变的pi结构域识别衍生出cas9核心结构域的天然存在的cas9所识别的相同的pam序列,但以不同的亲和力或特异性识别。syn-cas9分子或syn-cas9多肽可以分别是syn-eacas9分子或syn-eacas9多肽或syn-eicas9分子、syn-eicas9多肽。示例性syn-cas9分子或syn-cas9多肽包含:a)cas9核心结构域,例如来自表2a或2b的cas9核心结构域,例如金黄色葡萄球菌、化脓性链球菌或空肠弯曲杆菌cas9核心结构域;以及b)来自选自表4和5的物种xcas9序列的改变的pi结构域。在一个实施例中,所述改变的pi结构域的rkr基序(pam结合基序)与和cas9核心结构域相关联的天然或内源pi结构域的rkr基序的序列相比包含:1、2或3个氨基酸残基处的差异;在第一、第二或第三位置处的氨基酸序列差异;在第一和第二位置、第一和第三位置、或第二和第三位置处的氨基酸序列差异。在一个实施例中,cas9核心结构域包含来自表2a的物种xcas9的cas9核心结构域,并且所述改变的pi结构域包含来自表2a的物种ycas9的pi结构域。在一个实施例中,物种xcas9的rkr基序不是物种ycas9的rkr基序。在一个实施例中,改变的pi结构域的rkr基序选自xxy、xng和xnq。在一个实施例中,改变的pi结构域与来自表2a的所述物种y的天然存在的pi结构域的氨基酸序列具有至少60%、70%、80%、90%、95%或100%同源性。在一个实施例中,改变的pi结构域与来自表2a的所述第二物种的天然存在的pi结构域的氨基酸序列相差不超过50、40、30、25、20、15、10、5、4、3、2或1个氨基酸残基。在一个实施例中,cas9核心结构域包含金黄色葡萄球菌核心结构域,并且改变的pi结构域包含:脱氮脂环酸芽孢杆菌(a.denitrificans)pi结构域;空肠弯曲杆菌pi结构域;鼬鼠螺杆菌pi结构域;或物种xpi结构域的改变的pi结构域,其中物种x选自表5。在一个实施例中,cas9核心结构域包含化脓性链球菌核心结构域,并且改变的pi结构域包含:脱氮脂环酸芽孢杆菌pi结构域;空肠弯曲杆菌pi结构域;鼬鼠螺杆菌pi结构域;或物种xpi结构域的改变的pi结构域,其中物种x选自表5。在一个实施例中,cas9核心结构域包含空肠弯曲杆菌核心结构域,并且改变的pi结构域包含:脱氮脂环酸芽孢杆菌pi结构域;鼬鼠螺杆菌pi结构域;或物种xpi结构域的改变的pi结构域,其中物种x选自表5。在一个实施例中,cas9分子或cas9多肽进一步包含位于所述cas9核心结构域和所述改变的pi结构域之间的接头。在一个实施例中,接头包括:位于cas9核心结构域和异源pi结构域之间的本文其他地方所述的接头。合适的接头在第v章节中进一步描述。用于syn-cas9分子的示例性改变的pi结构域描述于表4和5中。表2a中提供了表4和5中提及的83种cas9直向同源物的序列。表3提供了具有已知pam序列和对应rkr基序的cas9直向同源物。在一个实施例中,syn-cas9分子或syn-cas9多肽也可以是尺寸优化的,例如syn-cas9分子或syn-cas9多肽包含一个或多个缺失和任选地位于侧接缺失的氨基酸残基之间的一个或多个接头。在一个实施例中,syn-cas9分子或syn-cas9多肽包含rec缺失。f)尺寸优化的cas9分子和cas9多肽本文所述的工程化cas9分子和工程化cas9多肽包括包含减少分子尺寸的缺失同时仍保留所希望的cas9特性(例如基本天然的构象、cas9核酸酶活性和/或靶核酸分子识别)的cas9分子或cas9多肽。本文提供了包含一个或多个缺失和任选地一个或多个接头的cas9分子或cas9多肽,其中接头位于侧接缺失的氨基酸残基之间。用于鉴定参考cas9分子中合适缺失的方法、用于生成具有缺失和接头的cas9分子的方法、以及使用此类cas9分子的方法对于本领域普通技术人员来说在阅读本文后是显而易见的。具有缺失的cas9分子(例如金黄色葡萄球菌、化脓性链球菌或空肠弯曲杆菌cas9分子)比对应天然存在的cas9分子更小,例如具有减少的氨基酸数量。较小尺寸的cas9分子允许增加递送方法的灵活性,并且从而增加基因组编辑的实用性。cas9分子或cas9多肽可以包含基本上不影响或减少本文所述的所得cas9分子或cas9多肽的活性的一个或多个缺失。保留在包含如本文所述的缺失的cas9分子或cas9多肽中的活性包括以下中的一种或多种:切口酶活性,即切割核酸分子的单链(例如非互补链或互补链)的能力;双链核酸酶活性,即切割双链核酸的两条链并产生双链断裂的能力,其在一个实施例中是在两种切口酶活性的存在下;内切核酸酶活性;外切核酸酶活性;解旋酶活性,即解开双链核酸的螺旋结构的能力;以及核酸分子(例如靶核酸或grna)的识别活性。可使用本文或本领域所述的活性测定来评估本文所述的cas9分子或cas9多肽的活性。(1)鉴定适合缺失的区域可以通过多种方法鉴定cas9分子的用于缺失的合适区域。来自各种细菌物种的天然存在的直向同源cas9分子(例如表2a中列出的那些中的任一种)可以在化脓性链球菌cas9的晶体结构上建模(nishimasu等人,cell[细胞],156:935-949,2014)以检查所选cas9直向同源物相对于蛋白质三维构象的保守水平。在空间上远离参与cas9活性(例如与靶核酸分子和/或grna交界)的区域的较不保守或不保守的区域代表作为缺失的候选物而基本上不影响或减少cas9活性的区域或结构域。(2)rec优化的cas9分子和cas9多肽当该术语在本文使用时,rec优化的cas9分子或rec优化的cas9多肽是指在rec2结构域和re1ct结构域中的一个或两个中包含缺失(统称为rec缺失)的cas9分子或cas9多肽,其中该缺失包含关联(cognate)结构域中至少10%的氨基酸残基。rec优化的cas9分子或cas9多肽可以是eacas9分子或eacas9多肽、或eicas9分子或eicas9多肽。示例性rec优化的cas9分子或rec优化的cas9多肽包含:a)选择以下的缺失:i)rec2缺失;ii)rec1ct缺失;或iii)rec1sub缺失。任选地,接头位于侧接缺失的氨基酸残基之间。在一个实施例中,cas9分子或cas9多肽仅包括一个缺失或仅包括两个缺失。cas9分子或cas9多肽可以包含rec2缺失和rec1ct缺失。cas9分子或cas9多肽可以包含rec2缺失和rec1sub缺失。通常,缺失将含有关联结构域中至少10%的氨基酸,例如rec2缺失将包括rec2结构域中至少10%的氨基酸。缺失可以包含:其关联结构域的至少10%、20%、30%、40%、50%、60%、70%、80%或90%的氨基酸残基;其关联结构域的所有氨基酸残基;其关联结构域之外的氨基酸残基;其关联结构域之外的多个氨基酸残基;紧接其关联结构域n末端的氨基酸残基;紧接其关联结构域c末端的氨基酸残基;紧接其关联结构域的n末端的氨基酸残基和紧接其关联结构域的c末端的氨基酸残基;其关联结构域n末端的多个(例如,多达5、10、15或20个)氨基酸残基;其关联结构域c末端的多个(例如,多达5、10、15或20个)氨基酸残基;其关联结构域n末端的多个(例如,多达5、10、15或20个)氨基酸残基和其关联结构域c末端的多个(例如,多达5、10、15或20个)氨基酸残基。在一个实施例中,缺失不会超出以下范围:其关联结构域;其关联结构域的n末端氨基酸残基;其关联结构域的c末端氨基酸残基。rec优化的cas9分子或rec优化的cas9多肽可以包括位于侧接缺失的氨基酸残基之间的接头。在第v章节中披露了在rec优化的cas9分子中侧接rec缺失的氨基酸残基之间使用的合适的接头。在一个实施例中,rec优化的cas9分子或rec优化的cas9多肽包含(除了任何rec缺失和相关接头之外)与天然存在的cas9(例如,表2a中所述的cas9分子,例如金黄色葡萄球菌cas9分子、化脓性链球菌cas9分子、或空肠弯曲杆菌cas9分子)的氨基酸序列具有至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%同源性的氨基酸序列。在一个实施例中,rec优化的cas9分子或rec优化的cas9多肽包含(除了任何rec缺失和相关接头之外)与天然存在的cas9(例如,表2a中所述的cas9分子,例如金黄色葡萄球菌cas9分子、化脓性链球菌cas9分子、或空肠弯曲杆菌cas9分子)的氨基酸序列相差不超过1、2、3、4、5、6、7、8、9、10、15、20或25个氨基酸残基的氨基酸序列。在一个实施例中,rec优化的cas9分子或rec优化的cas9多肽包含(除了任何rec缺失和相关接头之外)与天然存在的cas9(例如,表2a中所述的cas9分子,例如金黄色葡萄球菌cas9分子、化脓性链球菌cas9分子、或空肠弯曲杆菌cas9分子)的氨基酸序列相差不超过1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%或25%的氨基酸残基的氨基酸序列。对于序列比较,典型地一个序列用作参考序列,测试序列与该参考序列进行比较。当使用序列比较算法时,将测试序列和参考序列输入计算机中,必要时指定子序列坐标,并指定序列算法程序参数。可以使用默认程序参数,或者可以指定替代参数。基于程序参数,序列比较算法然后计算测试序列相对于参考序列的序列同一性百分比。用于比较的序列比对方法是本领域熟知的。可以进行用于比较的序列的最佳比对,例如通过局部同源性算法(smith和waterman,(1970)adv.appl.math.[高等应用数学]2:482c)、通过同源比对算法(needleman和wunsch,(1970)j.mol.biol.[分子生物学杂志]48:443)、通过相似性捜索方法(pearson和lipman,(1988)proc.nat’l.acad.sci.usa[美国国家科学院院刊]85:2444),通过这些算法的计算机化执行(在wisconsingeneticssoftwarepackage[威斯康星遗传软件包]中的gap、bestfit、fasta、和tfasta,geneticscomputergroup[遗传计算机组],575sciencedr.[科学街575号],madison[麦迪逊],wi[威斯康星州])或通过手动比对和目测检查(参见例如,brent等人,(2003)currentprotocolsinmolecularbiology[现代分子生物学实验技术])。适用于确定序列同一性百分比和序列相似性的算法的两个实例是blast和blast2.0算法,其分别描述于altschul等人,(1977)nuc.acidsres.[核酸研究]25:3389-3402;和altschul等人,(1990)j.mol.biol.[分子生物学杂志]215:403-410中。用于执行blast分析的软件可通过美国国家生物技术信息中心(nationalcenterforbiotechnologyinformation)公开获得。还可以使用e.meyers和w.miller((1988)comput.appl.biosci.[生物科学中的计算机应用]4:11-17)的算法,使用pam120权重残基表、12的空位长度罚分和4的空位罚分来确定两个氨基酸序列之间的同一性百分比,该算法已并入align程序(版本2.0)中。此外,可以使用needleman和wunsch((1970)j.mol.biol.[分子生物学杂志]48:444-453)算法,使用blossom62矩阵或pam250矩阵,16、14、12、10、8、6、或4的空位权重和1、2、3、4、5、或6的长度权重来确定两个氨基酸序列之间的同一性百分比,该算法已并入gcg软件包(可在www.gcg.com获得)中的gap程序中。在表2a中提供了83种天然存在的cas9直向同源物的示例性rec缺失的序列信息。来自不同细菌物种的示例性cas9分子的氨基酸序列如下所示。表2a.cas9直向同源物的氨基酸序列表2b.cas9核心结构域的氨基酸序列表3.鉴定的pam序列和对应rkr基序。表4和5中提供了pi结构域。表4.改变的pi结构域表5.其他改变的pi结构域g)编码cas9分子的核酸本文提供了编码cas9分子或cas9多肽(例如eacas9分子或eacas9多肽)的核酸。编码cas9分子或cas9多肽的示例性核酸描述于cong等人,science[科学]2013,399(6121):819-823;wang等人,cell[细胞]2013,153(4):910-918;mali等人,science[科学]2013,399(6121):823-826;jinek等人,science[科学]2012,337(6096):816-821中。编码cas9分子或cas9多肽的另一种示例性核酸在图8中以黑色显示。在一个实施例中,编码cas9分子或cas9多肽的核酸可以是合成核酸序列。例如,合成核酸分子可以经化学修饰。在一个实施例中,cas9mrna具有以下特性中的一种或多种(例如,所有):它被封端,多聚腺苷酸化,被5-甲基胞嘧啶和/或假尿苷取代。此外或可替代地,可以对合成核酸序列进行密码子优化,例如至少一个非常见密码子或较不常见密码子已被常见密码子替代。例如,合成核酸可以指导优化的信使mrna的合成,例如针对哺乳动物表达系统中的表达优化的,例如本文所述的。此外或可替代地,编码cas9分子或cas9多肽的核酸可以包含核定位序列(nls)。核定位序列是本领域已知的。seqidno:22是编码化脓性链球菌的cas9分子的示例性密码子优化的核酸序列。seqidno:23是化脓性链球菌cas9分子的对应氨基酸序列。seqidno:24是编码脑膜炎奈瑟菌的cas9分子的示例性密码子优化的核酸序列。seqidno:25是脑膜炎奈瑟菌cas9分子的对应氨基酸序列。seqidno:26是金黄色葡萄球菌cas9分子的氨基酸序列。seqidno:39是编码金黄色葡萄球菌cas9的cas9分子的示例性密码子优化的核酸序列。如果任何上述cas9序列在c-末端处与肽或多肽融合,则应理解终止密码子将被除去。h)其他cas分子和cas多肽各种类型的cas分子或cas多肽可用于实践本文披露的发明。在一些实施例中,使用ii型cas系统的cas分子。在其他实施例中,使用其他cas系统的cas分子。例如,可以使用i型或iii型cas分子。示例性cas分子(和cas系统)描述于例如haft等人,ploscomputationalbiology[公共科学图书馆·计算生物学]2005,1(6):e60和makarova等人,naturereviewmicrobiology[自然微生物学评论]2011,9:467-477中,将这两篇参考文献的内容都通过引用以其整体并入本文。示例性cas分子(和cas系统)也示于表600中。表600.cas系统4.基因组编辑方法和递送方法a)基因组编辑方式通常,应理解的是,根据本文所述方法的任何基因的改变可以通过任何机制介导,并且任何方法不限于特定机制。可与基因改变相关联的示例性机制包括但不限于非同源末端连接(例如,经典的或替代的)、微同源介导的末端连接(mmej)、同源定向修复(例如,内源供体模板介导的)、合成依赖链退火(sdsa)、单链退火、单链侵入、单链断裂修复(ssbr)、错配修复(mmr)、碱基切除修复(ber)、链间交联(icl)、跨损伤合成(translesionsynthesis,tls)、或无错误的复制后修复(prr)。本文描述了用于靶向性敲除编码蛋白质pd-1的pdcd1的一个或两个等位基因的示例性方法。(1)用于基因靶向的nhej方式如本文所述的,核酸酶诱导的非同源末端连接(nhej)可以用于靶基因特异性敲除。核酸酶诱导的nhej也可用于去除(例如,缺失)目的基因中的序列插入。尽管不希望受理论束缚,但据信,在一个实施例中,与本文所述的方法相关联的基因组改变依赖于核酸酶诱导的nhej和nhej修复途径的易错性质。nhej通过使两个末端连接在一起来修复dna中的双链断裂;然而,通常,只要两个相容末端在恰好它们通过双键断裂形成时被完美连接,原始序列就被恢复。在末端重新连接之前,双键断裂的dna末端常常是酶加工的受试者,在一条或两条链处产生核苷酸的添加或去除。这使得nhej修复位点处的dna序列中存在插入和/或缺失(indel)突变。这些突变中的三分之二典型地改变阅读框并且因此产生非功能蛋白。另外,维持阅读框但插入或缺失大量的序列的突变可以破坏蛋白质的功能性。这是基因座依赖性的,因为关键功能结构域中的突变可能比蛋白质的非关键区中的突变耐受性低。由nhej生成的indel突变在性质上是不可预测的;然而,在给定的断裂位点处,某些indel序列是有利的并且是以群体来过度表示的,很可能是由于小的微同源区。缺失的长度可以广泛地变化;最常见的是在1-50bp范围内,但它们很容易达到大于100-200bp。插入往往是较短的并且经常包含紧密围绕断裂位点的序列的短的重复。然而,有可能获得大的插入,并且在这些情况中,插入的序列经常被跟踪至基因组的其他区域或跟踪至细胞中存在的质粒dna。因为nhej是诱变的方法,所以其还可以用于缺失小序列基序,只要不需要生成特定最终序列即可。如果双链断裂被靶向靠近短的靶序列,则由nhej修复导致的缺失突变经常跨越并且因此去除不想要的核苷酸。对于较大的dna区段的缺失,引入两个双链断裂(序列的每侧上一个双链断裂)可以在末端之间产生nhej,其中去除了整个间插序列。在一些实施例中,一对grna可用于引入两个双链断裂,导致两个断裂之间的间插序列的缺失。这两种方式可以用于缺失特定dna序列;然而,nhej的易错性质仍可能在修复位点产生indel突变。双链切割eacas9分子和单链或切口酶eacas9分子均可用于本文所述的方法和组合物中以生成nhej介导的indel。靶向目的基因(例如基因的编码区,例如早期编码区)的nhej介导的indel可以用于敲除目的基因(即消除其表达)。例如,目的基因的早期编码区包含紧接转录起始位点的序列,在编码序列的第一外显子内,或在转录起始位点的500bp内(例如,少于500、450、400、350、300、250、200、150、100或50bp)。在一个实施例中,将nhej介导的indel引入一种或多种t细胞表达的基因(例如pdcd1)中。靶向该基因的单个grna或grna对与cas9双链核酸酶或单链切口酶一起提供。(2)双链或单链断裂相对于靶位置的放置在grna和cas9核酸酶生成双链断裂以诱导nhej介导的indel的一个实施例中,grna(例如单分子(或嵌合)或模块化grna)分子被配置为将一个双链断裂定位在靶位置的核苷酸附近。在一个实施例中,切割位点在距靶位置0-30bp之间(例如,距靶位置少于30、25、20、15、10、9、8、7、6、5、4、3、2或1bp)。在与cas9切口酶复合的两种grna诱导两个单链断裂以诱导nhej介导的indel的一个实施例中,两种grna(例如,独立地是单分子(或嵌合)或模块化grna)被配置为定位两个单链断裂以提供nhej修复靶位置的核苷酸。在一个实施例中,grna被配置为将切口定位在不同链上的相同位置或彼此的几个核苷酸内,基本上模拟双链断裂。在一个实施例中,较近的切口在距靶位置0-30bp之间(例如,距靶位置少于30、25、20、15、10、9、8、7、6、5、4、3、2或1bp),并且两个切口彼此在25-55bp内(例如,在25至50、25至45、25至40、25至35、25至30、50至55、45至55、40至55、35至55、30至55、30至50、35至50、40至50、45至50、35至45、或40至45bp之间)并且彼此相距不超过100bp(例如,不超过90、80、70、60、50、40、30、20或10bp)。在一个实施例中,grna被配置为在靶位置的核苷酸的任一侧上放置单链断裂。双链切割eacas9分子和单链或切口酶eacas9分子均可用于本文所述的方法和组合物中以在靶位置两侧生成断裂。可以在靶位置的两侧生成双链或成对单链断裂以去除两个切口之间的核酸序列(例如,缺失两个断裂之间的区域)。在一个实施例中,两种grna(例如独立地是单分子(或嵌合)或模块化grna)被配置为将双链断裂定位在靶位置的两侧。在一个替代实施例中,三种grna(例如独立地是单分子(或嵌合)或模块化grna)被配置为在靶位置的任一侧定位双链断裂(即,一种grna与cas9核酸酶复合)和两个单链断裂或成对单链断裂(即,两种grna与cas9切口酶复合)。在另一个实施例中,四种grna(例如独立地是单分子(或嵌合)或模块化grna)被配置为在靶位置的任一侧生成两对单链断裂(即,两对的两种grna与cas9切口酶复合)。一个或多个双链断裂或一对中两个单链切口的较近者理想地在靶位置的0-500bp内(例如,距靶位置不超过450、400、350、300、250、200、150、100、50或25bp)。当使用切口酶时,一对中的两个切口彼此在25-55bp内(例如,在25至50、25至45、25至40、25至35、25至30、50至55、45至55、40至55、35至55、30至55、30至50、35至50、40至50、45至50、35至45、或40至45bp之间)并且彼此相距不超过100bp(例如,不超过90、80、70、60、50、40、30、20或10bp)。b)靶向性敲低与通过使基因在dna水平上突变来永久性消除或减少表达的crispr-cas介导的基因敲除不同,crispr-cas敲低允许通过使用人工转录因子来暂时减少基因表达。将cas9蛋白的两个dna切割结构域中的关键残基进行突变(例如,d10a和h840a突变)导致生成催化失活的cas9(eicas9,其也称为死cas9或dcas9)。催化失活的cas9与grna复合并定位至该grna靶向结构域所指定的dna序列,然而,该cas9不会切割靶dna。将dcas9融合至效应结构域(例如转录阻遏结构域)使得能够将效应物募集至由grna指定的任何dna位点。虽然已经显示eicas9本身可以在编码序列中募集至早期区域时阻断转录,但是通过将转录阻遏结构域(例如krab、sid或erd)与cas9融合并将其募集至基因的启动子区可以实现更稳健的阻遏。靶向启动子的dnasei超敏感区可能产生更有效的基因阻遏或活化,因为这些区域更可能是cas9蛋白可接近的,并且更可能含有内源转录因子的位点。特别是对于基因阻遏,本文预期的是,阻断内源转录因子的结合位点将有助于下调基因表达。在另一个实施例中,eicas9可以与染色质修饰蛋白融合。改变染色质状态可以使得靶基因表达减少。在一个实施例中,grna分子可以被靶向已知的转录应答元件(例如,启动子、增强子等)、已知的上游激活序列(uas)、和/或疑似能够控制靶dna的表达的未知或已知功能的序列。在一个实施例中,crispr/cas介导的基因敲低可用于降低一种或多种t细胞表达的基因的表达。在使用本文所述的eicas9或eicas9融合蛋白敲低两种t细胞表达的基因(例如fas、bid、ctla4、pdcd1、cblb或ptpn6基因中的任两种)的一个实施例中,靶向这两种基因的单个grna或grna对与eicas9或eicas9融合蛋白一起提供。在使用eicas9或eicas9融合蛋白敲低三种t细胞表达的基因(例如fas、bid、ctla4、pdcd1、cblb或ptpn6基因中的任三种)的一个实施例中,靶向所有这三种基因的单个grna或grna对与eicas9或eicas9融合蛋白一起提供。在使用eicas9或eicas9融合蛋白敲低四种t细胞表达的基因(例如fas、bid、ctla4、pdcd1、cblb或ptpn6基因中的任四种)的一个实施例中,靶向所有四种基因的单个grna或grna对与eicas9或eicas9融合蛋白一起提供。在使用eicas9或eicas9融合蛋白敲低五种t细胞表达的基因(例如fas、bid、ctla4、pdcd1、cblb或ptpn6基因中的任五种)的一个实施例中,靶向所有五种基因的单个grna或grna对与eicas9或eicas9融合蛋白一起提供。在使用eicas9或eicas9融合蛋白敲低六种t细胞表达的基因(例如fas、bid、ctla4、pdcd1、cblb或ptpn6基因中的每一种)的一个实施例中,靶向所有六种基因的单个grna或grna对与eicas9或eicas9融合蛋白一起提供。c)单链退火单链退火(ssa)是另一种dna修复过程,其修复靶核酸中存在的两个重复序列之间的双链断裂。ssa途径所使用的重复序列通常长度大于30个核苷酸。发生在断裂末端处的切除以揭示靶核酸的两条链上的重复序列。切除后,将含有重复序列的单链突出端用rpa蛋白包被,以防止重复序列不适当退火,例如自身退火。rad52与突出端上的重复序列中的每一个结合并对齐该序列以使得能够将互补重复序列退火。退火后,将突出端的单链瓣进行切割。新dna合成填充了任何空位,并且连接恢复了dna双链体。作为加工的结果,缺失了两个重复之间的dna序列。缺失的长度可取决于许多因素,包括所使用的两个重复的位置、以及切除的途径或持续合成能力(processivity)。与hdr途径相反,ssa不需要模板核酸来改变或校正靶核酸序列。相反,使用互补重复序列。d)其他dna修复途径(1)ssbr(单链断裂修复)基因组中的单链断裂(ssb)由ssbr途径修复,这是与上面讨论的dsb修复机制不同的机制。ssbr途径有四个主要阶段:ssb检测、dna末端加工、dna空位填充和dna连接。在caldecott,naturereviewsgenetics[遗传学自然评论]9,619-631(2008年8月)中给出了更详细的解释,并且在此给出了总结。在第一阶段,当ssb形成时,parp1和/或parp2识别断裂并募集修复机器。parp1在dna断裂处的结合和活性是短暂的,并且似乎通过促进ssbr蛋白复合物在损伤处的局灶积累或稳定性来加速ssbr。可以说,这些ssbr蛋白中最重要的是xrcc1,其作为分子支架起作用,该分子支架与ssbr过程的多种酶组分(包括负责清洁dna3'和5'末端的蛋白质)相互作用,对其进行稳定和刺激。例如,xrcc1与促进末端加工的若干种蛋白质(dna聚合酶β、pnk和三种核酸酶ape1、aptx和aplf)相互作用。ape1具有内切核酸酶活性。aplf表现出内切核酸酶和3'至5'外切核酸酶活性。aptx具有内切核酸酶和3'至5'外切核酸酶活性。此末端加工是ssbr的重要阶段,因为大多数(如果不是全部)ssb的3'-和/或5'-末端“受损”。末端加工通常涉及将受损的3'-末端恢复为羟基化状态和/或将受损的5'末端恢复为磷酸酯部分,使末端变为具有连接能力。可加工受损的3'末端的酶包括pnkp、ape1和tdp1。可加工受损的5'末端的酶包括pnkp、dna聚合酶β和aptx。lig3(dna连接酶iii)也可参与末端加工。一旦清洁完末端后,可能会发生空位填充。在dna空位填充阶段,典型地存在的蛋白质是parp1、dna聚合酶β、xrcc1、fen1(瓣状内切核酸酶(flapendonculease)1)、dna聚合酶δ/ε、pcna和lig1。空位填充有两种方式,即短补丁修复和长补丁修复。短补丁修复涉及插入失去的单个核苷酸。在一些ssb中,“空位填充”可能继续置换两个或更多个核苷酸(已经报道了长达12个碱基的置换)。fen1是去除置换的5'-残基的内切核酸酶。多种dna聚合酶(包括polβ)参与ssb的修复,并且dna聚合酶的选择受ssb的来源和类型的影响。在第四阶段,dna连接酶如lig1(连接酶i)或lig3(连接酶iii)催化末端的连接。短补丁修复使用连接酶iii,并且长补丁修复使用连接酶i。有时,ssbr是复制偶联的。此途径可涉及ctip、mrn、ercc1和fen1中的一种或多种。可能促进ssbr的其他因子包括:aparp、parp1、parp2、parg、xrcc1、dna聚合酶b、dna聚合酶d、dna聚合酶e、pcna、lig1、pnk、pnkp、ape1、aptx、aplf、tdp1、lig3、fen1、ctip、mrn、和ercc1。(2)mmr(错配修复)细胞含有三个切除修复途径:mmr、ber和ner。切除修复途径具有共同的特征,因为它们典型地识别dna的一条链上的损伤,然后外切核酸酶/内切核酸酶去除损伤并留下1-30个核苷酸的空位(其由dna聚合酶循序地填充并最终用连接酶密封)。在li(cellresearch[细胞研究](2008)18:85–98)中给出了更完整的图,并且在此提供了总结。错配修复(mmr)在错配的dna碱基上操作。msh2/6或msh2/3复合物都具有atp酶活性,该活性在错配识别和修复开始中起重要作用。msh2/6优先识别碱基-碱基错配并鉴定1或2个核苷酸的错配,而msh2/3优先识别较大的id错配。hmlh1与hpms2异二聚化以形成hmutlα,其具有atp酶活性并且对于mmr的多个步骤是重要的。其具有pcna/复制因子c(rfc)依赖性内切核酸酶活性,该活性在涉及exo1的3'切口指导的mmr中起重要作用。(exo1是hr和mmr两者的参与者。)其调控错配引发的切除的终止。连接酶i是此途径的相关连接酶。可能促进mmr的其他因子包括:exo1、msh2、msh3、msh6、mlh1、pms2、mlh3、dnapold、rpa、hmgb1、rfc和dna连接酶i。(3)碱基切除修复(ber)碱基切除修复(ber)途径在整个细胞周期中是活跃的;其主要负责从基因组中去除小的、非螺旋扭曲的碱基损伤。相反,相关的核苷酸切除修复途径(在下一章节中讨论)修复庞大的螺旋扭曲损伤。在caldecott,naturereviewsgenetics[遗传学自然评论]9,619-631(2008年8月)中给出了更详细的解释,并且在此给出了总结。在dna碱基受损后,启动碱基切除修复(ber),并将该过程简化为五个主要步骤:(a)去除受损的dna碱基;(b)切除随后的碱基位点;(c)清除dna末端;(d)将正确的核苷酸插入到修复空位;以及(e)在dna主链中连接剩余的切口。这些最后的步骤与ssbr类似。在第一步中,受损特异性dna糖基化酶通过切割连接碱基与糖磷酸酯主链的n-糖苷键来切除受损碱基。然后ap内切核酸酶-1(ape1)或具有相关裂解酶活性的双功能dna糖基化酶切割磷酸二酯主链以产生dna单链断裂(ssb)。ber的第三步涉及清除dna末端。ber中的第四步由polβ(其将新的互补核苷酸添加至修复空位中)进行,并且在最后的步骤中,xrcc1/连接酶iii在dna主链中密封剩余切口。这完成了短补丁ber途径,其中大多数(约80%)受损dna碱基被修复。然而,如果在通过polβ插入一个核苷酸后步骤3中的5'-末端对末端加工活性具有抗性,则将聚合酶换为复制dna聚合酶polδ/ε,其然后再将约2-8个核苷酸添加至dna修复空位。这产生了5'-瓣结构,其被与持续合成能力因子增殖细胞核抗原(pcna)结合的瓣状内切核酸酶-1(fen-1)识别和切除。然后dna连接酶i密封dna主链中剩余的切口并完成长补丁ber。可能促进ber途径的另外的因子包括:dna糖基化酶,ape1、polb、pold、pole、xrcc1、连接酶iii、fen-1、pcna、recql4、wrn、myh、pnkp和aptx。(4)核苷酸切除修复(ner)核苷酸切除修复(ner)是一种重要的切除机制,其可以去除dna中庞大的螺旋扭曲损伤。关于ner的另外的细节在marteijn等人(naturereviewsmolecularcellbiology[分子细胞生物学自然评论]15,465–481(2014))中给出,并且在此给出了总结。ner是涵盖两条较小途径(全基因组ner(gg-ner)和转录偶联修复ner(tc-ner))的广阔途径。gg-ner和tc-ner使用不同的因子来识别dna受损。然而,它们使用相同的机器进行损伤切口、修复和连接。一旦识别出受损,细胞就会去除含有损伤的短的单链dna片段。内切核酸酶xpf/ercc1和xpg(由ercc5编码)通过切割损伤任一侧的受损链来去除损伤,导致22-30个核苷酸的单链空位。接下来,细胞进行dna空位填充合成和连接。参与此过程的是:pcna、rfc、dnapolδ、dnapolε或dnapolκ、以及dna连接酶i或xrcc1/连接酶iii。复制细胞倾向于使用dnapolε和dna连接酶i,而非复制细胞倾向于使用dnapolδ、dnapolκ和xrcc1/连接酶iii复合物来进行连接步骤。ner可能涉及以下因子:xpa-g、polh、xpf、ercc1、xpa-g、和lig1。转录偶联ner(tc-ner)可能涉及以下因子:csa、csb、xpb、xpd、xpg、ercc1、和ttda。可能促进ner修复途径的另外的因子包括xpa-g、polh、xpf、ercc1、xpa-g、lig1、csa、csb、xpa、xpb、xpc、xpd、xpf、xpg、ttda、uvssa、usp7、cetn2、rad23b、uv-ddb、cak亚复合物、rpa和pcna。(5)链内交联(icl)称为icl修复途径的专用途径修复链间交联。在复制或转录期间可发生链间交联或不同dna链中碱基之间的共价交联。icl修复涉及多个修复过程(特别是核溶解活性、跨损伤合成(tls)和hdr)的协调。募集核酸酶以在交联碱基的任一侧切除icl,同时协调tls和hdr以修复切割的链。icl修复可能涉及以下因子:内切核酸酶例如xpf和rad51c、内切核酸酶例如rad51、跨损伤聚合酶(例如dna聚合酶ζ和rev1)、以及范科尼贫血(fa)蛋白例如fancj。(6)其他途径哺乳动物中存在若干种其他dna修复途径。跨损伤合成(tls)是用于修复缺陷复制事件后留下的单链断裂的途径,并且涉及翻译聚合酶,例如dnapolζ和rev1。无错误的复制后修复(prr)是用于修复缺陷复制事件后留下的单链断裂的另一种途径。e)基因组编辑方法中的grna的实例如本文所述的任何grna分子可与任何cas9分子(其生成双链断裂或单链断裂以改变靶核酸的序列,例如靶位置或靶遗传特征)一起使用。在一些实例中,靶核酸在pdcd1基因座(例如,如所述的任何位置)处或其附近。在一些实施例中,将核糖核酸分子(例如grna分子)和蛋白质(例如cas9蛋白或其变体)引入本文提供的任何工程化细胞中。在这些方法中有用的grna分子描述如下。在一个实施例中,配置grna(例如嵌合grna)使得其包含以下特性中的一种或多种;a)例如当靶向产生双链断裂的cas9分子时,其可以将双链断裂定位(i)在靶位置的50、100、150、200、250、300、350、400、450或500个核苷酸内,或(ii)足够接近使靶位置在末端切除区内;b)其具有至少16个核苷酸的靶向结构域,例如(i)16、(ii)17、(iii)18、(iv)19、(v)20、(vi)21、(vii)22、(viii)23、(ix)24、(x)25、或(xi)26个核苷酸的靶向结构域;以及c)(i)近端和尾结构域(当连在一起时)包含至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域和近端结构域,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸);(ii)在第二互补结构域的最后一个核苷酸的3'处有至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌grna的对应序列,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸);(iii)在第二互补结构域(其与第一互补结构域的其对应核苷酸互补)的最后一个核苷酸的3’处有至少16、19、21、26、31、32、36、41、46、50、51或54个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌grna的对应序列,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少16、19、21、26、31、32、36、41、46、50、51或54个核苷酸);(iv)尾结构域的长度为至少10、15、20、25、30、35或40个核苷酸(例如,其包含来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少10、15、20、25、30、35或40个核苷酸);或(v)尾结构域包含天然存在的尾结构域(例如天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域)的对应位置的15、20、25、30、35、40个核苷酸或所有核苷酸。在一个实施例中,配置grna使得其包含以下特性:a和b(i)。在一个实施例中,配置grna使得其包含以下特性:a和b(ii)。在一个实施例中,配置grna使得其包含以下特性:a和b(iii)。在一个实施例中,配置grna使得其包含以下特性:a和b(iv)。在一个实施例中,配置grna使得其包含以下特性:a和b(v)。在一个实施例中,配置grna使得其包含以下特性:a和b(vi)。在一个实施例中,配置grna使得其包含以下特性:a和b(vii)。在一个实施例中,配置grna使得其包含以下特性:a和b(viii)。在一个实施例中,配置grna使得其包含以下特性:a和b(ix)。在一个实施例中,配置grna使得其包含以下特性:a和b(x)。在一个实施例中,配置grna使得其包含以下特性:a和b(xi)。在一个实施例中,配置grna使得其包含以下特性:a和c。在一个实施例中,配置grna使得其包含以下特性:a、b、和c。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(i)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(i)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(ii)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(ii)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(iii)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(iii)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(iv)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(iv)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(v)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(v)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(vi)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(vi)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(vii)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(vii)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(viii)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(viii)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(ix)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(ix)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(x)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(x)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(xi)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(xi)、和c(ii)。在一个实施例中,配置grna(例如嵌合grna)使得其包含以下特性中的一种或多种;a)例如当靶向产生单链断裂的cas9分子时,一种或两种grna可以将单链断裂定位(i)在靶位置的50、100、150、200、250、300、350、400、450或500个核苷酸内,或(ii)足够接近使靶位置在末端切除区内;b)一种或两种grna具有至少16个核苷酸的靶向结构域,例如(i)16、(ii)17、(iii)18、(iv)19、(v)20、(vi)21、(vii)22、(viii)23、(ix)24、(x)25、或(xi)26个核苷酸的靶向结构域;以及c)(i)近端和尾结构域(当连在一起时)包含至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域和近端结构域,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸);(ii)在第二互补结构域的最后一个核苷酸的3'处有至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌grna的对应序列,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸);(iii)在第二互补结构域(其与第一互补结构域的其对应核苷酸互补)的最后一个核苷酸的3’处有至少16、19、21、26、31、32、36、41、46、50、51或54个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌grna的对应序列,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少16、19、21、26、31、32、36、41、46、50、51或54个核苷酸);(iv)尾结构域的长度为至少10、15、20、25、30、35或40个核苷酸(例如,其包含来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少10、15、20、25、30、35或40个核苷酸);或(v)尾结构域包含天然存在的尾结构域(例如天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域)的对应位置的15、20、25、30、35、40个核苷酸或所有核苷酸。在一个实施例中,配置grna使得其包含以下特性:a和b(i)。在一个实施例中,配置grna使得其包含以下特性:a和b(ii)。在一个实施例中,配置grna使得其包含以下特性:a和b(iii)。在一个实施例中,配置grna使得其包含以下特性:a和b(iv)。在一个实施例中,配置grna使得其包含以下特性:a和b(v)。在一个实施例中,配置grna使得其包含以下特性:a和b(vi)。在一个实施例中,配置grna使得其包含以下特性:a和b(vii)。在一个实施例中,配置grna使得其包含以下特性:a和b(viii)。在一个实施例中,配置grna使得其包含以下特性:a和b(ix)。在一个实施例中,配置grna使得其包含以下特性:a和b(x)。在一个实施例中,配置grna使得其包含以下特性:a和b(xi)。在一个实施例中,配置grna使得其包含以下特性:a和c。在一个实施例中,配置grna使得其包含以下特性:a、b、和c。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(i)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(i)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(ii)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(ii)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(iii)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(iii)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(iv)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(iv)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(v)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(v)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(vi)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(vi)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(vii)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(vii)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(viii)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(viii)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(ix)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(ix)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(x)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(x)、和c(ii)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(xi)、和c(i)。在一个实施例中,配置grna使得其包含以下特性:a(i)、b(xi)、和c(ii)。在一个实施例中,grna与具有hnh活性的cas9切口酶分子(例如,ruvc活性失活的cas9分子,例如在d10处具有突变(例如d10a突变)的cas9分子)一起使用。在一个实施例中,grna与具有ruvc活性的cas9切口酶分子(例如,hnh活性失活的cas9分子,例如在h840处具有突变(例如h840a)的cas9分子)一起使用。在一个实施例中,配置包含第一和第二grna的一对grna(例如一对嵌合grna)使得其包含以下特性中的一种或多种;a)例如当靶向产生单链断裂的cas9分子时,一种或两种grna可以将单链断裂定位(i)在靶位置的50、100、150、200、250、300、350、400、450或500个核苷酸内,或(ii)足够接近使靶位置在末端切除区内;b)一种或两种grna具有至少16个核苷酸的靶向结构域,例如(i)16、(ii)17、(iii)18、(iv)19、(v)20、(vi)21、(vii)22、(viii)23、(ix)24、(x)25、或(xi)26个核苷酸的靶向结构域;c)对于一种或两种grna:(i)近端和尾结构域(当连在一起时)包含至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域和近端结构域,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸);(ii)在第二互补结构域的最后一个核苷酸的3'处有至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌grna的对应序列,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少15、18、20、25、30、31、35、40、45、49、50或53个核苷酸);(iii)在第二互补结构域(其与第一互补结构域的其对应核苷酸互补)的最后一个核苷酸的3’处有至少16、19、21、26、31、32、36、41、46、50、51或54个核苷酸(例如来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌grna的对应序列,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少16、19、21、26、31、32、36、41、46、50、51或54个核苷酸);(iv)尾结构域的长度为至少10、15、20、25、30、35或40个核苷酸(例如,其包含来自天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域,或与其相差不超过1、2、3、4、5、6、7、8、9或10个核苷酸的序列的至少10、15、20、25、30、35或40个核苷酸);或(v)尾结构域包含天然存在的尾结构域(例如天然存在的化脓性链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟菌尾结构域)的对应位置的15、20、25、30、35、40个核苷酸或所有核苷酸;d)配置grna使得当与靶核酸杂交时,它们被0-50、0-100、0-200、至少10、至少20、至少30或至少50个核苷酸分开;e)第一grna和第二grna产生的断裂位于不同的链上;以及f)pam面向外。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(iii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(iv)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(v)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(vi)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(vii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(viii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(ix)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(x)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和b(xi)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a和c。在一个实施例中,配置一种或两种grna使得其包含以下特性:a、b、和c。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(i)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(i)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(i)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(i)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(i)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ii)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ii)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ii)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ii)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ii)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iii)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iii)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iii)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iii)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iii)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iv)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iv)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iv)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iv)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(iv)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(v)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(v)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(v)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(v)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(v)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vi)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vi)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vi)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vi)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vi)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vii)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vii)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vii)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vii)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(vii)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(viii)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(viii)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(viii)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(viii)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(viii)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ix)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ix)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ix)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ix)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(ix)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(x)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(x)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(x)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(x)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(x)、c、d、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(xi)、和c(i)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(xi)、和c(ii)。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(xi)、c、和d。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(xi)、c、和e。在一个实施例中,配置一种或两种grna使得其包含以下特性:a(i)、b(xi)、c、d、和e。在一个实施例中,grna与具有hnh活性的cas9切口酶分子(例如,ruvc活性失活的cas9分子,例如在d10处具有突变(例如d10a突变)的cas9分子)一起使用。在一个实施例中,grna与具有ruvc活性的cas9切口酶分子(例如,hnh活性失活的cas9分子,例如在h840处具有突变(例如h840a)的cas9分子)一起使用。在一个实施例中,grna与具有ruvc活性的cas9切口酶分子(例如,hnh活性失活的cas9分子,例如在n863处具有突变(例如n863a)的cas9分子)一起使用。(1)用于基因编辑的剂的功能分析cas9分子、grna分子、cas9分子/grna分子复合物中的任一种可通过本领域已知的方法或如本文所述的进行评估。例如,用于评估cas9分子的内切核酸酶活性的示例性方法描述于例如jinek等人,science[科学]2012,337(6096):816-821中。(a)结合和切割测定:测试cas9分子的内切核酸酶活性可以在质粒切割测定中评估cas9分子/grna分子复合物结合并切割靶核酸的能力。在此测定中,合成或体外转录的grna分子在反应之前通过加热至95℃并缓慢冷却至室温而预退火。在37℃下,将天然或限制性消化-线性化的质粒dna(300ng(约8nm))与纯化的cas9蛋白分子(50-500nm)和grna(50-500nm,1:1)在含或不含10mmmgcl2的cas9质粒切割缓冲液(20mmhepesph7.5、150mmkcl、0.5mmdtt、0.1mmedta)中孵育60min。将反应用5xdna加样缓冲液(30%甘油、1.2%sds、250mmedta)终止,通过0.8%或1%琼脂糖凝胶电泳分离,并通过溴化乙锭染色可视化。所得切割产物指示cas9分子是切割两条dna链还是仅切割两条链中的一条。例如,线性dna产物指示两条dna链的切割。带有切口的打开的圆形产物指示两条链中只有一条被切割。可替代地,可以在寡核苷酸dna切割测定中评估cas9分子/grna分子复合物结合并切割靶核酸的能力。在此测定中,在37℃下,在50μl反应中,通过与5单位t4多核苷酸激酶和约3-6pmol(约20-40mci)[γ-32p]-atp在1xt4多核苷酸激酶反应缓冲液中孵育30min,将dna寡核苷酸(10pmol)放射性标记。在热灭活后(65℃持续20min),通过柱将反应纯化以除去未掺入的标记。通过将标记的寡核苷酸与等摩尔量的未标记的互补寡核苷酸在95℃下退火3min,然后缓慢冷却至室温,生成双链底物(100nm)。对于切割测定,通过加热至95℃持续30s,然后缓慢冷却至室温来退火grna分子。在9μl的总体积中,将cas9(500nm终浓度)与退火的grna分子(500nm)在切割测定缓冲液(20mmhepesph7.5、100mmkcl、5mmmgcl2、1mmdtt、5%甘油)中预孵育。将反应通过添加1μl靶dna(10nm)引发,并在37℃下孵育1h。将反应通过添加20μl加样染料(5mmedta、0.025%sds、甲酰胺中的5%甘油)淬灭,并加热至95℃持续5min。将切割产物在含有7m尿素的12%变性聚丙烯酰胺凝胶上分离,并通过磷光成像可视化。所得切割产物指示互补链、非互补链还是两者被切割。这些测定中的一种或两种可用于评估所提供的任何grna分子或cas9分子的适合性。(b)结合测定:测试cas9分子与靶dna的结合用于评估cas9分子与靶dna结合的示例性方法描述于例如jinek等人,science[科学]2012;337(6096):816-821中。例如,在电泳迁移率变动测定中,通过将每条链(10nmol)在去离子水中混合、加热至95℃持续3min并缓慢冷却至室温来形成靶dna双链体。所有dna均在含有1xtbe的8%天然凝胶上纯化。将dna条带通过uv遮蔽来可视化,切除,并通过在depc处理的h2o中浸泡凝胶块来洗脱。将洗脱的dna用乙醇沉淀并溶于depc处理的h2o中。在37℃下,使用t4多核苷酸激酶,用[γ-32p]-atp将dna样品5’末端标记30min。将多核苷酸激酶在65℃下热变性20min,并使用柱除去未掺入的放射性标记。在10μl的总体积中,结合测定在含有20mmhepesph7.5、100mmkcl、5mmmgcl2、1mmdtt和10%甘油的缓冲液中进行。将cas9蛋白分子用等摩尔量的预退火的grna分子编程,并从100pm至1μm滴定。添加放射性标记的dna至终浓度为20pm。将样品在37℃下孵育1h,并在含有1xtbe和5mmmgcl2的8%天然聚丙烯酰胺凝胶上于4℃下分离。将凝胶干燥并通过磷光成像使dna可视化。(c)用于测量cas9/grna复合物的热稳定性的技术cas9-grna核糖核蛋白(rnp)复合物的热稳定性可通过差示扫描荧光分析法(dsf)和其他技术检测。蛋白质的热稳定性可以在有利条件下(例如添加结合rna分子,例如grna)增加。因此,关于cas9/grna复合物的热稳定性的信息可用于确定复合物是否稳定。(d)差示扫描荧光分析法(dsf)cas9-grna核糖核蛋白(rnp)复合物的热稳定性可通过dsf测量。如下所述,rnp复合物包括一连串核糖核苷酸(例如rna或grna)和蛋白质(例如cas9蛋白或其变体)。此技术测量蛋白质的热稳定性,热稳定性可以在有利条件下(例如添加结合rna分子,例如grna)增加。该测定能以多种方式应用。示例性方案包括但不限于确定rnp形成的所希望的溶液条件的方案(测定1,见下文)、测试grna:cas9蛋白的所希望的化学计量比的方案(测定2,见下文)、筛选cas9分子(例如野生型或突变型cas9分子)的有效grna分子的方案(测定3,见下文)、以及在靶dna的存在下检查rnp形成的方案(测定4)。在一些实施例中,使用两种不同方案(一种用于测试grna:cas9蛋白的最佳化学计量比,另一种用于确定rnp形成的最佳溶液条件)进行测定。为了确定形成rnp复合物的最佳溶液,将在水+10xsypro中的2umcas9的溶液(生命技术公司(lifetechnologies)目录号s-6650)分配到384孔板中。然后添加在具有不同ph和盐的溶液中稀释的等摩尔量的grna。在室温下孵育10’并短暂离心以去除任何气泡后,使用具有bio-radcfxmanager软件的bio-radcfx384tm实时系统c1000touchtm热循环仪运行从20℃至90℃的梯度,温度每10秒上升1°。第二测定包括将各种浓度的grna与来自上述测定1的最佳缓冲液中的2umcas9混合,并在rt下在384孔板中孵育10'。添加等体积的最佳缓冲液+10xsypro(生命技术公司目录号s-6650),并用b黏合剂(msb-1001)密封板。在短暂离心以去除任何气泡后,使用具有bio-radcfxmanager软件的bio-radcfx384tm实时系统c1000touchtm热循环仪运行从20℃至90℃的梯度,温度每10秒上升1°。在第三测定中,纯化目的cas9分子(例如cas9蛋白,例如cas9变体蛋白)。将变体grna分子文库合成并重悬浮至20μm的浓度。在5xsypro(生命技术公司目录号s-6650)的存在下,将cas9分子与grna分子一起在预定缓冲液中以各自1μm的终浓度孵育。在室温下孵育10分钟并以2000rpm离心2分钟以除去任何气泡后,使用具有bio-radcfxmanager软件的bio-radcfx384tm实时系统c1000touchtm热循环仪运行从20℃至90℃的梯度,温度每10秒上升1℃。在第四测定中,使用以下样品进行dsf实验:单独的cas9蛋白、cas9蛋白与grna、cas9蛋白与grna和靶dna、以及cas9蛋白与靶dna。混合组分的顺序是:反应溶液、cas9蛋白、grna、dna和syproorange。在不存在或存在mgcl2的情况下,反应溶液含有10mmhepesph7.5、100mmnacl。在以2000rpm离心2分钟以去除任何气泡后,使用具有bio-radcfxmanager软件的bio-radcfx384tm实时系统c1000touchtm热循环仪运行从20℃至90℃的梯度,温度每10秒上升1°。5.靶细胞cas9分子和grna分子(例如cas9分子/grna分子复合物)可用于在多种细胞中操纵细胞,例如以编辑靶核酸。在一个实施例中,例如如本文所述的,通过编辑一种或多种靶基因(例如,在其中诱导突变)来操纵细胞。在一些实施例中,调节一种或多种靶基因(例如,fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因)的表达。在另一个实施例中,通过编辑一种或多种靶基因(例如,在其中诱导突变)和/或调节一种或多种靶基因(例如,fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因)的表达来离体操纵细胞,并将其给予受试者。用于离体操纵的靶细胞的来源可以包括例如受试者的血液、受试者的脐带血或受试者的骨髓。用于离体操纵的靶细胞的来源还可以包括例如异源供体血液、脐带血或骨髓。可将本文所述的cas9和grna分子递送至靶细胞。在一个实施例中,靶细胞是t细胞(例如cd8+t细胞(例如,cd8+原初t细胞、中枢记忆t细胞或效应记忆t细胞)、cd4+t细胞、自然杀伤t细胞(nkt细胞)、调节性t细胞(treg)、干细胞记忆t细胞)、淋巴祖细胞、造血干细胞、自然杀伤细胞(nk细胞)或树突细胞。在一个实施例中,靶细胞是诱导多能干(ips)细胞或衍生自ips细胞的细胞(例如,生成自受试者的ips细胞),该细胞被操纵以改变一种或多种靶基因(例如在其中诱导突变)或操纵一种或多种靶基因(例如,fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因)的表达,并分化成例如t细胞(例如cd8+t细胞(例如cd8+原初t细胞、中枢记忆t细胞或效应记忆t细胞)、cd4+t细胞、干细胞记忆t细胞)、淋巴祖细胞或造血干细胞)。在一个实施例中,靶细胞已经改变以含有特定t细胞受体(tcr)基因(例如,trac和trbc基因)。在另一个实施例中,tcr对肿瘤相关抗原(例如癌胚抗原(cea)、gp100、由t细胞1识别的黑色素瘤抗原(mart1)、黑色素瘤抗原a3(magea3)、nyeso1或p53)具有结合特异性。在一个实施例中,靶细胞已经改变以含有特异性嵌合抗原受体(car)。在一个实施例中,car对肿瘤相关抗原(例如cd19、cd20、碳酸酐酶ix(caix)、cd171、cea、erbb2、gd2、α-叶酸受体、lewisy抗原、前列腺特异性膜抗原(psma)或肿瘤相关糖蛋白72(tag72))具有结合特异性。在另一个实施例中,靶细胞已经改变以(例如通过tcr或car)结合以下肿瘤抗原中的一种或多种。肿瘤抗原可以包括但不限于ad034、akt1、brap、cage、cdx2、clp、ct-7、ct8/hom-tes-85、ctage-1、腓骨蛋白-1、hage、hca587/mage-c2、hcap-g、hce661、her2/neu、hla-cw、hom-hd-21/半乳凝素9、hom-meel-40/ssx2、hom-rcc-3.1.3/caxii、hoxa7、hoxb6、hu、hub1、km-hn-3、km-kn-1、koc1、koc2、koc3、koc3、lage-1、mage-1、mage-4a、mpp11、msln、nnp-1、ny-br-1、ny-br-62、ny-br-85、ny-co-37、ny-co-38、ny-eso-1、ny-eso-5、ny-lu-12、ny-ren-10、ny-ren-19/lkb/stk11、ny-ren-21、ny-ren-26/bcr、ny-ren-3/ny-co-38、ny-ren-33/snc6、ny-ren-43、ny-ren-65、ny-ren-9、ny-sar-35、ogfr、plu-1、rab38、rbpjκ、rhamm、scp1、scp-1、ssx3、ssx4、ssx5、top2a、top2b、或酪氨酸酶。a)将组分离体递送至靶细胞的方法可以使用多种递送方法和配制品以多种形式将组分(例如cas9分子和grna分子)引入靶细胞中,参见例如表6和7。当cas9或grna组分被编码为用于递送的dna时,该dna典型地但不一定包括控制区(例如包含启动子)以实现表达。cas9分子序列的有用启动子包括例如cmv、ef-1a、efs、mscv、pgk、或cag启动子。grna的有用启动子包括例如h1、ef-1a、trna或u6启动子。可以选择具有相似或不相似强度的启动子来调整组分的表达。编码cas9分子的序列可以包含核定位信号(nls),例如sv40nls。在一个实施例中,cas9分子或grna分子的启动子可以独立地是诱导型的、组织特异性的或细胞特异性的。在一些实施例中,将能够诱导遗传破坏的剂引入rnp复合物中。rnp复合物包括一连串核糖核苷酸(例如rna或grna分子)和蛋白质(例如cas9蛋白或其变体)。在一些实施例中,cas9蛋白作为核糖核蛋白(rnp)复合物(其包含本文提供的cas9蛋白和本文提供的grna分子,例如靶向pdcd1的grna)递送。在一些实施例中,将包括靶向pdcd1的一种或多种grna分子(例如如所述的任何grna分子)以及cas9酶或其变体的rnp经由物理递送(例如,电穿孔、粒子枪、磷酸钙转染、细胞压缩或挤压)、脂质体或纳米颗粒直接引入细胞中。在特定实施例中,将包括靶向pdcd1的一种或多种grna分子以及cas9酶或其变体的rnp经由电穿孔引入。表6提供了可以将组分递送至靶细胞的形式的实例。表6.表7总结了cas系统的组分(例如,如本文所述的cas9分子组分和grna分子组分)的各种递送方法。表7(1)cas9分子和/或grna分子的基于dna的递送编码cas9分子(例如,eacas9分子)和/或grna分子的dna可以通过本领域已知的方法或如本文所述的递送至细胞中。例如,编码cas9的和/或编码grna的dna可以例如通过载体(例如,病毒或非病毒载体)、基于非载体的方法(例如,使用裸dna或dna复合物)或其组合递送。在一些实施例中,编码cas9的和/或grna的dna通过载体(例如,病毒载体/病毒或质粒)递送。载体可以包含编码cas9分子和/或grna分子的序列。载体还可以包含编码与例如cas9分子序列融合的信号肽的序列(例如,用于核定位、核仁定位、线粒体定位)。例如,载体可以包含与编码cas9分子的序列融合的核定位序列(例如,来自sv40)。载体中可以包括一个或多个调节/控制元件,例如启动子、增强子、内含子、多聚腺苷酸化信号、kozak共有序列、内部核糖体进入位点(ires)、2a序列和剪接受体或供体。在一个实施例中,启动子被rna聚合酶ii识别(例如,cmv启动子)。在另一个实施例中,启动子被rna聚合酶iii识别(例如,u6启动子)。在另一个实施例中,启动子是调节型启动子(例如,诱导型启动子)。在另一个实施例中,启动子是组成型启动子。在另一个实施例中,启动子是组织特异性启动子。在另一个实施例中,启动子是病毒启动子。在另一个实施例中,启动子是非病毒启动子。在一个实施例中,载体或递送运载体是病毒载体(例如,用于生成重组病毒)。在一个实施例中,病毒是dna病毒(例如,dsdna或ssdna病毒)。在一个实施例中,病毒是rna病毒(例如,ssrna病毒)。示例性病毒载体/病毒包括例如逆转录病毒、慢病毒、腺病毒、腺相关病毒(aav)、痘苗病毒、痘病毒和单纯疱疹病毒。在一个实施例中,病毒感染分裂细胞。在另一个实施例中,病毒感染非分裂细胞。在另一个实施例中,病毒感染分裂细胞和非分裂细胞两者。在另一个实施例中,病毒可以整合到宿主基因组中。在另一个实施例中,将病毒工程化以(例如在人体内)具有降低的免疫力。在另一个实施例中,病毒具有复制能力。在另一个实施例中,病毒是复制缺陷型的,例如另外轮的病毒粒子复制和/或包装所必需的基因的一个或多个编码区被其他基因替代或缺失。在另一个实施例中,病毒引起cas9分子和/或grna分子的短暂表达。在另一个实施例中,病毒引起cas9分子和/或grna分子的持久(例如,至少1周、2周、1个月、2个月、3个月、6个月、9个月、1年、2年或永久)表达。病毒的包装容量可以变化,例如从至少约4kb到至少约30kb,例如,至少约5kb、10kb、15kb、20kb、25kb、30kb、35kb、40kb、45kb、或50kb。在一个实施例中,编码cas9和/或grna的dna通过重组逆转录病毒递送。在另一个实施例中,逆转录病毒(例如,莫洛尼鼠白血病病毒)包含例如允许整合到宿主基因组中的逆转录酶。在一个实施例中,逆转录病毒具有复制能力。在另一个实施例中,逆转录病毒是复制缺陷型的,例如另外轮的病毒粒子复制和包装所必需的基因的一个或多个编码区被其他基因替代或缺失。在一个实施例中,编码cas9和/或grna的dna通过重组慢病毒递送。例如,慢病毒是复制缺陷型的,例如不包含病毒复制所需的一种或多种基因。在一个实施例中,编码cas9和/或grna的dna通过重组腺病毒递送。在另一个实施例中,将腺病毒工程化以在人体内具有降低的免疫力。在一个实施例中,编码cas9和/或grna的dna通过重组aav递送。在一个实施例中,aav可以将其基因组并入到宿主细胞(例如,如本文所述的靶细胞)的基因组中。在另一个实施例中,aav是自身互补的腺相关病毒(scaav),例如包装一起退火以形成双链dna的两条链的scaav。可以在所披露的方法中使用的aav血清型包括aav1、aav2、修饰的aav2(例如,在y444f、y500f、y730f和/或s662v处的修饰)、aav3、修饰的aav3(例如,在y705f、y731f和/或t492v处的修饰)、aav4、aav5、aav6、修饰的aav6(例如,在s663v和/或t492v处的修饰)、aav8、aav8.2、aav9、aavrhl0,并且假型aav(例如aav2/8、aav2/5和aav2/6))也可以用于所披露的方法中。在一个实施例中,编码cas9和/或grna的dna通过杂合病毒(例如本文所述的一种或多种病毒的杂合体)递送。包装细胞用于形成能够感染靶细胞的病毒颗粒。这种细胞包括可以包装腺病毒的293细胞、以及可以包装逆转录病毒的ψ2细胞或pa317细胞。用于基因疗法的病毒载体通常由将核酸载体包装到病毒颗粒中的生产细胞系生成。载体典型地含有包装并随后整合到宿主或靶细胞(如果适用)中所需的最小病毒序列,并且其他病毒序列被编码有待表达的蛋白质(例如cas9)的表达盒替代。例如,用于基因疗法的aav载体典型地仅具有来自aav基因组的反向末端重复序列(itr)序列,其是宿主或靶细胞中包装和基因表达所必需的。失去的病毒功能是由包装细胞系反向供应的。此后,病毒dna被包装在细胞系中,该细胞系含有编码其他aav基因即rep和cap但缺乏itr序列的辅助质粒。该细胞系还感染作为辅助物的腺病毒。辅助病毒促进aav载体复制和来自辅助质粒的aav基因表达。辅助质粒由于缺乏itr序列而未大量包装。腺病毒的污染可以通过例如进行腺病毒比aav更敏感的热处理来减少。在一个实施例中,病毒载体具有细胞类型识别的能力。例如,病毒载体可以用不同的/替代的病毒包膜糖蛋白假型化;用细胞类型特异性受体工程化(例如,病毒包膜糖蛋白的遗传修饰以掺入靶向配体,例如肽配体、单链抗体、生长因子);和/或工程化以具有分子桥,该分子桥具有双重特异性,其一端识别病毒糖蛋白,并且另一端识别靶细胞表面的部分(例如,配体-受体、单克隆抗体、抗生物素蛋白-生物素和化学缀合)。在一个实施例中,病毒载体实现细胞类型特异性表达。例如,可以构建组织特异性启动子以限制转基因(cas9和grna)仅在特定靶细胞中表达。载体的特异性还可以通过转基因表达的微小rna依赖性控制来介导。在一个实施例中,病毒载体具有病毒载体和靶细胞膜的增加的融合效率。例如,可掺入融合蛋白(例如有融合能力的血凝素(ha))以增加病毒摄取到细胞中。在一个实施例中,病毒载体具有核定位的能力。例如,可以改变需要核膜分解(在细胞分裂期间)并因此不会感染非分裂细胞的病毒,以在病毒的基质蛋白中掺入核定位肽,从而使得能够转导非增殖细胞。在一个实施例中,编码cas9和/或grna的dna通过基于非载体的方法(例如,使用裸dna或dna复合物)来递送。例如,dna可以例如通过有机改性的二氧化硅或硅酸盐(ormosil)、电穿孔、短暂细胞压缩或挤压(例如,如lee等人[2012]nanolett[纳米快报]12:6322-27所述)、基因枪、声孔、磁转染、脂质介导的转染、树枝状大分子、无机纳米颗粒、磷酸钙或其组合来递送。在一个实施例中,经由电穿孔的递送包括将细胞与编码cas9和/或grna的dna在盒、室或比色皿中混合,并施加具有限定的持续时间和振幅的一个或多个电脉冲。在一个实施例中,经由电穿孔的递送是使用如下系统进行的,在其中细胞与编码cas9和/或grna的dna在连接至装置(例如泵)的容器中混合,该装置将混合物进料到盒、室或比色皿,其中施加具有限定的持续时间和振幅的一个或多个电脉冲,这之后将细胞递送至第二容器。在一个实施例中,编码cas9和/或grna的dna通过基于载体和非载体的方法的组合来递送。例如,病毒体包含与灭活病毒(例如,hiv或流感病毒)组合的脂质体,其可导致比单独的病毒或脂质体方法更有效的基因转移。在一个实施例中,递送运载体是非病毒运载体。在一个实施例中,非病毒载体是无机纳米颗粒。示例性无机纳米颗粒包括例如磁性纳米颗粒(例如,fe3mno2)和二氧化硅。纳米颗粒的外表面可以与带正电荷的聚合物(例如,聚乙烯亚胺、聚赖氨酸、聚丝氨酸)缀合,其允许有效负载的附着(例如,缀合或截留)。在一个实施例中,非病毒载体是有机纳米颗粒。示例性有机纳米颗粒包括例如snalp脂质体,其含有阳离子脂质和包被有聚乙二醇(peg)的中性辅助脂质、以及包被有脂质的鱼精蛋白-核酸复合物。用于基因转移的示例性脂质如下表8所示。表8.用于基因转移的脂质用于基因转移的示例性聚合物如下表9所示。表9.用于基因转移的聚合物在一个实施例中,运载体具有靶向修饰以增加纳米颗粒和脂质体(例如细胞特异性抗原、单克隆抗体、单链抗体、适配体、聚合物、糖和细胞穿透肽)的靶细胞摄取。在一个实施例中,运载体使用促融合肽/聚合物和内体去稳定肽/聚合物。在一个实施例中,运载体经历酸触发的构象变化(例如,以加速货物(cargo)的内体逃逸)。在一个实施例中,使用刺激可切割的聚合物,例如用于在细胞区室中释放。例如,可以使用在还原性细胞环境中切割的基于二硫化物的阳离子聚合物。在一个实施例中,递送运载体是生物非病毒递送运载体。在一个实施例中,运载体是减毒细菌(例如,天然或人工工程化为侵入性但减毒以预防发病机理和表达转基因(例如,产单核细胞李斯特菌、某些沙门氏菌属(salmonella)菌株,长双歧杆菌和修饰的大肠杆菌(escherichiacoli))、具有营养和组织特异性向性以靶向特定细胞的细菌、具有修饰的表面蛋白以改变靶细胞特异性的细菌)。在一个实施例中,运载体是遗传修饰的噬菌体(例如,具有大包装容量、较低免疫原性、含有哺乳动物质粒维持序列并掺入有靶向配体的工程化噬菌体)。在一个实施例中,运载体是哺乳动物病毒样颗粒。例如,可以生成(例如,通过纯化“空”颗粒,然后用所希望的货物离体组装病毒)修饰的病毒颗粒。还可以将运载体工程化以掺入靶向配体来改变靶组织特异性。在一个实施例中,运载体是生物脂质体。例如,生物脂质体是衍生自人细胞的基于磷脂的颗粒(例如,红细胞血影,其是源自受试者的分解成球形结构的红细胞(例如,组织靶向可以通过附着各种组织或细胞特异性配体实现)、或分泌外排体——内吞起源的受试者衍生的膜结合纳米颗粒(30-100nm)(例如,可以从各种细胞类型产生,并且因此可以被细胞摄取而不需要靶向配体)。在一个实施例中,递送除cas系统的组分(例如本文所述的cas9分子组分和/或grna分子组分)之外的一种或多种核酸分子(例如,dna分子)。在一个实施例中,核酸分子与cas系统的一种或多种组分同时递送。在一个实施例中,核酸分子在递送cas系统的一种或多种组分之前或之后(例如,少于约30分钟、1小时、2小时、3小时、6小时、9小时、12小时、1天、2天、3天、1周、2周或4周)进行递送。在一个实施例中,核酸分子通过与递送cas系统的一种或多种组分(例如cas9分子组分和/或grna分子组分)不同的方式进行递送。核酸分子可以通过本文所述的任何递送方法来递送。例如,核酸分子可以通过病毒载体(例如逆转录病毒或慢病毒)递送,并且cas9分子组分和/或grna分子组分可以通过电穿孔递送。在一个实施例中,核酸分子编码trac基因、trbc基因或car基因。(2)编码cas9分子的rna的递送编码cas9分子(例如,eacas9分子、eicas9分子或eicas9融合蛋白)和/或grna分子的rna可通过本领域已知的方法或如本文所述的递送至细胞,例如本文所述的靶细胞。例如,可以例如通过显微注射、电穿孔、短暂细胞压缩或挤压(例如,如lee等人[2012]nanolett[纳米快报]12:6322-27所述)、脂质介导的转染、肽介导的递送或其组合来递送编码cas9的和/或编码grna的rna。在一个实施例中,经由电穿孔的递送包括将细胞与编码cas9分子(例如,eacas9分子、eicas9分子或eicas9融合蛋白)和/或grna分子的rna在盒、室或比色皿中混合,并施加具有限定的持续时间和振幅的一个或多个电脉冲。在一个实施例中,经由电穿孔的递送是使用如下系统进行的,在其中细胞与编码cas9分子(例如,eacas9分子、eicas9分子或eicas9融合蛋白)和/或grna分子的rna在连接至装置(例如泵)的容器中混合,该装置将混合物进料到盒、室或比色皿,其中施加具有限定的持续时间和振幅的一个或多个电脉冲,这之后将细胞递送至第二容器。(3)cas9蛋白和核糖核蛋白(rnp)的递送cas9分子(例如,eacas9分子、eicas9分子或eicas9融合蛋白)可以通过本领域已知的方法或如本文所述的递送至细胞中。例如,可以例如通过显微注射、电穿孔、短暂细胞压缩或挤压(例如,如lee等人[2012]nanolett[纳米快报]12:6322-27所述)、脂质介导的转染、肽介导的递送或其组合来递送cas9蛋白分子。递送可以伴随编码grna的dna或伴随grna。在一些实施例中,cas9蛋白作为核糖核蛋白(rnp)复合物(其包含本文提供的cas9蛋白和本文提供的grna分子,例如靶向pdcd1的grna)递送。在一些实施例中,rnp复合物包括一连串核糖核苷酸(例如rna或grna分子)和蛋白质(例如cas9蛋白或其变体)。在一些实施例中,将包括靶向pdcd1的一种或多种grna分子(例如如所述的任何grna分子)以及cas9酶或其变体的rnp经由物理递送(例如,电穿孔、粒子枪、磷酸钙转染、细胞压缩或挤压)、脂质体或纳米颗粒直接引入细胞中。在特定实施例中,将包括靶向pdcd1的一种或多种grna分子(例如如所述的任何grna分子)以及cas9酶或其变体的rnp经由电穿孔引入。在一个实施例中,经由电穿孔的递送包括将细胞与cas9分子(例如,eacas9分子、eicas9分子或eicas9融合蛋白)(与或不与grna分子)在盒、室或比色皿中混合,并施加具有限定的持续时间和振幅的一个或多个电脉冲。在一个实施例中,经由电穿孔的递送是使用如下系统进行的,在其中细胞与cas9分子(例如,eacas9分子、eicas9分子或eicas9融合蛋白)(与或不与grna分子)在连接至装置(例如泵)的容器中混合,该装置将混合物进料到盒、室或比色皿,其中施加具有限定的持续时间和振幅的一个或多个电脉冲,这之后将细胞递送至第二容器。6.修饰的核苷、核苷酸和核酸修饰的核苷和修饰的核苷酸可以存在于核酸(例如特别是grna)中,但也可以存在于其他形式的rna(例如mrna、rnai或sirna)中。如本文所述的,“核苷”定义为含有五碳糖分子(戊糖或核糖)或其衍生物、以及有机碱(嘌呤或嘧啶)或其衍生物的化合物。如本文所述的,“核苷酸”定义为进一步包含磷酸酯基团的核苷。修饰的核苷和核苷酸可以包括以下中的一种或多种:(i)磷酸二酯主链连接中一个或两个非连接磷酸氧和/或一个或多个连接磷酸氧的改变(例如,替代);(ii)核糖的成分(例如核糖上的2'羟基)的改变(例如替代);(iii)用“去磷酸”接头批量替代磷酸酯部分;(iv)天然存在的核碱基的修饰或替代;(v)核糖-磷酸酯主链的替代或修饰;(vi)寡核苷酸的3'末端或5'末端的修饰,例如末端磷酸酯基团的去除、修饰或替代,或部分的缀合;以及(vii)糖的修饰。可以组合上文列出的修饰以提供可以具有两种、三种、四种或更多种修饰的修饰的核苷和核苷酸。例如,修饰的核苷或核苷酸可以具有修饰的糖和修饰的核碱基。在一个实施例中,grna的每个碱基被修饰,例如所有碱基都具有修饰的磷酸酯基团,例如所有碱基都是硫代磷酸酯基团。在一个实施例中,单分子或模块化grna分子的全部或基本上全部的磷酸酯基团被硫代磷酸酯基团替代。在一个实施例中,修饰的核苷酸(例如具有如本文所述的修饰的核苷酸)可以掺入核酸(例如“修饰的核酸”)中。在一些实施例中,修饰的核酸包含一个、两个、三个或更多个修饰的核苷酸。在一些实施例中,修饰的核酸中至少5%(例如,至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、或约100%)的位置是修饰的核苷酸。未修饰的核酸可能易于被例如细胞核酸酶降解。例如,核酸酶可以水解核酸磷酸二酯键。因此,在一个方面中,本文所述的修饰的核酸可以含有一个或多个修饰的核苷或核苷酸,例如以引入针对核酸酶的稳定性。a)磷酸酯主链修饰(1)磷酸酯基团在一些实施例中,修饰的核苷酸的磷酸酯基团可以通过用不同的取代基替代一个或多个氧来修饰。此外,修饰的核苷酸(例如存在于修饰的核酸中的修饰的核苷酸)可以包括用如本文所述的修饰的磷酸酯批量替代未修饰的磷酸酯部分。在一些实施例中,磷酸酯主链的修饰可以包括导致不带电荷的接头或具有不对称电荷分布的带电荷的接头的改变。修饰的磷酸酯基团的实例包括硫代磷酸酯、硒代磷酸酯(phosphoroselenate)、硼酸磷酸酯(boranophosphate)、硼酸磷酸酯(boranophosphateester)、氢膦酸酯、氨基磷酸酯、烷基或芳基膦酸酯以及磷酸三酯。在一些实施例中,磷酸酯主链部分中的非桥接磷酸氧原子之一可以被以下任何基团替代:硫(s)、硒(se)、br3(其中r可以是例如氢、烷基或芳基)、c(例如,烷基基团、芳基基团等)、h、nr2(其中r可以是例如氢、烷基或芳基)、或or(其中r可以是例如烷基或芳基)。未修饰的磷酸酯基团中的磷原子是非手性的。然而,用一个上述原子或原子团替代一个非桥接氧可以使磷原子成为手性的;也就是说,以这种方式修饰的磷酸酯基团中的磷原子是立构中心。立构磷原子可以具有“r”构型(本文中为rp)或“s”构型(本文中为sp)。二硫代磷酸酯的两个非桥接氧被硫替代。二硫代磷酸酯中的磷中心是非手性的,其排除了寡核糖核苷酸非对映异构体的形成。在一些实施例中,对一个或两个非桥接氧的修饰还可以包括用独立地选自s、se、b、c、h、n、和or(r可以是例如烷基或芳基)的基团替代非桥接氧。磷酸酯接头也可以通过用氮(桥接的氨基磷酸酯)、硫(桥接的硫代磷酸酯)和碳(桥接的亚甲基膦酸酯)来替代桥接氧(即,连接磷酸酯与核苷的氧)来修饰。替代可以在任一连接氧或两个连接氧处发生。(2)磷酸酯基团的替代磷酸酯基团可以用不含磷的连接剂替代。在一些实施例中,带电荷的磷酸酯基团可以被中性部分替代。可以替代磷酸酯基团的部分的实例可以包括但不限于例如甲基膦酸酯、羟基氨基、硅氧烷、碳酸酯、羧基甲基、氨基甲酸酯、酰胺、硫醚、环氧乙烷接头、磺酸酯、磺酰胺、硫代甲缩醛、甲缩醛、肟、亚甲基亚氨基、亚甲基甲基亚氨基、亚甲基肼基、亚甲基二甲基肼基和亚甲氧基甲基亚氨基。(3)核糖磷酸酯主链的替代还可以构建可以模拟核酸的支架,其中磷酸酯接头和核糖被核酸酶抗性核苷或核苷酸替代物替代。在一些实施例中,核碱基可以被替代主链拴系。实例可以包括但不限于吗啉代、环丁基、吡咯烷和肽核酸(pna)核苷替代物。b)糖修饰修饰的核苷和修饰的核苷酸可以包括对糖基的一种或多种修饰。例如,2'羟基基团(oh)可以被许多不同的“氧基”或“脱氧”取代基修饰或替代。在一些实施例中,对2'羟基基团的修饰可以增强核酸的稳定性,因为羟基不再能被去质子化以形成2'-醇盐离子。2'-醇盐可以通过对接头磷原子的分子内亲核攻击来催化降解。“氧基”-2'羟基基团修饰的实例可以包括烷氧基或芳氧基(or,其中“r”可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(peg);o(ch2ch2o)nch2ch2or,其中r可以是例如h或任选取代的烷基,并且n可以是从0至20(例如,从0至4、从0至8、从0至10、从0至16、从1至4、从1至8、从1至10、从1至16、从1至20、从2至4、从2至8、从2至10、从2至16、从2至20、从4至8、从4至10、从4至16和从4至20)的整数。在一些实施例中,“氧基”-2'羟基基团修饰可以包括“锁”核酸(lna),其中2'羟基可例如通过c1-6亚烷基或c1-6亚杂烷基桥连接至同一核糖的4'碳上,其中示例性桥可以包括亚甲基、亚丙基、醚或氨基桥;o-氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺或聚氨基)和氨基烷氧基、o(ch2)n-氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺或聚氨基)。在一些实施例中,“氧基”-2'羟基基团修饰可以包括甲氧基乙基基团(moe)、(och2ch2och3,例如peg衍生物)。“脱氧”修饰可以包括氢(即脱氧核糖,例如在部分dsrna的突出端部分);卤素(例如,溴、氯、氟或碘);氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基、二杂芳基氨基或氨基酸);nh(ch2ch2nh)nch2ch2-氨基(其中氨基可以是例如如本文所述的)、-nhc(o)r(其中r可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖)、氰基;巯基;烷基-硫代-烷基;硫代烷氧基;以及烷基、环烷基、芳基、烯基和炔基,其可任选地被例如如本文所述的氨基取代。糖基还可以含有立体化学构型与核糖中对应碳的立体化学构型相反的一个或多个碳。因此,修饰的核酸可以包括含有例如阿拉伯糖作为糖的核苷酸。核苷酸“单体”可以在糖的1'位处具有α键,例如α-核苷。修饰的核酸还可以包括“无碱基”糖,其在c-1’处缺乏核碱基。这些无碱基糖也可以在一个或多个组成糖原子处被进一步修饰。修饰的核酸还可以包括呈l形式的一种或多种糖,例如l-核苷。通常,rna包括糖基核糖,其是具有氧的5元环。示例性修饰的核苷和修饰的核苷酸可以包括但不限于核糖中的氧的替代(例如用硫(s)、硒(se)或亚烷基(例如像亚甲基或亚乙基));双键的添加(例如,以用环戊烯基或环己烯基替代核糖);核糖的环收缩(例如,以形成环丁烷或氧杂环丁烷的4元环);核糖的环扩展(例如,以形成具有另外的碳或杂原子的6元环或7元环,像例如脱水己糖醇、阿卓糖醇、甘露醇、环己基、环己烯基和吗啉代,其还具有氨基磷酸酯主链)。在一些实施例中,修饰的核苷酸可以包括多环形式(例如,三环;和“解锁”形式,例如二醇核酸(gna)(例如,r-gna或s-gna,其中核糖被附接到磷酸二酯键的二醇单元替代)、苏糖核酸(tna,其中核糖被α-l-苏式呋喃糖基-(3’→2’)替代)。c)对核碱基的修饰可以掺入修饰的核酸中的本文所述的修饰的核苷和修饰的核苷酸可以包括修饰的核碱基。核碱基的实例包括但不限于腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)和尿嘧啶(u)。可以修饰或完全替代这些核碱基以提供可以掺入修饰的核酸中的修饰的核苷和修饰的核苷酸。核苷酸的核碱基可以独立地选自嘌呤、嘧啶、嘌呤或嘧啶类似物。在一些实施例中,核碱基可以包括例如碱基的天然存在的和合成的衍生物。(1)尿嘧啶在一些实施例中,修饰的核碱基是修饰的尿嘧啶。具有修饰的尿嘧啶的示例性核碱基和核苷包括但不限于假尿苷(ψ)、吡啶-4-酮核糖核苷、5-氮杂-尿苷、6-氮杂-尿苷、2-硫代-5-氮杂-尿苷、2-硫代-尿苷(s2u)、4-硫代-尿苷(s4u)、4-硫代-假尿苷、2-硫代-假尿苷、5-羟基-尿苷(ho5u)、5-氨基烯丙基-尿苷、5-卤代-尿苷(例如,5-碘-尿苷或5-溴-尿苷)、3-甲基-尿苷(m3u)、5-甲氧基-尿苷(mo5u)、尿苷5-羟乙酸(cmo5u)、尿苷5-羟乙酸甲酯(mcmo5u)、5-羧基甲基-尿苷(cm5u)、1-羧基甲基-假尿苷、5-羧基羟基甲基-尿苷(chm5u)、5-羧基羟基甲基-尿苷甲酯(mchm5u)、5-甲氧基羰基甲基-尿苷(mcm5u)、5-甲氧基羰基甲基-2-硫代-尿苷(mcm5s2u)、5-氨基甲基-2-硫代-尿苷(nm5s2u)、5-甲基氨基甲基-尿苷(mnm5u)、5-甲基氨基甲基-2-硫代-尿苷(mnm5s2u)、5-甲基氨基甲基-2-硒基-尿苷(mnm5se2u)、5-氨基甲酰基甲基-尿苷(ncm5u)、5-羧基甲基氨基甲基-尿苷(cmnm5u)、5-羧基甲基氨基甲基-2-硫代-尿苷(cmnm5s2u)、5-丙炔基-尿苷、1-丙炔基-假尿苷、5-牛磺酸甲基(taurinomethyl)-尿苷(τcm5u)、1-牛磺酸甲基-假尿苷、5-牛磺酸甲基-2-硫代-尿苷(τm5s2u)、1-牛磺酸甲基-4-硫代-假尿苷、5-甲基-尿苷(m5u,即具有核碱基脱氧胸腺嘧啶)、1-甲基-假尿苷(m1ψ)、5-甲基-2-硫代-尿苷(m5s2u)、1-甲基-4-硫代-假尿苷(m1s4ψ)、4-硫代-1-甲基-假尿苷、3-甲基-假尿苷(m3ψ)、2-硫代-1-甲基-假尿苷、1-甲基-1-脱氮-假尿苷、2-硫代-1-甲基-1-脱氮-假尿苷、二氢尿苷(d)、二氢假尿苷、5,6-二氢尿苷、5-甲基-二氢尿苷(m5d)、2-硫代-二氢尿苷、2-硫代-二氢假尿苷、2-甲氧基-尿苷、2-甲氧基-4-硫代-尿苷、4-甲氧基-假尿苷、4-甲氧基-2-硫代-假尿苷、n1-甲基-假尿苷、3-(3-氨基-3-羧基丙基)尿苷(acp3u)、1-甲基-3-(3-氨基-3-羧基丙基)假尿苷(acp3ψ)、5-(异戊烯基氨基甲基)尿苷(inm5u)、5-(异戊烯基氨基甲基)-2-硫代-尿苷(inm5s2u)、α-硫代-尿苷、2'-o-甲基-尿苷(um)、5,2'-o-二甲基-尿苷(m5um)、2'-o-甲基-假尿苷(ψm)、2-硫代-2'-o-甲基-尿苷(s2um)、5-甲氧基羰基甲基-2'-o-甲基-尿苷(mcm5um)、5-氨基甲酰基甲基-2'-o-甲基-尿苷(ncm5um)、5-羧基甲基氨基甲基-2'-o-甲基-尿苷(cmnm5um)、3,2'-o-二甲基-尿苷(m3um)、5-(异戊烯基氨基甲基)-2'-o-甲基-尿苷(inm5um)、1-硫代-尿苷、脱氧胸苷、2'-f-阿糖-尿苷、2'-f-尿苷、2'-oh-阿糖-尿苷、5-(2-甲酯基乙烯基)尿苷、5-[3-(1-e-丙烯基氨基)尿苷、吡唑并[3,4-d]嘧啶、黄嘌呤、和次黄嘌呤。(2)胞嘧啶在一些实施例中,修饰的核碱基是修饰的胞嘧啶。具有修饰的胞嘧啶的示例性核碱基和核苷包括但不限于5-氮杂-胞苷、6-氮杂-胞苷、假异胞苷、3-甲基-胞苷(m3c)、n4-乙酰基-胞苷(act)、5-甲酰基-胞苷(f5c)、n4-甲基-胞苷(m4c)、5-甲基-胞苷(m5c)、5-卤代-胞苷(例如,5-碘-胞苷)、5-羟基甲基-胞苷(hm5c)、1-甲基-假异胞苷、吡咯并-胞苷、吡咯并-假异胞苷、2-硫代-胞苷(s2c)、2-硫代-5-甲基-胞苷、4-硫代-假异胞苷、4-硫代-1-甲基-假异胞苷、4-硫代-1-甲基-1-脱氮-假异胞苷、1-甲基-1-脱氮-假异胞苷、泽布拉恩(zebularine)、5-氮杂-泽布拉恩、5-甲基-泽布拉恩、5-氮杂-2-硫代-泽布拉恩、2-硫代-泽布拉恩、2-甲氧基-胞苷、2-甲氧基-5-甲基-胞苷、4-甲氧基-假异胞苷、4-甲氧基-1-甲基-假异胞苷、赖胞苷(k2c)、α-硫代-胞苷、2'-o-甲基-胞苷(cm)、5,2'-o-二甲基-胞苷(m5cm)、n4-乙酰基-2'-o-甲基-胞苷(ac4cm)、n4,2'-o-二甲基-胞苷(m4cm)、5-甲酰基-2'-o-甲基-胞苷(f5cm)、n4,n4,2'-o-三甲基-胞苷(m42cm)、1-硫代-胞苷、2'-f-阿糖-胞苷、2'-f-胞苷、和2'-oh-阿糖-胞苷。(3)腺嘌呤在一些实施例中,修饰的核碱基是修饰的腺嘌呤。具有修饰的腺嘌呤的示例性核碱基和核苷包括但不限于2-氨基-嘌呤、2,6-二氨基嘌呤、2-氨基-6-卤代-嘌呤(例如,2-氨基-6-氯-嘌呤)、6-卤代-嘌呤(例如,6-氯-嘌呤)、2-氨基-6-甲基-嘌呤、8-叠氮基-腺苷、7-脱氮-腺苷、7-脱氮-8-氮杂-腺苷、7-脱氮-2-氨基-嘌呤、7-脱氮-8-氮杂-2-氨基-嘌呤、7-脱氮-2,6-二氨基嘌呤、7-脱氮-8-氮杂-2,6-二氨基嘌呤、1-甲基-腺苷(m1a)、2-甲基-腺苷(m2a)、n6-甲基-腺苷(m6a)、2-甲基硫代-n6-甲基-腺苷(ms2m6a)、n6-异戊烯基-腺苷(i6a)、2-甲基硫代-n6-异戊烯基-腺苷(ms2i6a)、n6-(顺式-羟基异戊烯基)腺苷(io6a)、2-甲基硫代-n6-(顺式-羟基异戊烯基)腺苷(ms2io6a)、n6-甘氨酰基氨基甲酰基-腺苷(g6a)、n6-苏氨酰基氨基甲酰基-腺苷(t6a)、n6-甲基-n6-苏氨酰基氨基甲酰基-腺苷(m6t6a)、2-甲基硫代-n6-苏氨酰基氨基甲酰基-腺苷(ms2g6a)、n6,n6-二甲基-腺苷(m62a)、n6-羟基正缬氨酰基氨基甲酰基-腺苷(hn6a)、2-甲基硫代-n6-羟基正缬氨酰基氨基甲酰基-腺苷(ms2hn6a)、n6-乙酰基-腺苷(ac6a)、7-甲基-腺苷、2-甲基硫代-腺苷、2-甲氧基-腺苷、α-硫代-腺苷、2'-o-甲基-腺苷(am)、n6,2'-o-二甲基-腺苷(m6am)、n6-甲基-2'-脱氧腺苷、n6,n6,2'-o-三甲基-腺苷(m62am)、1,2'-o-二甲基-腺苷(m1am)、2'-o-核糖基腺苷(磷酸盐)(ar(p))、2-氨基-n6-甲基-嘌呤、1-硫代-腺苷、8-叠氮基-腺苷、2'-f-阿糖-腺苷、2'-f-腺苷、2'-oh-阿糖-腺苷、和n6-(19-氨基-五氧杂十九烷基)-腺苷。(4)鸟嘌呤在一些实施例中,修饰的核碱基是修饰的鸟嘌呤。具有修饰的鸟嘌呤的示例性核碱基和核苷包括但不限于肌苷(i)、1-甲基-肌苷(m1i)、怀俄苷(img)、甲基怀俄苷(mimg)、4-脱甲基-怀俄苷(img-14)、异怀俄苷(img2)、怀丁苷(yw)、过氧怀丁苷(o2yw)、羟基怀丁苷(ohyw)、未修饰的羟基怀丁苷(ohyw*)、7-脱氮-鸟苷、辫苷(q)、环氧辫苷(oq)、半乳糖基-辫苷(galq)、甘露糖基-辫苷(manq)、7-氰基-7-脱氮-鸟苷(preq0)、7-氨基甲基-7-脱氮-鸟苷(preq1)、古嘌苷(g+)、7-脱氮-8-氮杂-鸟苷、6-硫代-鸟苷、6-硫代-7-脱氮-鸟苷、6-硫代-7-脱氮-8-氮杂-鸟苷、7-甲基-鸟苷(m7g)、6-硫代-7-甲基-鸟苷、7-甲基-肌苷、6-甲氧基-鸟苷、1-甲基-鸟苷(m'g)、n2-甲基-鸟苷(m2g)、n2,n2-二甲基-鸟苷(m22g)、n2,7-二甲基-鸟苷(m2,7g)、n2,n2,7-二甲基-鸟苷(m2,2,7g)、8-氧代-鸟苷、7-甲基-8-氧代-鸟苷、1-甲基-6-硫代-鸟苷、n2-甲基-6-硫代-鸟苷、n2,n2-二甲基-6-硫代-鸟苷、α-硫代-鸟苷、2'-o-甲基-鸟苷(gm)、n2-甲基-2'-o-甲基-鸟苷(m2gm)、n2,n2-二甲基-2'-o-甲基-鸟苷(m22gm)、1-甲基-2'-o-甲基-鸟苷(m'gm)、n2,7-二甲基-2'-o-甲基-鸟苷(m2,7gm)、2'-o-甲基-肌苷(im)、1,2'-o-二甲基-肌苷(m'im)、o6-苯基-2’-脱氧肌苷、2'-o-核糖基鸟苷(磷酸盐)(gr(p))、1-硫代-鸟苷、o6-甲基-鸟苷、o6-甲基-2’-脱氧鸟苷、2'-f-阿糖-鸟苷、和2'-f-鸟苷。d)示例性修饰的grna在一些实施例中,修饰的核酸可以是修饰的grna。应理解的是,本文所述的任何grna可根据本章节进行修饰。如本文所讨论的,短暂表达或递送的核酸可能易于被例如细胞核酸酶降解。因此,在一个方面中,本文所述的修饰的grna可以含有一个或多个修饰的核苷或核苷酸,其引入针对核酸酶的稳定性。尽管不希望受理论束缚,但据信本文所述的这些和其他修饰的grna对某些细胞类型(例如循环细胞,如t细胞)表现出增强的稳定性,并且这可能是观察到的改善的原因。例如,如本文所讨论的,当通过包含真核mrna帽结构或帽类似物修饰grna的5'末端时,我们已经看到在某些细胞类型(例如,t细胞)中基因的离体编辑方面的改善。本发明涵盖这样的认识,即用5'封端的grna观察到的改善可以扩展到已经以其他方式修饰以实现相同类型的结构或功能结果的grna(例如,通过包含修饰的核苷或核苷酸,或者当通过用磷酸酶(例如小牛肠碱性磷酸酶)处理来修饰体外转录的grna以除去5'三磷酸酯基团时)。虽然不希望受理论束缚,但在一些实施例中,本文所述的修饰的grna可以含有一种或多种修饰(例如,修饰的核苷或核苷酸),其引入针对核酸酶的稳定性(例如,通过包含修饰的核苷或核苷酸和/或3'聚a尾)。因此,在一个方面中,本文讨论的方法和组合物提供了用于通过使用在其5'末端或附近(例如,在其5'末端的1-10、1-5或1-2个核苷酸内)修饰的grna进行某些细胞的基因编辑(例如,离体基因编辑)的方法和组合物。在一些实施例中,grna分子的5'末端缺乏5'三磷酸酯基团。在一些实施例中,靶向结构域的5'末端缺乏5'三磷酸酯基团。在一些实施例中,grna分子的5'末端包括5'帽。在一些实施例中,靶向结构域的5'末端包括5'帽。在一些实施例中,grna分子缺乏5'三磷酸酯基团。在一些实施例中,grna分子包含靶向结构域,并且该靶向结构域的5'末端缺乏5'三磷酸酯基团。在一些实施例中,grna分子包括5'帽。在一些实施例中,grna分子包含靶向结构域,并且该靶向结构域的5'末端包括5'帽。在一个实施例中,通过包含真核mrna帽结构或帽类似物(例如,但不限于g(5’)ppp(5’)g帽类似物、m7g(5’)ppp(5’)g帽类似物或3’-o-me-m7g(5’)ppp(5’)g抗反转帽类似物(arca))来修饰grna的5'末端。在某些实施例中,5'帽包含修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5'-5'三磷酸酯键与grna分子的剩余部分连接。在一些实施例中,5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由5'-5'三磷酸酯键连接。在一些实施例中,grna分子的5'末端具有以下化学式:其中:b1和b1'各自独立地是每个r1独立地是c1-4烷基,其任选地被苯基或6元杂芳基取代;r2、r2'和r3'各自独立地是h、f、oh或o-c1-4烷基;x、y和z各自独立地是o或s;并且x'和y'各自独立地是o或ch2。在一个实施例中,每个r1独立地是-ch3、-ch2ch3或-ch2c6h5。在一个实施例中,r1是-ch3。在一个实施例中,b1'是在一个实施例中,r2、r2'和r3'各自独立地是h、oh或o-ch3。在一个实施例中,x、y和z各自是o。在一个实施例中,x'和y'是o。在一个实施例中,grna分子的5'末端具有以下化学式:在一个实施例中,grna分子的5'末端具有以下化学式:在一个实施例中,grna分子的5'末端具有以下化学式:在一个实施例中,grna分子的5'末端具有以下化学式:在一个实施例中,x是s,并且y和z是o。在一个实施例中,y是s,并且x和z是o。在一个实施例中,z是s,并且x和y是o。在一个实施例中,硫代磷酸酯是sp非对映异构体。在一个实施例中,x'是ch2,并且y'是o。在一个实施例中,x'是o,并且y'是ch2。在一个实施例中,5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'四磷酸酯键连接。在一个实施例中,grna分子的5'末端具有以下化学式:其中:b1和b1'各自独立地是每个r1独立地是c1-4烷基,其任选地被苯基或6元杂芳基取代;r2、r2'和r3'各自独立地是h、f、oh或o-c1-4烷基;w、x、y和z各自独立地是o或s;并且x'、y'和z'各自独立地是o或ch2。在一个实施例中,每个r1独立地是-ch3、-ch2ch3或-ch2c6h5。在一个实施例中,r1是-ch3。在一个实施例中,b1'是在一个实施例中,r2、r2'和r3'各自独立地是h、oh或o-ch3。在一个实施例中,w、x、y和z各自是o。在一个实施例中,x'、y'和z'各自是o。在一个实施例中,x'是ch2,并且y'和z'是o。在一个实施例中,y'是ch2,并且x'和z'是o。在一个实施例中,z'是ch2,并且x'和y'是o。在一个实施例中,5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'五磷酸酯键连接。在一个实施例中,grna分子的5'末端具有以下化学式:其中:b1和b1'各自独立地是每个r1独立地是c1-4烷基,其任选地被苯基或6元杂芳基取代;r2、r2'和r3'各自独立地是h、f、oh或o-c1-4烷基;v、w、x、y和z各自独立地是o或s;并且w'、x'、y'和z'各自独立地是o或ch2。在一个实施例中,每个r1独立地是-ch3、-ch2ch3或-ch2c6h5。在一个实施例中,r1是-ch3。在一个实施例中,b1'是在一个实施例中,r2、r2'和r3'各自独立地是h、oh或o-ch3。在一个实施例中,v、w、x、y和z各自是o。在一个实施例中,w'、x'、y'和z'各自是o。应理解的是,如本文所用的,术语“5'帽”涵盖传统的mrna5'帽结构,但也涵盖这些的类似物。例如,除了上文所示的化学结构所涵盖的5'帽结构之外,可以使用例如具有亚甲基-双(膦酸酯)部分的四磷酸酯类似物(例如,参见rydzik,am等人,(2009)orgbiomolchem[有机与生物分子化学]7(22):4763-76)、具有硫取代非桥氧的类似物(例如,参见grudzien-nogalska,e.等人,(2007)rna13(10):1745-1755)、n7-苄基化二核苷四磷酸酯类似物(例如,参见grudzien,e.等人,(2004)rna10(9):1479-1487)、或抗反转帽类似物(例如,参见美国专利号7,074,596以及jemielity,j.等人,(2003)rna9(9):1108-1122和stepinski,j.等人,(2001)rna7(10):1486-1495)。本申请还涵盖使用具有卤素基团代替oh或ome的帽类似物(例如,参见美国专利号8,304,529);具有至少一个硫代磷酸酯(ps)键的帽类似物(例如,参见美国专利号8,153,773和kowalska,j.等人,(2008)rna14(6):1119-1131);和具有至少一个硼酸磷酸酯(boranophosphate)或硒代磷酸酯(phosphoroselenoate)键的帽类似物(例如,参见美国专利号8,519,110);以及炔基衍生的5'帽类似物(例如,参见美国专利号8,969,545)。通常,5'帽可以在grna的化学合成或体外转录期间包括在内。在一个实施例中,不使用5'帽,而是通过用磷酸酶(例如,小牛肠碱性磷酸酶)处理来修饰grna(例如,体外转录的grna)以去除5'三磷酸酯基团。本文讨论的方法和组合物还提供了用于通过使用包含3'聚a尾的grna进行基因编辑的方法和组合物。例如,可以通过在体外转录grna分子前体后使用聚腺苷聚合酶将聚a尾添加至grna分子前体来制备此类grna。例如,在一个实施例中,可以使用聚合酶(例如大肠杆菌聚a聚合酶(e-pap))酶促地添加聚a尾。包括聚a尾的grna也可以通过体外转录从dna模板制备。在一个实施例中,将限定长度的聚a尾在dna模板上编码,并经由rna聚合酶(例如t7rna聚合酶)用grna转录。具有聚a尾的grna也可以通过在具有或不具有与grna分子前体和聚a寡核苷酸互补的夹板dna寡核苷酸的存在下,使用rna连接酶或dna连接酶进行体外转录后连接聚a寡核苷酸与grna分子前体来制备。例如,在一个实施例中,将限定长度的聚a尾合成为合成的寡核苷酸,并在具有或不具有与指导rna和聚a寡核苷酸互补的夹板dna寡核苷酸的存在下用rna连接酶或dna连接酶连接在grna的3'末端。包括聚a尾的grna也可以合成地制备为一个或若干个片段,其在具有或不具有一个或多个夹板dna寡核苷酸的存在下通过rna连接酶或dna连接酶连接在一起。在一些实施例中,聚a尾由少于50个腺嘌呤核苷酸(例如少于45个腺嘌呤核苷酸、少于40个腺嘌呤核苷酸、少于35个腺嘌呤核苷酸、少于30个腺嘌呤核苷酸、少于25个腺嘌呤核苷酸或少于20个腺嘌呤核苷酸)组成。在一些实施例中,聚a尾由在5与50个之间的腺嘌呤核苷酸(例如在5与40个之间的腺嘌呤核苷酸、在5与30个之间的腺嘌呤核苷酸、在10与50个之间的腺嘌呤核苷酸、或在15与25个之间的腺嘌呤核苷酸)组成。在一些实施例中,聚a尾由约20个腺嘌呤核苷酸组成。本文讨论的方法和组合物还提供了用于通过使用包括本文所述的一个或多个修饰的核苷或核苷酸的grna进行基因编辑(例如,离体基因编辑)的方法和组合物。虽然本章节中讨论的一些示例性修饰可以包括在grna序列内的任何位置,但是在一些实施例中,grna包含在其5'末端或附近(例如,其5'末端的1-10、1-5或1-2个核苷酸内)的修饰。在一些实施例中,grna在其3'末端或附近(例如,在其3'末端的1-10、1-5或1-2个核苷酸内)包含修饰。在一些实施例中,grna包含在其5'末端或附近的修饰和在其3'末端或附近的修饰两者。例如,在一些实施例中,grna分子(例如,体外转录的grna)包含与来自真核细胞中表达的基因的靶向结构域互补的靶向结构域,其中grna分子在其5'末端被修饰并且包含3'聚a尾。例如,grna分子可以缺乏5'三磷酸酯基团(例如,靶向结构域的5'末端缺乏5'三磷酸酯基团)。在一个实施例中,通过用磷酸酶(例如,小牛肠碱性磷酸酶)处理来修饰grna(例如,体外转录的grna)以去除5'三磷酸酯基团并且包含如本文所述的3'聚a尾。可替代地,grna分子可以包括5'帽(例如,靶向结构域的5'末端包括5'帽)。在一个实施例中,grna(例如,体外转录的grna)含有如本文所述的5'帽结构(或帽类似物)和3'聚a尾两者。在一些实施例中,5'帽包含修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5'-5'三磷酸酯键与grna分子的剩余部分连接。在一些实施例中,5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接(例如如上所述的)。在一些实施例中,聚a尾由在5与50个之间的腺嘌呤核苷酸(例如在5与40个之间的腺嘌呤核苷酸、在5与30个之间的腺嘌呤核苷酸、在10与50个之间的腺嘌呤核苷酸、在15与25个之间的腺嘌呤核苷酸、少于30个腺嘌呤核苷酸、少于25个腺嘌呤核苷酸或约20个腺嘌呤核苷酸)组成。在又其他实施例中,本发明提供了包含靶向结构域的grna分子,该靶向结构域与在真核细胞中表达的基因的靶结构域互补,其中该grna分子包含由少于30个腺嘌呤核苷酸(例如,少于25个腺嘌呤核苷酸、在15与25个之间的腺嘌呤核苷酸、或约20个腺嘌呤核苷酸)组成的3'聚a尾。在一些实施例中,这些grna分子在其5'末端被进一步修饰(例如,将grna分子通过用磷酸酶处理来修饰以除去5'三磷酸酯基团或修饰为包括如本文所述的5'帽)。在一些实施例中,可以在3'末端u核糖处修饰grna。在一些实施例中,修饰grna的5'末端和3'末端u核糖(例如,将grna通过用磷酸酶处理来修饰以除去5'三磷酸酯基团或修饰为包括如本文所述的5'帽)。例如,u核糖的两个末端羟基基团可被氧化成醛基并伴随核糖环的打开以提供如下所示的修饰的核苷:其中“u”可以是未修饰的或修饰的尿苷。在另一个实施例中,3'末端u可以用如下所示的2’3’环状磷酸酯修饰:其中“u”可以是未修饰的或修饰的尿苷。在一些实施例中,grna分子可以含有3'核苷酸,其可以例如通过掺入本文所述的一个或多个修饰的核苷酸来稳定化以对抗降解。在此实施例中,例如尿嘧啶可以用修饰的尿嘧啶(例如5-(2-氨基)丙基尿苷和5-溴尿苷,或用本文所述的任何修饰的尿苷)替代;腺苷和鸟嘌呤可以用修饰的腺苷和鸟苷(例如在8位处具有修饰,例如8-溴鸟苷,或本文所述的任何修饰的腺苷或鸟苷)替代。在一些实施例中,grna包含在其5'末端或附近的修饰和在其3'末端或附近的修饰两者。在一个实施例中,体外转录的grna含有5'帽结构(或帽类似物)和3'聚a尾两者。在一个实施例中,通过用磷酸酶(例如,小牛肠碱性磷酸酶)处理来修饰体外转录的grna以去除5'三磷酸酯基团并且包含3'聚a尾。虽然前述内容集中于末端修饰,但应理解的是本文所讨论的方法和组合物可以使用在grna序列内的一个或多个非末端位置和/或一个或多个末端位置处包括一个或多个修饰的核苷或核苷酸的grna。在一些实施例中,糖修饰的核糖核苷酸可以掺入grna中,例如其中2'oh-基团被如下基团替代,该基团选自h、-or、-r(其中r可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖)、卤素、-sh、-sr(其中r可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖)、氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基、二杂芳基氨基或氨基酸);或氰基(-cn)。在一些实施例中,磷酸酯主链可以如本文所述的(例如用硫代磷酸酯基团)进行修饰。在一些实施例中,grna的一个或多个核苷酸可各自独立地是修饰或未修饰的核苷酸,包括但不限于2'-糖修饰的,例如2'-o-甲基、2'-o-甲氧基乙基,或2'-氟修饰的,包括例如2'-f或2'-o-甲基腺苷(a)、2'-f或2'-o-甲基胞苷(c)、2'-f或2'-o-甲基尿苷(u)、2'-f或2'-o-甲基胸苷(t)、2'-f或2'-o-甲基鸟苷(g)、2'-o-甲氧基乙基-5-甲基尿苷(teo)、2'-o-甲氧基乙基腺苷(aeo)、2'-o-甲氧基乙基-5-甲基胞苷(m5ceo)、及其任何组合。在一些实施例中,grna可以包括“锁”核酸(lna),其中2'oh-基团可以例如通过c1-6亚烷基或c1-6亚杂烷基桥连接至同一核糖的4'-碳上,其中示例性桥可以包括亚甲基、亚丙基、醚或氨基桥;o-氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺或聚氨基)和氨基烷氧基或o(ch2)n-氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺或聚氨基)。在一些实施例中,grna可以包括修饰的核苷酸,其是多环的(例如,三环;和“解锁”形式,例如二醇核酸(gna)(例如,r-gna或s-gna,其中核糖被附接到磷酸二酯键的二醇单元替代)、或苏糖核酸(tna,其中核糖被α-l-苏式呋喃糖基-(3’→2’)替代)。通常,grna分子包括糖基核糖,其是具有氧的5元环。示例性修饰的grna可以包括但不限于核糖中的氧的替代(例如用硫(s)、硒(se)或亚烷基(例如像亚甲基或亚乙基));双键的添加(例如,以用环戊烯基或环己烯基替代核糖);核糖的环收缩(例如,以形成环丁烷或氧杂环丁烷的4元环);核糖的环扩展(例如,以形成具有另外的碳或杂原子的6元环或7元环,像例如脱水己糖醇、阿卓糖醇、甘露醇、环己基、环己烯基和吗啉代,其还具有氨基磷酸酯主链)。尽管大多数糖类似物改变位于2'位,但其他位点也可以修饰,包括4'位。在一个实施例中,grna包含4'-s、4'-se或4'-c-氨基甲基-2'-o-me修饰。在一些实施例中,可以将脱氮核苷酸(例如7-脱氮-腺苷)掺入grna中。在一些实施例中,o-和n-烷基化核苷酸(例如n6-甲基腺苷)可以掺入grna中。在一些实施例中,grna分子中一个或多个或所有核苷酸是脱氧核苷酸。e)mirna结合位点微小rna(或mirna)是天然存在的细胞19-25个核苷酸长的非编码rna。它们与具有适当的mirna结合位点(例如在mrna的3'utr中)的核酸分子结合,并下调基因表达。尽管不希望受理论束缚,但据信下调是通过降低核酸分子稳定性或通过抑制翻译来实现的。本文披露的rna种类(例如编码cas9的mrna)可以包含mirna结合位点(例如在其3'utr中)。可以选择mirna结合位点以促进所选细胞类型中表达的下调。举例来说,mir-122(肝脏中丰富存在的微小rna)的结合位点的掺入可以抑制肝脏中目的基因的表达。d.统治型(governing)grna分子及其用于限制cas9系统活性的用途使用或包括编码cas9分子或grna分子的核酸(例如dna)的方法和组合物可另外使用或包括“统治型grna分子”。统治型grna可以限制引入细胞或受试者中的其他crispr/cas组分的活性。在一个实施例中,grna分子包含与核酸上的靶结构域互补的靶向结构域,该核酸包含编码引入细胞或受试者中的crispr/cas系统的组分的序列。在一个实施例中,统治型grna分子包含与如下核酸上的靶序列互补的靶向结构域:(a)编码cas9分子的核酸;(b)编码grna的核酸,该grna包含靶向fas、bid、ctla4、pdcd1、cblb、ptpn6、trac或trbc基因的靶向结构域(靶基因grna);或编码crispr/cas组分的多于一种的核酸,例如,(a)和(b)两者。统治型grna分子可以与cas9分子复合以使系统的组分失活。在一个实施例中,cas9分子/统治型grna分子复合物使包含编码cas9分子的序列的核酸失活。在一个实施例中,cas9分子/统治型grna分子复合物使包含编码靶基因grna分子的序列的核酸失活。在一个实施例中,cas9分子/统治型grna分子复合物对cas9分子/靶基因grna分子复合物的活性施加时间、表达水平或其他限制。在一个实施例中,cas9分子/统治型grna分子复合物降低脱靶或其他不需要的活性。在一个实施例中,统治型grna分子靶向编码序列或控制区(例如启动子)以使crispr/cas系统组分被负调控。例如,统治型grna可以靶向cas9分子的编码序列或调控cas9分子编码序列的表达的控制区(例如启动子)、或位于两者之间的序列。在一个实施例中,统治型grna分子靶向靶基因grna的编码序列或控制区(例如启动子)。在一个实施例中,统治型grna(例如靶向cas9或靶向靶基因grna的统治型grna分子)或编码其的核酸与cas9分子或编码其的核酸分开地(例如,稍后)引入。例如,第一载体(例如病毒载体,例如aav载体)可以引入编码cas9分子和一种或多种靶基因grna分子的核酸,并且第二载体(例如病毒载体,例如,aav载体)可以引入编码统治型grna分子(例如靶向cas9或靶向靶基因grna的grna分子)的核酸。在一个实施例中,可以在第一载体之后引入第二载体。在其他实施例中,可以将统治型grna分子(例如靶向cas9或靶向靶基因grna的统治型grna分子)或编码其的核酸与cas9分子或编码其的核酸一起(例如同时或在同一载体中)引入,但是例如在转录控制元件(例如启动子或增强子)下,这些转录控制元件(在稍后的时间被活化,例如使得在一段时间后cas9的转录降低。在一个实施例中,转录控制元件内在地被活化。在一个实施例中,经由引入外触发来活化转录元件。典型地,编码统治型grna分子(例如,靶向cas9的grna分子)的核酸序列与其负调节的组分(例如编码cas9分子的核酸)处于不同的控制区(例如启动子)的控制下。在一个实施例中,“不同的控制区”是指仅不处于在功能上与两个受控序列偶联的一个控制区(例如启动子)的控制下。在一个实施例中,不同是指在控制区的种类或类型方面的“不同控制区”。例如,编码统治型grna分子(例如,靶向cas9的grna分子)的序列处于控制区(例如启动子)的控制下,该控制区具有较低水平的表达,或在编码其负调节的组分(例如编码cas9分子的核酸)的序列后表达。举例来说,编码统治型grna分子(例如,靶向cas9的统治型grna分子)的序列可以处于本文所述的控制区(例如启动子)(例如人u6小核启动子、或人h1启动子)的控制下。在一个实施例中,编码其负调控的组分(例如编码cas9分子的核酸)的序列可以处于本文所述的控制区(例如,启动子)(例如cmv、ef-1a、mscv、pgk、cag控制启动子)的控制下。iii.组合物和配制品还提供了此类细胞的群体、含有此类细胞和/或针对此类细胞富集的组合物,例如其中表达重组受体的细胞构成在组合物中总细胞的至少50%、60%、70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多,或某些类型的细胞(例如t细胞或cd8+或cd4+细胞)。在这些组合物中有用于给予(例如用于过继细胞疗法)的药物组合物和配制品。还提供了用于将细胞和组合物给予受试者(例如患者)的治疗方法。还提供了用于给予的包括细胞的组合物,这些组合物包括药物组合物和配制品,例如单位剂型组合物(其包括以给定剂量或其分数给予的细胞数)。药物组合物和配制品通常包括一种或多种任选地药学上可接受的载体或赋形剂。在一些实施例中,组合物包括至少一种另外的治疗剂。术语“药物配制品”是指如下制剂,该制剂处于使得其中所含活性成分的生物活性有效的形式,并且不含对给予配制品的受试者具有不可接受的毒性的另外的组分。“药学上可接受的载体”是指药物配制品中除活性成分外的成分,其对受试者无毒。药学上可接受的载体包括但不限于缓冲液、赋形剂、稳定剂或防腐剂。在一些方面中,载体的选择部分地由特定细胞和/或由给予方法确定。因此,存在多种合适的配制品。例如,药物组合物可以含有防腐剂。合适的防腐剂可以包括例如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。在一些方面中,使用两种或更多种防腐剂的混合物。防腐剂或其混合物典型地以按总组合物的重量计约0.0001%至约2%的量存在。载体描述于例如remington'spharmaceuticalsciences[雷明顿药物科学]第16版,osol,a.编辑(1980)中。药学上可接受的载体在所用剂量和浓度下通常对接受者无毒,并且包括但不限于:缓冲液,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;六甲基氯化铵;苯扎氯铵;苄索氯铵;苯酚、丁基或苄醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)的多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯基吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖、或糊精;螯合剂,例如edta;糖类,例如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐抗衡离子,例如钠;金属复合物(如锌-蛋白质复合物);和/或非离子表面活性剂,例如聚乙二醇(peg)。在一些方面中,缓冲剂包括在组合物中。合适的缓冲剂包括例如柠檬酸、柠檬酸钠、磷酸、磷酸钾和各种其他酸和盐。在一些方面中,使用两种或更多种缓冲剂的混合物。缓冲剂或其混合物典型地以按总组合物的重量计约0.001%至约4%的量存在。用于制备可给予的药物组合物的方法是已知的。示例性方法在例如remington:thescienceandpracticeofpharmacy[雷明顿:药物科学与实践],lippincottwilliams&wilkins[利平科特·威廉斯·威尔金斯出版公司];第21版(2005年5月1日)中更详细地描述。配制品可以包括水溶液。配制品或组合物还可以含有可用于用细胞治疗的特定适应症、疾病或病症的多于一种的活性成分,优选具有与细胞互补活性的那些,其中各活性不会相互产生不利影响。此类活性成分合适地以对预期目的有效的量组合地存在。因此,在一些实施例中,药物组合物进一步包括其他药学活性剂或药物,例如化学治疗剂,例如天冬酰胺酶、白消安、卡铂、顺铂、柔红霉素、多柔比星、氟尿嘧啶、吉西他滨、羟基脲、甲氨蝶呤、紫杉醇、利妥昔单抗、长春花碱和/或长春新碱。在一些实施例中,药物组合物含有有效治疗或预防疾病或病症的量(例如治疗有效量或预防有效量)的细胞。在一些实施例中,通过定期评估治疗的受试者来监测治疗或预防功效。所希望的剂量可通过单次推注给予细胞、通过多次推注给予细胞、或通过连续输注给予细胞来递送。可以使用标准给予技术、配制品和/或装置来给予细胞和组合物。细胞的给予可以是自体的或异源的。例如,免疫应答细胞或祖细胞可以从一名受试者获得,并给予同一受试者或不同的相容受试者。外周血衍生的免疫应答细胞或其后代(例如,体内、离体或体外衍生的)可以经由局部注射(包括导管给予)、全身注射、局部注射、静脉内注射或肠胃外给予来给予。当给予治疗组合物(例如,含有遗传修饰的免疫应答细胞的药物组合物)时,通常将其配制成单位剂量可注射形式(溶液、悬浮液、乳液)。配制品包括用于口服、静脉内、腹膜内、皮下、经肺、透皮、肌内、鼻内、经颊、舌下或栓剂给予的那些。在一些实施例中,肠胃外给予细胞群体。如本文所用的术语“肠胃外”包括静脉内、肌内、皮下、直肠、阴道和腹膜内给予。在一些实施例中,使用通过静脉内、腹膜内或皮下注射的外周全身递送将细胞给予受试者。在一些实施例中,组合物作为无菌液体制剂(例如等渗水溶液、悬浮液、乳液、分散体或黏性组合物,其在一些方面中可以缓冲至所选ph)提供。液体制剂通常比凝胶、其他黏性组合物和固体组合物制备起来更容易。另外地,液体组合物稍微更方便给予,特别是通过注射。在另一方面,黏性组合物可以配制在适当的黏度范围内,以提供与特定组织的更长的接触时间。液体或黏性组合物可以包含载体,这些载体可以是溶剂或分散介质,其含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如甘油、丙二醇、液体聚乙二醇)及其合适的混合物。无菌可注射溶液可以通过将细胞掺入溶剂中来制备,例如与合适的载体、稀释剂或赋形剂(例如无菌水、生理盐水、葡萄糖、右旋糖等)混合。组合物可以含有辅助物质,例如润湿剂、分散剂或乳化剂(例如甲基纤维素)、ph缓冲剂、胶凝或黏度增强添加剂、防腐剂、调味剂和/或颜料,这取决于所希望的给予和制备的途径。在一些方面中,可以参考标准文本来制备合适的制剂。可以添加各种增强组合物稳定性和无菌性的添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂和缓冲液。通过各种抗细菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚和山梨酸)可以确保防止微生物的作用。通过使用延迟吸收的剂(例如单硬脂酸铝和明胶)可以实现可注射药物形式的延长吸收。用于体内给予的配制品通常是无菌的。例如,通过无菌过滤膜过滤可以容易地实现无菌。iv.给予方法和在过继细胞疗法中的用途提供了给予细胞、群体和组合物的方法,以及此类细胞、群体和组合物用于治疗或预防疾病、病症和障碍(包括癌症)的用途。在一些实施例中,将细胞、群体和组合物给予患有待治疗的特定疾病或病症的受试者或患者,例如经由过继细胞疗法,例如过继t细胞疗法。在一些实施例中,通过所提供的方法制备的细胞和组合物(例如在孵育和/或其他加工步骤后的工程化组合物和生产终止(end-of-production)组合物)被给予受试者,例如患有疾病或病症、或有患上该疾病或病症的风险的受试者。在一些方面中,这些方法由此治疗(例如改善)疾病或病症的一种或多种症状,例如通过减轻表达由工程化t细胞识别的抗原的癌症中的肿瘤负担。用于过继细胞疗法的细胞的给予方法是已知的,并且可以与所提供的方法和组合物一起使用。例如,过继t细胞疗法方法描述于例如gruenberg等人的美国专利申请公开号2003/0170238;rosenberg的美国专利号4,690,915;rosenberg(2011)natrevclinoncol.[自然评论临床肿瘤学]8(10):577-85)中。参见例如,themeli等人(2013)natbiotechnol.[自然生物技术]31(10):928-933;tsukahara等人(2013)biochembiophysrescommun[生物化学与生物物理学研究通讯]438(1):84-9;davila等人(2013)plosone[公共科学图书馆·综合]8(4):e61338。如本文所用的,“受试者”是哺乳动物,例如人或其他动物,并且典型地是人。在一些实施例中,给予细胞、细胞群体或组合物的受试者(例如,患者)是哺乳动物,典型地是灵长类动物,例如人。在一些实施例中,灵长类动物是猴或猿。受试者可以是雄性或雌性,并且可以处于任何合适的年龄,包括婴儿、幼年、青春期、成年和老年受试者。在一些实施例中,受试者是非灵长类哺乳动物,例如啮齿动物。如本文所用的,“治疗(treatment)”(及其语法变体,例如“治疗(treat或treating)”)是指疾病或病症或障碍,或与之相关的症状、不良反应或结果、或表型的完全或部分减轻或减少。所希望的治疗效果包括但不限于预防疾病的发生或复发、症状的缓和、疾病的任何直接或间接病理后果的减少、预防转移、降低疾病进展的速度、减轻或减缓疾病状态、以及缓解或改善预后。这些术语并不暗示完全治愈疾病或完全消除任何症状或对所有症状或结果的一种或多种影响。如本文所用的,“延迟疾病的发展”意指推迟、阻碍、减慢、延缓、稳定、阻抑和/或延期疾病(例如癌症)的发展。此延迟可以具有不同的时间长度,这取决于病史和/或所治疗的个体。对于本领域技术人员显而易见的是,足够或显著的延迟实际上可以涵盖预防,因为个体不会患上疾病。例如,可能延迟晚期癌症,例如转移的发展。如本文所用的,“预防”包括提供关于受试者中疾病的发生或复发的预防,该受试者可能易患该疾病但尚未被诊断患有该疾病。在一些实施例中,所提供的细胞和组合物用于延迟疾病的发展或减慢疾病的进展。如本文所用的,“阻抑”功能或活性是当与除了目的条件或参数之外在其他方面相同的条件相比时、或者可替代地,与另一种情况相比时,减少功能或活性。例如,与不存在细胞情况下的肿瘤生长速率相比,阻抑肿瘤生长的细胞降低肿瘤的生长速率。在给予的背景下,剂(例如药物配制品、细胞或组合物)的“有效量”是指以剂量/量计并且持续所需的时间段有效实现所希望的结果(例如治疗或预防结果)的量。剂(例如药物配制品或细胞)的“治疗有效量”是指以剂量计并且持续所需的时间段有效实现所希望的治疗结果(例如用于治疗疾病、病症或障碍,和/或治疗的药代动力学或药效动力学作用)的量。治疗有效量可以根据例如疾病状态、受试者的年龄、性别和体重以及给予的细胞群体等因素而变化。在一些实施例中,所提供的方法涉及以有效量(例如治疗有效量)给予细胞和/或组合物。“预防有效量”是指以剂量计并且持续所需的时间段有效实现所希望的预防结果的量。典型地,但不是必须的,因为预防剂量是在疾病之前或早期在受试者体内使用的,所以预防有效量将小于治疗有效量。在肿瘤负担较低的背景下,在一些方面中,预防有效量将高于治疗有效量。在一些实施例中,受试者例如在用另一种治疗性干预(包括化学疗法、放射和/或造血干细胞移植(hsct)例如同种异体hsct)后,患有持续性或复发性疾病。在一些实施例中,尽管受试者已经对另一种疗法产生抗性,但给予有效地治疗了受试者。用于过继细胞疗法的细胞的给予方法是已知的,并且可以与所提供的方法和组合物一起使用。例如,过继t细胞疗法方法描述于例如gruenberg等人的美国专利申请公开号2003/0170238;rosenberg的美国专利号4,690,915;rosenberg(2011)natrevclinoncol.[自然评论临床肿瘤学]8(10):577-85)中。参见例如,themeli等人(2013)natbiotechnol.[自然生物技术]31(10):928-933;tsukahara等人(2013)biochembiophysrescommun[生物化学与生物物理学研究通讯]438(1):84-9;davila等人(2013)plosone[公共科学图书馆·综合]8(4):e61338。在一些实施例中,细胞疗法(例如过继t细胞疗法)通过自体转移进行,其中细胞从接受细胞疗法的受试者或从衍生自这种受试者的样品中分离和/或以其他方式制备。因此,在一些方面中,细胞来源于需要治疗的受试者(例如患者),并且在分离和加工后将细胞给予同一受试者。在一些实施例中,细胞疗法(例如过继t细胞疗法)通过同种异体转移进行,其中从将要接受或最终接受细胞疗法的受试者以外的受试者(例如,第一受试者)分离和/或以其他方式制备细胞。在此类实施例中,然后将细胞给予相同物种的不同受试者,例如第二受试者。在一些实施例中,第一和第二受试者在遗传上是相同的。在一些实施例中,第一和第二受试者在遗传上是相似的。在一些实施例中,第二受试者与第一受试者表达相同的hla类别或超型。在一些实施例中,在给予细胞或含有细胞的组合物之前,用靶向疾病或病症(例如肿瘤)的治疗剂治疗受试者。在一些方面中,受试者对另一种治疗剂是难治的或无反应的。在一些实施例中,受试者例如在用另一种治疗性干预(包括化学疗法、放射和/或造血干细胞移植(hsct)例如同种异体hsct)后,患有持续性或复发性疾病。在一些实施例中,尽管受试者已经对另一种疗法产生抗性,但给予有效地治疗了受试者。在一些实施例中,受试者对另一种治疗剂有反应,并且用该治疗剂进行治疗减轻了疾病负担。在一些方面中,受试者最初对治疗剂有反应,但随着时间的推移表现出疾病或病症的复发。在一些实施例中,受试者未复发。在一些此类实施例中,确定受试者有复发的风险,例如有复发的高风险,并且因此预防性地给予细胞,例如以降低复发的可能性或预防复发。在一些方面中,受试者未接受过另一种治疗剂的预先治疗。在用所提供的组合物、细胞、方法和用途来治疗的疾病、病症和障碍中有肿瘤,包括实体瘤、血液恶性肿瘤和黑色素瘤、以及感染性疾病,例如感染病毒或其他病原体(例如hiv、hcv、hbv、cmv)和寄生虫病。在一些实施例中,疾病或病症是肿瘤、癌症、恶性肿瘤、赘生物或其他增殖性疾病或障碍。此类疾病包括但不限于白血病、淋巴瘤(例如慢性淋巴细胞白血病(cll)、急性淋巴细胞白血病(all)、非霍奇金淋巴瘤、急性髓性白血病、多发性骨髓瘤、难治性滤泡性淋巴瘤、套细胞淋巴瘤、惰性b细胞淋巴瘤)、b细胞恶性肿瘤、结肠癌、肺癌、肝癌、乳腺癌、前列腺癌、卵巢癌、皮肤癌、黑色素瘤、骨癌和脑癌、卵巢癌、上皮癌、肾细胞癌、胰腺癌、霍奇金淋巴瘤、宫颈癌、结肠直肠癌、胶质母细胞瘤、神经母细胞瘤、尤因肉瘤、髓母细胞瘤、骨肉瘤、滑膜肉瘤和/或间皮瘤。在一些实施例中,疾病或病症是感染性疾病或病症,例如但不限于病毒、逆转录病毒、细菌和原生动物感染,免疫缺陷,巨细胞病毒(cmv),爱泼斯坦-巴尔病毒(epstein-barrvirus,ebv),腺病毒,bk多瘤病毒。在一些实施例中,疾病或病症是自身免疫性或炎性疾病或病症,例如关节炎(例如类风湿性关节炎(ra))、i型糖尿病、系统性红斑狼疮(sle)、炎性肠病、银屑病、硬皮病、自身免疫性甲状腺病、格雷夫斯病、克罗恩病、多发性硬化、哮喘和/或与移植相关联的疾病或病症。在一些实施例中,与疾病、障碍或障碍相关联的抗原选自ror1、b细胞成熟抗原(bcma)、碳酸酐酶9(caix)、tegfr、her2/neu(受体酪氨酸激酶erbb2)、l1-cam、cd19、cd20、cd22、间皮素、cea、和乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、egfr、上皮糖蛋白2(epg-2)、上皮糖蛋白40(epg-40)、epha2、erb-b2、erb-b3、erb-b4、erbb二聚体、egfrviii、叶酸结合蛋白(fbp)、fcrl5、fcrh5、胎儿型乙酰胆碱受体、gd2、gd3、hmw-maa、il-22r-α、il-13r-α2、激酶插入结构域受体(kdr)、κ轻链、lewisy、l1-细胞黏附分子(l1-cam)、黑色素瘤相关抗原(mage)-a1、mage-a3、mage-a6、黑色素瘤优先表达抗原(prame)、存活蛋白、tag72、b7-h6、il-13受体α2(il-13ra2)、ca9、gd3、hmw-maa、cd171、g250/caix、hla-aimageal、hla-a2ny-eso-1、psca、叶酸受体-a、cd44v6、cd44v7/8、avb6整联蛋白、8h9、ncam、vegf受体、5t4、胎儿型achr、nkg2d配体、cd44v6、双抗原、癌-睾丸抗原、间皮素、鼠cmv、黏蛋白1(muc1)、muc16、psca、nkg2d、ny-eso-1、mart-1、gp100、瘤胚抗原、ror1、tag72、vegf-r2、癌胚抗原(cea)、her2/neu、雌激素受体、孕酮受体、肝配蛋白b2、cd123、c-met、gd-2、o-乙酰化gd2(ogd2)、ce7、肾母细胞瘤1(wt-1)、周期蛋白、周期蛋白a2、ccl-1、cd138、病原体特异性抗原。在一些实施例中,与疾病或障碍相关联的抗原选自下组,该组由以下组成:孤儿酪氨酸激酶受体rorl,tegfr,her2,ll-cam,cd19,cd20,cd22,间皮素,cea,和乙型肝炎表面抗原,抗叶酸受体,cd23,cd24,cd30,cd33,cd38,cd44,egfr,egp-2,egp-4,0epha2,erbb2、3、或4,fbp,胎儿型乙酰胆碱受体,gd2,gd3,hmw-maa,il-22r-α,il-13r-α2,kdr,κ轻链,lewisy,l1-细胞黏附分子,mage-a1,间皮素,muc1,muc16,psca,nkg2d配体,ny-eso-1,mart-1,gp100,瘤胚抗原,ror1,tag72,vegf-r2,癌胚抗原(cea),前列腺特异性抗原,psma,her2/neu,雌激素受体,孕酮受体,肝配蛋白b2,cd123,cs-1,c-met,gd-2,和magea3和/或生物素化分子,和/或由hiv、hcv、hbv或其他病原体表达的分子。在一些实施例中,将细胞以所希望的剂量给予,其在一些方面中包括细胞或一种或多种细胞类型的所希望的剂量或数量和/或细胞类型的所希望的比率。因此,在一些实施例中,细胞的剂量基于细胞总数(或每kg体重的数量)和个体群体或亚型的所希望的比率(例如cd4+与cd8+的比率)。在一些实施例中,细胞的剂量基于个体群体或个体细胞类型中细胞的所希望的总数(或每kg体重的数量)。在一些实施例中,剂量基于此类特征的组合,例如总细胞的所希望的数量、所希望的比率和个体群体中细胞的所希望的总数。在一些实施例中,细胞的群体或亚型(例如cd8+和cd4+t细胞)以总细胞的所希望的剂量(例如t细胞的所希望的剂量)的容忍差或在其内给予。在一些方面中,所希望的剂量是细胞的所希望的数量或每单位被给予细胞的受试者体重的细胞的所希望的数量(例如细胞/kg)。在一些方面中,所希望的剂量是或高于细胞的最小数量或每单位体重的细胞的最小数量。在一些方面中,在以所希望的剂量给予的总细胞中,个体群体或亚型以所希望的输出比率(例如cd4+与cd8+的比率)或在其附近存在,例如在这种比率的一定的容忍差或误差内。在一些实施例中,细胞以一种或多种个体群体或亚型细胞的所希望的剂量(例如cd4+细胞的所希望的剂量和/或cd8+细胞的所希望的剂量)的容忍差或在其内给予。在一些方面中,所希望的剂量是细胞的亚型或群体的所希望的数量、或每单位被给予细胞的受试者体重的此类细胞的所希望的数量(例如细胞/kg)。在一些方面中,所希望的剂量是或高于细胞的群体或亚型的最小数量、或每单位体重的细胞的群体或亚型的最小数量。因此,在一些实施例中,剂量基于总细胞的所希望的固定剂量和所希望的比率,和/或基于个体亚型或亚群的一个或多个(例如每个)的所希望的固定剂量。因此,在一些实施例中,剂量基于t细胞的所希望的固定或最小剂量和cd4+与cd8+细胞的所希望的比率,和/或基于cd4+和/或cd8+细胞的所希望的固定或最小剂量。在某些实施例中,细胞、或细胞亚型的个体群体以约100万至约1000亿个细胞(像例如100万至约500亿个细胞(例如,约500万个细胞、约2500万个细胞、约5亿个细胞、约10亿个细胞、约50亿个细胞、约200亿个细胞、约300亿个细胞、约400亿个细胞、或由前述值的任两个所限定的范围),例如约1000万到大约1000亿个细胞(例如,约2000万个细胞、约3000万个细胞、约4000万个细胞、约6000万个细胞、约7000万个细胞、约8000万个细胞、约9000万个细胞、约100亿个细胞、约250亿个细胞、约500亿个细胞、约750亿个细胞、约900亿个细胞、或由前述值的任两个所限定的范围),并且在一些情况下约1亿个细胞至约500亿个细胞(例如,约1.2亿个细胞、约2.5亿个细胞、约3.5亿个细胞、约4.5亿个细胞、约6.5亿个细胞、约8亿个细胞、约9亿个细胞、约30亿个细胞、约300亿个细胞、约450亿个细胞)或在这些值之间的任何值)的范围给予受试者。在一些实施例中,总细胞的剂量和/或细胞的个体亚群的剂量在104或约104与109或约109个细胞/千克(kg)体重之间(例如在105与106个细胞/kg体重之间)的范围内,例如为或约为1x105个细胞/kg、1.5x105个细胞/kg、2x105个细胞/kg、或1x106个细胞/kg体重。例如,在一些实施例中,将细胞以(在104或约104与109或约109个t细胞/千克(kg)体重之间,例如在105与106个t细胞/kg体重之间,例如为或约为1x105个t细胞/kg、1.5x105个t细胞/kg、2x105个t细胞/kg、或1x106个t细胞/kg体重)的一定误差范围或在其内给予。在一些实施例中,将细胞以(在104或约104与109或约109个cd4+和/或cd8+细胞/千克(kg)体重之间,例如在105与106个cd4+和/或cd8+个细胞/kg体重之间,例如为或约为1x105个cd4+和/或cd8+个细胞/kg、1.5x105个cd4+和/或cd8+个细胞/kg、2x105个cd4+和/或cd8+个细胞/kg、或1x106cd4+和/或cd8+个细胞/kg体重)的一定误差范围或在其内给予。在一些实施例中,将细胞以(大于和/或至少约1x106、约2.5x106、约5x106、约7.5x106或约9x106个cd4+细胞,和/或至少约1x106、约2.5x106、约5x106、约7.5x106或约9x106个cd8+细胞,和/或至少约1x106、约2.5x106、约5x106、约7.5x106或约9x106个t细胞)的一定误差范围或在其内给予。在一些实施例中,将细胞以(在约108与1012之间或在约1010与1011个t细胞之间、在约108与1012之间或在约1010与1011个cd4+细胞之间、和/或在约108与1012之间或在约1010与1011个cd8+细胞之间)的一定误差范围或在其内给予。在一些实施例中,将细胞以多种细胞群体或亚型(例如cd4+和cd8+细胞或亚型)的所希望的输出比率的容忍范围或在其内给予。在一些方面中,所希望的比率可以是特定比率或者可以是比率范围。例如,在一些实施例中,所希望的比率(例如,cd4+与cd8+细胞的比率)在5:1或约5:1与5:1或约5:1之间(或大于约1:5且小于约5:1),或在1:3或约1:3与3:1或约3:1之间(或大于约1:3且小于约3:1),例如在2:1或约2:1与1:5或约1:5之间(或大于约1:5且小于约2:1,例如为或约为5:1、4.5:1、4:1、3.5:1、3:1、2.5:1、2:1、1.9:1、1.8:1、1.7:1、1.6:1、1.5:1、1.4:1、1.3:1、1.2:1、1.1:1、1:1、1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5、或1:5)。在一些方面中,容忍差在所希望的比率的约1%、约2%、约3%、约4%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%(包括在这些范围之间的任何值)内。为了预防或治疗疾病,适当的剂量可取决于待治疗的疾病类型、细胞或重组受体的类型、疾病的严重程度和病程、给予细胞用于预防还是治疗目的、之前疗法、受试者的临床病史和对细胞的反应、以及主治医师的判断。在一些实施例中,组合物和细胞适合一次或在一系列治疗中给予受试者。细胞可以通过任何合适的方式给予,例如通过推注输注,通过注射,例如静脉内或皮下注射、眼内注射、眼周注射、视网膜下注射、玻璃体内注射、经中隔注射、巩膜下注射、脉络膜内注射、前房内注射、结膜下注射(subconjectvalinjection,subconjuntivalinjection)、眼球筋膜下(sub-tenon)注射、眼球后注射、眼球周注射、或后近巩膜(posteriorjuxtascleral)递送。在一些实施例中,它们通过肠胃外、肺内和鼻内给予,并且如果需要局部治疗,则通过病灶内给予。肠胃外输注包括肌内、静脉内、动脉内、腹膜内或皮下给予。在一些实施例中,给定剂量通过单次推注给予细胞来给予。在一些实施例中,其通过多次推注给予细胞来给予(例如,在不超过3天的时间段内给予),或通过连续输注细胞来给予。在一些实施例中,将细胞作为组合治疗的一部分与另一种治疗性干预(例如抗体或工程化细胞或受体或剂,例如细胞毒性剂或治疗剂)例如同时或以任何顺序循序地给予。在一些实施例中,将细胞与一种或多种另外的治疗剂或与另一种治疗性干预同时或以任何顺序循序地共同给予。在一些背景下,将细胞与另一种疗法在时间上足够接近地共同给予,使得细胞群体增强一种或多种另外的治疗剂的效果,或反之亦然。在一些实施例中,在一种或多种另外的治疗剂之前给予细胞。在一些实施例中,在一种或多种另外的治疗剂之后给予细胞。在一些实施例中,一种或多种另外的剂包括细胞因子,例如il-2,以增强持续性。在一些实施例中,该方法包括给予化学治疗剂。在给予细胞后,在一些实施例中,例如通过许多已知方法中的任一种来测量工程化细胞群体的生物活性。要评估的参数包括工程化或天然t细胞或其他免疫细胞与抗原的体内(例如通过成像)或离体(例如通过elisa或流式细胞术)特异性结合。在某些实施例中,可以使用本领域已知的任何合适的方法(例如描述于例如kochenderfer等人,j.immunotherapy[免疫疗法杂志],32(7):689-702(2009),和herman等人j.immunologicalmethods[免疫学方法],285(1):25-40(2004)中的细胞毒性测定)测量工程化细胞破坏靶细胞的能力。在某些实施例中,通过测定一种或多种细胞因子(例如cd107a、ifnγ、il-2和tnf)的表达和/或分泌来测量细胞的生物活性。在一些方面中,通过评估临床结果(例如肿瘤负担或负荷的减少)来测量生物活性。在某些实施例中,工程化细胞以任何数量的方式进一步修饰,使得其治疗或预防功效增加。例如,由群体表达的工程化car或tcr可以直接或通过接头间接缀合至靶向部分。将化合物(例如car或tcr)与靶向部分缀合的实践是本领域已知的。参见例如,wadwa等人,j.drugtargeting[药物靶向杂志]3:111(1995),和美国专利5,087,616。v.定义如本文使用的术语“约”是指本
技术领域:
的技术人员容易知道的相应值的通常误差范围。本文对“约”某一值或参数的提及包括(并描述)针对该值或参数本身的实施例。如本文所用的,单数形式“一种/个(a,an)”和“该(the)”包括复数种/个指示物,除非上下文另外明确说明。例如,“一种/个(a或an)”意指“至少一种/个”或“一种/个或多种/个”。贯穿本披露,所要求保护的主题的各个方面以范围形式呈现。应理解的是,范围形式的描述仅仅是为了方便和简洁,并且不应该被解释为对所要求保护的主题的范围的不能转变的限制。因此,应该认为范围的描述具体披露了所有可能的子范围以及该范围内的单个数值。例如,在提供了值的范围的情况下,应理解的是,在该范围的上限和下限之间的每个中间值以及在所陈述范围内的任何其他所述或中间值涵盖在所要求保护的主题内。这些较小范围的上限和下限可以独立地被包含在这些较小范围内,并且也涵盖在所要求保护的主题内,受制于在所陈述范围内任何确切排除的限制。在所陈述范围包括限制中的一者或两者的情况下,排除了那些包括的限制中的任一者或两者的范围也包括在所要求保护的主题内。无论范围的广度如何,这都适用。如本文所用的,“结构域”用于描述蛋白质或核酸的区段。除非另外说明,否则结构域不需要具有任何特定的功能属性。如本文所用的,当关于氨基酸序列(参考多肽序列)使用时,“氨基酸序列同一性百分比(%)”和“同一性百分比”定义为:在为了实现最大序列同一性百分比(并且不考虑作为序列同一性的一部分的任何保守取代)而比对序列并且引入空位(必要时)后,候选序列(例如,链霉抗生物素蛋白突变蛋白)中与参考多肽序列中氨基酸残基相同的氨基酸残基的百分比。出于确定氨基酸序列同一性百分比的目的,可以用本领域技术中的多种方式来实现比对,例如使用公开可获得的计算机软件,例如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可以确定用于比对序列的适当参数,包括在被比较序列的全长范围实现最大比对所需的任何算法。两个序列之间的同源性或序列同一性(这些术语在本文中可互换地使用)的计算如下进行。出于最佳比较的目的来比对序列(例如,可以在第一和第二氨基酸或核酸序列中的一个或两个中引入空位以用于最佳比对,并且出于比较目的,非同源序列可以忽略)。使用gcg软件包中的gap程序与blossum62评分矩阵,12的空位罚分、4的空位延伸罚分和5的移码空位罚分,将最佳比对确定为最佳评分。然后比较对应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一序列中的位置被与第二序列中的对应位置相同的氨基酸残基或核苷酸占据时,则这些分子在该位置是相同的。两个序列之间的百分比同一性是序列共有的相同位置数的函数。氨基酸取代可以包括将多肽中的一个氨基酸用另一个氨基酸替代。氨基酸通常可以根据以下常见的侧链特性进行分组:(1)疏水性:正亮氨酸、met、ala、val、leu、ile;(2)中性亲水性:cys、ser、thr、asn、gln;(3)酸性:asp、glu;(4)碱性:his、lys、arg;(5)影响链取向的残基:gly、pro;(6)芳香族:trp、tyr、phe。非保守氨基酸取代将涉及将这些类别之一的成员交换为另一类别。如本文所用的,“调节剂”是指可以改变受试分子或基因序列的活性(例如,酶活性、转录活性或翻译活性)、量、分布或结构的实体,例如药物。在一个实施例中,调节包括切割,例如共价键或非共价键的断裂、或共价键或非共价键的形成,例如部分与受试分子的附接。在一个实施例中,调节剂改变受试分子的三维、二级、三级或四级结构。调节剂可以增加、减少、启动或消除受试活性。如本文所用的,“大分子”是指具有至少2、3、5、10、20、30、40、50、60、70、80、90或100kd的分子量的分子。大分子包括蛋白质、多肽、核酸、生物制品和碳水化合物。如本文所用的,“多肽”是指具有少于100个氨基酸残基的氨基酸聚合物。在一个实施例中,其具有少于50、20或10个氨基酸残基。如本文所用的,“非同源末端连接”或“nhej”是指连接介导的修复和/或非模板介导的修复,包括例如典型nhej(cnhej)、替代nhej(altnhej)、微同源介导的末端连接(mmej)、单链退火(ssa)和合成依赖性微同源介导的末端连接(sd-mmej)。如本文所用的,“参考分子”(例如参考cas9分子或参考grna)是指与受试分子(例如受试cas9分子或受试grna分子,例如修饰的或候选cas9分子)进行比较的分子。例如,cas9分子可以表征为具有参考cas9分子的核酸酶活性的不超过10%。参考cas9分子的实例包括天然存在的未修饰的cas9分子,例如天然存在的cas9分子,例如化脓性链球菌、金黄色葡萄球菌或嗜热链球菌的cas9分子。在一个实施例中,参考cas9分子是与要和其比较的cas9分子具有最接近的序列同一性或同源性的天然存在的cas9分子。在一个实施例中,参考cas9分子是已经在其上进行改变(例如突变)的亲本形式的序列(例如天然存在的或已知的序列)。如本文中关于分子的修饰所使用的“替代”或“替代的”不要求过程限制,而仅仅指示存在替代实体。如本文所用的,“小分子”是指具有小于约2kd(例如小于约2kd、小于约1.5kd、小于约1kd、或小于约0.75kd)的分子量的化合物。如本文所用的,受试者包括任何活生物体,例如人和其他哺乳动物。哺乳动物包括但不限于人和非人动物,包括农场动物、运动动物、啮齿动物和宠物。该术语包括但不限于哺乳动物(例如,人、其他灵长类动物、猪、啮齿动物(例如,小鼠和大鼠或仓鼠)、兔、豚鼠、牛、马、猫、狗、绵羊和山羊)。在一个实施例中,受试者是人。在其他实施例中,受试者是家禽。如本文所用的,组合物是指两种或更多种产物、物质或化合物(包括细胞)的任何混合物。其可以是溶液、悬浮液、液体、粉末、糊剂、水性、非水性或其任何组合。如本文所用的,当提及一种或多种特定细胞类型或细胞群体时,“富集”是指例如通过基于由群体或细胞表达的标记的阳性选择,或通过基于不存在于待耗竭的细胞群体或细胞上的标记的阴性选择,例如与组合物中的细胞总数或体积相比、或者相对于其他细胞类型,增加细胞类型或群体的数量或百分比。该术语不要求从组合物中完全除去其他细胞、细胞类型或群体,并且不要求如此富集的细胞在富集的组合物中以100%或甚至接近100%存在。如本文所用的,细胞或细胞群体对特定标记呈“阳性”的陈述是指特定标记(典型地是表面标记)在细胞上或细胞中的可检测到的存在。当提及表面标记时,该术语是指如通过流式细胞术所检测的,表面表达的存在,例如通过用特异性结合标记的抗体进行染色并检测所述抗体,其中该染色通过流式细胞术以如下水平是可检测到的,该水平基本上高于在其他方面相同的条件下用同种型匹配对照或荧光减一(fluorescenceminusone,fmo)门控对照进行相同程序检测到的染色,和/或该水平基本上与已知对标记呈阳性的细胞的水平相似,和/或该水平基本上高于已知对标记呈阴性的细胞的水平。如本文所用的,细胞或细胞群体对特定标记呈“阴性”的陈述是指特定标记(典型地是表面标记)在细胞上或细胞中不存在实质上可检测到的存在。当提及表面标记时,该术语是指如通过流式细胞术所检测的,表面表达的不存在,例如通过用特异性结合标记的抗体进行染色并检测所述抗体,其中该染色通过流式细胞术以如下水平没有检测到,该水平基本上高于在其他方面相同的条件下用同种型匹配对照或荧光减一(fmo)门控对照进行相同程序检测到的染色,和/或该水平基本上低于已知对标记呈阳性的细胞的水平,和/或该水平与已知对标记呈阴性的细胞的水平相比是基本上相似的。如本文所用的,术语“载体”是指能够繁殖与其连接的另一种核酸的核酸分子。该术语包括作为自我复制核酸结构的载体以及掺入已引入其的宿主细胞基因组中的载体。某些载体能够指导它们可操作地连接的核酸的表达。此类载体在本文中被称为“表达载体”。除非另外说明,否则如本文在氨基酸序列的背景下所用的“x”是指任何氨基酸(例如,二十种天然氨基酸中的任一种)。除非另外定义,否则本文使用的所有领域术语、符号和其他技术和科学术语或命名旨在具有与所要求保护的主题所属领域的普通技术人员通常理解的含义相同的含义。在一些情况下,为了清楚和/或为了便于参考而在本文中定义具有通常理解的含义的术语,并且本文中包含的这些定义不应被解释为表示与本领域通常理解的实质性差异。本申请中提及的所有出版物(包括专利文献、科学文章和数据库)出于所有目的通过引用以其整体并入,在程度上如同每个单独的出版物通过引用单独并入。如果本文所述的定义与通过引用并入本文的专利、申请、公开申请和其他出版物中所述的定义相反或以其他方式不一致,则本文所述的定义优先于通过引用并入本文的定义。本文使用的章节标题只是出于组织的目的,而不应解释为限制所述的主题。vi.示例性实施例在所提供的实施例中有:1.一种组合物,该组合物包含(a)工程化免疫细胞,该工程化免疫细胞包含特异性结合抗原的重组受体;和(b)能够诱导编码pd-1多肽的pdcd1基因的遗传破坏的剂,其中所述剂能够在该组合物中至少70%、至少75%、至少80%、或至少或大于90%的细胞中,和/或在该组合物中至少70%、至少75%、至少80%、或至少或大于90%的表达该重组受体的细胞中诱导所述遗传破坏,和/或预防或减少pd-1表达。2.一种组合物,该组合物包含(a)工程化免疫细胞,该工程化免疫细胞包含编码特异性结合抗原的重组受体的核酸;和(b)能够诱导编码pd-1多肽的pdcd1基因的遗传破坏的剂,其中所述剂能够在该组合物中至少70%、至少75%、至少80%、或至少或大于90%的细胞中,和/或在该组合物中至少70%、至少75%、至少80%、或至少或大于90%的表达该重组受体的细胞中诱导所述遗传破坏,和/或预防或减少pd-1表达。3.如实施例1或实施例2所述的组合物,其中该工程化免疫细胞在其表面上表达该重组受体。4.一种组合物,该组合物包含含有工程化免疫细胞的细胞群体,该工程化免疫细胞包含(a)特异性结合抗原的重组受体;和(b)编码pd-1多肽的pdcd1基因的遗传破坏,所述遗传破坏预防或减少所述pd-1多肽的表达,其中:在该组合物中至少约70%、至少约75%、或至少约80%或至少或大于约90%的细胞含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因,不含pdcd1基因,和/或不含功能性pdcd1基因;和/或不表达pd-1多肽;和/或在该组合物中至少约70%、至少约75%、或至少约80%或至少或大于约90%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,和/或不表达pd-1多肽。5.一种组合物,该组合物包含含有工程化免疫细胞的细胞群体,该工程化免疫细胞包含(a)特异性结合抗原的重组受体,其中在该重组受体与所述抗原结合时,该工程化免疫细胞能够诱导细胞毒性、增殖和/或分泌细胞因子;和(b)编码pd-1多肽的pdcd1基因的遗传破坏,所述遗传破坏能够预防或减少所述pd-1多肽的表达,任选地其中所述预防或减少是在该组合物中至少或至少约或大于或大于约70%、75%、80%、85%或90%的细胞中和/或在该组合物中至少或至少约或大于或大于约70%、75%、80%、85%或90%的表达该重组受体的细胞中。6.一种组合物,该组合物包含含有工程化免疫细胞群体的细胞群体,每个工程化免疫细胞包含(a)特异性结合抗原的重组受体;和(b)编码pd-1多肽的pdcd1基因的遗传破坏,其中所述遗传破坏能够预防或减少所述pd-1多肽的表达,其中:平均而言,分别与该组合物中包含该重组受体且不包含该遗传破坏的其他细胞中所述重组受体的平均表达和/或表面表达水平相比,这些工程化免疫细胞以相同、大致相同或基本相同的水平表现出该受体的表达和/或表面表达,或这些工程化免疫细胞不表达该pd-1多肽,并且平均而言,分别与该组合物中包含该重组受体且表达该pd-1多肽的细胞中的平均表达和/或表面水平相比,这些工程化免疫细胞以相同、大致相同或基本相同的水平表现出该受体的表达和/或表面表达。7.如实施例1-4和6中任一项所述的组合物,其中任选地如在体外测定中所测量的,任选地在任选地包括任选地在一种或多种细胞因子的存在下孵育12、24、36、48或60小时的体外测定中,在与该抗原、表达该抗原的细胞和/或抗原受体活化物质一起孵育时,该重组受体能够特异性结合该抗原,能够活化或刺激工程化t细胞,能够诱导细胞毒性,或能够诱导该免疫细胞的增殖、存活和/或细胞因子分泌。8.如实施例1-4、6和7中任一项所述的组合物,其中任选地如在体外测定中所测量的,该体外测定任选地包括任选地在一种或多种细胞因子的存在下孵育12、24、36、48或60小时且任选地包括或不包括将该免疫细胞暴露于表达pd-l1的细胞,在与该抗原、表达该抗原的细胞和/或抗原受体活化物质一起孵育时,该工程化免疫细胞能够特异性结合该抗原,能够诱导细胞毒性、增殖、存活和/或分泌细胞因子。9.如实施例7或实施例8所述的组合物,其中:当在相同条件下评估时,该结合、细胞毒性、增殖、存活或细胞因子分泌的水平或程度或范围或持续时间与针对包含该重组受体但不包含pdcd1基因的该遗传破坏的免疫细胞检测到或观察到的相比相同、大致相同或基本相同。10.如实施例6和8-9中任一项所述的组合物,其中该结合、细胞毒性、增殖、存活和/或细胞因子分泌是在抽出并再次暴露于该抗原、抗原表达细胞和/或物质后如任选地在体外测定中所测量的。11.如实施例1-10中任一项所述的组合物,其中该免疫细胞是来自受试者的原代细胞。12.如实施例1-11中任一项所述的组合物,其中该免疫细胞是人细胞。13.如实施例1-12中任一项所述的组合物,其中该免疫细胞是白细胞。14.如实施例1-13中任一项所述的组合物,其中该免疫细胞是nk细胞或t细胞。15.如实施例14所述的组合物,其中该免疫细胞包含含有未分级的t细胞的多种t细胞,包含分离的cd8+细胞或针对cd8+t细胞进行富集,或包含分离的cd4+t细胞或针对cd4+细胞进行富集,和/或针对其子集进行富集,该子集选自下组,该组由以下组成:原初细胞、效应记忆细胞、中枢记忆细胞、干中枢记忆细胞、效应记忆细胞和长寿效应记忆细胞。16.如实施例14或实施例15所述的组合物,其中表现出非活化的长寿记忆或中枢记忆表型的t细胞、或表达该受体且包含该遗传破坏的t细胞在该组合物中的百分比与如下细胞群体相同或基本相同,该细胞群体与该组合物相同或基本相同但不含该遗传破坏或但不表达该pd-1多肽。17.如实施例1-16中任一项所述的组合物,其中当在相同条件下评估时,任选地在不存在或存在使该免疫细胞接触或暴露于pd-l1的情况下进行比较,表现出非活化的长寿记忆或中枢记忆表型的t细胞在该组合物中的百分比与表现出该表型的t细胞在包含含有该重组受体但不含编码pd-1多肽的pdcd1基因的该遗传破坏的t细胞的组合物中的百分比相比相同、大致相同或基本相同。18.如实施例16或实施例17所述的组合物,其中该表型是如将该组合物在或在约37℃±2℃下孵育至少12小时、24小时、48小时、96小时、6天、12天、24天、36天、48天或60天后所评估的。19.如实施例18所述的组合物,其中该孵育是体外的。20.如实施例18或实施例19所述的组合物,其中该孵育的至少一部分是在刺激剂的存在下进行的,该孵育的至少一部分是任选地长达1小时、6小时、24小时或48小时的孵育。21.如实施例20所述的组合物,其中该刺激剂是能够诱导t细胞、cd4+t细胞和/或cd8+t细胞增殖的剂。22.如实施例20或实施例21所述的组合物,其中该刺激剂是或包含对cd3具有特异性的抗体、对cd28具有特异性的抗体和/或细胞因子。23.如实施例16-22中任一项所述的组合物,其中包含该重组受体的t细胞包含一种或多种选自以下的表型标记:ccr7+、4-1bb+(cd137+)、tim3+、cd27+、cd62l+、cd127+、cd45ra+、cd45ro-、t-bet低、il-7ra+、cd95+、il-2rβ+、cxcr3+或lfa-1+。24.如实施例1-23中任一项所述的组合物,其中该重组受体是功能性非tcr抗原受体或转基因tcr。25.如实施例1-23中任一项所述的组合物,其中该重组受体是嵌合抗原受体(car)。26.如实施例25所述的组合物,其中该car包含抗原结合结构域,该抗原结合结构域是抗体或抗体片段。27.如实施例26所述的组合物,其中该抗体片段是单链片段。28.如实施例26或实施例27所述的组合物,其中该抗体片段包含通过柔性免疫球蛋白接头连接的抗体可变区。29.如实施例26-28中任一项所述的组合物,其中该片段包含scfv。30.如实施例1-29中任一项所述的组合物,其中该抗原与疾病或障碍相关联。31.如实施例30所述的组合物,其中该疾病或障碍是感染性疾病或病症、自身免疫性疾病、炎性疾病或肿瘤或癌症。32.如实施例1-31中任一项所述的组合物,其中该重组受体特异性结合肿瘤抗原。33.如实施例1-32中任一项所述的组合物,其中该抗原选自ror1、her2、l1-cam、cd19、cd20、cd22、间皮素、cea、乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、egfr、egp-2、egp-4、epha2、erbb2、erbb3、erbb4、fbp、胎儿型乙酰胆碱受体、gd2、gd3、hmw-maa、il-22r-α、il-13r-α2、kdr、κ轻链、lewisy、l1-细胞黏附分子(cd171)、mage-a1、间皮素、muc1、muc16、psca、nkg2d配体、ny-eso-1、mart-1、gp100、瘤胚抗原、tag72、vegf-r2、癌胚抗原(cea)、前列腺特异性抗原、psma、雌激素受体、孕酮受体、肝配蛋白b2、cd123、cs-1、c-met、gd-2、magea3、ce7、肾母细胞瘤1(wt-1)、周期蛋白a1(ccna1)、bcma和白细胞介素12。34.如实施例1-33中任一项所述的组合物,其中该重组受体包含含有itam的细胞内信号传导结构域。35.如实施例34所述的组合物,其中该细胞内信号传导结构域包含cd3-ζ(cd3ζ)链的细胞内结构域。36.如实施例34或实施例35所述的组合物,其中该重组受体进一步包含共刺激信号传导区。37.如实施例36所述的组合物,其中该共刺激信号传导区包含cd28或4-1bb的信号传导结构域。38.如实施例1-3和7-37中任一项所述的组合物,其中该剂包含以下中的至少一种:(a)具有与pdcd1基因的靶结构域互补的靶向结构域的至少一种grna,或(b)编码该至少一种grna的至少一种核酸。39.如实施例1-3和7-38中任一项所述的组合物,其中该剂包含至少一种cas9分子和grna的复合物,该grna具有与pdcd1基因的靶结构域互补的靶向结构域。40.如实施例38或实施例39所述的组合物,其中该指导rna进一步包含第一互补结构域、与该第一互补结构域互补的第二互补结构域、近端结构域和任选地尾结构域。41.如实施例40所述的组合物,其中该第一互补结构域和第二互补结构域通过连接结构域连接。42.如实施例41中任一项所述的组合物,其中该指导rna包含3'聚-a尾和5'抗反向帽类似物(arca)帽。43.如实施例39-42中任一项所述的组合物,其中该cas9分子是酶促活性cas9。44.如实施例38-43中任一项所述的组合物,其中该至少一种grna包括靶向结构域,该靶向结构域包含选自下组的序列,该组由以下组成:gucugggcggugcuacaacu(seqidno:508)、gcccuggccagucgucu(seqidno:514)、cgucugggcggugcuacaac(seqidno:1533)、uguagcaccgcccagacgac(seqidno:579)、cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)。45.如实施例38-44中任一项所述的组合物,其中该至少一种grna包括靶向结构域,该靶向结构域包含序列cgacuggccagggcgccugu(seqidno:582)。46.如实施例38-45中任一项所述的组合物,其中该cas9分子是切口酶,并且两种cas9分子/grna分子复合物由两种不同的grna分子指导,以在该靶结构域的相对链上以两个单链断裂来切割该靶结构域。47.如实施例39-46中任一项所述的组合物,其中该cas9分子是金黄色葡萄球菌cas9分子。48.如实施例39-46中任一项所述的组合物,其中该cas9分子是化脓性链球菌cas9。49.如实施例39-48中任一项所述的组合物,其中该cas9分子缺乏活性ruvc结构域或活性hnh结构域。50.如实施例39-46、48和49中任一项所述的组合物,其中该cas9分子是包含d10a突变的化脓性链球菌cas9分子。51.如实施例46-50中任一项所述的组合物,其中该两种grna分子包含选自以下靶向结构域对的靶向结构域:52.如实施例39-46和48-51中任一项所述的组合物,其中该cas9分子是包含n863a突变的化脓性链球菌cas9分子。53.如实施例52所述的组合物,其中该两种grna分子包含选自以下靶向结构域对的靶向结构域:54.如实施例1-53中任一项所述的组合物,其中该遗传破坏包括双链断裂的产生,该双链断裂通过非同源末端连接(nhej)修复以实现该pdcd1基因中的插入和缺失(indel)。55.如实施例1-54中任一项所述的组合物,其中:在该组合物中至少约70%、至少约75%、或至少约80%的细胞含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;和/或在该组合物中至少约70%、至少约75%、或至少约80%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,或不表达pd-1多肽。56.如实施例4或实施例55所述的组合物,其中:在该组合物中大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的细胞含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;和/或在该组合物中大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,和/或不表达pd-1多肽。57.如实施例1-56中任一项所述的组合物,其中:任选地如通过流式细胞术所评估的,在该组合物中至少或至少约90%的细胞、或在该组合物中至少或至少约90%的表达该重组受体的细胞含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽。58.如实施例1-57中任一项所述的组合物,其中基因组中该基因的两个等位基因都被破坏。59.如实施例1-58中任一项所述的组合物,其中在该组合物中的细胞和/或在该组合物中的表达该重组受体的细胞没有针对含有该遗传破坏的细胞进行富集或选择;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽。60.如实施例1-59中任一项所述的组合物,其中平均而言,在该组合物中的每个细胞中或在该组合物中的表达该重组受体的每个细胞中,不超过2个、不超过5个或不超过10个其他基因被破坏或被该剂破坏。61.如实施例1-60中任一项所述的组合物,其中在该组合物中的每个细胞中或在该组合物中的表达该重组受体的每个细胞中,没有其他基因在该细胞中被破坏或被该剂破坏。62.如实施例1-61中任一项所述的组合物,该组合物进一步包含药学上可接受的缓冲剂。63.如实施例1-62中任一项所述的组合物,其中,在将该组合物给予任选地患有该疾病或病症的受试者后的时间点:表达该重组受体且不表达pd-1的细胞在该受试者的血液中或来自该受试者的血液来源的样品中或在该受试者的组织或生物样品中是可检测到的;含有该遗传破坏的细胞在该受试者的血液中或来自该受试者的血液来源的样品中或在该受试者的组织或生物样品中是可检测到的;含有该遗传破坏且表达该重组受体的细胞在该受试者的血液中或来自该受试者的血液来源的样品中或在该受试者的组织或生物样品中是可检测到的。64.如实施例63所述的组合物,其中该时间点为或约为给予后7、8、9、10、11、12、13、或14天或者2、3、4、5、6、7、8、9、10、11、或12周。65.如实施例63或64所述的组合物,其中在该血液或样品中可检测到的所述细胞以如下浓度或约如下浓度或至少如下浓度或至少约如下浓度存在:1、2、3、4、5、6、7、8、9、10或100个细胞/微升的血液,和/或代表在该血液中至少10%、20%、25%、30%、35%、40%、45%或50%或更多的t细胞。66.如实施例1-65中任一项所述的组合物,其中,在将该组合物给予受试者后:在该组合物中包含该遗传破坏的细胞在该受试者中以如下速率和/或持续如下时间来扩增和/或持续存在:该速率和/或时间与在该组合物中不含该遗传破坏的t细胞的扩增和/或持续性、和/或t细胞表达该重组受体但不包含该缺失的参考组合物的t细胞的扩增和/或持续性至少相同、任选地更大;和/或在该组合物中包含该遗传破坏且包含该重组受体的细胞在该受试者中以如下速率和/或持续如下时间来扩增和/或持续存在:该速率和/或时间与在该组合物中不含该遗传破坏的t细胞的扩增和/或持续性、和/或t细胞表达该重组受体但不包含该缺失的参考组合物的t细胞的扩增和/或持续性至少相同、任选地更大。67.如实施例66所述的组合物,其中该速率或时间至少或至少约大1.5倍或2倍或3倍。68.一种产生基因工程化免疫细胞的方法,该方法包括:(a)向免疫细胞中引入编码特异性结合抗原的重组受体的核酸分子;以及(b)向该免疫细胞中引入能够诱导编码pd-1多肽的pdcd1基因的遗传破坏的剂,该剂包含以下中的一种:(i)具有与该pdcd1基因的靶结构域互补的靶向结构域的至少一种grna或(ii)编码该至少一种grna的至少一种核酸。69.一种产生基因工程化免疫细胞的方法,该方法包括向表达特异性结合抗原的重组受体的免疫细胞中引入能够诱导编码pd-1多肽的pdcd1基因的遗传破坏的剂,该剂包含以下中的一种:(i)具有与该pdcd1基因的靶结构域互补的靶向结构域的至少一种grna或(ii)编码该至少一种grna的至少一种核酸。70.如实施例68或实施例69所述的方法,其中该剂包含至少一种cas9分子和grna的复合物,该grna具有与pdcd1基因的靶结构域互补的靶向结构域。71.如实施例68-70中任一项所述的方法,其中该指导rna进一步包含第一互补结构域、与该第一互补结构域互补的第二互补结构域、近端结构域和任选地尾结构域。72.如实施例71所述的方法,其中该第一互补结构域和第二互补结构域通过连接结构域连接。73.如实施例68-72中任一项所述的方法,其中该指导rna包含3'聚-a尾和5'抗反向帽类似物(arca)帽。74.如实施例68-73中任一项所述的方法,其中引入包括在体外使这些细胞与该剂或其一部分接触。75.如实施例68-74中任一项所述的方法,其中该剂的引入包括电穿孔。76.如实施例74或实施例75所述的方法,其中该引入进一步包括在这些细胞与该剂接触之前、期间或之后,或在该电穿孔之前、期间或之后,在体外孵育这些细胞。77.如实施例68-76中任一项所述的方法,其中(a)中的该引入包括转导,并且该引入进一步包括在该转导之前、期间或之后,在体外孵育这些细胞。78.如实施例76或实施例77所述的方法,其中该孵育的至少一部分是在如下的存在下:(i)选自由il-2、il-7和il-15组成的组的细胞因子,和/或(ii)任选地包含抗cd3和/或抗cd28抗体的一种或多种刺激剂或活化剂。79.如实施例77或实施例78所述的方法,其中(a)中的该引入包括:在转导之前,将这些细胞与浓度为20u/ml至200u/ml、任选地约100u/ml的il-2一起孵育;与浓度为1ng/ml至50ng/ml、任选地约10ng/ml的il-7一起孵育,和/或与浓度为0.5ng/ml至20ng/ml、任选地约5ng/ml的il-15一起孵育;以及在转导之后,将这些细胞与浓度为10u/ml至200u/ml、任选地约50u/ml的il-2一起孵育;与浓度为0.5ng/ml至20ng/ml、任选地约5ng/ml的il-7一起孵育,和/或与浓度为0.1ng/ml至10ng/ml、任选地约0.5ng/ml的il-15一起孵育。80.如实施例76-79中任一项所述的方法,其中该孵育独立地进行长达或大约24小时、36小时、48小时、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天或21天。81.如实施例76-80中任一项所述的方法,其中该孵育独立地进行24-48小时或36-48小时。82.如实施例74-81中任一项所述的方法,其中使这些细胞与该剂以大约1微克/100,000、200,000、300,000、400,000、或500,000个细胞的比率接触。83.如实施例76-82中任一项所述的方法,其中:该孵育处于30℃±2℃至39℃±2℃的温度;或该孵育处于至少或约至少30℃±2℃、32℃±2℃、34℃±2℃或37℃±2℃的温度。84.如实施例76-83中任一项所述的方法,其中该孵育的至少一部分处于30℃±2℃,并且该孵育的至少一部分处于37℃±2℃。85.如实施例68-84中任一项所述的方法,其中该方法进一步包括在(a)中的该引入和(b)中的该引入之间使这些细胞静置。86.如实施例70-85中任一项所述的方法,其中该cas9分子是酶促活性cas9。87.如实施例68-86中任一项所述的方法,其中该至少一种grna包括靶向结构域,该靶向结构域包含选自下组的序列,该组由以下组成:gucugggcggugcuacaacu(seqidno:508)、gcccuggccagucgucu(seqidno:514)、cgucugggcggugcuacaac(seqidno:1533)、uguagcaccgcccagacgac(seqidno:579)、cgacuggccagggcgccugu(seqidno:582)和caccuaccuaagaaccaucc(seqidno:723)。88.如实施例68-87中任一项所述的方法,其中该至少一种grna包括靶向结构域,该靶向结构域包含序列cgacuggccagggcgccugu(seqidno:582)。89.如实施例68-79中任一项所述的方法,其中该cas9分子是切口酶,并且两种cas9分子/grna分子复合物由两种不同的grna分子指导,以在该靶结构域的相对链上以两个单链断裂来切割该靶结构域。90.如实施例70-89中任一项所述的方法,其中该cas9分子是金黄色葡萄球菌cas9分子。91.如实施例70-90中任一项所述的方法,其中该cas9分子是化脓性链球菌cas9。92.如实施例70-91中任一项所述的方法,其中该cas9分子缺乏活性ruvc结构域或活性hnh结构域。93.如实施例70-89、91和92中任一项所述的方法,其中该cas9分子是包含d10a突变的化脓性链球菌cas9分子。94.如实施例89-93中任一项所述的方法,其中该两种grna分子包含选自以下靶向结构域对的靶向结构域:95.如实施例70-89和91-94中任一项所述的方法,其中该cas9分子是包含n863a突变的化脓性链球菌cas9分子。96.如实施例94所述的方法,其中该两种grna分子包含选自以下靶向结构域对的靶向结构域:97.如实施例68-96中任一项所述的方法,其中该遗传破坏包括双链断裂的产生,该双链断裂通过非同源末端连接(nhej)修复以实现该pdcd1基因中的插入和缺失(indel)。98.如实施例68-97中任一项所述的方法,其中该重组受体是功能性非tcr抗原受体或转基因tcr。99.如实施例68-98中任一项所述的方法,其中该重组受体是嵌合抗原受体(car)。100.如实施例99所述的方法,其中该car包含抗原结合结构域,该抗原结合结构域是抗体或抗体片段。101.如实施例100所述的方法,其中该抗体片段是单链片段。102.如实施例100或实施例101所述的方法,其中该抗体片段包含通过柔性免疫球蛋白接头连接的抗体可变区。103.如实施例100-102中任一项所述的方法,其中该片段包含scfv。104.如实施例100-103中任一项所述的方法,其中该抗原与疾病或障碍相关联。105.如实施例104所述的方法,其中该疾病或障碍是感染性疾病或病症、自身免疫性疾病、炎性疾病或肿瘤或癌症。106.如实施例68-105中任一项所述的方法,其中该重组受体特异性结合肿瘤抗原。107.如实施例68-106中任一项所述的方法,其中该抗原选自ror1、her2、l1-cam、cd19、cd20、cd22、间皮素、cea、乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、egfr、egp-2、egp-4、epha2、erbb2、erbb3、erbb4、fbp、胎儿型乙酰胆碱受体、gd2、gd3、hmw-maa、il-22r-α、il-13r-α2、kdr、κ轻链、lewisy、l1-细胞黏附分子(cd171)、mage-a1、间皮素、muc1、muc16、psca、nkg2d配体、ny-eso-1、mart-1、gp100、瘤胚抗原、tag72、vegf-r2、癌胚抗原(cea)、前列腺特异性抗原、psma、雌激素受体、孕酮受体、肝配蛋白b2、cd123、cs-1、c-met、gd-2、magea3、ce7、肾母细胞瘤1(wt-1)、周期蛋白a1(ccna1)、bcma和白细胞介素12。108.如实施例68-107中任一项所述的方法,其中该重组受体包含含有itam的细胞内信号传导结构域。109.如实施例108所述的方法,其中该细胞内信号传导结构域包含cd3-ζ(cd3ζ)链的细胞内结构域。110.如实施例108或实施例109所述的方法,其中该重组受体进一步包含共刺激信号传导区。111.如实施例110所述的方法,其中该共刺激信号传导区包含cd28或4-1bb的信号传导结构域。112.如实施例68-111中任一项所述的方法,其中编码该重组受体的核酸是病毒载体。113.如实施例112所述的方法,其中该病毒载体是逆转录病毒载体。114.如实施例112或实施例113所述的方法,其中该病毒载体是慢病毒载体或γ逆转录病毒载体。115.如实施例68-114中任一项所述的方法,其中编码该重组载体的核酸的引入是通过转导,该转导任选地是逆转录病毒转导。116.如实施例68-115中任一项所述的方法,其中该免疫细胞是来自受试者的原代细胞。117.如实施例68-116中任一项所述的方法,其中该免疫细胞是人细胞。118.如实施例68-117中任一项所述的方法,其中该免疫细胞是白细胞。119.如实施例68-118中任一项所述的方法,其中该免疫细胞是nk细胞或t细胞。120.如实施例119所述的方法,其中该免疫细胞是t细胞,该t细胞是未分级的t细胞、分离的cd8+t细胞或分离的cd4+t细胞。121.如实施例68-120中任一项所述的方法,该方法在多种免疫细胞上进行。122如实施例68-121中任一项所述的方法,其中在引入该剂和引入该重组受体之后,细胞没有针对以下进行富集或选择:(a)含有该遗传破坏或不表达该内源性pd-1多肽的细胞,(b)表达该重组受体的细胞,或(a)和(b)两者。123.如实施例68-122中任一项所述的方法,该方法进一步包括针对以下进行富集或选择:(a)含有该遗传破坏或不表达该内源性pd-1多肽的细胞,(b)表达该重组受体的细胞,或(a)和(b)两者。124.如实施例68-123中任一项所述的方法,该方法进一步包括在或约在37℃±2℃下孵育这些细胞。125.如实施例124所述的方法,其中该孵育进行以下时间:在1小时或约1小时与96小时或约96小时之间、在4小时或约4小时与72小时或约72小时之间、在8小时或约8小时与48小时或约48小时之间、在12小时或约12小时与36小时或约36小时之间、在6小时或约6小时与24小时或约24小时之间、在36小时或约36小时与96小时或约96小时之间,包括端值。126.如实施例125所述的方法,其中该孵育或该孵育的一部分在刺激剂的存在下进行。127.如实施例126所述的方法,其中该刺激剂是能够诱导t细胞、cd4+t细胞和/或cd8+t细胞增殖的剂。128.如实施例126或实施例127所述的方法,其中该刺激剂是或包含对cd3具有特异性的抗体、对cd28具有特异性的抗体和/或细胞因子。129.如实施例68-128中任一项所述的方法,该方法进一步包括将由该方法产生的细胞在药学上可接受的缓冲剂中配制。130.如实施例68-129中任一项所述的方法,其中该方法产生细胞群体,在该细胞群体中:至少约70%、至少约75%、或至少约80%的细胞既1)含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;又2)表达该重组受体;或至少约70%、至少约75%、或至少约80%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,或不表达pd-1多肽。131.如实施例68-130中任一项所述的方法,其中该方法产生细胞群体,在该细胞群体中:大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的细胞既1)含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;又2)表达该重组受体;和/或大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,和/或不表达pd-1多肽。132.如实施例68-131中任一项所述的方法,其中基因组中该基因的两个等位基因都被破坏。133.一种基因工程化免疫细胞,该基因工程化免疫细胞通过如实施例68-132中任一项所述的方法产生。134.多种基因工程化免疫细胞,这些基因工程化免疫细胞通过如实施例68-132中任一项所述的方法产生。135.如实施例134所述的多种基因工程化免疫细胞,其中:至少约70%、至少约75%、或至少约80%的细胞既1)含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;又2)表达该重组受体;或至少约70%、至少约75%、或至少约80%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,或不表达pd-1多肽。136.如实施例134或实施例135所述的多种基因工程化免疫细胞,其中:大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的细胞既1)含有该遗传破坏;不表达该内源性pd-1多肽;不含连续的pdcd1基因、pdcd1基因、和/或功能性pdcd1基因;和/或不表达pd-1多肽;又2)表达该重组受体;和/或大于80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、或95%的表达该重组受体的细胞含有该遗传破坏,不表达该内源性pd-1多肽,和/或不表达pd-1多肽。137.一种组合物,该组合物包含如实施例133所述的基因工程化免疫细胞或如实施例134-136中任一项所述的多种基因工程化免疫细胞以及任选地药学上可接受的缓冲剂。138.一种治疗方法,该治疗方法包括将如实施例1-67和137中任一项所述的组合物给予患有疾病或病症的受试者。139.如实施例138所述的方法,其中该重组受体特异性结合与该疾病或病症相关联的抗原。140.如实施例138或实施例139所述的方法,其中该疾病或病症是癌症、肿瘤、自身免疫性疾病或障碍、或感染性疾病。141.如实施例140所述的方法,其中该癌症或肿瘤是白血病、淋巴瘤、慢性淋巴细胞白血病(cll)、急性淋巴细胞白血病(all)、非霍奇金淋巴瘤、急性髓性白血病、多发性骨髓瘤、难治性滤泡性淋巴瘤、套细胞淋巴瘤、惰性b细胞淋巴瘤、b细胞恶性肿瘤、结肠癌、肺癌、肝癌、乳腺癌、前列腺癌、卵巢癌、皮肤癌、黑色素瘤、骨癌、和脑癌、卵巢癌、上皮癌、肾细胞癌、胰腺癌、霍奇金淋巴瘤、宫颈癌、结肠直肠癌、胶质母细胞瘤、神经母细胞瘤、尤因肉瘤、髓母细胞瘤、骨肉瘤、滑膜肉瘤、和/或间皮瘤。142.如实施例139-141中任一项所述的方法,其中该抗原选自下组,该组由以下组成:孤儿酪氨酸激酶受体ror1,tegfr,her2,l1-cam,cd19,cd20,cd22,间皮素,cea,乙型肝炎表面抗原,抗叶酸受体,cd23,cd24,cd30,cd33,cd38,cd44,egfr,egp-2,egp-4,epha2,erbb2、3、或4,fbp,胎儿型乙酰胆碱受体,gd2,gd3,hmw-maa,il-22r-α,il-13r-α2,kdr,κ轻链,lewisy,l1-细胞黏附分子,mage-a1,间皮素,muc1,muc16,psca,nkg2d配体,ny-eso-1,mart-1,gp100,瘤胚抗原,ror1,tag72,vegf-r2,癌胚抗原(cea),前列腺特异性抗原,psma,her2/neu,雌激素受体,孕酮受体,肝配蛋白b2,cd123,cs-1,c-met,gd-2,magea3,ce7,肾母细胞瘤1(wt-1),周期蛋白a1(ccna1),bcma和白细胞介素12。143.如实施例139-142中任一项所述的方法,其中该抗原是cd19或bcma。144.如实施例138-143中任一项所述的方法,其中给予该受试者的工程化细胞在给予后减少和/或消除了pd-1的表达持续1天、2天、3天、4天、5天、6天、7天、10天、14天、1个月、2个月或更长时间。145.如实施例138-144中任一项所述的方法,其中给予该受试者的工程化细胞在给予后在该受试者中持续至少1天、2天、3天、4天、5天、6天、7天、10天、14天、1个月、2个月或更长时间。146如实施例138-145中任一项所述的方法,其中,在给予该组合物后的时间点:表达该重组受体且不表达pd-1的细胞在该受试者的血液中或来自该受试者的血液来源的样品中或在该受试者的组织或生物样品中是可检测到的;含有该遗传破坏的细胞在该受试者的血液中或来自该受试者的血液来源的样品中或在该受试者的组织或生物样品中是可检测到的;含有该遗传破坏且表达该重组受体的细胞在该受试者的血液中或来自该受试者的血液来源的样品中或在该受试者的组织或生物样品中是可检测到的。147.如实施例138-146中任一项所述的方法,其中该时间点为或约为给予后7、8、9、10、11、12、13、或14天或者2、3、4、5、6、7、8、9、10、11、或12周。148.如实施例138-147所述的方法,其中在该血液或样品中可检测到的所述细胞以如下浓度或约如下浓度或至少如下浓度或至少约如下浓度存在:1、2、3、4、5、6、7、8、9、10或100个细胞/微升的血液,和/或代表在该血液中至少10%、20%、25%、30%、35%、40%、45%或50%或更多的t细胞。149.如实施例138-148中任一项所述的方法,其中,在给予后:在该组合物中包含该遗传破坏的细胞在该受试者中以如下速率和/或持续如下时间来扩增和/或持续存在:该速率和/或时间与在该组合物中不含该遗传破坏的t细胞的扩增和/或持续性、和/或t细胞表达该重组受体但不包含该缺失的参考组合物的t细胞的扩增和/或持续性至少相同、任选地更大;和/或在该组合物中包含该遗传破坏且包含该重组受体的细胞在该受试者中以如下速率和/或持续如下时间来扩增和/或持续存在:该速率和/或时间与在该组合物中不含该遗传破坏的t细胞的扩增和/或持续性、和/或t细胞表达该重组受体但不包含该缺失的参考组合物的t细胞的扩增和/或持续性至少相同、任选地更大。150.如实施例149所述的方法,其中该速率或时间至少或至少约大1.5倍或2倍或3倍。151.如实施例140-150中任一项所述的方法,其中该肿瘤是实体瘤。152.如实施例140-151中任一项所述的方法,其中该肿瘤不是b细胞衍生的肿瘤,不是白血病和/或不是淋巴瘤。153.如实施例140-152中任一项所述的方法,其中该肿瘤或其细胞表达或已经观察到表达pd-1的配体。154.一种药物组合物,该药物组合物包含工程化免疫细胞,该工程化免疫细胞包含(a)特异性结合抗原的重组受体;和(b)编码pd-1多肽的pdcd1基因的遗传破坏,所述遗传破坏预防或减少所述pd-1多肽的表达,其中该工程化细胞在给予受试者之前具有降低和/或消除的pd-1表达的表型,并且其中在给予该受试者之后,这些细胞维持该表型持续1天、2天、3天、4天、5天、6天、7天、10天、14天、1个月、2个月或更长时间。155.如实施例1-67、137和154中任一项所述的组合物,用于治疗受试者的疾病或病症。156.如实施例155所述的使用的组合物,其中该重组受体特异性结合与该疾病或病症相关联的抗原。157.如实施例155或实施例156所述的使用的组合物,其中该疾病或病症是癌症、肿瘤、自身免疫性疾病或障碍、或感染性疾病。158.如实施例155-157中任一项所述的使用的组合物,其中该疾病或病症是癌症或肿瘤,该癌症或肿瘤是白血病、淋巴瘤、慢性淋巴细胞白血病(cll)、急性淋巴细胞白血病(all)、非霍奇金淋巴瘤、急性髓性白血病、多发性骨髓瘤、难治性滤泡性淋巴瘤、套细胞淋巴瘤、惰性b细胞淋巴瘤、b细胞恶性肿瘤、结肠癌、肺癌、肝癌、乳腺癌、前列腺癌、卵巢癌、皮肤癌、黑色素瘤、骨癌、和脑癌、卵巢癌、上皮癌、肾细胞癌、胰腺癌、霍奇金淋巴瘤、宫颈癌、结肠直肠癌、胶质母细胞瘤、神经母细胞瘤、尤因肉瘤、髓母细胞瘤、骨肉瘤、滑膜肉瘤、和/或间皮瘤。159.如实施例155-158中任一项所述的使用的组合物,其中该抗原选自下组,该组由以下组成:孤儿酪氨酸激酶受体ror1,tegfr,her2,l1-cam,cd19,cd20,cd22,间皮素,cea,乙型肝炎表面抗原,抗叶酸受体,cd23,cd24,cd30,cd33,cd38,cd44,egfr,egp-2,egp-4,epha2,erbb2、3、或4,fbp,胎儿型乙酰胆碱受体,gd2,gd3,hmw-maa,il-22r-α,il-13r-α2,kdr,κ轻链,lewisy,l1-细胞黏附分子,mage-a1,间皮素,muc1,muc16,psca,nkg2d配体,ny-eso-1,mart-1,gp100,瘤胚抗原,ror1,tag72,vegf-r2,癌胚抗原(cea),前列腺特异性抗原,psma,her2/neu,雌激素受体,孕酮受体,肝配蛋白b2,cd123,cs-1,c-met,gd-2,magea3,ce7,肾母细胞瘤1(wt-1),周期蛋白a1(ccna1),bcma和白细胞介素12。160.如实施例155-159中任一项所述的使用的组合物,其中该抗原是cd19或bcma。161.如实施例155-160中任一项所述的使用的组合物,其中,在将该组合物给予受试者后,含有该遗传破坏且任选地含有该重组受体的一种或多种细胞在如下时间在该受试者的组织或生物样品中持续和/或可检测到,该时间至少为或至少约为给予后1天、2天、3天、4天、5天、6天、7天、10天、14天、1个月、2个月或更长时间;和/或在如下时间在来自该受试者的生物样品或组织中可检测到的至少50%、60%、70%、80%、85%或90%的t细胞或表达该重组受体的t细胞含有该遗传破坏,该时间至少为或至少约为给予后1天、2天、3天、4天、5天、6天、7天、10天、14天、1个月、2个月或更长时间。162.一种改变t细胞的方法,该方法包括使该t细胞与一种或多种cas9分子/grna分子复合物接触,其中在该一种或多种cas9分子/grna分子复合物中的一种或多种grna分子包含与来自pdcd1基因的靶结构域互补的靶向结构域。163.一种改变t细胞的方法,该方法包括使该t细胞与至少两种cas9分子/grna分子复合物接触,每种复合物包含如下grna分子,该grna分子包含与来自该pdcd1基因的靶结构域互补的靶向结构域。164.如实施例162或实施例163所述的方法,其中该t细胞来自患有癌症的受试者。165.如实施例164所述的方法,其中该癌症选自下组,该组由以下组成:淋巴瘤、慢性淋巴细胞白血病(cll)、b细胞急性淋巴细胞白血病(b-all)、急性成淋巴细胞性白血病、急性髓性白血病、非霍奇金淋巴瘤(nhl)、弥漫性大细胞淋巴瘤(dlcl)、多发性骨髓瘤、肾细胞癌(rcc)、神经母细胞瘤、结肠直肠癌、乳腺癌、卵巢癌、黑色素瘤、肉瘤、前列腺癌、肺癌、食管癌、肝细胞癌、胰腺癌、星形细胞瘤、间皮瘤、头颈癌、和髓母细胞瘤。166.如实施例162-165中任一项所述的方法,其中该t细胞来自患有癌症或者否则可以受益于该pdcd1基因的t细胞靶位置处的突变的受试者。167.如实施例162-166中任一项所述的方法,其中该接触是离体进行的。168.如实施例162-167中任一项所述的方法,其中该t细胞包含重组受体。169.如实施例162-168中任一项所述的方法,该方法进一步包括在将编码重组受体的核酸引入该细胞中的条件下使该t细胞与该核酸接触。170.如实施例168或实施例169所述的方法,其中该重组受体是功能性非tcr抗原受体或转基因tcr。171.如实施例168-170中任一项所述的方法,其中该重组受体是嵌合抗原受体(car)。172.如实施例171所述的方法,其中该car包含抗原结合结构域,该抗原结合结构域是抗体或抗体片段。173.如实施例172所述的方法,其中该抗体片段是单链片段。174.如实施例172或实施例173所述的方法,其中该抗体片段包含通过柔性免疫球蛋白接头连接的抗体可变区。175.如实施例172-174中任一项所述的方法,其中该片段包含scfv。176.如实施例172-175中任一项所述的方法,其中该抗原与疾病或障碍相关联。177.如实施例176所述的方法,其中该疾病或障碍是感染性疾病或病症、自身免疫性疾病、炎性疾病或肿瘤或癌症。178.如实施例168-177中任一项所述的方法,其中该重组受体特异性结合肿瘤抗原。179.如实施例171-178中任一项所述的方法,其中该抗原选自ror1、her2、l1-cam、cd19、cd20、cd22、间皮素、cea、乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、egfr、egp-2、egp-4、epha2、erbb2、erbb3、erbb4、fbp、胎儿型乙酰胆碱受体、gd2、gd3、hmw-maa、il-22r-α、il-13r-α2、kdr、κ轻链、lewisy、l1-细胞黏附分子(cd171)、mage-a1、间皮素、muc1、muc16、psca、nkg2d配体、ny-eso-1、mart-1、gp100、瘤胚抗原、tag72、vegf-r2、癌胚抗原(cea)、前列腺特异性抗原、psma、雌激素受体、孕酮受体、肝配蛋白b2、cd123、cs-1、c-met、gd-2、magea3、ce7、肾母细胞瘤1(wt-1)、周期蛋白a1(ccna1)、bcma和白细胞介素12。180.如实施例168-179中任一项所述的方法,其中该重组受体包含含有itam的细胞内信号传导结构域。181.如实施例180所述的方法,其中该细胞内信号传导结构域包含cd3-ζ(cd3ζ)链的细胞内结构域。182.如实施例180或实施例181所述的方法,其中该重组受体进一步包含共刺激信号传导区。183.如实施例182所述的方法,其中该共刺激信号传导区包含cd28或4-1bb的信号传导结构域。184.如实施例164-183中任一项所述的方法,其中在该接触步骤之后将该改变的t细胞返回到该受试者的身体。185.如实施例162-184中任一项所述的方法,其中该t细胞来自患有癌症的受试者,该接触是离体进行的,并且在该接触步骤后将该改变的t细胞返回到该受试者的身体。186.如实施例162-185中任一项所述的方法,其中该一种或多种cas9分子/grna分子复合物在该接触之前形成。187.如实施例163-186中任一项所述的方法,其中该至少两种cas9分子/grna分子复合物在该接触之前形成。188.如实施例162-187中任一项所述的方法,其中该一种或多种grna分子包含与来自seqidno:481-555、563-1516、1517-3748、14657-16670、和16671-21037中的任一个的靶向结构域相同或相差不超过3个核苷酸的靶向结构域。189.如实施例188所述的方法,其中该一种或多种grna分子包含选自seqidno:563-1516的靶向结构域。190.如实施例188所述的方法,其中该一种或多种grna分子包含选自seqidno:1517-3748的靶向结构域。191.如实施例188所述的方法,其中该一种或多种grna分子包含选自seqidno:14657-16670的靶向结构域。192.如实施例188所述的方法,其中该一种或多种grna分子包含选自seqidno:16671-21037的靶向结构域。193.如实施例188所述的方法,其中该一种或多种grna分子包含选自seqidno:481-500和508-547的靶向结构域。194.如实施例188所述的方法,其中该一种或多种grna分子包含选自seqidno:501-507和548-555的靶向结构域。195.如实施例188所述的方法,其中该一种或多种grna分子包含选自seqidno:508、514、576、579、582、和723的靶向结构域。196.如实施例188所述的方法,其中该一种或多种grna分子包含选自seqidno:508、510、511、512、514、576、579、581、582、766、和723的靶向结构域。197.如实施例162-196中任一项所述的方法,其中该一种或多种grna分子在其5'末端被修饰或包含3’聚a尾。198.如实施例162-196中任一项所述的方法,其中该一种或多种grna分子在其5'末端被修饰且包含3’聚a尾。199.如实施例197或实施例198所述的方法,其中该一种或多种grna分子缺乏5'三磷酸酯基团。200.如实施例197或实施例198所述的方法,其中该一种或多种grna分子包括5'帽。201.如实施例200所述的方法,其中该5'帽包含修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。202.如实施例200所述的方法,其中该5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。203.如实施例197-202中任一项所述的方法,其中该3'聚a尾由约10至约30个腺嘌呤核苷酸组成。204.如实施例197-202中任一项所述的方法,其中该3'聚a尾由约20个腺嘌呤核苷酸组成。205.如实施例203或实施例204所述的方法,其中包括该3'聚a尾的一种或多种grna分子通过体外转录从dna模板制备。206.如实施例205所述的方法,其中该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。207.如实施例205所述的方法,其中该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。208.如实施例162-207中任一项所述的方法,其中该一种或多种cas9分子/grna分子复合物经由电穿孔被递送至该t细胞中。209.如实施例163-208中任一项所述的方法,其中该至少两种cas9分子/grna分子复合物经由电穿孔被递送至该t细胞中。210.如实施例162-209中任一项所述的方法,其中该一种或多种grna分子包含与来自该pdcd1基因的靶结构域互补的靶向结构域,并且其中该一种或多种grna分子指导该cas9分子以至少40%的切割效率来切割该靶结构域。211.如实施例210所述的方法,其中使用标记的抗pdcd1抗体和流式细胞术来确定该切割效率。212.如实施例162-211中任一项所述的方法,其中该cas9分子由单种grna分子指导并以单个双链断裂来切割该靶结构域。213.如实施例212所述的方法,其中该cas9分子是化脓性链球菌cas9分子。214.如实施例162-213中任一项所述的方法,其中该靶向结构域选自:215.如实施例162-211中任一项所述的方法,其中该cas9分子是切口酶,并且两种cas9分子/grna分子复合物由两种不同的grna分子指导,以在该靶结构域的相对链上以两个单链断裂来切割该靶结构域。216.如实施例215所述的方法,其中该cas9分子是化脓性链球菌cas9分子。217.如实施例162-216中任一项所述的方法,其中该化脓性链球菌cas9分子具有d10a突变。218.如实施例162-217中任一项所述的方法,其中该两种grna分子包含选自以下靶向结构域对的靶向结构域:219.如实施例162-218中任一项所述的方法,其中该化脓性链球菌cas9分子具有n863a突变。220.如实施例219所述的方法,其中该两种grna分子包含选自以下靶向结构域对的靶向结构域:221.如实施例162-220中任一项所述的方法,其中该一种或多种grna分子是一种或多种模块化grna分子。222.如实施例162-220中任一项所述的方法,其中该一种或多种grna分子是一种或多种嵌合grna分子。223.如实施例222所述的方法,其中该一种或多种grna分子从5'至3'包含:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。224.如实施例222或实施例223所述的方法,其中该一种或多种grna分子包含长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。225.如实施例210-224中任一项所述的方法,其中该方法的特征在于切割效率为至少60%。226.如实施例210-224中任一项所述的方法,其中该方法的特征在于切割效率为至少80%。227.如实施例210-224中任一项所述的方法,其中该方法的特征在于切割效率为至少90%。228.如实施例210-227中任一项所述的方法,其中该grna分子的特征在于少于5个脱靶。229.如实施例210-228中任一项所述的方法,其中该grna分子的特征在于少于2个外显子脱靶。230.如实施例228或实施例229所述的方法,其中脱靶通过guide-seq鉴定。231.如实施例228或实施例229所述的方法,其中脱靶通过amp-seq鉴定。232.一种cas9分子/grna分子复合物,其中该grna分子包含与来自pdcd1基因的靶结构域互补的靶向结构域,并且该grna分子在其5'末端被修饰和/或包含3'聚a尾。233.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含与来自seqidno:481-555、563-1516、1517-3748、14657-16670、和16671-21037中的任一个的靶向结构域相同或相差不超过3个核苷酸的靶向结构域。234.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含选自seqidno:563-1516的靶向结构域。235.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含选自seqidno:1517-3748的靶向结构域。236.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含选自seqidno:14657-16670的靶向结构域。237.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含选自seqidno:16671-21037的靶向结构域。238.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含选自seqidno:481-500和508-547的靶向结构域。239.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含选自seqidno:501-507和548-555的靶向结构域。240.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含选自seqidno:508、514、576、579、582、和723的靶向结构域。241.如实施例232所述的cas9分子/grna分子复合物,其中该grna分子包含选自seqidno:508、510、511、512、514、576、579、581、582、766、和723的靶向结构域。242.如实施例232-241中任一项所述的cas9分子/grna分子复合物,其中该grna分子在其5'末端被修饰。243.如实施例242所述的cas9分子/grna分子复合物,其中该grna分子缺乏5'三磷酸酯基团。244.如实施例242所述的cas9分子/grna分子复合物,其中该grna分子包括5'帽。245.如实施例244所述的cas9分子/grna分子复合物,其中该5'帽包含修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。246.如实施例244所述的cas9分子/grna分子复合物,其中该5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。247.如实施例232-246中任一项所述的cas9分子/grna分子复合物,其中该3'聚a尾由约10至约30个腺嘌呤核苷酸组成。248.如实施例232-246中任一项所述的cas9分子/grna分子复合物,其中该3'聚a尾由约20个腺嘌呤核苷酸组成。249.如实施例247或实施例248所述的cas9分子/grna分子复合物,其中包括该3'聚a尾的grna分子通过体外转录从dna模板制备。250.如实施例249所述的cas9分子/grna分子复合物,其中该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。251.如实施例249所述的cas9分子/grna分子复合物,其中该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。252.如实施例232-251中任一项所述的cas9分子/grna分子复合物,其中该cas9分子以双链断裂来切割靶结构域。253.如实施例252所述的cas9分子/grna分子复合物,其中该cas9分子是化脓性链球菌cas9分子。254.如实施例232-253中任一项所述的cas9分子/grna分子复合物,其中该靶向结构域选自以下靶向结构域的组:255.如实施例232-251中任一项所述的cas9分子/grna分子复合物,其中该cas9分子以单链断裂来切割靶结构域。256.如实施例255所述的cas9分子/grna分子复合物,其中该cas9分子是化脓性链球菌cas9分子。257.如实施例232至实施例256中任一项所述的cas9分子/grna分子复合物,其中该化脓性链球菌cas9分子具有d10a突变。258.如实施例232至实施例257中任一项所述的cas9分子/grna分子复合物,其中该靶向结构域选自以下靶向结构域的组:259.如实施例232-256中任一项所述的cas9分子/grna分子复合物,其中该化脓性链球菌cas9分子具有n863a突变。260.如实施例259所述的cas9分子/grna分子复合物,其中该靶向结构域选自以下靶向结构域的组:261.如实施例232-260中任一项所述的cas9分子/grna分子复合物,其中该grna分子是模块化grna分子。262.如实施例232-261中任一项所述的cas9分子/grna分子复合物,其中该grna分子是嵌合grna分子。263.如实施例262所述的cas9分子/grna分子复合物,其中该grna分子从5'至3'包含:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。264.如实施例262或实施例263所述的cas9分子/grna分子复合物,其中该grna分子包含长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。265.一种组合物,该组合物包含至少两种cas9分子/grna复合物,每种复合物包含如下grna分子,该grna分子包含与来自pdcd1基因的靶结构域互补的靶向结构域。266.如实施例265所述的组合物,其中该grna分子包含与来自seqidno:481-555、563-1516、1517-3748、14657-16670、和16671-21037中的任一个的靶向结构域相同或相差不超过3个核苷酸的靶向结构域。267.如实施例265所述的组合物,其中该grna分子包含选自seqidno:563-1516的靶向结构域。268.如实施例265所述的组合物,其中该grna分子包含选自seqidno:1517-3748的靶向结构域。269.如实施例265所述的组合物,其中该grna分子包含选自seqidno:14657-16670的靶向结构域。270.如实施例265所述的组合物,其中该grna分子包含选自seqidno:16671-21037的靶向结构域。271.如实施例265所述的组合物,其中该grna分子包含选自seqidno:481-500和508-547的靶向结构域。272.如实施例265所述的组合物,其中该grna分子包含选自seqidno:501-507和548-555的靶向结构域。273.如实施例265所述的组合物,其中该grna分子包含选自seqidno:508、514、576、579、582、和723的靶向结构域。274.如实施例265所述的组合物,其中该grna分子包含选自seqidno:508、510、511、512、514、576、579、581、582、766、和723的靶向结构域。275.如实施例265-741中任一项所述的组合物,其中该grna分子在其5'末端被修饰。276.如实施例275所述的组合物,其中该grna分子缺乏5'三磷酸酯基团。277.如实施例275所述的组合物,其中该grna分子包括5'帽。278.如实施例277所述的组合物,其中该5'帽包含修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。279.如实施例277所述的组合物,其中该5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。280.如实施例265-279中任一项所述的组合物,其中该3'聚a尾由约10至约30个腺嘌呤核苷酸组成。281.如实施例265-279中任一项所述的组合物,其中该3'聚a尾由约20个腺嘌呤核苷酸组成。282.如实施例280或实施例281所述的组合物,其中包括该3'聚a尾的grna分子通过体外转录从dna模板制备。283.如实施例282所述的组合物,其中该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。284.如实施例282所述的组合物,其中该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。285.如实施例265-284中任一项所述的组合物,其中该cas9分子以双链断裂来切割靶结构域。286.如实施例285所述的组合物,其中该cas9分子是化脓性链球菌cas9分子。287.如实施例265-286中任一项所述的组合物,其中该靶向结构域选自以下靶向结构域的组:288.如实施例265-287中任一项所述的组合物,其中该cas9分子以单链断裂来切割靶结构域。289.如实施例288所述的组合物,其中该cas9分子是化脓性链球菌cas9分子。290.如实施例265-289中任一项所述的组合物,其中该化脓性链球菌cas9分子具有d10a突变。291.如实施例265-290中任一项所述的组合物,其中该靶向结构域选自以下靶向结构域的组:292.如实施例265-291中任一项所述的组合物,其中该化脓性链球菌cas9分子具有n863a突变。293.如实施例292所述的组合物,其中该靶向结构域选自以下靶向结构域的组:294.如实施例265-293中任一项所述的组合物,其中该grna分子是模块化grna分子。295.如实施例265-294中任一项所述的组合物,其中该grna分子是嵌合grna分子。296.如实施例295所述的组合物,其中该grna分子从5'至3'包含:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。297.如实施例295或实施例296所述的组合物,其中该grna分子包含长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。298.一种grna分子,该grna分子包含与pdcd1基因的靶结构域互补的靶向结构域,其中该grna分子在其5'末端被修饰和/或包含3'聚a尾。299.如实施例298所述的grna分子,其中该grna分子包含与来自seqidno:481-555、563-1516、1517-3748、14657-16670、和16671-21037中的任一个的靶向结构域相同或相差不超过3个核苷酸的靶向结构域。300.如实施例298所述的grna分子,其中该grna分子包含选自seqidno:563-1516的靶向结构域。301.如实施例298所述的grna分子,其中该grna分子包含选自seqidno:1517-3748的靶向结构域。302.如实施例298所述的grna分子,其中该grna分子包含选自seqidno:14657-16670的靶向结构域。303.如实施例298所述的grna分子,其中该grna分子包含选自seqidno:16671-21037的靶向结构域。304.如实施例298所述的grna分子,其中该grna分子包含选自seqidno:481-500和508-547的靶向结构域。305.如实施例298所述的grna分子,其中该grna分子包含选自seqidno:501-507和548-555的靶向结构域。306.如实施例298所述的grna分子,其中该grna分子包含选自seqidno:508、514、576、579、582、和723的靶向结构域。307.如实施例298所述的grna分子,其中该grna分子包含选自seqidno:508、510、511、512、514、576、579、581、582、766、和723的靶向结构域。308.如实施例298-94中任一项所述的grna分子,其中该grna分子在其5'末端被修饰。309.如实施例308所述的grna分子,其中该grna分子缺乏5'三磷酸酯基团。310.如实施例308所述的grna分子,其中该grna分子包括5'帽。311.如实施例310所述的grna分子,其中该5'帽包含修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。312.如实施例310所述的grna分子,其中该5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。313.如实施例298-312中任一项所述的grna分子,其中该grna分子包含3'聚a尾,该3'聚a尾由约10至约30个腺嘌呤核苷酸组成。314.如实施例298-312中任一项所述的grna分子,其中该grna分子包含3'聚a尾,该3'聚a尾由约20个腺嘌呤核苷酸组成。315.如实施例313或314所述的grna分子,其中包括该3'聚a尾的grna分子通过体外转录从dna模板制备。316.如实施例315所述的grna分子,其中该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。316.如实施例315所述的grna分子,其中该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。317.如实施例298-316中任一项所述的grna分子,其中该grna分子是化脓性链球菌grna分子。318.如实施例298-317中任一项所述的grna分子,其中该靶向结构域选自以下靶向结构域的组:319.如实施例318所述的grna分子,其中该靶向结构域选自以下靶向结构域的组:320.如实施例318所述的grna分子,其中该靶向结构域选自以下靶向结构域的组:321.如实施例318所述的grna分子,其中该靶向结构域选自以下靶向结构域的组:322.如实施例298-321中任一项所述的grna分子,其中该grna分子是模块化grna分子。323.如实施例298-322中任一项所述的grna分子,其中该grna分子是嵌合grna分子。324.如实施例323所述的grna分子,其中该grna分子从5'至3'包含:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。325.如实施例323或实施例324所述的grna分子,其中该grna分子包含长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。326.一种制备用于植入的细胞的方法,该方法包括使该细胞与一种或多种cas9分子/grna分子复合物接触,其中在该一种或多种cas9分子/grna分子复合物中的一种或多种grna分子包含与来自pdcd1基因的靶结构域互补的靶向结构域。327.如实施例326所述的方法,其中该一种或多种grna分子包含与来自该pdcd1基因的靶结构域互补的靶向结构域,并且其中该一种或多种grna分子指导该cas9分子以至少40%的切割效率来切割该靶结构域。328.如实施例327所述的方法,其中使用标记的抗pdcd1抗体和流式细胞术来确定该切割效率。329.如实施例326-328中任一项所述的方法,其中该一种或多种grna分子在其5'末端被修饰或包含3’聚a尾。330.如实施例326-328中任一项所述的方法,其中该一种或多种grna分子在其5'末端被修饰且包含3’聚a尾。331.如实施例329或实施例330所述的方法,其中该一种或多种grna分子缺乏5'三磷酸酯基团。332.如实施例329或实施例330所述的方法,其中该一种或多种grna分子包括5'帽。333.如实施例332所述的方法,其中该5'帽包含修饰的鸟嘌呤核苷酸,该鸟嘌呤核苷酸经由5’-5’三磷酸酯键与该grna分子的剩余部分连接。334.如实施例332所述的方法,其中该5'帽包含两个任选修饰的鸟嘌呤核苷酸,这些鸟嘌呤核苷酸经由任选修饰的5'-5'三磷酸酯键连接。335.如实施例329-334中任一项所述的方法,其中该3'聚a尾由约10至约30个腺嘌呤核苷酸组成。336.如实施例329-334中任一项所述的方法,其中该3'聚a尾由约20个腺嘌呤核苷酸组成。337.如实施例335或实施例336所述的方法,其中包括该3'聚a尾的一种或多种grna分子通过体外转录从dna模板制备。338.如实施例337所述的方法,其中该靶向结构域的5'核苷酸是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸不是鸟嘌呤核苷酸。339.如实施例337所述的方法,其中该靶向结构域的5'核苷酸不是鸟嘌呤核苷酸,该dna模板包含紧接对应于该靶向结构域的序列上游的t7启动子序列,并且该t7启动子序列的3'核苷酸是鸟嘌呤核苷酸以外的核苷酸的下游的鸟嘌呤核苷酸。340.如实施例326-339中任一项所述的方法,其中该一种或多种cas9分子/grna分子复合物经由电穿孔被递送至该细胞中。341.如实施例326-340中任一项所述的方法,其中该cas9分子由单种grna分子指导并以单个双链断裂来切割该靶结构域。342.如实施例341所述的方法,其中该cas9分子是化脓性链球菌cas9分子。343.如实施例326-342中任一项所述的方法,其中该单种grna分子包含选自以下靶向结构域的靶向结构域:344.如实施例326-343中任一项所述的方法,其中该cas9分子是切口酶,并且两种cas9分子/grna分子复合物由两种不同的grna分子指导,以在该靶结构域的相对链上以两个单链断裂来切割该靶结构域。345.如实施例326-344中任一项所述的方法,其中该cas9分子是具有d10a突变的化脓性链球菌cas9分子。346.如实施例326-345中任一项所述的方法,其中该两种grna分子包含选自以下靶向结构域对的靶向结构域:347.如实施例326-346中任一项所述的方法,其中该化脓性链球菌cas9分子具有n863a突变。348.如实施例347所述的方法,其中该两种grna分子包含选自以下靶向结构域对的靶向结构域:349.如实施例326-348中任一项所述的方法,其中该一种或多种grna分子是一种或多种模块化grna分子。350.如实施例326-349中任一项所述的方法,其中该一种或多种grna分子是一种或多种嵌合grna分子。351.如实施例350所述的方法,其中该一种或多种grna分子从5'至3'包含:靶向结构域;第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域。352.如实施例350或实施例351所述的方法,其中该一种或多种grna分子包含长度不超过25个核苷酸的连接结构域以及连在一起长度为至少20个核苷酸的近端结构域和尾结构域。353.如实施例326-352中任一项所述的方法,其中该一种或多种grna分子指导该cas9分子以至少60%的切割效率来切割该靶结构域。354.如实施例326-352中任一项所述的方法,其中该一种或多种grna分子指导该cas9分子以至少80%的切割效率来切割该靶结构域。355.如实施例326-352中任一项所述的方法,其中该一种或多种grna分子指导该cas9分子以至少90%的切割效率来切割该靶结构域。356.如实施例326-355中任一项所述的方法,其中该一种或多种cas9分子/grna分子复合物产生少于5个脱靶。357.如实施例326-356中任一项所述的方法,其中该一种或多种cas9分子/grna分子复合物产生少于2个外显子脱靶。358.如实施例356或实施例357所述的方法,其中脱靶通过guide-seq鉴定。359.如实施例356或实施例357所述的方法,其中脱靶通过amp-seq鉴定。360.如实施例326-359中任一项所述的方法,其中该接触是离体进行的。361.如实施例326-360中任一项所述的方法,其中该细胞是免疫细胞。362.如实施例361所述的方法,其中该细胞是淋巴细胞或抗原呈递细胞。363.如实施例362所述的方法,其中该细胞是t细胞、b细胞或抗原呈递细胞。364.如实施例326-363中任一项所述的方法,其中该细胞是t细胞。365.如实施例326-364中任一项所述的方法,其中该细胞包含重组受体。366.如实施例326-365中任一项所述的方法,该方法进一步包括在将编码重组受体的核酸引入该细胞中的条件下使该细胞与该核酸接触。367.如实施例365或实施例366所述的方法,其中该重组受体是功能性非tcr抗原受体或转基因tcr。368.如实施例365-367中任一项所述的方法,其中该重组受体是嵌合抗原受体(car)。369.如实施例368所述的方法,其中该car包含抗原结合结构域,该抗原结合结构域是抗体或抗体片段。370.如实施例369所述的方法,其中该抗体片段是单链片段。371.如实施例369或实施例370所述的方法,其中该抗体片段包含通过柔性免疫球蛋白接头连接的抗体可变区。372.如实施例369-371中任一项所述的方法,其中该片段包含scfv。373.如实施例369-372中任一项所述的方法,其中该抗原与疾病或障碍相关联。374.如实施例373所述的方法,其中该疾病或障碍是感染性疾病或病症、自身免疫性疾病、炎性疾病或肿瘤或癌症。375.如实施例365-374中任一项所述的方法,其中该重组受体特异性结合肿瘤抗原。376.如实施例369-375中任一项所述的方法,其中该抗原选自ror1、her2、l1-cam、cd19、cd20、cd22、间皮素、cea、乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、egfr、egp-2、egp-4、epha2、erbb2、erbb3、erbb4、fbp、胎儿型乙酰胆碱受体、gd2、gd3、hmw-maa、il-22r-α、il-13r-α2、kdr、κ轻链、lewisy、l1-细胞黏附分子(cd171)、mage-a1、间皮素、muc1、muc16、psca、nkg2d配体、ny-eso-1、mart-1、gp100、瘤胚抗原、tag72、vegf-r2、癌胚抗原(cea)、前列腺特异性抗原、psma、雌激素受体、孕酮受体、肝配蛋白b2、cd123、cs-1、c-met、gd-2、magea3、ce7、肾母细胞瘤1(wt-1)、周期蛋白a1(ccna1)、bcma和白细胞介素12。377.如实施例365-376中任一项所述的方法,其中该重组受体包含含有itam的细胞内信号传导结构域。378.如实施例377所述的方法,其中该细胞内信号传导结构域包含cd3-ζ(cd3ζ)链的细胞内结构域。379.如实施例377或378所述的方法,其中该重组受体进一步包含共刺激信号传导区。380.如实施例379所述的方法,其中该共刺激信号传导区包含cd28或4-1bb的信号传导结构域。381.一种t细胞,该t细胞通过如实施例162-231和326-380中任一项所述的方法制备。382.一种t细胞,该t细胞包含如实施例232-264中任一项所述的cas9分子/grna分子复合物。383.一种t细胞,该t细胞包含如实施例265-297中任一项所述的组合物。384.一种治疗受试者的方法,该方法包括向该受试者给予如实施例381-383中任一项所述的t细胞。385.如实施例232-264中任一项所述的cas9分子/grna分子复合物、如实施例265-297中任一项所述的组合物、或如实施例381-383中任一项所述的t细胞,用于疗法。386.如实施例232-264中任一项所述的cas9分子/grna分子复合物或如实施例265-297中任一项所述的组合物在制备用于治疗癌症的药物中的用途。vii.实例以下实例仅用于说明目的而包括,并不旨在限制本发明的范围。实例1:在原代t细胞中针对pdcd1的grna的筛选为了评估用于靶向pdcd1(编码程序性死亡-1pd-1的基因)的某些grna,生成包含靶向pdcd1基因座的不同标记的grna的grna和cas9的核糖核蛋白复合物(rnp)并将其通过电穿孔递送至活化的原代t细胞中。将化脓性链球菌cas9蛋白(基本上如公开的pct申请号wo2015161276所述的纯化)与相应的体外转录的grna(基本上如公开的pct申请号wo2015161276所述的制备)以1:1、1:1.25或1:5的cas9:grna比率(取决于grna)复合至少15min。在使用差示扫描荧光分析法(dsf)验证蛋白质与grna完全复合后,使用电穿孔将rnp给予至来自健康人供体的活化的cd4+t细胞。使用电穿孔在96孔格式中以1μg的rnp/100,000个细胞的剂量将rnp添加至500,000个细胞中。将细胞在含有il-2、il-7和il-15的t细胞培养基中电穿孔后进行培养。为了评估pdcd1敲除的效率,使用抗cd3/抗cd28珠重新活化t细胞48小时,同时在t细胞培养基中进行培养。在电穿孔后第7天,如实例2所述,使用pe缀合的抗pd1抗体通过流式细胞术来分析细胞。pd-1阴性细胞的百分比显示于图23中。表1000提供了以这种方式鉴定的具有大于45%pdcd1敲除效率的六种示例性rnp的grna的靶向结构域的序列。表1000通过guide-seq(参见naturebiotechnology[自然生物技术]33:187–197,2015,将其通过引用以其整体并入本文)在原代t细胞中评估上文鉴定的6种grna各自的特异性。来源于2个独立实验的四个独立gdna样品的结果总结于表2000中。如果在4个样品中的至少一个中存在双向读数,或在4个样品中的至少2个中存在单向读数,则称为脱靶。为了证实guide-seq结果,将来自用化脓性链球菌rnp(其使用具有靶向结构域gucugggcggugcuacaacu(seqidno:508)的grna制备)处理的t细胞的6种独立gdna进行amp-seq。amp-seq结果类似于guide-seq结果,并确认了(a)鉴定的脱靶和(b)通过guide-seq生成的指导物的等级顺序。表2000实例2:多个供体的pdcd1敲除效率的评估为了评估多个供体的切割效率,将使用具有靶向结构域cgacuggccagggcgccugu(seqidno:582)的grna所制备的靶向pdcd1的rnp电穿孔到来自多个供体的活化的原代cd4+t细胞中。作为对照,使用具有aavs1靶向结构域(seqidno:387)的grna制备的对照rnp所制备的rnp也被电穿孔到活化的原代cd4+t细胞中。然后使用pe缀合的抗pd-1抗体通过流式细胞术(facs)来评估pd-1表达。将先前从健康供体分离的原代cd4+t细胞解冻并使用抗cd3/抗cd28珠活化,同时在含有il-2、il-7和il-15的t细胞培养基中进行培养。在活化48小时后,将珠从细胞中取出并在用rnp以1μg/100,000个细胞的剂量进行电穿孔之前再培育24小时。培育若干天(在3至4天之间)后,用抗cd3/抗cd28珠或pma/离子霉素(pma/io)再刺激细胞。在抗cd3/抗cd28活化的情况下,将细胞与珠一起孵育48小时,并在24小时后通过facs评估pd-1表达。在pma/io活化的情况下,将细胞在pma/io的存在下培养24小时,然后通过facs评估pd-1表达。根据可在biolegend网站上获得的“细胞表面免疫荧光染色方案(cellsurfaceimmunofluorescencestainingprotocol)”(www.biolegend.com/media_assets/support_protocol/biolegend_surface_staining_flow_protocol_091012.pdf,并且将其通过引用以其整体并入本文),使用pe缀合的抗pd-1抗体(可从加利福尼亚州(ca)的博奇公司(biolegend)获得)来评估pd-1表达。用于t细胞分选的门控参数如文献(例如参见,d.davies,cellsortingbyflowcytometry[通过流式细胞术进行细胞分选],第257-276页,于flowcytometry:principlesandapplications[流式细胞术:原理和应用]中,m.g.macey编辑,2007humanapressinc.[胡玛纳出版社公司],totowa[托托瓦],nj[新泽西州],将其通过引用以其整体并入本文)所述的基于一个或多个通道中的荧光信号以及前向和侧向散射来设置。无论活化条件如何,在aavs1编辑的或未处理的对照群体中评估pd-1的表达。在图24a中,绘制具有pdcd1敲除的细胞的百分比,其中误差条描绘了多个供体的标准差。在上述实验中如通过facs(流式细胞术)所检测到的pd-1表达的实例示于图24b中。在aavs1编辑的或未处理的对照群体中观察到pd-1的上调。在用靶向pdcd1的rnp处理的细胞中,观察到组合物含有大约90%pd-1阴性t细胞,并且在一些供体生成的细胞中观察到>90%pd-1阴性细胞。实例3:pdcd1敲除不会改变t细胞培养物的组成为了评估pdcd1的缺失是否导致cd8+t细胞培养物的组成变化,将使用具有靶向结构域cgacuggccagggcgccugu(seqidno:582)的grna所制备的靶向pdcd1的rnp递送至cd4+/cd8+t细胞的共培养物中。将用rnp(其使用具有aavs1靶向结构域(seqidno:387)的grna制备)处理的cd8+t细胞用作对照。将分离的cd4+和cd8+t细胞用抗cd3/抗cd28珠活化,并在含有il-2、il-7和il-15的t细胞培养基中进行培养。活化48小时后,除去活化珠并将细胞培养过夜。第二天,将细胞用靶向pdcd1或aavs1的rnp进行电穿孔,并在含有il-2、il-7和il-15的t细胞培养基中进行培养。在第4天分离出一部分细胞,以在用抗cd3/抗cd28珠重新活化后通过流式细胞术评估pd-1表达的水平。将细胞的剩余部分(未活化的细胞)在t细胞冷冻培养基中冷冻。为了确定通过缺失pdcd1是否改变了细胞的组成,将aavs1指导物和pdcd1指导物处理的细胞解冻到含有il-2、il-7和il-15的t细胞培养基中。然后用针对cd8、cd62l和cd45ra的抗体将细胞染色,以评估cd8+细胞群体内的亚群(包括例如原初、中枢记忆、效应记忆和终末分化的效应记忆)。在活(基于前向/侧向散射)cd8+细胞上检测的cd62l和cd45ra表面表达水平示于图25中。将基于这两种标记的表达的亚群在等高线图的象限中标记,其中标记每个象限中的细胞百分比。该图显示,与用靶向aavs1的对照rnp处理的细胞相比,用靶向pdcd1的rnp处理的细胞中没有观察到主要变化。实例4:基因工程化以表达嵌合抗原受体(car)的细胞中pdcd1的遗传破坏通过基于免疫亲和力的选择从获自健康供体的人pbmc样品中分离原代人cd4+和cd8+t细胞。在通过慢病毒转导24-48小时用嵌合抗原受体(car)工程化之前,通过在37℃下在含有人血清、il-2(100u/ml)、il-7(10ng/ml)和il-15(5ng/ml)的培养基中用抗cd3/抗cd28试剂培养来刺激所得细胞。将细胞使用含有编码示例性抗cd19car的核酸分子和编码用作转导的替代标记的截短的egfr(egfrt)的核酸的慢病毒载体进行转导,这些核酸分子由编码t2a核糖体开关的序列分开。car包括抗cd19scfv、ig衍生的间隔子、人cd28衍生的跨膜结构域、人4-1bb衍生的细胞内信号传导结构域和人cd3ζ衍生的信号传导结构域。将模拟转导用作阴性对照。转导后,将细胞在含有人血清以及il-2(50u/ml)、il-7(5ng/ml)和il-15(0.5ng/ml)的培养基中培养36-48小时。然后将细胞用使用具有靶向结构域cgacuggccagggcgccugu(seqidno:582)的pdcd1靶向性grna(或具有靶向结构域guccccuccaccccacagug(seqidno:387)的aavs1对照grna)和化脓性链球菌cas9所制备的rnp进行电穿孔。然后将细胞在含有相同浓度的il-2、il-7和il-15的相同培养基中在30℃下培养过夜,然后在37℃下培养至电穿孔后第12-15天。a.car和pd-1表达在用与抗cd3/抗cd28抗体缀合的珠再刺激24小时后,在电穿孔后第12天评估pd-1和car表达的细胞表面表达(如经由替代标记所指示的)。将细胞用抗egfr抗体或抗pd1抗体染色,以通过流式细胞术验证表面上的car表达(如通过替代标记egfrt的表面表达所指示的)和pd-1表达。结果示于图26中。如图18所示,在这些条件下观察到经受用靶向pdcd1的rnp电穿孔的大于90%的cd8+t细胞和大于90%的cd4+t细胞对pd-1的表面表达(包括在car表达群体中)呈阴性(如通过egfrt标记所指示的)。此结果与car转导的和不表达car的cd8+和cd4+细胞中两个等位基因处pdcd1的有效缺失一致。在对照和pd-1阴性细胞两者中也观察到替代标记的表面表达,指示pd-1敲除不会阻止重组替代标记蛋白的表面表达。b.car+pd-1ko细胞的表型评估还通过流式细胞术(评估各种标记(包括指示表型、分化状态和/或活化状态的那些)的表面表达)来评估修饰的工程化cd4+和cd8+t细胞的表型特征。如上所述,将细胞用对ccr7、41bb、tim3、cd27、cd45ra、cd45ro、lag3、cd62l、cd25和cd69具有特异性的抗体(除了识别pd-1和egfrt标记(car表达的替代物)的那些外)染色。确定每种t细胞亚型cd4+和cd8+的每个亚群(car+/pd1+;car+/pd1-;car-/pd1+;和car-/pd1-)中针对每种标记检测到的平均荧光强度。如图27a(cd4+)和图27b(cd8+)中所示的结果指示在测试的条件下,在pd-1阴性的表达car的细胞(car+/pd1-)和pd-1阳性的表达car的细胞(car+/pd1+)中各种标记的表达水平相似。c.在car-t细胞中的pdcd1缺失通过核酸酶诱导的非同源末端连接(nhej)进行的pdcd1基因座的破坏可导致在nhej修复位点处的dna序列中存在插入和/或缺失(indel)突变。使用miseq测序仪(亿明达公司(illumina))在初次扩增后第20天和第二次扩增后10天分析如上所述的被工程化且经受缺失的t细胞中indel的存在。确定pdcd1基因座处的indel的数量及与通过pdcd1靶向性grna引入的pdcd1切割位点相比的其相对位置。如图28a所示,超过90%的car+t细胞和已经用pdcd1靶向性cas9/grnarnp电穿孔的模拟转导的t细胞在初次和第二次扩增后在pdcd1基因座处含有indel。相比之下,在用对照gaasv1靶向性cas9/grnarnp电穿孔的细胞中未检测到pdcd1indel。如图28b所示的,插入和缺失发生在由pdcd1靶向性grna指导的切割位点上或其附近(即,在上游或下游50个碱基对内)。结果证明,在这些条件下,pdcd1靶向性grna在超过90%的表达car的t细胞中影响pdcd1的遗传破坏,并且该破坏通过多次扩增是稳定的。实例5:pdcd1缺失的表达car的t细胞的功能活性将如实例4所述产生的表达示例性抗cd19car并敲除表达pd-1基因的基因工程化人t细胞(cd8+或cd4+)针对各种功能反应进行评估。a.细胞溶解活性如上文实例4所述进行转导(和模拟转导)和pdcd1(或对照)缺失。然后评估细胞对抗表达cd19抗原的k562靶细胞(k562-cd19)或表达对照抗原(ror1)的非特异性cd19阴性k562对照细胞(k562-ror)的细胞溶解活性。在nucred染料的存在下,将t细胞与靶细胞(k562-cd19或k562-ror1)以4:1的效应物:靶标比率孵育。使用incucyte定量细胞分析系统(埃森生物科学公司(essenbioscience))通过评估nucred染料的细胞染色强度,在70小时内测量靶细胞的裂解。发生裂解的细胞表现出染料的染色强度降低。结果显示,表达car的t细胞(例如car+/pd1+、car+/pd1-和car+/aavs1-)能够以靶抗原特异性方式杀死表达cd19的靶细胞至相似程度。在与表达非特异性抗原的靶细胞一起孵育后,任何这些细胞中没有观察到细胞裂解。结果证明,在这些条件下,pdcd1的缺失不会影响表达抗cd19car的t细胞的car介导的细胞毒活性。b.t细胞扩增通过流式细胞术评估与表达cd19的靶细胞一起孵育后t细胞的增殖。将经受使用具有如上所述生成的靶向pdcd1(或aavs1对照)的指导物的rnp进行缺失的表达car的cd8+或cd4+t细胞(或模拟对照)用celltracetm紫(赛默飞世尔公司(thermofisher))细胞增殖测定染料进行标记。将细胞洗涤并与相同的靶细胞(k562-cd19或k562-ror)以1:1的效应物:靶标比率一式三份地孵育96小时。如通过流式细胞术所评估的,通过celltracetm紫染料稀释指示活t细胞的分裂。如图29所示,表达抗cd19car的cd4+和cd8+t细胞(有或没有pdcd1缺失)在与k562-cd19共培养后以抗原特异性方式增殖至相似程度。因此,结果证明,在这些条件下,car+t细胞可以在缺失pdcd1后以car抗原特异性方式增殖。c.细胞因子释放在将各种细胞与表达抗原的细胞和对照靶细胞一起孵育后,也评估了细胞因子的释放。将如上所述生成的经受pdcd1靶向性或aavs1靶向性缺失或未转染(ut)的表达car的t细胞(和模拟对照)与靶细胞(k562-cd19或k562-ror)以4:1的效应物:靶标比率一式三份地共培养。将共培养的细胞孵育约24小时,然后收集上清液,使用多重细胞因子免疫测定(细观发现公司(mesoscalediscovery))测量ifn-γ、tnf-α或il-2。结果如图30a(ifn-γ)、图30b(tnf-α)和图30c(il-2)所示。结果显示,在这些条件下,在与表达cd19的靶细胞一起孵育后,pdcd1缺失的和表达car的对照t细胞以抗原特异性方式分泌相似水平的细胞因子。实例6:grna的克隆和初步筛选可以如本实例所述的评估候选grna的适合性。尽管针对嵌合grna进行了描述,该方式也可用于评估模块化grna。将grna克隆到载体中对于每种grna,设计并获得一对重叠的寡核苷酸。将寡核苷酸退火并连接到含有上游u6启动子和长嵌合grna的剩余序列的消化载体主链中。对质粒进行序列验证并准备好以生成足够量的转染质量的dna。替代启动子可用于驱动体内转录(例如,h1启动子)或用于体外转录(例如,t7启动子)。在线性dsdna分子中克隆grna(stitchr)对于每种grna,设计并获得单个寡核苷酸。将u6启动子和grna支架(例如包括除靶向结构域之外的所有物质,例如包括衍生自crrna和tracrrna的序列,例如包括第一互补结构域;连接结构域;第二互补结构域;近端结构域;和尾结构域)分别进行pcr扩增并纯化为dsdna分子。将grna特异性寡核苷酸用于pcr反应以将u6和grna支架缝合在一起,通过寡核苷酸中指定的靶向结构域连接。纯化所得dsdna分子(stitchr产物)用于转染。替代启动子可用于驱动体内转录(例如,h1启动子)或用于体外转录(例如,t7启动子)。任何grna支架可用于产生与来自任何细菌物种的cas9相容的grna。初步grna筛选将待测试的每种grna与表达cas9的质粒和少量表达gfp的质粒一起转染到人细胞中。在初步实验中,这些细胞可以是永生化的人细胞系,例如293t、k562或u2os。可替代地,可以使用原代人细胞。在这种情况下,细胞可能与最终的治疗细胞靶(例如,红细胞样细胞)相关。使用类似于潜在治疗性靶细胞群体的原代细胞可以在内源染色质和基因表达的背景下提供关于基因靶向率的重要信息。可以使用脂质转染(例如lipofectamine或fugene)或通过电穿孔(例如lonzanucleofection)进行转染。转染后,可以通过荧光显微镜或流式细胞术确定gfp表达,以确认一致其高水平的转染。这些初步转染可以包含不同grna和不同靶向方式(17聚体、20聚体、核酸酶、双切口酶等)以确定哪些grna/grna组合产生最大活性。可以通过t7e1型测定或通过测序在靶基因座处测量nhej诱导的indel形成来评估每种grna的切割效率。可替代地,也可以使用其他错配敏感性酶,例如celi/surveyor核酸酶。对于t7e1测定,pcr扩增子大约为500-700bp,并且预期的切割位点不对称地放置在扩增子中。在pcr产物的扩增、纯化和尺寸验证之后,通过加热至95℃然后缓慢冷却使dna变性并重新杂交。然后用识别并切割非完全匹配的dna的t7内切核酸酶i(或其他错配敏感性酶)消化杂交的pcr产物。如果在原始模板dna中存在indel,当扩增子变性并再退火时,这导致携带不同indel的dna链的杂交,并且因此导致不完全匹配的双链dna。消化产物可通过凝胶电泳或通过毛细管电泳可视化。切割的dna的分数(切割产物的密度除以切割和未切割的密度)可用于使用以下等式来估计nhej百分比:%nhej=(1-(1-切割的分数)1/2)。t7e1测定的敏感性低至约2%-5%nhej。可以使用测序代替t7e1测定,或除其之外还使用测序。对于sanger测序,将纯化的pcr扩增子克隆到质粒主链中,转化,微量制备并用单一引物测序。在通过t7e1确定nhej率后,可以使用sanger测序来确定indel的确切性质。还可以使用下一代测序技术进行测序。当使用下一代测序时,扩增子可以是300-500bp,并且预期的切割位点不对称地放置。在pcr之后,可以将下一代测序衔接子和条形码(例如illumina多重衔接子和索引)添加至扩增子的末端,例如用于高通量测序(例如在illuminamiseq上)。此方法允许检测非常低的nhej率。实例7:通过nhej评估基因靶向可以选择在初步测试中诱导最高水平的nhej的grna用于进一步评估基因靶向效率。在这种情况下,细胞来源于疾病受试者,因此具有相关突变。转染后(通常在转染后2-3天),可以从大量转染细胞中分离基因组dna,并且pcr可以用于扩增靶区域。在pcr之后,可以通过测序来确定基因靶向效率以生成所希望的突变(靶基因的敲除或靶序列基序的去除)。对于sanger测序,pcr扩增子可以为500-700bp长。对于下一代测序,pcr扩增子可以为300-500bp长。如果目的是敲除基因功能,则可以使用测序来评估经历nhej诱导的indel(其导致预期会破坏基因功能的移码或大的缺失或插入)的等位基因的百分比。如果目的是去除特定序列基序,则可以使用测序来评估经历跨越此序列的nhej诱导的缺失的等位基因的百分比。实例8:在293细胞中grna的筛选针对t细胞受体β(trbc)的grna的筛选为了鉴定具有最高中靶nhej效率的grna,选择42种化脓性链球菌和27种金黄色葡萄球菌grna(表3000)。通过pcrstitchr反应生成由u6启动子、grna靶区域和适当的tracr序列(化脓性链球菌或金黄色葡萄球菌)组成的dna模板。随后使用lipofectamine3000将此dna模板与编码cmv启动子下游的适当的cas9(化脓性链球菌或金黄色葡萄球菌)的dna质粒一起转染到293细胞中。转染后48-72小时从细胞中分离基因组dna。为了确定t细胞受体β基因(trbc)处的修饰率,使用用表4000中列出的引物的基因座pcr来扩增靶区域。pcr扩增后,对pcr产物进行t7e1测定。简言之,此测定涉及熔化pcr产物,然后进行再退火步骤。如果发生了基因修饰,则由于一些频率的插入或缺失,将存在作为不完全匹配的双链产物。这些双链产物对错配位点处通过t7内切核酸酶1酶的切割敏感。因此,可以通过分析t7e1切割的量来确定cas9/grna复合物的切割效率。用于提供t7e1切割的%nhej的测量值的公式如下:(100*(1-((1-(切割的分数))^0.5)))。此分析的结果如图11和图12所示。表3000表4000针对t细胞受体α(trac)的grna的筛选为了鉴定具有最高中靶nhej效率的grna,选择18种化脓性链球菌和13种金黄色葡萄球菌grna(表5000)。通过pcrstitchr反应生成由u6启动子、grna靶区域和适当的tracr序列(化脓性链球菌或金黄色葡萄球菌)组成的dna模板。随后使用lipofectamine3000将此dna模板与编码cmv启动子下游的适当的cas9(化脓性链球菌或金黄色葡萄球菌)的dna质粒一起转染到293细胞中。转染后48-72小时从细胞中分离基因组dna。为了确定t细胞受体α基因(trac)处的修饰率,使用用表6000中列出的引物的基因座pcr来扩增靶区域。pcr扩增后,对pcr产物进行t7e1测定。简言之,此测定涉及熔化pcr产物,然后进行再退火步骤。如果发生了基因修饰,则由于一些频率的插入或缺失,将存在作为不完全匹配的双链产物。这些双链产物对错配位点处通过t7内切核酸酶1酶的切割敏感。因此,可以通过分析t7e1切割的量来确定cas9/grna复合物的切割效率。用于提供t7e1切割的%nhej的测量值的公式如下:(100*(1-((1-(切割的分数))^0.5)))。此分析的结果如图13和图14所示。表5000表6000针对pdcd1基因的grna的筛选为了鉴定具有最高中靶nhej效率的grna,选择48种化脓性链球菌和27种金黄色葡萄球菌grna(参见表7000a和7000b)。通过pcrstitchr反应生成由u6启动子、grna靶区域和适当的tracr序列(化脓性链球菌或金黄色葡萄球菌)组成的dna模板。随后使用lipofectamine3000将此dna模板与编码cmv启动子下游的适当的cas9(化脓性链球菌或金黄色葡萄球菌)的dna质粒一起转染到293细胞中。转染后48-72小时从细胞中分离基因组dna。为了确定pd-1基因(pdcd1)处的修饰率,使用用表7000c中列出的引物的基因座pcr来扩增靶区域。pcr扩增后,对pcr产物进行t7e1测定。简言之,此测定涉及熔化pcr产物,然后进行再退火步骤。如果发生了基因修饰,则由于一些频率的插入或缺失,将存在作为不完全匹配的双链产物。这些双链产物对错配位点处通过t7内切核酸酶1酶的切割敏感。因此,可以通过分析t7e1切割的量来确定cas9/grna复合物的切割效率。用于提供t7e1切割的%nhej的测量值的公式如下:(100*(1-((1-(切割的分数))^0.5)))。表7000a中所示的grna的此分析的结果如图15和图16所示。可以用本文所述的其他grna(包括表7000b中所示的那些)进行类似的实验。表7000a表7000b表7000c引物名称序列外显子seqidno:gwed259cactgcctctgtcactctcgpd1_外显子_1_5'556gwed260agggactgagagtgaaaggtpd1_外显子_1_3'557jfpr004caggatgcccaagggtcagpd1_外显子_2_5'558jfpr004rggagctcctgatcctgtgcpd1_外显子_2_3'559gwed257aatggtgaccggcatctctgpd1_外显子_3_5'560jfpr005ctgcacaggatcaggagctcpd1_外显子_3_5'561jfpr005ragaatgtgagtcctgcaggcpd1_外显子_3_3'562实例9:grna的酶促合成和递送至原代t细胞将cas9mrna和grna作为rna分子递送至t细胞为了证明原代cd4+t细胞中cas9介导的切割,将化脓性链球菌cas9和针对tcrβ链(trbc-210(gcgcugacgaucugggugac)(seqidno:413))或tcrα链(trac-4(gcugguacacggcaggguca)(seqidno:453))设计的grna作为rna分子经由电穿孔递送至t细胞。在此实施例中,使用t7聚合酶体外转录cas9和grna两者。在转录(同时在通过大肠杆菌聚a聚合酶转录后向rna种类的3'末端添加聚a尾)的同时地向两种rna种类中添加5’arca帽。为了生成在trbc1和trbc2基因座处修饰的cd4+t细胞,通过电穿孔将10ug的cas9mrna和10ug的trbc-210(gcgcugacgaucugggugac)(seqidno:413))grna引入细胞中。在同一实验中,我们还通过引入10ug的cas9mrna与10ug的trac-4(gcugguacacggcaggguca)(seqidno:453)grna来靶向trac基因。将靶向aavs1(guccccuccaccccacagug)(seqidno:51201)基因组位点的grna用作实验对照。在电穿孔之前,将t细胞在补充有10%fbs和重组il-2的rpmi1640中进行培养。将细胞使用cd3/cd28珠活化并扩增至少3天。在将mrna引入活化的t细胞中后,在电穿孔后24、48和72小时通过流式细胞术使用对cd3具有特异性的荧光素(apc)缀合的抗体来监测细胞上的cd3表达。在72小时,观察到cd3阴性细胞群体(图17a和图17b)。为了证实cd3阴性细胞的生成是trbc基因座处基因组编辑的结果,收获基因组dna并进行t7e1测定。实际上,数据证实在trbc2基因座和trac基因座处存在dna修饰(图17c)。将cas9/grnarnp递送至t细胞为了证明在jurkatt细胞中cas9介导的切割,将金黄色葡萄球菌cas9和针对tcrα链(trac-233(gugaauaggcagacagacuuguca)(seqidno:474))设计的grna作为核糖核酸蛋白复合物(rnp)通过电穿孔递送。在此实施例中,cas9在大肠杆菌中表达并纯化。具体地,将编码cas9的hj29质粒转化到rosettatm2(de3)化学感受态细胞(emdmillipore#71400-4)中,并铺板到具有适当的抗生素的lb平板上用于选择,并在37℃下孵育过夜。将具有适当抗生素的脑心浸液肉汤(teknova#b9993)的10ml起子培养物用4个菌落接种,并使其在37℃下以220rpm振荡生长。在过夜生长后,将起子培养物添加至具有适当抗生素和补充物的1lterrificbrothcomplete(teknova#t7060)中,并在37℃下以220rpm振荡生长。将温度逐渐降至18℃,当od600大于2.0时,通过添加iptg至0.5mm诱导基因表达。允许继续诱导过夜,然后将细胞通过离心收集并重悬于tg300(50mmtrisph8.0、300mmnacl、20%甘油、1mmtcep、蛋白酶抑配制剂片剂(thermoscientific#88266))中并储存于-80℃。将细胞通过解冻冷冻的悬浮液来裂解,然后两次通过设定为18000psi的lm10经由离心澄清提取物,并通过与ni-nta琼脂糖树脂(qiagen#30230)在4℃下分批孵育来捕获可溶性提取物。将浆液倒入重力流动柱中,用tg300+30mm咪唑洗涤,然后用tg300+300mm咪唑洗脱目的蛋白质。将ni洗脱液用等体积的hg100(50mmhepesph7.5、100mmnacl、10%甘油、0.5mmtcep)稀释,并加载到hitrapsphp柱(gehealthcarelifesciences#17-1152-01)上,并用从hg100至hg1000(50mmhepesph7.5、1000mmnacl、10%甘油、0.5mmtcep)的30柱体积梯度进行洗脱。将适当的级分在用sds-page凝胶测定后进行合并,并且浓缩以装载到在hg150(10mmhepesph7.5、150mmnacl、20%甘油、1mmtcep)中平衡的srt10sec300柱(sepax#225300-21230)上。将级分通过sds-page测定并且适当合并,浓缩到至少5mg/ml。使用t7聚合酶通过体外转录生成grna。在转录(同时在通过大肠杆菌聚a聚合酶转录后向rna种类的3'末端添加聚a尾)的同时地向rna中添加5’arca帽。在引入细胞中之前,将纯化的cas9和grna混合并允许形成复合物持续10分钟。随后通过电穿孔将rnp溶液引入jurkatt细胞中。在电穿孔之前和之后,将细胞在补充有10%fbs的rpmi1640培养基中进行培养。在电穿孔后24、48和72小时通过流式细胞术使用对cd3具有特异性的荧光素缀合的抗体来监测细胞上的cd3表达。在48和72小时,观察到cd3阴性细胞群体(图18a和图18b)。为了证实cd3阴性细胞的生成是trac基因座处基因组编辑的结果,收获基因组dna并进行t7e1测定。实际上,数据证实在trac基因座处存在dna修饰(图18c)。实例10:评估grna修饰对t细胞活力的影响为了评估grna修饰如何影响t细胞活力,将化脓性链球菌cas9mrna与aavs1grna(guccccuccaccccacagug)(seqidno:387)(有或没有修饰)组合地递送至jurkatt细胞。具体地,分析了4种不同修饰组合,(1)具有5'抗反向帽类似物(arca)帽和聚a尾的grna(参见图19),(2)仅具有5’arca帽的grna,(3)仅具有聚a尾的grna,(4)没有任何修饰的grna。为了生成所有四种前述形式的修饰的grna,dna模板包含t7启动子、aavs1grna靶序列(guccccuccaccccacagug)(seqidno:387)和化脓性链球菌tracr序列。对于所有grna,将t7聚合酶用于在7.5mmutp、7.5mmgtp、7.5mmctp和7.5mmatp的存在下生成grna。为了用5’arca帽修饰grna,将6.0mm的arca类似物添加至ntp池中。因此,仅添加1.5mm的gtp,而其余的ntp池保持相同的浓度:7.5mmutp、7.5mmctp和7.5mmatp。为了向grna中添加聚a尾,使用从大肠杆菌纯化的重组聚a聚合酶,在体外聚合酶反应终止后,在转录的grna末端添加一系列a。通过用dna酶i除去dna模板来实现终止。将聚a尾反应进行大约40分钟。无论grna修饰如何,所有grna制剂均通过苯酚:氯仿提取然后进行异丙醇沉淀来纯化。一旦生成grna,用化脓性链球菌cas9mrna(用5’arca帽和聚a尾修饰)和4种不同的修饰的aavs1特异性grna之一对jurkatt细胞进行电穿孔。电穿孔后,通过进行膜联蛋白-v和碘化丙啶双染色来确定细胞活力。通过流式细胞术来确定未针对膜联蛋白-v和pi染色的活细胞的分数。结果在图20中定量。基于活细胞的分数,可以得出结论,当通过电穿孔引入时,已经用5’arca帽和聚a尾两者修饰的grna对jurkatt细胞的毒性最小。实例11:将cas9/grnarnp递送至原初t细胞为了证明在原初t细胞中cas9介导的切割,将金黄色葡萄球菌cas9和针对tcrα链(具有靶向结构域gugaauaggcagacagacuuguca(seqidno:474))设计的grna作为核糖核酸蛋白复合物(rnp)通过电穿孔递送。在此实施例中,cas9在大肠杆菌中表达并纯化。具体地,将编码cas9的hj29质粒转化到rosettatm2(de3)化学感受态细胞(emdmillipore#71400-4)中,并铺板到具有适当的抗生素的lb平板上用于选择,并在37℃下孵育过夜。将具有适当抗生素的脑心浸液肉汤(teknova#b9993)的10ml起子培养物用4个菌落接种,并使其在37℃下以220rpm振荡生长。在过夜生长后,将起子培养物添加至具有适当抗生素和补充物的1lterrificbrothcomplete(teknova#t7060)中,并在37℃下以220rpm振荡生长。将温度逐渐降至18℃,当od600大于2.0时,通过添加iptg至0.5mm诱导基因表达。允许继续诱导过夜,然后将细胞通过离心收集并重悬于tg300(50mmtrisph8.0、300mmnacl、20%甘油、1mmtcep、蛋白酶抑配制剂片剂(thermoscientific#88266))中并储存于-80℃。将细胞通过解冻冷冻的悬浮液来裂解,然后两次通过设定为18000psi的lm10经由离心澄清提取物,并通过与ni-nta琼脂糖树脂(qiagen#30230)在4℃下分批孵育来捕获可溶性提取物。将浆液倒入重力流动柱中,用tg300+30mm咪唑洗涤,然后用tg300+300mm咪唑洗脱目的蛋白质。将ni洗脱液用等体积的hg100(50mmhepesph7.5、100mmnacl、10%甘油、0.5mmtcep)稀释,并加载到hitrapsphp柱(gehealthcarelifesciences#17-1152-01)上,并用从hg100至hg1000(50mmhepesph7.5、1000mmnacl、10%甘油、0.5mmtcep)的30柱体积梯度进行洗脱。将适当的级分在用sds-page凝胶测定后进行合并,并且浓缩以装载到在hg150(10mmhepesph7.5、150mmnacl、20%甘油、1mmtcep)中平衡的srt10sec300柱(sepax#225300-21230)上。将级分通过sds-page测定并且适当合并,浓缩到至少5mg/ml。使用t7聚合酶通过体外转录生成具有靶向结构域gugaauaggcagacagacuuguca(seqidno:474)的grna。在转录(同时在通过大肠杆菌聚a聚合酶转录后向rna种类的3'末端添加聚a尾)的同时地向rna中添加5’arca帽。在此实施例中,通过ficoll梯度从新鲜脐带血中分离t细胞,然后使用cd3磁珠进行阳性选择。随后将细胞在补充有10%fbs、il-7(5ng/ml)和il-15(5ng/ml)的rpmi1640培养基中进行培养。分离24小时后,将细胞用rnp溶液(通过在室温下孵育纯化的cas9和grna持续10分钟而生成)进行电穿孔。在电穿孔后96小时通过流式细胞术使用对cd3具有特异性的apc缀合的抗体来监测细胞上的cd3表达。相对于接受grna和非功能性cas9的阴性对照,在提供功能性rnp复合物的细胞中观察到cd3阴性细胞群体(图21a和图21b)。为了证实cd3阴性细胞的生成是trac基因座处基因组编辑的结果,收获基因组dna并进行t7e1测定。实际上,数据证实在trac基因座处存在dna修饰(图21c)。实例12:通过将cas9mrna和grna作为rna分子或作为cas9/grnarnp递送至jurkatt细胞来靶向pdcd1基因座将cas9mrna和grna作为rna分子递送至jurkatt细胞为了证明在jurkatt细胞中pdcd1基因座处的cas9介导的切割,将化脓性链球菌cas9和针对pdcd1基因座设计的grna(具有靶向结构域gucugggcggugcuacaacu(seqidno:508))作为rna分子经由电穿孔递送至t细胞。在此实施例中,使用t7聚合酶体外转录cas9和grna两者。在转录(同时在通过大肠杆菌聚a聚合酶转录后向rna种类的3'末端添加聚a尾)的同时地向两种rna种类中添加5’arca帽。为了生成在pdcd1基因座处修饰的jurkatt细胞,通过电穿孔将10ug的cas9mrna和10ug的grna(具有靶向结构域gucugggcggugcuacaacu(seqidno:508))引入细胞中。在电穿孔之前,将t细胞在补充有10%fbs的rpmi1640中进行培养。在24、48和72小时,分离基因组dna并在pdcd1基因座处进行t7e1测定。实际上,数据证实在pdcd1基因座处存在dna修饰(图22)。将cas9/grnarnp递送至jurkatt细胞为了证明在jurkatt细胞中pdcd1基因座处的cas9介导的切割,将化脓性链球菌cas9和针对pdcd1基因座涉及的grna(具有靶向结构域gucugggcggugcuacaacu(seqidno:508))作为核糖核酸蛋白复合物(rnp)通过电穿孔递送。在此实施例中,cas9在大肠杆菌中表达并纯化。具体地,将编码cas9的hj29质粒转化到rosettatm2(de3)化学感受态细胞(emdmillipore#71400-4)中,并铺板到具有适当的抗生素的lb平板上用于选择,并在37℃下孵育过夜。将具有适当抗生素的脑心浸液肉汤(teknova#b9993)的10ml起子培养物用4个菌落接种,并使其在37℃下以220rpm振荡生长。在过夜生长后,将起子培养物添加至具有适当抗生素和补充物的1lterrificbrothcomplete(teknova#t7060)中,并在37℃下以220rpm振荡生长。将温度逐渐降至18℃,当od600大于2.0时,通过添加iptg至0.5mm诱导基因表达。允许继续诱导过夜,然后将细胞通过离心收集并重悬于tg300(50mmtrisph8.0、300mmnacl、20%甘油、1mmtcep、蛋白酶抑配制剂片剂(thermoscientific#88266))中并储存于-80℃。将细胞通过解冻冷冻的悬浮液来裂解,然后两次通过设定为18000psi的lm10经由离心澄清提取物,并通过与ni-nta琼脂糖树脂(qiagen#30230)在4℃下分批孵育来捕获可溶性提取物。将浆液倒入重力流动柱中,用tg300+30mm咪唑洗涤,然后用tg300+300mm咪唑洗脱目的蛋白质。将ni洗脱液用等体积的hg100(50mmhepesph7.5、100mmnacl、10%甘油、0.5mmtcep)稀释,并加载到hitrapsphp柱(gehealthcarelifesciences#17-1152-01)上,并用从hg100至hg1000(50mmhepesph7.5、1000mmnacl、10%甘油、0.5mmtcep)的30柱体积梯度进行洗脱。将适当的级分在用sds-page凝胶测定后进行合并,并且浓缩以装载到在hg150(10mmhepesph7.5、150mmnacl、20%甘油、1mmtcep)中平衡的srt10sec300柱(sepax#225300-21230)上。将级分通过sds-page测定并且适当合并,浓缩到至少5mg/ml。使用t7聚合酶通过体外转录生成具有靶向结构域gucugggcggugcuacaacu(seqidno:508)的grna。在转录(同时在通过大肠杆菌聚a聚合酶转录后向rna种类的3'末端添加聚a尾)的同时地向rna中添加5’arca帽。在引入细胞中之前,将纯化的cas9和grna混合并允许形成复合物持续10分钟。随后通过电穿孔将rnp溶液引入jurkatt细胞中。在电穿孔之前和之后,将细胞在补充有10%fbs的rpmi1640培养基中进行培养。在24、48和72小时,分离基因组dna并在pdcd1基因座处进行t7e1测定。实际上,数据证实在pdcd1基因座处存在dna修饰(图22)。实例13:化脓性链球菌cas9蛋白的纯化cas9在大肠杆菌中表达并纯化。具体地,将编码cas9的hj29质粒转化到rosettatm2(de3)化学感受态细胞(emdmillipore#71400-4)中,并铺板到具有适当的抗生素的lb平板上用于选择,并在37℃下孵育过夜。将具有适当抗生素的脑心浸液肉汤(teknova#b9993)的10ml起子培养物用4个菌落接种,并使其在37℃下以220rpm振荡生长。在过夜生长后,将起子培养物添加至具有适当抗生素和补充物的1lterrificbrothcomplete(teknova#t7060)中,并在37℃下以220rpm振荡生长。将温度逐渐降至18℃,当od600大于2.0时,通过添加iptg至0.5mm诱导基因表达。允许继续诱导过夜,然后将细胞通过离心收集并重悬于tg300(50mmtrisph8.0、300mmnacl、20%甘油、1mmtcep、蛋白酶抑配制剂片剂(thermoscientific#88266))中并储存于-80℃。将细胞通过解冻冷冻的悬浮液来裂解,然后两次通过设定为18000psi的lm10经由离心澄清提取物,并通过与ni-nta琼脂糖树脂(qiagen#30230)在4℃下分批孵育来捕获可溶性提取物。将浆液倒入重力流动柱中,用tg300+30mm咪唑洗涤,然后用tg300+300mm咪唑洗脱目的蛋白质。将ni洗脱液用等体积的hg100(50mmhepesph7.5、100mmnacl、10%甘油、0.5mmtcep)稀释,并加载到hitrapsphp柱(gehealthcarelifesciences#17-1152-01)上,并用从hg100至hg1000(50mmhepesph7.5、1000mmnacl、10%甘油、0.5mmtcep)的30柱体积梯度进行洗脱。将适当的级分在用sds-page凝胶测定后进行合并,并且浓缩以装载到在hg150(10mmhepesph7.5、150mmnacl、20%甘油、1mmtcep)中平衡的srt10sec300柱(sepax#225300-21230)上。将级分通过sds-page测定并且适当合并,浓缩到至少5mg/ml。将等分试样储存在-80℃。实例14:grna的体外转录通过pcr来组装编码修饰的t7启动子、grna靶序列和嵌合化脓性链球菌grna支架的dna模板。用于pcr的5'有义引物由修饰的t7启动子、grna靶向序列(其基于所希望的靶位点针对每种grna进行修饰)和来自化脓性链球菌grnatracr序列的5'末端的序列(gttttagagctagaaata(seqidno:51205))组成。3'反义引物(aaaagcaccgactcggtgccactttttcaagttgata(seqidno:51206))是化脓性链球菌grnatracr序列的3'末端的反向互补体。用于pcr反应的dna模板是含有化脓性链球菌grnatracr序列的质粒。因此,用作靶特异性grna的体外转录的dna模板的扩增的pcr产物编码以下:修饰的t7启动子-grna靶序列-化脓性链球菌嵌合grna支架(即,修饰的t7启动子,然后是grna)。鉴于t7rna聚合酶需要g以启动转录,t7启动子典型地在其3'末端具有两个g以确保启动子下游的整个rna序列的转录。然而,结果是产生的转录物可以含有至少一个(如果不是两个)来自启动子序列的g,这可能改变grna特异性或grna与cas9蛋白之间的相互作用。为了解决在grna靶序列以g起始的情况下的这种担忧,通过使用包括以下修饰的t7启动子序列:taatacgactcactata(seqidno:51203)的5’有义引物,从grnapcr模板中的以下t7启动子序列taatacgactcactatagg(seqidno:51202)中去除两个gg。对于不以g起始的grna靶序列,将grnapcr模板中编码的t7启动子序列进行修饰,使得通过使用包括以下修饰的t7启动子序列:taatacgactcactatag(seqidno:51204)的5'有义引物去除t7启动子的3'末端的仅一个g。用messagemachinetmt7超转录试剂盒(ambion公司)通过dna模板的体外转录来生成grna。在实例10中,在体外转录过程中将arca帽添加至grna的5'末端,然后用e-pap处理,其在grna序列的末端添加聚a尾,因此,将实例10中使用的所有grna在5'末端处用arca帽进行修饰,并且在3'末端出用聚a尾进行修饰。对于实例11-13中所述的所有实验,从grnapcr模板体外转录grna,该模板编码修饰的t7启动子、grna和grna3’处的聚a尾(20a)。在体外转录过程中将arca帽添加至grna的5'末端,因此,将实例11-13中所有grna在5'末端用arca帽进行修饰,并且在3'末端用聚a尾进行修饰。修饰的t7启动子序列不限于本文所述的序列。例如,t7启动子序列(及其修饰)可以是标准生物组件登记册(registryofstandardbiologicalparts)(位于以下http://地址:parts.igem.org/promoters/catalog/t7)的“启动子/目录t7(promoters/catalog/t7)”中提到的至少任何序列。应理解的是,本披露涵盖通过体外转录从dna模板制备本发明的grna的方法,该模板包括如本文所述的修饰的t7启动子,其中已去除一个或多个3'末端g(例如,其中序列taatacgactcactatag(seqidno:51204)位于在其5'末端缺乏g的靶序列的紧接上游,或序列taatacgactcactata(seqidno:51203)位于在其5’末端有g的靶序列的紧接上游)。本领域技术人员基于其他t7启动子序列将识别这些修饰的t7启动子的其他变体,包括标准生物组件登记册(位于以下http://地址:parts.igem.org/promoters/catalog/t7,并且通过引用以其整体并入本文)的“启动子/目录/t7”中提到的至少任何序列。实例15:靶向grna对的pdcd1的鉴定为了评估化脓性链球菌切口酶是否可用于生成高百分比的pdcd1阴性t细胞,根据实例8的方法从大肠杆菌中纯化d10a和n863a两种切口酶。使用软件工具,对pdcd1grna进行鉴定并将其定位于pdcd1的基因座处。根据如下两个主要标准来选择grna对用于进一步评估:1)两种grna的pam序列面向外;和2)预测的切割位点(距离pam为4bp)之间的距离大于30bp且小于90bp。如实例9所述,使用基于t7的体外转录反应生成所选的grna。每种grna与d10a切口酶或n863a切口酶复合。在使用dsf验证复合完成后(参见本文第iv章节中的方法),将对应于所列对的两种适当的rnp以1:1的比率组合,并以1ug总rnp/100,000个细胞的剂量电穿孔进入细胞。将rnp在96孔格式中电穿孔到250,000个活化的cd4t细胞中(一式两份地),并且随后在含有il-2、il-7和il-15的t细胞培养基中进行培养。培养3天后,将细胞用pma/io活化24小时,并使用pe缀合的抗人pdcd1抗体通过流式细胞术来评估pdcd1表达。pdcd1阴性细胞的百分比绘制于图31中。若干d10a切口酶对的递送导致>90%的pdcd1阴性细胞,而当与n863a切口酶复合时相同的grna对产生较低但可检测到的pdcd1敲除水平。单种切口酶rnp导致pdcd1表达的可忽略的损失,而与野生型化脓性链球菌复合的单种grna导致如预期的高敲除水平。表8000a和8000b提供了用于各grna对的靶向结构域的细节。表8000a表8000b实例16:在nalm-6播散性肿瘤模型中评估pdcd1缺失的表达car的t细胞的体内活性通过用过表达pd-l1的nalm-6肿瘤细胞系注射nod/scid/gc-/-(nsg)小鼠来生成播散性肿瘤异种移植小鼠模型。具体地,在第零(0)天,给小鼠静脉内(iv)注射过表达pd-l1的nalm6人b细胞前体白血病细胞系并用绿色荧光蛋白和萤火虫荧光素酶(nalm6-pd-l1-ffluc-gfp)转染的5x105个细胞。允许肿瘤移植发生持续4天并使用生物发光成像进行验证。在第4天,八(8)个研究组中每个中的小鼠不接受任何处理或以各种剂量/类型之一接受单次静脉内(i.v.)注射工程化细胞(基本上如实例4所述的生成),如下:(1)不给予细胞(仅肿瘤);(2)用模拟对照载体转导的1x106个aavs1缺失的t细胞;(3)表达抗cd19car+t细胞的5x105个aavs1缺失的细胞;(4)1x106个aavs1缺失的抗cd19car+t细胞;(5)用模拟对照载体转导的1x106个pdcd1缺失的t细胞;(6)5x105个pdcd1缺失的抗cd19car+t细胞;(7)1x106个pdcd1缺失的抗cd19car+t细胞;和(8)经受模拟电穿孔对照的1x106个抗cd19car+t细胞。a.抗肿瘤活性处理后,通过生物发光成像来监测肿瘤随时间的生长,并且大约每5-7天持续至第28天测量平均辐射量(p/s/cm2/sr)。对于生物发光成像,小鼠接受腹膜内(i.p.)注射重悬于pbs中的荧光素底物(马萨诸塞州(ma)霍普金顿(hopkinton)的caliper生命科学公司(caliperlifesciences))(15μg/g体重)。如图32所示,对照小鼠中的肿瘤(单独的肿瘤和用模拟对照转导的aavs1缺失的t细胞或模拟对照转导的pdcd1缺失的t细胞处理的那些)在研究过程中继续生长。相比之下,已经以不同剂量给予表达抗cd19car的工程化t细胞(包括pdcd1缺失的抗cd19car+t细胞)的小鼠在所有测试的处理后时间点表现出平均辐射量的减少。结果指示pdcd1缺失的car+t细胞能够在小鼠癌症模型中阻抑肿瘤生长,并且pdcd1缺失不损害car+t细胞的体内抗肿瘤功能。b.pdcd1敲除细胞的体内扩增和持续性从第一卫星组(satellitegroup)的小鼠获得骨髓样品,并分析对照组以评估给予的pdcd1缺失的细胞的体内扩增和持续性。通过流式细胞术确定绝对cd4+和cd8+t细胞计数(图33a和33b)和绝对pd1+t细胞计数(图34a、34b和34c)。在第9天骨髓中循环cd4+或cd8+细胞数量的结果分别示于图33a和33b中。结果指示pdcd1缺失的car+t细胞在给予后在小鼠模型中扩增并持续,与car+对照(aavs1缺失和模拟电穿孔的)细胞相比具有相似的速率。在第9天在骨髓中观察到的pd1+t细胞(cd3+、cd4+和cd8+)的计数分别示于图34a、34b和34c中。结果与如下结论一致,即在给予具有表达car靶向性抗原的肿瘤的动物和体内扩增后,在car+细胞中维持pdcd1缺失,并且pd-1敲除的car+t细胞在给予后在体内持续存在。实例17:在a549皮下肿瘤模型中评估pdcd1缺失的表达car的t细胞的体内活性通过向nod/scid/gc-/-(nsg)小鼠注射经工程化以表达高水平人cd19的a549肺腺癌细胞,生成皮下肿瘤异种移植小鼠模型。在此研究中,异种移植模型中这些细胞中人cd19的过表达允许在实体瘤的背景下评估cd19特异性的pdcd1car+t细胞。另外地,基于分开的观察结果,即a549肺腺癌细胞可响应于干扰素γ刺激而上调pd-l1,该模型允许在肿瘤环境中评估可响应于ifn-γ而表达pd-l1的cd19特异性pdcd1car+t细胞。在第零(0)天,将a549-hucd19hi细胞皮下植入到免疫缺陷型nsg小鼠中。体外研究证明,在与cd19靶抗原相互作用时,t细胞阴性调节分子pd-1在cart细胞(包括表达抗cd19car的细胞)上被上调。cart细胞上的pd-1与表达cd19的肿瘤细胞上的pd-l1的相互作用可能限制cart细胞的活性。在肿瘤移植后,三(3)个不同处理组中的小鼠接受单次静脉内(i.v.)注射如实例4所述生成的各种4x106个表达抗cd19car的t细胞群体:(1)aavs1缺失的抗cd19car+t细胞;(2)pdcd1缺失的抗cd19car+t细胞;和(3)未经受缺失或电穿孔的抗cd19car+细胞。未注射任何工程化t细胞(仅肿瘤)的小鼠被评估为阴性对照。在car-t细胞给予后第11、14、19、23和26天测量肿瘤体积。结果示于图35中。如所示的,与未处理的对照中观察到的情况相比,观察到每种car+细胞组合物的给予减少此cd19过表达肺腺癌模型中的肿瘤生长。本发明并不旨在将范围限于披露的特定实施例,所披露的特定实施例例如是为了说明本发明的各个方面。根据本文的描述和教导,对所述的组合物和方法的各种修改将变得显而易见。此类变化可以在不脱离本披露的真实范围和精神的情况下实践,并且旨在落入本披露的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 水稻ABA受体OsPYL3基因、其编码蛋白及其应用
- 一株胞内表达枯草芽孢杆菌漆酶的基因工程菌株及实现该菌株分泌表达漆酶的诱导方法
- 检测表皮生长因子受体基因位点突变的荧光定量pcr试剂盒的制作方法
- T1r味觉受体及其编码基因的制作方法
- 放射性配基N<sub>2</sub>S<sub>2</sub>-Memantine和脑受体显像剂<sup>99m</sup>Tc-Memantine的油水分配系数测定方法
- 猕猴雌二醇受体β基因片段及其应用的制作方法
- 一种受体蛋白及其编码基因与应用的制作方法
- 一种水稻乙烯受体类蛋白及其编码基因与应用的制作方法
- 栉孔扇贝TGF-β I型受体基因及其SNP位点的制作方法
- 双峰驼褪黑素受体、编码基因及其获取方法