用于人腹泻症病毒的感染·增殖培养的2D类器官及其使用的制作方法
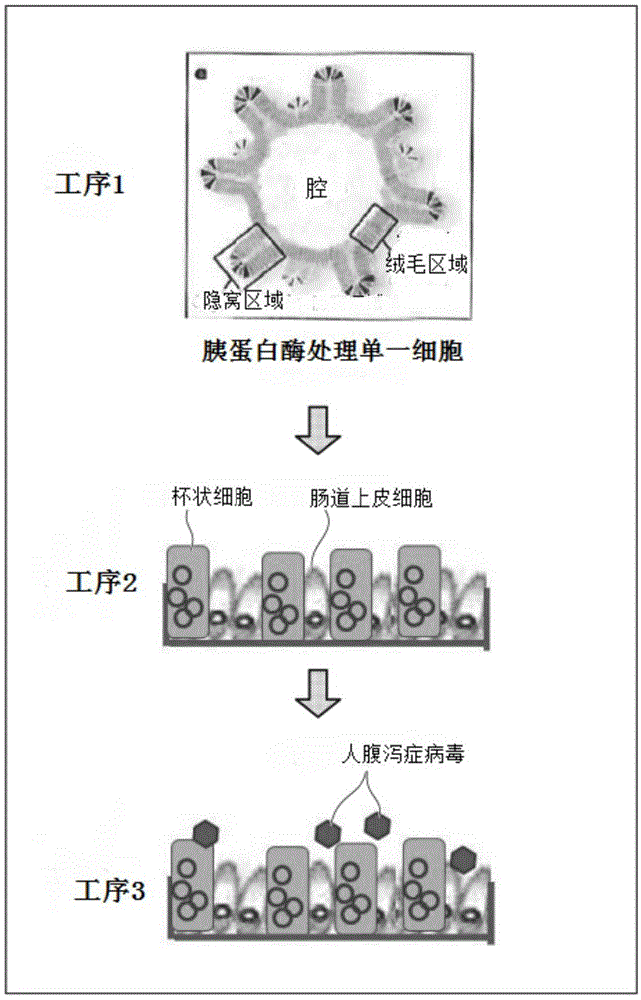
本发明涉及用于人腹泻症病毒的感染·增殖培养的2d类器官及其使用。更详细而言,涉及用于人腹泻症病毒的感染·增殖培养的2d类器官、用于人腹泻症病毒的感染·增殖培养的2d类器官培养物、人腹泻症病毒的制造方法、人腹泻症病毒制造试剂盒、用于人腹泻症病毒的感染·增殖培养的2d类器官培养试剂盒以及用于人腹泻症病毒的感染·增殖培养的2d类器官的制造方法。本申请基于2016年8月24日在日本申请的日本特愿2016-163711号主张优先权,在此引用其内容。
背景技术:
:在感染人诺如病毒等人腹泻症病毒的情况下治疗效果高的抗病毒药尚不存在。多数人腹泻症病毒只能在肠道上皮中感染增殖,因此不能以体外(invitro)方式人工大量生产,成为治疗药开发的大问题。针对该问题,确立了使用小鼠诺如病毒的细胞培养系(例如,参照非专利文献1)。但是,在非专利文献1记载的细胞培养系中,由于不能使用人病毒,因此无法应用于人病毒的研究,人们期待人病毒的细胞培养系的开发。另一方面,人肠道上皮细胞的长期培养长久以来是不可能的。可以认为这是由于维持人肠道上皮干细胞所需的增殖因子不明的缘故。近年来,将人肠道上皮干细胞粘着在细胞外基质上,在包含添加bmp抑制剂、分裂促进增殖因子和wnt激动剂的人细胞用的基础培养基的细胞培养基的存在下进行培养,由此类器官培养获得成功,其长时间维持人肠道上皮干细胞并使其分化(例如,参照专利文献1)。现有技术文献专利文献专利文献1日本专利第5458112号公报。非专利文献非专利文献1环境感染杂志vol.24,no.6,2009。技术实现要素:发明所要解决的课题但是,专利文献1的细胞培养基包含p38抑制剂,因此在使用该培养基的培养方法中,有时会引起分化抑制或细胞死亡,存在改良的余地。本发明的目的在于,为了解决上述课题,提供一种以体外方式大量制造人腹泻症病毒的方法、用于此的类器官以及制造该类器官的方法。用于解决课题的手段本申请的发明人们不断进行为了解决上述课题所需的深入研究,结果发现,通过使用改良来自人小肠的类器官的制造方法而得到的培养类器官,能够使其感染人腹泻症病毒并进行增殖培养,从而完成了本发明。也就是说,本发明包含以下的形态。[1]一种用于人腹泻症病毒的感染·增殖培养的2d类器官,所述类器官由工序1和工序2获得,在工序1中,在细胞外基质上对人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织进行立体培养,得到3d类器官,在工序2中,使在所述工序1中得到的所述3d类器官分散,制备单一细胞,在细胞外基质上对所述单一细胞进行单层培养,获得2d类器官,在所述2d类器官中,构成包含分化的绒毛细胞及杯状细胞的人肠道内腔的上皮细胞为单层结构。[2]根据[1]所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,在所述工序1和工序2的培养中,使用的细胞培养基包括从(i)wnt激动剂、ii)从胰岛素样生长因子1(insulin-likegrowthfactor1;igf1)、纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2)、egf(epidermalgrowthfactor)和表皮调节素(epiregulin;ereg)组成的组中所选的至少一种、(iii)骨形成因子(bonemorphogeneticprotein;bmp)抑制剂、iv)转化增殖因子-β(transforminggrowthfactor-β;tgf-β)抑制剂、及v)γ分泌酶抑制剂组成的组中所选的至少一种。[3]根据[2]所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述wnt激动剂是从wnt蛋白质、r-脊椎蛋白和gsk-3β抑制剂组成的组中选出的至少一种。[4]根据[2]或[3]所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述细胞培养基包括igf1和fgf2。[5]根据[3]或[4]所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述wnt蛋白质与其稳定化物质afamin形成复合体。[6]根据[3]-[5]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述wnt蛋白质是从wnt1、wnt2、wnt2b、wnt3、wnt3a,wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、wnt9a、wnt9b、wnt10a、wnt10b、wnt11、wnt16组成的组中所选的至少一种。[7]根据[3]-[6]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述r-脊椎蛋白是从r-脊椎蛋白1、r-脊椎蛋白2、r-脊椎蛋白3和r-脊椎蛋白4组成的组中所选的至少一种。[8]根据[2]-[7]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述mbp抑制剂是从包括头蛋白(noggin)、gremlin、腱蛋白、腱蛋白结构域的腱蛋白样蛋白质、包括卵泡抑素(follistatin)、卵泡抑素结构域的卵泡抑素相关蛋白质、包括dan、dan半胱氨酸-结节结构域的dan样蛋白质、硬骨素/sost以及α-2巨球蛋白组成的组中所选的至少一种。[9]根据[2]-[8]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述bmp抑制剂是头蛋白(noggin)。[10]根据[2]-[9]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述wnt激动剂是wnt蛋白质和r-脊椎蛋白。[11]根据[2]-[10]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述tgf-β抑制剂是从a83-01、sb-431542、sb-505124、sb-525334、sd-208、ly-36494、以及sjn-2511组成的组中所选的至少一种。[12]根据[2]-[11]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述tgf-β抑制剂是a83-01。[13]根据[2]-[12]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述细胞培养基还包括来自动物的胆汁。[14]根据[1]-[13]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官,其中,所述工序1和工序2中的细胞外基质是matrigel(注册商标)。[15]一种用于人腹泻症病毒的感染·增殖培养的2d类器官培养物,所述2d类器官是根据[1]-[14]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官。[16]根据[15]所述的用于人腹泻症病毒的感染·增殖培养的2d类器官培养物,其中,所述培养物是无血清的。[17]一种人腹泻症病毒的制造方法,所述制造方法具有工序3,在所述工序3中,使[1]-[14]的任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官感染人腹泻症病毒,对感染的2d类器官进行培养,使感染人腹泻症病毒并增殖培养。[18]一种用于人腹泻症病毒的感染·增殖培养的2d类器官培养试剂盒,所述试剂盒具有细胞培养基,所述细胞培养基包括从(i)wnt激动剂、ii)从胰岛素样生长因子1(insulin-likegrowthfactor1;igf1)、纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2)、egf(epidermalgrowthfactor)和表皮调节素(epiregulin;ereg)组成的组中所选的至少一种、(iii)骨形成因子(bonemorphogeneticprotein;bmp)抑制剂、iv)转化增殖因子-β(transforminggrowthfactor-β;tgf-β)抑制剂、及v)γ分泌酶抑制剂组成的组中所选的至少一种。[19]根据[18]所述的用于人腹泻症病毒的感染·增殖培养的2d类器官培养试剂盒,其中,所述细胞培养基还包括来自动物的胆汁。[20]一种制造人腹泻症病毒的试剂盒,所述试剂盒具有细胞培养基,所述细胞培养基包括从(i)wnt激动剂、ii)从胰岛素样生长因子1(insulin-likegrowthfactor1;igf1)、纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2)、egf(epidermalgrowthfactor)和表皮调节素(epiregulin;ereg)组成的组中所选的至少一种、(iii)骨形成因子(bonemorphogeneticprotein;bmp)抑制剂、iv)转化增殖因子-β(transforminggrowthfactor-β;tgf-β)抑制剂、及v)γ分泌酶抑制剂组成的组中所选的至少一种。[21]根据[20]所述的制造人腹泻症病毒的试剂盒,其中,所述wnt激动剂是wnt蛋白质和r-脊椎蛋白。[22]根据[21]所述的制造人腹泻症病毒的试剂盒,其中,所述wnt蛋白质与其稳定化物质afamin形成复合体。[23]根据[20]-[22]中任一项所述的制造人腹泻症病毒的试剂盒,其中,所述细胞培养基还包括来自动物的胆汁。[24]一种用于人腹泻症病毒的感染·增殖培养的2d类器官的制造方法,所述制造方法具有工序1和工序2,在工序1中,在细胞外基质上对人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织进行立体培养,得到3d类器官,在工序2中,使在所述工序1中得到的所述3d类器官分散,制备单一细胞,在细胞外基质上对所述单一细胞进行单层培养,获得2d类器官,在所述2d类器官中,构成包含分化的绒毛细胞及杯状细胞的人肠道内腔的上皮细胞为单层结构,在所述工序1和工序2的培养中,使用的细胞培养基包括从(i)wnt激动剂、ii)从胰岛素样生长因子1(insulin-likegrowthfactor1;igf1)、纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2)、egf(epidermalgrowthfactor)和表皮调节素(epiregulin;ereg)组成的组中所选的至少一种、(iii)骨形成因子(bonemorphogeneticprotein;bmp)抑制剂、iv)转化增殖因子-β(transforminggrowthfactor-β;tgf-β)抑制剂、及v)γ分泌酶抑制剂组成的组中所选的至少一种。[25]根据[24]所述的用于人腹泻症病毒的感染·增殖培养的2d类器官的制造方法,其中,所述wnt激动剂是wnt蛋白质和r-脊椎蛋白。[26]根据[25]所述的用于人腹泻症病毒的感染·增殖培养的2d类器官的制造方法,其中,所述wnt蛋白质与其稳定化物质afamin形成复合体。[27]根据[24]-[26]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官的制造方法,其中,所述细胞培养基还包括来自动物的胆汁。[28]根据[24]-[27]中任一项所述的用于人腹泻症病毒的感染·增殖培养的2d类器官的制造方法,其中,所述工序1和工序2中的细胞外基质是matrigel(注册商标)。发明效果根据本发明,能够提供通过以体外方式增殖培养人腹泻症病毒来大量制造人腹泻症病毒的方法,以及用于此的类器官的制造方法。附图说明图1是本实施方式的基于人腹泻症病毒的增殖培养的制造方法的说明图。图2是表示实施例2中的qrt-pcr结果的图表。图3的上段是实施例2中的感染了诺如病毒的类器官的免疫染色像;下段是上段的示意图。图4的(a)~(c)是实验例3中的2d类器官的光学显微镜照片。图5的(a)和(b)是表示实验例4中的qrt-pcr结果的图表。具体实施方式[人腹泻症病毒的制造方法]作为一个实施方式,本发明提供人腹泻症病毒的制造方法,其具有工序1、工序2和工序3,在工序1中,在细胞外基质上立体培养人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织,得到3d类器官,在工序2中,使在上述工序1中得到的上述3d类器官分散,制备单一细胞,在细胞外基质上对所述单一细胞进行单层培养,获得2d类器官,在该2d类器官中,构成包含分化的绒毛细胞及杯状细胞的人肠道内腔的上皮细胞为单层结构,在工序3中,使在上述工序2中得到的2d类器官感染人腹泻症病毒,培养感染了的2d类器官,对人腹泻症病毒进行感染·增殖培养,其中,在上述工序1、工序2和工序3的培养中,使用规定的细胞培养基。首先,对工序1、工序2以及工序3的培养中使用的培养基进行说明。其中,在本实施方式中,工序1、工序2以及工序3的培养中使用的培养基可以全部为相同的培养基,也可以是彼此不同的培养基。(细胞培养基)本实施方式中使用的培养基是包括从(i)wnt激动剂、ii)从胰岛素样生长因子1(insulin-likegrowthfactor1;igf1)、纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2)、egf(epidermalgrowthfactor)和表皮调节素(epiregulin;ereg)组成的组中所选的至少一种、(iii)骨形成因子(bonemorphogeneticprotein;bmp)抑制剂、iv)转化增殖因子-β(transforminggrowthfactor-β;tgf-β)抑制剂、及v)γ分泌酶抑制剂组成的组中所选的至少一种的细胞培养基。根据本实施方式的细胞培养基,能够实质上不含p38抑制剂地长期培养人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织。在本说明书中,人肠道上皮细胞包含从人肠道上皮组织取得的分化的人肠道上皮细胞和人肠道上皮干细胞。“人肠道上皮干细胞”是指具有长时间的自己复制功能和向人肠道上皮分化细胞分化能力的细胞,是指来自人肠道上皮组织的干细胞。在本说明书中,“类器官”是指通过将细胞高密度地集聚在所控制的空间内而自组织而成的立体细胞组织体。在本说明书中,“实质上不包含”是指完全不包含特定成分,或者仅包含不发挥特定成分所具有功能的程度的浓度。因此,“实质上不包含p38抑制剂”是指完全不含有p38抑制剂,或者仅包含不引起基于p38抑制剂的分化抑制及细胞死亡的程度的浓度。本实施方式的细胞培养基优选包含从igf1、fgf2、egf以及表皮调节素组成的组中所选的至少一种,可以适当选择是否含有上述4种因子中的哪一种。其中,本实施方式的细胞培养基优选包含igf1及表皮调节素、fgf2及表皮调节素、或igf1及fgf2,更优选包含igf1及fgf2。通过含有上述因子,即使实质上不含egf及p38抑制剂,也可以由人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织以高效率形成类器官。(细胞基础培养基)本实施方式的细胞培养基中可以包含任何无血清的细胞基础培养基。本实施方式的细胞培养基优选用于人细胞。作为该无血清的细胞基础培养基,例如可以举出用碳酸系的缓冲液缓冲至ph7.2以上ph7.6以下的规定的合成培养基等。更具体而言,可以例举出补充了谷氨酸、胰岛素、b27supplement(thermofisher)、n-acetyl-l-cystein(和光纯药)、青霉素或链霉素、以及转铁蛋白的高级杜氏改良恩格尔培养基/hamf-12混合培养基(dulbecco’smodifiedeaglemedium:nutrientmixturef-12;dmem/f12)。另外,替代高级杜氏改良恩格尔培养基/hamf-12混合培养基,可以举出rpmi1640培养基(roswellparkmemorialinstitute1640medium)、dmem/f12、以及高级rpmi培养基等。上述本实施方式的细胞培养基实质上不含有胎牛血清(fetalbovineserum(fbs)或fetalcalfserum)等不确定成分。另外,上述细胞培养基中可以含有5%血清。(wnt激动剂)在本说明书中,“wnt激动剂”是指在细胞内使t细胞因子(以下,也称为tcf)/淋巴样增强因子(以下,也称为lef)介导性转录活化的药剂。因此,wnt激动剂并不限定于wnt家族蛋白质,包含与frizzled受体家族成员结合而活性化的wnt激动剂、细胞内β–连环蛋白分解的抑制剂、以及tcf/lef的活性化物质。wnt激动剂优选为从wnt蛋白质、r-脊椎蛋白(r-spondin)和gsk-3β抑制剂组成的组中选出的至少一种,更优选为wnt蛋白质和r-脊椎蛋白。与该wnt激动剂不存在下的wnt活性的水平比较,wnt激动剂至少10%,优选至少20%,更优选至少30%,进一步更优选至少50%,特别优选至少90%,最优选100%地在细胞中刺激wnt活性。wnt活性使用对于本领域技术人员公知的方法,例如可以利用ptopflash和pfopflashtcf荧光素酶报告基因构建,通过测定wnt的转录活性来进行研究(参考文献:korineketal.,1997,science275:1784-1787)。在人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织的培养中,优选含有wnt激动剂。作为本实施方式的细胞培养基中所含的wnt激动剂,更优选含有wnt蛋白质和afamin的复合体,进一步优选含有wnt蛋白质和afamin的复合体以及r-脊椎蛋白(r-spondin)两者。在本实施方式的细胞培养基中,由于含有wnt蛋白质和afamin的复合体以及r-脊椎蛋白,人肠道上皮干细胞或人肠道上皮细胞能够更高效地形成类器官。(wnt蛋白质)作为wnt激动剂的一种的wnt蛋白质不特别限定其来源,可以使用来自各种生物的wnt蛋白质。其中,优选来自哺乳动物的wnt蛋白质。作为哺乳动物,例如可以举出人、小鼠、大鼠、牛、猪、兔子等。作为哺乳动物的wnt蛋白质,可以举出wnt1、wnt2、wnt2b、wnt3、wnt3a,wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、wnt9a、wnt9b、wnt10a、wnt10b、wnt11、wnt16等。在本实施方式的细胞培养基中,可以组合使用多种wnt蛋白质。作为制造wnt蛋白质的方法,例如可以举出使用wnt蛋白质表达细胞进行制造的方法等。在wnt蛋白质表达细胞中,细胞的来源(生物种、培养形态等)没有特别限定,只要是稳定表达wnt蛋白质的细胞即可,也可以是瞬时表达wnt蛋白质的细胞。作为wnt蛋白质表达细胞,例如可举出稳定表达小鼠wnt3a的l细胞(atcccrl-2647)、稳定表达小鼠wnt5a的l细胞(atcccrl-2814)等。另外,wnt蛋白质表达细胞可以使用公知的转基因技术来制造。即,将编码了期望的wnt蛋白质的dna插入公知的表达载体中,将得到的表达载体导入适当的宿主细胞中,由此可以制造wnt蛋白质表达细胞。编码了期望的wnt蛋白质的基因碱基序列例如可以从genbank等公知的数据库取得。由wnt蛋白质表达细胞表达的wnt蛋白质只要具有wnt活性,可以是wnt蛋白质片段,也可以包含wnt蛋白质的氨基酸序列以外的氨基酸序列。关于wnt蛋白质的氨基酸序列以外的氨基酸序列,没有特别限定,例如可以举出亲和标签的氨基酸序列等。另外,wnt蛋白质的氨基酸序列不需要与能够从genbank等公知的数据库取得的氨基酸序列完全一致,只要具有wnt活性,也可以是与能够从公知的数据库取得的氨基酸序列实质上相同的氨基酸序列。作为与能够从genbank等公知的数据库取得的wnt蛋白质的氨基酸序列实质上相同的氨基酸序列,例如可举出在能够从公知的数据库取得的氨基酸序列中缺失、置换或附加一至数个氨基酸的氨基酸序列等。“缺失、置换或附加一至数个氨基酸的氨基酸序列”是指,例如可以通过部位特异性突变诱发法等公知的突变肽制造方法等,使氨基酸以能够缺失、置换或附加的程度的数目(优选10个以下,更优选7个以下,进一步优选6个以下)进行缺失、置换或附加而得到的氨基酸序列。另外,作为实质上相同的氨基酸序列,例如可以举出与能够从公知的数据库取得的氨基酸序列的同一性至少为80%以上、优选至少为85%以上,更优选至少为90%以上、进一步优选至少为92%以上、特别优选至少为95%以上,最优选至少为99%以上的氨基酸序列等。可以通过例如tcf报告基因检测来确认wnt蛋白质的活性。一般地,tcf报告基因检测是指,导入具有当wnt信号进入细胞时特异性活性化的转录因子的t细胞因子(tcf)的结合序列的荧光素酶基因,通过荧光素酶的发光简便地评价wnt蛋白质的活性强度的方法(参考文献:molenaaretal.,cell,86,391,1996.)。作为tcf报告基因检测以外的方法,可以举出利用当wnt信号进入时细胞内的β连环蛋白稳定化,通过蛋白质印迹法对β连环蛋白的量进行定量评价的方法(参考文献:shibamotoetal.,genetocells,3,659,1998.)等。另外,对于如wnt5a等那样,经由non-canonicalpathway向细胞发送信号的wnt蛋白质,可以使用通过评价作为细胞内适配蛋白质的dvl2的磷酸化,来评价wnt蛋白质的活性的方法(参考文献:kikuchietal.,emboj.,29,3470,2010.)等。(r-脊椎蛋白(r-spondin))作为wnt激动剂的一种的r-脊椎蛋白,可以举出由r-脊椎蛋白1、r-脊椎蛋白2、r-脊椎蛋白3和r-脊椎蛋白4组成的r-脊椎蛋白家族。众所周知,r-脊椎蛋白家族是分泌蛋白质,与wnt信号传递路径的活性化和控制有关。在本实施方式的细胞培养基中,也可以组合使用多种r-脊椎蛋白。只要具有r-脊椎蛋白活性,可以是r-脊椎蛋白的片段,也可以包含r-脊椎蛋白的氨基酸序列以外的氨基酸序列。(含量)本实施方式的细胞培养基中所含的wnt蛋白质的浓度优选为50ng/ml以上,更优选为100ng/ml以上10μg/ml以下,进一步优选为200ng/ml以上1μg/ml以下,特别优选为300ng/ml以上1μg/ml以下。在人肠道上皮干细胞的培养中,优选每2天将wnt激动剂添加到培养基中,优选每4天将细胞培养基更换为新鲜的。(gsk-3β抑制剂)公知的gsk-3β抑制剂包括:chir-99021、chir-98014(sigma-aldrich)、锂(sigma)、kenpaullon(biomolinternational,leost,m.etal.(2000)eurjbiochem267,5983-5994)、6-bromoindirubin-30-acetoxime(meyer,letal.(2003)chem.biol.10,1255-1266)、sb216763和sb415286(sigma-aldrich)、以及抑制gsk-3与axin的相互作用的frat家族成员以及来自frat的肽。概说明示在通过参照纳入本说明书的meijeretal.(2004)trendsinpharmacologicalsciences25,471-480中。用于确定gsk-3β抑制的水平的方法和检测是本领域技术人员公知的,例如包括liaoetal.(2004),endocrinology,145(6)2941-2949中记载的方法和检测。(afamin)在本说明书中,“afamin”是指属于白蛋白家族的糖蛋白质,已知存在于血液或体液中。在用于细胞培养的培养基中通常添加的血清中,含有来自采集了该血清的动物的afamin。由于血清中含有afamin以外的杂质等,因此在本实施方式的细胞培养基中,优选不使用血清,而单独使用afamin。本实施方式的细胞培养基中含有的afamin的来源没有特别限定,可以使用来自各种生物的afamin。其中,优选为来自哺乳动物的afamin。作为哺乳动物,例如可列举与上述“wnt蛋白质”部分中相同的哺乳动物。主要哺乳动物的afamin的氨基酸序列和编码该序列的基因的碱基序列例如可以从genbank等公知的数据库中取得。例如,在genbank中,人afamin的氨基酸序列被登记为登录号aaa21612,对其编码的基因的碱基序列被登记为登录号l32140,牛afamin氨基酸序列被登记为登录号daa28569,对其编码的基因的碱基序列被登记为登录号gj060968。本实施方式的细胞培养基中含有的afamin可以是通过公知的方法对血清等中所含的天然的afamin进行纯化而得到的,也可以是重组afamin。重组afamin可以通过适当使用公知的基因重组技术来制造。作为重组afamin的制造方法,例如,可以将编码afamin的dna插入公知的表达载体并将得到的表达载体导入适当的宿主细胞以表达重组afamin,并使用公知的纯化方法进行纯化,制造重组afamin。重组afamin也可以是附加了亲和标签的afamin。对于附加的亲和标签没有特别限定,可以从公知的亲和标签中适当选择使用。作为亲和标签,优选是由特异性抗体识别的亲和标签,例如可举出flag标签、myc标签、ha标签、v5标签等。上述的wnt蛋白质由于特定的丝氨酸残基被脂肪酸(棕榈油酸)修饰,因此具有强的疏水性。因此,广泛已知wnt蛋白质在水溶液中容易凝聚或改性,因此纯化和保存非常困难。另一方面,据报告,该特定的丝氨酸残基被脂肪酸修饰对wnt蛋白质的生理活性是必须的,其参加与frizzled受体家族成员的结合。另外,也有见解认为,在水溶液中,wnt蛋白质与afamin一对一地结合,形成复合体,保持高生理活性的同时可溶化(activeandwater-solubleformoflipidatedwntproteinismaintainedbyaserumglycolproteinafamin/α-albumin.miharae,hiraih,yamamotoh,tamura-kawakamik,matanom,kikuchia,satot,takagij.elife.2016feb23;5.)。基于该见解,可以通过培养表达wnt蛋白质和afamin这两者的细胞的方法,制造wnt蛋白质-afamin复合体,也可以通过将wnt蛋白质表达细胞和afamin表达细胞进行共培养的方法,制造wnt蛋白质-afamin复合体。可以使用与上述的“wnt蛋白质”部分中同样的方法,对wnt蛋白质-afamin复合体中的wnt蛋白质的活性进行评价。本实施方式的细胞培养基中所含的afamin的浓度没有特别限定,优选为50ng/ml以上10μg/ml以下,更优选为100ng/ml以上1μg/ml以下,进一步优选为300μg/ml以上1μg/ml以下。(胰岛素样生长因子1(insulin-likegrowthfactor1;igf1))一般而言,“胰岛素样生长因子1(insulin-likegrowthfactor1;igf1)”别名也被称为生长调节素c,主要是在肝脏中由生长激素(gh)的刺激而分泌的因子。已知大部分人体的细胞(特别是肌肉、骨骼、肝脏、肾脏、神经、皮肤以及肺等的细胞)受到igf1的影响。igf1除了胰岛素样效果之外,还具有对细胞生长(特别是神经细胞)和发展以及细胞dna合成进行调节的功能。本实施方式的细胞培养基中所含的igf1的浓度没有特别限定,优选为5ng/ml以上1μg/ml以下,更优选为10ng/ml以上1μg/ml以下,进一步优选为50ng/ml以上500ng/ml以下。本实施方式的细胞培养基中所含的igf1的浓度为上述范围,由此即使实质上不含p38抑制剂,也能够长期培养人肠道上皮干细胞、人肠道上皮细胞或包含这些细胞中的至少任一种的组织。另外,能够由人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织高效率地形成类器官。另外,在人肠道上皮干细胞的培养中,优选每2天将igf1添加到培养基中,优选每4天将培养基更换为新鲜的。(纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2))一般地,“纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2)”是碱性的纤维芽细胞增殖因子,与纤维芽细胞增殖因子受体(fibroblastgrowthfactorreceptor;fgfr)结合,具有促进血管内皮细胞的增殖和促进向筒状结构的组织化、即促进血管新生的功能。另外,已知人fgf2具有低分子量型(lwl)和高分子量型(hwl)两种亚型。lwl主要存在于细胞质中,以自分泌(autocrine)方式作用,另一方面,hwl处于核内,在细胞内作用的胞内分泌机构中显示活性。本实施方式的细胞培养基中所含的fgf2的浓度没有特别限定,优选为5ng/ml以上1μg/ml以下,更优选为10ng/ml以上1μg/ml以下,进一步优选为50ng/ml以上500ng/ml以下。本实施方式的细胞培养基中所含的fgf2的浓度为上述范围,由此即使实质上不含p38抑制剂,也能够长期培养人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织。另外,可以由人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织高效率地形成类器官。另外,在人肠道上皮干细胞的培养中,优选每2天向培养基中添加fgf2,优选每4天将培养基更换为新鲜的。(表皮调节素(epiregulin;ereg))一般地,“表皮调节素(epiregulin;ereg)”是指与酪氨酸激酶(erbb)家族受体(erbb1~4)中的erbb1及erbb4特异性结合的egf样生长因子。已知对角蛋白生成细胞、肝细胞、纤维芽细胞以及血管内皮细胞的增殖进行刺激。另外,ereg主要在膀胱、肺、肾脏、大肠等癌症肿瘤、胎盘以及末梢血白血球中表达。本实施方式的细胞培养基中所含的ereg的浓度没有特别限定,优选为5ng/ml以上1μg/ml以下,更优选为10ng/ml以上1μg/ml以下,进一步优选为50ng/ml以上500ng/ml以下。本实施方式的细胞培养基中所含的ereg的浓度为上述范围,由此即使实质上不含p38抑制剂,也能够长期培养人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织。另外,可以由人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织高效率地形成类器官。另外,在人肠道上皮干细胞的培养中,优选每2天将ereg添加到培养基中,优选每4天将培养基更换为新鲜的。(bmp抑制剂)骨形成因子(bonemorphogeneticprotein;bmp)作为二聚体配体与由二种不同的受体丝氨酸/苏氨酸激酶、i型和ii型受体组成的受体复合体结合。ii型受体使i型受体磷酸化,其结果是,该受体激酶被活性化。该i型受体接着使特异性受体基质(smad)磷酸化,其结果是,通过信号传递路径诱导转录活性。一般地,bmp抑制剂例如是阻止或抑制bmp分子与bmp受体结合的物质,是为了形成中和bmp活性的复合体而与bmp分子结合的药剂。另外,bmp抑制剂例如是与bmp受体结合,阻止或抑制bmp分子与受体结合的物质,是作为拮抗剂或逆激动剂发挥作用的药剂。与该抑制剂不存在下的bmp活性水平相比,bmp抑制剂具有优选为50%以上,更优选为70%以上,进一步优选为80%以上,特别优选为90%以上的抑制活性。bmp抑制活性可以通过使用对于本领域技术人员公知的方法(参考文献:zilberbergetal.,bmccellbiol,8:41,2007.)测定bmp的转录活性来进行评价。作为本实施方式的细胞培养基所含的bmp抑制剂,优选为天然bmp结合蛋白质,例如,可举出:头蛋白(noggin)、gremlin、腱蛋白(chordin)、腱蛋白结构域等腱蛋白样蛋白质;卵泡抑素(follistatin)、卵泡抑素结构域等卵泡抑素相关蛋白质;dan、dan半胱氨酸-结节结构域等dan样蛋白质;硬骨素/sost、脱氢胆酸、α-2巨球蛋白等。作为本实施方式的细胞培养基所含的bmp抑制剂,其中,优选腱蛋白样蛋白质或dan样蛋白质,更优选腱蛋白样蛋白质。作为腱蛋白样蛋白质,优选头蛋白。腱蛋白样蛋白质或dan样蛋白质是扩散性蛋白质,能够以各种亲和度与bmp分子结合,抑制bmp分子靠近信号传递受体。在培养上皮干细胞的情况下,通过向细胞培养基中添加这些bmp抑制剂,能够防止干细胞的丧失。本实施方式的细胞培养基中所含的bmp抑制剂的浓度优选为10ng/ml以上100ng/ml以下,更优选为20ng/ml以上100ng/ml以下,进一步优选为50ng/ml以上100ng/ml以下。干细胞的培养中,优选每2天将bmp抑制剂添加至培养基中,优选每4天将培养基更换为新鲜的。(tgf-β抑制剂)转化增殖因子-β(transforminggrowthfactor-β;tgf-β)是增殖因子的一种,在肾脏、骨髓、血小板等几乎所有的细胞中产生。在tgf-β中存在5种类的子类型(β1~β5)。另外,已知tgf-β促进骨芽细胞的增殖、以及胶原蛋白那样的结合组织的合成和增殖,对上皮细胞的增殖和破骨细胞有抑制作用。一般地,tgf-β抑制剂例如是阻止或抑制tgf-β向tgf-β受体的结合,是为了形成中和tgf-β活性的复合体而与tgf-β结合的药剂。此外,tgf-β抑制剂例如是与tgf-β受体结合,阻止或抑制tgf-β向受体的结合,是作为拮抗剂或逆激动剂发挥作用的药剂。与该tgf-β抑制剂不存在下的tgf-β活性水平相比,tgf-β抑制剂优选具有50%以上、更优选70%以上、进一步优选80%以上、特别优选90%以上的抑制活性。tgf-β抑制活性可以通过本领域技术人员公知的方法来评价。作为该评价系统,可举出使用启动荧光素酶报告基因的人pai-1启动子或包含smad结合部位的报告基因构建体稳定地转染细胞的细胞检测(参考文献:degouvilleetal.,brjpharmacol,145(2):166-177,2005.)。作为本实施方式的细胞培养基所含的tgf-β抑制剂,例如,可举出:a83-01(3-(6-甲基吡啶-2-基)-1-苯氨基硫甲酰基-4-喹啉-4-基吡唑)、alk5inhibitori(3-(吡啶-2-基)-4-(4-醌基)-1h-吡唑)、ldn193189(4-(6-(4-(哌嗪-1-基)苯基)吡唑并[1,5-a]嘧啶-3-基)喹啉)、sb431542(4-[4-(1,3-苯并二噁茂-5-基)-5-吡啶-2-基-1h-咪唑-2-基]苯甲酰胺)、sb-505124(2-(5-苯并[1,3]二氧杂环戊烯-5-基-2-叔丁基-3h-咪唑-4-基)-6-甲基吡啶盐酸盐水合物)、sd-208(2-(5-氯-2-氟苯基)蝶啶-4-基)吡啶-4-基-胺)、sb-525334(6-[2-(1,1-二甲基乙基)-5-(6-甲基-2-吡啶基)-1h-咪唑-4-基]喹喔啉)、ly-364947(4-[3-(2-吡啶基)-1h-吡唑-4-基]-喹啉)、ly2157299(4-[2-(6-甲基-吡啶-2-基)-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基]-喹啉-6-羧酸酰胺)、tgf-βrikinaseinhibitorii616452(2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-二氮杂萘)、tgf-βrikinaseinhibitoriii616453(2-(5-苯并[1,3]二氧杂环戊烯-4-基-2-叔丁基-1h-咪唑-4-基)-6-甲基吡啶、hcl)、tgf-βrikinaseinhibitorix616463(4-((4-((2,6-二甲基吡啶-3-基)氧基)吡啶-2-基)氨基)苯磺酰胺)、tgf-βrikinaseinhibitorvii616458(1-(2-((6,7-二甲氧基-4-喹啉基)氧基)-(4,5-二甲基苯基)-1-乙酮)、tgf-βrikinaseinhibitorviii616459(6-(2-叔丁基-5-(6-甲基-吡啶-2-基)-1h-咪唑-4-基)-喹喔啉)、ap12009(tgf-β2反义化合物“trabedersen”)、belagenpumatucel-l(tgf-β2反义基因修饰同种异体肿瘤细胞疫苗)、cat-152(glaucoma-lerdelimumab(抗-tgf-β-2单克隆抗体))、cat-192(metelimumab(中和tgfβ1的人igg4单克隆抗体)、gc-1008(抗-tgf-β单克隆抗体)等。作为本实施方式的细胞培养基所含的tgf-β抑制剂,其中优选a83-01。本实施方式的细胞培养基中所含的tgf-β抑制剂的浓度优选为100nm以上10μm以下,更优选为500nm以上5μm以下,进一步优选为500nm以上2μm以下。在干细胞的培养中,优选每2天向培养基中添加tgf-β抑制剂,优选每4天将培养基更换为新鲜的。(γ分泌酶抑制剂)与不存在该抑制剂的情况下的γ分泌酶活性水平相比较,γ分泌酶抑制剂优选具有50%以上、更优选70%以上、进一步优选80%以上、特别优选90%以上的抑制活性。可以通过对本领域技术人员而言公知的方法来评价γ分泌酶抑制活性。作为本实施方式的细胞培养基中所含的γ分泌酶,例如可举出bms299897、dapt、dbz、jlk6、l-685、458、ly411575等。作为本实施方式的细胞培养基中所含的γ分泌酶,尤其优选为ly411575。本实施方式的细胞培养基中所含的γ分泌酶抑制剂的浓度优选为1nm以上10μm以下,更优选为100nm以上1μm以下。从每个细胞的人腹泻症病毒的生产量增加的观点出发,优选在工序2的单层培养中使用γ分泌酶抑制剂。在干细胞的培养中,优选每2天向培养基中添加γ分泌酶抑制剂,优选向培养基中添加4天。(分裂促进增殖因子)作为本实施方式的细胞培养基中也可以包含的分裂促进增殖因子,例如可以举出上皮增殖因子(epidermalgrowthfactor;egf)、来自脑的神经营养因子(brainderivedneurotrophicfactor;bdnf)、角蛋白生成细胞增殖因子(keratinocytegrowthfactor;kgf)等增殖因子家族。也可以组合使用多种这些分裂促进增殖因子。egf是对各种培养外胚叶性细胞和中胚叶性细胞的强力的分裂促进因子,对一部分纤维芽细胞的特异性细胞分化具有显著的影响。egf前驱体通过蛋白质分解而被切断,作为生成刺激细胞的53-氨基酸肽类激素的膜结合分子存在。作为上述细胞培养基中也可以包含的分裂促进增殖因子,其中优选egf。本实施方式的细胞培养基中所含的egf的浓度优选为5ng/ml以上500ng/ml以下,更优选为10ng/ml以上400ng/ml以下,进一步优选为50ng/ml以上200ng/ml以下。另外,在前述细胞培养基中含有kgf的情况下也优选为与kgf相同的含量。使用多个kgf,例如kgf1及kgf2(也作为fgf7及fgf10为人所知)时,优选kgf的总含量为上述范围。在干细胞的培养中,优选每2天将分裂促进增殖因子添加到培养基中,优选每4天将培养基更换为新鲜的。(其他成分)本实施方式的细胞培养基可以进一步包含rock(rho-激酶)抑制剂。作为rock抑制剂,例如可举出y-27632((r)-(+)-反式-4-(1-氨基乙基)-n-(4-吡啶基)环己烷甲酰胺双盐酸盐一水合物)、法舒地尔(ha1077)(5-(1,4-二氮杂环庚烷-1-基磺酰基)异喹啉)、h-1152((s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂卓双盐酸盐)等。在使用y-27632作为rock抑制剂的情况下,优选在分散为单细胞的干细胞的培养期间的最初2天添加。本实施方式的细胞培养基所含的y-27632优选为约10μm。本实施方式的细胞培养基中还可以进一步添加胃泌素(或leu15-胃泌素等适当的替代物)。本实施方式的细胞培养基中所含的胃泌素(或适当的替代物)浓度可以为例如1ng/ml以上10μg/ml以下,可以为例如1ng/ml以上1μg/ml以下,可以为例如5ng/ml以上100ng/ml以下。本实施方式的细胞培养基可以进一步包含至少一种氨基酸。作为本实施方式的细胞培养基所含的氨基酸,例如可举出:l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-胱氨酸、l-谷氨酸、l-谷氨酰胺、l-甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-蛋氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸、l-缬氨酸、以及它们的组合等。一般地,细胞培养基所含的l-谷氨酰胺的浓度是0.05g/l以上1g/l以下(通常为0.1g/l以上0.75g/l以下)。细胞培养基所含的其它氨基酸是0.001g/l以上1g/l(通常为0.01g/l以上0.15g/l以下)。氨基酸也可以通过合成获得。本实施方式的细胞培养基中还可以进一步含有至少1种维生素。作为本实施方式的细胞培养基中所含的维生素,例如可以举出:硫胺(维生素b1),核黄素(维生素b2)、烟酸(维生素b3)、d-泛酸钙(维生素b5),吡哆醛/吡哆胺/吡哆醇(维生素b6)、叶酸(维生素b9),氰钴胺(维生素b12)、抗坏血酸(维生素c)、钙化醇(维生素d2),dl-α生育酚(维生素e)、生物素(维生素h)、甲萘醌(维生素k)等。本实施方式的细胞培养基中还可以进一步含有至少1种无机盐。本实施方式的细胞培养基中所含的无机盐为了有助于维持细胞的渗透压平衡,以及有助于膜电位的调节。作为无机盐的具体例,可以举出钙、铜、铁、镁、钾、钠和锌的盐。盐通常以氯化物、磷酸盐、硫酸盐、硝酸盐、以及碳酸氢盐的形式使用。更具体的盐可以举出cacl2、cuso4-5h2o、fe(no3)-9h2o,feso4-7h2o、mgcl、mgso4、kcl、nahco3、nacl、na2hpo4、na2hpo4-h2o、znso4-7h2o等。本实施方式的细胞培养基还可以进一步含有至少1种能够成为碳能源的糖。作为本实施方式的细胞培养基中所含的糖,例如可以举出葡萄糖、半乳糖、麦芽糖、果糖等。其中,作为糖,优选葡萄糖,特别优选d-葡萄糖(右旋糖)。本实施方式的细胞培养基中所含的糖的浓度优选为1g/l以上10g/l。本实施方式的细胞培养基中还可以进一步含有至少1种微量元素。作为本实施方式的细胞培养基中所含的微量元素,例如可以举出钡、溴,钴、碘、锰、铬、铜、镍、硒、钒、钛、锗,钼、硅、铁、氟、银、铷、锡、锆、镉、锌,铝或它们的离子等。本实施方式的细胞培养基中还可以进一步含有至少1种附加的药剂。作为该药剂,可举出已有报告称能改善干细胞培养的营养素或增殖因子,例如胆固醇/转铁蛋白/白蛋白/胰岛素/黄体酮、腐胺、亚硒酸盐/其他因子等。本实施方式的细胞培养基中还可以进一步含有来自动物的胆汁。如在实施例中后述,通过在细胞培养基中添加来自动物的胆汁,能够显著地促进人腹泻症病毒的增殖。作为来自动物的胆汁,可以举出牛胆汁提取物、猪胆汁提取物等。这些胆汁提取物可以是市售的。(工序1)工序1是在细胞外基质上对人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织进行立体培养,得到3d类器官的工序。在工序1中优选具备细胞外基质制备工序、粘着工序、类器官形成工序,其中,在细胞外基质制备工序中制备细胞外基质,在粘着工序中,将细胞外基质中的人肠道上皮干细胞、人肠道上皮细胞或包含这些细胞中的至少任一种的组织粘着到细胞外基质上,在类器官形成工序中,在上述粘着工序后,添加上述细胞培养基,对所述人肠道上皮干细胞、所述人肠道上皮细胞、或包含所述这些细胞中的至少任一种的组织进行培养,形成类器官。以下对工序1所具备的优选工序进行详细说明。《细胞外基质制备工序》一般地,“细胞外基质(extracellularmatrix;ecm)”是指生物中存在于细胞外的超分子结构。该ecm是用于使上皮干细胞、上皮肿瘤细胞、或包含它们的组织进行增殖的基础场所。ecm包含各种多糖、水、弹性蛋白以及糖蛋白质。作为糖蛋白质,例如可举出胶原蛋白、内功素(巢蛋白)、纤连蛋白、层粘蛋白等。作为ecm的制备方法,例如可以举出使用结合组织细胞的方法等。更具体而言,在培养ecm产生细胞例如纤维芽细胞后,取出这些细胞,通过添加上皮干细胞、上皮细胞、上皮肿瘤细胞、或含有它们的组织,能够将ecm用作基础场所。作为ecm产生细胞,例如可举出:主要产生胶原蛋白和蛋白聚糖的软骨细胞,主要产生iv型胶原蛋白、层粘蛋白、间质前胶原以及纤连蛋白的纤维芽细胞,主要产生胶原蛋白(i型、iii型以及v型)、硫酸软骨素蛋白聚糖、透明质酸、纤连蛋白以及肌腱蛋白-c的结肠肌纤维芽细胞等。或者,也可以使用市售的ecm。作为市售的ecm,例如可举出:来自细胞外基质蛋白质(invitrogen公司制)、来自engelbreth-holm-swarm(ehs)小鼠肉瘤细胞的基膜制备物(例如,matrigel(注册商标)(bdbiosciences公司制))等。也可以使用pronectin(sigmaz378666)等合成ecm。另外,也可以使用天然ecm和合成ecm的混合物。在为了培养干细胞而使用ecm的情况下,可以强化干细胞的长期生存及未分化干细胞的持续存在。在不存在ecm的情况下,无法长时间培养干细胞培养物,不能够观察到未分化干细胞的持续存在。进而,若存在ecm,则能够培养在不存在ecm的情况下无法培养的类器官。ecm通常沉到悬浮有细胞的培养皿的底部。例如可以,当ecm在37℃凝固时,加入上述细胞培养基,使其在ecm中扩散而使用。培养基中的细胞通过与ecm的表面结构相互作用,例如通过与整合素相互作用而能够固定于ecm。ecm也可以涂布在培养容器等上使用。在使用纤连蛋白作为ecm的情况下,涂布于培养容器中的比例优选为1μg/cm2以上250μg/cm2以下,更优选为1μg/cm2以上150μg/cm2以下,进一步优选为8μg/cm2以上125μg/cm2以下。作为细胞外基质,优选使用matrigel(注册商标)。如在实施例中后述,如果使用matrigel(注册商标)作为细胞外基质,则存在2d类器官向培养基材的粘着变得良好的倾向。《粘着工序》接着,准备人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织。作为从人肠道上皮组织分离人肠道上皮细胞的方法,可以举出本
技术领域:
中公知的方法。例如,通过将螯合剂和分离组织恒温放置,能够将隐窝分离。清洗该组织后,用玻璃载片将人肠道上皮细胞层从粘膜下层剥离、细切。然后,在胰蛋白酶或优选包含edta和egta中的至少任一种的液体中进行恒温放置,例如,使用过滤及离心机中的至少任一种,将未消化的组织片段和来自于隐窝的单一细胞分离。替代胰蛋白酶,也可以使用其他的蛋白质分解酶,例如胶原酶和中性蛋白酶i中的至少任一种。作为从人肠道上皮组织分离干细胞的方法,可以举出本
技术领域:
中公知的方法。干细胞在其表面上表达lgr5及lgr6中的至少任一种(lgr5及lgr6属于大型g蛋白质共轭受体(gpcr)超家族)。作为分离方法,可以举出如下方法:从人肠道上皮组织制备细胞悬浮液,使该细胞悬浮液与和lgr5及lgr6中的至少任意一种结合的化学物质接触,将该和lgr5及lgr6中的至少任意一种结合的化学物质分离,并从该结合化合物分离干细胞。作为与lgr5及lgr6中的至少任意一种结合的化学物质,例如可以举出抗体,更具体而言,例如,特异性地识别lgr5及lgr6中的至少任意一种,并与其结合的单克隆抗体(例如,包括小鼠和大鼠单克隆抗体的单克隆抗体等)。可以使用这样的抗体,例如应用磁性珠,或通过荧光激活细胞分选仪,来分离表达lgr5及lgr6中的至少任意一种的干细胞。将利用上述方法分离的人肠道上皮干细胞、人肠道上皮细胞、人肠道上皮肿瘤细胞、或包含这些细胞中的至少任一种的组织包埋在由前述制备工序得到的细胞基质中,播种到板上,静置。播种的细胞通过与ecm的表面结构相互作用,例如能够通过与整合素相互作用而粘着到ecm。《类器官形成工序》接着,在细胞播种后,在细胞未干时,添加上述细胞培养基,进行培养。培养温度优选为30℃以上40℃以下,更优选为37℃左右。培养时间可以根据使用的细胞适当地调整。从培养开始起1-2周左右后,能够形成类器官。另外,对于以往只能进行2-3个月的细胞维持培养的细胞,在工序1中,即使在3个月以上的长期间(优选为10个月左右),也能够维持培养细胞。通过工序1,能够得到3d类器官(参照图1)。另外,在类器官形成工序中,也可以在低氧下进行培养。通过在低氧下进行培养,可以由人肠道上皮干细胞、人肠道上皮细胞、或人肠道上皮肿瘤细胞、或包含这些细胞中的至少任一种的组织高效率地形成类器官。本实施方式中的低氧下是指氧浓度优选为0.1%以上15%以下,更优选为0.3%以上10%以下,进一步优选为0.5%以上5%以下。(工序2)工序2是使在上述工序1中得到的3d类器官分散而制备单一细胞,在细胞外基质上对上述单一细胞进行单层培养而得到2d类器官的工序。如图1所示,在3d类器官中,感染人腹泻症病毒的部位是肠道的内侧部分。因此,需要破坏3d类器官,使内侧的部分露出。作为使3d类器官分散并制备单一细胞的方法,没有特别限定,可以举出物理方法、酶处理法等,从不损伤细胞的观点出发,优选酶处理法。作为酶处理法中使用的酶,可以举出胰蛋白酶等与在上述[粘着工序]中所列举的相同的酶。接着,与上述[细胞外基质制备工序]同样地,播种到制备的细胞外基质上,静置。播种的细胞通过与ecm的表面结构相互作用,例如通过与整合素相互作用而能够与ecm粘着。接着,在细胞播种后,在细胞未干时添加上述分化培养基,进行单层培养。通过工序2,获得了2d类器官(参见图1)。(工序3)工序3是使在上述工序2中得到的2d类器官感染人腹泻症病毒,培养感染了的2d类器官的工序(参照图1)。由于2d类器官与液体培养基接触的细胞表面也包含3d类器官的内侧的面,因此人腹泻症病毒高效地感染。作为人腹泻症病毒,可以举出轮状病毒、诺如病毒、札如病毒、星状病毒、肠道腺病毒、双埃可病毒、爱知病毒等,优选为诺如病毒。如在实施例中后述那样,通过工序3,人腹泻症病毒增殖。根据本实施方式的人腹泻症病毒的制造方法,能够以体外方式人工大量地进行人腹泻症病毒增殖培养来生产,能够有助于对人腹泻症病毒的病态的解析、抗病毒药和消毒药的开发、疫苗的开发等。[试剂盒]在一实施方式中,提供人腹泻症病毒制造试剂盒,其具备细胞培养基,该细胞培养基包括从(i)wnt激动剂、ii)从胰岛素样生长因子1(insulin-likegrowthfactor1;igf1)、纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2)、egf(epidermalgrowthfactor)和表皮调节素(epiregulin;ereg)组成的组中所选的至少一种,(iii)骨形成因子(bonemorphogeneticprotein;bmp)抑制剂、iv)转化增殖因子-β(transforminggrowthfactor-β;tgf-β)抑制剂、及v)γ分泌酶抑制剂组成的组中所选的至少一种。本实施方式的试剂盒也可以称为用于人腹泻症病毒的感染·增殖培养的2d类器官培养试剂盒。在本实施方式的试剂盒中,上述细胞培养基可以进一步含有来自动物的胆汁。如实施例中后述,通过在细胞培养基中添加来自动物的胆汁,能够显著地促进人腹泻症病毒的增殖。作为来自动物的胆汁,可以举出牛胆汁提取物、猪胆汁提取物等。这些胆汁提取物可以是市售的。在本实施方式的试剂盒中,上述细胞培养基可以是无血清的。本实施方式的试剂盒除了上述细胞培养基以外,还可以具备细胞培养器具、使用说明书等。作为细胞培养器具等,可以举出细胞培养板等,但并不限于此。本实施方式的试剂盒可适用于人腹泻症病毒的制造方法。通过将人腹泻症病毒的制造方法中使用的试剂类进行试剂盒化,可以更简便且在更短时间内制造人腹泻症病毒。[类器官的制造方法]在一实施方式中,本发明提供类器官的制造方法,其具有工序1和工序2,在工序1中,在细胞外基质上立体培养人肠道上皮干细胞、人肠道上皮细胞、或包含这些细胞中的至少任一种的组织,获得3d类器官,在工序2中,由前述工序1中获得的所述3d类器官利用蛋白质分解酶分散,制备单一细胞,在细胞外基质上对所述单一细胞进行单层培养,获得2d类器官,在该2d类器官中,构成包含分化的绒毛细胞及杯状细胞的人肠道内腔的上皮细胞为单层结构,在上述工序1和工序2的培养中,使用的细胞培养基包括从(i)wnt激动剂、ii)从胰岛素样生长因子1(insulin-likegrowthfactor1;igf1)、纤维芽细胞增殖因子2(fibroblastgrowthfactor2;fgf2)、egf(epidermalgrowthfactor)和表皮调节素(epiregulin;ereg)组成的组中所选的至少一种,(iii)骨形成因子(bonemorphogeneticprotein;bmp)抑制剂、iv)转化增殖因子-β(transforminggrowthfactor-β;tgf-β)抑制剂、及v)γ分泌酶抑制剂组成的组中所选的至少一种。工序1和工序2的详细情况与“人腹泻症病毒的制造方法”中所述的工序相同。如在实施例中后述,2d类器官包含作为mucin2阳性细胞的杯状细胞。2d类器官可以应用于再生医疗、上皮细胞的基础医学研究、药物应答的筛选、使用来源于疾病的上皮类器官的创新性药物研究等。[培养物]在一实施方式中,本发明提供一种用于人腹泻症病毒的感染·增殖培养的2d类器官培养物。用于人腹泻症病毒的感染·增殖培养的2d类器官与之前所述的相同。在此,“培养物”除了2d类器官以外,包含细胞培养基以及细胞外基质。在本实施方式的培养物中,细胞培养基可以为无血清的。另外,细胞培养基可以含有来自动物的胆汁。另外,细胞外基质可以是matrigel(注册商标)。[用途]作为一实施方式,本发明提供人腹泻症病毒、特别是诺如病毒的消毒药的筛选方法、消毒药创新性药物、该病毒的感染细胞、感染机制的确定、由该病毒产生的腹泻症状的预防/治疗药的筛选、预防·治疗药创新性药物的开发方案。在对人腹泻症病毒的药物应答的筛选中,在使用上述的2d类器官的情况下,在例如96孔板(96-wellplate)或384孔板(384-wellplate)等多孔板中培养类器官。使用分子库,鉴定对该类器官和/或感染人病毒造成影响的分子。作为库,例如可举出抗体片段库、肽噬菌体展示库、肽库(例如lopap(商标)、sigmaaldrich公司制)、脂质库(biomol公司制)、合成化合物库(例如lopap(商标)、sigmaaldrich公司制)或天然化合物库(specs、timtec公司制)等。并且,也可以使用基因库。作为基因库,例如可举出cdna库、反义库、sirna、或其他的非编码rna库等。作为具体的方法,可以举出在某一定时间内暴露于人腹泻症病毒感染细胞和人腹泻症病毒试验药剂的多种浓度,在暴露时间结束时评价培养物的方法。进而,本实施方式的2d类器官可以在新候补药物或已知或新营养辅助食品的毒性检测中代替caco-2细胞等细胞株的使用。以下,通过实施例对本发明进行说明,但本发明并不限于以下的实施例。实施例[实验例1](细胞培养基的制备)首先,在市售的advanceddmem/f-12培养基(thermoficherscientific公司制)中,添加人重组r-脊椎蛋白1(r&dsystems公司制),使其最终浓度为1μg/ml,添加头蛋白(peprotech公司制),使其最终浓度为100ng/ml,添加a83-01(tocris公司制),使其最终浓度为500nm,(以下,称为“nra培养基”)。进一步地,准备培养基,该培养基以如下的组合添加了以下各种:最终浓度300ng/ml的wnt3a、最终浓度500ng/ml的igf1(biolegend公司制)、最终浓度50ng/ml的fgf2(peprotech公司制)、最终浓度50ng/ml的egf(thermoficherscientific公司制)、最终浓度10μm的sb202190(sigmaaldrich公司制)及最终浓度为1μm的ly411575(sigmaaldrich公司制)。·wnra+igf1+fgf2培养基·wenras培养基·enra培养基·enral培养基以下示出缩略语的含义。w;wnt3ae;egfn;头蛋白r;r脊椎蛋白1a;a-83-01s;sb202190l;ly411575[实验例2](使用了类器官的诺如病毒的增殖)《肠道干细胞的培养》基于由庆应义塾大学医学部伦理委员会承认的伦理研究计划,从获得说明和同意的健康者和消化道肿瘤患者采集距离消化道肿瘤至少5cm以上的部分作为正常粘膜。采集的组织借助edta或liberaseth提取上皮细胞,包埋在matrigel(注册商标)中。将含有上皮细胞(以下称为“肠道干细胞”)的matrigel(注册商标)播种于48孔板(48wellplate),进行培养。具体而言,如下所述。将培养的肠道干细胞与25μl的matrigel(注册商标)(bdbioscience公司制)一起播种于48孔板。将(1)中制备的wnra+igf1+fgf2培养基每孔100μl地添加到孔中,在37℃培养。从培养开始,每2天进行培养基更换,培养7天,得到3d类器官。《板的制作》将用pbs(-)稀释的2.5%matrigel(注册商标)以50μl/孔地添加到96孔板中,在37℃温育1小时以上。然后,将各孔用pbs(-)清洗3次,用于以下的细胞培养。《类器官的平面培养及诺如病毒感染》形成2d类器官,使其感染诺如病毒。具体而言,使用tryple(商标)express(thermoficherscientific公司制)破坏上述类器官,使其成为单一细胞。将该单一细胞分为3份,用各培养基(wenras培养基(增殖培养基)、enra培养基(分化培养基1)、enral培养基(分化培养基2))清洗后,悬浮在掺入最终浓度为10μm的y-27632(rock抑制剂;和光纯药公司制)的各培养基中。将该细胞悬浮液以1×105细胞/孔散到各孔中,静置3小时以上,使其粘着在板上。接着,将10%乳剂以各分化培养基稀释了10倍得到的粪便诺如病毒以5μl/孔加入,温育3小时。然后,用pbs(-)清洗3次,以250μl/孔加入各培养基,同时取样20μl(第0天)。然后,对感染后1天、2天、3天、6天的培养基取样20μl(第一天、第二天、第三天、第六天)。《诺如病毒rna的纯化》使用highpureviralrnakit(rochelifescience公司制)由取样的培养基纯化病毒rna,得到30μl的病毒rna悬浮液。《基于实时qrt-pcr的诺如病毒基因组的测定》由109拷贝/μl的模板dna制作10倍稀释系列,将其作为标准品。按照表1所示的组成,制作实时qrt-pcr混合料。另外,以表2所示的循环进行qrt-pcr。qrt-pcr的结果示于图2。[表1][表2]如图2所示,在使用分化培养基1的情况下的类器官培养上清液中的诺如病毒基因组的增加倍率与使用增殖培养基的情况相比,压倒性地高。由此,可以确认利用使用了分化培养基1的培养类器官,使感染·增殖人诺如病毒。另外,将感染6天后的在各培养基中培养的类器官利用dapi染色、以及抗人诺如病毒rna依赖性rna聚合酶(rdrp)抗体和抗mucin2抗体进行免疫染色。将该类器官的荧光染色像示于图3。如图3的正中图和右图所示,确认了rdrp的表达。由此,确认了诺如病毒感染了类器官并增殖。另外,如图3的正中图和右图所示,确认了mucin2的表达。由此,确认了类器官分化为杯状(goblet)细胞。[实验例3](细胞外基质的研究)发明人发现,存在2d类器官的细胞粘着不稳定的情况。因此,研究了细胞外基质。作为细胞外基质,使用胶原蛋白i和matrigel(注册商标)。《板的制作》将用pbs(-)稀释的2.5%matrigel(注册商标)或10%胶原蛋白i以50μl/孔添加到96孔板中,在37℃温育1小时以上。然后,将各孔用pbs(-)清洗3次,用于以下的细胞培养。另外,为了进行比较,使用无涂层的96孔板。《3d类器官的形成》与实验例2同样地培养肠道干细胞,得到3d类器官。《2d类器官的形成》使用tryple(商标)express(thermoficherscientific公司制)破坏所得到的类器官,制成单一细胞。将该单一细胞用enra培养基(分化培养基1)清洗后,悬浮于加入最终浓度10μm的y-27632(rock抑制剂;和光纯药公司制)的enra培养基中。将该细胞悬浮液以1×105细胞/孔散发到各孔,观察第二天细胞的粘着。图4(a)~(c)是各条件下的2d类器官的光学显微镜照片。图4(a)是使用无涂层的96孔板的结果,图4(b)是使用胶原蛋白i作为细胞外基质的结果,图4(c)是使用matrigel(注册商标)作为细胞外基质的结果。其结果,可知如果使用matrigel作为细胞外基质,则2d类器官向培养基的粘着良好。[实验例4](细胞培养基的研究)在使用类器官的诺如病毒的增殖中,在细胞培养基中添加来自动物的胆汁,研究其影响。另外,将在实验例2中使用的wenras培养基(增殖培养基)和enra培养基(分化培养基1)以各种组合的方式用作3d类器官的培养基和2d类器官的培养基,研究其影响。《板的制作》将用pbs(-)稀释的2.5%matrigel(注册商标)以50μl/孔添加到96孔板中,在37℃温育1小时以上。然后,将各孔用pbs(-)清洗3次,用于以下的细胞培养。《3d类器官的形成》与实验例2同样地培养肠道干细胞,得到3d类器官。此时,使用实验例2中使用的wenras培养基(增殖培养基)或enra培养基(分化培养基1)作为培养基。《2d类器官的形成》使用tryple(商标)express(thermoficherscientific公司制)破坏得到的3d类器官,制成单一细胞。将该单一细胞用wenras培养基(增殖培养基)或enra培养基(分化培养基1)清洗后,使其悬浮于添加了最终浓度10μm的y-27632(rock抑制剂;和光纯药公司制)的各培养基中。另外,准备在各培养基中添加了0.1%猪胆汁提取物(bileextractporcine、bep)的物质和未进行添加的物质。将该细胞悬浮液以1×105细胞/孔散发到各孔,静置3小时以上,使其粘着在板上。在下述表3中示出了3d类器官的培养及2d类器官的培养中使用的培养基的组合。表3中,“+”表示添加了,“-”表示未添加。[表3]组猪胆汁提取物3d类器官的培养基2d类器官的培养基1-增殖培养基增殖培养基2+增殖培养基增殖培养基3-增殖培养基分化培养基14+增殖培养基分化培养基15-分化培养基1增殖培养基6+分化培养基1增殖培养基7-分化培养基1分化培养基18+分化培养基1分化培养基1接着,将10%乳剂以各分化培养基稀释了10倍得到的粪便诺如病毒以5μl/孔加入,温育3小时。然后,用pbs(-)清洗3次,以250μl/孔加入各培养基,同时取样20μl(第0天)。然后,对感染后1天、2天、3天、6天的培养基取样20μl(第一天、第二天、第三天、第六天)。《诺如病毒rna的纯化》使用highpureviralrnakit(rochelifescience公司制)由取样的培养基纯化病毒rna,得到30μl的病毒rna悬浮液。《基于实时qrt-pcr的诺如病毒基因组的测定》与实验例2同样地进行实时qrt-pcr,测定诺如病毒的增殖。图5(a)和(b)是表示qrt-pcr的结果的图表。图5(a)表示组1-4的结果,图5(b)表示组5-8的结果。结果,可知在3d类器官的培养及2d类器官的培养双方都使用了分化培养基的组7及8中,诺如病毒的增殖显著地高。另外,可知在培养基中含有来自动物的胆汁的组8中,诺如病毒的增殖更显著地高。产业上的可利用性根据本发明,能够以体外方式人工大量地进行人腹泻症病毒增殖培养来生产,能够有助于对人腹泻症病毒的病态的解析、抗病毒药和消毒药的开发、疫苗的开发等。sequencelisting<110>keiouniversity<120>methodforproducinghumandiarrheavirus<130>pc-24113<150>jp2016-163711<151>2016-08-24<160>3<170>patentinversion3.5<210>1<211>26<212>dna<213>artificialsequence<220><223>senseprimernamedcog2f<220><221>misc_feature<222>(9)..(9)<223>nisa,c,g,ort<400>1cargarbcnatgttyagrtggatgag26<210>2<211>21<212>dna<213>artificialsequence<220><223>antisenseprimernamedcog2r<400>2tcgacgccatcttcattcaca21<210>3<211>20<212>dna<213>artificialsequence<220><223>synthesyzedprobeforring2<400>3tgggagggcgatcgcaatct20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1