作为脱色剂或亮白剂的二氟化的化合物的制作方法
本文描述的发明涉及新的二氟化的化合物,它们在化妆品和药物应用中的用途及其制备方法。这些化合物特别地可用作脱色剂、亮白剂、漂白剂或增白剂,以及用于治疗干扰性色素沉着。
背景技术:
对有效和安全的亮肤产品的需求导致开发了许多亮肤剂,例如曲酸、乙醇酸、壬二酸、儿茶素、对苯二酚、熊果苷,以及最近的脱氧熊果苷。已经开发了它们用于亮肤或治疗色素沉着障碍。这些化合物作为酪氨酸酶的抑制剂,所述酪氨酸酶催化赋予皮肤和头发颜色的黑色素的形成。过度产生黑色素,例如长时间暴露于阳光,激素变化或医学治疗,会产生皮肤色素沉着过度(int.j.mol.sci.2009,10,4066-4087)。
酪氨酸酶抑制剂在治疗色素沉着过度的化妆品中变得重要。
氢醌的衍生物,例如熊果苷(氢醌的糖基化形式),脱氧熊果苷(不含羟基部分的熊果苷的合成形式)或其衍生物(例如描述于wo2013/103874)是非常有吸引力的化合物。
然而,缩醛官能团的裂解导致氢醌的释放,由于可能的副作用,氢醌在化妆品应用中受到限制(biosci.biotechnol.biochem.2013,77,1127-1130;indianj.dermatol.venereol.leprol.2010,76,3-6)。
已经开发了更稳定的氢醌衍生物(wo2012/160218),但是像熊果苷这样的化合物对目标作用部位(即黑素细胞)的皮肤渗透性差。
这就是为什么开发相比已经提供的脱色剂或亮白剂更有效和更安全的新的脱色剂或亮白剂仍然是一个重要目的。
已经出人意料地发现,在碳环部分的不同位置上存在羟基和/或氨基的新的二氟化衍生物具有改善的功效,安全性和渗透性,并且也可通过更短的化学合成方法获得,使得降低它们的生产成本。
技术实现要素:
因此,本发明涉及具有下式i的化合物:
或其化妆品或药学上可接受的盐,立体异构体或以任何比例的立体异构体的混合物,特别地对映异构体或对映异构体的混合物,更特别地外消旋体混合物,
其中:
-r1表示氢原子、oh、osir3r4r5、or6、oc(o)r7、oco2r8、oc(o)nr9r10、op(o)(or11)2,或oso3r12,
-r2表示oh、osir13r14r15、or16、oc(o)r17、oco2r18、oc(o)nr19r20、op(o)(or21)2、oso3r22、nh2、nhr33,或nr33r34,
-x1、x2、x3、x4和x5彼此独立地表示氢原子、oh、osir23r24r25、or26、oc(o)r27、oco2r28、oc(o)nr29r30、op(o)(or31)2,或oso3r32,
其中:
-r3、r4、r5、r13、r14、r15、r23、r24和r25彼此独立地表示(c1-c6)烷基、芳基、芳基-(c1-c6)烷基或(c1-c6)烷基-芳基,
-r6、r16和r26彼此独立地表示o-保护基团;或(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、(c3-c7)环烷基、5-至7-元杂环烷基、芳基、杂芳基、(c3-c7)环烷基-(c1-c6)烷基、(5-至7-元杂环烷基)-(c1-c6)烷基、芳基-(c1-c6)烷基或杂芳基-(c1-c6)烷基,所述基团任选地被一个或多个选自卤原子、(c1-c6)烷基和(c1-c6)烷氧基的基团取代,
-r7、r8、r17、r18、r27和r28彼此独立地表示(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、(c3-c7)环烷基、5-至7-元杂环烷基、芳基、杂芳基、(c3-c7)环烷基-(c1-c6)烷基,(5-至7-元杂环烷基)-(c1-c6)烷基、芳基-(c1-c6)烷基或杂芳基-(c1-c6)烷基、所述基团任选地被一个或多个选自卤原子、(c1-c6)烷基和(c1-c6)烷氧基的基团取代,
-r9、r10、r19、r20、r29和r30彼此独立地表示氢原子;n-保护基团;或(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、(c3-c7)环烷基、5-至7-元杂环烷基、芳基、杂芳基、(c3-c7)环烷基-(c1-c6)烷基,(5-至7-元杂环烷基)-(c1-c6)烷基,芳基-(c1-c6)烷基或杂芳基-(c1-c6)烷基,所述基团任选地被一个或多个选自卤原子、(c1-c6)烷基和(c1-c6)烷氧基的基团取代,
-r11、r12、r21、r22、r31和r32彼此独立地表示氢原子或(c1-c6)烷基,并且
-r33和r34彼此独立地表示n-保护基团;或(c1-c6)烷基、(c2-c6)烯基、(c2-c6)炔基、(c3-c7)环烷基、5-元至7-元杂环烷基、芳基、杂芳基、芳基-(c1-c6)烷基、杂芳基-(c1-c6)烷基、(c1-c6)-烷基-芳基或(c1-c6)-烷基-杂芳基,所述基团任选地被一个或多个选自卤原子、oh、cooh和cho的基团取代。
如在本发明中所使用的:
-“化妆品或药学上可接受的”涉及对制备化妆品或药物组合物有用的物质,其通常是无毒的,安全的并且对于药物和化妆品用途是可接受的。
-“化妆品或药学上可接受的盐”涉及如本文所限定的化妆品或药学上可接受的盐,并且其具有原始化合物的药学和化妆品性质和活性。
它可以为:(1)与无机酸如盐酸、溴酸、硫酸、硝酸、磷酸等形成的酸加成盐;或与有机酸如乙酸、苯磺酸、苯甲酸、樟脑磺酸、柠檬酸、乙磺酸、富马酸、葡庚糖酸、葡萄糖酸、谷氨酸、乙醇酸、羟基萘酸、2-羟基乙磺酸、乳酸、马来酸、苹果酸、扁桃酸、甲磺酸、粘康酸、2-萘磺酸、丙酸、水杨酸、琥珀酸、二苯甲酰基-l-酒石酸、酒石酸、对甲苯磺酸、三甲基乙酸、三氟乙酸等形成的酸加成盐,和(2)当母体化合物中存在的酸质子被金属离子例如碱金属离子(例如na+、k+或li+)、碱土金属离子(如ca2+或mg2+)或铝离子取代时形成的盐;或者与有机碱或无机碱配位时形成的盐。可接受的有机碱包括二乙醇胺、乙醇胺、n-甲基葡糖胺、三乙醇胺、氨丁三醇等。可接受的无机碱包括氢氧化铝、氢氧化钙、氢氧化钾、碳酸钠和氢氧化钠。
化妆品或药学上可接受的盐特别地可以为盐酸盐。
-“立体异构体”是指构型立体异构体并且包括几何异构体和光学异构体。
几何异构体,也称为e/z异构体或顺式-反式异构体,由c=c双键上取代基的不同位置而产生,其可具有z或e构型,也称为顺式或反式构型。
光学异构体由包含四个不同取代基(包括可能地孤对电子)的原子(例如碳或硫原子)上的取代基或孤对电子的不同空间位置而产生。因此该原子表示手性或不对称中心。因此,将彼此不是镜像的光学异构体称为“非对映异构体”,将不可重叠的镜像的光学异构体称为“对映异构体”。
将手性化合物的两种对映异构体的等摩尔混合物称为外消旋体或外消旋混合物。
-“(c1-c6)烷基”是指含有1至6个碳原子的直链或支链饱和烃链,包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异-丁基、仲丁基、叔丁基、正戊基、正己基等。
-“(c2-c6)烯基”是指含有2至6个碳原子且包含至少一个双键的直链或支链不饱和烃链,包括但不限于乙烯基、丙烯基、丁烯基、戊烯基、己烯基等。
-“(c2-c6)炔基”是指含有2至6个碳原子且包含至少一个三键的直链或支链不饱和烃链,包括但不限于乙炔基、丙炔基、丁炔基、戊炔基、己炔基等。
-“(c1-c6)烷氧基”是指如上限定的(c1-c6)烷基通过氧原子与分子结合,包括但不限于甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基、正戊氧基、正己氧基等。
-“(c3-c7)环烷基”是指具有3至7个碳原子的烃环,包括但不限于环丙基、环戊基、环己基等。
-“(c3-c7)环烷基-(c1-c6)烷基”是指如上限定的(c3-c7)环烷基通过如上限定的(c1-c6)烷基与分子结合。有利地,(c3-c7)环烷基-(c1-c6)烷基包括环丙基、环戊基或环己基部分和甲基或乙基部分。
-“芳基”是指芳族烃基,其优选包含6至10个碳原子并且包含一个或多个稠环,例如苯基或萘基。
-“芳基-(c1-c6)烷基”是指如上限定的芳基通过如上限定的(c1-c6)烷基与分子结合。特别地,芳基-(c1-c6)烷基为苄基。
-“(c1-c6)烷基-芳基”是指通过如上限定的(c1-c6)烷基通过如上限定的芳基与分子结合。特别地,(c1-c6)烷基-芳基为甲基-苯基。
-“5-至7-元杂环烷基”是指具有5至7个成员的饱和烃环,其中一个或几个,特别地1至3个(例如1或2个)碳原子各自被氮原子、氧原子或硫原子所替代,优选被氮原子或氧原子所替代。它可以为例如吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基、吗啉基、哌嗪基或氮杂环庚烷基。
“(5-至7-元杂环烷基)-(c1-c6)烷基”是指如上限定的5-至7-元杂环烷基通过如上限定的(c1-c6)烷基与分子结合。(5-至7-元杂环烷基)-(c1-c6)烷基可包括例如吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基、吗啉基、哌嗪基或氮杂环庚烷基部分和甲基或乙基部分。
-“杂芳基”是指芳族基团,优选具有5至10个成员,包含一个或多个,特别地一个或两个稠环,其中一个或多个环的原子包含一个或多个,有利地1至4个,更有利地1或2个选自氮原子、氧原子和硫原子的杂原子,其余为碳原子。杂芳基可以特别地为噻吩基、呋喃基、吡咯基、吲哚基等。
-“杂芳基-(c1-c6)烷基”是指如上限定的杂芳基通过如上限定的(c1-c6)烷基与分子结合。杂芳基-(c1-c6)烷基可包括例如噻吩基、呋喃基、吡咯基或吲哚基部分和甲基或乙基部分。
-“三烷基甲硅烷基”是指基团-sialk1alk2alk3,其中alk1、alk2和alk3,相同或不同,表示如上限定的(c1-c6)-烷基。例如,它可以为三甲基甲硅烷基或三乙基甲硅烷基。
-“卤原子”是指氟原子、溴原子、氯原子或碘原子。
-“保护基团”是指选择性地阻断多官能化合物中的反应性位点的化学基团,以使得选择性地在另一未受保护的反应性位点上进行化学反应。
-“o-保护基团”是指保护羟基(oh)在合成过程中不发生不希望的反应的取代基,例如“greene’sprotectivegroupsinorganicsynthesis”,第四版,2007,johnwiley&sons,hoboken,newjersey中公开的那些o-保护基团。由o-保护基团保护的羟基可以为例如醚、酯、碳酸酯、缩醛等。特别地,o-保护基团可以为任选地被一个或几个(特别地1个至3个)卤原子(例如氯原子)取代的(c1-c6)烷基,例如甲基、乙基、叔丁基或2,2,2-三氯乙基;芳基-(c1-c6)烷基,例如苄基,芳基部分任选地被一个或几个甲氧基取代,例如苄基(bn)或对甲氧基苄基(pmb);式–car1ar2ar3的三苯甲基衍生物,例如三苯基甲基(也称为三苯甲基-tr)、(4-甲氧基苯基)二苯甲基(也称为甲氧基三苯甲基-nmt)或双-(4-甲氧基苯基)苯基甲基(也称为二甲氧基三苯甲基-dmt);式-ch2orgp2或-ch2srgp2(特别是-ch2orgp2)的取代甲基,例如甲氧基甲基(mom)、苄氧基甲基、2-甲氧基乙氧基甲基(mem)、2-(三甲基甲硅烷基)乙氧基甲基或甲硫基甲基;式-ch2ch2orgp2或-ch2ch2srgp2(特别是-ch2ch2orgp2)的取代乙基,例如乙氧基乙基(ee);式-sirgp3rgp4rgp5的甲硅烷基,例如,三甲基甲硅烷基(tms)、三乙基甲硅烷基(tes)、叔丁基二甲基甲硅烷基(tbs或tbdms)和叔丁基二苯基甲硅烷基(tbdps);式-co-rgp6的羰基化基团,例如乙酰基(ac),新戊酰基(piv或pv)或苯甲酰基(bz)或式–co2-rgp7的羰基化基团,如烯丙氧基羰基(alloc)或9-芴基甲氧基羰基(fmoc);或四氢吡喃基
-“n-保护基团”是指旨在保护胺官能团(特别是伯胺官能团)在合成过程中不发生不希望的反应的基团。常用的n-保护基团公开于“greene’sprotectivegroupsinorganicsynthesis”,第四版,2007年,johnwiley&sons,hoboken,newjersey。由n-保护基团保护的胺官能团可以为氨基甲酸酯、酰胺、磺酰胺、n-烷基衍生物、氨基缩醛衍生物、n-苄基衍生物、亚胺衍生物、烯胺衍生物或n-杂原子衍生物。特别地,n-保护基团可以为甲酰基;任选地被一个或几个甲氧基取代的芳基(例如苯基),例如对甲氧基苯基(pmp);芳基-(c1-c6)烷基(例如苄基),芳基部分任选地被一个或几个甲氧基取代,例如苄基(bn),对甲氧基苄基(pmb)或3,4-二甲氧基苄基(dmpm);-co-rgp1例如乙酰基(ac)、新戊酰基(piv或pv)、苯甲酰基(bz)或对甲氧基苄基羰基(moz);-co2-rgp1例如叔丁氧基羰基(boc)、三氯乙氧基羰基(troc)、烯丙氧基羰基(alloc)、苄氧基羰基(cbz或z)或9-芴基甲氧基羰基(fmoc);-so2-rgp1例如苯磺酰基、甲苯磺酰基(ts或tos)或2-硝基苯磺酰基(也称为nosyl-nos或ns);等,其中rgp1表示任选地被一个或几个卤原子(例如f或cl)取代的(c1-c6)烷基;(c2-c6)链烯基,例如烯丙基;任选地被一个或几个选自ome(甲氧基)和no2(硝基)的基团取代的芳基(例如苯基);芳基-(c1-c6)烷基,例如苄基,芳基部分任选地被一个或几个甲氧基取代;或9-芴基甲基。特别地,它可以为叔丁氧基羰基、苄氧基羰基或9-芴基甲氧基羰基。
根据第一个特别的实施方案,根据本发明的化合物为具有下式ia的化合物:
或其化妆品或药学上可接受的盐,立体异构体或以任何比例的立体异构体的混合物,特别地对映异构体或对映异构体的混合物,更特别地外消旋体混合物,
其中r1、x1、x2、x3、x4和x5如上或如下所限定,r2a表示oh、osir13r14r15、or16、oc(o)r17、oco2r18、oc(o)nr19r20、op(o)(or21)2,或oso3r22,其中r13至r22如上或如下所限定。因此,r2a为r2基团,其中r2=oh、osir13r14r15、or16、oc(o)r17、oco2r18、oc(o)nr19r20、op(o)(or21)2,或oso3r22。
根据第二个特别的实施方案,根据本发明的化合物为具有下式ib的化合物:
或其化妆品或药学上可接受的盐,立体异构体或以任何比例的立体异构体的混合物,特别地对映异构体或对映异构体的混合物,更特别地外消旋体混合物,其中r1、x1、x2、x3、x4和x5如上或如下所限定,r2b表示nh2、nhr33,或nr33r34,其中r33和r34如上或如下所限定。因此,r2b为r2基团,其中r2=nh2、nhr33,或nr33r34。
有利地,x1、x2、x3、x4和x5彼此独立地表示氢原子、oh、or26、oc(o)r27、oco2r28,或oc(o)nr29r30;优选表示氢原子、oh或or26。
特别地,x1、x2、x3、x4和x5中的至少一个,并且优选x3表示除氢原子之外的基团,例如oh、or26、oc(o)r27、oco2r28,或oc(o)nr29r30,特别地例如oh或or26。
更特别地,x1、x2、x4和x5各自表示氢原子,x3表示除氢原子之外的基团,即oh、osir23r24r25、or26、oc(o)r27、oco2r28、oc(o)nr29r30、op(o)(or31)2,或oso3r32;尤其表示oh、or26、oc(o)r27、oco2r28,或oc(o)nr29r30;特别地表示oh或or26。
有利地,r1表示氢原子、oh、or6、oc(o)r7、oco2r8或oc(o)nr9r10;更特别地表示氢原子、oh或or6。
有利地,r2表示nh2、nhr33、nr33r34、oh、or16、oc(o)r17、oco2r18或oc(o)nr19r20;特别地表示nh2、nhr33、nr33r34、oh或or16;更特别地表示nh2、oh或or16,例如nh2或oh。r2可以特别地表示oh、or16、oc(o)r17、oco2r18或oc(o)nr19r20;更特别地表示oh或or16,例如oh。
根据特别的实施方案:
-r1表示氢原子、oh、or6、oc(o)r7、oco2r8或oc(o)nr9r10,并且
-r2表示nh2、nhr33、nr33r34、oh、or16、oc(o)r17、oco2r18或oc(o)nr19r20;特别地表示oh、or16、oc(o)r17、oco2r18或oc(o)nr19r20。
根据另一特别的实施方案:
-r1表示氢原子、oh或or6,并且
-r2表示nh2、nhr33、nr33r34、oh或or16;更特别地表示nh2、oh或or16;特别地表示oh或or16。
根据特别的实施方案,r1不表示氢原子。
在本发明优选的实施方案中:
-x1、x2、x4、x5相同并表示氢原子,
-x3表示oh、osir23r24r25、or26、oc(o)r27、oco2r28、oc(o)nr29r30、op(o)(or31)2,或oso3r32,
-r1表示氢原子、oh、osir3r4r5、or6、oc(o)r7、oco2r8、oc(o)nr9r10、op(o)(or11)2,或oso3r12,并且
-r2表示nh2、nhr33、nr33r34、oh、osir13r14r15、or16、oc(o)r17、oco2r18、oc(o)nr19r20、op(o)(or21)2,或oso3r22;特别地表示oh、osir13r14r15、or16、oc(o)r17、oco2r18、oc(o)nr19r20、op(o)(or21)2,或oso3r22。
在本发明另一优选的实施方案中:
-x1、x2、x4、x5相同并表示氢原子,
-x3表示oh、or26、oc(o)r27、oco2r28或oc(o)nr29r30,
-r1表示氢原子、oh、or6、oc(o)r7、oco2r8或oc(o)nr9r10,并且
-r2表示nh2、nhr33、nr33r34、oh、or16、oc(o)r17、oco2r18或oc(o)nr19r20;特别地表示oh、or16、oc(o)r17、oco2r18或oc(o)nr19r20。
在本发明更优选的实施方案中:
-x1、x2、x4、x5相同并表示氢原子,
-x3表示oh或or26,例如oh,
-r1表示氢原子、oh或or6,例如h或oh,并且
-r2表示nh2、nhr33、nr33r34、oh或or16;更特别地表示nh2、oh或or16;特别地表示oh或or16,例如oh。
根据特别有利的实施方案:
-x1、x2、x4、x5相同并表示氢原子,并且
-x3、r1和r2相同并表示oh。
根据另一特别有利的实施方案:
-x1、x2、x4、x5相同并表示氢原子,
-x3和r2相同并表示oh,并且
-r1表示氢原子。
根据另一特别有利的实施方案:
-x1、x2、x4、x5相同并表示氢原子,
-x3表示oh,
-r2表示nh2,并且
-r1表示氢原子。
特别地,在上面x1、x2、x3、x4、x5、r1和r2的限定中:
-r6、r7、r8、r16、r17、r18、r26、r27和r28彼此独立地表示(c1-c6)烷基、芳基、杂芳基、芳基-(c1-c6)烷基或杂芳基-(c1-c6)烷基,所述基团任选地被一个或几个选自卤原子、(c1-c6)烷基和(c1-c6)烷氧基的基团取代,
-r9、r10、r19、r20、r29和r30彼此独立地表示氢原子,或(c1-c6)烷基、芳基、杂芳基、芳基-(c1-c6)烷基或杂芳基-(c1-c6)烷基,所述基团任选地被一个或几个选自卤原子、(c1-c6)烷基和(c1-c6)烷氧基的基团取代,并且
-r33和r34彼此独立地表示(c1-c6)烷基、芳基、杂芳基、芳基-(c1-c6)烷基或杂芳基-(c1-c6)烷基,所述基团任选地被一个或几个选自卤原子、oh、cooh和cho的基团取代。
更特别地,在上面x1、x2、x3、x4、x5、r1和r2的限定中:
-r6、r7、r8、r16、r17、r18、r26、r27和r28彼此独立地表示(c1-c6)烷基、芳基、芳基-(c1-c6)烷基,所述基团任选地被一个或几个选自卤原子、(c1-c6)烷基和(c1-c6)烷氧基的基团取代,
-r9、r10、r19、r20、r29和r30彼此独立地表示氢原子,或(c1-c6)烷基、芳基或芳基-(c1-c6)烷基,所述基团任选地被一个或几个选自卤原子、(c1-c6)烷基和(c1-c6)烷氧基的基团取代,并且
-r33和r34彼此独立地表示(c1-c6)烷基、芳基或芳基-(c1-c6)烷基,所述基团任选地被一个或几个选自卤原子、oh、cooh和cho的基团取代。
优选地,在上面x1、x2、x3、x4、x5、r1和r2的限定中:
-r6、r7、r8、r16、r17、r18、r26、r27、r28、r33和r34彼此独立地表示(c1-c6)烷基、芳基或芳基-(c1-c6)烷基,并且
-r9、r10、r19、r20、r29和r30彼此独立地表示氢原子或(c1-c6)烷基、芳基或芳基-(c1-c6)烷基。
根据本发明的化合物可以选自:
及其化妆品或药学上可接受的盐。
根据本发明的化合物可以有利地选自:示例性化合物7、8、15、16、16a、16b、21、26a、26b、28a、28b及其化妆品或药学上可接受的盐,特别是示例性化合物7、8、15、16及其化妆品或药学上可接受的盐,优选选自示例性化合物8、16、16a、16b、28a、28b及其化妆品或药学上可接受的盐,特别是示例性化合物8、16及其化妆品或药学上可接受的盐。
化妆品或药学上可接受的盐的实例为化合物27a和27b,它们分别为28a和28b的盐酸盐。
本发明还涉及制备式i化合物或其化妆品或药学上可接受的盐的方法。
制备式i化合物的特别方法描述于方案1中。
方案1
-其中x1、x2、x3、x4、x5、r1、r2如上限定且r2和苯氧基取代基为顺式构型的式i化合物可通过式ii化合物和式iii化合物之间的亲核取代来制备
其中x1x、x2x、x3x、x4x、x5x、r1x和r2x分别表示如上限定的x1、x2、x3、x4、x5、r1和r2,任选地为保护形式,并且r表示离去基团。
本发明中使用的术语“离去基团”是指在亲核取代反应过程中易于被亲核试剂取代的化学基团,在本情况下,亲核试剂为醇,即带有oh基团的分子。这种离去基团特别地可以为磺酸盐。磺酸盐特别地为–oso2-rlg基团,其中rlg表示(c1-c6)烷基、芳基、芳基-(c1-c6)烷基或(c1-c6)烷基-芳基,所述基团任选地被一个或几个卤原子(例如氟原子)取代。磺酸盐尤其可以为甲磺酸盐(ch3-s(o2)o-)、三氟甲烷磺酸盐(cf3-s(o)2o-)或甲苯磺酸盐(p-me-c6h4-s(o)2o-),特别为三氟甲烷磺酸盐。
亲核取代可以例如在二甲基甲酰胺中并在碱(例如k2co3或nah,优选k2co3)的存在下实现。
当x1x、x2x、x3x、x4x、x5x、r1x和r2x中的至少一者为保护形式时,可能需要一个或几个去保护步骤。去保护的条件是本领域技术人员公知的(例如“greene’sprotectivegroupsinorganicsynthesis”,第4版,2007年,johnwiley&sons,hoboken,newjersey)。
受保护的基团可以特别地为oh基团,其可以用任何o-保护基团(例如前面限定的,特别是苄基)进行保护。受保护的基团还可以特别地为nh2基团,其可以用任何n-保护基团(例如前面限定的,特别cbz基团)进行保护。
-式ii化合物可商购或用公知的合成方法进行制备。
-通过本领域技术人员公知的方法将羟基转化为良好的离去基团r,可以从化合物iv获得式iii化合物。
-式iv化合物可在氢化条件下由化合物v进行制备。在这种情况下,通过使用氢和钯碳作为催化剂,尤其是在作为溶剂的乙酸乙酯中,可以减少双键。反应可以在三乙胺存在下进行。
-式v化合物可通过二烯化合物vi的关环复分解(rcm)产生。该反应可以在grubbs催化剂(优选第二代)的存在下,尤其是在作为溶剂的甲苯中进行。
-通过在金属存在下在羰基化合物vii上加成3-溴-3,3-二氟丙烯,可以形成式vi化合物。例如,金属可以为铟、锌、镉或锡。特别地,金属为铟。该步骤可以在作为溶剂的四氢呋喃/水(thf/h2o)中进行。
制备式i化合物的另一方法描述于方案2中。
方案2
-其中x1、x2、x3、x4、x5、r1、r2如上所限定的式i化合物可通过式xi化合物的氟化反应获得,
其中x1x、x2x、x3x、x4x、x5x、r1x和r2x如先前限定。
氟化剂可以例如为dast(二乙氨基三氟化硫)。氟化反应可在二氯甲烷中进行。
当x1x、x2x、x3x、x4x、x5x、r1x和r2x中的至少一者为保护形式时,可能需要一个或几个去保护步骤。去保护的条件是本领域技术人员公知的(例如“greene’sprotectivegroupsinorganicsynthesis”,第4版,2007年,johnwiley&sons,hoboken,newjersey)。
-式xi化合物可通过在氧化条件下(例如dessmartin试剂,尤其是在二氯甲烷中)氧化式x化合物来制备。
-式x化合物可通过硼氢化-氧化顺序由化合物ix制备。这种反应是本领域技术人员公知的。
-式ix化合物可通过式viii化合物与上述式ii化合物之间的mitsunobu反应来获得。这种反应是本领域技术人员公知的。
式vii化合物和式viii化合物可以使用本领域技术人员已知的方法进行制备。
制备式i化合物(其中x3=oh)的另一方法描述于方案3中。
方案3
-其中x1、x2、x3、x4、x5、r1如上所限定,r2为oh、osir13r14r15、or16、oc(o)r17、oco2r18、oc(o)nr19r20、op(o)(or21)2,或oso3r22,并且r2和苯氧基取代基为反式构型的式i化合物,可通过氧化式xv的芳香醛进行制备,
其中x1x、x2x、x4x、x5x、r1x和r2x如先前限定。
可通过在m-cpba和naoh的作用下使用dakin反应进行氧化。
当x1x、x2x、x4x、x5x、r1x和r2x中的至少一者为保护形式时,可能需要一个或几个去保护步骤。去保护的条件是本领域技术人员公知的(例如“greene’sprotectivegroupsinorganicsynthesis”,第4版,2007年,johnwiley&sons,hoboken,newjersey)。
-式xv化合物可通过式xiv化合物与式xvi化合物之间的芳族亲核取代来获得。
亲核取代可以例如在二甲基甲酰胺中和在碱例如k2co3的存在下实现。
-式xvi化合物可商购或用公知的合成方法进行制备。
-式xiv化合物可通过式xiii环氧化合物的开环而产生。该反应可以在芳族醇和路易斯酸例如三氟甲磺酸铒(iii)的存在下进行。
-式xiii化合物可通过式xii化合物的二氟化反应而形成。氟化剂可以为dast(二乙氨基三氟化硫)。
-式xii化合物可商购或用公知的合成方法进行制备。
制备式i化合物的另一方法描述于方案4中。
方案4
-其中x1、x2、x3、x4、x5、r1如上所限定,r2为nh2、nhr33,或nr33r34,并且r2和苯氧基取代基为顺式构型的式i化合物可通过式ii化合物和式xvii化合物之间的亲核取代来获得,其中x1x、x2x、x3x、x4x、x5x、r1x如先前限定,r表示离去基团,例如磺酸盐(例如三氟甲磺酸盐),r2x表示如上限定的r2,任选地以受保护的形式。
当x1x、x2x、x3x、x4x、x5x、r1x和r2x中的至少一者为保护形式时,可能需要一个或几个去保护步骤。去保护的条件是本领域技术人员公知的(例如“greene’sprotectivegroupsinorganicsynthesis”,第4版,2007,johnwiley&sons,hoboken,newjersey)。
-通过本领域技术人员公知的方法将羟基转化为良好的离去基团r(例如磺酸盐,如三氟甲磺酸酯),可以从化合物xvi获得式xvii化合物。
-式xviv化合物可通过式xiii环氧化合物的开环而产生。该反应可以例如在胺和三甲基铝的存在下实现。
-式xiii化合物可通过式xii化合物的二氟化反应而形成。氟化剂可以为dast(二乙氨基三氟化硫)。
在上述四种方法中可以使用保护和去保护步骤,以防止不希望的反应。这些步骤是本领域技术人员公知的。
最后的成盐步骤可以在两种方法中进行,以制备式i化合物在化妆品或药学上可接受的的盐。这种反应可通过将式i化合物与合适的酸或碱(尤其是如上限定的)混合来进行。
可以通过使用本领域技术人员公知的方法将本发明中描述的化合物与反应介质分离,例如通过萃取、蒸发溶剂、沉淀或结晶,然后过滤。
例如,可以通过硅胶柱色谱,高效液相色谱,重结晶或蒸馏来纯化化合物。
本发明还涉及化妆品或药物组合物,更特别地涉及化妆品或皮肤病学组合物,其包含至少一种根据本发明的化合物和至少一种化妆品或药学上可接受的赋形剂。
这种组合物更特别地旨在局部施用,特别是施用于皮肤,例如人体皮肤。
因此,这种组合物可以是洗剂、泡沫、凝胶、分散体、悬浮液、喷雾剂、精华液、面霜、乳液,乳状物和油或面膜的形式。
本发明的组合物还可包含一种或多种添加剂,例如抗氧化剂、润肤剂、保湿剂、增稠剂、芳香剂、防腐剂、颜料或着色剂,或遮光剂。这些添加剂对于本领域技术人员来说是常规的。
这些添加剂的实例列于下面以及internationalcosmeticingredientdictionaryandhandbook,eds.wenningerandmcewen(thecosmetic,toiletry,andfragranceassoc.,washington,d.c.,第7@版,1997)中。
抗氧化剂可用于保护组合物的成分免受包含在组合物内或与组合物接触的氧化剂的影响。抗氧化剂的实例包括抗坏血酸棕榈酸酯、丁基化羟基苯甲醚、丁基化羟基甲苯、没食子酸丙酯钾、没食子酸辛酯、没食子酸十二烷基酯、苯基-α-萘基胺和生育酚如α-生育酚。
润肤剂是使皮肤柔软和光滑的药剂。润肤剂的实例包括油和蜡,例如硅氧烷(例如聚二甲基硅氧烷及其衍生物)、微晶蜡、聚乙烯、甘油三酯(例如蓖麻油、可可脂、红花油、玉米油、橄榄油、鳕鱼肝油、杏仁油、棕榈油、角鲨烯和大豆油的那些)、乙酰化单酸甘油酯、乙氧基化甘油酯、脂肪酸、脂肪酸烷基酯、脂肪酸链烯基酯、脂肪醇、脂肪醇醚、醚酯、羊毛脂和羊毛脂衍生物、多元醇酯、蜡酯(例如蜂蜡、植物蜡)、磷脂、甾醇、棕榈酸异丙酯或硬脂酸甘油酯。
保湿剂用于增加和保持皮肤中的水分。保湿剂的实例包括丙二醇、丁二醇、聚乙二醇(peg)(例如peg-4至peg-32)、丙三醇(也称为甘油)、山梨糖醇、木糖醇、麦芽糖醇、甘露醇、聚葡萄糖、透明质酸及其盐(例如钠盐或钾盐)、尿素、芦荟、蜂蜜等。
增稠剂用于增加组合物的粘度和厚度。增稠剂的实例包括脂质增稠剂,例如鲸蜡醇、硬脂醇、肉豆蔻醇、巴西棕榈蜡或硬脂酸;天然衍生增稠剂,例如纤维素衍生物(如羟乙基纤维素)、瓜尔胶、刺槐豆胶、黄原胶或明胶;矿物增稠剂,例如二氧化硅、膨润土或硅酸铝镁;合成增稠剂如卡波姆;离子增稠剂如nacl。
芳香剂或香料的实例包括薄荷、玫瑰油、玫瑰水、芦荟、丁香油、薄荷醇、樟脑、桉树油和其他植物提取物。为了从组合物中除去某些气味,可以使用掩盖剂。
防腐剂可用于保护组合物免于降解。防腐剂的实例包括苯氧基乙醇、对羟基苯甲酸丁酯、对羟基苯甲酸乙酯、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯扎氯铵、苄索氯铵、苯甲酸、苯甲醇及其混合物如液化油。但是,本发明的组合物可以不含防腐剂。
颜料或着色剂用于改变组合物的颜色,例如以获得白色组合物。
在清澈或透明的组合物使用遮光剂(例如氧化钛),以使其不透明。因此,根据是否使用遮光剂,本发明可以是清澈的或不透明的。
本发明还涉及根据本发明的化合物,特别是作为脱色剂、亮白剂、漂白剂或增白剂,更特别地用于皮肤(例如人体皮肤)的化妆品用途。
本发明还涉及根据本发明的化妆品组合物,特别是作为脱色组合物、亮白组合物、漂白组合物或增白组合物,更特别地旨在局部施用于皮肤(例如人体皮肤)的化妆品用途。
本发明还涉及根据本发明的化合物在制备化妆品组合物中的用途,所述化妆品组合物尤其旨在用于使皮肤(例如人体皮肤)脱色、亮白、漂白或增白。
本发明还涉及根据本发明的化合物用作更特别地用于皮肤(例如人体皮肤)的脱色剂、亮白剂、漂白剂或增白剂。
本发明还涉及用于使皮肤(例如人体皮肤)脱色、亮白、漂白或增白的方法,所述方法通过在所述皮肤上施用有效量的根据本发明的化合物或根据本发明的化妆品组合物给有此需要的人。
本发明还涉及根据本发明的化合物尤其在治疗色素沉着障碍中作为药物的用途,更特别地通过局部施用于皮肤,例如人体皮肤。
本发明还涉及根据本发明的药物组合物(特别是皮肤病学组合物)尤其在治疗色素沉着障碍中作为药物的用途,更特别地通过局部施用于皮肤,例如人体皮肤。
本发明还涉及根据本发明的化合物在制备药物组合物,特别是皮肤病学组合物中的用途,所述药物组合物尤其旨在用于更特别地通过局部施用于皮肤(例如人体皮肤)治疗色素沉着障碍。
本发明还涉及根据本发明的化合物用于更特别地通过局部施用于皮肤(例如人体皮肤)治疗色素沉着障碍的用途。
本发明还涉及用于治疗皮肤(例如人体皮肤)色素沉着障碍的方法,所述方法通过在所述皮肤上施用有效量的根据本发明的化合物或根据本发明的药物组合物(特别是皮肤病学组合物)给有此需要的人。
色素沉着障碍更特别是色素沉着过度,尤其是由于过度暴露于阳光、燃烧、损伤、烧伤、药物或激素改变,例如雀斑或黄褐斑。
为了说明本发明,下面描述化合物制备的实施例。列出的实施例不旨在限制性的。
附图说明
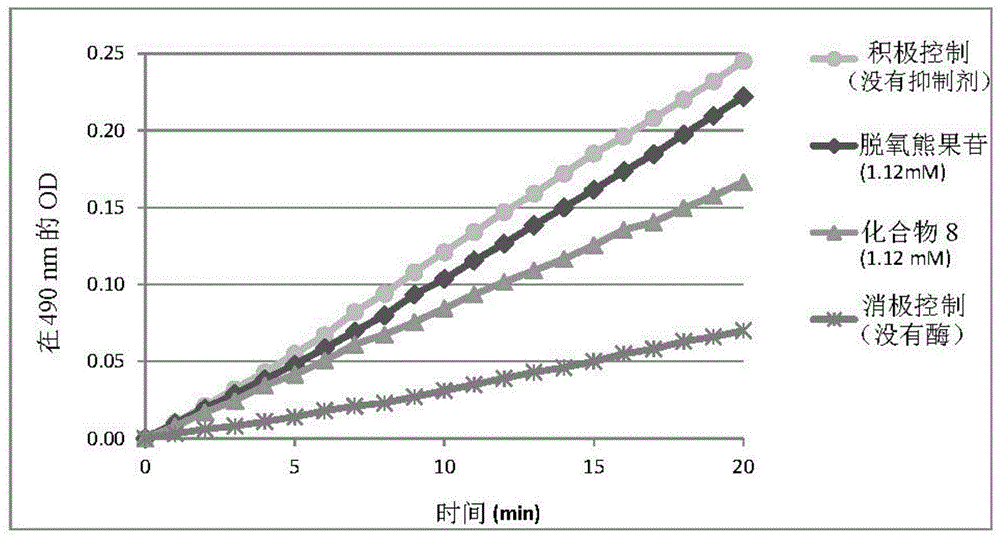
图1表示化合物8在1.12mm对人酪氨酸酶动力学的抑制。
具体实施方式
实施例
在实施例中已使用以下缩写。
dast:二乙氨基三氟化硫
dbu:1,8-二氮杂二环[5.4.0]十一-7-烯
dcm:二氯甲烷
dmf:二甲基甲酰胺
eq.:当量
esi:电喷雾电离
mcpba:间氯过氧苯甲酸
nmr:核磁共振
rt:室温
sat.aq.:饱和水溶液
thf:四氢呋喃
1.根据本发明的化合物的制备
中间体化合物2的合成
在惰性气氛下,将锌(32.8g,501.9mmol,5eq.)加入到化合物1(按照j.org.chem.2005,70,10139-10142中所述制备)(45.6g,100.4mmol,1eq.)在乙醇(1.4l)/水(70.2ml)/acoh(35.1ml)的混合物中的溶液中。将混合物在回流下搅拌1小时。然后将混合物在棉布上过滤以除去锌。用乙酸乙酯洗涤棉布并浓缩滤液,溶于乙酸乙酯中,用sat.aq.nahco3、水洗涤,用硫酸钠干燥,过滤并浓缩以得到淡黄色油状的中间体化合物2(29.6g,99%)。
1hnmr(cdcl3,300mhz):3.8(dd,j=1.5hz,j=3.9hz,1h);4.2(dd,j=3.9hz,j=7.5hz,1h);4.4(d,j=12hz,1h);4.6-4.7(m,2h);4.8(d,j=12hz,1h);5.3-5.4(m,2h);6(ddd,j=7.8hz,j=10.5hz,j=17.4hz,1h);7.3-7.4(m,10h);9.7(d,j=1.5hz,1h)。
中间体化合物3的合成
在惰性气氛下,将3-溴-3,3-二氟丙烯(12.3ml,119mmol,1.2eq.)加入到中间体化合物2(29.6g,99.7mmol,1eq.)在thf(55.4ml)/h2o(203ml)和铟(13.7g,119mmol,1.2eq.)中的冷却非均相溶液(10℃)中。将混合物在10℃下搅拌1小时。然后,加入hcl2n并用et2o萃取混合物。合并有机层,用硫酸钠干燥并浓缩。通过硅胶色谱法(
质量(esi+):375.2[m+h]+,392.2[m+nh4]+,397.2[m+na]+。
19fdecnmr(cdcl3,282.5mhz):108.2(d,j=251hz,1f);-113.4(d,j=251hz,1f)。
中间体化合物4的合成
在惰性气氛下,将grubbs’ii催化剂(2.09g,2.46mmol,8%)加入到中间体化合物3(11.5g,30.8mmol,1eq.)在甲苯(164ml)中的脱气溶液中。将混合物在回流下搅拌1小时,在sio2垫上过滤,用乙酸乙酯洗涤。浓缩滤液,通过硅胶色谱法(
质量(esi+):364.2[m+nh4]+。
19fdecnmr(cdcl3,282.5mhz):-102.4(d,j=274hz,1f);-105.2(d,j=274hz,1f)。
中间体化合物5的合成
将et3n(0.6ml,4.33mmol,1.5eq.),然后10%pd/c(0.184g,0.173mmol,6%)加入到中间体化合物4(1.00g,2.89mmol,1eq.)在乙酸乙酯(72ml)的溶液中。将混合物在氢气氛下在室温下搅拌2小时,在millipore0.45μm上过滤并浓缩。通过硅胶色谱法(
质量(esi+):366.2[m+nh4]+,371.1[m+na]+,387.1[m+k]+。
19fdecnmr(cdcl3,282.5mhz):-106.4(d,j=242hz,1f);-116.3(brd,1f)。
中间体化合物6的合成
在惰性气氛下,将吡啶(0.63ml,7.69mmol,4eq),然后三氟甲磺酸酐(1.29ml,7.69mmol,4eq)加入到中间体化合物5(670mg,1.92mmol,1eq.)在二氯甲烷(17.9ml)中的冷却溶液(0℃)中。将反应混合物在室温下搅拌16小时。然后将混合物用二氯甲烷稀释,并用2nhcl洗涤两次将有机层用硫酸钠干燥并浓缩,得到深色残余物的粗中间体化合物6(889mg)。将中间体化合物6不经进一步纯化用于下一步骤。
19fnmr(cdcl3,282.5mhz):-104.5(dt,j=246hz,j=11hz,1f);-115.5(d,j=246hz,1f)。
化合物7的合成
在惰性气氛下,将k2co3(0.673g,4.87mmol,3eq.)和苄氧基苯酚(1.14g,5.68mmol,3.5eq.)溶解在dmf(3.9ml)中,并将该悬浮液在室温下搅拌1小时。加入中间体化合物6(0.78g,1.62mmol,1eq.)在dmf(1.56ml)中的溶液,并将混合物加热至110℃过夜。然后加入水,水层用乙酸乙酯萃取两次。将合并的有机层用盐水洗涤,用硫酸钠干燥并浓缩,得到深色油状物。通过快速色谱法(
质量(esi+):548.3[m+nh4]+,553.2[m+na]+,569.2[m+k]+。
化合物8的合成
将pd/c10%(128mg,0.12mmol,10%,)加入到化合物7(637mg,1.2mmol,1eq.)在thf(35ml)中的溶液中。然后,加入1nhcl(4.8ml,4.8mmol,4eq.)。将混合物在氢气氛下在室温下搅拌2小时。过滤反应混合物(h-ptfe0.45μm)并浓缩。通过快速色谱法(
质量(esi-):259.1[m-h]-。
19fdec(meod,282.5mhz):-104.7(brd,j=257hz,1f);-106.8(brd,j=257hz,1f)。
中间体化合物9的合成
在0℃下,向外消旋形式的环己-2-烯醇(1.0g,9.68mmol,1eq.)的dcm(70ml)溶液中加入mcpba(77%,3.80g,16.9mmol,1.75eq.)。在室温下搅拌16小时后,将反应混合物用na2s2o3水溶液洗涤。然后将有机层用硫酸钠干燥,过滤并浓缩,得到粗残余物的中间体化合物9(360mg,33%)。
1hnmr(cdcl3,300mhz):1.00-2.00(m,6h);3.32(s,1h);3.35(s,1h);4.01(s,1h)。
中间体化合物10的合成
在55℃下,将中间体化合物9(360mg,3.15mmol,1eq.)的溶液加入到nah(204mg,8.52mmol,2.7eq.)和bnbr(0.377ml,3.15mmol,1eq.)在thf中的悬浮液中。在55℃加热4小时后,向混合物中缓慢加入冰,然后用et2o萃取两次。然后将合并的有机层用盐水洗涤,用硫酸钠干燥,过滤并浓缩。然后通过硅胶色谱法(
质量(ic+):205.2。
中间体化合物11的合成
在惰性气氛下,将中间体化合物10(410mg,2.00mmol,1eq.)在甲苯(12.6ml)中的溶液用三甲基甲硅烷基三氟甲磺酸酯(tmsotf)(0.38ml,2.11mmol,1.05eq.),然后用2,6-二甲基吡啶处理(1.17ml,10.0mmol,5eq.)进行处理。在室温下搅拌30分钟后,加入dbu(1.50ml,10.0mmol,5eq.)。然后将反应混合物用2nhcl稀释,用et2o萃取两次,并将合并的有机层用盐水洗涤,用硫酸钠干燥,过滤并浓缩。通过硅胶快速色谱法(
1hnmr(cdcl3,300mhz):1.54-2.60(m,4h);2.39(brs,1h,oh);3.65(m,1h);4.22(brs,1h);4.59(d,1h,j=11.7hz,ochhph);4.63(m,1h);4.68(d,j=11.7hz,1h,ochhph);3.46(m,1h,ch=);5.82(m,1h,ch=);7.26-7.37(m,5h,har)。
中间体化合物12的合成
在惰性气氛下,将对苄氧基苯酚(348mg,1.70mmol,1.2eq.)和1,1′-(偶氮二羰基)二哌啶(addp)(430mg,1.70mmol,1.2eq.)加入到中间体化合物11(290mg,1.42mmol,1eq)在甲苯(4.53ml)中的溶液中。将混合物冷却至0℃并加入p(nbu)3(0.45ml,1.70mmol,1.2eq.)。然后将反应混合物在室温下搅拌2小时,然后用dcm稀释。然后浓缩混合物,通过硅胶快速色谱(
质量(esi+):404.2[m+nh4]+;409.1[m+na]+;425.1[m+k]+。
中间体化合物13的合成
将bh3.me2s(2m的thf溶液,0.37ml,0.74mmol,5eq)缓慢加入到冷却至0℃的中间体化合物12(57.0mg,0.15mmol,1当量)在thf(0.75ml)中的溶液中。然后将混合物在室温下搅拌20小时。然后将反应混合物冷却至0℃并依次加入h2o2(30%w/v,0.45ml,4.42mmol,30eq.)、水(0.19ml,10.32mmol,70eq.)和naoh(2m水溶液,0.59ml,1.18mmol,8eq.)。然后将混合物在室温下再搅拌3小时。将水加入到混合物中,然后用乙酸乙酯萃取3次。然后将合并的有机层用硫酸钠干燥,过滤并浓缩。通过硅胶快速色谱法(
质量(esi+):422.3[m+nh4]+。
中间体化合物14的合成
将戴斯马丁氧化剂(34.6mg,0.08mmol,1.5eq.)加入到中间体化合物13(22.0mg,0.05mmol,1eq.)在dcm(0.16ml)中的溶液中。将反应混合物在室温下搅拌2小时。然后将naoh(1m水溶液)加入到混合物中,然后用dcm萃取3次。然后将合并的有机层用硫酸钠干燥,过滤并浓缩。通过硅胶快速色谱法(ait4g,环己烷/乙酸乙酯93:7至60:40)纯化粗残余物,得到无色油状的中间体化合物14(12mg,55%)。
质量(esi+):420.2[m+nh4]+。
化合物15的合成
在惰性气氛下,将dast(0.42ml,3.47mmol,10eq.)加入到中间体化合物14(140mg,0.35mmol,1eq.)在dcm(0.94ml)中的溶液中。将混合物在室温下搅拌2小时,然后加入dcm。然后将稀释的溶液倒在冷的nahco3水溶液上。将混合物搅拌5分钟,然后用dcm萃取3次。将合并的有机层用硫酸钠干燥,过滤并浓缩。通过硅胶快速色谱法(
质量(esi+):447.1[m+na]+。
化合物16的合成
在惰性气氛下,将pd/c(10%,15.0mg,0.01mmol,0.3eq.)加入到化合物15(20mg,0.05mmol,1eq)在乙酸乙酯(1ml)中的溶液中。然后将混合物在氢气氛(10巴)下搅拌过夜。过滤混合物(用millipore0.45μm),过滤器用乙酸乙酯洗涤。最后浓缩滤液,以定量产率得到白色固体的化合物16。
质量(esi-):243.1[m-h]-。
19fdec(meod,282.5mhz):-100.0(d,j=246hz,1f);-113.9(d,j=246hz,1f)。
得到的化合物16为下列两种对映异构体16a和16b的外消旋混合物。
化合物18的合成
在惰性气氛下,在室温下,将dast(5eq.,13.5g,10.3ml,83.9mmol)加入到7-氧杂二环[4.1.0]庚-2-酮(1eq.,1.92g,1.7ml,16.8mmol)在无水dcm(17ml)中的溶液中。将反应混合物搅拌2小时,然后倒入冰水混合物中。然后通过硅胶塞过滤有机层。通过从45℃大气压下至85℃减压下的蒸馏缓慢去除dcm。得到淡黄色液体的化合物18(1.94g,86%)。
19fdecnmr(cdcl3,282.5mhz):-96.5(d,j=263hz,1f);-100.2(d,j=263hz,1f)。
化合物19的合成
将三(三氟甲磺酸)铒(10%,0.47g,0.746mmol)加入到化合物18(1eq.,1g,7.46mmol)在苄醇(935μl,8.95mmol,1.2eq)中的溶液中,然后将混合物在室温下搅拌4小时。向混合物中加入饱和nahco3溶液,然后加入dcm,用dcm萃取两次。将合并的有机层用na2so4干燥,过滤并浓缩。通过快速色谱法(
质量(esi+):260.1[m+nh4]+
19fdecnmr(cdcl3,282.5mhz)-104.1(d,j=241hz,1f);-118.0(brd,j=241hz,1f)。
化合物20的合成
将k2co3(6eq.,222mg,1.61mmol)加入到化合物19(1eq.,65mg,0.268mmol)和4-氟苯甲醛(3eq.,101mg,0.0881ml,0.805mmol)在无水dmf(2.83ml)中的溶液中。将混合物加热至130℃并保持3天。加入水和盐水以溶解k2co3,并用acoet萃取混合物两次。将合并的有机层用na2so4干燥,过滤并浓缩,得到淡黄色液体。粗物质的分析显示一些剩余的化合物19,因此化合物在相同条件下重新参与反应。将混合物搅拌过夜,并进行与先前描述的相同的后处理。通过快速色谱法(biotage
19fdecnmr(cdcl3,282.5mhz):-101.8(d,j=247hz,1f);-114.2(brd,j=247hz,1f)。
化合物21的合成
在惰性气氛下,将化合物20(1eq.,72mg,0.208mmol)加入到m-cpba(3.5eq.,163mg,0.291ml,0.728mmol)在无水dcm(3.47ml)中的溶液中。将反应混合物在45℃下搅拌16小时。然后将混合物用饱和nahco3洗涤并用dcm萃取两次。将合并的有机层用na2so4干燥,过滤并浓缩,得到淡黄色残余物,将其溶于甲醇(0.866ml)中。加入naoh1m(5eq.,1.04ml,1.04mmol),将混合物在室温下搅拌1小时。用2nhcl将ph调节至2,然后过滤混合物。将滤液用dcm萃取两次,然后将合并的有机层用na2so4干燥,过滤并浓缩,得到粗化合物21(64mg,92%,含有mcpba残余物)。
质量(esi-):333.1[m-h]-;379.1[m+hcoo]-;393.1[m+ch3coo]-。
19fdecnmr(cdcl3,282.5mhz):-104.2(brd,j=242hz,1f;-118.2(brd,j=242hz,1f)。
化合物16的合成
将钯碳(10%w%,0.3eq.,60.2mg,0.0565mmol)加入到化合物21(1eq.,63mg,0.188mmol)在乙酸乙酯(4ml)中的溶液中。将反应混合物在氢气压力(10巴)下搅拌过夜。将混合物用millipore0.45μm过滤,黑色固体用acoet洗涤。浓缩滤液并用快速色谱法(biotage
19fnmr(meod,282.5mhz):-100.0(d,j=246hz,1f);-113.9(d,j=246hz,1f)。
得到的化合物16为下列两种对映异构体16a和16b的外消旋混合物。
化合物22a和22b的合成
在惰性气氛下,将dast(5eq.,3.02ml,24.7mmol)加入到7-氧杂二环[4.1.0]庚-2-酮(1eq.,0.5ml,4.94mmol)在无水dcm(5ml)中的溶液中。将反应在室温下搅拌2小时。然后将混合物缓慢倒入冰水中,分离层。将有机层通过硅胶塞过滤(用最小体积的dcm洗脱)。将含有二氟环氧化物18的滤液冷却至0℃,滴加三甲基铝(1.05eq.,2m,2.59ml,5.18mmol)。搅拌1小时后,缓慢加入(r)-(+)-1-苯基乙胺(1.15eq.,0.74ml,5.68mmol),然后将混合物在0℃下搅拌15分钟,并回流过夜。然后向混合物中加入饱和氯化铵水溶液,分离层。将水层用dcm萃取,并将合并的有机层用na2so4干燥,过滤并浓缩。通过快速色谱法(
质量(esi+):256.1[m+h]+
19fdecnmr(cdcl3,282.5mhz):
22a:-103.8(d,j=239hz,1f,cf2);-120.0(d,j=240hz,1f,cf2)。
22b:-103.8(d,j=238hz,1f,cf2);-119.8(d,j=238hz,1f,cf2)。
化合物23a和23b的合成
将钯碳(0.25eq,20%碳50%水湿2.66g,4.99mmol)和hcl1n(1.4eq.,1m,28ml,28mmol)加入到22a(1eq.,5.1g,20mmol)在thf(102ml)中的溶液中。将混合物在氢气氛下搅拌过夜,然后用millipore0.45μm过滤。浓缩滤液并与甲苯共蒸发,得到白色固体的粗23a(4.03g,108%)。
在相同条件下由22b(1eq.,3.63g,14.2mmol)获得粗23b(2.78g,104%)。
质量(esi+):152.1[m-hcl+h]+
19fdecnmr(cdcl3,282.5mhz):-106.1(d,j=242hz,1f,cf2);-121.8(d,j=242hz,1f,cf2)。
化合物24a和24b的合成
在惰性气氛下,将氯甲酸苄酯(1.46eq.,4.46ml,31.4mmol)和nahco3(3eq.,5.41g,64.4mmol)依次加入到23a(1eq.,4.03g,21.5mmol)在乙醇(97.4ml)中的溶液中。将混合物在室温下搅拌16小时。然后将水加入到混合物中,通过蒸发去除乙醇。将水溶液用乙酸乙酯萃取两次,然后将合并的有机层用na2so4干燥,过滤并浓缩,得到淡黄色油状的粗24a(6.65g,109%)。
在相同条件下从23b(1eq.,2.78g,14.82mmol)获得粗24b(4.74g,112%)。
质量(esi+):286.1[m+h]+;303.2[m+nh4]+;588.3[2m+nh4]+。
19fdecnmr(cdcl3,285.5mhz):-105.1(d,j=243hz,1f,cf2);-118.2(brd,j=243hz,1f,cf2)。
化合物25a和25b的合成
在惰性气氛下,将吡啶(21.9eq.,41.3ml,511mmol)和三氟甲磺酸酐((3.27eq.,12.7ml,76.3mmol)依次加入到24a(1eq.,6.65g,23.3mmol)在冷却至0℃的无水dcm(172ml)中的溶液中。将混合物在0℃下搅拌1小时,然后加入hcl(1.5m水溶液)。分离层,然后水层用dcm萃取两次。将合并的有机层用na2so4干燥,过滤并浓缩。用快速色谱法(
在相同条件下由24b(1eq.,4.74g,16.61mmol)获得25b(4.21g,3步后71%)。
质量(esi+):435.1[m+nh4]+
19fdecnmr(cdcl3,285.5mhz):74.5(d,j=9hz,cf3);-102.3(d,j1=246hz,1f,cf2);-115,5(d,j=246hz,1f,cf2)。
化合物26a和26b的合成
在惰性气氛下,将k2co3(3eq.,4.6g,33.3mmol)和苄氧基苯酚(3.5eq.,7.77g,38.8mmol)溶解在dmf(26.6ml)中,然后将该悬浮液在室温下搅拌1小时。然后加入25a(1eq.,4.63g,11.1mmol)在无水dmf(10.7ml)中的溶液,将混合物加热至130℃保持3小时。然后将水加入至混合物中,用乙酸乙酯萃取混合物3次。将合并的有机层用盐水洗涤,用na2so4干燥,过滤并浓缩。通过快速色谱法(
在相同条件下由25b(4.21g,10.1mmol)获得26b(1.63g,48%)。仅需要通过快速色谱法进行一次纯化。
质量(esi+):334.2[m+h]+
19fdecnmr(cdcl3,285.5mhz):101.1(d,j=242hz,1f,cf2);-117.0(d,j=242hz,1f,cf2)。
化合物28a和28b的合成
将钯碳(0.1eq,20%碳50%水湿118mg,0.22mmol)和hcl1n(1.4eq.,1m,3.13ml,3.13mmol)加入到26a(1eq.,745mg,2.23mmol)在thf(65.7ml)中的溶液中。将混合物在氢气氛下搅拌过夜,然后用millipore0.45μm过滤。用甲醇洗涤固体残余物,浓缩滤液,得到白色固体的粗品27a(743mg,119%)。然后将该固体溶解在甲醇中,加入amberlitetmira-67直至ph>7。过滤悬浮液,浓缩滤液,得到白色固体的28a(289mg,2步后54%)。
在相同条件下由26b(333mg,1mmol)获得28b(140mg,2步后58%)。
质量(esi+):244.1[m+h]+。
19fdecnmr(meod,285.5mhz):-101.4(d,j=243hz,1f,cf2);-117.4(brd,j=243hz,1f,cf2)。
2.生物活性
化合物8作为人酪氨酸酶抑制剂的体外功效
化合物8的功效通过抑制人酪氨酸酶来评估,并与现有技术的化合物脱氧熊果苷进行比较。
方法
使用feldaninc(加拿大)的即用型试剂盒进行测定:人酪氨酸酶测定试剂盒(参考a021-a-001试剂盒)。
该方案按照制造商使用说明书中描述的进行。简而言之,该试剂盒用于在不同抑制剂的存在下测定人酪氨酸酶活性。该试剂盒测量l-酪氨酸转化为在490nm处吸收的多巴色素复合物。测定的时间过程为20分钟,之后分析和比较结果。
结果
以1.12mm的最终浓度测试化合物8和脱氧熊果苷。
在表1中记录了在490nm处测量的吸光度,并在图1中绘制了随时间的变化。
表1:用化合物8和脱氧熊果苷在490nm处测量od20分钟
此外,对于每种化合物,使用下式计算酪氨酸酶抑制剂的功效:
结果记录于表2中。
表2:化合物8和脱氧熊果苷在t=20分钟时的抑制剂功效
在这些测试条件下,化合物8在体外对人酪氨酸酶的抑制作用方面显示出比脱氧熊果苷的功效高3.4倍。
化合物8,16和28a对人表皮黑素细胞中黑色素合成抑制的体外作用
方法
l-酪氨酸刺激人黑素细胞以诱导黑色素合成的增加,然而当加入增白剂时能够测量对该合成的抑制。
生物模型:轻微着色的正常人表皮黑素细胞(nhem)在补充有无pma的hmgs-2;胰岛素5μg/ml;青霉素50u/ml;链霉素50μg/ml;庆大霉素25μg/ml的培养基m254中培养(培养箱:37℃和5%的co2)。
培养和处理:将黑素细胞接种在24孔板中并在培养基中培养24小时。然后在诱导物(l酪氨酸,1mm)的存在下,用含有测试化合物或不含有测试化合物的培养基(刺激对照)替换培养基。然后将细胞培养240小时,在培养72和168小时后进行2次处理更新。并行进行非刺激对照。所有实验条件均以n=3进行。
黑色素测定:在培养结束时,除去培养上清液,用0.5nnaoh溶液通过细胞裂解提取黑色素。在405nm处测量每个实验点的光密度(od),并使用黑色素标准物(标准曲线0.39至100μg/ml黑色素)计算黑色素量。结果以黑色素μg/ml表示。
结果
■测试浓度:
已经在nhem培养物上预先测试了不同浓度的化合物,以确定用于评估黑色素合成的潜在抑制的更高的非细胞毒性浓度。所有化合物的测定浓度均为300μm:8、16、28a。
结果记录于表3中。
表3:化合物8、16、28a对黑色素合成的影响:
(1):统计显著性的阈值
ns:>0.05,不显著
*:0.01至0.05,显著
**:0.001至0.01,非常显著
***:<0.001,极其显著
在测试条件下,l-酪氨酸刺激使黑色素的合成增加至22.9μg/ml(与未刺激对照中的7.6μg/ml相比)。
通过将黑色素合成分别降低至10.2μg/ml、9.3μg/ml和8.1μg/ml,测试化合物28a、8和16显示出高的抑制效果。
- 还没有人留言评论。精彩留言会获得点赞!