耐盐性乳酸菌、耐盐性乳酸菌的培养方法、及免疫激活剂与流程
本发明涉及一种耐盐性乳酸菌、耐盐性乳酸菌的培养方法、及免疫激活剂。更详细而言,涉及一种食品适性高、容易制造、进而具有免疫激活作用的耐盐性乳酸菌、耐盐性乳酸菌的培养方法、及免疫激活剂。
背景技术:
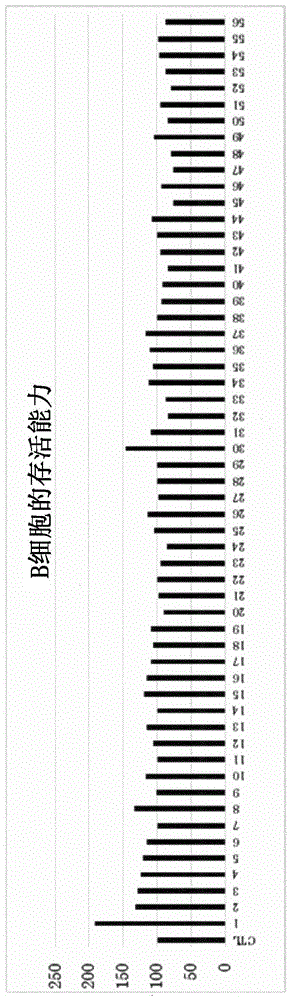
:目前,已知有乳酸菌具有各种各样的作用,报道有整肠作用·肠内菌群改善、胆固醇减少、抗肥胖效果、认知功能改善效果、美容效果等。进而,就乳酸菌而言,也多有免疫改善(过敏改善、癌症预防、感染防御)效果的报道例。期待这种乳酸菌产生的健康效果,在食品领域中,出售有在饮料(drink)、酸乳酪、补充剂、点心等各种各样的形态中配合有乳酸菌的商品。需要说明的是,乳酸菌以活菌、杀菌菌体、乳酸菌生产物质等各种各样的形状发挥效果,因此,存在上述各种各样的形态的商品。而且,目前,作为参与免疫的乳酸菌,具体而言报道有:(1)将浆细胞样树突状细胞(pdc)直接活化,发挥抗病毒效果等的“plasma乳酸菌(乳酸乳球菌jcm5805株)”;(2)证实具有nk活性增强效果、减少患感冒风险的“1073r-1株(保加利亚乳杆菌oll1073r-1)”;(3)已知有将巨噬细胞进行活化,在肠道免疫中起作用的“fk-23菌(粪肠球菌fk-23)”;(4)直接影响到th1和th2细胞,具有控制ige抗体的作用,已证实对过敏症状的有效性的“l-92乳酸菌(嗜酸乳杆菌l-92株)”(例如参照日本专利文献1)等。另外,例如在作为日本的传统的发酵食品的豆酱中,乳酸菌与其发酵有关。该乳酸菌为对食盐具有耐性的乳酸菌,其主要乳酸菌为嗜盐四联球菌。日本人通过从古至今食用豆酱而也摄取耐盐性乳酸菌。而且,作为耐盐性乳酸菌的嗜盐四联球菌除豆酱之外,通常也可从酱油、鱼露、鱼虾酱、咸菜等含有碳水化合物的食盐浓度高的食品中广泛分离出。另外,特别是在酱油的酿造中,嗜盐四联球菌作为引子使用。这样,以嗜盐四联球菌为主的耐盐性乳酸菌与日本的饮食生活从古至今存在关系。关于该耐盐性乳酸菌,通过将该耐盐性乳酸菌在盐分引起的应激条件下进行培养而产生双链rna。而且,报道有该双链rna经由toll样受体3(trl3)作用于树突状细胞,活化免疫细胞(参照日本专利文献2、3)。另外,报道有作为耐盐性乳酸菌的一种的、具有作为th1型细胞因子的白细胞介素12(il-12)及干扰素-γ(inf-γ)的产生诱发能力、且具有ige的产生抑制能力的耐盐性乳酸菌(参照日本专利文献4)。现有技术文献专利文献日本专利文献1:日本特开2004-026729号公报日本专利文献2:日本专利第5099649号公报日本专利文献3:日本专利第5312322号公报日本专利文献4:日本特开2011-004731号公报技术实现要素:发明要解决的技术问题但是,日本专利文献1中记载的乳酸菌存在如下问题:需要充分地整备生长环境,或需要在大量地制造时可以杀菌的大规模罐等设备,或需要培养液的处理等,在制造中花费劳力或成本。另外,日本专利文献2、3中记载的双链rna因加热或乳酸菌的死亡而容易破坏,因此,在工业水平的制造中,需要高度的技术(例如,在制造阶段需要充分的温度管理以避免加热,另外,需要用于缓和乳酸菌的死亡导致的双链rna的损伤的控制装置等)。日本专利文献4中记载的耐盐性乳酸菌具有白细胞介素-12及干扰素-γ的产生诱发能力等。认为:由于该耐盐性乳酸菌为源自豆酱的物质,因此食品适性高,只要有能够杀菌和保温的设备即可,所以因培养简单而容易制造。这样,由于耐盐性乳酸菌为食品适性高、容易制造的物质,因此,如果可以发现耐盐性乳酸菌的进一步效能、效果,则可以容易地制造具有该效能、效果的乳酸菌。本发明提供一种通过直接作用于b细胞而提高b细胞的存活能力和活化能力、从而发挥免疫激活效果的耐盐性乳酸菌。而且,本发明的耐盐性乳酸菌食品适性高(即安全性高),因培养简单而容易制造。进而,本发明提供一种与耐盐性葡萄球菌属细菌相比富集(增殖)速度快的耐盐性乳酸菌。具体而言,在商业的乳酸菌制造中,以超过18w/v%的盐分浓度进行培养时,污染菌没有富集,但培养天数增加,另外,最终收量也变低(例如1.0×109cfu/ml左右)。因此,以超过18w/v%的盐分浓度进行培养的方法不一定是廉价且有效的条件。另一方面,以缩短培养天数、提高收量为目的,将盐分浓度从超过18w/v%降低至12~14w/v%时,存在耐盐性高的污染菌(特别是葡萄球菌属细菌中的部分细菌(耐盐性葡萄球菌属细菌))会增殖的问题。因此,期望发现在12~14w/v%那样的18w/v%以下的盐分浓度中,与耐盐性葡萄球菌属细菌相比富集速度快的耐盐性乳酸菌(四联球菌属)。用于解决课题的技术方案根据本发明,提供以下所示的耐盐性乳酸菌、耐盐性乳酸菌的培养方法、及免疫激活剂。[1]一种具有免疫激活作用的耐盐性乳酸菌,其具有b细胞的存活能力及活化能力。[2]根据上述[1]所述的耐盐性乳酸菌,其是在豆酱的酿造工序中分离出的。[3]根据上述[1]或[2]所述的耐盐性乳酸菌,其为保藏编号nitebp-02318的耐盐性乳酸菌、保藏编号nitebp-02319的耐盐性乳酸菌、保藏编号nitebp-02320的耐盐性乳酸菌、保藏编号nitebp-02321的耐盐性乳酸菌、保藏编号nitebp-02322的耐盐性乳酸菌、保藏编号nitebp-02323的耐盐性乳酸菌、或保藏编号nitebp-02324的耐盐性乳酸菌。[4]根据上述[1]~[3]中任一项所述的耐盐性乳酸菌,其诱导白细胞介素-22、白细胞介素-10、及干扰素-γ的产生。[5]一种耐盐性乳酸菌的培养方法,将上述[1]~[4]中任一项所述的耐盐性乳酸菌在盐分浓度为11~18w/v%的培养基中培养。[6]一种免疫激活剂,其含有上述[1]~[4]中任一项所述的耐盐性乳酸菌。发明效果本发明的耐盐性乳酸菌由于食品适性(例如可以为源自豆酱的乳酸菌)高(即安全性高),因培养简单而容易制造,进而具有免疫激活作用。根据本发明的耐盐性乳酸菌的培养方法,可以将本发明的耐盐性乳酸菌简单且良好地进行培养。本发明的免疫激活剂食品适性(例如可以为源自豆酱的乳酸菌)高(即安全性高),因培养简单而容易制造,进而具有免疫激活作用。附图说明图1是表示实施例1中的脾脏b细胞的存活能力的结果的图表。图2是表示实施例1中的脾脏b细胞的活化能力的结果的图表。图3是表示实施例2中的全脾脏细胞的存活能力的结果的图表。图4是表示实施例2中的脾脏b细胞的存活能力的结果的图表。图5是表示实施例2中的脾脏t细胞的存活能力的结果的图表。图6是表示实施例2中的脾脏b细胞的活化能力的结果的图表。图7是表示实施例2中的脾脏t细胞的活化能力的结果的图表。图8是表示实施例5中的流式细胞计的结果的图。图9是表示实施例5中的白细胞介素-22的测定试验的结果的图表。图10是表示实施例5中的白细胞介素-22的测定试验的结果的图表。图11是表示实施例5中的白细胞介素-10的测定试验的结果的图表。图12是表示实施例5中的白细胞介素-10的测定试验的结果的图表。图13是表示实施例5中的干扰素-γ的测定试验的结果的图表。图14是表示实施例5中的干扰素-γ的测定试验的结果的图表。图15是表示实施例5中的流式细胞计的结果的图。图16是表示实施例5中的流式细胞计的结果的图。图17是表示实施例5中的流式细胞计的结果的图。图18是表示实施例6中的小鼠的血清iga的测定结果的图表。图19是表示实施例6中的小鼠的血清iga的测定结果的图表。具体实施方式以下,对本发明的具体实施方式进行说明,但本发明并不限定于以下的实施方式。即,应该理解的是,在不偏离本发明的宗旨的范围内,基于本领域技术人员的常识对以下的实施方式加入了适当变更、改良等的技术方案也属于本发明的范围。[1]耐盐性乳酸菌:本发明的耐盐性乳酸菌具有b细胞的存活能力及活化能力。本发明的耐盐性乳酸菌例如可以为在豆酱的酿造工序中分离出的。需要说明的是,本发明中的耐盐性乳酸菌可以为嗜盐四联球菌。这种耐盐性乳酸菌安全性高(即食品适性高),因培养简单而容易制造,可以通过直接作用于b细胞而提高b细胞的存活能力及活化能力,可以将免疫系统激活(即,具有免疫激活作用)。需要说明的是,以往已知有在耐盐性乳酸菌中有作用于淋巴细胞t细胞或树突状细胞的耐盐性乳酸菌。在此,b细胞为在体液免疫中发挥核心作用、可以对病原体等异物(抗原)产生抗体的唯一的细胞,但关于乳酸菌对其的作用则基本不了解。另外已知有:b细胞为对t细胞呈递抗原的细胞,为活化t细胞的维持中必不可少的细胞。因此,增强b细胞的作用则也会增强t细胞的作用,也会将免疫激活效果在免疫系统的细胞整体中增强。本发明中“b细胞的活化能力”是指活化抗体产生的能力和抗原呈递的能力这两者。而且,只要能够人为地强化等直接控制可以产生抗体并攻击异物的b细胞的作用,则可以期待抗体的作用所影响到的过敏疾病和感染症、自身免疫疾病等免疫系统疾病的预防或缓和、治疗。本说明书中“具有b细胞的存活能力”是指:使用从实验用小鼠脾脏细胞中分离的b细胞(脾脏b细胞),以未添加乳酸菌的试样中的存活的b细胞的数相对于总细胞数的比例为基准(基准值100)时,添加有乳酸菌的试样中的存活的b细胞的数相对于总细胞数的比例的值(测定值)超过100(其中,上述基准值及测定值分别为从平均值中减去了标准误差的值)。将与抗b220抗体进行反应的细胞设为b细胞,其“总细胞数”利用流式细胞计进行定量而求出。“存活的b细胞(活细胞)的数”为从总细胞数中减去了用碘丙啶(propidiumiodide,pi)核染色液染色的细胞(死细胞)的数的值。需要说明的是,“具有b细胞的存活能力”如上所述,具体而言是指通过实施例1所示的方法(即,(2)b细胞的制备、(3)细胞培养、(4)b细胞的存活能力及活化能力的测定的“b细胞的存活能力”的步骤)而得到的值(测定值)超过100。本说明书中“具有b细胞的活化能力”是指:使用从脾脏细胞中分离的b细胞(脾脏b细胞),以未添加乳酸菌的试样中的活化的b细胞的数和未活化的b细胞的数的比为基准(基准值100)时,添加有乳酸菌的试样中的活化的b细胞的数和未活化的b细胞的数的比值(测定值)超过100(其中,上述基准值及测定值分别为从平均值中减去了标准误差的值)。需要说明的是,“活化的b细胞的数”是利用流式细胞计测定与抗b220抗体和抗cd86抗体这两者反应的细胞的数而求出的。“未活化的b细胞的数”是利用流式细胞计测定不与抗cd86抗体反应而与抗b220抗体反应的细胞的数而求出的。需要说明的是,这些细胞以活细胞(未被pi染色的细胞)为前提。需要说明的是,“具有b细胞的活化能力”如上所述,具体而言是指通过实施例1所示的方法(即,(2)b细胞的制备、(3)细胞培养、(4)b细胞的存活能力及活化能力的测定的“b细胞的活化能力”的步骤)而得到的值(测定值)超过100。另外,“在豆酱的酿造工序中分离出的”的耐盐性乳酸菌是指定植于豆酱酿造工序中的“藏”、“室(ムロ)”、“桶”等的耐盐性乳酸菌。进而,是指在豆酱的装入至成熟工序中可增殖的菌。该“在豆酱的酿造工序中分离出的”的耐盐性乳酸菌也可以称为豆酱中所含的耐盐性的乳酸菌(即豆酱乳酸菌),换句话说,为源自豆酱的耐盐性的乳酸菌(即,以豆酱为起源的耐盐性的乳酸菌)。需要说明的是,在本发明中,“在豆酱的酿造工序中分离出的”耐盐性乳酸菌并不限于在豆酱的酿造工序中分离出的耐盐性乳酸菌,也包含在豆酱的酿造工序中进行分离、其后进行培养(传代培养)的耐盐性乳酸菌。目前,已知有即使乳酸菌为死菌体也具有免疫激活作用,广泛开发有效利用了该作用(免疫激活功能)的商品。该乳酸菌具有通过离心分离或干燥等而容易浓缩、菌数也容易稳定、操作也比较容易等优点。为了实际得到免疫激活效果,需要摄取大量的菌体,为了制备大量的菌体则需要用于其培养的大规模罐,因此,需要巨额的设备投资。另外,存在也需要菌体的浓缩或精制、高压釜相当的杀菌等培养液的处理等课题。因此,发明人等对食品适性高、容易制造、可刺激免疫的乳酸菌进行了深入研究。而且,着眼于耐盐性乳酸菌(例如在豆酱的酿造工序中分离出的耐盐性乳酸菌)由于食品适性高、能够以简易的培养设备大量地制造且可以简单地制造,因此是有用的。另外,发明人等着眼于:如果使用耐盐性乳酸菌可以提高产生在生物体防御中所需要的抗体的b细胞的存活能力及活化能力,则可以激活免疫系统,进而,在免疫应答中有效地起作用,是非常有用的。即,由于耐盐性乳酸菌包含在豆酱或酱油等食品中,因此,食品适性高。而且,作为本发明的耐盐性乳酸菌,例如可以使用在豆酱的酿造工序中分离出的耐盐性乳酸菌(豆酱乳酸菌),该豆酱乳酸菌也为食品适性高的乳酸菌。另外,如后述的培养方法所示,本发明的耐盐性乳酸菌可以用盐分浓度高的培养基培养,可以在污染菌难以增殖的环境下简单地生长。进一步优选的是,只要为与耐盐性葡萄球菌属细菌相比富集速度快的耐盐性乳酸菌,则与提高盐分浓度的情况(盐分浓度超过18w/v%)相比,可以缩短培养天数,且最终收量提高。其结果,可以以简易的培养设备更有效地且大量地制造耐盐性乳酸菌,与一般的乳酸菌的培养相比,可以抑制对培养装置的设备投资。更具体而言,本发明的耐盐性乳酸菌可以为比耐盐性葡萄球菌属细菌(sn-2820株)的增殖倍率大的耐盐性乳酸菌。这种情况下,可以缩短培养天数,且最终收量升高。其结果,可以以简易的培养设备更有效地且大量地制造耐盐性乳酸菌,可以抑制与一般的乳酸菌的培养相比对培养装置的设备投资。需要说明的是,本说明书中“增殖倍率”意指:在实施例4的条件下进行培养的情况下,由式:“培养20小时后的菌数(cfu/ml)/初始菌数(cfu/ml)”算出的值。在此,免疫细胞担负对抗来自外部的病原体的身体的防御系统、免疫系统的作用。而且,免疫细胞的主体为白细胞,白细胞由巨噬细胞、淋巴细胞、粒细胞构成。这些中,淋巴细胞发挥免疫功能的核心作用,由t细胞、b细胞、nk细胞(自然杀伤细胞)和分别发挥重要的作用的细胞构成。淋巴细胞中,b细胞是产生排除侵入于体内的病原体所需要的抗体的唯一的细胞,在体液免疫中发挥核心作用。另外,b细胞也作为对t细胞传递抗原的信息的抗原呈递细胞之一而已知。本发明的耐盐性乳酸菌只要具有b细胞的存活能力及活化能力,则可以为任何菌。例如,本发明的耐盐性乳酸菌可以为在豆酱的酿造工序中分离出的嗜盐四联球菌。本发明的耐盐性乳酸菌优选为组胺产生能力低的乳酸菌。另外,本发明的耐盐性乳酸菌优选为诱导白细胞介素-22、白细胞介素-10、及干扰素-γ的产生的耐盐性乳酸菌。由于这种耐盐性乳酸菌诱导白细胞介素-22的产生,因此,可以增殖角化细胞,并促进皮肤的更新,所以,可以期待优选用于美肌材料、抗菌材料等用途。白细胞介素-22为属于白细胞介素-10家族的细胞因子,与皮肤或肠道的粘膜屏障防御、组织修复、细胞存活和增殖有关,可以期待特应性皮炎等皮肤疾病、或脂肪肝疾病、c.difficile(艰难梭菌(clostridiumdifficile))等导致的感染症的预防、治疗等用途。特别是,本发明的耐盐性乳酸菌优选诱导来自b细胞的白细胞介素-22、白细胞介素-10、及干扰素-γ的产生。已知有干扰素-γ使攻击病毒等的杀伤性t细胞或巨噬细胞的细胞性免疫能力增大,已知有在免疫激活中起作用。白细胞介素-10为具有强力的抗炎症作用的细胞因子,由b细胞中的调节性b细胞所产生。报道有该调节性b细胞具有对炎症或自身免疫疾病、感染免疫等的抑制能力,具有抑制不适度的免疫反应的功能(免疫耐受)。这样,通过由本发明的耐盐性乳酸菌刺激b细胞,诱导白细胞介素-22、白细胞介素-10、及干扰素-γ那样的各种各样的细胞因子的产生,其结果,适度的免疫应答得到促进,因此,具有增强生物体防御的优点。[1-1]优选的耐盐性乳酸菌:本发明的耐盐性乳酸菌优选为选自由保藏编号nitebp-02318(以下,有时记为“no.1的菌株”或简记为“no.1”)的耐盐性乳酸菌、保藏编号nitebp-02319(以下,有时记为“no.3的菌株”或简记为“no.3”)的耐盐性乳酸菌、保藏编号nitebp-02320(以下,有时记为“no.13的菌株”或简记为“no.13”)的耐盐性乳酸菌、保藏编号nitebp-02321(以下,有时记为“no.15的菌株”或简记为“no.15”)的耐盐性乳酸菌、保藏编号nitebp-02322(以下,有时记为“no.19的菌株”或简记为“no.19”)的耐盐性乳酸菌、保藏编号nitebp-02323(以下,有时记为“no.30的菌株”或简记为“no.30”)的耐盐性乳酸菌、及保藏编号nitebp-02324(以下,有时记为“no.31的菌株”或简记为“no.31”)的耐盐性乳酸菌构成的组中的至少1个。进而,本发明的耐盐性乳酸菌为保藏编号nitebp-02318的耐盐性乳酸菌、保藏编号nitebp-02319的耐盐性乳酸菌、保藏编号nitebp-02320的耐盐性乳酸菌、保藏编号nitebp-02321的耐盐性乳酸菌、保藏编号nitebp-02322的耐盐性乳酸菌、保藏编号nitebp-02323的耐盐性乳酸菌、或保藏编号nitebp-02324的耐盐性乳酸菌。这些耐盐性乳酸菌例如为源自豆酱的乳酸菌(即,豆酱乳酸菌),因此,安全性高,因生长简单而容易制造,进而,可以直接作用于b细胞而实现b细胞的存活能力及活化能力,可以良好地激活免疫系统(即,具有良好的免疫激活作用)。认为上述的耐盐性乳酸菌也可以作用于t细胞,进而也作用于树突状细胞等。进而,上述的耐盐性乳酸菌可以使血清中的iga(immunoglobulina,免疫球蛋白a)浓度增大,可以提高免疫激活能力。需要说明的是,上述的no.1、3、13、15、19、30、31的菌株的耐盐性乳酸菌为嗜盐四联球菌。需要说明的是,保藏编号nitebp-02318的耐盐性乳酸菌、保藏编号nitebp-02319的耐盐性乳酸菌、保藏编号nitebp-02320的耐盐性乳酸菌、保藏编号nitebp-02321的耐盐性乳酸菌、保藏编号nitebp-02322的耐盐性乳酸菌、保藏编号nitebp-02323的耐盐性乳酸菌、及保藏编号nitebp-02324的耐盐性乳酸菌被保藏于独立行政法人制品评价技术基盘机构的专利微生物保藏中心(npmd)。在“优选的耐盐性乳酸菌”中,no.1的菌株、no.13的菌株、no.19的菌株、及no.30的菌株的耐盐性乳酸菌的各细胞(包含b细胞、t细胞)的存活能力总的说来优异(参照实施例2)。因此,根据no.1的菌株、no.13的菌株、no.19的菌株、及no.30的菌株的耐盐性乳酸菌,通过免疫细胞整体增加而发挥免疫激活作用,可以优选作为免疫激活剂的有效成分使用。“优选的耐盐性乳酸菌”中,no.1的菌株、no.31的菌株的耐盐性乳酸菌的b细胞的存活能力及b细胞的活化能力优异。特别是no.31的菌株的耐盐性乳酸菌的b细胞的活化能力非常高。而且,no.1的菌株、no.31的菌株的耐盐性乳酸菌可以作为高效的免疫激活剂的有效成分使用。本发明的耐盐性乳酸菌也优选为选自no.1的菌株、no.3的菌株、no.13的菌株、no.15的菌株、no.30的菌株、及no.31的菌株的耐盐性乳酸菌中的任一种。这些耐盐性乳酸菌的培养天数短,且最终收量高。更具体而言,这些耐盐性乳酸菌为增殖倍率比耐盐性葡萄球菌属细菌(sn-2820株)的增殖倍率大的耐盐性乳酸菌。因此,与no.19的菌株的耐盐性乳酸菌相比,可以缩短培养天数,且最终收量升高。其结果,可以以更简易的培养设备更有效地且大量地制造。需要说明的是,no.1、3、13、15、19、30、31的菌株的耐盐性乳酸菌中,具有非常优异的免疫激活效果、且适合以简易的培养设备制造的菌为no.1的菌株的耐盐性乳酸菌。[1-1a]保藏编号nitebp-02318的耐盐性乳酸菌:保藏编号nitebp-02318(no.1的菌株)的耐盐性乳酸菌,其b细胞的存活能力及b细胞的活化能力这两者非常优异。因此,如果利用no.1的菌株的耐盐性乳酸菌,则发挥非常优异的免疫激活作用。另外,no.1的菌株的耐盐性乳酸菌,其白细胞介素-22、白细胞介素-10、及干扰素-γ的产生诱发能力优异。该no.1的菌株的耐盐性乳酸菌由于白细胞介素-22的产生诱发能力优异,因此,如上所述,可以增殖角化细胞,促进皮肤的更新。因此,no.1的菌株的耐盐性乳酸菌可以优选用于美肌材料、抗菌材料等用途。需要说明的是,关于no.3、13、15、19、30、31的菌株的耐盐性乳酸菌,也白细胞介素-22的产生诱发能力优异,与no.1的菌株的耐盐性乳酸菌同样地,可以优选用于美肌材料、抗菌材料等用途。特别是no.1的菌株的耐盐性乳酸菌在白细胞介素-22、白细胞介素-10、及干扰素-γ中,白细胞介素-10的产生诱发能力优异,另一方面,这些中,干扰素-γ的产生诱发能力弱(参照图9~图14)。因此认为,在白细胞介素-22、白细胞介素-10、及干扰素-γ中,在要较多地产生白细胞介素-10的情况下,利用no.1的菌株的耐盐性乳酸菌是非常有效的。在此,在免疫系统中,免疫激活功能和免疫耐受功能这两者均衡地起作用为1个重要的要素。从这种观点出发,如果利用no.1的菌株的耐盐性乳酸菌,则基于干扰素-γ的免疫激活能力提高,另一方面,可以发挥利用属于白细胞介素-10家族的白细胞介素-10及白细胞介素-22抑制不适度的免疫反应的功能(免疫耐受),从而整体上免疫激活功能和免疫耐受功能这两者均衡地起作用。这样,使用no.1的菌株的耐盐性乳酸菌时,不仅白细胞介素-22及干扰素-γ、而且具有强力的抗炎症性的细胞因子即白细胞介素-10也充分地起作用,使免疫系统成熟,其结果,免疫系统整体均衡地发挥功能,可以期待提高对病原体等的适度的免疫应答功能。no.1的菌株的耐盐性乳酸菌可以使血清中的iga(immunoglobulina)浓度增大(参照表7、图18)。该iga参与粘膜面的局部免疫,因此,例如通过利用no.1的菌株的耐盐性乳酸菌,iga浓度也同时增大,可以使免疫激活能力提高。no.1的菌株的耐盐性乳酸菌对白细胞介素-12的表达经由b细胞而不直接地给予影响。即,no.1的菌株的耐盐性乳酸菌不具有b细胞介导的白细胞介素-12的产生诱发能力(参照表3)。[1-1b]保藏编号nitebp-02319~bp-02322的耐盐性乳酸菌:关于保藏编号nitebp-02319~bp-02322(no.3的菌株、no.13的菌株、no.15的菌株、no.19的菌株)的耐盐性乳酸菌,其也白细胞介素-22、白细胞介素-10、及干扰素-γ的产生诱发能力优异。特别是,这些耐盐性乳酸菌在白细胞介素-22、白细胞介素-10、及干扰素-γ中,干扰素-γ的产生诱发能力优异。因此,在白细胞介素-22、白细胞介素-10、及干扰素-γ中,在要较多地产生干扰素-γ的情况下,利用这些耐盐性乳酸菌是有效的。由于干扰素-γ具有促进nk细胞的增殖、或提高nk细胞的攻击力的作用,因此,在也想要增强干扰素-γ的这种作用的情况下,可以利用这些菌株的耐盐性乳酸菌。[1-1c]保藏编号nitebp-02323的耐盐性乳酸菌:关于保藏编号nitebp-02323(no.30的菌株)的耐盐性乳酸菌,其白细胞介素-22、白细胞介素-10、及干扰素-γ的产生诱发能力优异。特别是,no.30的菌株的耐盐性乳酸菌在白细胞介素-22、白细胞介素-10、及干扰素-γ中,干扰素-γ的产生诱发能力优异。进而,该no.30的菌株的耐盐性乳酸菌可以使血清中的iga浓度增大(参照表8、图19)。例如通过利用no.30的菌株的耐盐性乳酸菌,iga浓度也同时增大,可以使免疫激活能力提高。认为在白细胞介素-22、白细胞介素-10、及干扰素-γ中,在要较多地产生干扰素-γ、同时使血清中的iga浓度增大的情况下利用no.30的菌株的耐盐性乳酸菌是有效的。[1-1d]保藏编号nitebp-02324的耐盐性乳酸菌:保藏编号nitebp-02324(no.31的菌株)的耐盐性乳酸菌,其白细胞介素-22、白细胞介素-10、及干扰素-γ的产生诱发能力非常优异。即,认为在要更多地产生白细胞介素-22、白细胞介素-10、及干扰素-γ的全部的情况下利用no.31的菌株的耐盐性乳酸菌是有效的。[2]耐盐性乳酸菌的培养方法:本发明的耐盐性乳酸菌的培养方法将本发明的耐盐性乳酸菌在盐分浓度为11~18w/v%的培养基中进行培养。需要说明的是,“w/v%”意指(质量(g)/体积(100ml))%。通过在这种条件下进行培养,可以将本发明的耐盐性乳酸菌简单且良好地进行培养。具体而言,在商业的乳酸菌制造中,以超过18w/v%的盐分浓度进行培养时,虽然污染菌不富集,但培养天数变长,另外,最终收量也变低(例如1.0×109cfu/ml左右)。因此,以超过18w/v%的盐分浓度进行培养的方法不一定是廉价且有效的条件。另一方面,以缩短培养天数、提高收量为目的,将培养基的盐分浓度从超过18w/v%降低至12~14w/v%时,存在耐盐性高的污染菌(特别是葡萄球菌属细菌中的部分细菌(耐盐性葡萄球菌属细菌))会增殖的问题。因此,通过将本发明的耐盐性乳酸菌在上述盐分浓度的培养基中进行培养,防止不具有耐盐性的污染菌富集,另一方面,与耐盐性葡萄球菌属细菌相比富集速度加快,因此,可以在具有耐盐性的污染菌富集之前使培养结束。因此,根据本发明的培养方法,可以以简易的培养设备更有效地且大量地制造耐盐性乳酸菌,与一般的乳酸菌的培养相比,可以抑制对培养装置的设备投资。作为培养基,可以使用含有氮源及碳源的培养基。作为氮源,没有特别限制,可以举出例如:酱油、豆酱、肉提取物、胨、面筋、酪蛋白、酵母提取物、氨基酸等。另外,作为碳源,没有特别限制,可以举出例如:葡萄糖、麦芽消化液、稻米的糖化液、蔗糖、淀粉、糖稀粉、甘油等。进而,除氮源及碳源之外,作为无机质,例如可以含有醋酸钠、镁、锰、铁等无机盐等,也可以含有维生素类等。培养基的盐分浓度优选设为11~18w/v%,进一步优选设为11~16w/v%,特别优选设为12~14w/v%。培养基的盐分浓度超过18w/v%时,与杂菌(污染菌)相比,耐盐性乳酸菌旺盛地进行增殖。但是,盐分浓度超过18w/v%时,有耐盐性乳酸菌的增殖速度与其它盐分浓度的情况相比变慢、且最终收量变低的不良。培养温度优选为20~40℃,进一步优选为28~37℃。培养时间为24~120小时左右,在培养中可以进行搅拌。另外,培养基的ph优选为5~9,进一步优选为6~7。根据本方法,在培养基中以高浓度含有食盐,因此,大肠杆菌或土壤细菌等污染菌不易富集。在此,为了缩短培养时间并提高最终收量,将培养基的盐分浓度从18w/v%降低至12~14w/v%时,耐盐性葡萄球菌属细菌有可能富集。但是,即使降低盐分浓度,与耐盐性葡萄球菌属细菌相比富集速度也快,不会受污染菌的影响。根据本发明的方法,通过控制不具有耐盐性的污染菌、并且对于具有耐盐性的污染菌采用富集速度快的耐盐性乳酸菌,可以容易且良好地培养耐盐性乳酸菌。根据本发明的培养方法,不使用密闭系的无菌培养装置、而在开放系的培养装置(但是可以进行杀菌、保温的装置)也可以充分地培养本发明的耐盐性乳酸菌。[3]耐盐性乳酸菌的制备方法:本发明的耐盐性乳酸菌可以在培养后进行杀菌等处理而制备。具体而言,培养结束后,通过离心分离等手段而将含有食盐的培养基成分除去、清洗、精制。然后进行加热杀菌,其后,通过冷冻干燥、减压干燥、热风干燥等手段而进行干燥、浓缩。这样,可以制备本发明的耐盐性乳酸菌。需要说明的是,加热杀菌没有特别限制,具体而言,优选高压釜杀菌(121℃、20分钟)或同程度的杀菌(105℃、30分钟)。[4]免疫激活剂:本发明的免疫激活剂含有本发明的耐盐性乳酸菌。由于该免疫激活剂含有耐盐性乳酸菌(例如源自豆酱的耐盐性乳酸菌),因此安全性高(食品适性高),由于使用耐盐性乳酸菌而容易制造。而且,通过含有本发明的耐盐性乳酸菌,发挥免疫激活作用。本发明的免疫激活剂只要含有本发明的耐盐性乳酸菌作为有效成分,则其含有比例没有特别限制。需要说明的是,本发明的免疫激活剂除本发明的耐盐性乳酸菌以外,作为其它成分,可以含有难消化性糊精、低聚糖、糊精、二氧化硅等。需要说明的是,本发明的免疫激活剂可以含有通过本发明的耐盐性乳酸菌的培养方法得到的培养物、菌体或菌体成分。需要说明的是,本发明的免疫激活剂既可以将其本身作为饮食品、补充剂、医药品等,也可以添加于饮食品、补充剂、医药品等而使用。作为饮食品,没有特别限制,可举出例如:豆酱、方便豆酱汁、调理豆酱(豆酱加工品)、金山寺豆酱等副食酱、酱油、汤汁、调味汁、调味作料汁、咸菜(淡味腌制)等加工调味料、拌饭料(日语:ご飯の素)等调味食品、家常菜、米酒(曲饮料)、加年糕片的小豆粥等。实施例以下,基于实施例,具体地说明本发明,但本发明并不限定于这些实施例。(实施例1)<b细胞的存活能力及活化能力的测定试验>在源自实验用小鼠(c57bl/6)的脾脏的b细胞(b220阳性细胞)中添加实施有杀菌处理的、在豆酱的酿造工序中分离的(即,为源自豆酱的物质)嗜盐四联球菌(即,耐盐性乳酸菌)的菌体并进行细胞培养,调查脾脏b细胞的存活能力及脾脏b细胞的活化能力。以下,有时在本实施例中将“脾脏b细胞”简记为“b细胞”。(1)乳酸菌悬浮液的制备:对从豆酱的酿造工序中分离的乳酸菌的56株,分别使用“10sg10n培养基”,在30℃下培养4~7天。其后,对上述56株的全部,在121℃下进行15分钟高压釜灭菌处理,得到每菌株的培养液。需要说明的是,“10sg10n培养基”为将酱油(ichibiki社制的商品名“浓口酱油(日语:こいくちしょうゆ)”)10v/v%、葡萄糖1.0w/v%、酵母提取物1.0w/v%、聚胨0.5w/v%、醋酸钠3水合物0.2w/v%、氯化钠10w/v%、“tween80(聚(氧乙烯)山梨糖醇酐单油酸酯)”0.0025w/v%、硫酸镁七水合物0.02w/v%、硫酸锰四水合物0.001w/v%、及硫酸铁七水合物0.001w/v%进行混合并调整为ph6.8而进行高压釜灭菌的物质。需要说明的是,“v/v%”表示(体积/体积)%。接着,将进行灭菌处理而得到的各培养液以5000rpm进行10分钟离心分离。其后,分别收集菌体,用蒸馏水清洗3次后,用蒸馏水悬浮并进行冷冻干燥,得到菌体(56株)。其后,分别对进行了冷冻干燥的菌体,用ph6.8的磷酸缓冲液(pbs)以成为0.1mg/ml的方式悬浮,制备56株的乳酸菌悬浮液。(2)b细胞的制备:将从实验用小鼠(c57bl/6)的脾脏中采取的细胞集中于1.5ml反应管(greinerbio-one社制),加入0.5ml的红细胞溶解缓冲液(0.155mnh4cl,0.01mtris-hcl,ph7.5)而将细胞悬浮。其后,加入ph6.8的磷酸缓冲液(pbs)0.5ml,以1200rpm进行5分钟离心分离,用ph6.8的磷酸缓冲液(pbs)清洗1次。用基本培养基悬浮后,加入生物素-抗b220抗体(tonbobiosciences社制),进行冷藏(5℃)并静置30分钟。需要说明的是,基本培养基使用如下培养基:在加入有青霉素-链霉素混合溶液(在培养基中100u/ml-100μg/ml、nacalaitesque社制)及2-巯基乙醇(在培养基中50μm、nacalaitesque社制)的l-谷氨酸(0.3g/l)加rpmi1640(nacalaitesque社制)中以成为9(w/v)%的方式添加在55℃下加热30分钟而灭活的胎牛血清(safcbiosciences社制)而得的培养基。静置后,以1200rpm进行5分钟离心分离,用ph6.8的磷酸缓冲液(pbs)清洗2次后,用ph6.8的磷酸缓冲液(pbs)悬浮。其后,加入作为磁珠的streptavidinparticlesplus·dm(日本bd社制),进行冷藏(5℃)并静置30分钟。其后,以1200rpm进行5分钟离心分离,用ph6.8的磷酸缓冲液(pbs)清洗1次后,再次悬浮于ph6.8的磷酸缓冲液(pbs),移至圆底管。其后,用bdimagcellseparationsystem(日本bd社制)进行细胞分离,将被磁铁吸引的细胞作为阳性部分回收。将回收的阳性部分作为“b细胞(b220阳性细胞)”,再次悬浮于基本培养基,制备b细胞悬浮液。需要说明的是,得到的b细胞悬浮液使用血细胞计数器计测细胞数。(3)细胞培养:以成为2×106cells/ml的方式用基本培养基对b细胞悬浮液进行调整,将调整后的b细胞悬浮液播种于48孔微孔板(falcon社制)各0.5ml,设为1×106cells/0.5ml/孔。其后,加入各乳酸菌悬浮液(0.1mg/ml)各5μl,在37℃、5%co2的条件下培养2天。需要说明的是,将在调整后的b细胞悬浮液中不添加菌体(乳酸菌悬浮液)、并且在与添加有菌体的水准相同的条件(37℃、5%co2的条件)下培养了2天的产物设为对照。(4)b细胞的存活能力及活化能力的测定:培养后,使用流式细胞计(miltenyibiotec社制macsquantanalyzer),对各试样(细胞培养液)进行存活能力及活化能力的测定。首先,将在48孔微孔板中进行了培养的细胞培养液移至1.5ml反应管(greinerbio-one社制),以1200rpm进行5分钟离心分离,回收细胞。其后,将回收的细胞悬浮于ph6.8的磷酸缓冲液(pbs)0.2ml,加入violetfluor450标记抗b220抗体(tonbobiosciences社制)和apc标记抗cd86抗体(tonbobiosciences社制)各1μl,在冷藏(5℃)下静置60分钟。静置后,以1200rpm进行5分钟离心分离,回收细胞,悬浮于ph6.8的磷酸缓冲液(pbs)0.5ml。其后,加入propidiumiodide(pi)核染色液(cosmobio社制)0.5μl,得到测定用试样。对该测定用试样使用流式细胞计进行测定。需要说明的是,分析使用fcs数据分析软件flowjo(flowjo,llc社制)。需要说明的是,使用propidiumiodide(pi)核染色液是因为,该染色液为不透过活细胞的细胞膜的试剂,可以将死细胞进行染色。(b细胞的存活能力)将从测定用试样中计数得到的细胞数中减去了添加的乳酸菌的数(乳酸菌悬浮液中的菌体的数)的数设为总细胞数。另外,测定用试样中,将可被pi检测的细胞(即,用pi核染色液进行了染色的细胞)看作死细胞,计数其数量,将总细胞数和死细胞的数的差设为活细胞的数。然后,算出总细胞中的活细胞的比例(活细胞的数/总细胞数×100)。同样地,算出对照(未添加乳酸菌悬浮液的物质)中的总细胞中的活细胞的比例。其后,将这些值进行比较,算出以对照为基准(100)时的比值,设为b细胞的存活能力(细胞存活能力)的值。需要说明的是,重复进行细胞存活能力的试验,对b细胞的存活能力的值求出平均值(x-)和标准误差(s.e.)。将结果示于图1及表1。需要说明的是,图1~图7、图9~图14中,“ctl”表示对照(control)。本实施例中“平均值(x-)”为6次试验(n=6)的平均值。对b细胞的存活能力,按照以下的基准进行评价。将利用式:“平均值(x-)-标准误差(s.e.)”算出的值超过100且低于110的情况设为“a”,将为110以上且低于130的情况设为“aa”,将130以上的情况设为“aaa”。将结果示于表1。(b细胞的活化能力)利用作为b细胞的细胞表面标记物的violetfluor450标记抗b220抗体和作为b细胞的活化标记物的apc标记抗cd86抗体检测表达b220及cd86的b细胞,计数其数量。而且,在b细胞(b220阳性细胞)中,算出活化的b细胞(cd86+、b220+)和未活化的b细胞(cd86-、b220+)的商(活化的b细胞的数和未活化的b细胞的数的比)。同样地,算出对照(未添加乳酸菌悬浮液的物质)中的活化的b细胞(cd86+、b220+)和未活化的b细胞(cd86-、b220+)的商。其后,将这些值进行比较,算出以对照为基准(100)时的比值,设为b细胞的活化能力的值。需要说明的是,重复进行b细胞的活化能力的试验,对b细胞的活化能力的值求出平均值(x-)和标准误差(s.e.)。将结果示于图2及表1。对b细胞的活化能力,按照以下的基准进行评价。将利用式:“平均值(x-)-标准误差(s.e.)”算出的值超过100且低于110的情况设为“a”,将110以上且低于130的情况设为“aa”,将130以上的情况设为“aaa”。将结果示于表1。需要说明的是,表1、表2中,“评价”的栏的“-”意指利用式:“平均值(x-)-标准误差(s.e.)”算出的值为100以下。另外,表1中,就“评价”的栏的“ok/ng”而言,将利用式:“平均值(x-)-标准误差(s.e.)”算出的值超过100的情况(即,为a、aa、aaa的任一种评价的情况)设为“ok”,将利用式:“平均值(x-)-标准误差(s.e.)”算出的值为100以下的情况设为“ng”。另外,表1中,就“综合评价”的栏的“ok/ng”而言,将b细胞的存活能力及活化能力的评价均为“ok”的情况设为“ok”,将其以外设为“ng”。可知:在“综合评价”的栏中为“ok”的菌株具有b细胞的存活能力及b细胞的活化能力。“cd86+、b220+”表示在细胞表面表达cd86及b220这两者。另外,“cd86-、b220+”表示没有表达cd86但表达b220。[表1]“aaa”:平均值(x-)-标准误差(s.e.)的值为130以上“aa”:平均值(x-)-标准误差(s.e.)的值为110以上且低于130“a”:平均值(x-)-标准误差(s.e.)的值超过100且低于110“-”:平均值(x-)-标准误差(s.e.)的值为100以下从豆酱的酿造工序中分离的乳酸菌的56株中,no.1、3、13、15、19、30、31的7个菌株(以下,有时记为“代表菌株”)为b细胞的存活能力高、且b细胞的活化能力也高的结果(参照表1)。这些耐盐性乳酸菌如表1所示,认为通过直接作用于b细胞而使b细胞的存活能力及活化能力提高。另外,由于这些耐盐性乳酸菌源自豆酱,因此食品适性高(即,安全性高)。进而,由于能够在污染菌难以繁殖的高盐分浓度下生长,因此,培养简单。因此,这些耐盐性乳酸菌容易制造。在本实施例中,着眼于b220阳性细胞对b细胞进行了分析,但在代替b220阳性细胞而用cd19阳性细胞进行分析的情况下,也得到同样的结果。由此也可以确认:给定的菌株提高b细胞的存活能力及活化能力。需要说明的是,no.1的菌株为保藏编号nitebp-02318的耐盐性乳酸菌,no.3的菌株为保藏编号nitebp-02319的耐盐性乳酸菌,no.13的菌株为保藏编号nitebp-02320的耐盐性乳酸菌,no.15的菌株为保藏编号nitebp-02321的耐盐性乳酸菌,no.19的菌株为保藏编号nitebp-02322的耐盐性乳酸菌,no.30的菌株为保藏编号nitebp-02323的耐盐性乳酸菌,no.31的菌株为保藏编号nitebp-02324的耐盐性乳酸菌。(实施例2)将b细胞的存活能力及活化能力这两者高的菌株(no.1、3、13、15、19、30、31)和其它任意的菌株(no.2、20、26、28、34、49)作为试验菌株,研究对脾脏细胞全体(全脾脏细胞)的影响。<细胞的存活能力及活化能力的测定试验>将各试验菌株进行杀菌处理,将杀菌处理后的菌体添加于实验用小鼠(c57bl/6)的脾脏细胞而进行培养,调查培养后的脾脏细胞全体的存活能力、脾脏b细胞和脾脏t细胞的存活能力、及脾脏b细胞和脾脏t细胞的活化能力。以下,在本实施例中,有时将“脾脏b细胞”简记为“b细胞”,有时将“脾脏t细胞”简记为“t细胞”。需要说明的是,本实施例2与实施例1不同,未将b细胞分离。即,在用于试验的细胞(全脾脏细胞)中,包含b细胞、t细胞、树突状细胞、nk细胞等。(1)乳酸菌悬浮液的制备:使用与实施例1中制备的乳酸菌悬浮液同样的乳酸悬浮液。(2)脾脏细胞悬浮液的制备:将从实验用小鼠(c57bl/6)的脾脏中采取的细胞集中于1.5ml反应管(greinerbio-one社制),加入0.5ml的红细胞溶解缓冲液(0.155mnh4cl,0.01mtris-hcl,ph7.5)而悬浮脾脏细胞。其后,加入ph6.8的磷酸缓冲液(pbs)0.5ml,以1200rpm进行5分钟离心分离,用ph6.8的磷酸缓冲液(pbs)清洗2次。用基本培养基悬浮,制备脾脏细胞悬浮液。需要说明的是,基本培养基使用与实施例1相同的培养基。得到的脾脏细胞悬浮液使用血细胞计数器计测细胞数。(3)细胞培养:以成为2×106cells/ml的方式用基本培养基对脾脏细胞悬浮液进行调整,将调整后的脾脏细胞悬浮液播种于48孔微孔板(falcon社制)各0.5ml,设为1×106cells/0.5ml/孔。其后,加入各乳酸菌悬浮液(0.1mg/ml)各5μl,在37℃、5%co2的条件下培养2天。需要说明的是,将在调整后的脾脏细胞悬浮液中不添加菌体(乳酸菌悬浮液)、并且在与添加有菌体的水准相同的条件(37℃、5%co2的条件)下培养了2天的产物设为对照。(4)细胞的存活能力及活化能力的测定:培养后,使用流式细胞计(miltenyibiotec社制macsquantanalyzer),对各试样(细胞培养液)进行细胞的存活能力及活化能力的测定。首先,将在48孔微孔板中进行了培养的细胞培养液移至1.5ml反应管(greinerbio-one社制),以1200rpm进行5分钟离心分离,回收细胞。其后,将回收的细胞悬浮于ph6.8的磷酸缓冲液(pbs)0.2ml,加入以下的4种抗体各1μl,在冷藏(5℃)下静置60分钟。添加的4种抗体为violetfluor450标记抗b220抗体(tonbobiosciences社制)、apc标记抗cd86抗体(tonbobiosciences社制)、brilliantviolet510标记抗cd4抗体(biolegend社制)、及pe标记抗cd69抗体(biolegend社制)。静置后,以1200rpm进行5分钟离心分离,回收细胞,悬浮于ph6.8的磷酸缓冲液(pbs)0.5ml。其后,加入propidiumiodide(pi)核染色液(cosmobio社制)0.5μl,得到测定用试样。对该测定用试样,使用流式细胞计进行测定。需要说明的是,分析使用fcs数据分析软件flowjo(flowjo,llc社制)。(细胞的存活能力)将从测定用试样中计数得到的细胞数中减去了添加的乳酸菌的数(乳酸菌悬浮液中的菌体的数)的数设为总细胞数。另外,测定用试样中,将可被pi检测的细胞(用pi核染色液染色的细胞)看作死细胞,计数其数,将总细胞数和死细胞的数的差设为活细胞的数。然后,算出总细胞中的活细胞的比例(活细胞的数/总细胞数×100)。同样地,算出对照(没有添加乳酸菌悬浮液的物质)中的总细胞中的活细胞的比例。其后,将这些值进行比较,算出以对照为基准(100)时的比值,设为细胞的存活能力(细胞存活能力)的值。需要说明的是,重复进行细胞存活能力的试验,对细胞的存活能力的值求出平均值(x-)和标准误差(s.e.)。将结果示于图3及表2。本实施例中“平均值(x-)”为8次试验(n=8)的平均值。对细胞的存活能力,按照以下的基准进行评价。将利用式:“平均值(x-)-标准误差(s.e.)”算出的值超过100且低于120的情况设为“a”,将120以上且低于150的情况设为“aa”,将150以上的情况设为“aaa”。将结果示于表2。(b细胞的存活能力)用作为b细胞的细胞表面标记物的violetfluor450标记抗b220抗体(tonbobiosciences社制)检测b细胞。算出活细胞中的b细胞的数和总细胞数的商(存活的b细胞的数相对于总细胞数的比例)。需要说明的是,在本实施例中,将从测定用试样中计数而得的细胞数中减去了添加的乳酸菌的数(乳酸菌悬浮液中的菌体的数)的数设为“总细胞数”。另外,将测定用试样中可被pi检测的细胞(用pi核染色液染色的细胞)看作死细胞,计数其数,将总细胞数和死细胞的数的差设为“活细胞的数”。而且,算出对照(没有添加乳酸菌悬浮液的物质)中的总细胞中的活细胞的比例。其后,将这些值进行比较,算出以对照为基准(100)时的比值,设为b细胞的存活能力的值。需要说明的是,重复进行b细胞的存活能力的试验,对b细胞的存活能力的值求出平均值(x-)和标准误差(s.e.)。将结果示于图4及表2。对b细胞的存活能力,按照以下的基准进行评价。将利用式:“平均值(x-)-标准误差(s.e.)”算出的值超过100且低于120的情况设为“a”,将120以上且低于150的情况设为“aa”,将150以上的情况设为“aaa”。将结果示于表2。(t细胞的存活能力)用作为t细胞的细胞表面标记物的brilliantviolet510标记抗cd4抗体(biolegend社制)检测t细胞。算出活细胞中的t细胞的数和总细胞数的商(存活的t细胞的数相对于总细胞数的比例)。而且,算出对照(未添加乳酸菌悬浮液的物质)中的总细胞中的活细胞的比例。其后,将这些值进行比较,算出以对照为基准(100)时的比值,设为t细胞的存活能力的值。需要说明的是,重复进行t细胞的存活能力的试验,对t细胞的存活能力的值,求出平均值(x-)和标准误差(s.e.)。将结果示于图5及表2。对t细胞的存活能力,按照以下的基准进行评价。将利用式:“平均值(x-)-标准误差(s.e.)”算出的值超过100且低于120的情况设为“a”,将120以上且低于150的情况设为“aa”。将150以上的情况设为“aaa”。将结果示于表2。(b细胞的活化能力)利用作为b细胞的细胞表面标记物的violetfluor450标记抗b220抗体和b作为细胞的活化标记物的apc标记抗cd86抗体,检测表达b220及cd86的b细胞,将其数计数。而且,算出b细胞(b220阳性细胞)中的活化的b细胞(cd86+、b220+)和未活化的b细胞(cd86-、b220+)的商(活化的b细胞/未活化的b细胞的比值)。同样地,算出对照(未添加乳酸菌悬浮液的物质)中的活化的b细胞(cd86+、b220+)和未活化的b细胞(cd86-、b220+)的商。其后,将这些值进行比较,算出以对照为基准(100)时的比值,设为b细胞的活化能力的值。需要说明的是,重复进行b细胞的活化能力的试验,对b细胞的活化能力的值求出平均值(x-)和标准误差(s.e.)。将结果示于图6及表2。对b细胞的活化能力,按照以下的基准进行评价。将利用式:“平均值(x-)-标准误差(s.e.)”算出的值超过100且低于120的情况设为“a”,将120以上且低于150的情况设为“aa”,将150以上的情况设为“aaa”。将结果示于表2。(t细胞的活化能力)利用作为t细胞的细胞表面标记物的brilliantviolet510标记抗cd4抗体(biolegend社制)和作为t细胞的活化标记物的pe标记抗cd69抗体(biolegend社制),检测表达cd4及cd69的细胞,将其数计数。而且,算出t细胞(cd4阳性(cd4+)细胞)中的活化的t细胞(cd69+,cd4+)和未活化的t细胞(cd69-,cd4+)的商(活化的t细胞/未活化的t细胞的比值)。同样地,算出对照(未添加乳酸菌悬浮液的物质)中的活化的t细胞(cd69+,cd4+)和未活化的t细胞(cd69-,cd4+)的商。其后,将这些值进行比较,算出以对照为基准(100)时的比值,设为t细胞的活化能力的值。需要说明的是,重复进行t细胞的活化能力的试验,对t细胞的活化能力的值求出平均值(x-)和标准误差(s.e.)。将结果示于图7及表2。对t细胞的活化能力,按照以下的基准进行评价。将利用式:“平均值(x-)-标准误差(s.e.)”算出的值超过100且低于120的情况设为“a”,将120以上且低于150的情况设为“aa”,将150以上的情况设为“aaa”。将结果示于表2。如表2所示,在脾脏细胞中也同样地,代表菌株(no.1、3、13、15、19、30、31)的b细胞的存活能力及活化能力高,另外,对于t细胞,存活能力及活化能力也高。即,认为这些耐盐性乳酸菌通过直接作用于b细胞而提高b细胞的存活能力及活化能力,进而,t细胞的存活能力及活化能力也提高。因此,认为可以采用这些代表菌株作为发挥免疫激活作用的免疫激活剂的有效成分。另外,更具体而言,由表2可知:no.1的菌株、no.13的菌株、no.19的菌株、及no.30的菌株的耐盐性乳酸菌的细胞存活能力的评价及b细胞的存活能力的评价均为“aaa”,进而,t细胞的存活能力为“a”以上。由该结果可知:各细胞(包括b细胞、t细胞)的存活能力总的说来优异。另外,可知:no.1的菌株、no.31的菌株的耐盐性乳酸菌的b细胞的存活能力及活化能力均非常高(b细胞的存活能力的评价为“aaa”,b细胞的活化能力的评价为“aa”),特别是no.31的菌株的耐盐性乳酸菌与其它菌株相比,b细胞的活化能力的平均值(x-)高,b细胞的活化能力非常高。[表2]表2中,“b220+活细胞数/总细胞数”表示算出相对于总细胞数的“pi没有检出,与violetfluor450标记抗b220抗体反应的b细胞的数”的比例。“cd4+活细胞数/总细胞数”表示算出相对于总细胞数的“pi没有检出,与brilliantviolet510标记抗cd4抗体(biolegend社制)反应的t细胞的数”的比例。“cd86+、b220+/cd86-、b220+”表示算出活化的b细胞(cd86+、b220+)/未活化的b细胞(cd86-、b220+)的比值。“cd4+,cd69+/cd4+,cd69-”表示算出活化的t细胞/未活化的t细胞的比值。需要说明的是,在本实施例中,着眼于b220阳性细胞对b细胞进行了分析,在用cd19阳性细胞代替b220阳性细胞进行分析的情况下也得到同样的结果。由此也可以确认:给定的菌株提高b细胞的存活能力及活化能力。(实施例3)对代表菌株中no.1的菌株和其它的菌株(no.2、20)进行微阵列分析,研究基因表达的状态。<利用dna微阵列分析的基因表达谱的调查>(1)rna的制备:将从实验用小鼠(c57bl/6)的脾脏采取的细胞以在基本培养基中成为5×106cells/5ml/孔的方式播种于6孔微孔板(falcon社制)。其后,加入乳酸菌悬浮液(0.1mg/ml)各50μl,在37℃、5%co2的条件下培养24小时。需要说明的是,将在脾脏细胞悬浮液中不添加菌体(乳酸菌悬浮液)、并且在与添加菌体的水准相同的条件(在37℃、5%co2的条件下24小时)下进行了培养的物质设为对照。培养的细胞与生物素-抗b220抗体(tonbobiosciences社制)及作为磁珠的streptavidinparticlesplus·dm(日本bd社制)反应之后,用bdimagcellseparationsystem(日本bd社制)进行细胞分离,将被磁铁吸引的细胞(阳性部分)作为“b细胞(b220阳性细胞)”回收。需要说明的是,就脾脏细胞的制备而言,用与实施例2同样的方法进行,乳酸菌悬浮液的制备及b细胞的回收用与实施例1同样的方法进行。就rna提取而言,使用isogenii(nippongene社制),从b细胞中提取总rna,所述b细胞是从培养的脾脏细胞中分离成的。其后,以提取的总rna为模板,制备标记的cdna,供于dna微阵列分析。dna微阵列分析使用agilent社制的“sureprintg3mousegeneexpression8×60k”。其后,利用基因表达软件“rversion2.15.1(therfoundation.)”进行分析。算出相对于“对照中的基因表达量”的“添加乳酸菌悬浮液的情况下的基因表达量”。将结果示于表3。需要说明的是,表3中,在表达量为“2.0”以上的情况下,相对于对照存在显著差异。[表3]基因名称no.1no.2no.20cd862.01.11.4cd703.21.21.9白细胞介素-102.21.21.6白细胞介素-12a1.31.11.0白细胞介素-12b1.3-1.21.6白细胞介素-2210.01.03.1干扰素-β---干扰素-γ8.31.23.2※1:表示b细胞的基因表达量(将对照(未添加乳酸菌)中的表达量设为1时的相对比值)。※2:“-”表示不能检测。dna微阵列分析的结果可以确认:通过在b细胞中添加no.1的菌株,cd86基因或cd70基因的表达增加。由这些基因表达增加这一点可知b细胞得到活化。另外,已知有cd86或cd70诱导t细胞上的分别介由cd28、cd27的辅助信号,对t细胞的活化是重要的。认为通过添加no.1的菌株,也对t细胞的活化给予影响。由dna微阵列分析的结果可知:no.1的菌株在基因水平上也将b细胞及t细胞这两者活化(即,使b细胞的存活能力及活化能力提高,进而,使t细胞的存活能力及活化能力提高)。另外,可知:通过添加本发明的耐盐性乳酸菌,干扰素-γ的表达量增加,也具有通过诱导干扰素-γ的产生而导致的免疫激活作用。已知有干扰素-γ为具有抗病毒效果的细胞因子。另外,通过添加本发明的耐盐性乳酸菌,白细胞介素-10的表达量也增加。白细胞介素-10为具有强力的抗炎症作用的细胞因子,在各种各样的细胞中抑制具有炎症作用的细胞因子的放出。因此认为,本发明的耐盐性乳酸菌不仅有免疫激活作用,而且也对免疫耐受起作用,使免疫功能成熟。进而,通过添加本发明的耐盐性乳酸菌,白细胞介素-22的表达增加。白细胞介素-22参与组织修复、细胞存活/增殖、粘膜屏障防御。需要说明的是,可知:no.1的菌株在白细胞介素-12和干扰素-β的表达中经由b细胞而不直接地给予影响。白细胞介素-12为特征在于对杀伤t细胞或nk细胞(自然杀伤细胞)的活化作用的细胞因子。干扰素-β为在使免疫细胞发挥抗病毒功能中最初产生的生理活性物质。通过添加no.1的菌株而得到的基因表达谱是以往未知的,推测通过未知的作用机制显示免疫激活作用。另外,已知有白细胞介素-22是由cd4阳性t细胞、nk细胞、nkt细胞等免疫细胞产生的,但关于由b细胞产生这一点则是未知的,对基于b细胞而提高白细胞介素-22的表达量的乳酸菌,也没有报道。(比较例1)<培养基的盐分浓度的研究>关于酱油酿造中使用的代表的耐盐性乳酸菌(嗜盐四联球菌da-297株),分6阶段(6样品)准备培养基的盐分浓度,比较各阶段中的培养速度。需要说明的是,也与耐盐性乳酸菌(嗜盐四联球菌da-297株)同时添加杂菌而进行共培养,比较它们的培养速度。作为杂菌,使用耐盐性葡萄球菌属细菌。需要说明的是,已知有包含食物中毒菌在内的一般菌类(细菌)对食盐没有耐性,将盐分从8w/v%起提高时,可以充分地抑制增殖,但葡萄球菌属细菌的一部分为耐盐性。因此,可以说是在嗜盐四联球菌菌的培养中最具有污染风险的微生物之一。需要说明的是,使用的葡萄球菌属细菌为在酱油制造工序中、在将酱油乳酸菌进行培养的工序中在培养基上于35℃下混入的细菌,为其中耐盐性最高的菌株(sn-2820株)。需要说明的是,作为培养基,使用含有酱油(ichibiki社制的商品名“浓口酱油”)20w/v%、葡萄糖1.7w/v%并以成为盐分浓度14w/v%的方式添加食盐、再调整为ph6.8的培养基。该菌株即使在食盐浓度最高的培养基(盐分浓度18w/v%)中也可稍微增殖。需要说明的是,序列表中示出耐盐性葡萄球菌属细菌sn-2820株的16srdna部分碱基序列。对序列表所示的碱基序列,从已知的碱基序列数据库中检索同源性高的碱基序列,结果,与腐生性葡萄球菌腐生亚种(staphylococcussaprophyticussubsp.saprophyticus)的16srdna部分碱基序列一致。由该结果,sn-2820株鉴定为腐生性葡萄球菌腐生亚种。(培养基)作为氮源及微量矿物质成分,使用浓口酱油(ichibiki社制),作为碳源,使用葡萄糖(关东化学社制),作为其它原料,使用食盐(关东化学社制)和水。这样,用简单且仅由食品原料构成的培养基进行研究。浓口酱油在全部的样品中设为20v/v%,葡萄糖在全部的样品中设为1.7w/v%。进而,以培养基的盐分浓度成为8、10、12、14、16、18w/v%的6阶段的方式调整食盐的添加量。而且,在全部的样品中用食品添加剂氢氧化钠(关东化学社制)调整至ph成为7.0。就培养基而言,在试管(直径18mm×180mm)中放入各10ml,用シリコセン(信越聚合物社制、注册商标)塞住之后,在121℃下用高压釜灭菌15分钟。(培养)设定为传代培养,添加1v/v%在相同培养基中进行了前培养的嗜盐四联球菌da-297株,以初始菌数成为1.5×107cfu/ml的方式进行接种。另外,设定为相对于嗜盐四联球菌da-297株混入0.1v/v%葡萄球菌属细菌,而添加进行了前培养的葡萄球菌属细菌sn-2820株。此时的葡萄球菌属细菌的初始菌数为1.1×104cfu/ml。其后,对嗜盐四联球菌da-297株,在30℃的恒温器中静置培养24小时、及72小时。(菌数的测定)就静置培养24小时之后的嗜盐四联球菌da-297株的活菌数而言,在“10sg10n平板培养基”上涂布稀释菌液,进行培养(在30℃下4天,厌氧培养)之后,计测菌落数。另外,就葡萄球菌属细菌而言,用标准琼脂培养基(sa)平板培养法进行培养之后,测定菌数(活菌)。“10sg10n平板培养基”为含有酱油(ichibiki社制的商品名“浓口酱油”)10v/v%、葡萄糖1.0w/v%、酵母提取物1.0w/v%、聚胨0.5w/v%、醋酸钠3水合物0.2w/v%、氯化钠10w/v%、“tween80”0.0025w/v%、硫酸镁七水合物0.02w/v%、硫酸锰四水合物0.001w/v%、硫酸铁七水合物0.001w/v%的、ph6.8、琼脂2%的培养基。而且,算出24小时后的菌数(活菌)除以初始菌数所得的值(24小时后的菌数/初始菌数),来作为24小时的增殖倍率(倍/24小时)。将结果示于表4。需要说明的是,将72小时后的嗜盐四联球菌da-297株的菌数设为“总菌数”,对该总菌数(活菌和死菌的合计(最终收量)),在显微镜下使用血细胞计数器计测菌数。[表4]如表4所示,可知:就嗜盐四联球菌da-297株而言,在盐分浓度8~14w/v%下旺盛地增殖,在18w/v%下也可以充分地增殖。另一方面,就葡萄球菌属细菌而言,在盐分浓度8~18w/v%的范围内,盐分浓度越低,越良好地增殖。另外,在盐分浓度10w/v%以下,与嗜盐四联球菌da-297株相比,增殖倍率高,在盐分浓度8w/v%下,与嗜盐四联球菌da-297株相比,以约8倍的速度富集。由以上的结果可知:就嗜盐四联球菌da-297株而言,将培养基的盐分浓度设为14w/v%以上为好。另一方面,盐分浓度越高,耐盐性乳酸菌的最终收量越变低。因此,对在盐分12w/v%下也与耐盐性葡萄球菌属细菌相比生长速度快的源自豆酱的耐盐性乳酸菌,在以下的实施例4中进行了研究。(实施例4)<耐盐性乳酸菌的选抜>在本实施例中,在将培养基的盐分浓度设为12w/v%的情况下,以no.1、3、13、15、19、30、31的7个菌株(7个样品)为对象,进行与耐盐性葡萄球菌属细菌sn-2820株相比富集速度快的耐盐性乳酸菌的选抜。(培养基)作为氮源及微量矿物质成分,使用浓口酱油(ichibiki社制),作为碳源,使用葡萄糖(关东化学社制),作为其它原料,使用食盐(关东化学社制)和水。这样,用简单且仅由食品原料构成的培养基进行了研究。上述培养基具体而言使用以浓口酱油成为20v/v%、葡萄糖成为1.7w/v%、盐分浓度成为12w/v%的方式将浓口酱油、葡萄糖、及食盐与水混合、其后用食品添加剂氢氧化钠(关东化学社制)调整为ph7.0的培养基。将制作的培养基放入试管(直径18mm×180mm)中各10ml,用シリコセン(注册商标)塞住之后,在121℃下用高压釜灭菌处理15分钟。(培养)设定为传代培养,添加用相同培养基进行了前培养的各耐盐性乳酸菌1v/v%。此时初始菌数为3.7×106~1.5×107cfu/ml。另外,设定为相对于耐盐性乳酸菌混入1v/v%葡萄球菌属细菌,添加进行了前培养的葡萄球菌属细菌sn-2820株。此时的葡萄球菌属细菌的初始菌数为1.8×105~5.7×105cfu/ml。其后,将全部的样品(7个菌株和耐盐性葡萄球菌属细菌sn-2820株)在30℃的恒温器中静置培养20小时。(菌数的测定)接着,进行菌数的测定。菌数的测定用与比较例1同样的方法进行。算出将培养20小时后的菌数除以初始菌数所得的值(20小时之后的菌数/初始菌数),来作为20小时的增殖倍率(倍/20小时)。将结果示于表5。[表5]如表5所示,可知:关于no.19的菌株以外的菌株(no.1、no.3、no.13、no.15、no.30、no.31),在盐分浓度12w/v%下旺盛地增殖,与耐盐性葡萄球菌属细菌相比,优先增殖。另外,同样的结果在盐分浓度14~18w/v%下也可得到。这样,可知:就本发明的耐盐性乳酸而言,在盐分浓度12~18w/v%下也可以将耐盐性乳酸菌良好地培养,即使相对于耐盐性乳酸菌混入1v/v%左右的耐盐性葡萄球菌属细菌,也可以将耐盐性乳酸菌优先培养。如果培养基的盐分浓度为盐分浓度11w/v%以上,则与作为杂菌(污染菌)所设定的耐盐性葡萄球菌属细菌等菌相比旺盛地增殖,因此优选。另一方面,在盐分浓度18w/v%下,存在与其它盐分浓度的情况相比、耐盐性乳酸菌自身的增殖速度变慢的倾向。因此,本发明的耐盐性乳酸菌优选在盐分浓度11~16w/v%下进行培养,进一步优选在盐分浓度12~16w/v%下进行培养,最优选设为盐分浓度12~14w/v%。需要说明的是,对该实验中使用的前培养液的上清液测定组胺量。在测定中使用“チェックカラーヒスタミン(kikkomanbiochemifa社制)”。测定的结果可知:在全部的乳酸菌培养液中组胺浓度低于20ppm,没有组胺产生能力。需要说明的是,测定方法根据“チェックカラーヒスタミン”中附带的使用说明书。(实施例5)<细胞因子产生细胞的测定试验>在实验用小鼠(c57bl/6)的脾脏细胞中添加杀菌处理后的试验菌体而进行共培养,测定白细胞介素-22、白细胞介素-10、干扰素-γ的各种细胞因子的产生细胞的比例。作为试验菌株,使用代表菌株(no.1、3、13、15、19、30、31)和其它任意的菌株(no.2、20)。(1)乳酸菌悬浮液的制备:用ph6.8的磷酸缓冲液(pbs)以成为1mg/ml的浓度的方式悬浮,除此之外,与实施例1中制备的乳酸菌悬浮液同样地制备。(2)脾脏细胞悬浮液的制备:将从实验用小鼠(c57bl/6)的脾脏中采取的细胞集中于1.5ml反应管(greinerbio-one社制),加入0.5ml的红细胞溶解缓冲液(0.155mnh4cl,0.01mtris-hcl,ph7.5)而使脾脏细胞悬浮。其后,加入ph6.8的磷酸缓冲液(pbs)0.5ml,以1200rpm进行5分钟离心分离,用ph6.8的磷酸缓冲液(pbs)清洗2次。其后,用基本培养基悬浮,制备脾脏细胞悬浮液。需要说明的是,基本培养基使用与实施例1相同的培养基。对得到的脾脏细胞悬浮液,使用血细胞计数器计测细胞数。(3)细胞培养:以成为2×106cells/ml的方式用基本培养基对上述脾脏细胞悬浮液进行调整,播种于6孔微孔板(falcon社制)各3ml,设为6×106cells/3ml/孔。其后,加入各乳酸菌悬浮液(1mg/ml)各30μl,在37℃、5%co2的条件下培养2天,得到乳酸菌添加培养物。需要说明的是,将在上述脾脏细胞悬浮液中不添加菌体(乳酸菌悬浮液)、并且在与添加有菌体的水准相同的条件(37℃、5%co2的条件)下进行了培养的物质设为对照。(4)细胞因子的测定:在上述培养2天中的培养42小时的后的阶段,在各培养液中加入bdgolgistoptm(bd社制)2μl并进行混合,其后,在37℃、5%co2的条件下进一步培养6小时(培养时间合计为48小时)。其后,将培养的细胞培养液移至15ml锥形管(bd社制),以1200rpm进行5分钟离心分离,回收细胞。其后,对回收的细胞,使用bdcytofix/cytopermtmfixation/permeabilizationkit(bd社制)进行固定·透过的操作。操作按照附带的说明书。在此,为了所使用的抗体的方便,分成进行产生白细胞介素-22的细胞和产生干扰素-γ的细胞的确认的第1组和进行产生白细胞介素-10的细胞的确认的第2组的2个组,进行细胞染色。在第1组中,使用pe标记抗白细胞介素-22抗体(affymetrixebioscience社制)、alexa647标记抗干扰素-γ抗体(bdpharmingen社制)、及violetfluor450标记抗b220抗体(tonbobiosciences社制)。在第2组中,使用pe标记抗白细胞介素-10抗体(biolegend社制)、alexa647标记抗干扰素-γ抗体(bdpharmingen社制)、及violetfluor450标记抗b220抗体(tonbobiosciences社制)。需要说明的是,如图15所示,在同时检测产生白细胞介素-22的细胞和产生白细胞介素-10的细胞时,使用pe标记抗白细胞介素-22抗体(affymetrixebioscience社制)、alexa647标记抗白细胞介素-10抗体(bdpharmingen社制)、及violetfluor450标记抗b220抗体(tonbobiosciences社制)(第3组)。在图15~图17中,示出将染色前的细胞分成3个组(上述第1组至第3组)并对各组进行了细胞染色的结果。染色后,以1200rpm离心分离5分钟而回收细胞,悬浮于ph6.8的磷酸缓冲液(pbs)0.5ml,设为测定用试样。细胞因子的测定使用流式细胞计(miltenyibiotec社制macsquantanalyzer)而进行。需要说明的是,分析使用fcs数据分析软件flowjo(flowjo,llc社制)。(5)细胞因子产生细胞量的测定:(5-1)白细胞介素-22的产生细胞量:对用流式细胞计得到的乳酸菌添加培养物的分析结果,求出全脾脏细胞的淋巴细胞中的白细胞介素-22阳性细胞的比例。同时,求出b220阳性细胞(脾脏b细胞)中的白细胞介素-22阳性细胞的比例。进而,对用流式细胞计得到的对照(不添加乳酸菌悬浮液而进行培养的物质)的分析结果,与上述乳酸菌添加培养物的情况同样地进行,求出全脾脏细胞中的白细胞介素-22阳性细胞的比例。进而,求出对照中的b220阳性细胞中的白细胞介素-22阳性细胞的比例。需要说明的是,图8中,示出流式细胞计中的测定的一例,纵轴表示b220的表达,横轴表示白细胞介素-22的表达。在图8中的上段,示出对照(control),在下段,示出添加有no.1的菌株的情况(记为“+no.1”),进而,在图8中的左侧示出全脾脏细胞的淋巴细胞中的白细胞介素-22阳性细胞的比例,在右侧示出b220阳性细胞(脾脏b细胞)中的白细胞介素-22阳性细胞的比例。而且,算出以对照中算出的值为基准(100)时的上述“全脾脏细胞中的白细胞介素-22阳性细胞的比例”,将该算出值设为全脾脏细胞中的白细胞介素-22的产生细胞量(il-22+/全脾脏细胞)。同样地,算出以对照中算出的值为基准(100)时的上述“b220阳性细胞中的白细胞介素-22阳性细胞的比例”,将该算出值设为脾脏b细胞中的白细胞介素-22的产生细胞量(il-22+/脾脏b细胞)。需要说明的是,重复进行试验,求出平均值(x-)和标准误差(s.e.)。本实施例中“平均值(x-)”为6次试验(n=6)的平均值。对脾脏b细胞的白细胞介素-22的产生细胞量(il-22+/脾脏b细胞),将结果示于图9、及表6(“il-22产生量”的“脾脏b细胞”的栏)中。需要说明的是,图9中,“il-22+/脾脏b细胞”表示脾脏细胞的b细胞中的白细胞介素-22的产生细胞量(il-22+/脾脏b细胞)。对脾脏细胞中的白细胞介素-22的产生细胞量(il-22+/全脾脏细胞),将结果示于图10、及表6(“il-22产生量”的“全脾脏细胞”的栏)中。图10中,“il-22+/全脾脏细胞”表示脾脏细胞中的白细胞介素-22的产生细胞量(il-22+/全脾脏细胞)。[表6](5-2)白细胞介素-10的产生细胞量:对白细胞介素-10的产生细胞量,也与上述“白细胞介素-22的产生细胞量”的测定试验同样地算出。关于脾脏细胞的b细胞中的白细胞介素-10的产生细胞量的结果,示于图11及表6,关于脾脏细胞中的白细胞介素-10的产生细胞的量的结果,示于图12及表6。需要说明的是,表6中,脾脏细胞的b细胞中的白细胞介素-10的产生细胞的量的结果示于“il-10产生量”的“脾脏b细胞”的栏中,脾脏细胞中的白细胞介素-10的产生细胞的量的结果示于“il-10产生量”的“全脾脏细胞”的栏中。需要说明的是,图11中,“il-10+/脾脏b细胞”表示脾脏细胞的b细胞中的白细胞介素-10的产生细胞的量。图12中,“il-10+/全脾脏细胞”表示脾脏细胞中的白细胞介素-10的产生细胞的量。(5-3)干扰素-γ的产生细胞量:对干扰素-γ的产生细胞量,也与上述“白细胞介素-22的产生细胞量”的测定试验同样地算出。需要说明的是,关于脾脏细胞的b细胞中的干扰素-γ的产生细胞的量的结果,示于图13及表6,关于脾脏细胞中的干扰素-γ的产生细胞的量的结果,示于图14及表6。需要说明的是,表6中,脾脏细胞的b细胞中的白细胞介素-22的产生细胞的量的结果示于“ifn-γ产生量”的“脾脏b细胞”的栏中,脾脏细胞中的白细胞介素-22的产生细胞的量的结果示于“ifn-γ产生量”的“全脾脏细胞”的栏中。图13中,“ifn-γ+/脾脏b细胞”表示脾脏细胞的b细胞中的干扰素-γ的产生细胞的量。图14中,“ifn-γ+/全脾脏细胞”表示脾脏细胞中的干扰素-γ的产生细胞的量。由以上的结果可知:将代表菌株(no.1、3、13、15、19、30、31)和脾脏细胞进行共培养时,与对照(不添加乳酸菌悬浮液而进行培养的物质)相比,产生白细胞介素-22、白细胞介素-10、及干扰素-γ的b细胞的比例增大(参照图9、图11、图13)。另外,可知:并不仅限定于b细胞,在脾脏细胞全体中因这些代表菌株而产生白细胞介素-22、白细胞介素-10、及干扰素-γ的细胞的比例也增大(参照图10、图12、图14)。需要说明的是,在实施例3的dna微阵列分析中,显示:代表菌株的no.1的菌株在b细胞中诱导白细胞介素-22、白细胞介素-10、干扰素-γ的产生。进而,在本实施例中,进行体外培养的细胞培养中的细胞因子的测定试验。其结果,可以确认:并不限于no.1的菌株,全部代表菌株均诱导白细胞介素-22、白细胞介素-10、干扰素-γ的产生。具体而言,可知:在含有b细胞的脾脏细胞中诱导白细胞介素-22、白细胞介素-10、干扰素-γ的产生,通过与作为耐盐性乳酸菌的上述代表菌株的共培养,产生上述细胞因子的细胞的量增大到1.1~5倍左右(参照图9~图14、表6)。(b细胞的子集)图15~图17中,示出用流式细胞计分析全脾脏细胞的淋巴细胞、及脾脏b细胞(b220阳性(b220+)细胞的细胞因子产生的结果。具体而言,图15表示用白细胞介素-22和白细胞介素-10展开的结果,图16表示用白细胞介素-22和干扰素-γ展开的结果,图17表示用白细胞介素-10和干扰素-γ展开的结果。由图15~图17可知:在全脾脏细胞及脾脏b细胞(b220阳性(b220+)细胞)的任一种情况下,均未确认到产生白细胞介素-22、白细胞介素-10、干扰素-γ中的2种以上的细胞。即,可知一个细胞仅产生白细胞介素-22、白细胞介素-10、干扰素-γ中的一种。需要说明的是,在图15~图17中,示出添加有no.1的菌株的结果,但在含有代表菌株的任一种检体中,均可得到与no.1的菌株同样的结果。在此,已知有:辅助性t细胞中存在根据细胞因子产生的特征而进行分类的子集(亚集团)。具体而言,已知有:在辅助性t细胞中,如th1细胞(以产生干扰素-γ为特征的细胞)、或th2细胞(以产生白细胞介素-4为特征的细胞)、th9细胞(以产生白细胞介素-9为特征的细胞)、th17细胞(以产生白细胞介素-17为特征的细胞)、th22细胞(以产生白细胞介素-22为特征的细胞)等那样,存在具有产生各自的细胞因子的作用的物质。另一方面,关于b细胞,尚未得知存在子集,但由图15~图17的结果可知:关于b细胞,也如辅助性t细胞那样存在子集。即,可知:在b细胞中,分别存在“产生白细胞介素-22的b细胞”、“产生白细胞介素-10的b细胞”、“产生干扰素-γ的b细胞”。已知有b细胞中的调节性b细胞产生白细胞介素-10。其中,认为“产生白细胞介素-10的b细胞”是调节性b细胞,认为调节性b细胞也因这些乳酸菌而增加或活化。需要说明的是,在对照(不添加乳酸菌悬浮液而进行培养的物质)中,也微量地检出产生白细胞介素-22、白细胞介素-10、干扰素-γ的b细胞。其结果,可知:即使在通常的条件(不含乳酸菌的培养条件)下,b细胞也产生上述细胞因子(白细胞介素-22、白细胞介素-10、干扰素-γ)。在本实施例中,检测b220阳性细胞而对b细胞进行了分析,但在代替b220阳性细胞而用cd19阳性细胞进行分析的情况下,也同样地检出产生白细胞介素-22、白细胞介素-10、及干扰素-γ的细胞。由该结果也可知:b细胞产生上述细胞因子,通过代表菌株,上述细胞因子的产生被诱导。(实施例6)<乳酸菌的饲喂试验>对实验用小鼠(c57bl/6)饲喂进行了杀菌处理的乳酸菌的菌体,测定其后的小鼠的血液中的血清iga。作为乳酸菌,使用代表菌株中的no.1及no.30的菌株。(1)乳酸菌配合饲料的制备:制备在通常的小鼠用饲料中含有1(w/w)%量的进行杀菌处理、其后进行了冷冻干燥的乳酸菌的菌体的饲料。需要说明的是,作为通常的小鼠用饲料,使用小鼠饲养繁殖用饲料ce-2(日本clea社制)。(2)饲喂试验:将通常的实验用小鼠(c57bl/6)(8周龄·雌)6只分成2组,对一组给予乳酸菌配合饲料(乳酸菌给药组),对另一组给予不含乳酸菌的菌体的通常的小鼠用饲料而进行饲养(对照组(乳酸菌非给药组))。从试验开始14天后,分别采血,通过离心分离回收血清而制备。(3)iga的测定:利用elisa法测定制备的血清中的总iga浓度。在测定中使用microlon96孔微孔板(greinerbio-one社制)。作为抗原,使用goatanti-mouseiga-unlb抗体(southernbiotech社制),作为二抗,使用goatanti-mouseiga-apconjugate(southernbiotech社制),作为显色底物,使用碱性磷酸酶底物(sigma社制)。另外,吸光度(405nm)的测定使用vmaxkineticmicroplatereader(moleculardevices社制)。在此,使用阶段稀释的对照组的检体,制作吸光度和iga浓度的标准曲线。而且,使用该标准曲线,算出乳酸菌给药组的检体和对照组(乳酸菌非给药组)的检体中的iga浓度。其后,将对照组(乳酸菌非给药组)中的iga浓度的平均值作为基准值(100),求出各检体的iga浓度的相对值。关于乳酸菌给药组和对照组(乳酸菌非给药组)的各数值,实施f检验并确认在分散上是否存在显著差异。其后,进行student’st检验(其为假定等分散的2标本的检验)。其结果,如表7、表8、图18及图19所示,no.1菌、no.30菌的乳酸菌给药组与对照组(乳酸菌非给药组)相比,血清中的iga浓度分别上升约25%、约22%。而且,student’st检验的结果,分别成为p<0.05(p=0.038)、p<0.01(p=0.0001),以5%及1%的显著水平确认到显著差异。由这些结果可知:通过本发明的耐盐性乳酸菌的摄取,血清中的总iga浓度增大,免疫激活能力因本发明的耐盐性乳酸菌而增大。[表7]对照组乳酸菌给药组(no.1)平均值(x-)100.0125.0标准偏差9.17.3p=0.038[表8]对照组乳酸菌给药组(no.30)平均值(x-)100.0122.3标准偏差1.91.1p=0.0001由以上的情况可知:如表1~表3所示,本发明的耐盐性乳酸菌通过直接作用于b细胞而使b细胞的存活能力及活化能力提高,进而使t细胞的存活能力及活化能力提高。由此可知:本发明的耐盐性乳酸菌具有免疫激活作用。进而可知:本发明的耐盐性乳酸菌中的no.1的菌株诱导白细胞介素-22、白细胞介素-10、及干扰素-γ的产生。进而可知:如表6所示,除no.1的菌株以外,关于no.3、13、15、19、30、31的菌株,也诱导白细胞介素-22、白细胞介素-10、及干扰素-γ的产生。而且,认为:代表菌株的耐盐性乳酸菌使血清中的总iga浓度增大,免疫激活能力因这些乳酸菌而增大(参照表7、表8、图18及图19)。另外可知:如表4、表5所示,如果盐分浓度为11~18w/v%,则可以选择性且良好地培养本发明的耐盐性乳酸菌,可以抑制污染菌的增殖。工业上的可利用性本发明的耐盐性乳酸菌可以作为添加到饮食品、补充剂、医药品等中而发挥免疫激活作用的免疫激活剂的有效成分采用,或将本身制成饮食品、补充剂、医药品等。本发明的耐盐性乳酸菌的培养方法可以作为本发明的耐盐性乳酸菌的培养方法采用。本发明的免疫激活剂可以用作添加于饮食品、补充剂、医药品等而发挥免疫激活作用的免疫激活剂,或将本身制成饮食品、补充剂、医药品等。作为饮食品,可举出例如:豆酱、方便豆酱汁、调理豆酱(豆酱加工品)、金山寺豆酱等副食酱、酱油、汤汁、调味汁、调味作料汁、咸菜(淡味腌制)的素等加工调味料、拌饭料等调味食品、家常菜、米酒(曲饮料)、加年糕片的小豆粥等。保藏编号保藏编号nitebp-02318、保藏编号nitebp-02319、保藏编号nitebp-02320、保藏编号nitebp-02321、保藏编号nitebp-02322、保藏编号nitebp-02323、保藏编号nitebp-02324受理厅记入栏国际事务局记入栏序列表<110>一引株式会社(ichibikico.,ltd.)国立大学法人东京医科齿科大学(nationaluniversitycorporationtokyomedicalanddentaluniversity)<120>耐盐性乳酸菌、耐盐性乳酸菌的培养方法、及免疫激活剂<130>wa-2199<160>1<170>patentinversion3.5<210>1<211>1000<212>dna<213>腐生性葡萄球菌腐生亚种(staphylococcussaprophyticussubsp.saprophyticus)<400>1gggcaatgcgggtgctatacatgcagtcgagcgaacagataaggagcttgctcctttgac60gttagcggcggacgggtgagtaacacgtgggtaacctacctataagactgggataacttc120gggaaaccggagctaataccggataacatttggaaccgcatggttctaaagtgaaagatg180gttttgctatcacttatagatggacccgcgccgtattagctagttggtaaggtaacggct240taccaaggcaacgatacgtagccgacctgagagggtgatcggccacactggaactgagac300acggtccagactcctacgggaggcagcagtagggaatcttccgcaatgggcgaaagcctg360acggagcaacgccgcgtgagtgatgaagggtttcggctcgtaaaactctgttattaggga420agaacaaatgtgtaagtaactgtgcacatcttgacggtacctaatcagaaagccacggct480aactacgtgccagcagccgcggtaatacgtaggtggcaagcgttatccggaattattggg540cgtaaagcgcgcgtaggcggtttcttaagtctgatgtgaaagcccacggctcaaccgtgg600agggtcattggaaactgggaaacttgagtgcagaagaggaaagtggaattccatgtgtag660cggtgaaatgcgcagagatatggaggaacaccagtggcgaaggcgactttctggtctgta720actgacgctgatgtgcgaaagcgtggggatcaaacaggattagataccctggtagtccac780gccgtaaacgatgagtgctaagtgttagggggtttccgccccttagtgctgcagctaacg840cattaagcactccgcctggggagtacgaccgcaaggttgaaactcaaaggaattgacggg900gacccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttaccaa960atcttgacatcctttgaaaactctagagatagagccttcc1000当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1