含有IgG结合肽的固相载体以及IgG的分离方法与流程
本发明涉及含有IgG结合肽的固相载体、含有该固相载体的IgG分离用柱、含有该固相载体或者柱的试剂盒、以及使用该固相载体或者柱的IgG的纯化方法等。
背景技术:
IgG抗体是目前最受关注的生物药品之一。近年来,以IgG抗体为中心的抗体药物利用于医药领域,工业上、制药上的利用中的重要性越来越高。在抗体的纯化中,蛋白A柱起到核心的作用,许多抗体药物的制造商引入了以该柱为中心的纯化系统。
然而,该蛋白A柱被指出了若干的问题点。一个是蛋白A混入到纯化抗体中的问题。蛋白A是源自细菌的蛋白质,人体给药后的免疫原性高,还担心内毒素的混入。作为IgG之类的药品的纯化所使用的亲和配体,为了不发生不合适的物质的混入,对作为配体的蛋白A要求高纯化度,这成为提高利用于药品纯化的蛋白A柱的成本的主要原因。因此,期待开发代替蛋白A的新的亲和柱。
本发明人等此前报告了可以利用由二硫键环化后的含有特定序列的肽配体来纯化IgG(专利文献1),但本肽配体存在因反复进行碱溶液清洗而使亲和性降低的问题。
现有技术文献
专利文献
专利文献1:WO2013/027796
技术实现要素:
发明要解决的问题
本发明的问题在于,提供一种能用于IgG纯化,并且稳定性、例如碱稳定性优异的IgG结合肽等。另外,本发明的问题在于,提供一种使用上述IgG结合肽来纯化IgG的方法等。
技术方案
本发明人发现了如下事实,从而完成了本申请发明:通过利用具有特定结构的接头对肽中的半胱氨酸残基中的硫醚基进行交联,肽的稳定性显著改善。
因此,本发明包含以下方案。
(1)一种固相载体,其固定化了具有能够与人IgG结合的特征的肽,
所述肽含有下述式I所示的、由13~17个氨基酸残基构成的氨基酸序列,
(X1-3)-C-(X2)-H-(Xaa1)-G-(Xaa2)-L-V-W-C-(X1-3) (I)
(式中,X各自独立地为半胱氨酸以外的任意氨基酸残基,
C为半胱氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
Xaa2为谷氨酸残基或者天冬酰胺残基,
L为亮氨酸残基,
V为缬氨酸残基,并且,
W为色氨酸残基,)
并且所述肽的外侧的2个半胱氨酸残基中的硫醚基由选自由下式所示的接头构成的组中的接头连结,
[化1]
R3SD
在此,R为取代或未取代的C1~C6烷基。
(2)根据(1)所述的固相载体,其中,
所述肽含有下述式II所示的、由13~17个氨基酸残基构成的氨基酸序列,
(X1-3)-C-(Xaa3)-(Xaa4)-H-(Xaa1)-G-(Xaa2)-L-V-W-C-(X1-3) (II)
(式中,X各自独立地为半胱氨酸以外的任意氨基酸残基,
C为半胱氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
Xaa2为谷氨酸残基或者天冬酰胺残基,
L为亮氨酸残基,
V为缬氨酸残基,
W为色氨酸残基,
Xaa3为丙氨酸残基、丝氨酸残基或者苏氨酸残基,并且,
Xaa4为酪氨酸残基或者色氨酸残基。)
(3)根据(1)或(2)所述的固相载体,其中,
所述肽含有下述式III所示的、由13~17个氨基酸残基构成的氨基酸序列,
(X1-3)-C-A-Y-H-(Xaa1)-G-E-L-V-W-C-(X1-3) (III)
(式中,X各自独立地为半胱氨酸以外的任意氨基酸残基,
C为半胱氨酸残基,
A为丙氨酸残基,
Y为酪氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
E为谷氨酸残基,
L为亮氨酸残基,
V为缬氨酸残基,并且,
W为色氨酸残基。)
(4)根据(1)~(3)中任一项所述的固相载体,其中,
采用了17个氨基酸残基的情况下的、所述肽的从N末端起第1~3、15~17个各氨基酸残基为:
第1个氨基酸残基=S、G、F或者无;
第2个氨基酸残基=D、G、A、S、P、高半胱氨酸或者无;
第3个氨基酸残基=S、D、T、N、E或者R;
第15个氨基酸残基=S、T或者D;
第16个氨基酸残基=H、G、Y、T、N、D、F、高半胱氨酸或者无;
第17个氨基酸残基=Y、F、H、M或者无。
(5)根据(4)所述的固相载体,其中,
所述肽由以下1)~14)中的任一种氨基酸序列构成,其中,Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,Xaa2为高半胱氨酸,
1)DCAYH(Xaa1)GELVWCT(SEQ ID NO:1)
2)GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2)
3)RCAYH(Xaa1)GELVWCS(SEQ ID NO:3)
4)GPRCAYH(Xaa1)GELVWCSFH(SEQ ID NO:4)
5)SPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:5)
6)GDDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:6)
7)GPSCAYH(Xaa1)GELVWCTFH(SEQ ID NO:7)
8)GPDCAYH(Xaa1)GELVWCSFH(SEQ ID NO:8)
9)GPDCAYH(Xaa1)GELVWCTHH(SEQ ID NO:9)
10)GPDCAYH(Xaa1)GELVWCTFY(SEQ ID NO:10)
11)SPDCAYH(Xaa1)GELVWCTFY(SEQ ID NO:11)
12)SDDCAYH(Xaa1)GELVWCTFY(SEQ ID NO:12)
13)RGNCAYH(Xaa1)GQLVWCTYH(SEQ ID NO:13)
14)G(Xaa2)DCAYH(Xaa1)GELVWCT(Xaa2)H(SEQ ID NO:14)。
(6)根据(1)或(2)所述的固相载体,其中,
所述肽含有下述式IV所示的、由13个氨基酸残基构成的氨基酸序列,
D-C-(Xaa3)-(Xaa4)-H-(Xaa1)-G-(Xaa2)-L-V-W-C-T (IV)
(式中,
D为天冬氨酸残基,
C为半胱氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
Xaa2为谷氨酸残基或者天冬酰胺残基,
L为亮氨酸残基,
V为缬氨酸残基,
W为色氨酸残基,
T为苏氨酸残基,
Xaa3为丙氨酸残基或者苏氨酸残基,并且,
Xaa4为酪氨酸残基或者色氨酸残基。)
(7)根据(6)所述的固相载体,其中,
所述肽由以下1)~4)中的任一种氨基酸序列构成,其中,Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
1)DCTYH(Xaa1)GNLVWCT(SEQ ID NO:15)
2)DCAYH(Xaa1)GNLVWCT(SEQ ID NO:16)
3)DCTYH(Xaa1)GELVWCT(SEQ ID NO:17)
4)DCAWH(Xaa1)GELVWCT(SEQ ID NO:18)。
(8)一种固相载体,其固定化了具有能够与人IgG结合的特征的肽,
所述肽含有下述式V所示的、由13个氨基酸残基构成的氨基酸序列,
D-C-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa1)-G-(Xaa5)-L-(Xaa6)-W-C-T (V)
(式中,
D为天冬氨酸残基,
C为半胱氨酸残基,
G为甘氨酸残基,
L为亮氨酸残基,
W为色氨酸残基,
T为苏氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
Xaa2为丙氨酸残基、丝氨酸残基或者苏氨酸残基,
Xaa3为色氨酸残基或者酪氨酸残基,
Xaa4为组氨酸残基、精氨酸残基、丝氨酸残基或者苏氨酸残基,
Xaa5为谷氨酸残基、天冬酰胺残基、精氨酸残基或天冬氨酸残基,并且,
Xaa6为异亮氨酸残基或者缬氨酸残基,)
并且所述肽的外侧的2个半胱氨酸残基中的硫醚基由选自由下式所示的接头构成的组中的接头连结,
[化2]
以及
在此,R为取代或者未取代的C1~C6烷基。
(9)根据(1)~(8)中任一项所述的固相载体,其中,
Xaa1为精氨酸残基、赖氨酸残基或其酰化衍生物、或者亮氨酸残基。
(10)根据(1)所述的固相载体,其中,
所述肽由以下氨基酸序列构成,
GPDCAYHRGELVWCTFH(SEQ ID NO:31)。
(11)根据(1)~(10)中任一项所述的固相载体,其中,
所述接头为下式所示的接头,
[化3]
(12)根据(1)~(11)中任一项所述的固相载体,其中,
所述肽的N末端被PEG化。
(13)根据(1)~(12)中任一项所述的固相载体,其中,
所述肽的C末端被酰胺化。
(14)根据(1)~(13)中任一项所述的固相载体,其中,
所述肽被多聚化。
(15)根据(14)所述的固相载体,其中,
所述肽的多聚体在该肽之间具有间隔体。
(16)根据(1)~(15)中任一项所述的固相载体,其中,
在所述肽与固相之间具有间隔体。
(17)一种IgG分离用柱,其含有(1)~(16)中任一项所述的固相载体。
(18)一种用于IgG的纯化的试剂盒,其含有(1)~(16)中任一项所述的固相载体或者(17)所述的IgG分离用柱。
(19)一种IgG的纯化方法,其包括:
使IgG与(1)~(16)中任一项所述的固相载体、或者(17)所述的IgG分离用柱结合的工序;以及
使所结合的IgG洗脱而回收IgG的工序。
本说明书包含作为本申请的优先权基础的日本专利申请号2016-225483号的公开内容。
有益效果
本发明的固相载体所含的肽通过利用具有特定结构的接头对半胱氨酸残基中的硫醚基进行交联,稳定性得到改善。因此,本发明的固相载体不易因碱清洗工序等而使IgG结合能力降低,因此能用于高效的IgG纯化。
附图说明
[图1]图1表示使源自人血清的γ-球蛋白(Wako)吸附于实施例3中制作出的肽固定化柱,使用酸性的洗脱溶液(20mM柠檬酸、pH2.5)进行洗脱后的情况下的结果。横轴表示洗脱液的体积,纵轴表示通过280nm的吸光度测定的蛋白质浓度。
[图2]图2表示从实施例3中制作出的肽固定化柱利用柠檬酸或者IgG结合肽使蛋白质洗脱,并进行了0.5mL分级的各级分的SDS-PAGE的结果。蛋白质的检测通过CBB染色来进行。
[图3]图3表示利用吸附溶液对肽固定化量不同的3种(1mg、4mg、10mg)柱进行平衡化后,以1mL/min(停留时间1min)的流速输送溶解于吸附溶液中的1mg/mL源自人血清的γ-球蛋白时的DBC的测定结果。DBC根据280nm吸光度下除去了非吸附成分的值达到样品整体的吸光度的10%之前输送的样品量而求得。
[图4]图4表示实施例2中制备出的由接头交联后的IgG结合肽、以及比较例1中制备出的由二硫化物交联后的IgG结合肽的、氢氧化钠处理时的DBC的测定结果。
具体实施方式
<含有IgG结合肽的固相载体>
在一个方案中,本发明涉及含有IgG结合肽的固相载体。作为本说明书中的“固相载体”,并不进行限定,但可列举出:玻璃珠、硅胶等无机载体;由交联聚乙烯醇、交联聚丙烯酸酯、交联聚丙烯酰胺、交联聚苯乙烯等合成高分子或结晶性纤维素、交联纤维素、交联琼脂糖、交联葡聚糖等多糖类构成的有机载体;进而通过它们的组合而得到的有机-有机、有机-无机等复合载体等,其中,亲水性载体的非特异吸附比较少,IgG结合肽的选择性良好,故优选。此处所说的亲水性载体表示将构成载体的化合物制成平板状时的与水的接触角为60度以下的载体。就这样的载体而言,作为代表例,可列举出:由纤维素、壳聚糖、葡聚糖等多糖类,聚乙烯醇、乙烯-乙酸乙烯酯共聚物皂化物、聚丙烯酰胺、聚丙烯酸、聚甲基丙烯酸、聚甲基丙烯酸甲酯、聚丙烯酸接枝化聚乙烯、聚丙烯酰胺接枝化聚乙烯、玻璃等构成的载体。
作为固相载体的形态,珠状、纤维状、粒子条、膜状(也包含中空纤维)、凝胶状等都可以,可以选择任意形态。从具有特定排阻极限分子量的载体制作的容易度考虑,特别优选使用珠状。珠状的平均粒径为10μm~2500μm的固相载体容易使用,尤其是,从IgG结合肽固定化反应的容易度的观点考虑,优选25μm至800μm的范围。作为固相载体,具体而言,例如可列举出:磁性珠、玻璃珠、聚苯乙烯珠、硅胶珠、以及多糖类珠等。
进而,若在固相载体表面存在能用于IgG结合肽的固定化反应的官能团,则便于IgG结合肽的固定化。作为这些官能团的代表例,可列举出:羟基、氨基、醛基、羧基、硫醇基、硅烷醇基、环氧基、琥珀酰亚胺基、N-羟基琥珀酰亚胺基等、酸酐基、碘乙酰基等。
作为固相载体,也可以使用市售品。作为市售品,可以举例示出:作为多孔质纤维素凝胶的GCL2000、GC700;利用共价键将烯丙基葡聚糖与亚甲基双丙烯酰胺交联而成的Sephacryl S-1000;作为丙烯酸酯系载体的Toyopearl;作为琼脂糖系交联载体的SepharoseCL4B;作为利用环氧基活化后的聚甲基丙烯酰胺的Eupergit C250L;含有利用NHS基活化后的琼脂糖凝胶(sepharose)载体的NHS活化预填充柱等。不过,在本实施方式中,不仅限于这些载体、活化载体。
上述的固相载体既可以分别单独使用,也可以将任意两种以上混合。另外,作为固相载体,从其使用目的以及方法考虑,理想的是表面积大,优选具有许多适当大小的细孔,即,优选为多孔质。
优选在上述固相载体固定化有本说明书中记载的IgG结合肽,肽的固定化可以使用本领域技术人员公知的方法来进行,可以通过例如物理吸附法、共价键合法、离子键合法等来进行。固定化优选通过使例如IgG结合肽的N末端的氨基直接或者经由间隔体与固相载体共价键合来进行。为了通过缩小IgG结合肽的空间位阻来提高分离效率,进而抑制非特异性结合,更优选经由亲水性间隔体进行固定化。亲水性间隔体并不特别限定,例如优选使用将两末端用羧基、氨基、醛基、环氧基等取代的聚亚烷基氧化物的衍生物。
导入到上述固相载体的IgG结合肽以及用作间隔体的有机化合物的固定化方法以及条件并不特别限定,可举例示出一般在将蛋白质、肽固定化于载体的情况下采用的方法。例如,可列举出:使载体与含有氨基的化合物、含有N-羟基琥珀酰亚胺基的化合物、溴化氰、环氧氯丙烷、二缩水甘油醚、甲苯磺酰氯、三氟代乙烷磺酰氯(tresyl chloride)、肼等反应而活化(由载体原本具有的官能团变成IgG结合肽容易反应的官能团),与IgG结合肽反应,进行固定化的方法;另外,通过向存在载体和IgG结合肽的体系中加入碳二亚胺之类的缩合试剂、或者像戊二醛那样在分子中具有多个官能团的试剂来进行缩合、交联而实现的固定化方法,更优选应用IgG结合肽在固相载体的灭菌时或者利用时不容易从固相载体脱离的固定化方法。
本说明书中记载的含有IgG结合肽的固相载体能填充至色谱柱等中来用于纯化或者分离人IgG。
关于可以含在本发明的固相载体中的IgG结合肽,以下进行详细说明。
本说明书中使用的“IgG”是指,哺乳动物、例如人及黑猩猩等灵长类,大鼠、小鼠及兔子等实验动物,猪、牛、马、绵羊及山羊等家畜动物,以及狗及猫等宠物动物的IgG,优选是指人的IgG(IgG1、IgG2、IgG3或者IgG4)。本说明书中的IgG进一步优选为人IgG1、IgG2或IgG4、或者兔子IgG,特别优选为人IgG1、IgG2、或者IgG4。
在一个方案中,可以含在本发明的固相载体中的IgG结合肽含有下述式I所示的、由13~17个氨基酸残基构成的氨基酸序列,
(X1-3)-C-(X2)-H-(Xaa1)-G-(Xaa2)-L-V-W-C-(X1-3) (I)
(式中,X各自独立地为半胱氨酸以外的任意氨基酸残基,
C为半胱氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
Xaa2为谷氨酸残基或者天冬酰胺残基,
L为亮氨酸残基,
V为缬氨酸残基,并且,
W为色氨酸残基)
并且所述肽的外侧的2个半胱氨酸残基中的硫醚基由选自由下式所示的接头构成的组中的接头连结,
[化4]
以及
在上述式中,N末端或者C末端的X1-3的符号是指,连续1~3个半胱氨酸(C或者Cys)以外的独立的任意氨基酸残基X,构成其的氨基酸残基为相同或者不同的残基,但优选由3个均不是相同的残基的序列构成。同样地,X2也是指,连续2个半胱氨酸(C或者Cys)以外的独立的任意氨基酸残基X,构成其的氨基酸残基为相同或者不同的残基,但优选由该2个连续的氨基酸残基不是相同的残基的序列构成。
以下示出在式I的肽的氨基酸序列中进一步特别指定了氨基酸残基X的式I’以及式I”所示的肽。
即,式I’所示的肽含有下述式I’所示的、由13~17个氨基酸残基构成的氨基酸序列,
(X1-3)-C-(X1)-Y-H-(Xaa1)-G-N-L-V-W-C-(X1-3) (I’)
(式中,X各自独立地为半胱氨酸以外的任意氨基酸残基,
C为半胱氨酸残基,
Y为酪氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
N为天冬酰胺残基,
L为亮氨酸残基,
V为缬氨酸残基,并且,
W为色氨酸残基)。
式I”所示的肽含有下述式I”所示的、由13~17个氨基酸残基构成的氨基酸序列,
(X1-3)-C-A-(X1)-H-(Xaa1)-G-E-L-V-W-C-(X1-3) (I”)
(式中,X各自独立地为半胱氨酸以外的任意氨基酸残基,
C为半胱氨酸残基,
A为丙氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
E为谷氨酸残基,
L为亮氨酸残基,
V为缬氨酸残基,并且,
W为色氨酸残基)。
另外,以下示出在式I的肽的氨基酸序列中进一步特别指定了氨基酸残基X的式II所示的肽。
即,式II所示的肽含有下述式II所示的、由13~17个氨基酸残基构成的氨基酸序列,
(X1-3)-C-(Xaa3)-(Xaa4)-H-(Xaa1)-G-(Xaa2)-L-V-W-C-(X1-3) (II)
(式中,X各自独立地为半胱氨酸以外的任意氨基酸残基,
C为半胱氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
Xaa2为谷氨酸残基或者天冬酰胺残基,
L为亮氨酸残基,
V为缬氨酸残基,
W为色氨酸残基,
Xaa3为丙氨酸残基、丝氨酸残基或者苏氨酸残基,并且,
Xaa4为酪氨酸残基或者色氨酸残基)。
在上述式I’、式I”以及式II的肽的氨基酸序列中,采用了17个氨基酸残基的情况下的、从N末端起第1个和第2个以及第16个和第17个氨基酸残基X可以缺失,那样的肽由13个氨基酸长度构成。
本说明书中使用的“采用了17个氨基酸残基的情况下的”是指,将肽的氨基酸残基用氨基酸序号来称呼时,为了针对式I的肽从作为最长的氨基酸长度的17个残基的N末端起依次从第1个到第17个进行编号而方便表达的术语。
另外,以下示出在式I的肽的氨基酸序列中进一步特别指定了氨基酸残基X的式III所示的肽。
即,式III所示的肽含有下述式III所示的、由13~17个氨基酸残基构成的氨基酸序列,
(X1-3)-C-A-Y-H-(Xaa1)-G-E-L-V-W-C-(X1-3) (III)
(式中,X各自独立地为半胱氨酸以外的任意氨基酸残基,
C为半胱氨酸残基,
A为丙氨酸残基,
Y为酪氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
E为谷氨酸残基,
L为亮氨酸残基,
V为缬氨酸残基,并且,
W为色氨酸残基)。
在上述式III的肽的氨基酸序列中,采用了17个氨基酸残基的情况下的、从N末端起第1个和第2个以及第16个和第17个氨基酸残基X可以缺失,那样的肽可以由13个氨基酸长度构成。
进而,上述各式的肽的氨基酸序列的半胱氨酸(C)以外的氨基酸残基、即采用了17个氨基酸残基的情况下的从N末端起第1~3、5、6、15~17个各氨基酸残基优选选自以下的残基。在此,各大写字母为氨基酸的单字母符号:
第1个氨基酸残基=S、G、F或者无,
第2个氨基酸残基=D、G、A、S、P、高半胱氨酸或者无,
第3个氨基酸残基=S、D、T、N、E或者R,
第15个氨基酸残基=S、T或者D,
第16个氨基酸残基=H、G、Y、T、N、D、F、高半胱氨酸或者无,
第17个氨基酸残基=Y、F、H、M或者无。
第5个氨基酸残基=A或者T,
第6个氨基酸残基=Y或者W。
另外,以下示出在式I的肽的氨基酸序列中进一步特别指定了氨基酸残基X的式IV所示的肽。
即,式IV所示的肽含有下述式IV所示的、由13个氨基酸残基构成的氨基酸序列,
D-C-(Xaa3)-(Xaa4)-H-(Xaa1)-G-(Xaa2)-L-V-W-C-T (IV)
(式中,
D为天冬氨酸残基,
C为半胱氨酸残基,
H为组氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
G为甘氨酸残基,
Xaa2为谷氨酸残基或者天冬酰胺残基,
L为亮氨酸残基,
V为缬氨酸残基,
W为色氨酸残基,
T为苏氨酸残基,
Xaa3为丙氨酸残基或者苏氨酸残基,并且,
Xaa4为酪氨酸残基或者色氨酸残基)。
以下的1)~18)列举出式I的肽的一些具体例,但不言而喻并不限于这些:
1)DCAYH(Xaa1)GELVWCT(SEQ ID NO:1),
2)GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2),
3)RCAYH(Xaa1)GELVWCS(SEQ ID NO:3),
4)GPRCAYH(Xaa1)GELVWCSFH(SEQ ID NO:4),
5)SPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:5),
6)GDDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:6),
7)GPSCAYH(Xaa1)GELVWCTFH(SEQ ID NO:7),
8)GPDCAYH(Xaa1)GELVWCSFH(SEQ ID NO:8),
9)GPDCAYH(Xaa1)GELVWCTHH(SEQ ID NO:9),
10)GPDCAYH(Xaa1)GELVWCTFY(SEQ ID NO:10),
11)SPDCAYH(Xaa1)GELVWCTFY(SEQ ID NO:11),
12)SDDCAYH(Xaa1)GELVWCTFY(SEQ ID NO:12),
13)RGNCAYH(Xaa1)GQLVWCTYH(SEQ ID NO:13),
14)G(Xaa2)DCAYH(Xaa1)GELVWCT(Xaa2)H(SEQ ID NO:14),
15)DCTYH(Xaa1)GNLVWCT(SEQ ID NO:15),
16)DCAYH(Xaa1)GNLVWCT(SEQ ID NO:16),
17)DCTYH(Xaa1)GELVWCT(SEQ ID NO:17),以及
18)DCAWH(Xaa1)GELVWCT(SEQ ID NO:18)
(式中,Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,Xaa2为高半胱氨酸,优选为高半胱氨酸之间彼此形成二硫键)。
作为式I的肽的优选具体例,可列举出:
1)DCAYH(Xaa1)GELVWCT(SEQ ID NO:1,其中,Xaa1为R),
2)GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2,其中,Xaa1为R、L、K或者乙酰化赖氨酸),以及
4)GPRCAYH(Xaa1)GELVWCSFH(SEQ ID NO:4,其中,Xaa1为R),
作为特别优选的例子,可列举出GPDCAYHRGELVWCTFH(SEQ ID NO:31)。
另外,在一个方案中,在本说明书中记载的IgG结合肽中,作为广义的一次结构,含有下述式V所示的、由13个氨基酸残基构成的氨基酸序列,
D-C-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa1)-G-(Xaa5)-L-(Xaa6)-W-C-T (V)
(式中,
D为天冬氨酸残基,
C为半胱氨酸残基,
G为甘氨酸残基,
L为亮氨酸残基,
W为色氨酸残基,
T为苏氨酸残基,
Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,
Xaa2为丙氨酸残基、丝氨酸残基或者苏氨酸残基,
Xaa3为色氨酸残基或者酪氨酸残基,
Xaa4为组氨酸残基、精氨酸残基、丝氨酸残基或者苏氨酸残基,
Xaa5为谷氨酸残基、天冬酰胺残基、精氨酸残基或天冬氨酸残基,并且,
Xaa6为异亮氨酸残基或者缬氨酸残基)
并且所述肽的外侧的2个半胱氨酸残基中的硫醚基由选自由下式所示的接头构成的组中的接头连结,
[化5]
以及
以下的19)~30)列举出式V的肽的一些具体例,但不言而喻并不限于这些:
19)DCTYT(Xaa1)GNLVWCT(SEQ ID NO:19),
20)DCAYT(Xaa1)GNLVWCT(SEQ ID NO:20),
21)DCSYT(Xaa1)GNLVWCT(SEQ ID NO:21),
22)DCTWT(Xaa1)GNLVWCT(SEQ ID NO:22),
23)DCTYH(Xaa1)GNLVWCT(SEQ ID NO:23),
24)DCTYR(Xaa1)GNLVWCT(SEQ ID NO:24),
25)DCTYS(Xaa1)GNLVWCT(SEQ ID NO:25),
26)DCTYT(Xaa1)GNLVWCT(SEQ ID NO:26),
27)DCTYT(Xaa1)GELVWCT(SEQ ID NO:27),
28)DCTYT(Xaa1)GRLVWCT(SEQ ID NO:28),
29)DCTYT(Xaa1)GDLVWCT(SEQ ID NO:29),以及
30)DCTYT(Xaa1)GNLIWCT(SEQ ID NO:30)
(式中,Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物)。
如上所述,在本说明书中记载的IgG结合肽中,Xaa1为精氨酸残基、赖氨酸残基、亮氨酸残基或天冬酰胺残基、或者它们的衍生物,优选为精氨酸残基、赖氨酸残基或其衍生物、亮氨酸残基或天冬酰胺残基,进一步优选为精氨酸残基、赖氨酸残基或其衍生物、或者亮氨酸残基。在本说明书中,衍生物的种类并不特别限定,可列举出乙酰基或者丙炔基等酰化衍生物(酰化衍生物由通式R-CO-表示,式中,R为烃,优选为碳数1~6的烷基)。作为衍生物的例子,例如可列举出赖氨酸残基的ε氨基被酰化、例如被乙酰化的衍生物。
如上所述,本说明书中记载的IgG结合肽的特征在于,在各氨基酸序列中具有隔开的至少两个半胱氨酸(C)残基,该半胱氨酸残基的硫醚基由选自由下式所示的接头构成的组中的接头连结,
[化6]
以及
上述IgG结合肽中的接头优选为下式所示的接头,
[化7]
进一步优选为下式所示的接头,
[化8]
上述IgG结合肽中的接头中的R为取代或者未取代的烷基,优选为取代或者未取代的C1~C6烷基,即甲基、乙基、丙基、丁基、戊基、或者己基。R的取代基并不特别限定,例如可以为羟基、(单或多)环氧乙烷基、羧基、烷氧基、酰基、烷基、酰胺基、酯基、卤素基团(F、Cl、Br、或者I)、或者它们的组合。另外,波浪线部分是指与硫醚基的键合部分。与通常的二硫键相比,该接头的稳定性、例如耐碱性或者还原反应等耐性、优选为耐碱性优异。
制备具有上述接头的肽的方法并不特别限定。例如,具有下式所示的接头的肽例如可以通过以下方法来得到:
包括将含有两个半胱氨酸残基的肽与在上述接头的波浪线部分具有参与交联反应的反应性的官能团(例如,卤素基团、咪唑基等)的化合物,在例如酸性条件下进行混合的工序,
[化9]
进而,通过使上述具有羰基的肽与伯胺(RNH2)反应,能得到由下式所示的接头连结的肽(R为与上述相同的意思),
[化10]
在所述化合物中,卤素基团优选从由F、Cl、Br以及I构成的组中选择,进一步优选从由Cl、Br以及I构成的组中选择。卤素基团优选为相同,进一步优选的是,卤素基团均为Cl。
本方法中的混合工序的条件若为在肽的半胱氨酸残基之间发生连结反应的条件,则并不特别限定。例如,可以通过将肽和所述化合物在适当的缓冲液中于室温(例如约15℃~30℃)或者低温下混合来进行反应。该混合工序可以适量加入促进连结反应的碱(或者alkali)、例如弱碱性的无机或者有机(例如,盐酸胍、重碳酸钠、以及二乙胺等)来进行。
本方法的混合工序中的肽与化合物的混合比率并不特别限定。肽与化合物的摩尔比率例如可以设为1:0.2~1:10,优选设为1:0.5~1:5或者1:1~1:2。
该混合工序中的混合时间(反应时间)只要在肽的半胱氨酸残基之间发生连结反应就并不限定,例如可以设为1分钟~5小时,优选设为10分钟~2小时或者15分钟~1小时。
本方法根据需要可以进一步包括:从进行了上述工序后的混合物中,分离出杂质、例如未反应的肽以及化合物等,对连结有半胱氨酸残基的肽进行纯化的工序。该工序可以通过本领域公知的方法,例如凝胶过滤色谱法、离子交换柱色谱法、亲和色谱法、反相柱色谱法、以及HPLC等色谱法等来进行。
另外,就本说明书中记载的IgG结合肽而言,为了提高其稳定性等,例如,可以通过N末端的PEG化(聚乙二醇加成)、以及C末端的酰胺化等来改性。进行PEG化时的PEG的分子数并不特别限定,例如,可以加成1~50分子、1~20分子、2~10分子、2~6分子、或者4分子的PEG。
另外,本说明书中记载的IgG结合肽可以被多聚化。在本说明书中,IgG结合肽的“多聚化”是指,2分子以上的上述IgG结合肽经由共价键连结,IgG结合肽的多聚体例如可以为2~6聚体、2~5聚体、2~4聚体、2~3聚体,优选为2聚体。
所述肽的多聚体可以在该肽之间具有间隔体。多聚化可以通过本领域技术人员公知的方法来进行,例如可以通过将上述IgG结合肽的N末端的氨基经由间隔体连结2分子以上来进行。间隔体的种类并不特别限定,例如可列举出:两末端具有羧基的天冬氨酸以及谷氨酸等氨基酸;以及将两末端用羧基、醛基、环氧基、N-羟基琥珀酰亚胺基等官能团取代的聚亚烷基氧化物的衍生物。
本说明书中记载的IgG结合肽与人IgG的结合亲和性,与其它的人免疫球蛋白(IgA、IgE、IgM)相比可以高约10倍以上,优选高约50倍以上,更优选高约200倍以上。关于本说明书中记载的肽与人IgG的结合的解离常数(Kd),可以通过表面等离子共振谱分析(例如使用BIACORE系统)来确定,例如小于1×10-1M、小于1×10-3M,优选小于1×10-4M,更优选小于1×10-5M。本说明书中记载的IgG结合肽可以与IgG的Fc结构域结合。
本说明书中记载的肽可以通过惯用的液相合成法、固相合成法等肽合成法、由自动肽合成机进行的肽合成等(Kelley et al.,Genetics Engineering Principles and Methods,Setlow,J.K.eds.,Plenum Press NY.(1990)Vol.12,p.1-19;Stewart et al.,Solid-Phase Peptide Synthesis(1989)W.H.Freeman Co.;Houghten,Proc.Natl.Acad.Sci.USA(1985)82:p.5132;《新生物化学实验讲座1蛋白质IV》(1992)日本生物化学会编、东京化学同人)来制造。或者,也可以通过使用对本说明书中记载的肽进行编码的核酸的基因重组法、噬菌体展示法等来制造肽。例如可以通过将对本说明书中记载的肽的氨基酸序列进行编码的DNA导入表达载体中,并导入宿主细胞中进行培养来制造目标肽。所制造的肽可以通过常规方法,例如凝胶过滤色谱法、离子交换柱色谱法、亲和色谱法、反相柱色谱法、HPLC等色谱法、硫酸铵分级、超滤、以及免疫吸附法等来进行回收或者纯化。
在肽合成中,例如,准备保护各氨基酸(无论是天然还是非天然)的、除了要结合的α-氨基和α-羧基以外的官能团的氨基酸类,在各氨基酸的α-氨基与α-羧基之间进行肽键形成反应。通常,预先将位于肽的C末端的氨基酸残基的羧基经由适当的间隔体(spacer)或者接头(linker)与固相结合。将这样得到的二肽的氨基末端的保护基选择性地去除,在与下一个氨基酸的α-羧基之间形成肽键。连续进行这样的操作,制造出侧基受到保护的肽,最后,去除所有保护基,从固相分离。保护基的种类和保护方法、肽键法的详情详细地记载于上述的文献中。
基因重组法的制造例如可以通过如下方法来进行:包括将对本说明书中记载的肽进行编码的DNA插入至适当的表达载体中,将载体导入至适当的宿主细胞中,对细胞进行培养,从细胞内或者从细胞外液回收目标肽。载体并不限定,例如为质粒、噬菌体、粘粒、噬菌粒、以及病毒等载体。作为质粒载体,并不限定,可列举出源自大肠杆菌的质粒(例如pET22b(+)、pBR322、pBR325、pUC118、pUC119、pUC18、pUC19、pBluescript等)、源自枯草杆菌的质粒(例如pUB110、pTP5等)、以及源自酵母的质粒(例如YEp13、YCp50等)等。作为噬菌体载体,并不限定,可列举出T7噬菌体展示载体(T7Select10-3b、T7Select1-1b、T7Select1-2a、T7Select1-2b、T7Select1-2c等(Novagen))、以及λ噬菌体载体(Charon4A、Charon21A、EMBL3、EMBL4、λgt10、λgt11、λZAP、λZAPII等)。作为病毒载体,并不限定,例如可列举出反转录病毒、腺病毒、腺伴随病毒、牛痘病毒及仙台病毒等动物病毒;以及杆状病毒等昆虫病毒等。作为粘粒载体,并不限定,可列举出Lorist 6、Charomid9-20、以及Charomid9-42等。作为噬菌粒载体,并不限定,例如已知有pSKAN、pBluescript、pBK、以及pComb3H等。载体中可以含有:能表达目标DNA的调节序列、用于筛选含有目标DNA的载体的选择标记、用于插入目标DNA的多克隆位点等。那样的调节序列中含有:启动子、增强子、终止子、S-D序列或者核糖体结合位点、复制起始点、以及polyA位点等。另外,选择标记例如可以使用:氨苄青霉素抗性基因、新霉素抗性基因、卡那霉素抗性基因、以及二氢叶酸还原酶基因等。用于导入载体的宿主细胞为大肠杆菌和枯草杆菌等细菌、酵母细胞、昆虫细胞、动物细胞(例如,哺乳动物细胞)、以及植物细胞等,向这些细胞的转化或者转染例如包括:磷酸钙法、电穿孔法、脂质体转染法、粒子枪(particle gun)法、以及PEG法等。转化细胞的培养按照用于培养宿主生物的常规方法来进行。例如,大肠杆菌、酵母细胞等微生物的培养液含有可被宿主微生物同化的碳源、氮源、以及无机盐类等。为了使本说明书中记载的肽的回收变容易,优选使通过表达生成的肽分泌至细胞外。这可以通过将对能使肽从该细胞分泌的肽序列进行编码的DNA与对目标肽进行编码的DNA的5'末端侧结合来进行。转移至细胞膜的融合肽被信号肽酶切断,目标肽分泌释放至培养基中。或者,也可以回收蓄积于细胞内的目标肽。该情况下,物理或者化学地破坏细胞,使用蛋白质纯化技术来回收目标肽。
<IgG分离用柱或者用于IgG的纯化的试剂盒>
在一个方案中,本发明涉及含有含上述IgG结合肽的固相载体的、IgG、优选为人IgG分离用柱。
上述IgG分离用柱包含用于IgG的纯化或者分离的色谱柱、高效液相色谱(HPLC)柱等柱。柱的尺寸并不特别限制,可以根据分析用、纯化用、分取用等用途、应用(装载)或者注入的量、柱的长度或者内径等使其变化。另外,柱的材质可以为金属、塑料、玻璃等通常用作柱的材质。
上述柱可以通过将上述本发明的固相载体(可以为干燥或者湿润状态中的任一种)紧密地填充至柱中来制造。
另外,在一个方案中,本发明涉及用于含有含上述IgG结合肽的固相载体的、IgG、优选为人IgG的纯化的试剂盒。
本发明的试剂盒可以含有:记载了人IgG的分析步骤、纯化步骤的使用说明书;纯化所需的试剂、缓冲液;固相载体的填充用柱中的至少一种。
<IgG的纯化方法>
在一个方案中,本发明涉及IgG、优选为人IgG的纯化方法,其包括:使IgG与上述固相载体、或者上述IgG分离用柱结合的工序;以及使所结合的IgG洗脱而回收IgG的工序。
结合工序可以通过本领域技术人员公知的方法来进行。例如,将上述固相载体或者IgG分离用柱利用适当的缓冲液进行平衡化,在0℃~室温、优选为0℃~约10℃、进一步优选为约4℃的低温下应用含有IgG的液体,使IgG与固相载体上的肽结合。例如在分离血清中的IgG的情况下,可以使用中性区域的pH、例如pH6.0~7.5的缓冲液,上柱,进行结合工序。
洗脱工序也可以通过本领域技术人员公知的方法来进行。例如,既可以向柱中通入酸性区域的pH、例如pH2~4的缓冲液(例如含有0.3M的NaCl的pH3.5至pH2.5的0.2M甘氨酸-HCl缓冲液或者20mM柠檬酸缓冲液)来进行,也可以使用上述IgG结合肽通过竞争洗脱来使其洗脱。特别是,从成本的观点考虑,优选利用酸进行洗脱。该情况下,可以通过将固相载体或者柱利用氢氧化钠溶液、氢氧化钾溶液以及氢氧化钾溶液等碱性溶液(例如,0.1M氢氧化钠溶液)进行清洗来再生固相载体或者柱,再次用于结合工序。若为本领域技术人员,则可以容易地确定溶液的碱性程度。因此,本发明的方法可以任意地包括通过利用碱性溶液进行清洗来再生固相载体或者柱的工序。
是否回收了IgG例如可以通过利用电泳进行的分子量确认、以及任意地使用之后的抗IgG抗体的蛋白质印迹法来判定。例如,电泳可以通过使用5%~20%丙烯酰胺梯度凝胶的SDS-PAGE来进行,另外,蛋白质印迹法可以将电泳后的蛋白质转印至PVDF膜,用脱脂乳封闭后,用抗IgGα链山羊抗体和HRP标记抗山羊IgG小鼠抗体进行检测。
本发明的方法对在从通过各种方法生产出的含IgG产物中纯化IgG的工序中得到富含IgG的级分的情况是有用的。因此,优选在亲和色谱法、HPLC等柱色谱法中使用本发明的方法。在纯化IgG时,除了这样的色谱法以外,还可以适当组合蛋白质的惯用纯化技术,例如凝胶过滤色谱法、离子交换柱色谱法、反相柱色谱法等色谱法、硫酸铵分级、超滤等。
通过以下的实施例进一步对本发明进行具体说明,但本发明的范围并不受这些实施例限制。
实施例
[实施例1:IgG结合肽的制备以及结合亲和性的测定]
通过Fmoc固相合成法按照常规方法合成出将N末端用生物素化PEG4封闭的以下6个IgG结合肽:
DCAYH(Xaa1)GELVWCT(SEQ ID NO:1,其中,Xaa1为精氨酸,C末端为酰胺化);
GPRCAYH(Xaa1)GELVWCSFH(SEQ ID NO:4,其中,Xaa1为精氨酸,C末端为酰胺化);
GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2,其中,Xaa1为精氨酸,C末端为酰胺化);
GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2,其中,Xaa1为亮氨酸,C末端为酰胺化);
GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2,其中,Xaa1为赖氨酸,C末端为酰胺化);
GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2,其中,Xaa1为乙酰化赖氨酸,C末端为酰胺化)。
去除保护基后,在pH8.5的水溶液中、氧化条件下形成分子内S-S键,使用反相HPLC,通过流速1.0ml/min、含有0.1%的TFA的10%至60%的乙腈的梯度洗脱纯化出具有分子内S-S键的肽。
纯化出的IgG结合肽的亲和性分析通过以下方法来进行。向设置于BIAcoreT200(GE healthcare)的CM5传感器芯片上,等量混合0.4M EDC(1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺)和0.1M sulfo-NHS(sulfo-N-hydroxysuccinimide、磺基-N-羟基琥珀酰亚胺)后,以10μl/ml的流速向传感器芯片注射7分钟,由此将传感器芯片激活,在pH4.0(10mM乙酸Na)的条件下,以固定化量按RU值计为4000~5000的方式,对IgG进行了固定化。使用HBS-EP缓冲液(0.01M HEPES、0.15M NaCl、0.005%Tween 20、3mM EDTA、pH7.0)的同时,以流速50μl/ml注射10nM至2μM浓度的肽180秒钟,由此监测结合反应,之后,通过利用缓冲液清洗600秒钟来测定出解离反应。结合参数的分析使用BIAevalution T100软件来进行。
将亲和性测定的结果示于以下的表1。表1的结果示出了:任意的肽均与IgG具有结合性,能用于抗体的纯化。
[表1]
各种肽的亲和性(全部使用了将肽的N末端用生物素化PEG4封闭的肽)。最下段的K(Acetyl)是指被乙酰化的赖氨酸残基。
[实施例2:由接头交联的IgG结合肽的制备]
NH2-PEG4化合成肽GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2、Xaa1为精氨酸、C末端为酰胺化)在肽合成珠(Rink-amide-Chemmatrix resin、Biotage)上通过Fmoc固相合成法按照常规方法进行了合成。
从树脂中切出肽,进行去保护后,得到了肽。将所得的肽65mg(15.6μmol)溶解于含有6M盐酸胍(Gn·HCl)的磷酸缓冲液(pH=7.3)5mL中,向其中加入溶解于乙腈120μL中的1,3-二氯-2-丙酮(2.9mg、23.4μmol、1.5等量摩尔),在室温下进行搅拌。1小时后,通过HPLC分析确认反应的结束,将反应溶液直接通过HPLC进行纯化,由此得到了环化肽(33mg、7.8μmol、产率50%)。
通过以上的步骤,得到了含有GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2、Xaa1为精氨酸、C末端为酰胺化)所示的氨基酸序列,且外侧的2个半胱氨酸残基中的硫醚基由下式所示的接头连结的N末端PEG4化以及C末端酰胺化肽a,
[化11]
另外,将通过与上述同样的方法制备出的肽(Fmoc-HN-PEG4-GPDCAYH(Xaa1)GELVWCTFH(SEQ ID NO:2、Xaa1为精氨酸、C末端为酰胺化))1.1mg溶解于220μL的DMF(2mM)中,向其中加入溶解于乙腈中的10mM的硫代羰基二咪唑22μL(0.5等量摩尔),在冰上搅拌2.5小时。通过HPLC分析确认反应的结束,将反应溶液直接通过HPLC进行纯化,由此得到了2个半胱氨酸残基中的硫醚基由下式所示的接头连结的环化肽b(0.3mg、产率27%),
[化12]
针对本肽,与实施例1同样地测定了与IgG的亲和性,其结果是,Kd为1μM。
[实施例3:源自人血清的γ-球蛋白的分离]
二氯丙酮交联肽能用作人抗体纯化亲和配体,或者固定化于NHS活化预填充柱(GE Healthcare),实施了各种评价。
肽固定化柱通过以下方法来制作。需要说明的是,溶液的输送使用了注射器。
向1mL容量的NHS活化预填充柱输送1mM盐酸5mL,去除了柱内的异丙醇溶液。接着,输送1.0mg/mL肽溶液(将溶解于DMSO中的100mg/mL的实施例2中制备出的肽a的溶液用偶联溶液(20mM碳酸缓冲液、50mM氯化钠、pH8.3)稀释至100倍)1mL,在室温下固定化1小时。之后,用1M Tris(pH8.0)5mL将未反应的NHS在室温下封闭1小时。最后,输送吸附溶液(20mM磷酸缓冲液、150mM氯化钠、pH7.4)5mL,用于色谱评价。
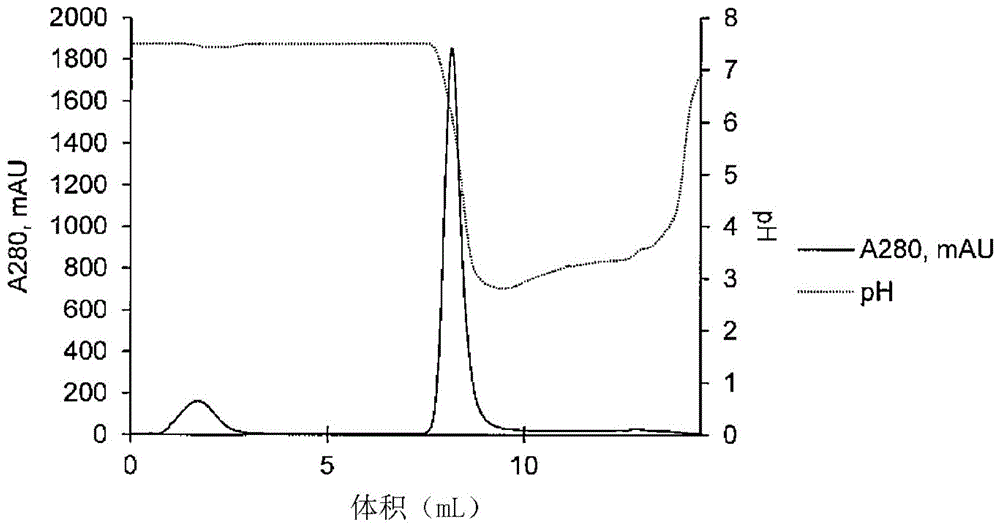
将制作出的肽固定化柱连接于液相色谱装置AKTAexplore(GE Healthcare),利用吸附溶液进行平衡化。接着,以1mL/min的流速输送溶解于吸附溶液中的1mg/mL源自人血清的γ-球蛋白(Wako)1min。进而,利用吸附溶液来清洗柱,输送酸性的洗脱溶液(20mM柠檬酸、pH2.5),由此使吸附成分洗脱。从柱中洗脱蛋白质通过280nm的吸光度进行了检测。将实验结果示于图1。
如图1所示,通过pH的降低确认了吸附于柱的源自人血清的γ-球蛋白的洗脱,因此显然实施例2中制备出的肽能用作亲和柱的配体。
[实施例4:使用肽进行的竞争洗脱]
对通过与实施例3相同的方法制作出的柱,输送1mg的源自人的血清γ-球蛋白,使其吸附。利用吸附溶液来清洗柱后,输送溶解于吸附溶液中的0.4mg/mL的实施例2中制备出的肽a的溶液2.5mL。将进行了0.5mL分级的各级分按照常规方法供于还原条件下的SDS-PAGE。蛋白质的检测通过CBB染色来进行。为了比较,柠檬酸洗脱也进行了同样的操作。
如图2所示,确认了表示轻链(L链)以及重链(H链)的25kDa附近以及50kDa附近的条带(band),因此显然作为洗脱方法能使用肽溶液。
[实施例5:动态结合载量(DBC)测定]
通过与实施例3同样的方法,制作出肽固定化量不同的3种(1mg、4mg、10mg)柱。其中,准备4mg/mL、10mg/mL的肽溶液,用于固定化。
利用吸附溶液对各柱进行平衡化后,以1mL/min、0.4mL/min、0.2mL/min(停留时间1min、2.5min、5min)的流速输送溶解于吸附溶液中的1mg/mL源自人血清的γ-球蛋白(Wako)。DBC根据280nm吸光度下除去了非吸附成分的值达到样品整体的吸光度的10%之前输送的样品量而求得。将1mL/min流速下的色谱图示于图3,将DBC归纳于表2。需要说明的是,为了比较,针对市售Protein A载体MabSelect(GE Healthcare)也进行了相同的测定。
[表2]
如图3以及表2所示,显然:通过增加肽固定化量,DBC变高。10mg肽固定化柱的DBC在停留时间5min的低流速下低于MabSelect,但在停留时间1min的高流速下显著高,给出了适于高流速下的纯化的启示(表2)。
[实施例6:耐碱性的评价]
向通过与实施例3相同的方法制作出的1mg肽固定化1mL柱,输送0.1M氢氧化钠溶液5mL。之后,利用吸附溶液进行清洗,与实施例5同样地进行了流速1mL/min下的DBC测定。接着,通过重复5次氢氧化钠溶液处理/DBC测定来评价了耐碱性。将进行氢氧化钠处理前的DBC设为100%,求出了DBC变动率。
[比较例1]
作为比较例1,制作将由二硫键交联的肽固定化1mg而成的柱,与实施例5同样地实施了耐碱性评价。
将实施例5以及比较例1的结果示于图4,将实测值归纳于表3。
[表3]
如图4以及表3所示,在由二硫键交联的肽中,通过5次氢氧化钠处理,DBC降低至86.4%(比较例1)。另一方面,在二氯丙酮交联肽中,未观察到DBC的降低,显然具有高耐碱性。
工业上的可利用性
本发明的固相载体所含的肽通过利用具有特定结构的接头对半胱氨酸残基中的硫醚基进行交联,稳定性得到改善。因此,本发明的固相载体不易因碱清洗工序等而使IgG结合能力降低,因此,能用于高效的IgG纯化,能用于也用作药品的IgG的高效生产。
本说明书中引用的所有出版物、专利以及专利申请直接通过引用编入本说明书中。
序列表
<110> 国立大学法人鹿儿岛大学
株式会社大赛璐
<120> 含有IgG结合肽的固相载体以及IgG的分离方法
<130> PH-7113-PCT
<150> JP 2016-225483
<151> 2016-11-18
<160> 31
<170> PatentIn version 3.5
<210> 1
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 1
Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr
1 5 10
<210> 2
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 2
Gly Pro Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr Phe
1 5 10 15
His
<210> 3
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 3
Arg Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Ser
1 5 10
<210> 4
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 4
Gly Pro Arg Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Ser Phe
1 5 10 15
His
<210> 5
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 5
Ser Pro Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr Phe
1 5 10 15
His
<210> 6
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 6
Gly Asp Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr Phe
1 5 10 15
His
<210> 7
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 7
Gly Pro Ser Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr Phe
1 5 10 15
His
<210> 8
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 8
Gly Pro Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Ser Phe
1 5 10 15
His
<210> 9
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 9
Gly Pro Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr His
1 5 10 15
His
<210> 10
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 10
Gly Pro Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr Phe
1 5 10 15
Tyr
<210> 11
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 11
Ser Pro Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr Phe
1 5 10 15
Tyr
<210> 12
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 12
Ser Asp Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr Phe
1 5 10 15
Tyr
<210> 13
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 13
Arg Gly Asn Cys Ala Tyr His Xaa Gly Gln Leu Val Trp Cys Thr Tyr
1 5 10 15
His
<210> 14
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa is homoserine
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<220>
<221> misc_feature
<222> (16)..(16)
<223> Xaa is homoserine
<400> 14
Gly Xaa Asp Cys Ala Tyr His Xaa Gly Glu Leu Val Trp Cys Thr Xaa
1 5 10 15
His
<210> 15
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 15
Asp Cys Thr Tyr His Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 16
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 16
Asp Cys Ala Tyr His Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 17
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 17
Asp Cys Thr Tyr His Xaa Gly Glu Leu Val Trp Cys Thr
1 5 10
<210> 18
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 18
Asp Cys Ala Trp His Xaa Gly Glu Leu Val Trp Cys Thr
1 5 10
<210> 19
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 19
Asp Cys Thr Tyr Thr Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 20
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 20
Asp Cys Ala Tyr Thr Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 21
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 21
Asp Cys Ser Tyr Thr Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 22
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 22
Asp Cys Thr Trp Thr Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 23
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 23
Asp Cys Thr Tyr His Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 24
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 24
Asp Cys Thr Tyr Arg Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 25
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 25
Asp Cys Thr Tyr Ser Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 26
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 26
Asp Cys Thr Tyr Thr Xaa Gly Asn Leu Val Trp Cys Thr
1 5 10
<210> 27
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 27
Asp Cys Thr Tyr Thr Xaa Gly Glu Leu Val Trp Cys Thr
1 5 10
<210> 28
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 28
Asp Cys Thr Tyr Thr Xaa Gly Arg Leu Val Trp Cys Thr
1 5 10
<210> 29
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 29
Asp Cys Thr Tyr Thr Xaa Gly Asp Leu Val Trp Cys Thr
1 5 10
<210> 30
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is arginine, lysine, leucine, asparagine, or derivative
thereof
<400> 30
Asp Cys Thr Tyr Thr Xaa Gly Asn Leu Ile Trp Cys Thr
1 5 10
<210> 31
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Synthetic construct
<400> 31
Gly Pro Asp Cys Ala Tyr His Arg Gly Glu Leu Val Trp Cys Thr Phe
1 5 10 15
His
- 还没有人留言评论。精彩留言会获得点赞!