针对FGFR1的单克隆抗体的制作方法
本发明涉及特异性针对fgfr1的抗体。更具体地,本发明涉及单克隆抗体,且更优选地是全人单克隆抗体,其以高亲和力结合并中和fgfr1。本发明还涉及编码所述抗体的核酸、用于表达这些核酸的载体,以及用于生产所述抗体的宿主细胞。此外,本发明涉及所述抗体在癌症的诊断和/或治疗中的用途。
发明背景
成纤维细胞生长因子(fgf)(beenken等)是一肝素结合蛋白家族(目前有23个成员),其调节各种细胞的功能。它们参与许多生理过程,例如在发育和血管生成过程中的形态发生,对包括肿瘤和内皮细胞在内的各种类型细胞的增殖,迁移和分化有影响(fernig和gallagher,1994,eswarakumar等,2005)。它们在许多病理过程中发挥着重要作用。
有四种主要类型的成纤维细胞生长因子受体(fgfr),其具有共同的结构特征:fgfr1,fgfr2,fgfr3和fgfr4。它们都具有细胞外配体结合结构域,其含有3个ig样结构域(d1至d3;它们因此属于免疫球蛋白超家族)和独特的跨膜和细胞质区域。它们还在ig结构域d1和d2之间具有所谓的“酸盒(acidbox)”,其显然用作fgf结合的调节剂。每个受体都可以被几个fgf结合(ornitz等,1996)。
fgfr1参与了癌症和关节炎等疾病。fgfr1基因扩增与多种癌症有关,如非小细胞肺癌,乳腺癌,胃癌和食道癌,胶质母细胞瘤,头颈部肿瘤或骨肉瘤(katoh和nakagama,2014,touat等,2015)。fgfr1有几种可供选择的剪接形式,最常见的是:1)结构域d3不同的两种:它们被命名为fgfr1-iiib和fgfr1-iiic(johnson和williams,1993)和2)d1结构域的存在或不存在上不同的两种:它们被命名为fgfr1a和fgfr1b。前一取代构成被认为是受体结合结构域的一部分,因此最有可能使两种剪接形式具有不同的配体特异性,从而对fgf/fgfr途径具有不同的作用。这两种形式也被证明是差异表达的,这可能是由fgfr1介导的复杂功能的精妙控制机制的一部分。
根据这些发现,fgfr1已成为癌症治疗或肥胖或糖尿病等其他疾病的有吸引力的靶点(jiao等,2011,wu等,2011)。在过去几年中,已经发表了几篇描述靶向fgfr的特异性抗体及其治疗用途的文献。其中,wo2005037235公开了对fgfr1-iiib,fgfr1-iiic和/或fgfr4有特异性的抗体。这些抗体被描述为拮抗和中和fgfr1和/或fgfr4iiic,作为例如肥胖症或糖尿病的治疗。另一个实例是wo2012108782,其涉及特异性靶向fgfr1的结构域d2和d3的单克隆抗体,以及它们用于抑制肿瘤生长的用途。
取决于预期的效果,具有激动剂作用的抗体可能是令人感兴趣的。例如,其中一些已在wo2012158704中公开。或者,靶向fgfr1的两个不同结构域的抗体可能是有趣的,例如wo2011000384中公开的抗体。
使用通过仅与受体的特定结构域(例如d2和d3-iiib和-iiic)结合来中和受体的拮抗剂来阻断fgf/fgfr1途径应该导致肿瘤生长的抑制或减慢。然而,尽管已经报道了针对fgfr1等的不同抗体,但尚未有针对fgfr1的有效抗癌药物进入市场。
考虑到癌症对公共健康的主要影响,仍然需要可用作药物的其他fgfr1拮抗剂,例如抗体。本发明提供了fgf/fgfr1途径的这类拮抗剂,其能够治疗与过度增殖和新血管形成有关的疾病。特别地,需要可用作药物的新型分子,特别是用于治疗癌症,例如非小细胞肺癌(nsclc)和小细胞肺癌(sclc),头颈部鳞状细胞癌(hnscc),恶性胸膜间皮瘤,骨肉瘤,软组织肉瘤,胶质母细胞瘤,转移性肾细胞癌(mrcc),乳腺癌或肝癌。
技术实现要素:
本发明提供了特异性结合fgfr1的新型单克隆抗体,特别是完全人抗体或其活性片段。这些fgfr1抗体不仅能够结合而且能够中和(或拮抗)fgfr1。因此它们尤其能够与fgfr1+细胞结合,例如nci-h520(atcc编号htb-182),nci-h1581(atcc编号crl-5878),dms114(atcc编号crl-2066)或dms53(atcc编号crl-2062)。
在第一个实施方式中,本发明描述了通过其互补决定区(cdr)序列与fgfr1结合的抗体或其部分。包含所述cdr的抗体保留了这些cdr来源的母体分子的fgfr1结合特异性。
在另一个实施方式中,描述了所述抗体的构架区(fr)。所述fr将与本发明所述cdr组合。
在另一个实施方式中,还公开了感兴趣的抗体的重链和轻链可变区的氨基酸序列,以及可与其组合的优选的恒定区的氨基酸序列。
本发明的又一个实施方式由编码本发明抗体的多核苷酸序列,包含所述多核苷酸序列的载体和细胞系组成。
还描述了用于制备根据本发明的抗体的方法。
本发明的另一个实施方式是一种药物组合物,其包含一种或至少一种感兴趣的抗体。
在另一个实施方式中,根据本发明的单克隆抗体用作fgfr1拮抗剂或简单地用作fgfr1结合剂,例如用作抗体药物偶联物。特别地,它们可用于治疗与fgfr1或fgfr1途径相关的病症,尤其是与fgfr1过表达相关的病症。因此,根据本发明的单克隆抗体可用于治疗自身免疫疾病或炎性疾病。具体而言,这类疾病或病症选自多发性硬化、类风湿性关节炎或舍格伦综合征。它们还可用于治疗伴有已知fgfr1扩增的癌症,例如nsclc,sclc,hnscc,恶性胸膜间皮瘤,骨肉瘤,软组织肉瘤,胶质母细胞瘤,mrcc,乳腺癌或肝癌。
在最后一个实施方式中,本发明描述了与fgfr1细胞外结构域上存在的表位结合的抗体或其部分。特别地,它们结合fgfr1的片段,包括仅来自结构域d2的氨基酸残基(例如形成mab#a08的表位的氨基酸残基)或来自结构域d3的氨基酸残基(例如形成mab#a05的表位的氨基酸残基)。
定义
-术语“免疫球蛋白”(ig)指由一种或多种多肽组成的蛋白,所述一种或多种多肽基本由免疫球蛋白基因编码。一种形式的免疫球蛋白构成抗体的基本结构单元。该形式是四聚体且由两个相同的免疫球蛋白链的对组成,各对具有一条轻链和一条重链。轻链具有两部分:可变结构域(vl)和恒定结构域(cl),其在轻链的上下文中也称为恒定区。重链也具有两部分:可变结构域(vh)和恒定区(ch)。在各对中,轻链和重链可变结构域共同主要负责结合抗原,且恒定区负责抗体效应功能。全长免疫球蛋白“轻链”(通常约25kda)由n末端处的可变结构域基因(通常约110个氨基酸)和c末端处的κ或λ恒定区结构域(分别为ck和cλ)编码。全长免疫球蛋白“重链”(通常约50kda)类似地由可变结构域基因(通常约116个氨基酸)和后文所述其他恒定区基因之一(通常约330个氨基酸)编码。存在五种类型的哺乳动物重链,其由希腊字母命名:[α]、[δ]、[ε]、[γ]和[μ]。重链类型分别将抗体的同种型限定为iga、igd、ige、igg和igm。恒定区在相同同种型的所有抗体中都相同,但在不同同种型的抗体中不同。重链[γ]、[α]和[δ]的恒定区由三个ig恒定结构域(ch1、ch2和ch3)和一个铰链区(用于增加挠性)组成;重链[ε]和[μ]的恒定区由四个ig恒定结构域(ch1、ch2、ch3和ch4)和一个铰链区组成。
免疫球蛋白轻链或重链可变结构域由“构架”区组成,其被三个高变区打断。因此,术语“高变区”指负责抗原结合的抗体的氨基酸残基。高变区包含来自“互补决定区”或“cdr”的氨基酸残基,即轻链可变结构域中的l-cdr1、l-cdr2和l-cdr3和重链可变结构域中的h-cdr1、h-cdr2和h-cdr3(kabat等1991)和/或来自“高变环”的那些残基(chothia和lesk,1987)。“构架区”或“fr”残基是除了本文所限定的超变区残基之外的那些可变区残基。不同轻链的构架区(即l-fr1、l-fr2、l-fr3和l-fr4)或不同重链的构架区(即h-fr1、h-fr2、h-fr3和h-fr4)的序列在物种内是相对保守的。因此,“人构架区”是与天然产生的人免疫球蛋白的构架区基本相同(约85%或更高,通常约90-95%或更高)的构架区。抗体的构架区即组成轻链和重链的组合的构架区,其用作定位和对齐cdr。cdr主要负责与抗原表位的结合。
-本文所用术语“抗体”及其复数形式包括但不限于多克隆抗体、亲和纯化的多克隆抗体、单克隆抗体和抗原结合片段,如f(ab′)2、fab蛋白酶水解片段以及单链可变区片段(scfv)。它指的是单臂(单价)或双臂(二价)抗体。该术语还包括seed体(davis等,2010或us8,871,912)。还包括遗传工程改造的完整抗体或片段,例如嵌合抗体、scfv和fab片段,以及合成的抗原结合肽和多肽。
-术语“人源化”免疫球蛋白指包含人构架区和一个或多个来自非人(通常是小鼠或大鼠)免疫球蛋白的cdr的免疫球蛋白。提供cdr的非人免疫球蛋白称为“供体”且提供框架的人免疫球蛋白称为“受体”(通过将非人cdr移植到人框架和恒定区上,或通过将整个非人可变结构域整合在人恒定区上(嵌合化)来进行人源化)。恒定区无需存在,但如果存在,其必须与人免疫球蛋白恒定区基本相同,即至少约85-90%、优选至少约95%或更高的相同程度。因此,人源化免疫球蛋白的所有部分与天然人免疫球蛋白序列的相应部分基本相同,可能为根据需要调整效应子功能而改变的若干重链恒定区残基和cdr除外。“人源化抗体”是包含人源化轻链可变结构域和人源化重链可变结构域的抗体。在一些情况下,人源化抗体可保留人构架区内的非人残基以增强适当的结合特征和/或可将一些氨基酸突变导入cdr内以改进结合亲和力和/或降低免疫原性和/或提高人的程度和/或改进抗体的生物化学/生物物理学性质。通过将抗体人源化可提高生物半衰期,并降低了给予人后不良免疫反应的可能性。
-术语“全人”免疫球蛋白指包含人构架区和人cdr的免疫球蛋白。恒定区无需存在,但如果存在,其必须与人免疫球蛋白恒定区基本相同,即至少约85-90%、优选至少约95%或更高的相同程度。因此,除可能为根据需要调整效应子功能或药代动力学特性而改变的若干重链恒定区残基外,全人免疫球蛋白的所有部分与天然人免疫球蛋白序列的相应部分基本相同。“全人抗体”或“全人单克隆抗体”是包含全人轻链可变结构域和全人重链可变结构域的抗体。在一些情况下,可在cdr、框架区或恒定区内引入氨基酸突变以改进抗体的结合亲和力和/或降低抗体的免疫原性和/或改进抗体的生物化学/生物物理学特性。
-术语“重组抗体”指其中氨基酸序列不同于天然抗体的抗体。由于抗体生成中重组dna技术的相关性,无需限制于天然抗体中发现的氨基酸的序列;可以重新设计抗体以获得所需的特性。可能的变化形式有很多,包括仅改变(例如可变结构域或恒定区的)一个或数个氨基酸到完全重新设计(例如可变结构域或恒定区)。通常,进行恒定区的变化是为改进、降低或改变一些特性,这些特性诸如补体固定(例如补体依赖的细胞毒性,cdc)、与fc受体的相互作用,以及其他效应子功能(例如抗体依赖的细胞毒性,adcc)、药代动力学特性(例如与新生儿fc受体(fcrn)结合)。进行可变结构域的变化是为改进抗原结合特性。除抗体外,免疫球蛋白还可以多种其他形式存在,包括例如单链或fv、fab和(fab′)2以及双抗体、线性抗体、多价或多特异性杂交抗体。
-本文所用术语“抗体部分”指完整或全长链或抗体的片段,通常是结合或可变区。所述部分或片段应保留完整链/抗体的至少一种活性,即其是“功能性部分”或“功能性片段”。如果其保留至少一种活性,则优选保留靶标结合特性。抗体部分(或抗体片段)的示例包括但不限于单链“fv”、“单链抗体”、“fv”或“scfv”。这些术语指在单个多肽链内包含来自重链和轻链的可变结构域但缺少恒定区的抗体片段。通常,单链抗体还包含vh和vl结构域之间的多肽接头,其能够令单链抗体形成抗原结合所需的结构。在具体的实施方式中,单链抗体还可以是双特异性和/或人源化的。
-“fab片段”由一条轻链和一条重链的可变结构域和ch1结构域组成。fab分子的重链无法与另一重链分子形成二硫键。含有一条轻链和一条重链且含有更多恒定区(ch1和ch2结构域之间部分)从而在两条重链之间形成链间二硫键的“fab’片段”称作f(ab′)2分子。“f(ab′)2”含有两条轻链和两条重链,其含有恒定区中ch1和ch2结构域之间的部分,使得两条重链之间形成链间二硫键。在定义了若干重要术语后,现在可以着重讨论本发明的具体实施方式了。
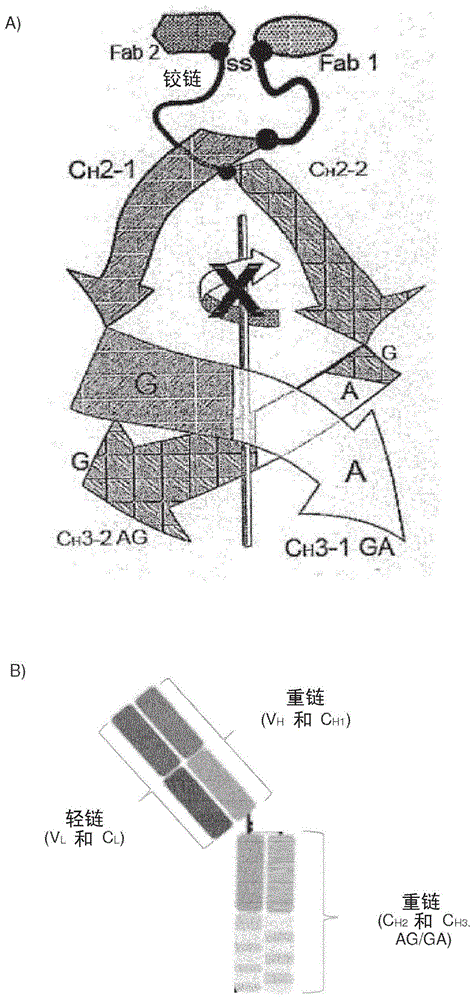
-术语seed体(seed表示链交换工程改造的结构域;复数形式:seed体),是指包含人igg和igach3结构域衍生物的特定类型的抗体,产生由人igg和igach3序列的交替区段组成的互补人seedch3异二聚体(图1)。它们是不对称的融合蛋白。davis等,2010或us8,871,912描述了seed体和seed技术,其全部内容纳入本文。
-在本发明的上下文中,术语“治疗”指对于疾病进展的任何有利影响,包括在疾病开始后减弱、减少和降低或缓解疾病发展。
-术语“药学上可接受的”旨在涵盖任何运载体,其不干扰活性成分的生物学活性的有效性并且对给予的宿主无毒。例如,对于胃肠道外给药,活性蛋白质可配制为用于在载剂中注射的单位剂型,载剂例如但不限于盐水、右旋糖溶液、血清白蛋白和林格氏溶液。
-人免疫系统已进化为对抗各种病毒、微生物和其他威胁。体液组分-抗体应答-是免疫系统武器库的关键组分。抗体可包被、阻断和加工外来侵入物,且重要的是招募免疫效应细胞以使用多种防御措施来应对侵入物。人免疫系统中存在多种抗体类型和同种型,各自被赋予多种效应功能,其可调节为针对侵入病原体的性质。重组治疗性抗体构建自人序列且几乎总是衍生自igg类。迄今为止,大多数治疗性抗体衍生自igg1同种型,其次是igg2和igg4。igg1同种型具有广泛应用性的原因是其啮合免疫效应细胞和补体的嵌入能力(built-inability)。抗体或效应细胞介导的效应功能主要包括细胞裂解(adcc=抗体依赖性细胞介导的细胞毒性)、吞噬作用(adcp=抗体依赖性细胞介导的吞噬作用)和补体依赖性细胞毒性(cdc)。我们对于这些效应功能的认识大部分来自对抗体介导的杀伤的体外分析。例如,人pbmc(外周血单核细胞)与靶细胞(通常是肿瘤细胞系)和靶特异性抗体的孵育导致靶细胞在数小时内裂解。大多数(如果不是全部)adcc由自然杀伤(nk)细胞进行。已经确定经典的igg效应功能是通过适当命名的fcγ受体介导的(nimmerjahn和ravetch,2011)。在人类中,fcγr包括三种活化受体fcγri,fcγriia和fcγriiia,并且这些受体在白细胞上以不同的水平和专有性表达。通过itam胞内结构域的所有信号导致信号级联放大,导致各表达fcγr的细胞的同源效应功能。nk细胞几乎专有性地表达fcγriiia,且该受体确定负责介导体外adcc。由抗体fc与补体蛋白c1q的结合触发的经典(抗体依赖性)补体途径包括非细胞和细胞机制,以及补体和fcγr途径之间的协同作用。
除非另有说明,否则本文所用的术语“成纤维细胞生长因子受体1或fgfr1”是指来自任何哺乳动物来源,例如人,小鼠或大鼠来源的任何野生型fgfr1。该术语包括“全长”fgfr1以及任何加工形式的fgfr1(例如成熟形式)或细胞外结构域(其包括本发明抗体的表位)。该术语还包括天然存在的fgfr1变体,例如剪切变体或等位基因变体。fgfr1细胞外结构域的氨基酸序列的实例例如公开为seqidno:80至seqidno:85。术语“表位”是指抗体结合的抗原部分。在本发明的框架中,抗原是fgfr1。表位可以是给定氨基酸序列内的线性表位(即由给定氨基酸序列内的连续残基组成),或构象表位(即由非连续残基组成,但形成特定的3d结构)。
具体实施方式
本发明基于新单克隆抗体或其部分的发现,更具体地是特异性针对fgfr1的全人单克隆抗体。特别地,它们对于人,猕猴和小鼠形式的fgfr1有特异性(即它们是交叉反应的)。全部拮抗fgfr1的这些抗体或其部分可用于治疗癌症,例如nsclc(鳞状细胞癌,腺癌或大细胞癌),sclc,hnscc,恶性胸膜间皮瘤,骨肉瘤,软组织肉瘤,胶质母细胞瘤,mrcc,乳腺癌或肝癌。
本发明提供结合并中和(或拮抗)fgfr1,优选人,猕猴和小鼠形式的fgfr1的新的单克隆抗体或其部分。特别地,本发明提供了新的轻链和重链可变结构域,其结合,调节和中和(或拮抗)fgfr1,优选人,猕猴和小鼠形式的fgfr1。优选地,根据本发明的单克隆抗体或其部分仅结合fgfr1b的同种型iiib和iiic,允许更好地治疗患者。甚至优选地,根据本发明的单克隆抗体或其部分仅结合到fgfr1a和fgfr1b的同种型iiib和iiic的结构域d3或仅结构域d2。
已经显示(参见实施例部分),根据本发明的单克隆抗体或其部分能够抑制细胞fgfr1的活性。它们具有很强的抗肿瘤活性。它们还能够增加无进展存活率(pfs)以及增强针对fgfr1+细胞系的adcc。有趣的是,根据本发明的单克隆抗体或其片段不影响激素fgf23水平,导致改善的安全性。
根据本发明的抗体的轻链和重链可变结构域或其片段可以分别融合至选自任何同种型(iga,igd,ige,igg和igm)的重链恒定区和轻链的κ或λ恒定结构域,并在多种宿主细胞中表达。优选地,选择的恒定区是igg的恒定区,且更优选地是lgg1、igg2或igg4的恒定区,且更优选地是lgg1的恒定区。或者,根据本发明的抗体是seed抗体(或seed体)(例如参见图1)。本发明所述抗体或其部分可以是糖基化/去糖基化和/或岩藻糖基化/去岩藻糖基化的。
根据第一个实施方式,结合fgfr1的本发明单克隆抗体中的任一种或其部分包含重链可变结构域,其包含h-cdr1,h-cdr2和h-cdr3,以及轻链可变结构域,其包含l-cdr1,l-cdr2和l-cdr3,其中,1)h-cdr1包含选自seqidno:3,seqidno:6,seqidno:7和seqidno:60的氨基酸序列或由其组成;h-cdr2包含选自seqidno:4,seqidno:8和seqidno:61的氨基酸序列或由其组成;并且h-cdr3包含选自seqidno:5,seqidno:9至seqidno:17,seqidno:62和seqidno:90的氨基酸序列或由其组成,和2)l-cdr1包含选自seqidno:18,seqidno:21和seqidno:63的氨基酸序列或由其组成;l-cdr2包含选自seqidno:19和seqidno:64的氨基酸序列或由其组成,并且l-cdr3包含选自seqidno:20,seqidno:22,seqidno:23,seqidno:65和seqidno:66的氨基酸序列或由其组成。甚至更优选地,根据本发明的单克隆抗体具有的一组h-cdr1,h-cdr2和h-cdr3分别包含以下或由其组成:1)氨基酸序列seqidno:3,seqidno:4和seqidno:5,2)氨基酸序列seqidno:60,seqidno:61和seqidno:62,或3)氨基酸序列seqidno:3,seqidno:4和seqidno:90。类似地,单克隆抗体优选具有的一组l-cdr1,l-cdr2和l-cdr3分别包含以下或由其组成:1)氨基酸序列seqidno:18,seqidno:19和seqidno:20,2)氨基酸序列seqidno:63,seqidno:64和seqidno:66。
在另一个实施方式中,本发明提供如本文所述的单克隆抗体或其部分,其中1)单克隆抗体的重链可变结构域包含框架区(fr)h-fr1,h-fr2,h-fr3和h-fr4,其中:h-fr1包含选自seqidno:30和seqidno:67的氨基酸序列或由其组成;h-fr2包含选自seqidno:31和seqidno:68的氨基酸序列或由其组成;h-fr3包含选自seqidno:32和seqidno:69的氨基酸序列或由其组成,并且h-fr4包含选自seqidno:33和seqidno:70的氨基酸序列或由其组成;并且2)轻链可变域包含l-fr1,l-fr2,l-fr3和l-fr4,其中:l-fr1包含选自seqidno:34和seqidno:71的氨基酸序列或由其组成;l-fr2包含选自seqidno:35和seqidno:72的氨基酸序列或由其组成;l-fr3包含选自seqidno:36和seqidno:73的氨基酸序列或由其组成;l-fr4包含选自seqidno:37和seqidno:74的氨基酸序列或由其组成。优选地,本发明所述h-fr和l-fr与上文所述h-cdr和l-cdr相关。优选地,根据本发明的单克隆抗体具有的一组h-fr1,h-fr2,h-fr3和h-fr4分别包含以下或由其组成:1)氨基酸序列seqidno:30,seqidno:31,seqidno:32和seqidno:33,或2)氨基酸序列seqidno:67,seqidno:68,seqidno:69和seqidno:70。类似地,单克隆抗体优选具有的一组l-fr1,l-fr2,l-fr3和l-fr4分别包含以下或由其组成:1)氨基酸序列seqidno:34,seqidno:35,seqidno:36和seqidno:37,或2)氨基酸序列seqidno:71,seqidno:72,seqidno:73和seqidno:74。
在另一个实施方式中,本发明提供了一种单克隆抗体或其部分,优选全人单克隆抗体或其部分,其中重链可变结构域包含选自seqidno:1、seqidno:24、seqidno:26、seqidno:27和seqidno:91-98的氨基酸序列或由其组成;并且轻链可变结构域包含选自seqidno:2、seqidno:25、seqidno:28和seqidno:29的氨基酸序列或由其组成。在优选的实施方式中,本发明提供了一种单克隆抗体,其中,该重链可变结构域包含选自seqidno:1和seqidno:24的氨基酸序列或由其组成;且该轻链可变结构域包含选自seqidno:2和seqidno:25的氨基酸序列或由其组成。优选地,可变重链和可变轻链的组合选自下组:1)seqidno:24和seqidno:25(mab#a08前导(lead)),2)seqidno:27和seqidno:29(mab#a05前导)。在另一个实施方式中,组合可变重链和可变轻链也可以选自下组:1)seqidno:1和seqidno:2(mab#a08命中(hit)),2)seqidno:26和seqidno:28(mab#a05命中),3)seqidno:93和seqidno:25(mab#a02),或4)seqidno:97和seqidno:25(mab#c01)。使用#a08命中和#a08前导获得最佳结果,其中#a08前导与#a08命中相比在其重链中具有突变n92s(imgt编号方案;参见lefranc,1997),并且与#a08命中相比在其轻链中具有突变q1s以及a2y。
还提供与本文公开的重链可变区序列具有至少95%或更多,96%或更多,97%或更多,98%或更多,或至少99%或更多序列相同性的其他重链可变区氨基酸序列。还提供与本文公开的轻链可变区序列具有至少95%或更多,96%或更多,97%或更多,98%或更多,或至少99%或更多序列相同性的其他轻链可变区氨基酸序列。
本发明所述工程改造的单克隆抗体(优选全人抗体)可包含任何类型的重链恒定区或其部分,其来自任何类的抗体(包括igm、igg、igd、iga和ige)和任何亚类(同种型)(特别包括igg1、igg2、igg3和igg4)。在需要抗体表现出细胞毒性活性时,重链恒定结构域通常是补体固定恒定结构域且类型通常是igg1类。不需要这种细胞毒活性时,恒定区可以是igg2或igg4类。工程改造的抗体可包含来自一种以上类别或同种型的序列。在本发明中,可以使用igg的igg1、igg2或igg4类。例如,可以使用以下重链恒定区的氨基酸序列:1)如seqidno:38中公开的同种异型g1m(3)的igg1,或2)具有seqidno:39所示序列的igg2同种型。应理解,上述恒定区序列可完整使用或仅使用其部分,例如其ch1、ch2和/或ch3部分。含有可变结构域和恒定结构域的重链的非限制性示例是seqidno:45所示的氨基酸序列。当根据本发明的抗体包含igg恒定结构域时,它们通常为二价形式(即它们通常会二聚化)。或者,可以使用seed体的恒定区,例如1)如seqidno:40或seqidno:43中所公开的seed(ag)或2)具有seqidno:41或seqidno:42中公开的序列的seed(ga)。当根据本发明的抗体包含seed链时,它们通常为单价形式(即它们通常不形成包含两个完整重链ga/ga或ag/ag的同型二聚体)。优选的恒定链是至少一个seed链。包含可变结构域和恒定seed结构域的重链的非限制性实例是seqidno:46,seqidno:47,seqidno:48,seqidno:49和seqidno:99-106所示的氨基酸序列。
根据本发明的工程改造的单克隆抗体还可包含任何类型的轻链免疫球蛋白恒定结构域,即κ或λ结构域。优选地,可以使用以下用于轻链恒定结构域的氨基酸序列:λ恒定基因,例如seqidno:44中描述的基因。包含可变结构域和恒定结构域的轻链的非限制性实例是seqidno:50和seqidno:51所示的氨基酸序列。
当本发明的抗体是单价seed体时,它由包含可变结构域和恒定结构域(例如seqidno:50和seqidno:51所公开的那些)的一条完整轻链,包含可变结构域和恒定结构域(例如seqidno:46,seqidno:47,seqidno:48,seqidno:49和seqidno:99-106中公开的那些)的一条完整的重链以及仅包含seed体的恒定结构域ch2和ch3(例如seqidno:41和seqidno:43所公开的那些)的一条部分重链组成。部分重链与完整重链上的对应物不对称。如果完整重链是“ag链”,则部分重链将是“ga链”,并且如果完整重链是“ga链”,则部分重链将是“ag链”。因此,例如,如果完整重链具有seqidno:46的氨基酸序列,则部分重链将具有seqidno:41的氨基酸序列。或者,如果完整重链具有seqidno:47的氨基酸序列,则部分重链将具有seqidno:43的氨基酸序列。根据本发明的seed体的非限制性实例是例如(作为单价seed体):1)包含轻链,完整重链和部分重链的seed体,所述轻链包含seqidno:50的氨基酸序列或由其组成,所述完整重链包含seqidno:46的氨基酸序列或由其组成,并且所述部分重链包含seqidno:41的氨基酸序列或由其组成,2)包含轻链,完整重链和部分重链的seed体,所述轻链包含seqidno:50的氨基酸序列或由其组成,所述完整重链包含seqidno:47的氨基酸序列或由其组成,并且所述部分重链包含seqidno:43的氨基酸序列或由其组成,3)包含轻链,完整重链和部分重链的seed体,所述轻链包含seqidno:51的氨基酸序列或由其组成,所述完整重链包含seqidno:48的氨基酸序列或由其组成,并且所述部分重链包含seqidno:41的氨基酸序列或由其组成,4)包含轻链,完整重链和部分重链的seed体,所述轻链包含seqidno:51的氨基酸序列或由其组成,所述完整重链包含seqidno:49的氨基酸序列或由其组成,并且所述部分重链包含seqidno:43的氨基酸序列或由其组成,或5)包含轻链,完整重链和部分重链的seed体,所述轻链包含seqidno:50的氨基酸序列或由其组成,所述完整重链包含seqidno:99-106的氨基酸序列或由其组成,并且所述部分重链包含seqidno:41的氨基酸序列或由其组成。单价seed体形式是优选的形式,因为它允许根据本发明的抗体对癌细胞具有良好的抑制作用,而不会以体重减轻作为副作用。
应理解,本发明还包括二价抗fgfr1seed体形式。二价抗fgfr1seed体由2条轻链,1条完整“ag”重链和1条完整“ga”重链组成。因此,例如,本发明包括seed体,其包含1)包含seqidno:50的氨基酸序列或由其组成的轻链,包含seqidno:46的氨基酸序列或由其组成的完整重链,和包含seqidno:47的氨基酸序列或由其组成的完整重链,或2)包含seqidno:51的氨基酸序列或由其组成的轻链,包含seqidno:48的氨基酸序列或由其组成的完整重链,和包含seqidno:49的氨基酸序列或由其组成的完整重链。
在本发明的另一方面,抗体或其部分与存在于fgfr1细胞外结构域上的表位结合。特别地,它们结合fgfr1的片段,包括仅来自结构域d2的氨基酸残基。优选地,根据本发明的抗体或其部分与#a08抗体之一结合相同的表位。更优选地,它们结合位于包括seqidno:81的氨基酸序列残基52-63和79-95的2个肽处或附近的构象表位。构象表位例如由残基ala58、ala59、lys60、thr61、lys63、lys95、arg97、ile104和asp106形成。因此,本发明还涵盖与mab#a08结合相同表位并拮抗fgfr1的单克隆抗体或其部分。优选地,所述单克隆抗体或其部分结合位于包括seqidno:81的氨基酸序列残基52-63和79-95的2个肽处或附近的构象表位。构象表位例如由残基ala58、ala59、lys60、thr61、lys63、lys95、arg97、ile104和asp106形成。
或者,抗体或其部分与存在于fgfr1细胞外结构域上的表位结合,包括仅来自结构域d3的氨基酸残基。优选地,根据本发明的抗体或其部分与mab#a05结合相同的表位。
本发明的其他实施方式是一种分离的核酸分子或多核苷酸,其编码本发明所述任意抗体或其部分,或其互补链或简并序列。在这一方面,术语“核酸分子”或可互换的“多核苷酸”涵盖所有不同类型的核酸,包括但不限于脱氧核糖核酸(例如dna、cdna、gdna、合成的dna等)、核糖核酸(如rna)和肽核酸(pna)。在优选的实施方式中,该核酸分子是dna分子,例如双链dna分子或cdna分子。术语“分离的”指核酸分子已经鉴定并与至少一种污染核酸分子分离,所述污染核酸分子通常在天然来源中与所述核酸分子结合。分离的核酸分子不同于其在天然中发现的形式或状态。因此,分离的核酸分子与天然细胞中存在的特定核酸分子不同。简并序列指编码与参考核苷酸序列相同的氨基酸序列的任意核苷酸序列,但其因为遗传密码简并性而包含不同的核苷酸序列。
在另一个实施方式中,核酸分子,也称为多核苷酸,编码本发明的任一种单克隆抗体的重链(包括在单价seed体的情况下编码部分和完整重链中的每一个的核酸分子),或其部分,例如重链可变结构域,并且另一多核苷酸编码本发明的任一种抗体的轻链或其部分,例如轻链可变结构域。在一个替代实施方式中,独特的多核苷酸编码重链(在单价seed体的情况下包括部分和完整重链)和本发明的任一种抗体的轻链或其部分,例如可变结构域或fab区。
在一个优选的实施方式中,编码本发明所述抗体的重链可变结构域的多核苷酸包含seqidno:52、seqidno:54、seqidno:56或seqidno:57或由其组成。在一个优选的实施方式中,编码本发明所述抗体的轻链可变结构域的多核苷酸包含seqidno:53、seqidno:55、seqidno:58或seqidno:59或由其组成。在另一个实施方式中,独特的多核苷酸编码本发明的任一种抗体的重链和轻链可变结构域,其中编码重链可变结构域的多核苷酸包含seqidno:52,seqidno:54,seqidno:56或seqidno:57或由其组成,并且编码轻链可变结构域的多核苷酸包含seqidno:53,seqidno:55,seqidno:58或seqidno:59或由其组成。编码重链和轻链的多核苷酸序列的前方通常有前导序列。
由于遗传密码子的简并性,应理解可优化编码本发明所述抗体的多核苷酸。因此,还提供了与编码本发明所述重链可变区序列(例如上文列举的优选的多核苷酸序列)至少90%或以上相同、至少95%或以上相同或至少99%或以上相同的多核苷酸序列。类似地,还提供了与编码本发明所述轻链可变区序列(例如上文列举的优选的多核苷酸序列)至少90%或以上相同、至少95%或以上相同或至少99%或以上相同的多核苷酸序列。
本发明的另一个实施方式是一种包含dna的载体,该dna编码本发明所述单克隆抗体或其部分,例如可变结构域(重链和/或轻链可变结构域)或fab区。该载体可以是任意克隆或表达载体,整合或自动复制,在任何原核或真核细胞中起作用。具体而言,该载体可以是质粒、粘粒、病毒、噬菌体、原生质体、人工染色体等。该载体可包含重链和轻链的整个或部分编码序列,或轻链和重链编码序列中的任一种,或其任何部分。如果该载体包含重链和轻链的编码序列或其部分,这些编码序列可以各自可操作地连接启动子。对于重链和轻链编码序列或其部分,该启动子可以是相同的或不同的。重链和轻链编码序列或其部分还可可操作地连接单个启动子,此时重链和轻链的编码序列或其部分可优选由内部核糖体进入位点(ires)隔开。用于真核基因表达的合适启动子是,例如,衍生自病毒基因,例如鼠或人巨细胞病毒(cmv)的启动子,小鼠双向cmv启动子,劳氏肉瘤病毒(rsv)启动子或人延伸因子-1α(ef-1α)启动子,这些是本领域技术人员熟知的。该载体可包含调控元件,例如启动子、终止子、增强子、选择标志物、复制起点、绝缘子等。可以通过各种方法将合适的核酸序列插入载体中。通常,使用本领域已知的方法将dna插入适当限制性内切酶位点。含有一种或多种这些组分的合适载体的构建采用本领域技术人员已知的标准连接技术。
本发明的另一个实施方式是一种重组宿主细胞,所述细胞包含一种或多种上文所述核酸分子/多核苷酸或一种或多种上文所述载体。宿主细胞可以是原核或真核细胞。原核细胞的示例包括细菌,例如大肠杆菌。真核细胞的示例是酵母细胞、植物细胞、哺乳动物细胞和昆虫细胞,包括任何原代细胞培养物或建立的细胞系(例如3t3、vero、hek293、tn5等)。用于表达糖基化蛋白质的合适宿主细胞衍生自多细胞生物。优选的有用哺乳动物宿主细胞系的实例包括cho(例如cho-s,expicho,cho-k1或cho-lf),hek293(例如293,293-6e或expi293),ns0,sp2/0和cos细胞。本发明的抗体可通过本领域已知的任何技术生产,例如通过重组技术、化学合成、克隆、连接或其组合。如果需要获得具有较低糖基化水平的抗体、去糖基化抗体或其去糖基化部分(如去糖基化fc部分),可有利地使用酵母表达系统或工程改造的/糖工程改造的cho细胞系。类似地,如果需要获得具有较低岩藻糖基化水平的抗体、去岩藻糖基化抗体或其去岩藻糖基化部分(如去岩藻糖基化fc部分),可有利地使用工程改造的/糖工程改造的酵母表达系统或工程改造的/糖工程改造的cho细胞系。
本发明的另一个实施方式因此是一种生产本发明的抗体或其部分(如可变结构域(重链和/或轻链可变结构域)或fab区)的方法,该方法包括在允许编码本发明所述抗体中任一种或其部分的核酸分子进行表达的条件下培养本发明的重组宿主细胞,并回收/分离生产的多肽。生产的多肽可以是糖基化或去糖基化的,可以是岩藻糖基化或去岩藻糖基化的,或可含有其他翻译后修饰,这取决于使用的宿主细胞。生产本发明的抗体或其部分的方法还可包括以下步骤:纯化该抗体或其部分,和/或将所述抗体或其部分配制为药物组合物。
用于制备编码本发明所述抗体(包括其部分,如可变结构域(重链和/或轻链可变结构域)或fab区)的多核苷酸(包括dna和rna)的其他方法是本领域熟知的。可使用异硫氰酸胍提取并随后在csci梯度中提供离心分离来制备总rna(chirgwin等1979)。使用aviv和leder的方法从总rna中制备多聚(a)+rna(aviv和leder,1972)。使用已知方法由多聚(a)+rna制备互补dna(cdna)。或者,可分离基因组dna。编码fgfr1抗体或其部分的多核苷酸可随后通过例如杂交或pcr进行鉴定和分离。
可通过本领域已知的任何技术生产本发明所述抗体(包括其部分,如可变结构域(重链和/或轻链可变结构域)或fab区),例如重组技术、化学合成、克隆、连接或其组合。许多书和综述教导了如何使用载体和原核或真核宿主细胞来克隆和生产重组蛋白。
本发明的另一个实施方式是一种药物组合物,其包含本发明所述单克隆抗体或其部分,例如可变结构域(重链和/或轻链可变结构域)或fab区。优选地,所述药物组合物还可包含至少一种其他赋形剂,例如缓冲剂、稳定剂、表面活性剂、运载体、稀释剂、载剂等。
根据本发明的药物组合物可用于预防和/或治疗(局部或全身)各种类型的癌症,例如nsclc(鳞状细胞癌,腺癌或大细胞癌),sclc,hnscc,恶性胸膜间皮瘤,骨肉瘤,软组织肉瘤,胶质母细胞瘤,mrcc,乳腺癌或肝癌。本发明的药物组合物可以与至少一种药学上可接受的运载体一起给予。
另一方面,本发明提供了根据本发明的单克隆抗体在制备用于预防或治疗癌症的药物中的用途。优选地,所述癌症是nsclc(鳞状细胞癌,腺癌或大细胞癌),sclc,hnscc,恶性胸膜间皮瘤,骨肉瘤,软组织肉瘤,成胶质细胞瘤,mrcc,乳腺癌或肝癌。
在另一个方面中,本发明涉及预防或治疗癌症的方法,包括给予患者本发明所述任意抗体或其部分或药物组合物。优选地,所述癌症是鳞状nsclc(鳞状细胞癌,腺癌或大细胞癌),sclc,hnscc,恶性胸膜间皮瘤,骨肉瘤,软组织肉瘤,成胶质细胞瘤,mrcc,乳腺癌或肝癌。
本发明所述药物组合物可以任何合适方式给予,例如静脉内、肌内、皮下或皮内。
对于胃肠道外(例如静脉内、皮下、肌内、皮内)给药,本发明的药物组合物可与药学上可接受的胃肠道外载剂(例如水、盐水、右旋糖溶液)和维持等张性或化学稳定性(例如防腐剂和缓冲剂)的添加剂一起配制为溶液、悬浮液、乳液或冻干粉末。通过常用技术对制剂进行灭菌。
本发明还包括针对fgfr1的重组抗体或其部分,如可变结构域(重链和/或轻链可变结构域)或fab区,其在功能上等同于上文所述的那些。还包括经修饰的抗体或其部分,其提供改进的稳定性和/或治疗功效。经修饰的抗体或其部分的示例包括具有氨基酸残基保守取代以及一个或多个氨基酸缺失或插入(其不明显不利地改变抗原结合应用性)的那些。取代的范围可以是从改变或修饰一个或多个氨基酸残基至完全重新设计某一区域,前提是维持治疗效用。本发明的抗体或其部分可经翻译后修饰(例如乙酰化、氧化、脱酰胺化、外消旋化和磷酸化)或可经合成修饰(例如连接标记基团)。应理解,通过本方法设计的抗体或其部分可具有其他保守性氨基酸取代,其基本不影响抗原结合或其他免疫球蛋白功能。
本发明的单克隆抗体或其部分(如可变结构域(重链和/或轻链可变结构域)或fab区)可包括衍生物。例如但不限于,这些衍生物包括通过,例如糖基化、乙酰化、peg化、磷酸化、酰胺化、由已知保护/阻断基团衍生、蛋白水解切割、连接于细胞配体或其它蛋白质等方法修饰的抗体。此外,衍生物可包含一种或多种非经典和/或非天然氨基酸。可通过修饰(例如取代、缺失或添加)经鉴定涉及fc区与fcrn受体相互作用的氨基酸残基来提高本发明的单克隆抗体的体内半衰期。
本文应用的所有参考文献,包括杂志文章或摘要、专利申请或任何其他参考文献,都通过引用全文纳入本文,包括所引用参考文献中的所有数据、表格、附图和文本。此外,本文所引用的参考文献内所引用的参考文献的全部内容也通过引用全文纳入本文。
附图描述:
图1:a)具有两个不同fab结构域的二价seed体分子的示意图,其由ch3结构域的异二聚体类似物配对。散列的灰色部分代表igg衍生部分,而白色代表iga衍生的部分。b)由ch3结构域的异二聚体类似物配对的单价seed体分子的示意图。
图2描绘了mab#a08和缓冲液与fgfr1-iiib和-iiic,fgfr2和fgfr3的结合传感图。结合信号(响应单位,ru)相对于时间绘制。测试缓冲液对照和mab#a08与hufgfr1b-iiib,-iiic,hufgfr2和hufgfr3的结合。
图3显示抗-fgfr1seed体对a)dms53和b)nci-h520细胞的adcc活性。将相对对照(无效应细胞)的倍数诱导对浓度(摩尔,m)作图。使用去岩藻糖基化的抗cd20抗体(增强的adcc功能)作为阴性对照;去岩藻糖基化的抗egfr抗体(增强的adcc功能)在dms53细胞(其表达egfr)中用作阳性对照,在nci-h520细胞(不表达egfr)中用作阴性对照。seed体a08被以岩藻糖基化(具有adcc功能)或去岩藻糖基化(增强的adcc功能)测试。
图4显示了在携带dms53-异种移植物的小鼠中,与载剂相比,单价抗fgfr1分子(seed体a08)的体内功效研究。结果报告为a)对肿瘤体积的作用,如肿瘤体积(mm3)对治疗后天数作图,b)对小鼠体重的作用,以随治疗后时间变化的体重%表示。图5显示在最后一次处理后19天收获的dms53肿瘤异种移植物中的pfgfr1水平。
图6显示了在小鼠中注射seed体a08,全-fgfr抑制剂(bgj398)和载剂对照后24小时小鼠血浆中fgf23水平的体内效应。
图7显示通过elisa绘制mab#a08,mab#a05和对照抗体(抗鸡蛋溶菌酶)的ig-d2的结构域映射。将在450nm处测量的光密度相对于抗体浓度作图(具有log10标度)。
图8显示了fgfr1b-iiic的细胞外结构域(与6个氨基酸的his标签,seqidno:81融合)的序列。可以通过质谱法鉴定的肽用灰色条表示。那些在fab存在下显示出对氢-氘交换的保护的那些由黑色条表示。无法分析的肽由序列中的下划线和斜体突出显示。
图9显示了fgfr1上mab#a08的表位(35-137)。fgfr1的骨架以带状表示。当突变为丙氨酸或甘氨酸(如果原始氨基酸是丙氨酸)时使mab#a08-fgfr1结合不稳定超过0.7kcal/mol的氨基酸显示为棒。
图10显示了通过elisa测量的各种亲和力成熟的mab对人fgfr1b(iiib)(hfgfr1b-iiib)和人fgfr1b(iiic)(hfgfr1b-iiic)的结合。a)mab是igg1形式,b)mab是单价seed体形式。
表格说明:
表1报告了针对人fgfr1的不同同种型(hufgfr1b-iiib,hufgfr1b-iiic和hufgfr1a-iiic)和来自不同物种的fgfr1a-iiic:小鼠(mu),大鼠(大鼠),恒河猴(rhe)和食蟹猴(cy)的mab#a05(二价igg)和mab#a08(二价igg)的spr计算的亲和常数kd(摩尔,m)。
表2报告了在非刺激或用fgf1或fgf2刺激的nci-h520细胞中,抗-fgfr1mab#a05和mab#a08与配体捕获物(fp-1039)和2种其他抗fgfr1(imc-h7和imc-a1)抗体相比对pfgfr1的抑制作用。已经报道了分子的选择性和它们计算的ic50(摩尔,m)。星号突出显示部分响应;标签记录了估计的ic50(由于不合适而无法准确计算)。
表3报告了pfgfr1抑制活性,其报告为在nci-h520细胞中,与一种其他抗fgfr1(imc-h7)相比,mab#a05,mab#a08的二价(igg1)和单价(seed体)形式的计算的ic50(摩尔,m)。星号突出显示部分响应。
表4报告了所有fgfr1突变体的亲和常数kd(纳摩尔,nm)。根据抗体-抗原结合的不稳定性突出显示自由能变化:“**”:>2kcal/mol去稳定化(结合热点);“*”:>1kcal/mol。nbd表示“未检测到结合”,ndc表示“没有收集数据”,nd表示“未确定”,nc表示“未计算”。
表5报告了重新形成人fgfr1b-iiib的seed体和igg的亲和力成熟克隆的亲和常数kd(纳摩尔,nm)。
序列表
seqidno:1:抗体#a08命中的可变重链(氨基酸序列)
seqidno:2:抗体#a08命中的可变轻链(氨基酸序列)
seqidno:3:抗体#a08命中和前导的重链的cdr-1(氨基酸序列)
ggsissnnw
seqidno:4:抗体#a08命中和前导的重链的cdr-2(氨基酸序列)
iyhsgst
seqidno:5:抗体#a08命中和前导的重链的cdr-3(氨基酸序列)
argtdwfdp
seqidno:6:抗体#a08命中的重链的另一cdr-1(氨基酸序列)
ggsisgnnw
seqidno:7:抗体#a08命中的重链的另一cdr-1(氨基酸序列)
ggsinsnhw
seqidno:8:抗体#a08命中的重链的另一cdr-2(氨基酸序列)
iyhsgsv
seqidno:9:抗体#a08命中的重链的另一cdr-3(氨基酸序列),x是选自脯氨酸(p)、谷氨酰胺(q)、丙氨酸(a)、亮氨酸(l)、组氨酸(h)、丝氨酸(s)或苏氨酸(t)的任意残基
aratdwfdx
seqidno:10:抗体#a08命中的重链的另一cdr-3(氨基酸序列)
argtdwydp
seqidno:11:抗体#a08命中的重链的另一cdr-3(氨基酸序列)
argtdwidt
seqidno:12:抗体#a08命中的重链的另一cdr-3(氨基酸序列)
arstdwfdp
seqidno:13:抗体#a08命中的重链的另一cdr-3(氨基酸序列)
argtdwyda
seqidno:14:抗体#a08命中的重链的另一cdr-3(氨基酸序列)
argtdwydl
seqidno:15:抗体#a08命中的重链的另一cdr-3(氨基酸序列),x是选自丝氨酸(s)或缬氨酸(v)的任意残基
arxtdwfdp
seqidno:16:抗体#a08命中的重链的另一cdr-3(氨基酸序列)
arakdwfda
seqidno:17:抗体#a08命中的重链的另一cdr-3(氨基酸序列)
aratdwydp
seqidno:18:抗体#a08命中和前导的轻链的cdr-1(氨基酸序列)
nigses
seqidno:19:抗体#a08命中和前导的轻链的cdr-2(氨基酸序列)
dds
seqidno:20:抗体#a08命中和前导的轻链的cdr-3(氨基酸序列)
qvwdstsdhrv
seqidno:21:抗体#a08命中的轻链的另一cdr-1(氨基酸序列)
nigdet
seqidno:22:抗体#a08命中的轻链的另一cdr-3(氨基酸序列)
qvwdssvdqav
seqidno:23:抗体#a08命中的轻链的另一cdr-3(氨基酸序列)
qvwdsssdhrv
seqidno:24:抗体#a08前导的可变重链(氨基酸序列)
seqidno:25:抗体#a08前导的可变轻链(氨基酸序列)
seqidno:26:抗体#a05命中的可变重链(氨基酸序列)
seqidno:27:抗体#a05前导的可变重链(氨基酸序列)
seqidno:28:抗体#a05命中的可变轻链(氨基酸序列)
seqidno:29:抗体#a05前导的可变轻链(氨基酸序列)
seqidno:30:抗体#a08家族的重链的fr-1(氨基酸序列),x是选自q和e(谷氨酸)的任意残基
xvqlqesgpglvkpsgtlsltcavs
seqidno:31:抗体#a08家族的重链的fr-2(氨基酸序列)
wswvrqppgkglewige
seqidno:32:抗体#a08家族的重链的fr-3(氨基酸序列),x是选自s和n(天冬酰胺)的任意残基
synpslksrvtisvdksknqfslklxsvtaadtavyyc
seqidno:33:抗体#a08家族的重链的fr-4(氨基酸序列)
wgqgtlvtvss
seqidno:34:抗体#a08家族的轻链的fr-1(氨基酸序列),x1是选自q和s的任意残基并且x2是选自a、s和y(酪氨酸)的任何残基
x1x2vltqppsvsvapgqtaritcggn
seqidno:35:抗体#a08家族的轻链的fr-2(氨基酸序列)
vhwyqqkpgqapvlvvy
seqidno:36:抗体#a08家族的轻链的fr-3(氨基酸序列)
drpsgiperfsgsnsgntatltisrveagdeadyyc
seqidno:37:抗体#a08家族的轻链的fr-4(氨基酸序列)
fgggtkltvl
seqidno:38:重链恒定区-人igg1同种异型g1m3(氨基酸序列)
seqidno:39:重链恒定区-人igg2同种异型g2h(氨基酸序列)
seqidno:40:重链恒定区ch1-铰链-ch2-ch3-seed(ag)(氨基酸序列)
seqidno:41:重链恒定区铰链-ch2-ch3-seed(ga)(氨基酸序列)
seqidno:42:重链恒定区ch1-铰链-ch2-ch3-seed(ga)(氨基酸序列)
seqidno:43:重链恒定区铰链-ch2-ch3-seed(ag)(氨基酸序列)
seqidno:44:轻链恒定区(λ)(氨基酸序列)
seqidno:45:#a08前导-igg1m3抗体的重链(氨基酸序列)
seqidno:46:#a08前导-seed(ag)抗体的重链(氨基酸序列)
seqidno:47:#a08前导-seed(ga)抗体的重链(氨基酸序列)
seqidno:48:#a05前导-seed(ag)抗体的重链(氨基酸序列)
seqidno:49:#a05前导-seed(ga)抗体的重链(氨基酸序列)
seqidno:50:#a08前导的轻链(氨基酸序列)
seqidno:51:#a05前导的轻链(氨基酸序列)
seqidno:52:抗体#a08命中的可变重链(核酸序列)
seqidno:53:抗体#a08命中的可变轻链(核酸序列)
seqidno:54:抗体#a08前导的可变重链(核酸序列)
seqidno:55:抗体#a08前导的可变轻链(核酸序列)
seqidno:56:抗体#a05命中的可变重链(核酸序列)
seqidno:57:抗体#a05前导的可变重链(核酸序列)
seqidno:58:抗体#a05命中的可变轻链(核酸序列)
seqidno:59:抗体#a05前导的可变轻链(核酸序列)
seqidno:60:抗体#a05命中和前导的重链的cdr-1(氨基酸序列)
ghtftgyy
seqidno:61:抗体#a05命中和前导的重链的cdr-2(氨基酸序列)
inpnsggt
seqidno:62:抗体#a05命中和前导的重链的cdr-3(氨基酸序列)
ardlfwslssgwsihpyyfdy
seqidno:63:抗体#a05命中和前导的轻链的cdr-1(氨基酸序列)
ssdvgsynl
seqidno:64:抗体#a05命中和前导的轻链的cdr-2(氨基酸序列)
ggs
seqidno:65:抗体#a05命中的轻链的cdr-3(氨基酸序列)
csytyngdv
seqidno:66:抗体#a05前导的轻链的cdr-3(氨基酸序列)
ssytysgdv
seqidno:67:抗体#a05家族的重链的fr-1(氨基酸序列),x1是选自q和e的任意残基并且x2是选自m(甲硫氨酸)和v(缬氨酸)的任何残基
x1x2qlvqsgaevkkpgasvkvsckas
seqidno:68:抗体#a05家族的重链的fr-2(氨基酸序列)
mhwvrqapgqglewmgw
seqidno:69:抗体#a05家族的重链的fr-3(氨基酸序列)
nyaqkfqgrvtmtrdtsistaymelsrlrsddtavyyc
seqidno:70:抗体#a05家族的重链的fr-4(氨基酸序列)
wgqgtlvtvss
seqidno:71:抗体#a05家族的轻链的fr-1(氨基酸序列)
qsaltqpasvsgspgqsitisctgt
seqidno:72:抗体#a05家族的轻链的fr-2(氨基酸序列)
vswyqqhpgkapklmiy
seqidno:73:抗体#a05家族的轻链的fr-3(氨基酸序列),x1是选自d(天冬氨酸)和g(甘氨酸)的任意残基,x2是选自t和n的任意残基,并且x3是选自s和t的任意残基。
krpsgvpdrfsgsksx1x2x3asltisglqaedeadyyc
seqidno:74:抗体#a05家族的轻链的fr-4(氨基酸序列)
fgtgtkvtvl
seqidno:75:轻链恒定区(λ)(核酸序列)
seqidno:76:重链恒定区-人igg1同种异型g1m3(核酸序列)
seqidno:77:重链恒定区-人igg2同种异型g2h(核酸序列)
seqidno:78:重链恒定区seed(ag)(核酸序列)
seqidno:79:重链恒定区-seed(ga)(核酸序列)
seqidno:80:人fgfr1b-iiib胞外结构域(氨基酸序列)
seqidno:81:人fgfr1b-iiic胞外结构域(氨基酸序列)
seqidno:82:小鼠fgfr1b-iiib胞外结构域(氨基酸序列)
seqidno:83:小鼠fgfr1b-iiic胞外结构域(氨基酸序列)
seqidno:84:人fgfr1d2-his6(氨基酸序列)
seqidno:85:人fgfr1-iiicd3-his6(氨基酸序列)
seqidno:86:带his标签的人fgfr1b-iiib胞外结构域(氨基酸序列)
seqidno:87:带his标签的人fgfr1b-iiic胞外结构域(氨基酸序列)
seqidno:88:带his标签的小鼠fgfr1b-iiib胞外结构域(氨基酸序列)
seqidno:89:带his标签的小鼠fgfr1b-iiic胞外结构域(氨基酸序列)
seqidno:90:抗体#a08命中的重链的另一cdr-3(氨基酸序列),x1是选自s(丝氨酸)、g(甘氨酸)、a(丙氨酸)或v(缬氨酸)的任意残基;x2是选自t(苏氨酸)或k(赖氨酸)的任意残基;x3是选自f(苯丙氨酸)、y(酪氨酸)或i(异亮氨酸)的任意残基,并且x4是选自p(脯氨酸)、l(亮氨酸)、a(丙氨酸)、t(苏氨酸)和h(组氨酸)的任意残基
arx1x2dwx3dx4
seqidno:91:抗体#a08命中的另一可变重链(氨基酸序列),x1是选自q(谷氨酰胺)或e(谷氨酸)的任意残基;x2是选自s(丝氨酸)、g(甘氨酸)、a(丙氨酸)或v(缬氨酸)的任意残基;x3是选自t(苏氨酸)或k(赖氨酸)的任意残基,x4是选自f(苯丙氨酸)、y(酪氨酸)或i(异亮氨酸)的任意残基,并且x5是选自p(脯氨酸)、l(亮氨酸)、a(丙氨酸)、t(苏氨酸)和h(组氨酸)的任意残基
seqidno:92:#b10-seed(ag)抗体的可变重链(氨基酸序列)
seqidno:93:#a02-seed(ag)抗体的可变重链(氨基酸序列)
seqidno:94:#g04-seed(ag)抗体的可变重链(氨基酸序列)
seqidno:95:#d02-seed(ag)抗体的可变重链(氨基酸序列)
seqidno:96:#d01-seed(ag)抗体的可变重链(氨基酸序列)
seqidno:97:#c01-seed(ag)抗体的可变重链(氨基酸序列)
seqidno:98:#a07-seed(ag)抗体的可变重链(氨基酸序列)
seqidno:99:#a08前导-seed(ag)抗体的另一可变重链(氨基酸序列),x1是选自q(谷氨酰胺)或e(谷氨酸)的任意残基;x2是选自s(丝氨酸)、g(甘氨酸)、a(丙氨酸)或v(缬氨酸)的任意残基;x3是选自t(苏氨酸)或k(赖氨酸)的任意残基,x4是选自f(苯丙氨酸)、y(酪氨酸)或i(异亮氨酸)的任意残基,并且x5是选自p(脯氨酸)、l(亮氨酸)、a(丙氨酸)、t(苏氨酸)和h(组氨酸)的任意残基
seqidno:100:#b10-seed(ag)抗体的重链(氨基酸序列)
seqidno:101:#a02-seed(ag)抗体的重链(氨基酸序列)
seqidno:102:#g04-seed(ag)抗体的重链(氨基酸序列)
seqidno:103:#d02-seed(ag)抗体的重链(氨基酸序列)
seqidno:104:#d01-seed(ag)抗体的重链(氨基酸序列)
seqidno:105:#c01-seed(ag)抗体的重链(氨基酸序列)
seqidno:106:#a07-seed(ag)抗体的重链(氨基酸序列)
seqidno:107:#b10-seed(ag)抗体的重链(核酸序列)
seqidno:108:#a02-seed(ag)抗体的重链(核酸序列)
seqidno:109:#g04-seed(ag)抗体的重链(核酸序列)
seqidno:110:#d02-seed(ag)抗体的重链(核酸序列)
seqidno:111:#d01-seed(ag)抗体的重链(核酸序列)
seqidno:112:#c01-seed(ag)抗体的重链(核酸序列)
seqidno:113:#a07-seed(ag)抗体的重链(核酸序列)
实施例
下面给出的工作实施例旨在说明本发明的特定实施方式,而不是以任何方式限制说明书或权利要求的范围。
实施例1-抗fgfr1拮抗剂抗体的产生和表征
1.1瞬时和稳定表达人和小鼠fgfr1的产生
基于ncbi参考np_075594,np_056934(分别为seqidno:80至seqidno:83)分别编码人和小鼠fgfr1b-iiib和fgfr1b-iiic的胞外结构域的cdna通过c末端6-组氨酸标签基因合成产生。将cdna亚克隆到哺乳动物表达载体pvac2载体(英韦沃基公司(invivogen))中以编码与胎盘碱性磷酸酶的gpi锚定结构域融合的fgfr1蛋白。
使用expifectamine(赛默飞世尔公司(thermofischer))转染expi293细胞,并且使用nucleofectorii装置(amaxa生物系统公司(amaxabiosystems))转染cho细胞,使用nucleofection系统编码载体,然后用潮霉素b选择。使用facs筛选小池的fgfr1表达。通过facs从最佳微型池分选单细胞并扩增。通过facs选择具有最高fgfr1表达的克隆。
3天后,使用抗fgfr1-igg1(1μg/ml和10μg/ml)或对照抗体(1μg/ml和10μg/ml)作为一抗,通过facs评估fgfr1细胞表面表达,并且使用r-藻红蛋白偶联的affinipuref(ab′)2片段山羊抗人igg,fcγ片段特异性(杰克逊免疫研究实验室(jacksonimmunoresearch)#109-116-098)作为二抗。
1.2.重组蛋白的制备
将重组人fgfr1b-iiib和fgfr1b-iiic胞外结构域(分别为seqidno:80,seqidno:81)与6-组氨酸标签融合。使用标准重组dna技术制备fgfr1融合构建体。使用pei将dna转染到hek293细胞中用于瞬时表达。通过镍螯合亲和柱从细胞上清液中纯化蛋白质并用咪唑洗脱。对纯化的蛋白质进行qc分析:在还原和非还原条件下的sdspage,用于测定纯度和表观mw的sec,用于浓度测定的uv光谱,以及用于测量内毒素污染的鲎变形细胞裂解物测定。通过它们抑制fgf1或fgf2诱导的fgfr1磷酸化的能力在体外对蛋白质进行功能测试(参见实施例1.10)。小鼠,大鼠,食蟹猴和恒河猴fgfr1a-iiic(带his6标签)购自创造生物标志公司(creativebiomart)和义翘神州生物技术公司(sinobiologicals),人fgfr2和fgfr3(带his6标签)来自义翘神州生物技术公司。
1.3动物
使用表达人抗体基因的转基因大鼠(来自开放单克隆技术公司(openmonoclonaltechnologies,inc.)/配体药物公司(ligandpharmaceuticals,inc.)的获批的omnirats)产生抗fgfr1人单克隆抗体:人轻链(vlcl或vkck)和人vh,同时表达重链的大鼠恒定区(geurts等,2009,menoret等,2010,ma等,2013,osborn等,2013)。
1.4使用噬菌体展示技术生成抗fgfr1抗体
使用噬菌体展示技术和his标记的人fgfr1b-iiib和fgfr1b-iiic抗原产生对fgfr1特异的单克隆抗体。将来自供体的具有重链和轻链的天然多样性的人噬菌体scfv抗体文库用于淘选。使用几种不同的臂来选择特异性结合人fgfr1的scfv(3-4轮选择)。通过elisa筛选17944个噬菌体克隆以鉴定458个单独的fgfr1结合物。通过elisa确认79个克隆与fgfr1,而不是与fgfr2,fgfr3或fgfr4特异性结合。其中,25个克隆显示通过facs与表达fgfr1的细胞结合。成功重新格式化了20个独特的克隆以进行igg1表达。基于其阻断fgfr1磷酸化的效力选择命中候选物(参见实施例1.10)。最初通过elisa测定,随后通过biacore定量与fgfr1的结合(参见实施例1.8)并通过facs测定与表达fgfr1的细胞结合(参见实施例1.7)。三个候选物符合预定义的概况,包括mab#a05。
1.5从大鼠杂交瘤产生抗fgfr1抗体
或者,为了产生针对fgfr1的完全人单克隆抗体,用人fgfr1b-iiib和fgfr1b-iiic抗原的his标记的d2-d3(seqidno:80和seqidno:81)免疫转基因大鼠omniratstm。如前所述,一般免疫方案用于多个位点的重复免疫(kilpatrick等,1997)。使用fgfr1过表达细胞通过facs监测血清免疫应答。
分离来自淋巴结的细胞并与骨髓瘤细胞融合以使用常规peg方法产生杂交瘤。在hat培养基中的烧瓶中培养10天后,收获上清液并冷冻细胞。通过facs测试上清液与过表达fgfr1的细胞的结合。
将单克隆杂交瘤细胞在96孔板中作单一分选,并在hat培养基中生长数天。测试7896上清液与表达鼠fgfr1的细胞的结合。通过elisa确认414个上清液与fgfr1结合。重新形成177个独特克隆并表达为igg。通过elisa证实27个克隆与fgfr1结合,并通过facs证实与fgfr1表达细胞结合(参见实施例1.7)。
选自噬菌体或杂交瘤的抗体中没有一种与d2结构域(seqidno:84)结合(通过elisa测试)并且能够在不存在配体的情况下抑制pfgfr1(数据未显示)。
然后使用fgfr1b-iiib和fgfr1b-iiic的混合物进行对omnirats的另一次免疫,以破坏耐受性并增加多样性。基于它们与表达fgfr1的细胞的结合选择138种杂交瘤上清液。重新格式化所有克隆并表达为igg。通过elisa(包括mab#a08)证实21个克隆与fgfr1b-iiib和fgfr1b-iiic,鼠fgfr1a-iiic和fgfr1的d2结构域结合。
1.6抗体表达和纯化
将抗体重链和轻链单独亚克隆至ptt5载体中并在使用expifectamine转染试剂转染后在expi293细胞中瞬时共表达。将细胞在5%co2潮湿培养箱中37℃下振荡孵育7天。收获并离心条件培养基以除去细胞碎片。使用标准方法通过蛋白a亲和层析从培养物上清液中纯化抗体。对纯化的蛋白质进行以下qc分析:在还原和非还原条件下的sdspage,用于测定纯度和表观mw的sec,用于浓度测定的uv光谱,以及用于测量内毒素污染的鲎变形细胞裂解物测定。
1.7针对抗fgfr1抗体的基于细胞的结合试验
通过facs评估抗fgfr1抗体与细胞系的结合。简而言之,将约1×105个表达fgfr1的细胞重悬浮于facs缓冲液(含有1%fbs的dpbs)中,该缓冲液含有100至0nm的抗fgfr1抗体的连续稀释液,并在冰上孵育30分钟。洗涤细胞并在含有fitc-偶联的山羊抗人iggfc抗体(杰克逊免疫研究实验室公司#109-096-098)的facs缓冲液中于冰上重悬30分钟。然后将细胞离心并重悬于含有7-aad和1%中性缓冲福尔马林的facs缓冲液中。在guavaeasycyte仪器(密理博西格玛公司(milliporesigma))上进行分析。将中值流强度(mfi)对抗体浓度作图,并使用graphpadprism软件计算ec50值。mab#a08和#a05对人和鼠fgfr1表达细胞具高度特异性,并且未显示与对照亲本expi293细胞的结合(数据未显示)。
1.8确定抗-fgfr1mab变体对fgfr1的kd
如下使用gehealthcarebiacore4000仪器通过表面等离子体共振(spr)测量抗fgfr1抗体与fgfr1的结合亲和力。首先将山羊抗人fc抗体(杰克逊免疫研究实验室公司#109-005-098)固定在biacore羧甲基化葡聚糖cm5芯片上,按照制造商描述的程序直接偶联游离氨基。然后在cm5生物传感器芯片上捕获抗体以获得约200个响应单位(ru)。使用运行的hbs-ep+缓冲液进行结合测量。在25℃下以30μl/min的流速注射2倍稀释系列的his-标记的fgfr1蛋白。使用简单的1:1langmuir结合模型(biacore4000评价软件)计算结合速率(kon,每mol/s)和解离速率(koff,每秒)。平衡解离常数(kd,mol)计算为koff/kon的比率。
如上所述鉴定的抗fgfr1抗体之一(mab#a08)与fgfr1b-iiib和fgfr1b-iiic结合,具有10×10-12和17×10-12m的相似亲和力(表1)。虽然抗fgfr1抗体mab#a05与fgfr1b-iiib和fgfr1b-iiic结合(如通过elisa测试所示),但通过spr检测的针对fgfr1b-iiic的结合显示出10×10-12m的亲和力。
1.9fgfr1针对其他家族成员的结合选择性
通过elisa针对不同的fgfr家族成员:fgfr1,fgfr2,fgfr3和fgfr4测试抗体的结合选择性。简言之,将板用不同的his6标记的fgfr蛋白包被过夜,用1%牛血清白蛋白封闭后,将1或0.1μg/ml的抗fgfr1抗体在室温下孵育1小时。洗涤后,将结合的抗体在室温下与过氧化物酶affinipuref(ab’)2片段山羊抗人fc(杰克逊免疫研究实验室公司#109-036-098)一起孵育1小时,并使用tmbhrp底物溶液进行检测(biofxlab#tmbw-1000-01)。在0.1μg/ml时,仅mab#a05显示针对fgfr2和fgfr4的强信号,而mab#a08与fgfr2具有非常弱的结合(数据未显示)。
使用与实施例1.8中公开的相似的方案,通过spr测量mab#a08对fgfr1,fgfr2和fgfr3的结合亲和力,具有以下修饰:对于fgfr2和fgfr3,连续稀释在1000nm开始。动力学曲线(图2)清楚地证明mab#a08具有与缓冲液阴性对照相似的特征,因此不与fgfr2和fgfr3结合。mab#a08以相似的亲和力概况特异性结合fgfr1-iiib和fgfr1-iiic(也参见表1)。
1.10nci-h520细胞系中磷酸-fgfr1(pfgfr1)的抑制
为了抑制fgfr1的活化,将nci-h520细胞(来自肺鳞状细胞癌)以2×104个细胞/孔接种在含10%fcs的rpmi培养基中,并在37℃,5%co2下孵育过夜。通过用无血清rpmi培养基替换培养基使细胞饥饿24小时。在optimem培养基中制备五倍系列稀释的抗fgfr1抗体或单臂分子(即单价seed体),并在37℃下加入细胞45分钟。将人fgf1(biomol#50440.50)或fgf2(biomol#50361.50)与肝素(西格玛奥德里奇(sigmaaldrich)#h3149)混合并加入到细胞中,使得最终浓度为100ng/mlfgf1或fgf2和5μg/ml肝素在37℃下持续10分钟。洗涤细胞并在冰上用triton裂解缓冲液裂解20分钟。通过离心将裂解的细胞通过裂解物滤板过滤。磷酸化的fgfr1(pfgfr1)使用涂有用于捕获的兔抗fgfr1(细胞信号公司(cellsignaling),克隆d8e4)以及用于用luminex仪器检测的小鼠抗磷酸-fgfr(tyr653/654)(细胞信号公司,克隆55h2)和驴抗-小鼠-pe(dianova#715-116-151)的珠来定量。将未处理的对照(未刺激的)设定为100%,并将抗体处理的样品计算为%对照。将pfgfr1的%对照针对抗体浓度作图,并使用graphpadprism软件计算ic50值(表2)。将抗fgfr1抗体的活性与fgf阱的活性进行比较,fgf阱是由融合至fc结构域的fgfr1的胞外结构域,以捕获fgfr1配体,命名为fp-1039(wo2007014123)和2种其他结合fgfr1-iiib和fgfr1-iiic的抗-fgfr1,imc-h7,以及仅与fgfr1-iiic结合的imc-a1(wo2005037235)组成的分子。所有分子均抑制fgf-1和fgf2诱导的细胞中的pfgfr1,但只有fp-1039和mab#a08在fgf1存在下完全抑制pfgfr1。mab#a08显示出最强的抑制活性,ic50为4/0.2nm,mab#a05对于fgf1-/fgf2-诱导的pfgfr1的ic50分别为1/1nm。在该测定中,仅mab#a08和imc-h7抑制配体非依赖性pfgfr1。
实施例2-mab#a08和mab#a05的优化
2.1重链和轻链变体
mab#a08和mab#a05重链的可变区的氨基酸序列(分别为seqidno:1和seqidno:26;vh)和mab#a08和mab#a05轻链的可变区的氨基酸序列(分别为seqidno:2和seqidno:28;vl)通过改变重链和轻链可变区中的框架区和cdr序列来分开修饰。这些序列变化的目的是将构架氨基酸残基突变为该位置处发现的最同源的人种系残基,以提高相关细胞试验中的效力,通过阻止asp异构化、asn脱酰胺和met氧化改善分子的可制造性,或消耗计算机鉴定的人t细胞表位的抗体,从而降低或消除其在人中的免疫原性。
构建两个重链变体(seqidno:24和seqidno:27),作为人igg1重链同种型并分别表示#a08vh前导(对应于seqidno:24;#a08前导的重链)和#a05vh前导(seqidno:27,#a05前导的重链)。根据imgt编号方案,进行了以下突变:
-#a08vh前导:n92s
-#a05vh前导:q1e,m2v
另外,如下在mab#a08的重可变区的cdr的氨基酸序列(seqidno:6至seqidno:17)中进行了几个突变:
-#a08cdr1:s35g(seqidno:6)或s31n,n37h(seqidno:7)
-#a08cdr2:t65v(seqidno:8)
-#a08cdr3:g107a,p117x(seqidno:9),x是选自p、q、a、l、h、s或t的任意残基;g107a,f115y(seqidno:10),g107a,f115i,p117t(seqidno:11),g107s(seqidno:12),f115i,p117a(seqidno:13),f115y,p117l(seqidno:14),g107x,x是选自s或v的任意残基(seqidno:15),g107a,t108k,p117a(seqidno:16),或g107a,f115y(seqidno:17)。
在人λ背景中构建了两个轻链变体,并且表示为#a08vl前导(seqidno:25,#a08前导的轻链)和#a05vl前导(seqidno:29,#a05前导的轻链)包含以下突变(根据imgt编号;下划线的残基位于其中一个cdr中):
-#a08vl前导:q1s,a2y
-#a05vl前导:d84g,t85n,s86t,c105s,n114s
以所有可能的配对组合合并原始和变体重链和轻链以生成多种功能性全人抗fgfr1抗体。基于它们对fgfr1的结合活性(通过elisa和facs)选择命中优化候选物。
实施例3-seed体产生和测试
3.1生物产生、净化和纯化
具有对应于seqidno:46和seqidno:41(重链)和seqidno:50(轻链)的氨基酸序列的单价seed体#a08由cho-lf细胞产生(产生去岩藻糖化蛋白质用于增强adcc)。细胞培养在250l一次性生物反应器中以分批模式进行。细胞在补充有葡萄糖的专有cho补料分批生长培养基中于37℃生长。在接种后第3、5、7和10天,向培养物中加入专有进料成分的混合物。
使用2.2m2millistak+podd0hc(密理博md0hc10fs1)和1.1m2millistak+podx0hc(密理博#mx0hc01fs1)过滤器净化来自生物反应器运行的粗制条件培养基,然后使用milliporeopticapxl30.5/0.2μm过滤器(密理博#khges03hh3)进行终端过滤。
然后使用标准方法纯化seed体并配制在10mm组氨酸中。该seed体#a08用于所有后续测定(参见3.2至3.8节)。#a08重链和轻链也用于构建也用于后续测定的标准igg1抗体(参见3.2和3.3节)。
3.2亲和力测量
使用类似于实施例1.8中描述的方案,通过biacore比较抗fgfr1seed体(单价)和igg1(二价)的亲和力。spr实验测量了对于seed体和igg1形式的与fgfr1b-iiic类似的结合亲和力。形成单价分子未改变fab部分的结合动力学(数据未显示)。
3.3在h520细胞中配体依赖性和非依赖性pfgfr1的抑制
使用与实施例1.10中描述的方案类似的方案,比较二价(igg1)和单价(seed体)抗体的活性。数据显示,当重新格式化为单价形式时,所有抗体的ic50高约10倍,最可能是由于细胞表面亲合力的丧失(表3)。只有克隆#a08在fgf1-,fgf2-诱导的和不存在配体的情况下作为单价分子保留抑制活性,ic50分别为70,6和20nm。在下游信号传导事件例如frs2和erk1/2的磷酸化(数据未显示)上获得了类似的发现。
3.4用dms53和nci-h520细胞的adcc测定
使用adccreporterbioassay核心试剂盒(普洛麦格(promega)#g7018)评估抗fgfr1抗体诱导adcc的能力。简言之,将dms53(来自人小细胞肺癌)或nci-h520靶细胞以1.25×104个细胞/孔接种在96孔板中,并在含有低igg血清的培养基中生长过夜。然后用预热的adcc测定缓冲液替换培养基。将五倍连续稀释的抗体与效应细胞(试剂盒提供的jurkatnfat-luc)一起加入细胞中,在预热的adcc测定缓冲液中比例为6∶1(效应细胞:靶细胞)。将板在37℃下孵育6小时。在室温下平衡平板15分钟后,加入bio-glo荧光素酶测定试剂。在室温下孵育5分钟后,使用envision2104酶标仪测量发光。将倍数诱导计算为信号(诱导减去背景)/信号(无抗体对照减去背景)的比率。将抗体诱导相对于抗体浓度作图。比较在存在或不存在岩藻糖的cho-lf细胞中产生的抗fgfr1,对照去岩藻糖基化抗egfr(egfr阳性-dms53细胞的阳性对照),去岩藻糖基化抗cd20(阴性对照)针对dms53(图3a)和nci-h520(图3b)细胞的adcc活性。去岩藻糖基化的抗fgfr1seed体诱导dms53和nci-h520细胞的adcc,而cho-lf细胞中产生的岩藻糖基化蛋白诱导中度adcc。
3.5dms53肿瘤异种移植物
用5×106个dms53细胞和基质胶(bd#354234)皮下注射7至9周龄的h2drag3小鼠(泰克尼克公司(taconic))。使肿瘤生长,将动物随机分成5组,每组10只动物,得到平均肿瘤体积约115mm3。每周两次用载剂(在10mm组氨酸缓冲液中)或seed体#a08以25,12,6,3mg/kg腹膜内注射组(制剂缓冲液参见实施例3.1)。每天检查动物并每周测量两次体重。通过收集长度和宽度每周测量肿瘤两次。使用以下公式计算肿瘤体积:长度×宽度×宽度/2。
(单价)seed体抗fgfr1以剂量依赖性方式抑制dms53异种移植物的生长,并且已经在6mg/kg下诱导强烈的肿瘤生长抑制(图4a)。虽然dms53模型在载剂处理的小鼠上诱导恶病质,但在seed体#a08处理的小鼠中观察到稳定的体重(图4b)。
在最后一次治疗后19天,收集肿瘤以使用如实施例1.10中所述的类似方案测量pfgfr1的水平。
图5显示通过用seed体#a08处理在dms53异种移植物中对pfgfr1的剂量依赖性体内抑制。在12mg/kg时获得完全抑制(检测下限)。
3.6nci-h226异种移植物模型
对11周龄的h2drag3小鼠(taconic)皮下注射2.5×106个nci-h226细胞(来自人肺鳞状细胞癌,间皮瘤)。使肿瘤生长至肿瘤体积范围为47至94mm3,将动物随机分成6组,每组10只动物。每周两次用载剂(在10mm组氨酸缓冲液中)或seed体#a08以50mg/kg腹膜内注射组(制剂参见实施例3.1)。每天检查动物并每周测量两次体重。通过收集长度和宽度每周测量肿瘤两次。使用以下公式计算肿瘤体积:长度×宽度×宽度/2。
(单价)seed体抗fgfr1抑制nci-h226异种移植物的生长,类似于治疗标准之一(培美曲塞/顺铂)(数据未显示)。所有组的体重都受到影响,表明模型相关的影响(数据未显示)。
3.7seed体对小鼠fgf23血浆水平的影响
重要的是测试seed体#a08(作为单价形式)在体内是否具有与全fgfr抑制剂类似的作用:干扰fgf23途径导致血浆fgf23水平升高(wohrle等,2013,yanochko等,2013)。在24小时后收集注射载剂,20mg/kg的全-fgfr抑制剂(bgj39)和12、50和100mg/kg的seed体#a08的小鼠的血浆样品,并使用小鼠fgf-23elisa试剂盒(密理博#ezmfgf23-43k)根据制造商的推荐进行小鼠fgf23的定量。数据表明,与全-fgfr抑制剂相反,seed体#a08不会改变所有测试剂量的血浆中的激素fgf23水平(图6)。
实施例4-表位作图
4.1结构域作图
通过产生fgfr1b-iiic(seqidno:81)的部分构建体,结构域d2(seqidno:81的残基1-142,对应于seqidno:84)和d3(seqidno:81的残基142-164,对应于seqidno:85),建立抗fgfr1抗体的结构域水平表位作图。通过elisa和针对d2测试针对那些d2结构域的抗体结合(图7)。数据显示mab#a08结合d2结构域,mab#a05不结合d2。elisa数据还证明mab#a05结合fgfr1b-iiib和fgfr1b-iiic。spr数据已经证实mab#a08与d2结构域和mab#a05与d3结构域的结合(数据未显示)。
4.2.通过氢-氘交换的表位作图
在存在或不存在过量的抗fgfr1fab或非特定的fab下,将fgfr1抗原的细胞外结构域(seqidno:81)在重水(d2o)溶液中孵育以允许蛋白质主链上的酰胺质子与来自溶剂的氘核交换。用蛋白酶消化样品并通过液相色谱-质谱(lc-ms)分析以确定每种肽中的氘化水平。
使用对应于mab#a08的fab代替完整igg,以通过减少蛋白酶消化产生的肽的数量来简化质谱分析。尽管如此,一些区域仍然无法识别和分析(图8中用下划线标出的斜体序列部分),但是这些区域代表序列的一小部分,并且全部位于ig样结构域d3中,远离含有mab#a08的区域的表位。因此,该方法不能用于其表位位于d3结构域内的mab#a05。观察到来自抗原的几种肽在存在fab的情况下与氘核质子交换率明显降低,表明这些肽的至少一些残基与fab直接接触并构成构象表位。它们在fgfr1的三维结构中是靠近的并且在抗原表面上构成单个片(图9)。
总之,hd交换鉴定了位于这2个肽附近的构象表位
i.在胞外结构域加his标签中,seqidno:81的残基52-63,和
ii.在胞外结构域加his标签中,seqidno:81的残基79-95,
其含有mab#a08的功能性表位。
4.3诱变
为了获得表位的更精细的残基水平图谱并补充hd交换数据,采用分子建模和人工检查fgfr1的晶体结构[(beenken等,2012);pdb记录30jv]来选择通过hd交换鉴定的表位内和周围的溶剂暴露残基。将所选残基突变为丙氨酸(大至小),或者如果所选残基是丙氨酸,突变为甘氨酸。在hek细胞中设计,表达和纯化总共35个点突变体,并如实施例1.8中所述使用表面等离振子共振测试与mab#a08的结合。测定抗体对野生型和每种突变体的亲和力,并用于计算每个表位残基对结合能的贡献。
结果总结在表4中。将变体与野生型d2进行比较。突变体相对于野生型d2构建体(δδgmut)的结合的吉布斯自由能的变化源自野生型和突变体kd的比率。对于野生型和突变蛋白,给出荧光监测的热变性的温度中点。给出了通过分析sec测定的单体百分比。对于kd和t1/2,给出平均值和标准偏差,其中n>1。重要的是确认mab#a08与k60a,t61a,k63a和k95a点突变体之间缺乏结合确实是由于失去了热点残留而不是抗原的全面解折叠。使用荧光监测的热解折叠(fmtu)测定法确认突变蛋白质的结构完整性,其中蛋白质与在水性溶液中猝灭但在被暴露的疏水残基结合时发荧光的染料一起孵育。随着温度升高,蛋白质的热变性暴露出疏水核心残基,并且可以通过染料荧光的增加对此进行监测。使用公式1中列出的boltzmann方程拟合熔解曲线,该方程改自(bullock等,1997)以确定曲线拐点处的温度(t1/2)。计算的t1/2报告在表4中。
公式1:
所有突变体都显示出与野生型d2类似的两种状态转变,表明在室温下的折叠结构。大多数变体蛋白质具有与野生型fgfr1-iiib或-iiic或野生型d2类似的熔点。值得注意的例外包括l53a,a55g,v56a,g92a,g93a和y94a的变体,其在fmtu测定中各自具有不典型的解链曲线,这表明这些变体的潜在局部或整体解折叠。在这些潜在不稳定的变体中,只有突变y94a对结合亲和力有影响。虽然该残基位于表位附近,但酪氨酸侧链在β折叠与其他表位残基相反的一侧上取向。总之,酪氨酸94的侧链原子不太可能参与与mab#a08的有意义的相互作用。
实施例5-亲和力成熟化
抗体#a08作为igg1(二价)和seed体(单价),使用(rhiel等,2014)中描述的酵母展示技术进行亲和力成熟化,并且从免疫的omnirats和幼稚人类文库进行轻链改组,然后进行cdr-h3简约诱变。在几轮分选后,挑选酵母克隆,如实施例1.6和3.1中所述重新形成独特的克隆。使用与实施例1.9中所述类似的方案,通过elisa测量抗fgfr1分子对人fgfr1b-iiib)和人fgfr1b-iiic)的结合亲和力。针对抗体浓度绘制od450,并使用graphpadprism软件计算ec50值(参见图10)。亲和力成熟化的抗fgfr1分子具有与两种形式的mab#a08(即igg1和seed体)相似的结合活性,但seed体#a07和igg1形式的mab#d01除外,其显示更高的ec50值(与mab#a08的8pm相比,15pm)。用mab#a02和#c01获得最佳结果,显示igg1和seed体形式的ec50改善。
通过biacore(使用类似于实施例1.8中描述的方案)测量对重新形成为igg和单价seed体的亲和力成熟克隆对人fgfr1b-iiib的亲和力,并与mab#08(表5)的那些进行比较。结果显示,除了克隆#g04和#d02具有更高kd并且根据其形式还显示不同kd之外,所有克隆具有比mab#08kd低2至4倍的kd。
表1:对不同物种的亲和力
表2h520细胞中的pfgfr1抑制(ic50,m)
表3igg1(二价)和seed体(单价)形式在nci-h520细胞中的pfgfr1抑制的比较(ic50,m)
表4:与所有fgfr1突变体的亲和力数据
表5-igg(二价)和seed体(单价)形式的亲和力成熟化克隆对人fgfr1b-iiic的亲和力(kd,nm)
参考文献
·aviv,h.和p.leder(1972).″通过寡聚胸苷酸-纤维素上的色谱法纯化生物活性球蛋白信使rna(purificationofbiologicallyactiveglobinmessengerrnabychromatographyonoligothymidylicacid-cellulose)″procnatlacadsciusa69:第1408-1412页.
·beenken,a.,a.v.eliseenkova,o.a.ibrahimi,s.k.olsen和m.mohammadi(2012).″成纤维细胞生长因子1(fgf1)n末端与fgf受体相互作用的可塑性是fgf1混杂的基础(plasticityininteractionsoffibroblastgrowthfactor1(fgf1)nterminuswithfgfreceptorsunderliespromiscuityoffgf1)″jbiolchem287:第3067-3078页.
·bullock,a.n.,j.henckel,b.s.dedecker,c.m.johnson,p.v.nikolova,m.r.proctor,d.p.lane和a.r.fersht(1997).″野生型和突变型p53核心结构域的热力学稳定性(thermodynamicstabilityofwild-typeandmutantp53coredomain)″procnatlacadsciusa94:第14338-14342页.
·chirgwin,j.m.,a.e.przybyla,r.j.macdonald和w.j.rutter(1979).″从富含核糖核酸酶的来源中分离生物活性核糖核酸(isolationofbiologicallyactiveribonucleicacidfromsourcesenrichedinribonuclease)″biochemistry18:第5294-5299页.
·chothia,c.和a.m.lesk(1987).″免疫球蛋白高变区的典型结构(canonicalstructuresfbrthehypervariableregionsofimmunoglobulins)″jmolbiol196:第901-917页.
·davis,j.h.,c.aperlo,y.li,e.kurosawa,y.lan,k.m.lo和j.s.huston(2010).″seed体:融合蛋白基于链交换工程改造的结构域(seed)ch3异二聚体在fc类似物平台上的不对称结合物或免疫融合和双特异性抗体(seedbodies:fusionproteinsbasedonstrand-exchangeengineereddomain(seed)ch3heterodimersinanfcanalogueplatformforasymmetricbindersorimmunofusionsandbispecificantibodies)″proteinengdessel23:第195-202页.
·eswarakumar,v.p.,i.lax和j.schlessinger(2005).″成纤维细胞生长因子受体的细胞信号传导(cellularsignalingbyfibroblastgrowthfactorreceptors)″cytokinegrowthfactorrev16:第139-149页.
·fernig,d.g.和j.t.gallagher(1994).″成纤维细胞生长因子及其受体:控制组织生长,形态发生和修复的信息网络(fibroblastgrowthfactorsandtheirreceptors:aninformationnetworkcontrollingtissuegrowth,morphogenesisandrepair)″proggrowthfactorres5:第353-377页.
·geurts,a.m.,g.j.cost,y.freyvert,b.zeitler,j.c.miller,v.m.choi,s.s.jenkins,a.wood,x.cui,x.meng,a.vincent,s.lam,m.michalkiewicz,r.schilling,j.foeckler,s.kalloway,h.weiler,s.menoret,i.anegon,g.d.davis,l.zhang,e.j.rebar,p.d.gregory,f.d.urnov,h.j.jacob和r.buelow(2009).″通过胚胎显微注射锌指核酸酶敲除大鼠(knockoutratsviaembryomicroinjectionofzinc-fingernucleases)″science325:第433页.
·jiao,h.,p.arner,s.l.dickson,h.vidal,n.mejhert,c.henegar,m.taube,c.hansson,a.hinney,p.galan,c.simon,a.silveira,a.benrick,j.o.jansson,a.bouloumie,d.langin,m.laville,c.debard,t.axelsson,m.ryden,j.kere,k.dahlman-wright,a.hamsten,k.clement和i.dahlman(2011).″遗传关联和基因表达分析将fgfr1鉴定为人类肥胖的新易感基因(geneticassociationandgeneexpressionanalysisidentifyfgfr1asanewsusceptibilitygeneforhumanobesity)″jclinendocrinolmetab96:第e962-966页.
·johnson,d.e.和l.t.williams(1993).″fgf受体多基因家族的结构和功能多样性(structuralandfunctionaldiversityinthefgfreceptormultigenefamily)″advcancerres60:第1-41页.
·kabat,e.a.,t.t.wu,h.m.perry,k.s.gottesman和c.foeller(1991).免疫感兴趣的蛋白质的序列(sequencesofproteinsofimmunologicalinterest).
·katoh,m.和h.nakagama(2014).″fgf受体:癌症生物学和治疗学(fgfreceptors:cancerbiologyandtherapeutics)″medresrev34:第280-300页.
·kilpatrick,k.e.,s.a.wring,d.h.walker,m.d.macklin,j.a.payne,j.l.su,b.r.champion,b.caterson和g.d.mcintyre(1997).″使用rimms快速开发亲和力成熟的单克隆抗体(rapiddevelopmentofaffinitymaturedmonoclonalantibodiesusingrimms)″hybridoma16:第381-389页.
·lefranc,m.-p.(1997)″独特的免疫遗传分析数据库编号系统(uniquedatabasenumberingsystemforimmunogeneticanalysis)″.immunologytoday,18,509,ligm:194
·ma,b.,m.j.osborn,s.avis,l.h.ouisse,s.menoret,i.anegon,r.buelow和m.bruggemann(2013).″转基因大鼠中的人抗体表达:具有人vh,d和jh但具有不同的大鼠c基因区域的嵌合igh基因座比较(humanantibodyexpressionintransgenicrats:comparisonofchimericighlociwithhumanvh,dandjhbutbearingdifferentratc-generegions)″jimmunolmethods400-401:第78-86页.
·menoret,s.,a.l.iscache,l.tesson,s.remy,c.usal,m.j.osborn,g.j.cost,m.bruggemann,r.buelow和i.anegon(2010).″免疫球蛋白重链敲除大鼠的表征(characterizationofimmunoglobulinheavychainknockoutrats)″eurjimmunol40:第2932-2941页.
·nimmerjahn,f.和j.v.ravetch(2011).″健康和疾病中的fcgammars(fcgammarsinhealthanddisease)″currtopmicrobiolimmunol350:第105-125页.
·ornitz,d.m.,j.xu,j.s.colvin,d.g.mcewen,c.a.macarthur,f.coulier,g.gao和m.goldfarb(1996).″成纤维细胞生长因子家族的受体特异性(receptorspecificityofthefibroblastgrowthfactorfamily)″jbiolchem271:第15292-15297页.
·osborn,m.j.,b.ma,s.avis,a.binnie,j.dilley,x.yang,k.lindquist,s.menoret,a.l.iscache,l.h.ouisse,a.rajpal,i.anegon,m.s.neuberger,r.buelow和m.bruggemann(2013).″高亲和力igg抗体在携带含大鼠ch区的种系人igh/igκ/igλ基因座的ig-敲除大鼠中自然发育(high-affinityiggantibodiesdevelopnaturallyinig-knockoutratscarryinggermlinehumanigh/igkappa/iglambdalocibearingtheratchregion)″jimmunol.
·rhiel,l.,s.krah,,r.gunther,s.becker,h.kolmar,b.hock(2014).″real-select:全长抗体展示和通过酵母细胞表面捕获的文库筛选(real-select:full-lengthantibodydisplayandlibraryscreeningbysurfacecaptureonyeastcells)″plosone9:e114887.
·touat,m.,e.ileana,s.postel-vinay,f.andre和j.c.soria(2015).″靶向癌症中的fgfr信号传导(targetingfgfrsignalingincancer)″clincancerres21:第2684-2694页.
·wohrle,s.,c.henninger,o.bonny,a.thuery,n.beluch,n.e.hynes,v.guagnano,w.r.sellers,f.hofmann,m.kneissel和d.grausporta(2013).″成纤维细胞生长因子(fgf)受体信号传导的药理学抑制改善了fgf23介导的低磷血症性佝偻病(pharmacologicalinhibitionoffibroblastgrowthfactor(fgf)receptorsignalingamelioratesfgf23-mediatedhypophosphatemicrickets)″jboneminerres28:第899-911页.
·wu,a.l.,g.kolumam,s.stawicki,y.chen,j.li,j.zavala-solorio,k.phamluong,b.feng,l.li,s.marsters,l.kates,n.vanbruggen,m.leabman,a.wong,d.west,h.stern,e.luis,h.s.kim,d.yansura,a.s.peterson,e.filvaroff,y.wu和j.sonoda(2011).″通过抗体介导的成纤维细胞生长因子受体1的激活改善2型糖尿病(ameliorationoftype2diabetesbyantibody-mediatedactivationoffibroblastgrowthfactorreceptor1)″scitranslmed3:第113ra126页.
·yanochko,g.m.,a.vitsky,j.r.heyen,b.hirakawa,j.l.lam,j.may,t.nichols,f.sace,d.trajkovic和e.blasi(2013).″全-fgfr抑制导致fgf23信号传导,软组织矿化和心血管功能障碍的阻断(pan-fgfrinhibitionleadstoblockadeoffgf23sighaling,softtissuemiheralization,andcardiovasculardysfunction)″toxicolsci135:第451-464页.
- 还没有人留言评论。精彩留言会获得点赞!